-
大量含氮废水的排放会造成水体富营养化现象。从成本和去除效果考虑,生物脱氮是公认的最佳脱氮方法[1-3]。厌氧氨氧化(anaerobic ammonium oxidation,Anammox)工艺可以解决传统硝化反硝化存在的剩余污泥产量高、碳源和能源消耗等问题[4]。在缺氧条件下,厌氧氨氧化菌利用亚硝酸盐氮(NO2−-N)为电子受体,将氨氮(NH4+-N)转化为氮气,其具有节约碳源、能耗和污泥产量少等优点[5-6]。在与Anammox组合的工艺中,如何高效稳定地获取NO2−-N是工艺运行的关键。短程硝化[7-8]、短程反硝化(partial denitrification,PD)[9]工艺等可为厌氧氨氧化工艺提供NO2−-N。从反应路径和节省物耗能耗等方面来讲,短程硝化是提供亚硝酸盐氮的最佳方法。但其在实际应用中抑制亚硝酸盐氧化菌(nitrite oxidizing bacteria,NOB)难度大,控制要求高,很难高效稳定的实现NO2−-N积累[4,10-13]。
PD工艺是指通过调控相关条件,将全程反硝化(NO3−-N→NO2−-N→NO→N2O→N2)控制在NO2−-N阶段[14]。PD工艺的关键在于以NO2−-N为产物的反硝化菌属的富集[15-16]。目前影响PD工艺NO2−-N积累的主要因素有C/N、pH、反应时间、反应器类型、碳源类型以及温度等。CAO等[17]在长期运行研究中发现,上流式厌氧污泥床反应器的亚硝酸盐积累率(nitrite accumulation rate,NAR)仅为51.0%,而序批式反应器(sequencing batch reactor,SBR)中的NAR稳定高于80%。袁怡等以乙酸钠为唯一碳源进行研究,发现高NAR通常发生在低C/N条件下。DU等[18]发现,C/N对高NAR的短程反硝化污泥影响不大,认为系统富集的Thauera菌是只能还原NO3−-N为NO2−-N的短程反硝化菌。基于此,不少研究者均实现了稳定的亚硝酸盐氮累积率[19-22]。在PD工艺的研究中,既有以硝酸钠作为NO3−-N来源[23-24],也有以硝酸钙作为NO3−-N来源[25-26],但两者对PD快速启动以及微生物变化的影响却鲜有报道。此外,关于磷元素添加对PD工艺的反硝化性能及微生物种群的影响也需进一步研究。
因此,本研究以乙酸钠为碳源,在SBR中通过硝酸钠和硝酸钙的交替投加、微量元素的投加量以及C/N比的改变,考察了不同条件对反硝化的性能及NO2−-N积累的影响,并分析了反应器微生物种群演替特征,以期为短程反硝化的快速启动及稳定运行提供参考。
-
本研究采用容积为40 L的圆柱形塑料容器(敞口)为反应器,有效容积为30 L。采用2个蠕动泵分别进行加水和排水,并通过电动搅拌器进行搅拌。实验在缺氧的条件下运行,温度为25~30 ℃。本实验共运行111 d,分为表1中所示的4个阶段。每天需进行2次洗泥,用蠕动泵抽排上清液至10 L,再用自来水冲洗底泥,加水至30 L,打开搅拌机30 s,后静置沉淀10 min,再重复1次上述步骤。随后运行1个周期,1个周期包括进水(15 min)、反应(表1)、沉淀(30 min)、排水(15 min)、闲置5个阶段。反应时间为搅拌时间,闲置时间为结束反应后至隔天洗泥前,根据进水硝酸盐氮还原率(nitrate reduction rate,NRR)以及亚硝酸盐氮积累率(nitrite accumulation rate,NAR)的改变而改变,在前者几乎完全还原的基础上,后者累积达到最大时,停止搅拌。在搅拌开始后2 min和结束后2 min取水样测定NO3−-N和NO2−-N,并测定温度、pH。
-
实验用水采用人工配水,主要成分是以硝酸钠(阶段Ⅰ、Ⅲ和Ⅳ)、硝酸钙(只阶段Ⅱ)和无水乙酸钠配制的100 mg·L−1的 NO3−-N以及300~400 mg·L−1 的COD;其他组分如下所示:0.10 mg·L−1 MgSO4·7H2O,0.40 mg·L−1 CaCl2,0.05 mg·L−1 KH2PO4(阶段Ⅲ、Ⅳ)。本实验SBR反应器接种泥为城市污水厂的污泥经短暂驯化后的反硝化污泥,污泥质量浓度为9.20 g·L−1。阶段Ⅰ结束时测得污泥质量浓度为1.40 g·L−1,在阶段Ⅱ~Ⅳ,控制污泥质量浓度在1.40~1.60 g·L−1。
-
在PD启动成功后(阶段Ⅳ)进行1次典型周期实验。在第0、30、75、90、105、135、195、255和315 min取水样,测定NO3−-N、COD和NO2−-N。其他实验条件与长期实验中阶段Ⅳ相同。
-
在前3个阶段的最后一天(第36、61、76天)以及阶段Ⅳ稳定运行8 d时(第85天)从反应器中采集污泥样品,编号分别为P1、P2、P3和P4。测序工作由上海生工生物工程股份有限公司负责进行,测序方法见文献[27]。
-
整个实验过程每天取进、出水样进行检测,采用N-(1-萘基)-乙二胺光度法测定NO2−-N,采用紫外分光光度法测定NO3−-N,采用多参数便携式水质分析仪(WTW Multi 3630 IDS)测定温度和pH,采用连华科技多参数水质测定仪(5B-6C)进行测定。COD为校准值,因为NO2−-N对 COD 测定贡献为 1.14 g·g−1(以 COD/NO2−-N计)[28];硝酸盐氮还原率(NRR)、亚硝酸盐氮积累率(NAR)根据文献[21]计算。
-
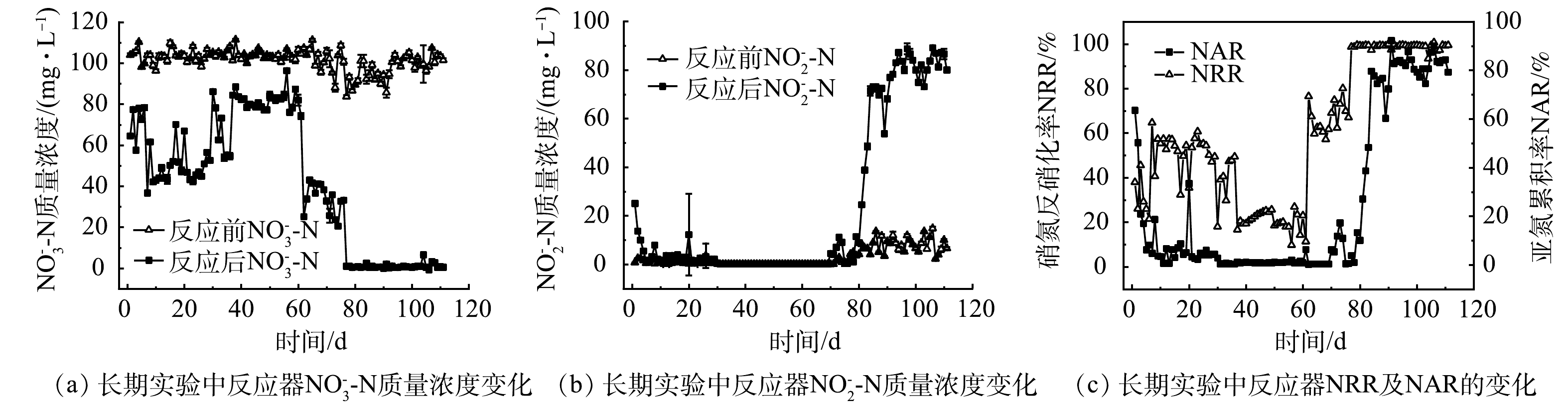
1)硝酸钠和硝酸钙为NO3−-N来源对反硝化性能影响的对比。如图1(a)所示,阶段Ⅰ和Ⅱ中NO3−-N来源分别为NaNO3以及Ca(NO3)2,NO3−-N质量浓度为(100±5) mg·L−1。接种污泥前1~6 d,反应后NO3−-N的平均质量浓度大于60 mg·L−1, NRR小于40%。由图1(b)可见,第1 天时,反应后NO2−-N质量浓度为25.1 mg·L−1,第2~6 天反应后NO2−-N质量浓度呈下降趋势,至1.6 mg·L−1。这主要是因为接种泥源中反硝化菌属所占比例较低,且受进水条件影响导致活性被抑制,从而使得反应器反硝化性能较差。在阶段Ⅰ第7~36 天中,出水NO3−-N质量浓度由(100±5) mg·L−1下降至(50±5) mg·L−1,NRR大于50%,反硝化性能比前一周明显增强。此时,出水NO2−-N质量浓度接近于0,反应器仍然不具备短程反硝化性能。而出水COD为215 mg·L−1,说明并不是因为缺少有机碳源导致反硝化性能差。在阶段Ⅱ(37~61 d),将原配水中所用NaNO3换为Ca(NO3)2后, NRR下降至20%,反硝化性能明显变差,且反应器出水NO2−-N质量浓度为0.15 mg·L−1。
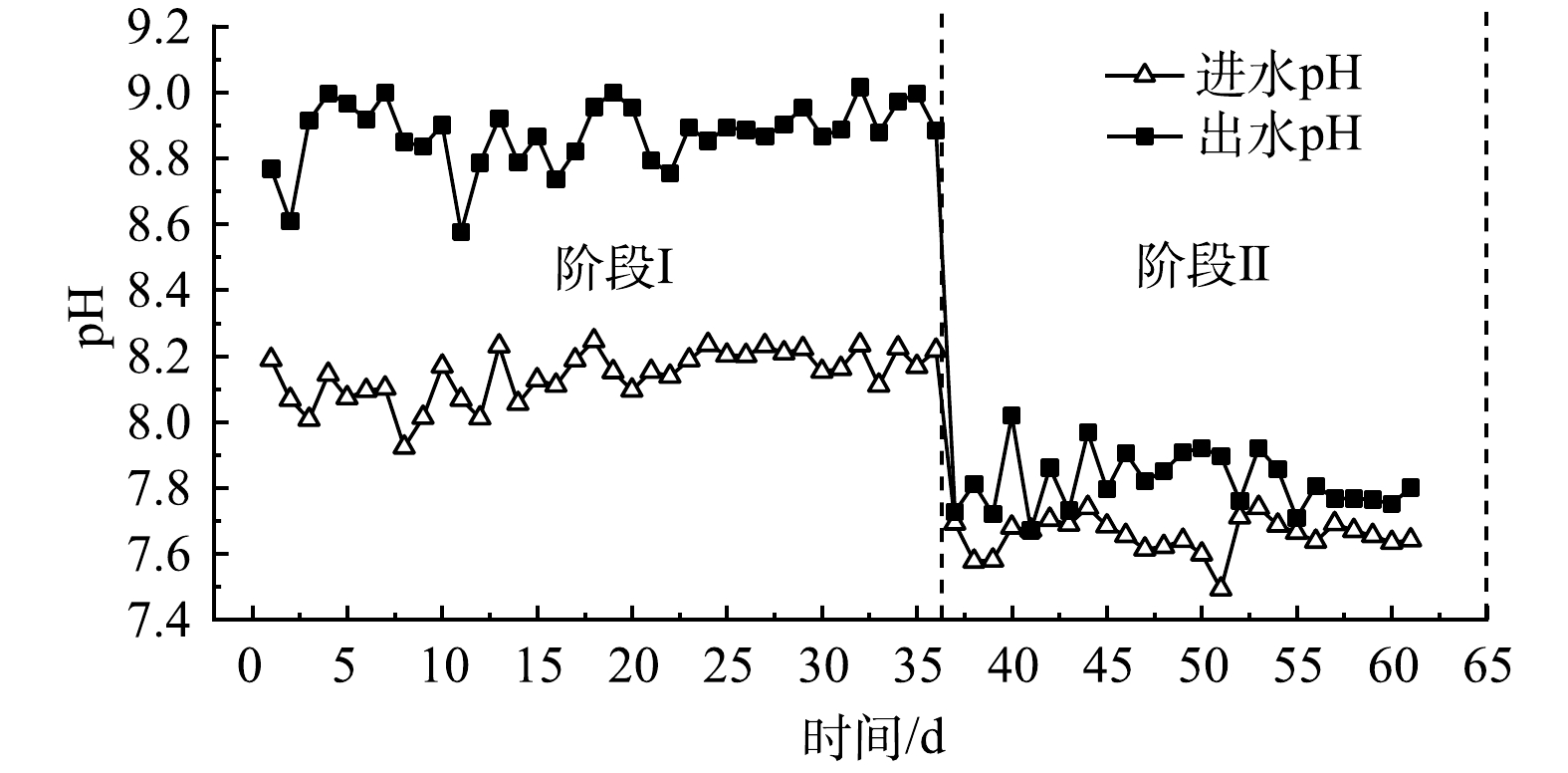
对比阶段Ⅰ与阶段Ⅱ,将NO3−-N来源由NaNO3换为Ca(NO3)2,反应时间由360 min延长至480 min,但反硝化性能反而变弱。Ca2+会与水中的磷酸盐结合,生成钙的配合物或沉淀,使得水中可供微生物利用的磷的含量减少。FERNANDEZ-NAVA等[26]发现随着反硝化反应器中钙盐质量浓度的增加,生物量生长速率和反硝化速率会受到抑制。娄红春等[29]在稳定运行的活性污泥反应器中引入不同浓度的Ca2+,来观测污泥形状、微生物酶活性、pH变化等,结果表明,过量的Ca2+引起污泥中无机成分增加,生物酶的催化活性降低,从而影响微生物的活性。而微生物的活性也直接影响着整个系统的性能。周昌琴等[30]发现随着脱氮系统中的Ca2+浓度增加,影响微生物的酶的活性受到一定程度的抑制,包括过氧化氢酶、磷酸酶、脲酶和蛋白酶4种酶。此外,反应器中投加Ca2+后,pH有所降低(图2)。其原因是Ca2+会消耗CO3−产生少部分碳酸钙沉淀,使系统中的pH平衡遭到破坏。因此,阶段II进出水的pH明显小于阶段I进出水的pH。而NO3−-N还原为N2是一个酶还原的过程,主要取决于电子生产、转移和利用,溶液中离子质量浓度和pH的会影响相关还原酶的活性,从而影响了反硝化性能。QIAN等[28]研究表明,当pH为9.0时,反应器的反硝化性能远高于pH为5.0和7.0;当pH为9.0、进水NO3−-N质量浓度为30~40 mg·L−1时,出水质量浓度几乎为零。这与本实验中阶段Ⅰ所得结果基本一致。CAO等[17]的研究表明,系统配水为硝酸钠与甲醇,并通过相关操作控制系统pH维持在7.5,当进水NO3−-N为40 mg·L−1时,50 min左右已经全部被还原。值得注意的是,本研究中pH与前者接近,在480 min的反应时间内,NO3−-N仅还原了20 mg·L−1左右。由此可以说明,在启动短程反硝化过程中,高pH有利于反硝化的进行;过量的Ca2+可通过影响pH直接或间接抑制微生物活性,从而导致反硝化性能降低。
由图1可见,当阶段Ⅲ反应时间为480 min时,反应器中的NO3−-N仍然未被完全还原,但与阶段Ⅰ(1~36 d)相比,NRR>62%,反硝化性能有明显提升;对比配水条件,阶段Ⅲ仅比阶段Ⅰ新增了磷酸二氢钾、硫酸镁和氯化钙。在62~69 d内,反应后NO3−-N质量浓度平均为35 mg·L−1左右,呈现先下降后上升的趋势,且在此期间,反应后NO2−-N质量浓度几乎降至0;在随后的7 d内,NRR对比之前有明显的上升, NO2−-N的累积率为10%。这也说明以NO2−-N为产物的短程反硝化菌的生长环境有所改善,使得系统的PD性能有明显的提升。磷源在微生物的代谢中其重要作用,磷源用于合成生物细胞中核酸、磷脂、辅酶及其他化合物,缺乏磷源易造成SBR系统中活性污泥丝状菌膨胀。滕李军等[31]通过控制不同磷源比例,考察了不同C/N/P比对SBR系统的脱氮影响,发现在磷源占比较低的系统内,系统中微生物活性较低,脱氮效果不佳;在C/N/P=100/5/1和C/N/P=100/5/0.8时,系统微生物活性较高,脱氮效果较好,而当系统中磷不足时,无法产生足量微生物分解有机物。因此,在短程反硝化实际应用中,废水进水中如果磷源不足时,应及时补充磷源。
2 )阶段Ⅳ典型周期实验分析。由图1可见,当C/N比增加到4之后,在第77~80天中, NO3−-N的质量浓度由反应前的100 mg·L−1降低至反应后的0 mg·L−1左右,NRR大于99%。这表明系统已具备高效的反硝化性能。此外,反应后NO2−-N的质量浓度为0 mg·L−1,几乎没有NO2−-N的累积。当反应时间由480 min降至300 min时,NAR由10%升高至27%,停止搅拌时NO2−-N质量浓度为24.58 mg·L−1;进一步将反应时间缩短至240 min时,NAR升高至38%;缩短至120 min时,NAR增大至约80%。研究人员普遍认为,NAR大于80%是PD反应器成功启动的标志[32]。这说明本研究成功启动了短程反硝化。在此后的运行中,由于短程反硝化菌的富集,PD性能有了进一步的提升。缺氧运行时间由120 min降低至70 min,NO3−-N已全部被还原, NAR稳定在80%及以上(均值83.8 %)。这说明反应器已具备稳定高效的PD性能,且略优于文献所报道结果[19, 21-22]。在启动PD工艺的过程中,当NO3−-N已被完全还原,缩短反应时间有利于NO2−-N的累积。
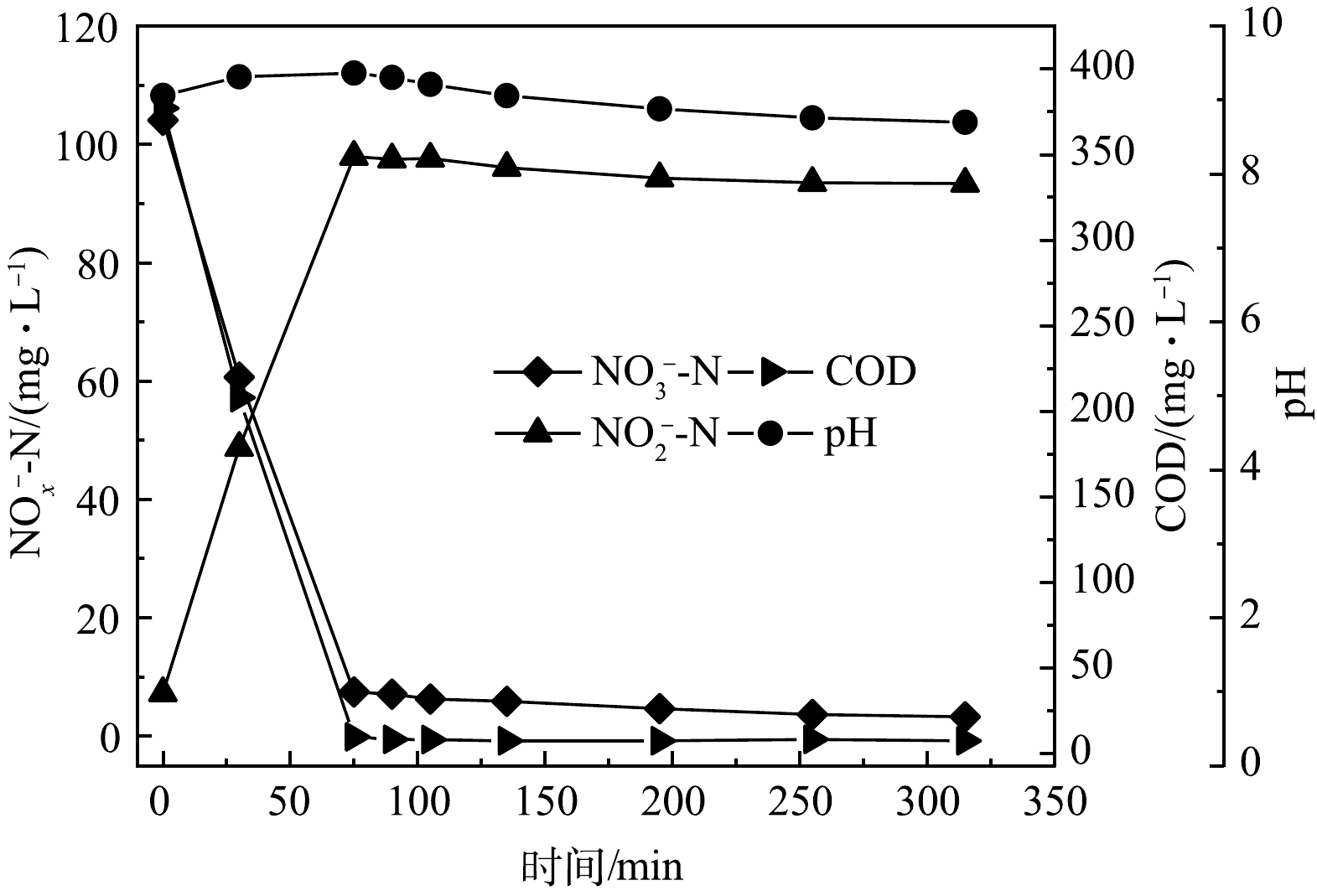
图3为阶段Ⅳ稳定阶段典型周期内氮素的转化、COD的去除以及pH的变化图。由图3可见,在反应器初始阶段(0~75 min)内,由于碳源充足,NO3−-N与COD在短时间内被迅速转化和消耗,pH随着有机物的消耗也相应地升高。NO2−-N的质量浓度呈直线上升且在反应器中迅速累积,由7.27 mg·L−1增加至97.94 mg·L−1,75 min时系统NAR达到周期内峰值,此时NAR为92%,高于文献报道的平均水平。在随后的240 min内,由于基质匮乏,除了pH有明显降低外,其他指标均维持在一定水平且略有降低;pH由9.364降至8.697,NO2−-N仍然保持较高水平,反应结束时质量浓度仅降低至93.35 mg·L−1,NAR仍然保持在89%。这表明反应器PD性能已达到较优状态。而NO3−-N和COD在反应结束时仍然未被完全反应,分别为3.22 mg·L−1和7.47 mg·L−1,还原率和去除率分别为97%和98%。在实验的75 min后继续搅拌,NO2−-N浓度并没有显著下降。这是因为反硝化菌可以利用的有机物几乎完全被消耗,碳源的匮乏使得反硝化速率较低。
-
1)生物多样性。本研究采用Shannon指数和ACE指数对样品微生物进行综合评估。Shannon指数的大小与微生物生物多样性的高低以及污泥中微生物的均匀程度成正比。ACE指数的高低与污泥样品中的微生物群落丰富度呈正比。ACE指数越高,表明污泥样品中的群落丰富度越高。微生物数据统计结果表明,4个阶段的污泥样品Shannon指数和ACE指数分别为3.38、1.91、2.50、2.93和714.48、650.16、644.91、615.11。污泥样品的Shannon指数排序为P1>P4>P3>P2,ACE指数排序为P1>P2>P3>P4。造成这种差异的原因是微生物的均匀程度不同。综合各指数可以看出,污泥样品P4中微生物的群落丰富度较低,种群分布较均匀,富集程度较高,微生物系统较为稳定。
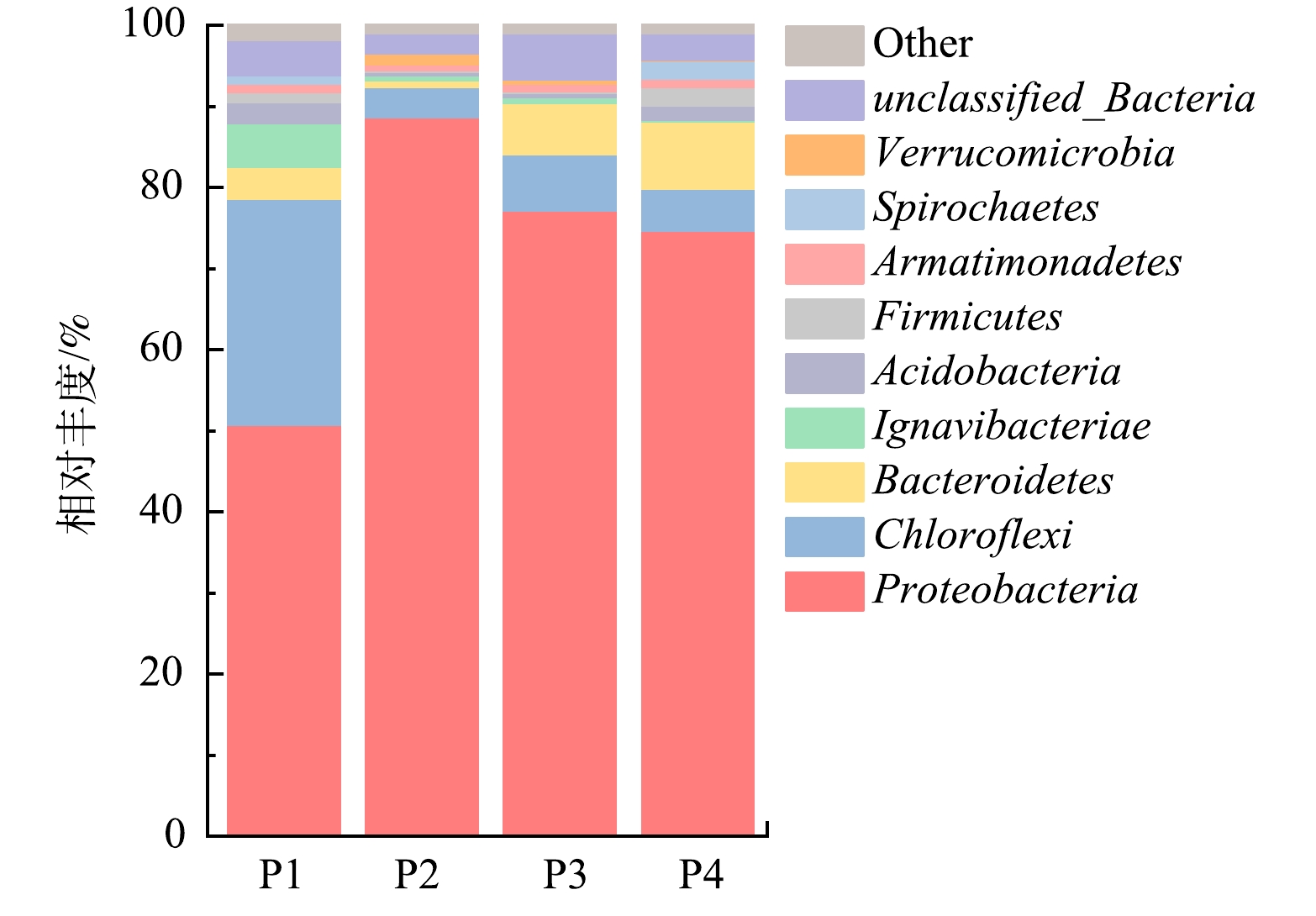
2)各阶段微生物门水平变化。图4为不同条件下反应器中活性污泥在门水平上的微生物特征。由图4可见,在4个阶段中,相对丰度最高的是Proteobacteria(变形菌门),其次是Chloroflexi(绿弯菌门)以及Bacteroidetes(拟杆菌门)。在阶段Ⅰ~Ⅳ中微生物相对丰度存在一定的差别。在阶段Ⅰ中分别为变形菌门(50.79%)、绿弯菌门(20.89%)、拟杆菌门(3.85%);在阶段Ⅱ中分别为变形菌门(88.72%)、绿弯菌门(3.70%)、拟杆菌门(0.88%)。而在阶段Ⅲ中,变形菌门(77.17%)、拟杆菌门(7.01%)、绿弯菌门(6.31%);在阶段Ⅳ中,变形菌门(74.71%)、拟杆菌门(5.19%)、绿弯菌门(8.27%)这3个门的总比例接近90%。这进一步地证明了反应器中相关功能菌富集程度高[23]。其中,变形菌门在反应器中处于主导地位,大多数与脱氮相关的功能菌(如氨氧化菌、亚硝酸盐氧化菌和反硝化菌等)都属于变形菌门,在各阶段丰度依次为P2>P3>P4>P1。变形菌门的相对丰度在阶段Ⅱ进一步增大,占绝对的主导地位。高丰度的变形菌门是反应器能取得高效稳定的NAR的基础,但反应器的NRR和NAR反而降低了,可见过量的Ca2+会对菌群的脱氮功能的实现产生负面影响。在此前关于短程反硝化的研究中也表明,变形菌门通常在反应器中占比较高(44%~82%)[32]。这与本研究所得结果相似。绿弯菌门和拟杆菌门可以降解易溶有机物和胞外聚合物[33],而Ca2+可以将水中可溶性的蛋白质和多糖絮凝沉淀[34]。这可能是绿弯菌门和拟杆菌门的相对丰度在阶段Ⅱ幅减小的原因之一。拟杆菌门在氮循环中还能起到反硝化的作用[35-36],所以在阶段Ⅳ中拟杆菌门占比(8.27%)大于前3个阶段。
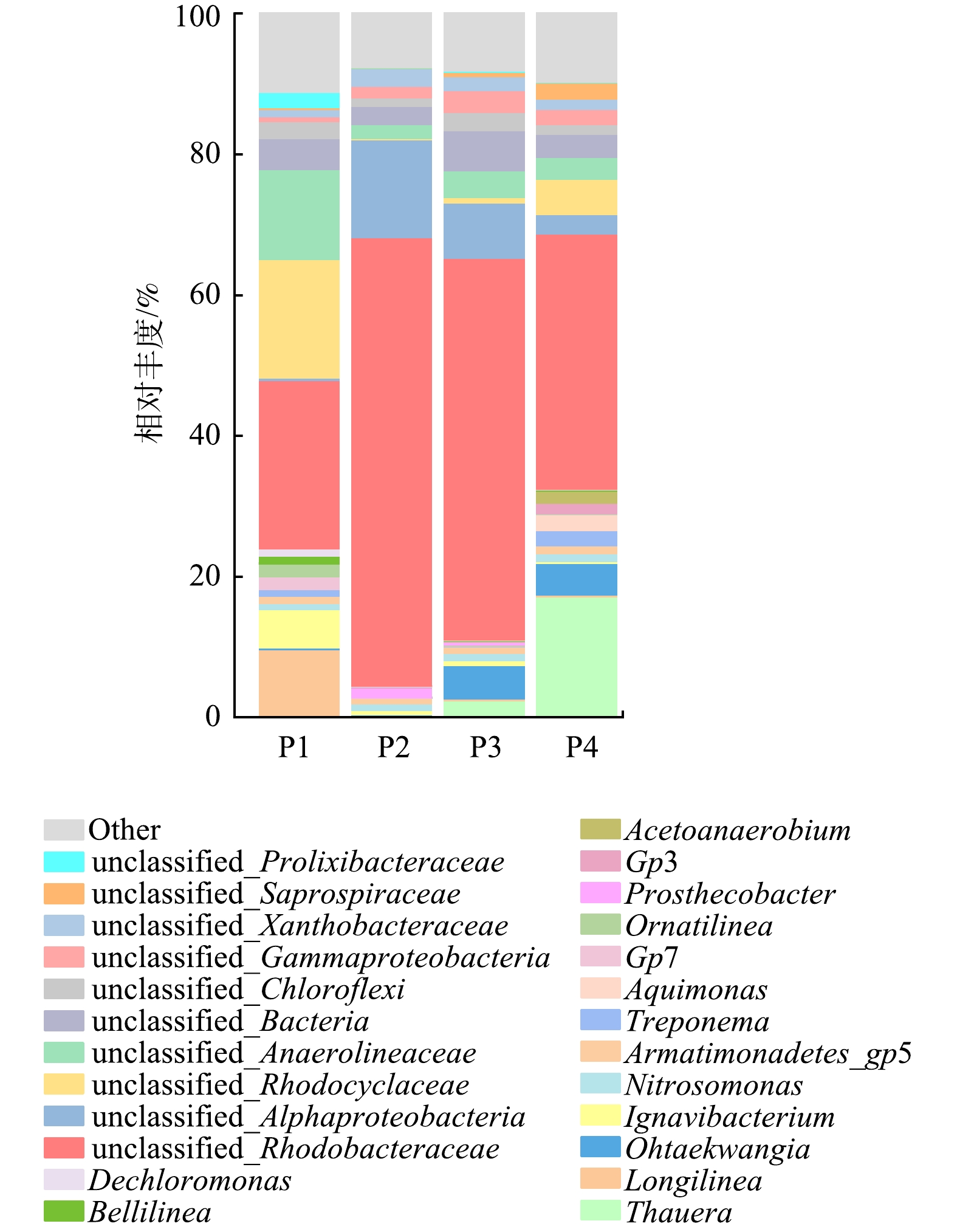
3)各阶段微生物属水平变化。图5为反应器4个阶段污泥样品在属水平上的微生物特征。由图5可见,反应器在4个阶段中,unclassified_Rhodobacteraceae(红杆菌科)所占比例都比较大,分别为23.89%、63.69%、54.22%、36.29%。Nitrosomonas(亚硝化单胞菌属)也有一定占比,在4个阶段的样品中相对丰度分别为0.87%、0.96%、0.99%、1.18%。亚硝化单胞菌属是自养型AOB,在有氧条件下能将NH4+-N氧化为NO2−-N。在阶段Ⅰ,占比超过10%的其余菌属分别为unclassified_Rhodocyclaceae(16.81%),unclassified_Anaerolineaceae(12.83%)。Rhodocyclaceae(红藻科)是反硝化系统中经常被发现的一种反硝化聚磷菌,在污水厂除磷中起到重要作用,但也不具备脱氮性能[37-38]。Longilinea菌属和Ignavibacterium菌属的占比也相对较高,分别为9.28 %及5.50 %,而Thauera (陶厄氏菌属),占比仅为0.39%。与其他阶段不同的是,阶段Ⅰ中Ignavibacterium菌属是其他阶段的数百倍,是反应器中占优势地位的反硝化菌[39]。由于反硝化菌占比较低,使得阶段Ⅰ中NRR不高。与其他以硝酸钠作为NO3−-N的阶段相比,在阶段Ⅱ中,系统中的反硝化菌Ignavibacterium在两周时间几乎消失,且Thauera菌也仅有0.14%,在4个阶段中处于最低水平。这也说明在乙酸钠为碳源的反应器中,过多的Ca2+会影响反硝化菌Thauera和Ignavibacterium的富集,使得反应器的反硝化性能变差。阶段Ⅱ中优势菌属为红杆菌科。有研究表明,红杆菌科多为化学异养菌,可以促进胞外聚合物EPS的分泌[40],被认为是重要的反硝化菌群[41-42],并且能够降解复杂的有机物[43]。作为反硝化菌,unclassified_Rhodobacteraceae的相对丰度由阶段Ⅰ时的23.89%增加到阶段Ⅱ的63.69%,其在反应器中主导菌属的地位得到进一步巩固。有研究[44]表明,微生物群落的多样越高,反应器脱氮效率越高。在本研究中,阶段Ⅱ时PD反应器内的微生物多样性是整个启动过程中最低的,可见过量的Ca2+会将无法适应的细菌淘汰出PD反应器,从而降低短程反硝化系统的微生物多样性,影响反应器的反硝化性能。在阶段Ⅲ中, Thauera相比阶段Ⅱ时数量翻了16倍,短程反硝化菌的富集较为迅速。研究显示,对于缺磷的系统会限制细菌的生长[45],投加磷酸盐可以富集异养反硝化菌和反硝化聚磷生物(denitrifying phosphorus accumulation organisms,DPAOs),从而提高反应器的反硝化性能[46]。这也表明适量的磷源有利于短程反硝化菌的富集。因此,在实际废水处理中,如若进水含磷量较少的话可以适量补充,有利于反硝化的顺利进行。在阶段Ⅳ中,反应器的平均NAR为83.8%,而Thauera是反应器中的优势菌属之一,占比高达17.25 %。Thauera已经被确定为短程反硝化过程中高效产生NO2−-N的功能性细菌,在先前关于PD的研究中被广泛检测到,且在微生物群落中占据主导地位[15, 47]。
4)微生物功能预测分析。本研究基于FAPROTAX分析绘制heatmap对微生物功能进行预测,FAPROTAX是基于目前对可培养菌的文献资料手动整理的原核功能注释数据库。由图6可知,NO3−-N的还原(nitrate reduction)在各阶段占比与各阶段的NRR呈正相关,P4(9.14%)>P3(2.65%)>P1(1.64%)>P2(0.89%)。这进一步验证了在阶段Ⅳ中,反应器的反硝化性能最强;与此同时,阶段Ⅳ中氮呼吸(nitrogen respiration)、硝酸盐呼吸(nitrate respiration)和亚硝酸盐呼吸(nitrite respiration)的占比也是最高的,分别为9.91%、9.11%和8.83%。这使得反应器在阶段Ⅳ保持着高效稳定的NRR,比其他研究所得结果略高[22]。此外,反应器中存在部分的好氧氨氧化(aerobic ammonia oxidation),这是微生物中亚硝化单胞菌属(Nitrosomonas)的存在导致的。一方面,本研究中PD反应器是在敞口条件下搅拌运行的,并非严格缺氧环境,由于搅拌使得空气中的氧气进入反应器,为氨氧化细菌的生长创造了有氧环境;另一方面,氨氧化所需底物NH4+-N来源于微生物的内源过程,利用微生物代谢、衰亡产生的蛋白质或其他含氮有机物,产生NH4+-N,从而为氨氧化提供反应底物。
-
1)以乙酸钠为碳源时,Ca2+质量浓度过高会抑制反硝化。以NaNO3为NO3−-N的来源时,硝酸盐氮还原率维持在50%左右;相同条件下,以Ca(NO3)2为NO3−-N的来源时,硝酸盐氮还原率仅有20%。在实际废水处理中,适量的磷有利于反硝化脱氮的顺利进行。长期运行下亚硝酸盐氮积累率平均为83.8%。
2)当碳氮比(COD/NO3−-N)提高为4时,反应器实现了稳定的短程反硝化,硝酸盐氮还原率大于98%,平均NAR为83.8%。
3)在反应器中变形菌门和拟杆菌门占主导地位。NO2−-N积累的关键功能菌属是Thauera菌属,其最高占比为17.25%。以Ca(NO3)2为NO3−-N的来源时,Thauera菌属占比仅为0.14%。
| 阶段 | 时间/d | 反应时间/min | COD/N | 换水比/% |
| Ⅰ | 1~36 | 360 | 3 | 70 |
| Ⅱ | 37~61 | 480 | 3 | 70 |
| Ⅲ | 62~76 | 480 | 3 | 70 |
| Ⅳ | 77~80 | 480 | 4 | 70 |
| 81~84 | 120~300 | 4 | 70 | |
| 85~111 | 70 | 4 | 70 |




 DownLoad:
DownLoad: