-
近年来,我国矿冶、机械制造、化工、电子、仪表等行业高速发展,相关企业的生产过程中几乎都会产生重金属废水。由于部分工矿企业的不达标排放,造成了严重的重金属污染[1]。大多数重金属都具有毒性,如果直接排放到水环境中,会通过食物链富集对水生生物和人类健康造成威胁[2]。目前,国内外关于重金属废水的处理方法主要包括生物絮凝法、吸附法、化学沉淀法、电化学法、絮凝法等[3]。其中吸附法和絮凝法作为传统且成熟的方法应用极为广泛,经济、高效且环境友好是评价吸附剂和絮凝剂的主要指标[4]。寻找具有广泛pH适应性且能够对抗实际复杂环境中不利影响的絮凝吸附药剂,是提高该方法处理重金属废水效率的关键[5]。
在重金属废水处理中,使用的材料必须易于获得、制备容易、投加操作简单、成本低,才可能被广泛推广应用[6]。许多建筑材料易于获得且价格相对较低,具有用于处理重金属废水的潜力[7]。在这类材料之中,水泥类材料生产技术成熟、产量高[8] (2020年我国水泥产量达15×109 t左右[9]),且和其他同类材料相比具有生产容易、经济高效等优点。目前,已经有用水泥类材料处理废水中重金属的报道。陈怡等[10]采用普通硅酸盐水泥和石灰的混合物对酸性重金属废水进行处理,通过石灰提供Ca2+和碱度来提高重金属离子的去除率,发现在弱酸条件下水泥能较好去除废水中Cu2+、Pb2+。樊志金[11]采用水泥+石灰、水泥+石灰+絮凝剂2种方案,在未考虑重金属离子间的相互影响下对比了2种方案下金属离子的沉淀效果。李国新等[12]使用硫铝酸盐水泥-膨润土制备了一种复合材料用于重金属废水的处理,该材料对辅料配比要求严格,制备较为复杂,普遍适用性有待进一步提高。在水泥材料用于重金属废水处理的相关研究中,一般都需要加入其他辅料来改善水泥的性能,还需要根据不同来水水质采用不同的配比。而水泥材料本身具有良好的重金属去除性能,兼具了经济性和安全性,如何在不添加其他辅料的情况下放大水泥基材料自身的优势,使其能够在实际复杂环境中适应广泛的pH条件,对抗不利影响,提高处理效率,还需要进一步探究。
硫铝酸盐水泥是 20 世纪 80 年代出现的水泥品种,以硫铝酸钙矿物与铁相矿物为主要成分。其水化物液相pH较高,为12.0~12.5[13],水化活性显著高于普通硅酸盐水泥,能够提供强碱度中和金属离子废水的酸度并生成难溶性沉淀;另外,硫铝酸盐水泥水化可产生的大量铁胶与铝胶[14],而铁系和铝系絮凝剂是目前应用广泛、工艺成熟的无机金属盐絮凝剂[3],可以通过絮凝作用促进重金属离子的网捕沉淀去除。此前,课题组在对湖库中低浓度磷的去除实验中发现硫铝酸盐水泥能在pH为5.0~8.0时形成絮凝体[15],可较好地吸附磷。一般来说,絮凝体对废水中的金属阳离子具有较好的去除效果。为进一步增加材料的应用场景,基于上述研究,本研究选择硫铝酸盐水泥(L)及其改性材料(LA)为重金属离子清除剂,以Cu2+、Pb2+、Zn2+、Cd2+为研究对象,考察了清除剂投加量、废水初始pH、重金属离子初始浓度、振荡时间等因素对L和LA去除重金属的影响,优化了最佳应用条件,通过竞争吸附和分析动力学原理,研究了不同重金属离子间的相互影响,解析了硫铝酸盐水泥及其改性材料去除重金属的机理,以期为该类型材料的推广应用提供参考。
-
本研究所用硫铝酸盐水泥(L)购自峨眉山强华特种水泥有限责任公司。硫铝酸盐水泥的主要成分为 CaO(35.12%)、Al2O3(28.77%)、SiO2(15.74%)、Fe2O3(1.45%)、SO3(8.46%)、MgO(0.96%)、TiO2(0.49%)、K2O(0.71%)、Na2O(0.50%)、其他成分(7.80 %)[15]。硫铝酸盐水泥经过水化和酸化改性后制得改性材料LA。制备方法为:称取10 g L于500 mL锥形瓶中,加入适量纯水,在(25±1) ℃的条件下振荡30 min,使其充分水化;调节pH至7.0,出现絮凝体,即酸化过程;以2 000 r·min−1将溶液离心,取沉淀置于60 ℃烘箱中烘干,用研钵研磨过80目筛后,装袋备用。
本实验依据《水质 铜、锌、铅、镉的测定 原子吸收分光光度法》(GB 7475-87)[16]测定水体中重金属含量,所用火焰原子吸收分光光度计为4530F。
-
本研究通过实验室模拟来探究L和LA处理Cu2+、Pb2+、Zn2+、Cd2+ 4种重金属废水的性能,实验配制单一重金属废水,用Cu、Pb、Zn、Cd单元素标准溶液和1+499硝酸溶液配制初始质量浓度分别为5、10、20、30、50 mg·L−1的单组分模拟废水。以重金属初始浓度作为影响因素的单一变量实验时设置梯度浓度,其余实验均取重金属初始质量浓度10 mg·L−1的单组分模拟废水。
-
本研究在LA除磷研究[15]的基础上探究其对重金属的去除能力,初始条件考虑除磷的最佳条件。在LA投加量为0.10 g·L−1时,可将0.1 mg·L−1的磷酸盐完全去除,最适pH为5.0~8.0,温度对去除率无明显影响,当振荡速度为140 r·min−1及其以上时,因高强度扰动造成絮体表面膜状物破坏,去除效果有所下降 [15]。综合考虑上述研究结果和文献数据[10],选定pH=7.0、振荡速度200 r·min−1、振荡时间30 min,温度25 ℃作为本次实验的初始参数,实验步骤详述如下。
1)影响因素实验。采用控制变量法,考察材料投加量、废水初始pH、重金属初始浓度、振荡时间4种因素对L和LA去除重金属效果的影响。
取初始质量浓度均为10 mg·L−1 的4种(Cu2+、Pb2+、Zn2+、Cd2+)单组分模拟重金属废水,调节初始pH为7.0,每种分别取100 mL到10个聚乙烯瓶中,5个为1组,并分别向两组投入梯度量的L和LA。Cu2+废水和Cd2+废水中L的投加量为:0.010、0.050、0.100、0.300、0.500 g,LA的投加量为:0.010、0.100、0.300、0.500、1.000 g;Pb2+废水和Zn2+废水中L的投加量为:0.001、0.003、0.005、0.010、0.050 g,LA的投加量为:0.001、0.003、0.005、0.010、0.100 g。在(25±1) ℃下,以200 r·min−1转速振荡30 min,振荡结束后静置10 min,用针管取上清液用滤头过滤,测定反应后溶液pH和重金属离子浓度。
取初始质量浓度均为10 mg·L−1 的4种(Cu2+、Pb2+、Zn2+、Cd2+)单组分模拟重金属废水,每种重金属废水用NaOH溶液和HNO3溶液调节初始pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,各取100 mL于聚乙烯瓶中,基于投加量实验结果称取L和LA的最佳投加量投入,即Cu2+废水中L和LA的投加量均为1 g·L−1;Pb2+废水中投加量均为0.05 g·L−1;Zn2+废水中投加量分别为L 0.05 g·L−1和LA 0.1 g·L−1;Cd2+废水中投加量均为3 g·L−1。在(25±1) ℃下,以200 r·min−1转速振荡30 min,振荡结束后静置10 min,用针管取上清液用滤头过滤,测定反应后溶液pH和重金属离子浓度。
取初始质量浓度为5、10、20、30、50 mg·L−1的4种 (Cu2+、Pb2+、Zn2+、Cd2+)单组分模拟重金属废水,基于pH实验得到改性前后材料对同一离子的最适pH存在差异,为更好地对L和LA的去除效果进行比较,该实验同一种离子废水设定相同的初始pH,即Cu2+废水pH为9.0;Pb2+废水pH为7.0;Zn2+废水pH为8.0;Cd2+废水pH为3.0。每种废水各取100 mL于聚乙烯瓶中,基于投加量实验结果称取L和LA的最佳投加量投入,即Cu2+废水中L和LA的投加量为1 g·L−1;Pb2+废水中投加量均为0.05 g·L−1;Zn2+废水中投加量分别为0.05 g·L−1和0.1 g·L−1;Cd2+废水中投加量均为3 g·L−1。在(25±1) ℃下,以200 r·min−1转速振荡30 min,振荡结束后静置10 min,用针管取上清液用滤头过滤,测定反应后溶液pH和重金属离子浓度。
取初始质量浓度均为10 mg·L−1 的4种(Cu2+、Pb2+、Zn2+、Cd2+)单组分模拟重金属废水,因各重金属废水处于最佳pH状态时沉淀效果远大于絮凝效果,无法探究振荡时间对去除效果的影响,则调节初始pH均为7.0,分别取100 mL于聚乙烯瓶中。在对Cu2+进行预实验时发现,当投加量为最佳投加量时,在1 min内就已经达到吸附平衡,为更好的探究时间的影响,减少投加量,即Cu2+废水中L和LA的投加量均为0.05 g·L−1;Pb2+废水中投加量均为0.05 g·L−1;Zn2+废水中投加量分别为0.01 g·L−1和 0.025 g·L−1;Cd2+废水中投加量分别为0.5 g·L−1和 0.25 g·L−1。在(25±1) ℃下,以200 r·min−1转速分别振荡5、10、15、20、30、45、60、90、120 min,振荡结束后静置10 min,用针管取上清液用滤头过滤,测定反应后溶液pH和重金属离子浓度。
2)正交实验。为了探究不同因素对L和LA去除重金属离子影响的强弱并优化最佳应用条件,因此需进行正交实验。基于影响因素实验可得各因素的最优值,取初始质量浓度均为10 mg·L−1 的4种(Cu2+、Pb2+、Zn2+、Cd2+)单组分模拟重金属废水,将材料投加量、废水pH、振荡时间作为影响因素,采用3因素3水平正交表L9(34)安排正交实验。各因素水平参数如表1、表2所示。
3)竞争吸附实验。实际工业废水中的重金属离子并不是单一存在,而是多种重金属离子共存,因此为进一步探究L和LA在实际废水中的吸附性能,设计多组分离子溶液探究不同重金属离子间是否存在竞争吸附。取初始质量浓度均为10 mg·L−1 的4种(Cu2+、Pb2+、Zn2+、Cd2+)单组分模拟重金属废水,进行双组分、3组分及4组分组合,具体模拟废水溶液配比如表3所示。
取上述多组分废水各100 mL,调节初始pH为7.0,装入聚乙烯瓶中,分为2组,分别投入0.01 g L、0.01 g LA,在(25±1) ℃下,以200 r·min−1振荡30 min,反应后取出静置10 min,用针管取上清液用滤头过滤,测定反应后溶液pH和重金属离子浓度。
4)吸附动力学实验。实验方法同振荡时间实验方法。使用伪一级吸附动力学和伪二级吸附动力学模型[17-18]对实验所得数据进行拟合,见式(1)和式(2)。
式中:Qe和Qt分别为吸附平衡时和t时刻的吸附量,mg·g−1; t为吸附时间,min;k1、k2分别为伪一级动力学和伪二级动力学吸附动力学常数,g·(mg·min)−1。
-
实验所得数据,由origin 2018处理分析并绘制图表。对正交实验所得数据直接采用SPSS 22.0进行极差分析和方差分析,对各影响因素的显著性进行比较从而得出L和LA去除重金属的最优条件组合。
-
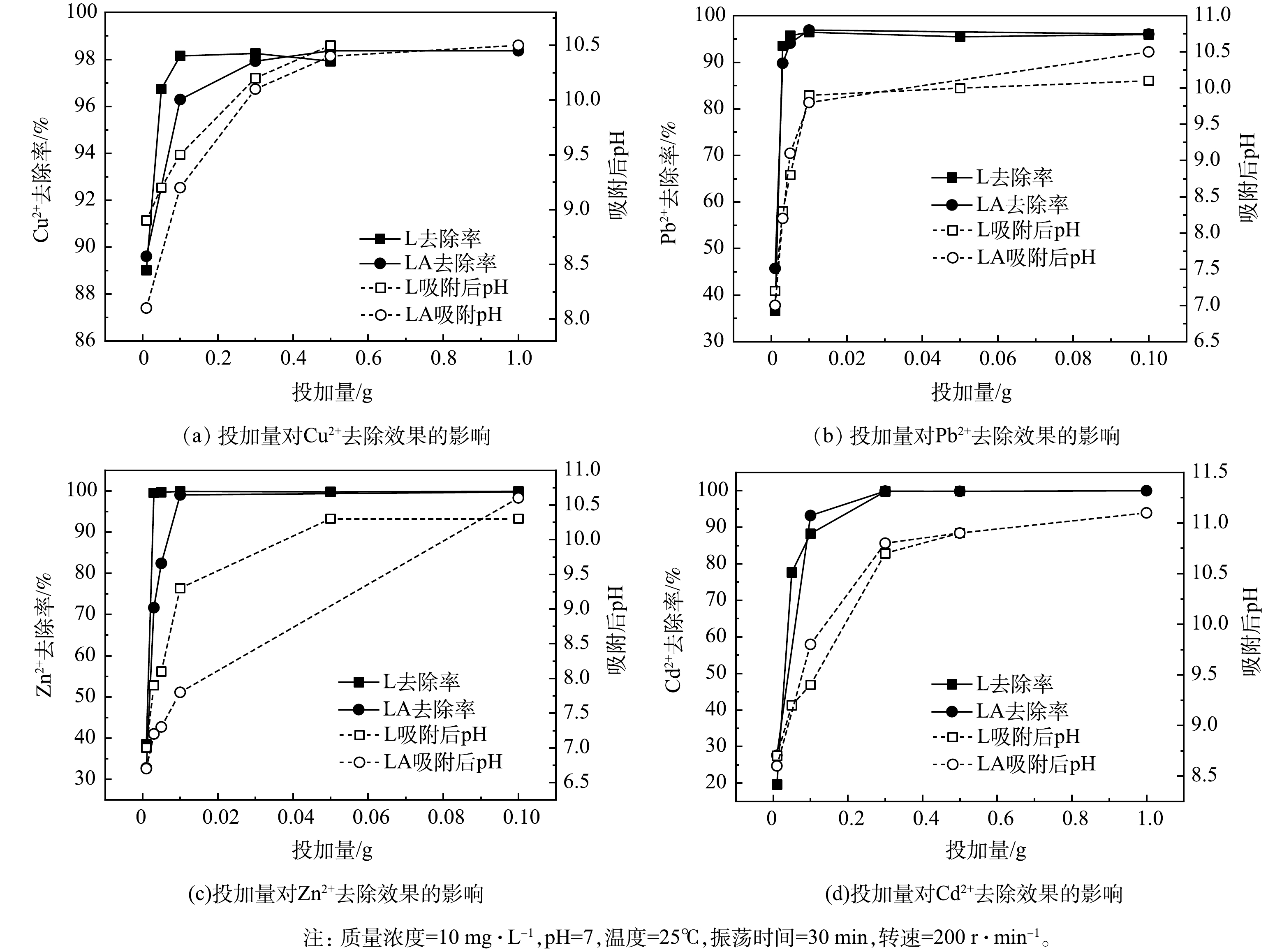
1) L和LA投加量对去除效果的影响。如图1所示,随着L和LA的投加量提升,4种重金属溶液pH及其去除率呈相同的变化趋势。当L和LA的投加量高于某一值后,金属离子去除率趋于稳定,考虑实际运用中的经济效益,取快速增长阶段与平稳阶段的临界值为最佳投加量。分析得出,L去除Cu2+、Pb2+、Zn2+、Cd2+的最佳投加量分别为1、0.05、0.05、0.05 g·L−1;LA对应的最佳投加量分别为1、0.05、0.1、3 g·L−1,去除率均大于94%。在相同投加量的情况下(未达到动态平衡时),L和LA对Pb2+和Zn2+的去除率均显优于Cu2+和Cd2+。这可能是由于Pb2+活性强,相比其他离子能够更加迅速的完成吸附、沉淀、结晶[10],在投加量少的时候,L对金属离子的去除率大于LA,随着投加量的增加,L与LA对金属离子的去除率逐渐趋近,但总体而言LA略高于L。L未经过酸化处理,加入溶液后前期pH大于LA,更多重金属离子生成沉淀而被去除。随着投加量增加,L和LA吸附金属离子后溶液pH相差不大,而LA由于其疏松多孔、胶结更加紧密的性质[15]容易捕捉到更多的金属离子。
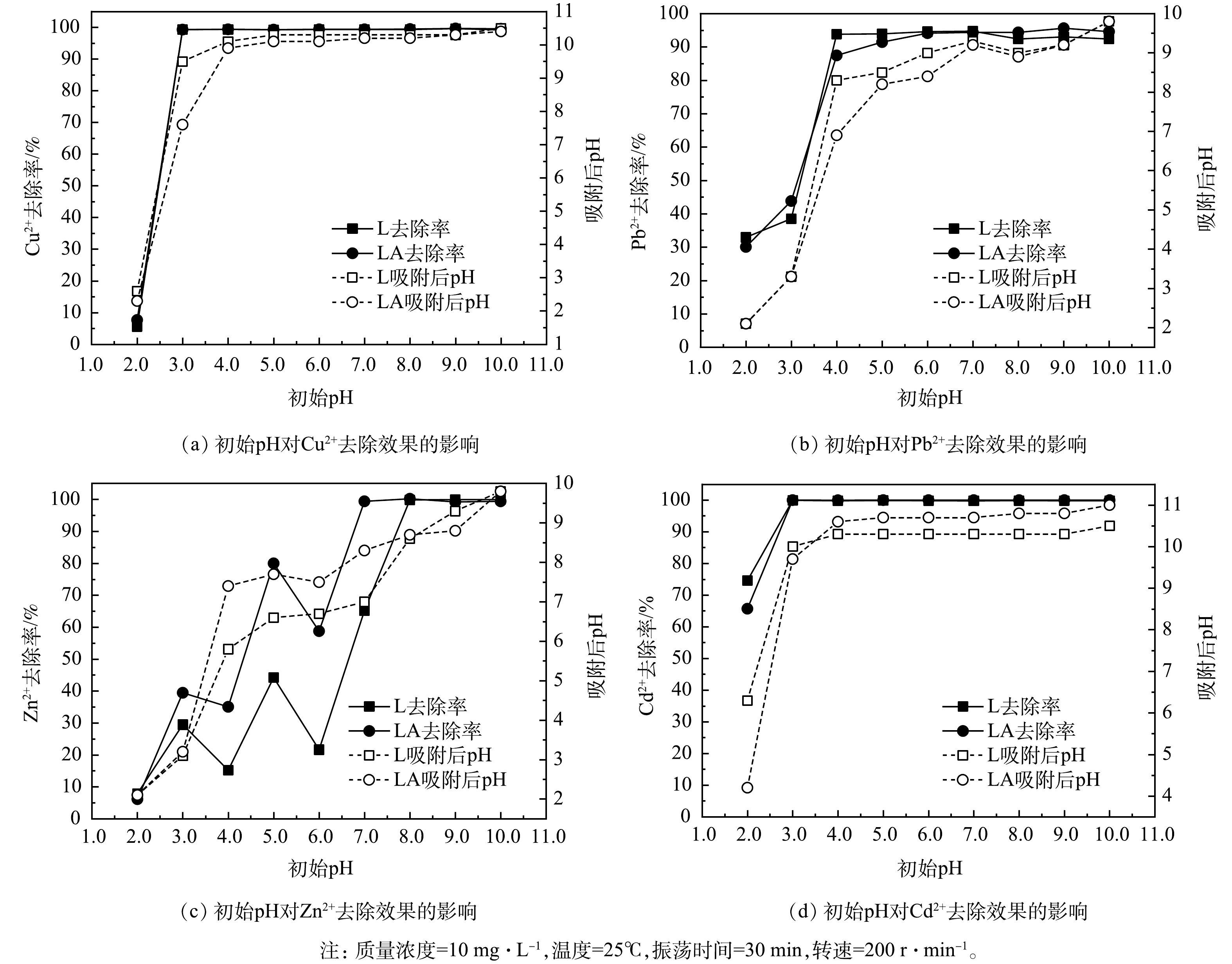
2)废水初始pH对去除效果的影响。如图2所示,L和LA在吸附4种重金属后,金属离子的去除率与溶液pH的变化趋势相似,且在相同pH条件下L和LA对金属离子的去除率差异较小,仅在pH=3.0~7.0时,LA对Zn2+的去除率明显高于L。这说明LA适应的pH范围更广泛,在L不能有效去除金属离子的条件下也能够发挥较好的作用。L去除Cu2+、Pb2+、Zn2+、Cd2+的最佳pH分别为9.0、7.0、10.0、3.0;LA去除上述离子的最佳pH分别为9.0、9.0、8.0、3.0,去除率均大于94%。结果表明,L和LA大都适用于中性和碱性条件,仅有去除Cd2+时更适合偏酸性条件。由此推测,在酸性条件下,更多H+与金属离子之间存在竞争吸附,从而影响金属离子的去除效果。而去除Cd2+的最佳pH偏低的原因可能是因为Cd2+更多是以其他方式被去除,不会与H+竞争活性位点。值得注意的是,溶液pH过高会导致生成的两性氢氧化物沉淀反溶,从而影响去除率。
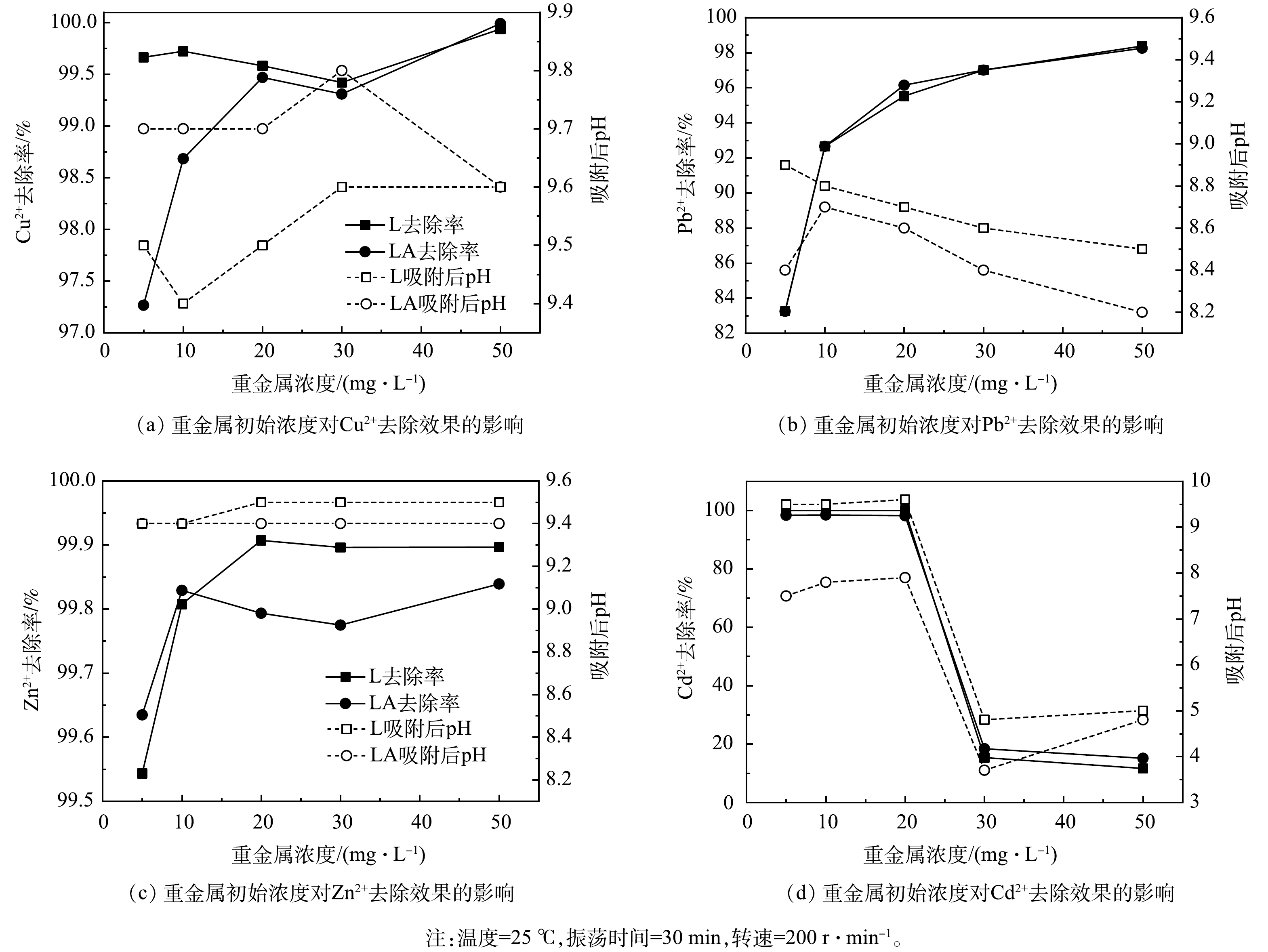
3)初始离子浓度对去除效果的影响。如图3所示,在不同初始浓度的Cu2+废水中,去除率均大于97%,随着离子浓度逐渐升高,L的去除率从高于LA到逐渐相等,甚至在Cu2+质量浓度为50 mg·L−1时,LA去除率已略高于L。因此,除沉淀作用外,LA可能具有更良好的吸附絮凝性能。对Pb2+而言,去除率随着溶液中Pb2+浓度的增加而增加,L同LA去除率基本一致。吸附后溶液pH下降,是由于溶液中OH−与Pb2+结合形成沉淀,溶液中OH−浓度降低导致的。对Zn2+而言,吸附后溶液pH整体稳定,虽略有波动,但去除效果优异,去除率均大于99.5%。当重金属质量浓度大于10 mg·L−1时,L去除效果优于LA。相对而言,L和LA对重金属质量浓度在10 mg·L−1以上的去除效果更好。Zn2+在溶液初始pH为8.0时已完全沉淀。对Cd2+而言,在5~20 mg·L−1去除率良好,但质量浓度大于30 mg·L−1时,金属离子去除率与溶液pH均大幅度下降。所以,应同时考虑高浓度条件下L和LA吸附达到饱和以及Cd2+形成沉淀的双重影响。随着重金属浓度的增加,吸附后溶液pH下降,在高浓度时,由于吸附位点饱和,L和LA去除金属离子主要是通过给溶液提供OH−,充当沉淀剂的作用。此时,去除机理以沉淀为主,吸附为辅。当溶液质量浓度为5~10 mg·L−1时,4种金属离子去除效果明显,除Pb2+去除率略低外,其他离子去除率均大于97%。
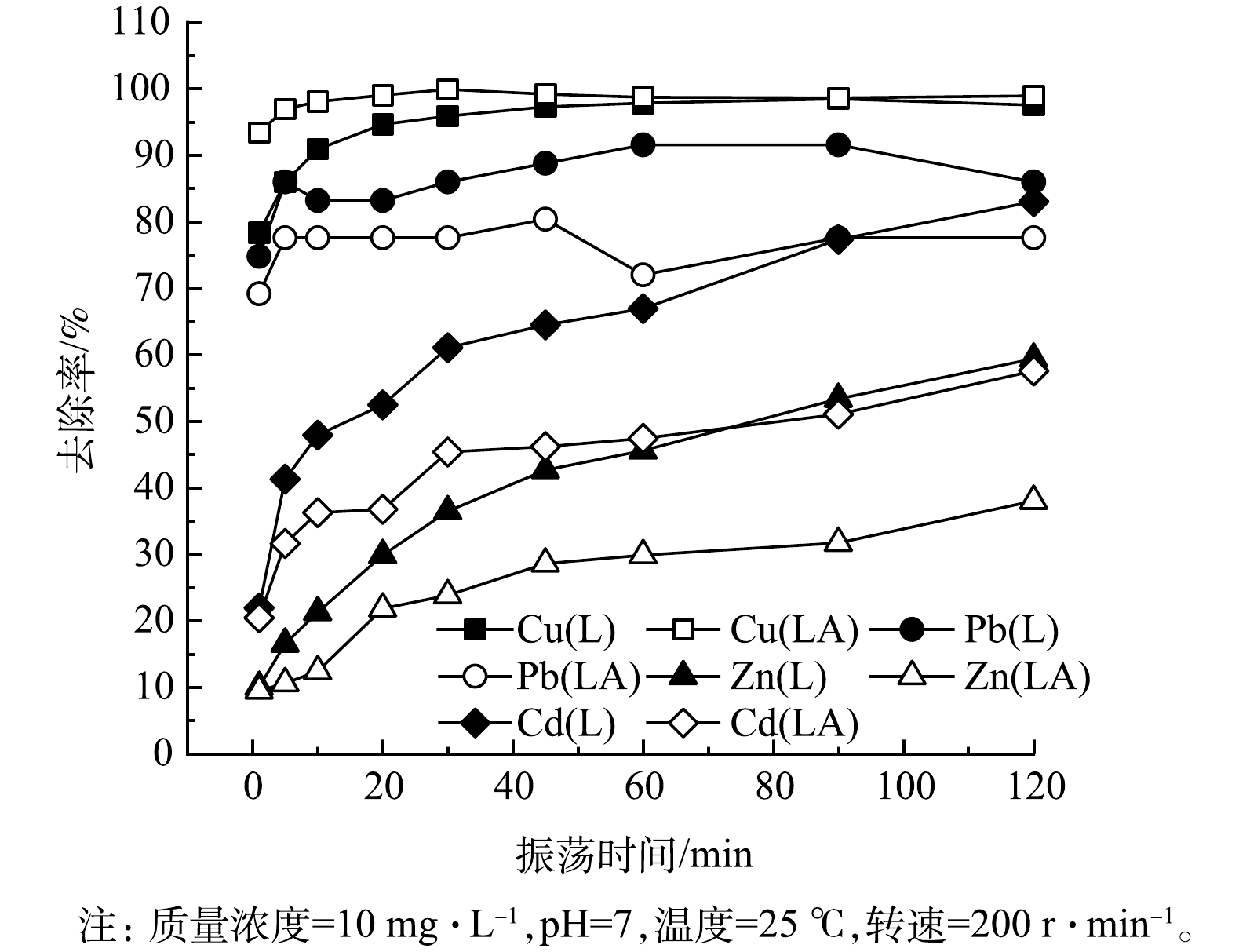
4)振荡时间对去除效果的影响。如图4所示,L和LA对金属离子的吸附速率很快,30 min内表观吸附速率可降到零。L和LA的反应速率变化趋势相似,几乎同时达到动态平衡。Zn2+和Cd2+的去除过程比较缓慢,但随着时间增加,去除率也有明显提升;Cu2+和Pb2+的去除过程迅速,基本在30 min内达到吸附平衡。Pb2+在后期去除率下降的原因可能是反应时间过久,L和LA中的Ca(OH)2持续释放OH−进入溶液,出现沉淀溶解的现象。
-
选取材料投加量、废水初始pH、振荡时间作为影响因素设计正交实验探究对单一重金属处理的最佳应用条件,所得实验结果如表4所示。
由表5可见,在对Cu2+的去除过程中,L和LA投加量、废水初始pH、振荡时间这3个因素中投加量的影响最大,而在Pb2+、Zn2+、Cd2+的去除中初始pH的影响最大。结果表明,3个因素对L和LA去除Cu2+、Pb2+、Cd2+的的影响均不显著(P>0.05),推测其可能不是影响去除率的主要因素。因此,在实际应用中考虑经济时间成本可使用次优组合。对Zn2+的去除进行方差分析时发现,3种因素是影响LA去除Zn2+的主要因素(P<0.05),但不是影响L去除Zn2+的主要因素(P>0.05)。后续可以尝试探究其他影响因素(如温度)对去除率的影响。
-
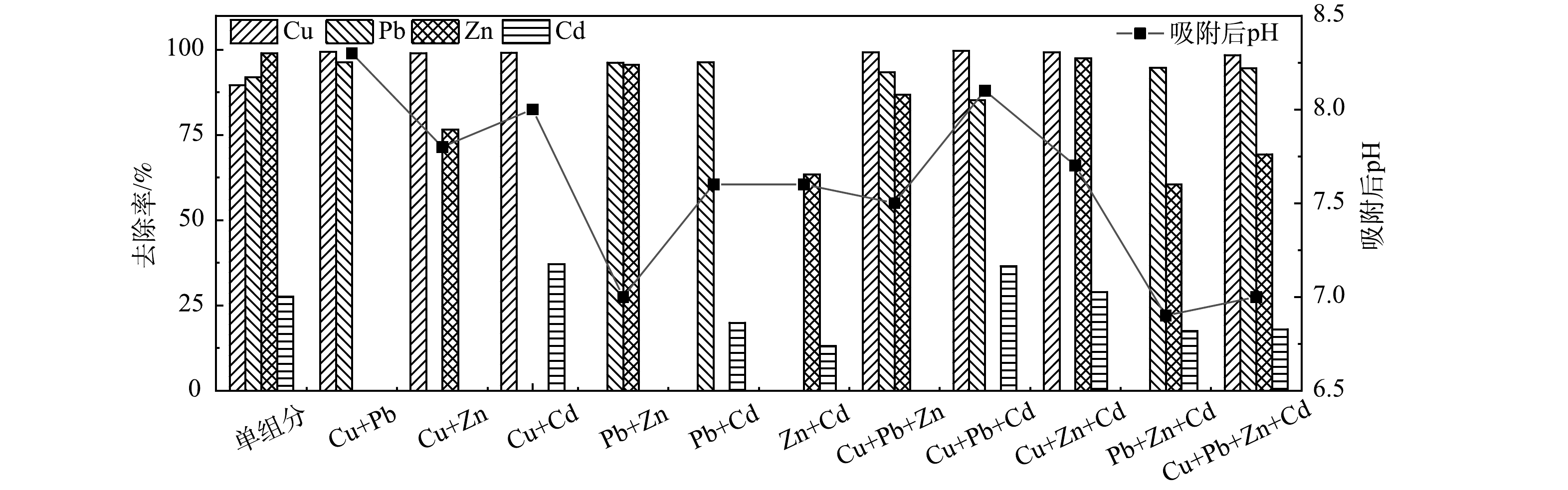
1)竞争吸附。不同重金属离子之间的性质存在差异,材料本身对不同离子的去除机理也有所不同,多种重金属离子共存时可能会发生竞争,往往会出现某一种离子被材料优先吸附,而影响其他离子去除率的情况。多组分重金属废水吸附后金属离子的去除率如下图5、图6所示。本实验中单组分与多组分为不同批次测定,火焰原子吸收光谱仪不同批次之间存在一定偶然误差,应对数据进行综合分析。
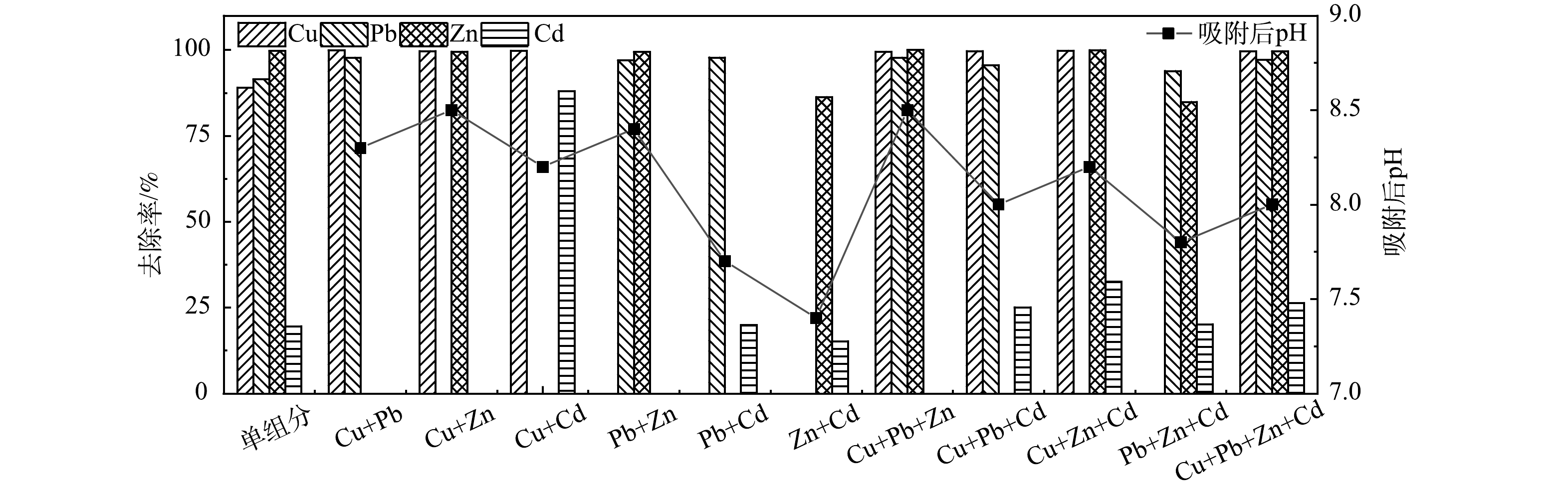
向多组分重金属废水中投加L后竞争吸附结果如图5所示。可以发现Cu2+的去除率几乎不受到其他离子影响,Pb2+略微受到Zn2+、Cd2+的抑制作用,Zn2+与Cd2+之间相互竞争激烈,抑制显著。在各离子分别组合的双组分废水中,Cu2+的竞争性是最强的,所受到其他离子的影响可忽略不计;其次是Zn2+,但Zn2+与Cd2+共存时去除率明显降低,在Cd2+影响Zn2+吸附的同时,Zn2+也影响Cd2+的吸附;然后是Pb2+,Zn2+对Pb2+略微有抑制;最后是Cd2+,Pb2+、Zn2+对其都有显著的抑制作用。值得一提的是,当Cu2+与Cd2+共存时,Cu2+对Cd2+的吸附有明显的促进作用,这一点可以从后面3组分与4组分的数据得到验证。在3组分及4组分的竞争吸附中,Cu2+受到Pb2+、Zn2+的抑制,去除率的极差为0.4%,影响微弱。Pb2+受到Cd2+的抑制强于Zn2+对其的抑制,此3种离子在溶液中共存时,3者相互抑制,其中Zn2+受抑制程度最显著。Cd2+受到Zn2+的抑制大于Pb2+对其的抑制。但并非如同其他研究[19-20]所表明,离子种类越多,竞争作用越强。通过与单组分的去除率进行对比发现,当Cu2+和Cd2+共存时,Cd2+的去除率反而大于单独Cd2+的去除率。对比Pb2++Zn2++Cd2+和Cu2++Pb2++Zn2++Cd2+可发现,当加入Cu2+后,其他3种重金属离子的去除率均有所提升。
向多组分重金属废水中投加LA后竞争吸附结果如图6所示。 Cu2+的去除略微受到Zn2+的抑制,在3种以上离子共存时,Pb2+的去除受到其他离子的抑制;Zn2+与Cd2+之间存在竞争,抑制显著。各离子与Cu2+进行双组分组合时,依旧是Cu2+的竞争能力最强,其他离子对其抑制程度为Zn2+>Cd2+>Pb2+,但影响都很微弱;其次在Pb2+参加的双组分吸附中,仅Zn2+对Pb2+有微弱的抑制,可忽略不计;然后是Zn2+在与Cd2+、Pb2+、Cu2+组合时,Zn2+受到各离子的抑制作用明显,各离子对Zn2+的抑制程度为Cd2+> Cu2+>Pb2+;当 Cd2+与Cu2+共存时,Cu2+依旧有促进Cd2+去除的作用,相较而言,Zn2+对Cd2+的抑制作用强于Pb2+对Cd2+的抑制作用。在3组分及4组分的吸附中,Cu2+的竞争情况同单组分一致;对Pb2+而言,Cu2+对其有抑制作用;对Zn2+而言,Pb2+、Cd2+与Zn2+共存时竞争激烈,Pb2+的去除率受到较大的影响;对Cd2+而言,Zn2+、Pb2+对其有显著的抑制作用。与投加L不同,投加LA后Cu2+能促进Zn2+与Cd2+的去除,但对Pb2+有抑制作用。
对比图5和图6,得到L和LA进行多组分吸附时离子之间的竞争吸附的强弱顺序分别为:Cu2+> Zn2+> Pb2+ > Cd2+和Cu2> Pb2+> Zn2+> Cd2+。分析原因为,溶液pH不同会影响L和LA的吸附能力,因为在同为矿物基材料的高岭土对重金属吸附研究中发现pH条件会影响材料表面的活性位点对离子的吸附,同时对离子交换、静电作用等都有显著影响[20]。整体来说,L吸附后溶液pH大于LA,金属离子去除率也高于LA,正如冯江涛等[21]的研究表明,大多数吸附剂需要在较高pH条件下才能对以阳离子为主要存在形态的重金属离子展现出更良好的吸附性能。通过对比单组分废水与多组分废水中金属离子的去除率,可以认为LA之间的竞争吸附更剧烈,这与L和LA吸附位点的数量差异、去除重金属离子的机理差异以及重金属离子本身的性质差异有关。在L和LA两种材料吸附中都可以发现Zn2+与Cd2+之间竞争激烈,这是由于Zn2+与Cd2+大多都是以形成氢氧化物沉淀存在于结晶体孔隙中而被去除[22],它们之间存在对OH−的竞争以及对晶体孔隙的竞争,从而导致了去除率下降。研究发现,亲和力大小决定了离子在吸附剂中的最终吸附量[23],不同组成成分具有不同的重金属吸附性能,其吸附顺序不尽相同。熊杰[24]在新型重金属捕集剂对多元重金属的竞争吸附研究中发现,Cu2+与絮凝剂活性基团的亲和力使其在竞争吸附中占据明显优势,与本次实验结果相符。除此之外,还有研究表明离子种类越多,浓度越大,重金属离子之间存在的竞争作用就越明显[20]。但有所不同的是,在本实验中重金属离子种类数增加并没有使去除率明显降低,反而部分重金属离子共存还能使去除率提高,也就是说重金属离子之间除竞争作用外也存在协同作用。一些重金属离子通过改变吸附剂表面的电势电位以及pH,或通过配位络合作用影响吸附点位,从而表现出对其他离子的抑制或促进作用[25-27]。这也就解释了本研究中处于竞争优势地位的Cu2+对其他离子的差异作用。既能够通过增强吸附剂表面的静电吸引力或减弱静电斥力促进其他离子吸附,也能通过生成一系列配合物对与其有相同吸附点位的离子产生抑制作用。
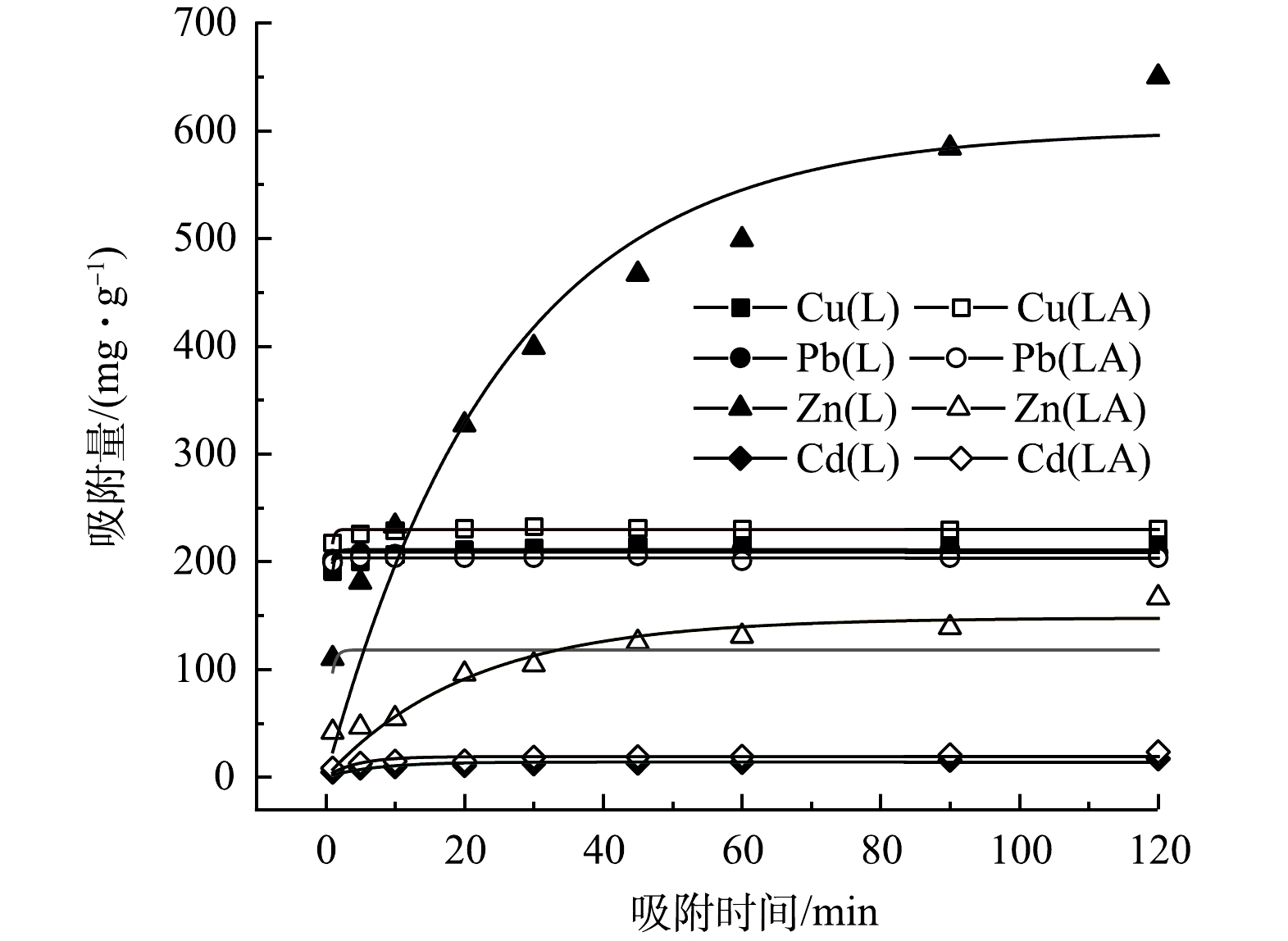
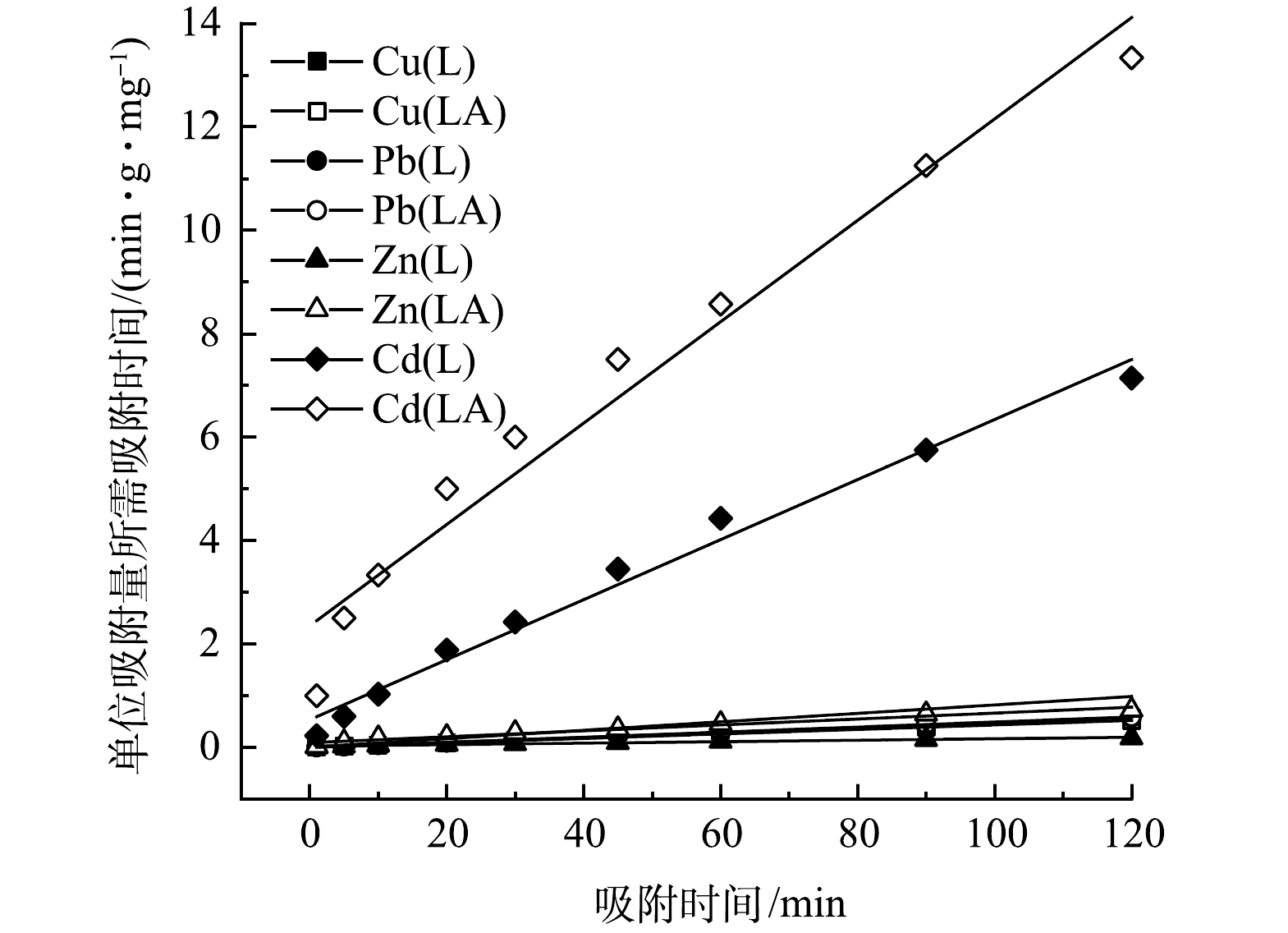
2)吸附动力学分析。为探究L和LA对重金属的吸附速率,本研究对Cu2+、Pb2+、Zn2+、Cd2+初始质量浓度均为10 mg·L−1的单组分模拟废水进行动力学分析,结果如图7和图8所示。由图可见,吸附速率最快的是Pb2+,最慢的是 Zn2+。对Cu2+和Cd2+而言,LA的吸附量大于L,而Pb2+和Zn2+则与之相反,说明L和LA对重金属离子的吸附具有选择性,且改性前后结构和水化产物的不同造成了这种差异性。由图8可以看出,伪二级吸附动力学的拟合程度远高于伪一级动力学方程,其可决系数均大于0.95,拟合结果与实验所得数据吻合较好。因此,L和LA的吸附以化学吸附为主。
3)反应机理分析。L的水化产物包括钙矾石(Aft)、C-S-H凝胶和Ca(OH)2、Al(OH)3(铝胶)、Fe(OH)3(铁胶)等[13]。水化时L发生的主要反应如式(3)和式(4)[28]所示。
目前的研究认为,水泥基材料固化重金属的机理主要是提供碱性环境促进重金属沉淀和吸附以及生成的水化产物C-S-H凝胶和钙矾石(Aft)对重金属的吸附、替代和封裹作用[29]。C-S-H凝胶单位面积所需的能量高、离子之间有很强的交换能力,其机理主要为吸附、共生和层间置换[8,10] ,而钙矾石(Aft)是化学置换。MIJNO等[30]认为C-S-H凝胶中的Ca2+能够被Pb2+、Cu2+以及Zn2+替代,并且认为这些金属离子在碱性环境中所生成的氢氧化物(Pb(OH)2、Cu(OH)2、Zn(OH)2)能够与C-S-H凝胶结合以达到固化目的。同时生成的Zn(OH)2、Cd(OH)2还可以藏匿于水泥基的另一种水化产物钙矾石(Aft)的晶体结构中[22]。并且Cd2+还被证实会以共沉淀和离子交换形式被去除[31]。
在L和LA水化时,其中的Ca(OH)2会溶于水体释放OH−,为重金属离子提供碱性环境,使得重金属离子与溶液中OH−反应生成沉淀(式(5))。并且二价重金属离子有时也会生成可溶性羟基络合物(式(6))。ELLIOTT等[32]的研究表明,重金属羟基配合物(MOH+)比游离的重金属离子(M2+)具有更高的吸附性。
这4种重金属的氢氧化物均为两性氢氧化物,Pb(OH)2、Zn(OH)2易溶于强碱溶液,Cu(OH)2、Cd(OH)2不溶于强碱而和过量氨水生成络合物。考虑到生成难溶氢氧化物和硫化物的速率更快,在本研究中,推测水解沉淀起主导作用。此外,与L相比,改性材料LA在中性条件下呈絮凝体状态,能够像大多数絮凝剂一样有效的对重金属离子进行网捕卷扫,达到沉降去除目的。王亚丽等[14]在用铁铝酸盐水泥制备透水材料时发现,其吸附重金属离子的方式主要为物理吸附和同晶置换。樊志金[11]研究同种类天然矿物基吸附重金属时,也得出材料水化产物通过晶格加成或置换重金属离子来达到去除的目的。
综上所述,硫铝酸盐水泥及其改性材料去除重金属的机理如图9所示。去除机理主要通过4种途径:作为沉淀剂,使重金属离子水解;作为吸附剂,对重金属离子进行吸附作用;作为絮凝剂,网捕卷扫作用沉降重金属离子;其水化产物晶格加成或置换重金属离子[11]。
4)安全性分析。以0.1 g·L−1的投加量进行溶出实验,溶液中Fe3+溶出值低于0.3 mg·L−1,Al2+溶出值低于0.2 mg·L−1,即使全部溶出也能满足《生活饮用水卫生标准》(GB 5749-2006)。
-
1) L和LA对废水中重金属离子均具有良好的去除性能,30 min内表观吸附速率可降到零。在pH为3.0~10.0条件下能够以极少的投加量(0.05~3 g·L−1)使目标离子达到94%以上的去除率。相比之下,LA对重金属离子的去除率略高于L。
2)除LA去除Zn2+外,材料投加量、废水pH、废水中重金属初始浓度3个因素对结果的影响均不显著。
3)在L和LA对多组分离子之间的竞争吸附中发现Cu2+的竞争性最强,且能够促进其他离子被吸附,有利于该材料在复杂水环境中的应用。吸附动力学分析结果表明L和LA的吸附以化学吸附为主。
4) L和LA对重金属离子的去除机理主要包括沉淀、吸附、絮凝、其水化产物晶格加成或置换重金属离子,其中以水解沉淀为主,其他作用为辅。
硫铝酸盐水泥及其改性材料对典型重金属的去除性能
Performance on typical heavy metals removal by sulphoaluminate cement and its modified material
-
摘要: 应用经济高效的材料和简易的方法去除水中重金属已成为当前的研究热点。选择硫铝酸盐水泥(L)及其改性材料(LA)为清除剂,以Cu2+、Pb2+、Zn2+、Cd2+ 4种典型的重金属离子为研究对象,通过考察L和LA去除重金属过程中单因素的影响,对去除条件进行了优化,此外,通过竞争吸附实验及吸附动力学模型探究了对金属离子的去除机理。结果表明,L和LA可以有效地去除废水中的重金属离子,在pH为3.0~10.0条件下能够以较少的投加量(0.05~3 g·L−1)使目标离子达到94%以上的去除率,30 min内表观吸附速率可降到零。相比之下,LA对金属离子的去除率略高于L。在最佳应用条件下,金属离子的去除率基本在90%以上。在竞争吸附实验中Cu2+的竞争性最强,且其能够促进其他离子被吸附。吸附动力学分析表明,L和LA对重金属的吸附是以化学吸附为主,去除机理以水解沉淀为主。以上研究结果可为该类材料对重金属的处理提供参考。Abstract: The application of cost-effective materials and simple methods to remove heavy metals from water has become a research hotspot. In this study, a type of sulphoaluminate cement (L) and its modified material (LA) were used to remove four typical heavy metal ions of Cu2+, Pb2+, Zn2+ and Cd2+ from the simulated wastewater. The removal conditions were optimized by investigating the effects of single factors on heavy metals removal by L and LA. In addition, the removal mechanism was analyzed by the competitive adsorption test and adsorption kinetic model. The results indicate that L and LA had a good performance on heavy metal ions removal from wastewater, under the conditions of pHs 3.0~10.0 and low dosages (0.05 g·L−1~3 g·L−1), the removal rate could reach higher than 94%, and the apparent adsorption rate decreased to zero within 30 minutes. The removal rate by LA was slightly higher than L. Under the best application conditions, the removal rates for these heavy metals were basically higher than 90%. In the competitive adsorption, Cu2+ showed the strongest competition and could promote the adsorption of other ions. The adsorption kinetics analysis shows that the heavy metals adsorption by L and LA was mainly dominated by chemical adsorption, and the mechanism of heavy metals removal was mainly dominated by hydrolytic precipitation. These results can provide a reference for heavy metals treatment in wastewater by this type of material.
-
Key words:
- sulphoaluminate cement /
- heavy metal wastewater /
- modification /
- removal mechanism
-
表 1 投加量的因素-水平表
Table 1. Factor of dosage - level table
g·L−1 重金属离子 材料 水平 1 2 3 Cu2+ L/LA 0.1 1 3 Pb2+ L/LA 0.03 0.05 0.1 Zn2+ L 0.03 0.05 0.1 LA 0.05 0.1 1 Cd2+ L 1 3 5 LA 0.5 3 5 注:水平1、2、3振荡时间因素-水平分别为15 min、30 min、45 min。 表 2 初始pH的因素-水平表
Table 2. Factors of initial pH - level table
重金属离子 材料 水平 1 2 3 Cu2+ L/LA 3.0 7.0 9.0 Pb2+ L 3.0 4.0 7.0 LA 4.0 7.0 9.0 Zn2+ L 5.0 7.0 9.0 LA 3.0 7.0 8.0 Cd2+ L/LA 2.0 3.0 7.0 注:水平1、2、3振荡时间因素-水平分别为15 min、30 min、45 min。 表 3 多组分模拟废水重金属离子组合情况
Table 3. Combination of heavy metal ions in the simulated wastewater with multicomponent
mg·L−1 组合方式 Cu2+ Pb2+ Zn2+ Cd2+ Cu2++Pb2+ 10 10 — — Cu2++Zn2+ 10 — 10 — Cu2++Cd2+ 10 — — 10 Pb2++Zn2+ — 10 10 — Pb2++Cd2+ — 10 — 10 Zn2++Cd2+ — — 10 10 Cu2++Pb2++Zn2+ 10 10 10 — Cu2++Pb2++Cd2+ 10 10 — 10 Cu2++Zn2++Cd2+ 10 — 10 10 Pb2++Zn2++Cd2+ — 10 10 10 Cu2++Pb2++Zn2++Cd2+ 10 10 10 10 表 4 正交实验重金属剩余浓度
Table 4. Residual concentration of heavy metals in the orthogonal experiment
mg·L−1 因素组合 Cu2+ Pb2+ Zn2+ Cd2+ L LA L LA L LA L LA X1Y1Z1 2.939 3.088 8.464 2.976 8.010 8.290 9.580 9.770 X1Y2Z2 0.928 0.735 0.594 0.686 4.340 6.560 0.026 3.190 X1Y3Z3 0.028 0.037 0.274 0.503 0.044 0.079 0.029 0.127 X2Y1Z2 0.018 0.072 1.097 0.957 4.310 5.790 0.550 0.359 X2Y2Z3 0.009 0.037 0.274 0.411 0.267 0.668 0.020 0.133 X2Y3Z1 0.028 0.037 0.228 0.457 0.051 0.040 0.020 0.066 X3Y1Z3 0.028 0.035 0.274 0.728 0.056 0.018 0.159 1.034 X3Y2Z1 0.037 0.018 0.183 0.320 0.738 0.023 0.014 0.055 X3Y3Z2 0.037 0.037 0.274 0.320 0.054 0.023 0.011 0.043 注:X为投加量;Y为初始pH;Z为振荡时间,下标数字1、2、3为表1、表2中各因素3水平。 表 5 极差分析结果
Table 5. Range analysis results
-
[1] 张帆, 李菁, 谭建华, 等. 吸附法处理重金属废水的研究进展[J]. 化工进展, 2013, 32(11): 2749-2756. [2] SRIVASTAVA N K, MAJUMDER C B. Novel biofiltration methods for the treatment of heavy metals from industrial wastewater[J]. Journal of Hazardous Materials, 2008, 151(1): 1-8. doi: 10.1016/j.jhazmat.2007.09.101 [3] 杜凤龄, 徐敏, 王刚, 等. 絮凝剂处理重金属废水的研究进展[J]. 工业水处理, 2014, 34(12): 12-16. doi: 10.11894/1005-829x.2014.34(12).012 [4] 朱四琛, 孙永军, 孙文全, 等. 絮凝法在重金属废水处理中的研究进展与应用[J]. 净水技术, 2018, 37(11): 40-50. doi: 10.15890/j.cnki.jsjs.2018.11.008 [5] 李博文, 杨桂锦. 重金属废水处理技术研究进展[J]. 中国资源综合利用, 2021, 39(11): 87-92. doi: 10.3969/j.issn.1008-9500.2021.11.024 [6] JOSEPH L, JUN B M, FLORA J R V, et al. Removal of heavy metals from water sources in the developing world using low-cost materials: A review[J]. Chemosphere, 2019, 229: 142-159. doi: 10.1016/j.chemosphere.2019.04.198 [7] HASSAN S S M, AWWAD N S, ABOTERIKA A H A. Removal of chromium(VI) from wastewater using Sorel's cement[J]. Journal of Radioanalytical and Nuclear Chemistry, 2006, 269(1): 135-140. doi: 10.1007/s10967-006-0242-2 [8] 姚燕, 王昕, 颜碧兰, 等. 水泥水化产物结构及其对重金属离子固化研究进展[J]. 硅酸盐通报, 2012, 31(5): 1138-1144. [9] 史伟, 王冬. 2009到2050年中国水泥产量预测//中国硅酸盐学会[J]. 2009中国水泥技术年会暨第十一届全国水泥技术交流大会论文集. 重庆, 2009: 18. [10] 陈怡, 肖迎旭, 樊志金, 等. 水泥-石灰对Cu2+、Pb2+废水处理研究[J]. 环境科学与技术, 2016, 39(2): 139-142. [11] 樊志金. 水泥处理重金属废水研究[D]. 成都: 西华大学, 2016. [12] 李国新, 牛梦蝶. 一种含重金属离子工业废水的处理方法及重金属离子-硫铝酸盐水泥-膨润土复合材料. CN110240456B[P], 2021-07-30. [13] 齐冬有, 王燕谋, 汪智勇, 等. 铁铝酸盐水泥有望破解水泥混凝土遭受海水腐蚀难题[N]. 2021-11-08. [14] 王亚丽, 崔素萍, 徐西奎. 铁铝酸盐水泥基材料吸附重金属离子规律的研究[J]. 混凝土, 2010(10): 8-9. [15] 杨蕤, 刘国, 黄艳采, 等. 硫铝酸盐水泥去除微污染水体中磷的性能及机理[J]. 湖泊科学, 2022, 34(3): 828-842 [16] 国家环境保护局. 水质 铜、锌、铅、镉的测定 原子吸收分光光度法: GB 7475-87 S].
[17] HO Y S, MCKAY G. Pseudo-second order model for sorption processes[J]. Process Biochemistry, 1999, 34(5): 451-465. doi: 10.1016/S0032-9592(98)00112-5 [18] LAGERGREN S. Zur theorie der sogenannten adsorption geloster stoffe[J]. Kungliga Svenska Vetenskapsakademiens Handlingar, 1898(24): 1-39. [19] JIANG M Q, JIN X Y, LU X Q, et al. Adsorption of Pb(II), Cd(II), Ni(II) and Cu(II) onto natural kaolinite clay[J]. Desalination, 2010, 252(1-3): 33-39. doi: 10.1016/j.desal.2009.11.005 [20] 梁艳, 卢燕南, 唐艳葵, 等. 多组分重金属复合体系在高岭土中的吸附差异[J]. 广西大学学报(自然科学版), 2021, 46(1): 173-181. doi: 10.13624/j.cnki.issn.1001-7445.2021.0173 [21] 冯江涛, 王桢钰, 闫炫冶, 等. 吸附去除水体重金属离子的影响因素研究进展[J]. 西安交通大学学报, 2022, 56(2): 1-17. [22] GINEYS N, AOUAD G, DAMIDOT D. Managing trace elements in Portland cement - Part I: Interactions between cement paste and heavy metals added during mixing as soluble salts[J]. Cement and Concrete Composites, 2010, 32(8): 563-570. doi: 10.1016/j.cemconcomp.2010.06.002 [23] 刘继芳, 曹翠华, 蒋以超, 等. 重金属离子在土壤中的竞争吸附动力学初步研究Ⅰ. 竞争吸附动力学的竞争规律与竞争系数[J]. 土壤肥料, 2000(2): 30-34. [24] 熊杰. 新型重金属捕集剂去除废水重金属离子研究[D]. 重庆: 重庆工商大学, 2021. [25] SONG L, FENG Y, ZHU C, et al. Enhanced synergistic removal of Cr(VI) and Cd(II) with bi-functional biomass-based composites[J]. Journal of Hazardous Materials, 2020, 388: 121776. doi: 10.1016/j.jhazmat.2019.121776 [26] ZHU C, LIU F, ZHANG Y, et al. Nitrogen-doped chitosan-Fe(III) composite as a dual-functional material for synergistically enhanced co-removal of Cu(II) and Cr(VI) based on adsorption and redox[J]. Chemical Engineering Journal, 2016, 306: 579-587. doi: 10.1016/j.cej.2016.07.096 [27] HUANG D, WU J, WANG L, et al. Novel insight into adsorption and co-adsorption of heavy metal ions and an organic pollutant by magnetic graphene nanomaterials in water[J]. Chemical Engineering Journal, 2018, 358: 1399-1409. [28] 王培铭, 李楠, 徐玲琳, 等. 低温养护下硫铝酸盐水泥的水化进程及强度发展[J]. 硅酸盐学报, 2017, 45(2): 242-248. doi: 10.14062/j.issn.0454-5648.2017.02.10 [29] 王登权, 何伟, 王强, 等. 重金属在水泥基材料中的固化和浸出研究进展[J]. 硅酸盐学报, 2018, 46(5): 683-693. doi: 10.14062/j.issn.0454-5648.2018.05.11 [30] MIJNO V, CATALAN L J J, MARTIN F, et al. Compositional changes in cement-stabilized waste during leach tests-comparison of SEM/EDX data with predictions from geochemical speciation modeling[J]. Journal of Colloid and Interface Science, 2004, 280(2): 465-477. doi: 10.1016/j.jcis.2004.08.025 [31] POMIES M P, LEQUEUX N, BOCH P. Speciation of cadmium in cement Part I. Cd2+ uptake by C-S-H[J]. Cement and Concrete Research, 2001, 31(4): 563-569. doi: 10.1016/S0008-8846(00)00480-4 [32] ELLIOTT H A, LIBERATI M R, HUANG C P. Competitive adsorption of heavy metals by soils[J]. Journal of Environmental Quality, 1986, 15(3): 215-219. -




 下载:
下载: