-
人工湿地(constructed wetlands,CWs)作为一种生态友好的污水处理工程技术,因其效率高、可持续、等优点,被广泛用于室外污水处理[1]。其中潜流湿地系统优势明显,其充分利用填料具有高水力负荷和高污染物去除负荷的能力,以及更小的占地面积[2]等优点。湿地填料是湿地中水生动植物的生存载体和微生物的稳定附着基[3]。不同的填料,因理化特性不同,其水处理效果也不同。合适的填料和配比组成,可提升人工湿地的污水处理效果、降低建设和维护成本。CWs中填料在处理效率和建设成本中占有很高的比例。因此,明确不同基质在不同负荷下对污染物质的去除效率,对湿地建设方案中有关基质组成的设计、湿地处理效果科学保障和成本控制尤为重要。火山岩、沸石和生物陶粒是常见的CWs填料,其中沸石和火山岩是一种天然材料,由于价格低廉,产量丰富而被广泛使用。STEFANAKIS等发现,沸石、火山岩等对水体中的有机物及氮元素均有较好的去除效果[4],但对于高浓度营养污染物的处理能力不足[5-6]。生物陶粒是一种人工材料,由于其处理污染物的性能较优而被广泛使用[7-9]。JIANG等发现,生物陶粒对溶解性有机磷去除能力最强[10]。尽管不同类型填料的人工湿地对氮磷污染物的净化已有许多研究,但其对于水体新兴污染的去除研究较少。
抗生素类污染物是水体中的一类新兴污染物,其可影响水体微生物群落组成和功能,并可引起一系列的水环境生态问题,甚至影响人类健康[11]。据统计,2013 年我国抗生素总使用量约为 16.2×104 t[12]。有研究[13]表明,我国长江流域以磺胺类(sulfonamides,SAs)喹诺酮类(quinolones,QNs)为主要污染物。上海市地表水中抗生素的残留检测发现,磺胺吡啶浓度最高[14]。这些抗生素的来源与人类医药使用和畜牧业的污水排放有关,同时也与水产养殖病害防治使用抗生素有一定关联。本课题组对上海某养殖场养殖尾水调查发现,SAs和QNs是该养殖场养殖尾水中检测频率和浓度最高的2种新型污染物[15]。目前,对市政污水中抗生素去除的研究较多,比如采用好氧生物法和厌氧生物法,均具有较高的去除潜能效率[16]。但对水产养殖尾水中抗生素残留的去除,目前相关研究还比较少见。
水产养殖中,养殖不同的水产品种和不同的养殖方式,其养殖尾水中氮磷营养污染负荷差别较大。不同营养污染负荷条件下,不同填料的潜流湿地对养殖尾水中抗生素的去除效果是否有差异?哪种填料组配的潜流湿地处理效果更好?这方面研究目前还尚未见报道。本研究构建了“沸石+生物陶粒” (湿地CW-B)、沸石(湿地CW-Z)、“沸石+火山岩” (湿地CW-V)为填料的3种小型人工潜流湿地实验系统,研究了不同类型基质填料潜流湿地对抗生素(磺胺嘧啶(sulfadiazine,SDZ)和诺氟沙星(norfloxacin,NFX))和常规污染物的去除效果,筛选出最佳填料和其适用条件,以期为后续处理含新兴污染物污水人工湿地的设计和建设提供参考。
-
所用的沸石、火山岩、生物陶粒和石英砂 4种基质填料均购自河南景盈水处理材料有限公司。3种实验基质沸石、火山岩和生物陶粒的直径分别为4~8、5~10和5~10 mm,主要规格参数如表1所示。石英砂主要用于分隔土壤和基质,土壤选自上海市青浦生态农业园蓝莓园基地,通过粉碎、过网等预处理后,备用。
-
诺氟沙星(NFX,C16H18FN3O3,分析纯(≥96%))购于生工生物工程(上海)股份有限公司。实验时先精确称量 1.0 g NFX,溶于50 Ml 0.1 mol·L−1的 NaOH 溶液中,待其完全溶解后,用去离子水稀释定容至 1 000 mL,配制成 1.0 g·L−1的诺氟沙星标准母液。磺胺嘧啶(SDZ,C10H10N4O2S,分析纯(≥96%))购于生工生物工程(上海)股份有限公司。SDZ 微溶于冷水,易溶于沸水,与NFX一样,配制成1.0 g·L−1的磺胺嘧啶标准母液备用。
-
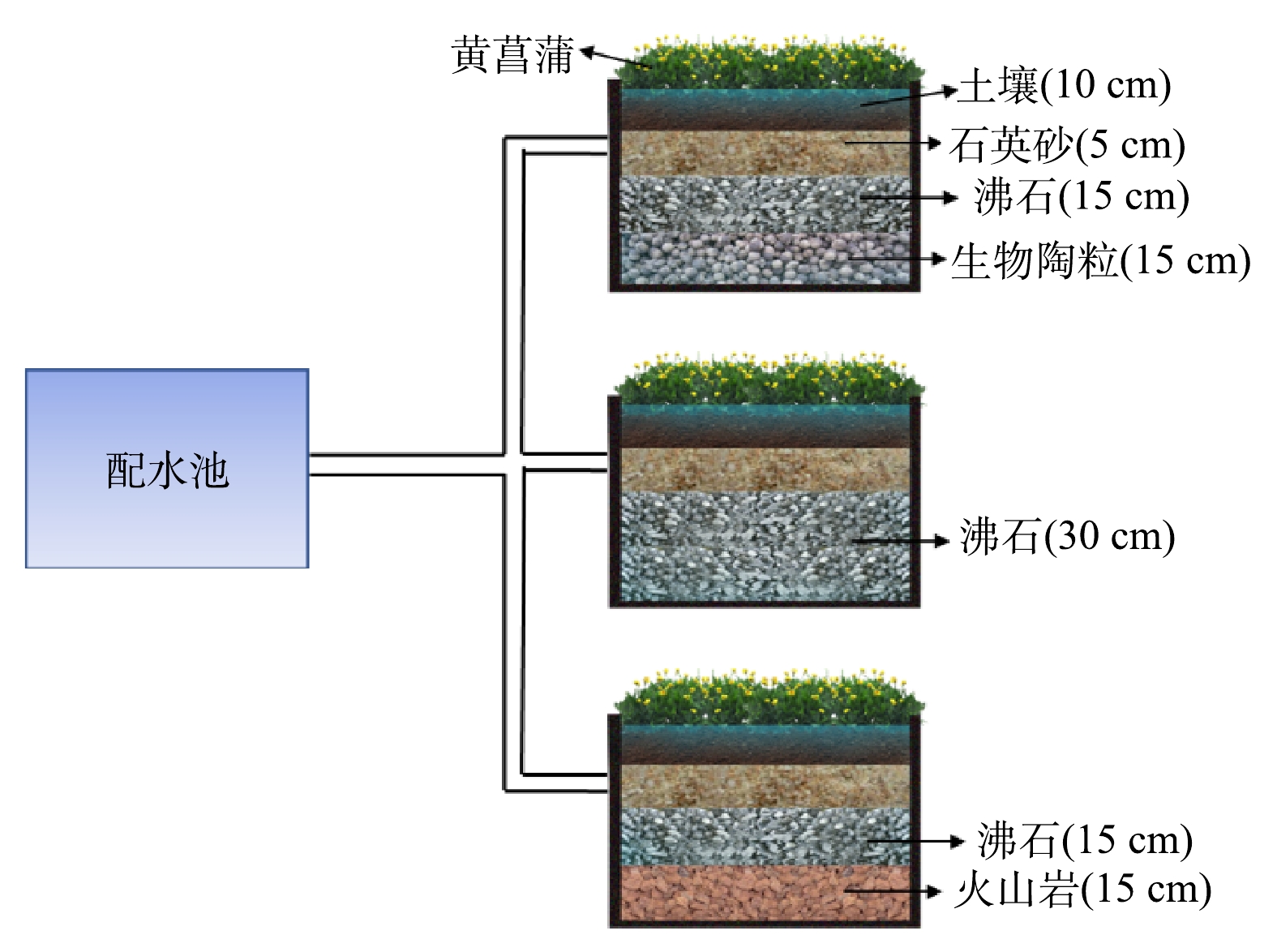
实验装置位于上海市青浦区温室棚内(图1),采用有机玻璃设计9个长1.2 m、宽1 m、高0.5 m的装置用来构建潜流湿地。每个装置工作体积为480 L,所有玻璃装置外围均用黑色纤维网包裹。人工污水配水池使用聚乙烯塑料正方体储水吨桶。设计3组不同填料类型的潜流湿地:CW-Z型湿地基质组成为表层10 cm土层,中层 5 cm石英砂(用于隔离土壤和基质),底层30 cm的厚沸石;CW-V型湿地基质为表层为10 cm土层,中层 5 cm石英砂(用于隔离土壤和基质),底层15 cm厚沸石+15cm火山岩;CW-B型湿地基质组成为表层10 cm土层,中层 5 cm石英砂(用于隔离土壤和基质),底层15 cm厚沸石+15cm生物陶粒。
-
实验前,从上海市青浦区沙田湖水产养殖场收集了1 500 L养殖尾水(抗生素含量小于1 µg·L−1),分别加入到9个潜流湿地进行微生物预培养(每个潜流湿地 150 L)。湿地植物选自同一种植基地,选取长势相同的黄菖蒲,种植密度为16株·m−2。在驯化30 d后,以水力停留时间(HRT)24 h为1个周期,模拟人工污水以降流方式泵入实验湿地系统。每个系统运行24 h后排空,然后立即补充新的人工污水,形成水力负荷为0.4 m3·(m2·d)−1的运行模式。
人工污水的配制基于当地水产养殖场尾水N、P、COD水平以及各类抗生素检出率和检出量[17]进行,分别设计了低、中、高3种浓度,实验湿地系统进水污染物负荷具体浓度如表2所示(湿地进水NO2-N含量小于0.1 mg·L−1,未列出)。对应潜流湿地组别名称为L-CW-B、L-CW-Z、L-CW-V,M-CW-B、M-CW-Z、M-CW-V和H-CW-B、H-CW-Z、H-CW-V(L代表低浓度、M代表中浓度和H代表高浓度)。以高浓度组为例,模拟人工污水以183 mg·L−1葡萄糖、49 mg·L−1NH4Cl、8 mg·L−1 KNO3、5 mg·L−1 KH2PO4、5 mg·L−1 CaCl2、5 mg·L−1 MgSO4的混合物溶解在经8 h曝气的500 L水体中,此外,在3个配水池中分别加入50 mL配置好的抗生素母液(磺胺嘧啶和诺氟沙星质量浓度均为100 µg·L−1)。在本实验中选择了较高的抗生素浓度,以探索常规污染物去除与抗生素去除之间的交互作用。
实验于2020年8—9月分为2个阶段进行:第1阶段在2020年8月,采集养殖尾水注入潜流湿地稳定培养30 d;第2阶段在2020年9月,模拟人工污水泵入实验系统,每隔24 h把装置内的水排干净,稳定运行7 d后,每次排水取湿地系统出水口水样1 L,进行相应指标测定,平行3份。
-
实验期间,根据水力停留时间24 h,对人工湿地的进、出水分别进行了采样和相应指标分析。用野外水质测定仪(美国YSI Pro Plus)原位测定温度、pH和溶解氧(DO)等物理化学参数;水质指标总氮(TN)、总磷(TP)、氨氮(NH3-N)、硝氮(NO3-N)、亚硝氮(NO2-N)以及高锰酸盐(COD)参照国家标准方法[18]。
抗生素测定:用玻璃纤维过滤器(孔径为 0.45 µm,直径为47 mm, UK Whatman 7184-004)过滤1 L水样,以去除水中的悬浮颗粒。保存在1 L棕色采样瓶中,冷冻保存并及时运回实验室,处理前(48 h内)置于4 °C冷库中保存。2种抗生素各取300 mL水样进行预处理[19]。采用高效液相色谱仪(HPLC,美国 Agielnt1100 system)对预处理后的水样进行测定。SAs测定参数为: C18色谱柱(150 mm×4.6 mm,5 µm),流动相乙腈/磷酸=60:40(0.017 mol·L−1),流速1.0 mL·min−1,紫外检测波长287 nm,柱温40 ℃,自动进样量10 µL。QNs测定参数:流动相0.1 mol·L−1柠檬酸乙酸铵(三乙胺调pH为4.5):乙腈=75∶25,流速1.5 mL·min−1,荧光检测器的激发和发射波长分别为280 nm和450 nm,柱温40 ℃,进样量10 µL。
-
采用SPSS 21.0和Origin 2019软件对数据进行数理统计分析。用单因素方差分析(ANOVA)检验评估不同潜流湿地水质和抗生素指标的差异性,P<0.05水平认为有显著差异。
-
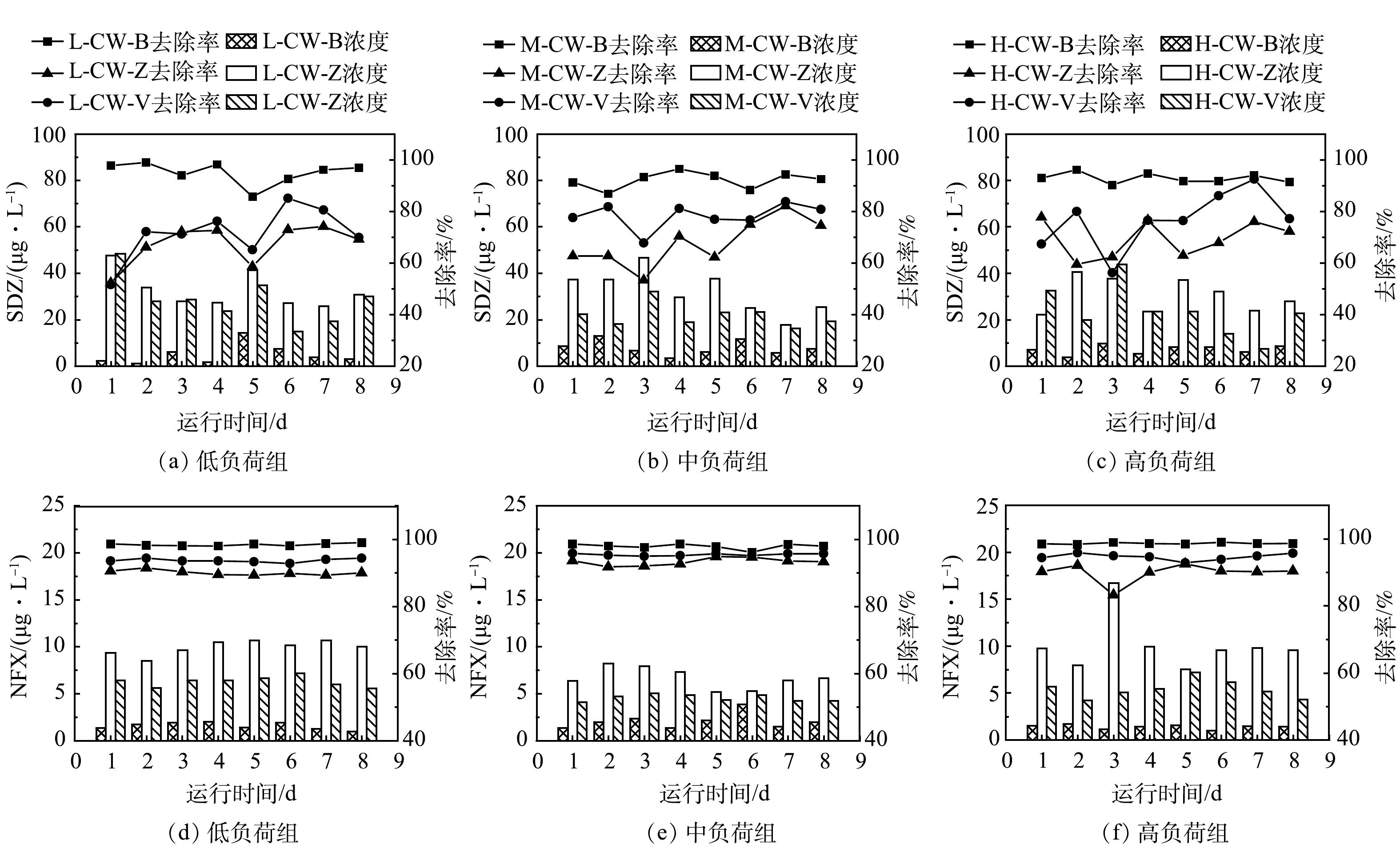
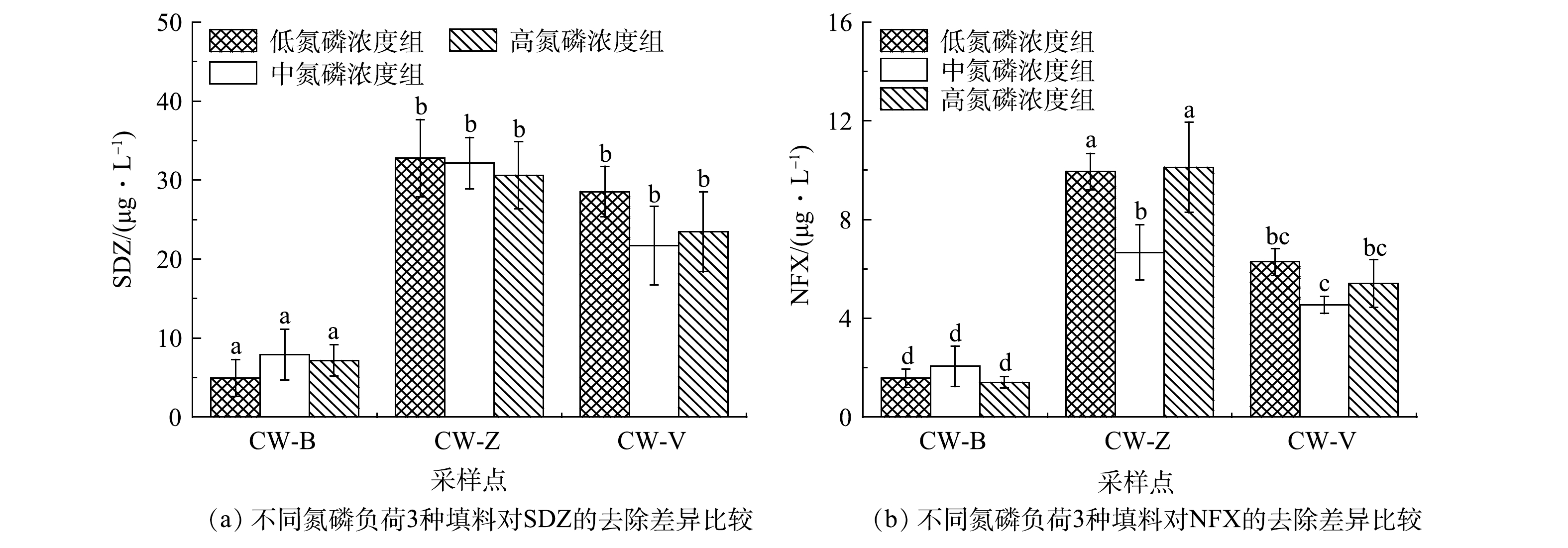
由图2和图3可见,在3种氮磷负荷下,不同填料类型的潜流湿地对NFX的去除效果均优于SDZ。低氮磷浓度组,CW-B处理组对NFX和SDZ的平均去除率最高(分别为98.42%、95.03%);中氮磷浓度组,同样,CW-B处理组对NFX和SDZ的平均去除率最高(分别为97.94%、92.11%);在高氮磷浓度处理组中依然如此。3种氮磷负荷下,均为CW-B填料湿地对复合抗生素(NFX和SDZ)的去除效率最高,且与其他2组表现出显著差异(P<0.05)。CW-V填料湿地对NFX和SDZ的平均去除效率要优于CW-Z,且两者存在显著差异(P<0.05) (除低氮磷浓度组SDZ的去除)。不同填料对抗生素的去除能力表现为生物陶粒>火山岩>沸石。
由图4可见,随着氮磷浓度的增加,不同填料类型的湿地对SDZ的去除率无显著变化(P>0.05);但对NFX的去除,则 CW-Z和CW-V处理组在中氮磷浓度条件下具有较高的去除效率,且显著高于低、高浓度组的去除率(P<0.05);CW-B处理组随着氮磷浓度的增加对2种抗生素的去除率无显著变化(P>0.05)。
-
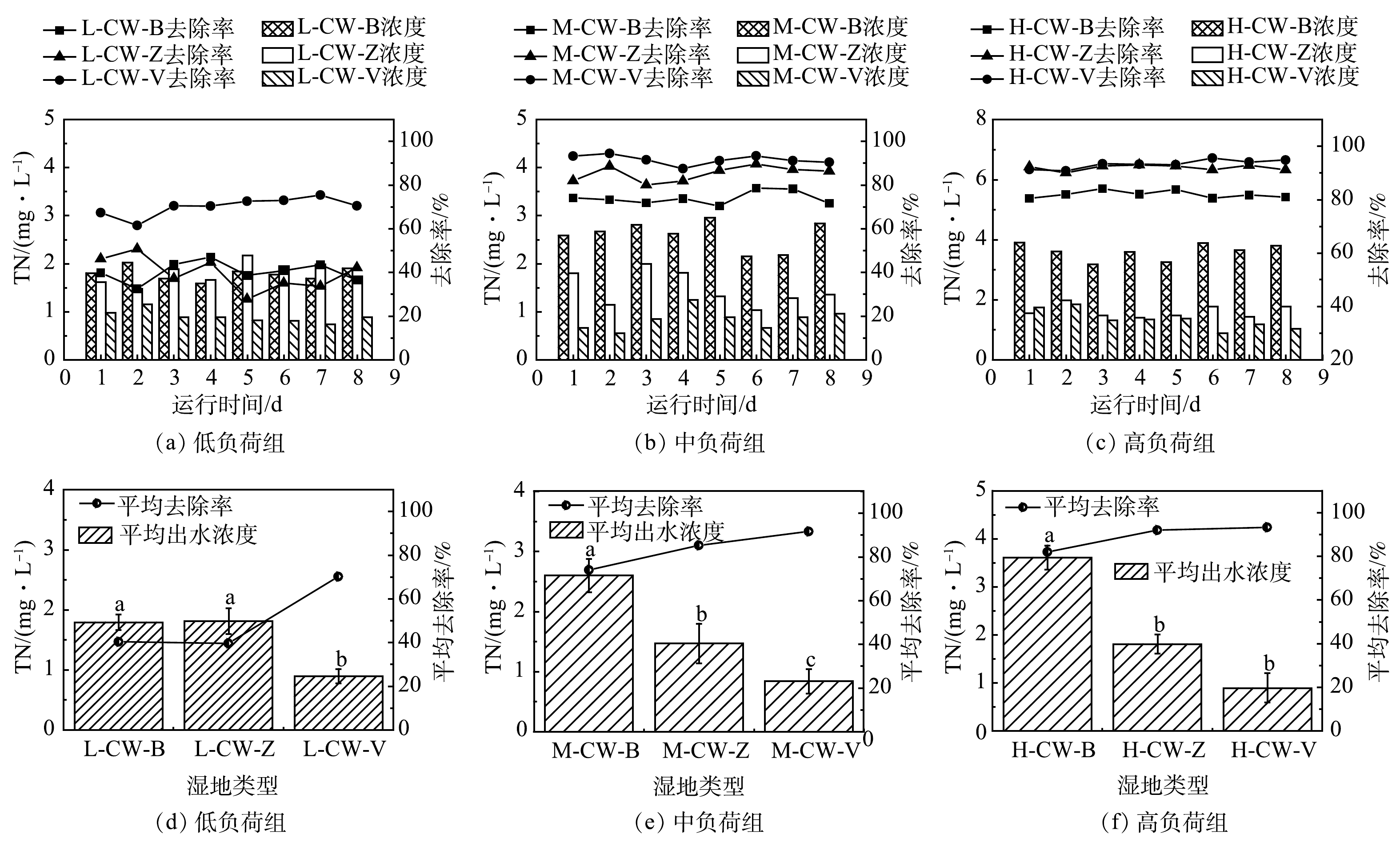
由图5可见,低氮磷浓度组,CW-V填料湿地对TN的去除率(平均为70.16%)显著高于另外两组(P<0.05),CW-B和CW-Z对TN的去除效果无显著差异(P>0.05),分别为40.29%和39.64%;中氮磷浓度组, CW-V处理组对TN的去除效果最好,平均可达91.16%, CW-Z的去除效果优于CW-B,分别为85.31%和73.98%,且3种填料湿地间存在显著差异(P<0.05);在高氮磷浓度组,CW-V对TN的平均去除率最高,为93.31%,但CW-V和CW-Z处理组之间无显著差异(P>0.05),CW-B与其他2组呈现显著差异(P<0.05)。随着污染物负荷增高,3 种填料类型的湿地处理组对TN的去除率总体呈增高趋势。
由图6可见,不同氮磷浓度组,3种不同填料湿地对NH3-N的去除都达到较高水平(90%以上),且各组之间无显著差异(P>0.05);对NO3-N的去除,则CW-B组的去除率显著低于CW-V和CW-Z两个处理组(P<0.05);各填料湿地出水口NO2-N含量较湿地进水升高了很多,CW-B出水口NO2-N含量显著高于CW-V和CW-Z(P<0.05)。不同填料类型湿地系统对氮的净化能力表现为火山岩>沸石>生物陶粒。
-
由图7可见,对于低氮磷浓度组,CW-B对TP的平均去除率(61.99%)高于另外2组,但无显著差异(P>0.05);对于中氮磷浓度组, CW-B对TP的去除率最高,平均可达69.04%,显著高于其他2组(P<0.05);对于高氮磷浓度组,CW-B对TP平均去除率(81.42%)依旧显著高于CW-V和CW-Z(P<0.05)。随着氮磷污染负荷的增高,3种不同填料类型的湿地系统对TP的去除率总体呈增长趋势。在3种氮磷负荷下,CW-B湿地对TP的去除率均最高(P<0.05),CW-V与CW-Z之间并未表现出显著差异(P>0.05)。不同湿地填料对磷的吸附能力表现为生物陶粒>火山岩>沸石。
-
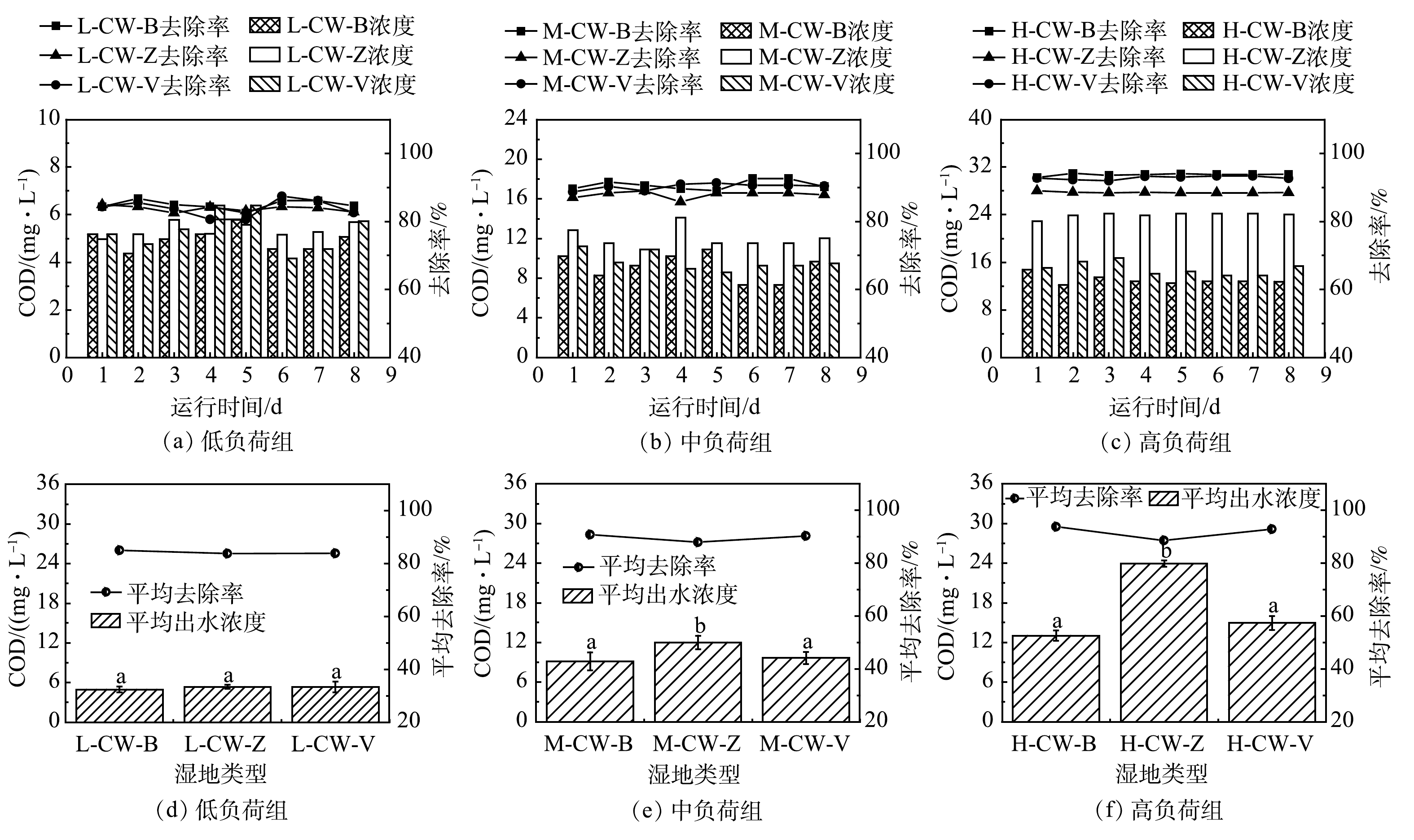
由图8可见,低氮磷浓度组,3种不同填料湿地对有机物的去除效果无显著差异(P>0.05);中氮磷浓度组, CW-B和CW-V对有机物的去除无显著差异,分别为90.76%和90.25%,且显著高于CW-Z处理组(P<0.05);高氮磷浓度组,CW-B和CW-V对有机物的去除率无显著差异,分别为96.98%和96.91%,且显著高于 CW-Z处理组(P<0.05)。结果表明,陶粒、火山岩对有机物的去除率都很高,达90%以上,且显著高于沸石处理组;随着污染负荷增高,3种不同填料类型的湿地对有机物的去除率有增高的趋势。
-
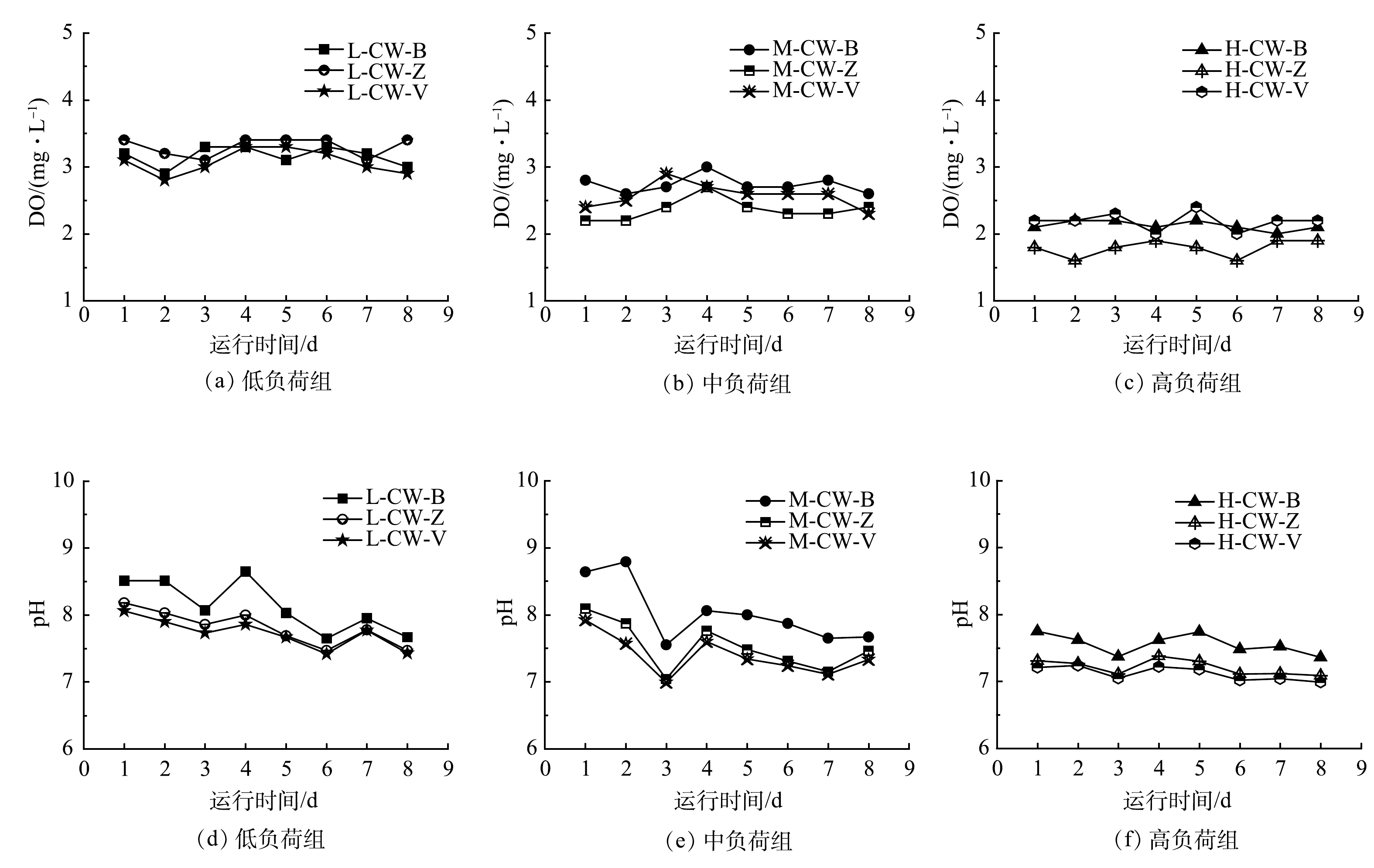
由图9可见,不同填料类型的湿地出水水体的DO含量和pH随着氮磷负荷的升高呈下降的趋势。中、高氮磷浓度组,CW-Z的DO含量最差;在3种氮磷负荷下,CW-B出水的pH最高,CW-V的pH最低。
-
基质是CWs的重要组成部分,直接影响湿地的处理成本、处理效率和可持续性[20]。结果表明,3种基质填料对SDZ和NFX 均有较高的去除率, 对NFX的去除率(>90%)明显优于对磺胺嘧啶SDZ的去除率(>60%)。陶粒处理组对抗生素的去除效果显著优于火山岩和沸石。LIU等[21]研究表明,CWs对于QNs的去除效率要优于SAs。近些年针对湖泊河流附近的湿地生态调查显示:QNs的去除效率最高,观测平均值>70%~90%[22-23]。此外,董甜姿[24]研究表明,在酸性条件下,SAs更容易水解,QNs则在中性条件下相比于SAs更利于发生水解。在整个实验过程中,装置内的水体 pH 均处在中性偏碱的状态,因此 ,pH 也可能是造成NFX去除效果更好的原因之一。
NFX是QNs中的一种,其具有喹诺酮类的双六环结构并在此基础上引入氟原子,光解和吸附的发生相对频繁而不易发生水解[25-26]。因此,不同填料类型的人工湿地对NFX的去除差异主要来源于填料的组成成分以及孔径大小。本研究所选用火山岩和生物陶粒具有多孔道含水架的内部结构,其吸附能力和离子交换能力较强[27],生物陶粒的粒径相比于火山岩和沸石较小,拥有较大的吸附面积。因此,3种填料对NFX的吸附性表现为生物陶粒>火山岩>沸石,且均表现出较高的去除率(大于90%)。CHEN等[28]研究表明,相比于被吸附,SAs更易被生物降解。而人工湿地比表面积大的填料会更加有利于生物膜的形成[29]。此外,孔隙率高的填料与抗生素接触时间更长,也有利于抗生素的去除[30]。本研究中虽然沸石的比表面积最大,但生物陶粒拥有更高的孔隙率,所以对抗生素的去除效果较好。LIU等[8]研究表明,沸石和生物陶粒相比于火山岩在处理高氨氮水体后,单位质量的基质上均含有较高的微生物量。此外,生物陶粒组提供了较高的DO环境,有利于基质附着微生物对抗生素的降解。
本研究结果表明,营养负荷的升高对3种基质填料去除SDZ的效果无显著影响,但在中浓度组,NFX的去除率较好。有研究[31-36]表明,CWs中TP、TN、NH3-N以及营养物质浓度的升高会提高抗生素的去除能力。LIU等[37]称抗生素的去除率与COD、总悬浮物(TSS)、TN、TP和NH3-N浓度呈倒U形关系,转折点分别为300、57.4、4.0、3.2和48 mg·L−1。本研究中,高营养浓度组的TN、TP浓度为20 mg·L−1和5 mg·L−1,超过了上述转折点,导致高氮磷浓度组的抗生素去除率要低于中氮磷浓度组。这一结果表明,在低浓度COD、TN、TP和NH3-N的条件下,抗生素的降解随基质中氮磷浓度的增加而增强。在高浓度时,抗生素的降解受到抑制。这可能归于以下2点原因。首先,CWs中微生物的栖息地和营养结构达到理想状态,在转折点可以达到最大的抗生素去除率。MUELLER 等[38]发现氮的缺乏可能会抑制磺胺甲恶唑的生物降解,抗生素的去除效率与硝化性能有关,当硝化速率最低时,生物降解效率最低。其次,高碳和高氮浓度会破坏系统的稳定性(微生物、植物和底物之间的网络)。HUANG等发现[39],由于TCS(四环素类抗生素)对氨氧化细菌和反硝化细菌的生长和活性的抑制,TN和NH3-N的去除效率与TCS的总浓度呈负相关。因此,氮、磷和抗生素的同步去除可能主要受功能细菌活性的影响。作为抗菌药物,抗生素可能会影响与重要反应过程(硝化、反硝化或氨氧化)相关的功能细菌,较高的抗生素浓度和较低的氮磷浓度会减弱功能细菌的活性。此外,本研究各基质的溶解氧含量随着氮磷浓度的升高呈现下降的趋势,低氮磷浓度组的溶解氧含量最高,较高的溶解氧有利于提高抗生素的去除效率[40]。因此,高氮磷浓度组中较低的溶解氧也可能是造成抗生素去除率较低的原因。
WU等[41]研究表明,湿地中抗生素的去除主要和基质的脱氮途径相关,脱氮主要靠微生物氨化-硝化-反硝化作用实现。本研究中的各氮磷浓度组出水口TN的质量浓度为1~4 mg·L−1,NH3-N、NO3-N的出水浓度均在0.4 mg·L−1以下,但NO2-N的含量较高。基质附着微生物在氧气充足时会将氨及游离氮离子(NH4+)氧化生成亚硝酸盐(NO2−)及NO3−,在缺氧时将NO3−还原成NO2−甚至还原成N2[42]。本实验中出水口DO含量较高,脱氮主要是通过微生物的硝化作用来实现的。随着污染负荷的升高和抗生素的加入,出水口NH3-N和NO3-N的含量较低,NO2-N的含量较高,说明基质内硝化作用不彻底。赵亚奇等[43]也发现,硝化过程容易受到抗生素的影响,尤其是亚硝化细菌,这种细菌一旦受到抑制,便会导致NO2−的积累。因此,抗生素的加入会导致水体中NO2−含量过高。王兵等[44]研究表明,黄菖蒲对氮的累积量随NO3-N质量浓度增加而增加,且对NO3-N有很好的去除效果。这也可能是导致本研究基质内NO3-N含量较低的原因。
-
1)本研究所选湿地的基质填料对抗生素的去除能力依次表现为生物陶粒>火山岩>沸石,3种填料对诺氟沙星NFX的去除率(>90%)明显优于对磺胺嘧啶SDZ的去除率(>60%)。较高的污染负荷会影响湿地对抗生素的去除效率。
2)在3种类型的湿地填料中,生物陶粒对协同去除水体中的磷和复合抗生素表现出很大的潜力,火山岩可以高效去除水体中的氮素。
3)随着污染负荷的升高,3种基质填料对于COD、TP和TN的去除率也有所升高。
| 样品 | 工业分析/% | 元素分析/% | 热值/(kcal·kg−1) | |||||||
| 挥发分 | 灰分 | 固定碳 | C | H | O | N | S | |||
| GW | 75.72 | 3.35 | 20.93 | 48.97 | 6.57 | 40.25 | 0.52 | 0.33 | 4 499 | |
| BR | 50.52 | 45.45 | 4.02 | 22.28 | 3.75 | 25.11 | 2.67 | 0.75 | 1 829 | |




 DownLoad:
DownLoad: