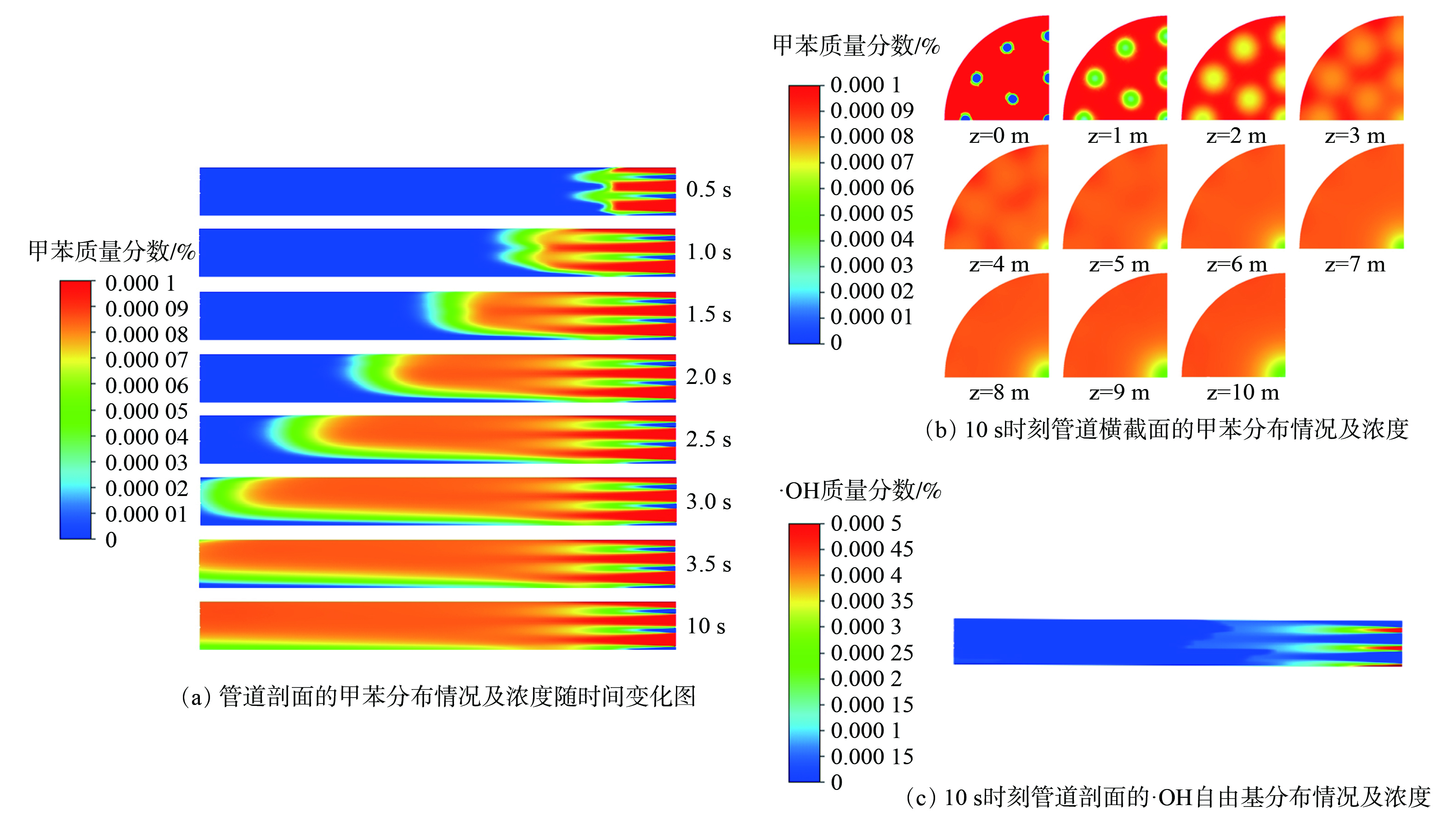
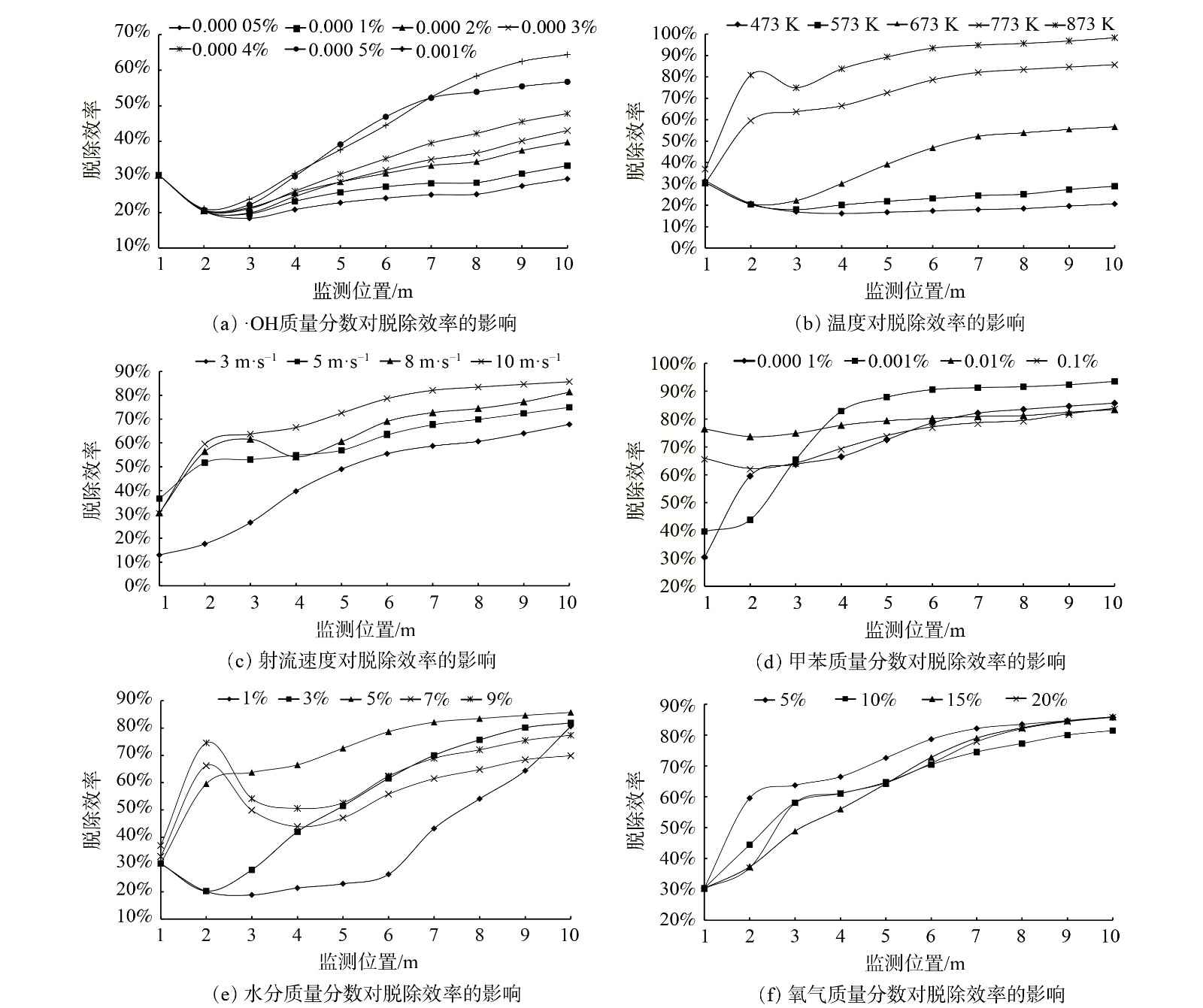
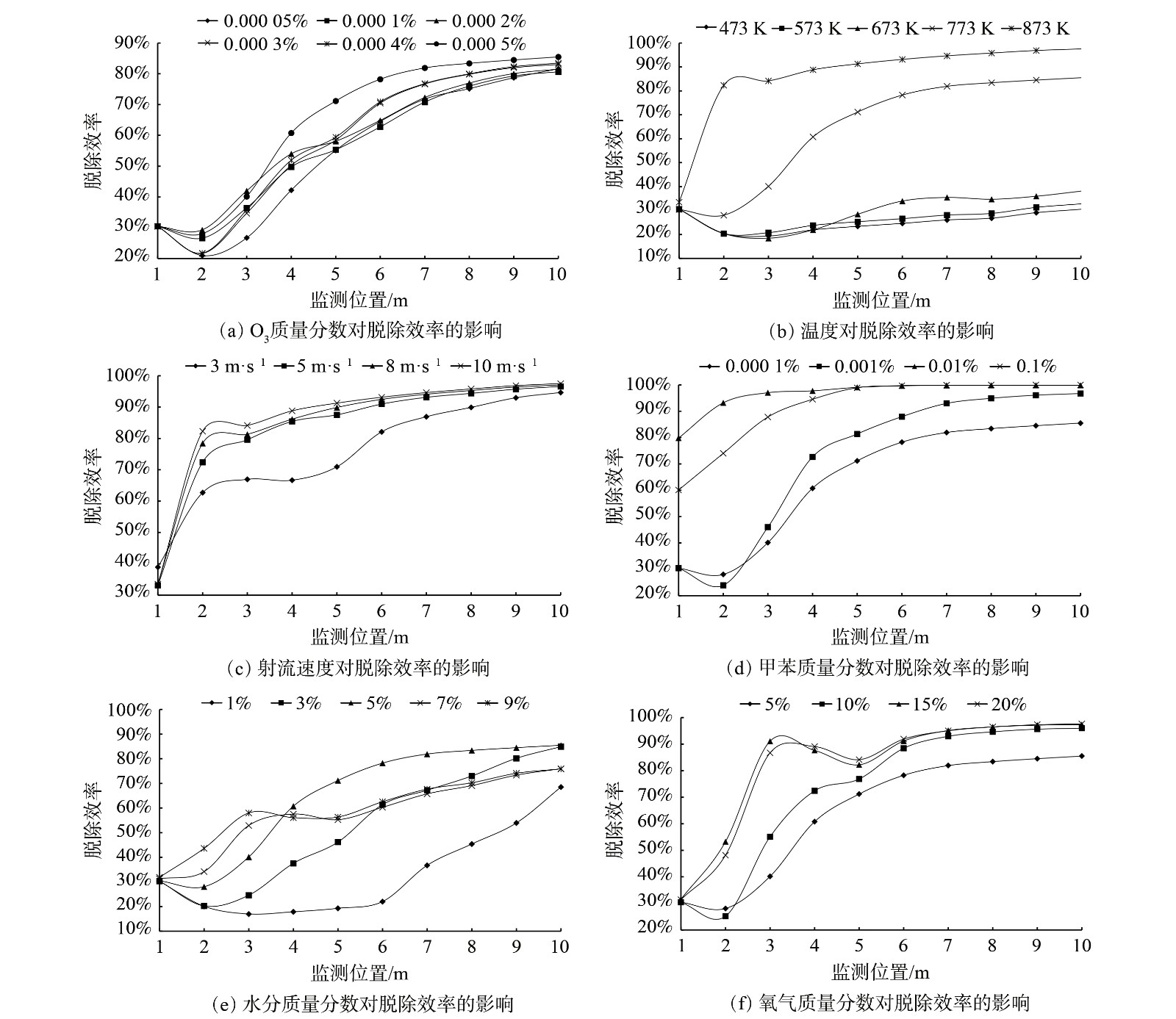
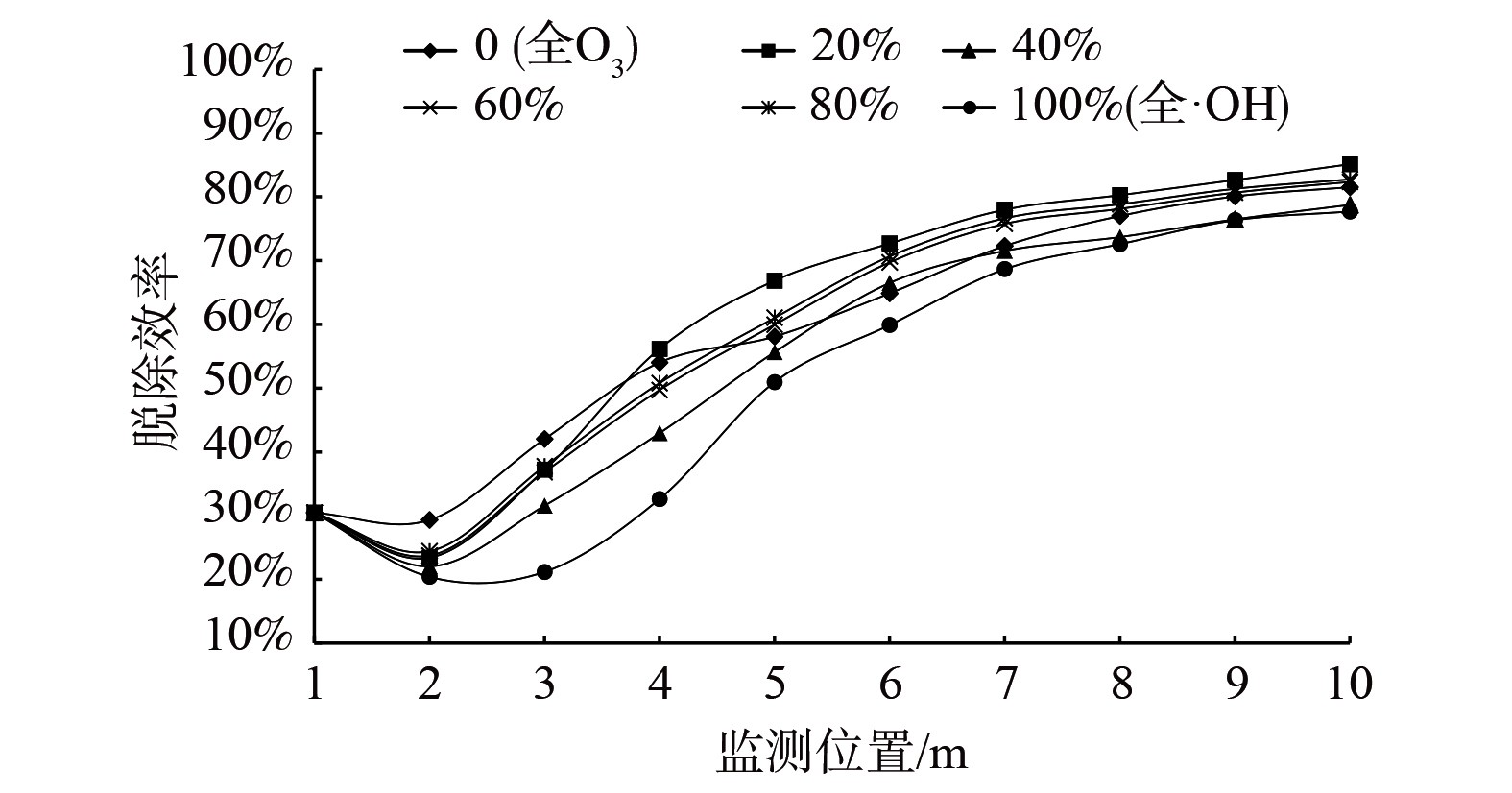
-
氮氧化物(NOx)会导致光化学烟雾、酸雨、地面臭氧和细颗粒物等多种环境问题[1-2]。NOx的排放主要来自于固定源和移动源。在移动源排放中,柴油车对NOx排放贡献较大。传统NH3选择性催化还原(NH3-SCR)技术已被广泛用于NOx的去除,但其存在氨腐蚀、硫酸氢铵形成等诸多问题[3]。而柴油车尾气中除NOx外还含有大量碳氢化合物。与使用高成本NH3或尿素的NH3-SCR工艺相比,碳氢化合物选择性催化还原NOx(HC-SCR)工艺无需添加任何外源性还原剂,并且可同时去除尾气中的NOx和未燃烧的碳氢化合物[4-5]。因此,从经济、节能和安全的角度来看,HC-SCR是一种具有应用潜力的柴油车尾气控制技术[6-7]。
相较于CH4[8]、C3H8[9]和C2H6O[10],C3H6作为SCR还原剂的活性更高[11-13]。单一/复合金属氧化物及沸石基催化剂已受到广泛关注,如Sn[14-15]、In[16-17]、Co[18-19]、Cu[20-21]、Fe[22-23]等。过渡金属氧化物负载型催化剂具有较强的研究价值。然而,用于柴油车尾气的HC-SCR技术还存在诸多挑战,其中低温活性有待提高是其中之一。Cu基催化剂具有成本低和效率高的特点,其在SCR反应中具有明显低温优势[24-25]。Cu负载到Al2O3、Ti0.5Zr0.5O2-δ等载体表面后,在≤300 ℃条件下能实现NO向N2的转化[26-27]。Cu基催化剂的低温催化性能主要取决于催化剂表面Cu的价态和分散状态[28],而相比于低价Cu+和Cu0物质,Cu2+被证明是SCR的活性位点[29-31]。SHIMIZU等[32]发现Cu-铝酸盐催化剂表现出比Cu-ZSM-5更优的脱硝活性和水热稳定性,这是由于其中高度分散的Cu2+离子起到了作用。因此,通过调控催化剂表面Cu物质的分布以提高活性Cu含量是提升Cu基催化剂低温SCR性能的关键。助剂掺杂是一种催化剂改性的常用手段[33-34],In作为一种d10系主族金属元素,被广泛用作催化剂助剂,可调控活性位点的反应性能。KHARAT等[35]发现In的添加对三元CuO-ZnO-Al2O3催化剂结构和催化性能产生了影响,增加催化剂比表面积并减小CuOx晶粒尺寸可使催化剂在250 °C的活性得到显著提升。In3+离子具有较大离子半径,掺杂后可能导致Co3O4晶格结构变形,并形成氧空位,进而促进催化氧化反应进行[36];此外,掺杂In能改变载体[37]或负载物质的结构[38],使得其催化性能得以提升。尽管Cu基催化剂表现出一定的C3H6-SCR活性,但其低温NOx转化率还有待提升。而In2O3较弱的氧化性能可抑制碳氢化合物的过度燃烧,使更多碳氢化合物可用作还原剂,进而使得In/Al催化剂在高温区间表现出较高的NOx去除效率[39]。
基于此,本研究以γ-Al2O3为载体,采用浸渍法制备CuO-In2O3/γ-Al2O3催化剂用于C3H6-SCR反应,拟通过添加In来改善催化剂表面Cu物质的分布,以期提高Cu基催化剂的低温活性,再进一步通过X射线光电子谱(XPS)、氢气程序升温还原(H2-TPR)等表征方法,探明助剂In对Cu离子价态和反应中间产物的影响,以揭示C3H6-SCR的反应机理。本研究可为应用于柴油车尾气控制技术的低温SCR催化剂开发提供参考。
-
以γ-Al2O3为载体,通过浸渍法分别制备CuO-In2O3/γ-Al2O3、CuO/γ-Al2O3和In2O3/γ-Al2O3催化剂(记为Cu-In/Al、Cu/Al和In/Al)。采用硝酸铜(0.228 g,Cu(NO3)2·3H2O,西亚化学工业有限公司)和硝酸铟(0.081 g,In(NO3)3·4H2O,麦克林生化科技有限公司)水溶液浸渍γ-Al2O3粉末(2.88 g),制备CuO-In2O3/γ-Al2O3催化剂。将混合后的溶液在室温下搅拌2 h,然后慢慢加热至80 °C,搅拌至糊状。最后,在110 °C下,将样品干燥12 h,并在600 ℃温度下煅烧5 h(升温速率为1 ℃·min−1)。其他催化剂的制备方法也类似。本研究所用的Cu-In/Al催化剂已在前期经过比例优化,按Cu、In最佳配比计算得到其负载量分别为:CuO负载量 (质量分数) 为2.5%;In2O3负载量 (质量分数) 为1.25%。
-
1) XRD。在Cu Kα辐射(λ=1.5418 Å)、2θ为10°~90°、扫描速率为8°·min−1的条件下,使用X射线衍射仪(Bruker, D8 ADVANCE X)测试样品的X射线衍射谱图(XRD),以确定催化剂组成。2) BET。在77 K下,采用物理吸附仪(Micromeritics, ASAP2020-M)进行N2吸附-解吸分析,以测定催化剂的比表面积(BET)。3) ICP。采用电感耦合等离子体发射光谱仪(Agilent ICP-OES 725-ES)对制备的催化剂进行元素含量分析。4) H2-TPR。为测试催化剂氧化还原性能,利用化学吸附分析仪(Micromeritics, ChemiSorb 2720 TPx)进行氢气程序升温还原(H2-TPR)实验。样品在Ar中400 ℃预处理1 h,然后冷却至30 ℃并切换至10%H2/Ar的反应气氛,流量为30 mL·min−1,以10 ℃·min−1的升温速率从30 °C升至800 ℃。5) XPS。通过光谱仪(Thermo Escalab 250-XI)进行X射线光电子能谱(XPS),分析催化剂表面元素价态,以Al Kα X射线为单色光源,并根据C1s峰(284.8 eV)校正各个元素的结合能。6) NO+O2-TPD。采用气体分析仪(Thermo Scientific Antaris IGS)进行NO+O2程序升温脱附(NO+O2-TPD)实验,以测定催化剂对NOx的吸附性能。先将100 mg样品在180 mL·min−1的N2中400 ℃预处理1 h,然后冷却至室温,通入混合气体 (NO 500×10−6+O2 5%) 吸附1 h;用N2吹扫后,程序升温至600 ℃进行脱附实验。7) in situ DRIFTS。在红外光谱仪(Nicolet iS50)上进行程序升温C3H6氧化反应和瞬态原位漫反射红外光谱(in situ DRIFTS)实验,以探明催化剂表面的反应机制。样品在500 ℃条件下充以N2预处理1 h,然后冷却至所需温度。在每个温度下采集背景光谱,并在相同温度下采集样品光谱。
-
C3H6-SCR的活性通过固定石英床连续反应器(内部直径6 mm)来测试。测试中使用150 mg催化剂,其粒径为40~60目,并以N2为平衡气。通入的气体组分及其体积分数为:C3H6 1 000×10−6、NO 500×10−6、O2 2%。通入气体的总流速为200 mL·min−1,气体空速为38 000 h−1。C3H6、NO、NO2、N2O等气体进出口浓度通过气体分析仪(Thermo Scientific, Antaris IGS)检测。NOx、C3H6的转化效率和N2选择性计算参考式 (1)~(3) 进行。
式中:
ηNOx ηC3H6 ψN2 -
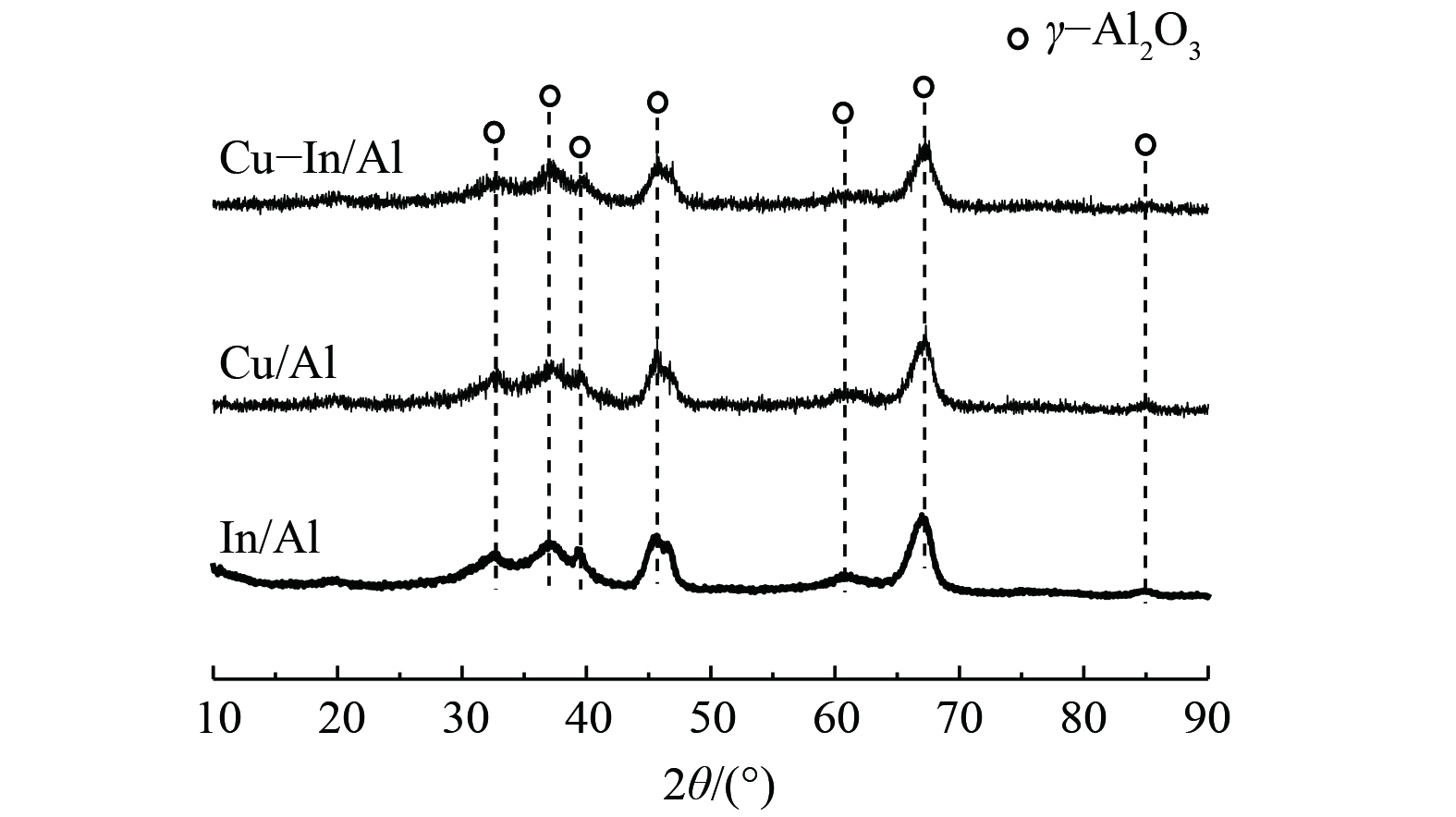
图1为Cu-In/Al、Cu/Al和In/Al催化剂的XRD测试结果。3种催化剂均显示出载体γ-Al2O3的衍射峰(PDF#79-1558),但未观察到CuO或In2O3的晶相。这表明Cu、In类物质的结晶度低或呈现无定形状态,并且高度分散在γ-Al2O3载体上。3种催化剂的BET测试结果较为相似,其比表面积分别为:In/Al 154 m2·g−1、Cu-In/Al 146 m2·g−1和Cu/Al 145 m2·g−1。与纯载体γ-Al2O3(比表面积为160 m2·g−1)相比,低结晶度或无定形的CuOx和InOx负载到γ-Al2O3表面后,并未显著改变载体的孔结构,对催化剂的比表面积影响亦较小,但Cu、In在表面的高度分散也将为催化反应提供更多反应位点。
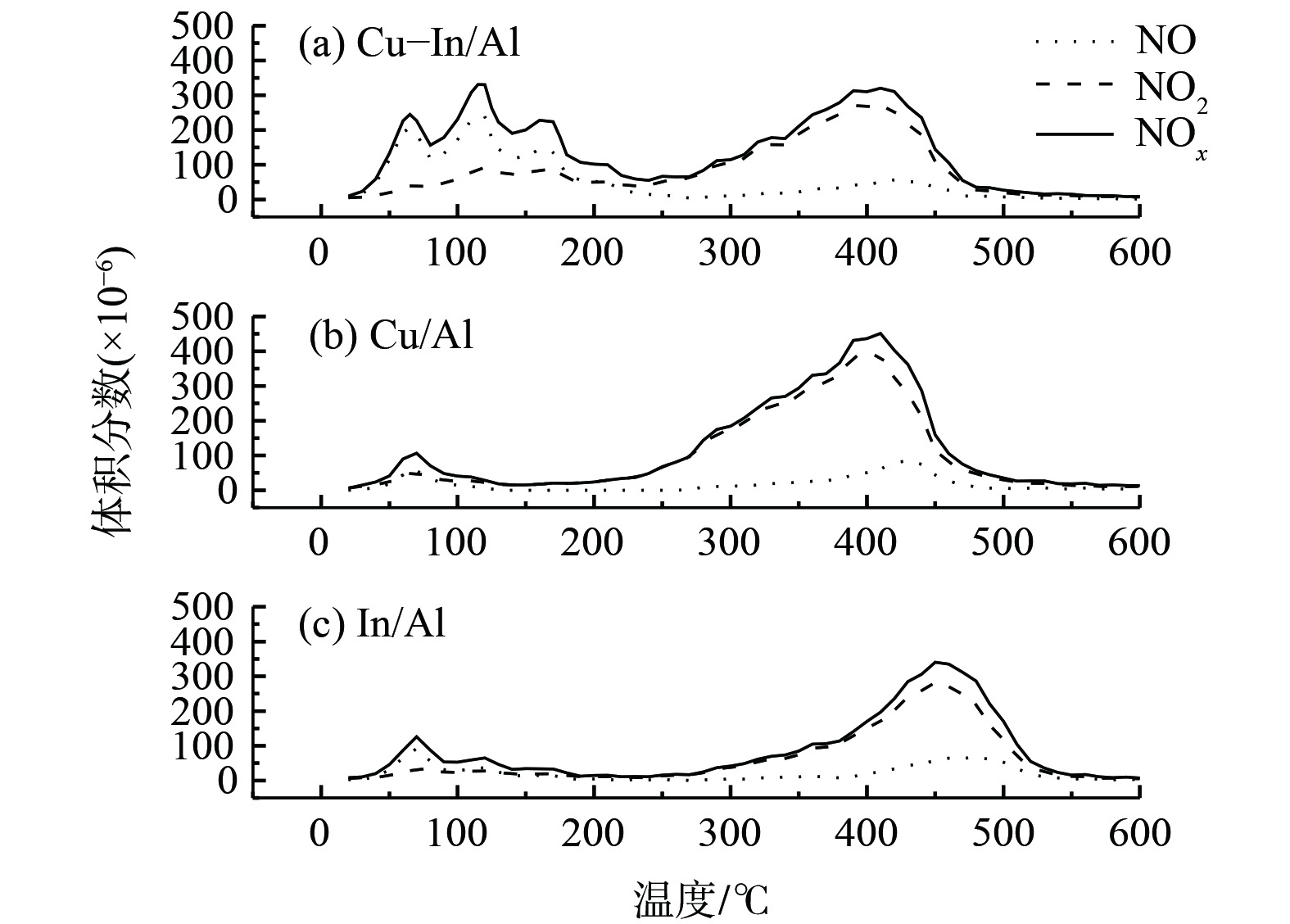
催化剂对NOx的吸附性能是SCR的重要参数。利用NO+O2-TPD考察了Cu-In/Al、Cu/Al和In/Al催化剂表面NOx的吸附性能,以探讨NOx在催化剂表面的吸附强度,结果如图2所示。在低于200 ℃条件下,吸附的物质多为NO,主要来自于弱结合的亚硝酸盐(ad-NO2−)分解;而在高于300 ℃条件下,吸附的物质多为NO2,主要来自于硝酸盐(ad-NO3−)的分解[39-40]。值得注意的是,在掺杂In后,Cu-In/Al催化剂上NO脱附峰强度明显增加,这说明In的掺杂有助于催化剂表面形成更多的亚硝酸盐。NOx总吸附量(表1)表明,Cu-In/Al催化剂表现出了最大NOx吸附量。同时,相比于In/Al,Cu/Al和Cu-In/Al表面硝酸盐的脱附温度较低。这可能是由于Cu位点上的硝酸盐结合能力不强,更容易分解,并易与C3H6活化后的中间产物反应,进而提升了SCR反应活性。
-
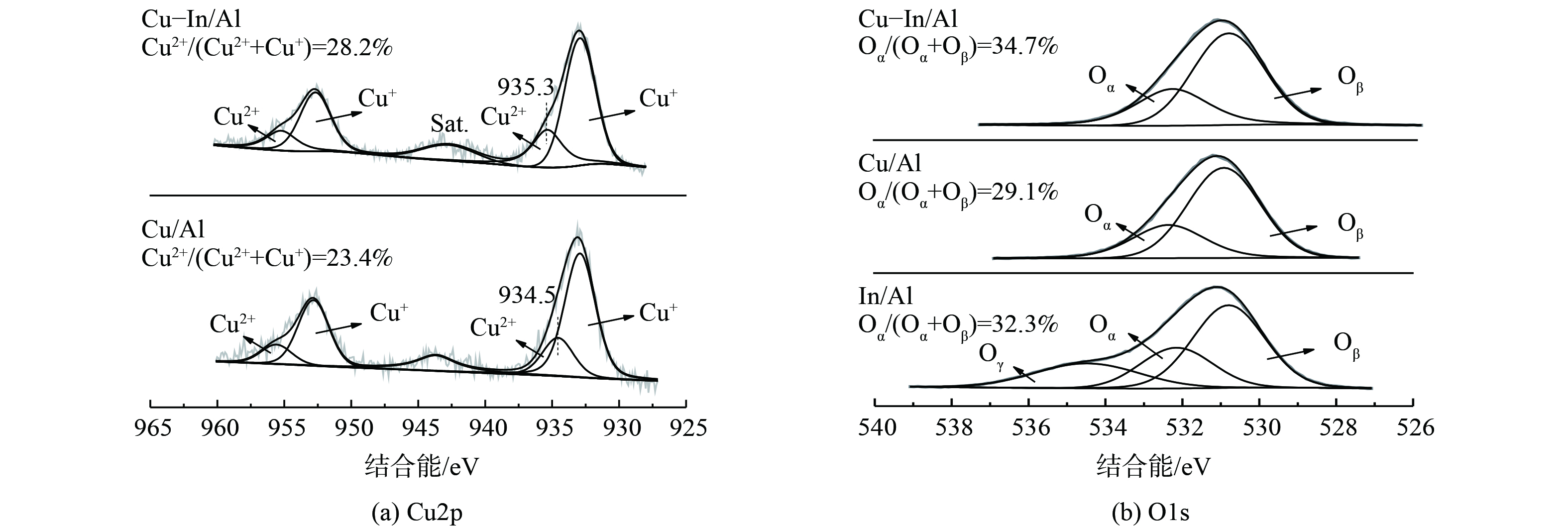
为进一步探讨In对催化剂表面组成和氧化状态的影响,Cu/Al、In/Al和Cu-In/Al催化剂的XPS结果如图3所示。Cu-In/Al和Cu/Al催化剂的Cu 2p光谱由2p1/2、2p3/2和卫星峰(943-945 eV)组成。分峰结果表明,催化剂表面同时存在Cu2+和Cu+类物质[27,41-42]。添加In后,Cu-In/Al催化剂表面上Cu2+增多。推测Cu2+可能是丙烯分子的主要吸附位点[43],表面更多的Cu2+有利于C—H键断裂,从而促进了C3H6活化氧化反应,最终使得C3H6-SCR的性能提升。此外,相比于Cu/Al催化剂,Cu-In/Al催化剂表面Cu2+的峰向更高结合能偏移 (由934.5 eV转移至935.3 eV) 。这表明催化剂上存在电子转移,导致Cu位点的电荷密度较低、存在高价态Cu。这可能是由于Cu2+与In有较强的相互作用,从而有利于气态反应物的活化氧化。催化剂的O1s谱图如图3(b)所示。经分峰后,2个主要O1s峰分别归属于催化剂的表面化学吸附氧(记为Oα)和晶格氧(记为Oβ)[44]。定量计算结果表明,Cu-In/Al催化剂的Oα/(Oα+Oβ)比例明显高于Cu/Al。这说明掺杂In会提高Cu-In/Al催化剂上的化学吸附氧物质的含量。
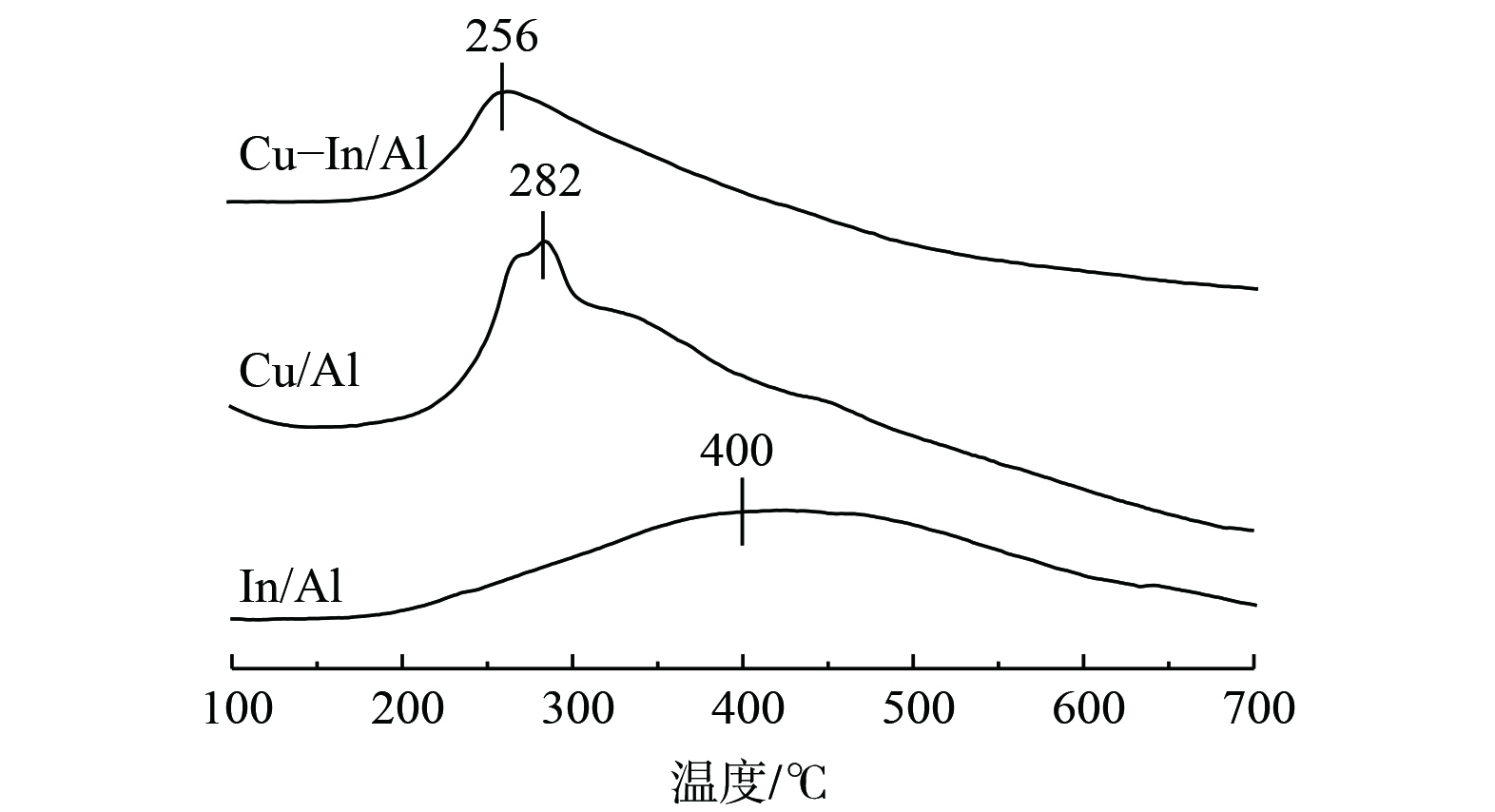
采用H2-TPR进一步研究催化剂的氧化还原性能,结果如图4所示。Cu-In/Al、Cu/Al和In/Al均显示出单一的H2还原峰,分别位于256、282和400 ℃温度下。Cu-In/Al和Cu/Al催化剂的峰主要归属于高度分散的Cu2+直接还原的金属Cu0[26,45],In/Al催化剂的宽峰主要归属于高度分散的In3+直接还原的金属In0[16,46]。相比Cu/Al和In/Al催化剂,Cu-In/Al催化剂的还原峰温度更低。这表明在CuIn位点的相互作用下,Cu2+表现出更强的氧化性。这与XPS中Cu-In/Al表面存在更高价态Cu类物质的结果相一致。在C3H6-SCR反应过程中,较强的氧化还原性能是催化剂展现出优异低温活性的原因之一。
-
Cu-In/Al、Cu/Al和In/Al催化剂在200~600 ℃条件下的C3H6-SCR活性如图5所示。In/Al催化剂在超过450 ℃的高温下的NOx去除效率较高,而Cu/Al催化剂在250 ℃开始起活,并表现出低温SCR活性。在In掺杂后,Cu-In/Al催化剂不但保持Cu/Al催化剂的低温活性优势,且NOx转化率显著提高,在350 ℃达到62%的NOx转化率。常见一元或二元非贵金属氧化物催化剂仅有高温SCR活性,在C3H6-SCR低温范围内 (< 400 ℃) 活性较低。In2O3/Al2O3[39,46]、CuO/Al2O3[47]、Co3O4/Al2O3[17]、Ga2O3-Al2O3[48]在350 ℃时的NOx转化率仅为约30%,且催化剂的起活温度较高。而掺杂In后的In2O3-Co3O4/Al2O3[17]、In2O3-SnO2/Al2O3[49]、In2O3-Ga2O3-Al2O3[48]催化剂在350 ℃的NOx转化率依然不高。相比之下,Cu-In/Al催化剂具有更好的低温活性潜力,在350 ℃的活性表现值得进一步研究,这可能与Cu和In之间的相互作用有关。
值得注意的是,图5 (b) 表明Cu-In/Al和Cu/Al催化剂上C3H6转化性能显著优于In/Al催化剂,而Cu/Al在掺杂In的基础上C3H6转化率又略有提高。在350 ℃时,催化剂的C3H6转化率按由大到小排列,依次为Cu-In/Al(93%)>Cu/Al(62%)>In/Al(6%)。此外,在图5(c)和(d)中,Cu-In/Al和Cu/Al催化剂表现出相似的N2选择性及产物分布。这表明C3H6还原NO后的产物主要是N2和CO2。因此,催化剂表面的CuOx可能是C3H6活化和NOx还原的活性位点,而In在其中是作为助剂促进了C3H6的活化转化,并提高了催化剂的NOx转化效率。
-
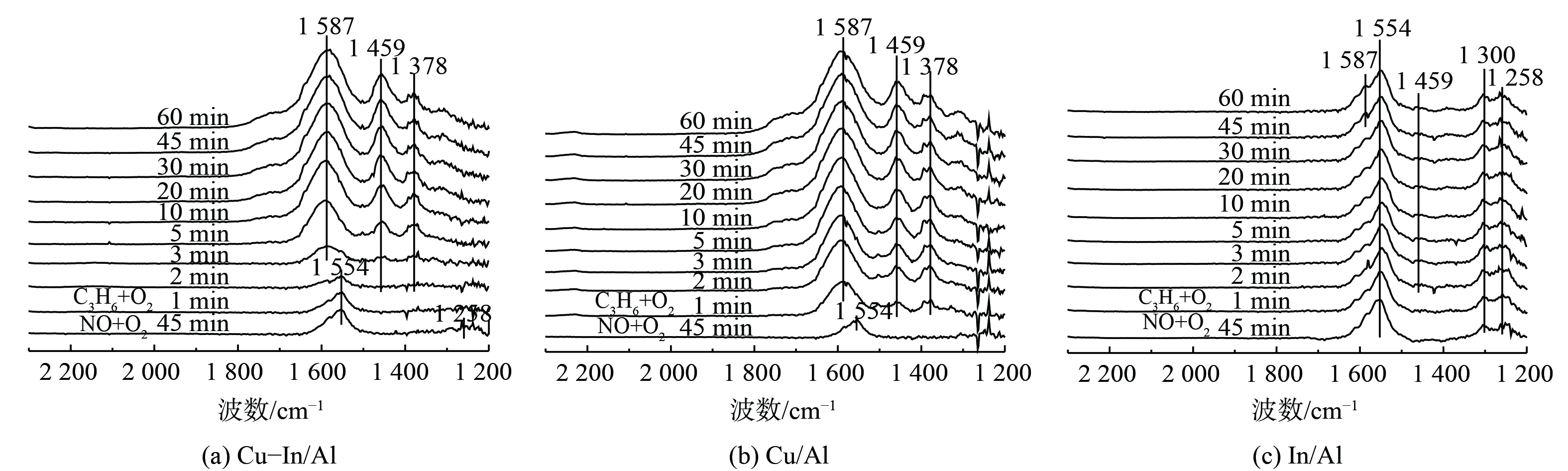
为阐明反应中间体和C3H6-SCR机理,采用原位DRIFTS方法测定不同反应中间产物的形成和转化情况。图6表明,在350 ℃条件下, (NO+O2) 在催化剂表面预吸附后,主要以单齿硝酸盐(峰值为1 258 cm−1)和双齿硝酸盐(峰值为1 300和1 554 cm−1)的形式存在[50]。反应气体切换为 (C3H6+O2) 后,Cu-In/Al和Cu/Al催化剂表面的硝酸盐快速消失,并出现乙酸盐υas(COO)、υs(COO)的振动峰[47,51](1 587和1 459 cm−1)和甲酸盐δ(—CH3)的振动峰(1 378 cm−1)[52-53]。这说明吸附态硝酸盐能与气态C3H6或表面活化CxHyOz快速反应。当硝酸盐被完全消耗后,C3H6吸附活化后形成的甲酸盐和乙酸盐在催化剂表面逐渐积累。但在In/Al催化剂上,随着气态C3H6的持续通入,吸附态硝酸盐仍稳定存在,几乎未被消耗减少,且未观察到深度氧化生成的甲酸盐,仅有少量乙酸盐吸附在表面。
在Cu-In/Al、Cu/Al和In/Al催化剂表面先进行C3H6的预吸附活化,然后再通入混合气体 (NO+O2) ,其原位红外结果如图7所示。在Cu-In/Al和Cu/Al催化剂表面,C3H6吸附活化后形成大量乙酸盐(1 587、1 580和1 459 cm−1)和甲酸盐(1 378 cm−1)。这说明C3H6在催化剂表面吸附,能被快速氧化活化生成CxHyOz类物质。另外,在Cu/Al催化剂上观察到明显的2 235 cm−1强峰。这个峰归属于L酸吸附的CO分子伸缩振动[54-55],表明了单独的CuOx位点会导致CxHyOz进一步氧化形成吸附的CO。这可能与其较低的NOx转化率相关。而在Cu-In/Al催化剂上2 235 cm−1处的峰较弱,可忽略,则表明掺杂In后,催化剂可抑制C3H6的过度氧化,更有利于C3H6活化形成乙酸盐或甲酸盐中间产物参与SCR反应。随着反应进一步进行,Cu基催化剂表面乙酸盐和甲酸盐逐渐被消耗,桥式硝酸盐(峰值为1 600 cm−1)和双齿硝酸盐(峰值为1 300和1 553 cm−1)出现并逐渐积累。这说明C3H6吸附活化后能与气态NO或吸附态硝酸盐反应。而对于In/Al催化剂 (图7(c)),C3H6在催化剂表面催化活化后,难以与气态NO反应,即使催化剂表面开始有硝酸盐形成,吸附态CxHyOz仍未减少。这表明2种吸附物质之间没有相互反应。这也是导致In/Al催化剂在350 ℃低温条件下C3H6-SCR性能差的主要原因。
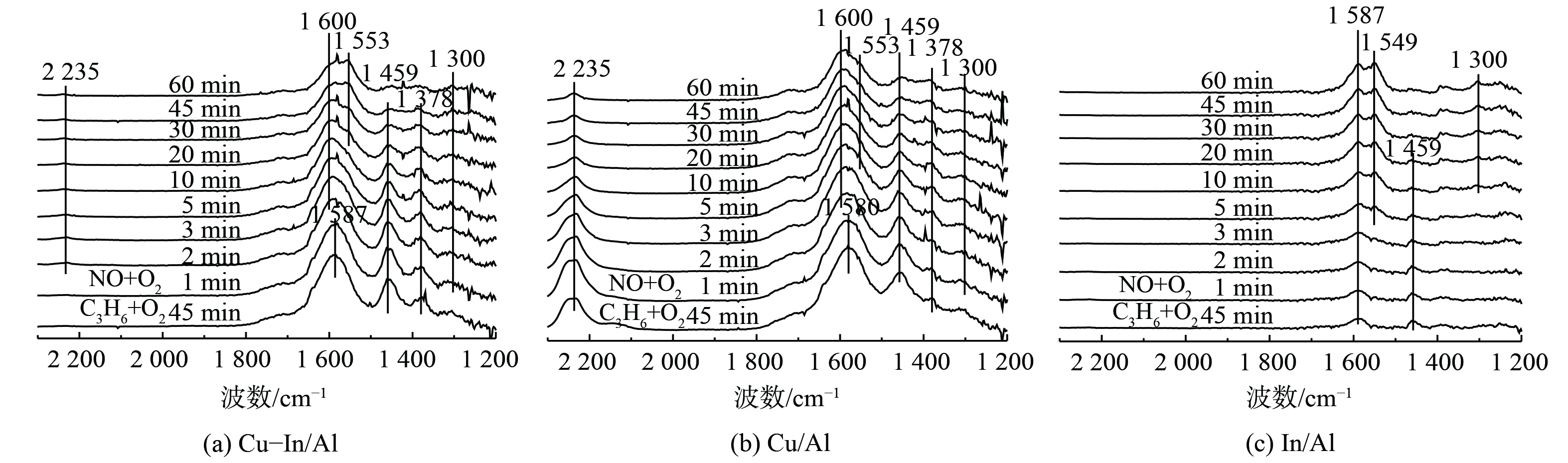
为进一步确认催化剂表面的C3H6-SCR反应路径,同时通入C3H6、NO和O2时的原位红外谱图如图8所示。在Cu-In/Al、Cu/Al和In/Al表面观察到桥式硝酸盐(峰值为1 600 cm−1)、双齿硝酸盐(峰值为1 300、1 550、1 555和1 568 cm−1)、硝基化合物(峰值为1 392 cm−1)、乙酸盐(峰值为1 587和1 459 cm−1)和甲酸盐(峰值为1 378 cm−1)等物质快速形成。结合图6和图7瞬态反应结果,C3H6和NO在催化剂表面会先形成吸附态中间产物,然后才能参与SCR反应,符合Langmuir-Hinshelwood (L-H)反应机制。在Cu-In/Al和Cu/Al催化剂上,吸附态硝酸盐仅存在于低温条件下,而In/Al催化剂上吸附态硝酸盐结合更强,这与NO-TPD结果一致。在350 ℃时,Cu-In/Al和Cu/Al表面上硝酸盐更活跃,更易于与吸附态CxHyOz反应,进而促进了SCR的低温活性。
-
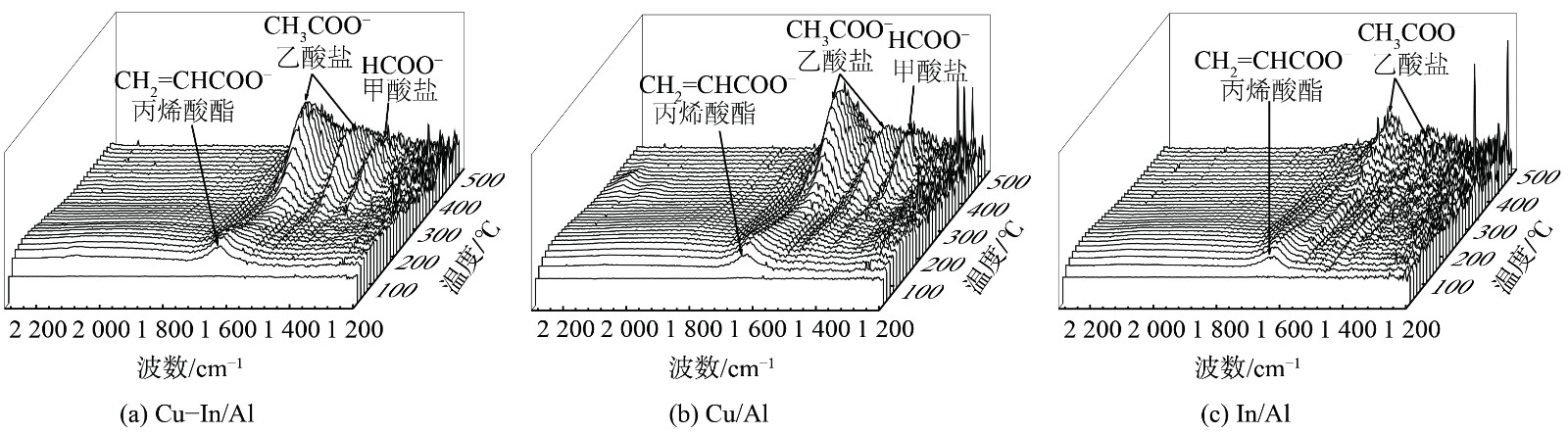
NO+O2-TPD结果表明掺杂In提高了Cu-In/Al催化剂对亚硝酸盐的吸附量,但原位红外光谱中并未观察到明显的亚硝酸盐特征峰。这主要是由于在350 ℃时,亚硝酸盐已被氧化为硝酸盐。C3H6-SCR反应机理和原位实验结果表明,CuOx是Cu/Al和Cu-In/Al主要的活性位点,而L-H反应路径需要C3H6和NO同时在催化剂表面吸附活化。在350 ℃时,掺杂In对CuOx位点的NOx吸附及反应影响不大,NOx吸附性能的提高可能并不是In促进催化剂低温活性提升的主要原因。而In可能主要影响催化剂表面C3H6活化转化为中间产物甲/乙酸盐的过程。为了证明这一假设并深入探究In对C3H6-SCR过程的促进作用,采用了程序升温C3H6氧化与原位红外相结合的方法开展进一步研究。图9为混合气体 (1 000×10−6C3H6+2%O2+N2) 条件下,Cu-In/Al、Cu/Al和In/Al表面的程序升温原位红外光谱。在3种催化剂表面,C3H6在低温条件下能迅速活化氧化形成丙烯酸酯(峰值为1 643 cm−1)。随着温度的升高,丙烯酸酯开始减少,出现了更稳定的乙酸盐(峰值为1 459和1 587 cm−1)和甲酸盐(峰值为1 378 cm−1),并在400 ℃下仍稳定存在。相比于In/Al催化剂,Cu基催化剂能大量形成具有更高氧化态碳的甲酸盐,这与瞬态原位红外结果一致。在Cu-In/Al催化剂上,乙酸盐和甲酸盐的出现温度更低(图10)。这表明掺杂In后,Cu-In/Al催化剂更容易将气态C3H6氧化转化为乙酸盐和甲酸盐,从而有利于其作为吸附态中间产物参与C3H6-SCR反应。这与Cu-In/Al催化剂氧化还原性能较强有关。
综上所述,In掺杂改变了Cu-In/Al催化剂表面Cu2+的分布,提高了催化剂表面高度分散的Cu2+比例,进而导致催化剂的氧化还原性能增强,并通过C3H6实现更快速地活化氧化,在低温下即实现C3H6-SCR快速反应。通过揭示甲/乙酸盐的快速形成对C3H6-SCR低温活性提升的促进机制,强调了C3H6快速吸附活化是促进C3H6-SCR低温活性的关键步骤,可为新型低温催化剂的设计和开发提供参考。
-
1)同时负载Cu、In的催化剂表现出较好的C3H6-SCR活性,并在350 ℃达到最佳NOx和C3H6转化率。这主要是由于添加In使得Cu/Al催化剂的Cu2+和表面活性氧比例提高,从而增强其氧化还原性能和NOx吸附性能。
2)在Cu-In/Al催化剂上,C3H6能被快速活化形成乙酸盐和甲酸盐,且积累形成大量硝酸盐。两类吸附态中间产物的快速反应可能是C3H6-SCR反应活性提高的原因。
3) In掺杂可调控C3H6活化速率。Cu-In/Al催化剂的低温活性潜能与C3H6快速活化有关。C3H6活化机制是调控C3H6-SCR低温活性的一种有效方法。





 下载:
下载: