-
氮氧化物(NOx)和挥发性有机化合物(volatile organic compounds,VOCs)等污染物是造成灰霾和近地面臭氧等大气污染问题的重要前体物。活性较强的VOCs在一定条件下与NOx发生光化学反应,造成O3体积增加,形成光化学烟雾,从而在更大范围内产生污染,对空气质量和人群健康造成威胁[1-2]。因此,开发高效、环保的催化剂以协同控制NO和甲苯的技术受到广泛重视。
目前,NOx控制技术主要有选择性催化还原、NOx储存还原和选择性催化氧化等。其中,NO催化氧化是反应过程中的关键步骤[3],同时催化氧化也是一种高效的甲苯控制技术,可将甲苯氧化成H2O和CO2 [4]。因此,可采用催化氧化法协同控制氮氧化物(NOx)和甲苯。然而,单独催化氧化NOx和甲苯的工艺会导致占地面积大、成本高[5]。因此,开发一种协同催化氧化NO和甲苯的催化剂具有重要意义。
贵金属催化剂是催化氧化技术中常用的催化剂,但其高成本和反应易团聚的缺点严重制约了其大规模应用[6]。钙钛矿催化剂由于成本低、环境友好及优异的催化活性等优点被认为是贵金属催化剂的替代品。CHEN等[7] 发现LaMe(Me=Mn, Fe, Co)钙钛矿催化剂具有良好的催化活性。其中,LaFeO3具有较好的热稳定性和较低的相形成温度,可应用较高温度条件下,但仍存在比表面积低、较少孔结构及B位Fe离子对甲苯和NO的氧化还原性能不够理想等缺点[8]。此外,工业尾气常含有的SO2会导致催化剂产生SO2中毒失活,从而严重抑制了其催化活性[9]。一般来说,钙钛矿催化剂的催化活性主要取决于氧迁移率、过渡金属的氧化还原特性及钙钛矿结构[10]。A或B位被不同价态的阳离子取代时,B位阳离子的氧数量会发生变化,钙钛矿结构中出现缺陷,诱导形成的氧空位可促进表面活性氧离子的迁移,从而提高其氧化还原能力[11]。一些过渡金属离子(如 Ce、Cu、Mn和 Co)具有 经济性和价态可变等优点[12],已被引入钙钛矿催化体系中以提高催化剂活性。如SHI等[10]将Ce部分取代LaMnO3钙钛矿复合氧化物的A位离子以提高催化性能和抗硫性能。WU等[12]发现LaM0.5Mn0.5O3 (M = Cu、Co、Fe、Ni、Cr)钙钛矿催化剂表现出优异的抗硫性能,主要原因是金属元素的引入提高了氧化还原能力和氧缺陷密度。ZHENG等 [13]发现Mn改性的LaFeO3催化剂具有较大表面积,因而表现出良好的活性。此外,ZHAO等[8]发现多孔 LaFeO3 钙钛矿催化剂具有更高比表面积,能提供更多表面活性位点。以上研究表明可通过过渡金属氧化物A位掺杂改性钙钛矿催化剂以提高其活性和抗硫性能。然而,不同过渡金属(X=Cu, Ce, Mn, Co)元素A位掺杂改性的多孔LaFeO3催化剂协同催化氧化甲苯和NO的研究较少,且SO2对其的影响机制尚不明确。
本研究通过溶胶-凝胶法制备一系列不同过渡金属X (X=Cu, Ce, Mn, Co)元素 A位取代的La0.65X0.35FeO3 (X=Cu, Ce, Mn, Co)钙钛矿催化剂,基于BET、SEM、XRD、XPS等表征结果探讨不同过渡金属元素A掺杂对La0.65X0.35FeO3协同催化氧化甲苯和NO的影响,并讨论SO2 对协同催化氧化反应的影响机理,以期为此类催化剂工业应用中的活性保持与再生提供参考。
-
不同过渡金属X (X=Cu, Ce, Mn, Co)元素A位掺杂改性的La0.65X0.35FeO3钙钛矿催化剂采用溶胶凝胶法制备。KIT-6硬模板基于文献[14]合成。首先,将一定量的硝酸镧(La(NO3)3·6H2O,分析纯,科密欧)、硝酸X(Co(NO3)3·6H2O、Ce(NO3)3· 6H2O、Cu(NO3)2· 3H2O、Mn(NO3)2·4H2O,均是分析纯,科密欧)、硝酸铁(Fe(NO3)3·9H2O,分析纯,国药集团)和柠檬酸 (分析纯,湖南汇虹) 按一定的物质的量之比(La:X:柠檬酸=4:4:8)加至20mL乙醇(分析纯,科密欧)水溶液中(V乙醇:V水=3),在室温下搅拌 6 h;再将1.0 g KIT-6加入上述混合溶液中,在 60 ℃搅拌2 h 后,于室温下超声搅拌至凝胶状态;然后将凝胶在 60 ℃ 下干燥 12 h后放入马弗炉中先在350 ℃煅烧2 h,后升温至750 ℃煅烧3 h,升温速率为 10 ℃·min−1;将所得样品用NaOH溶液(分析纯,天津大茂,浓度为2.0 mol·L−1)在75 ℃下处理1 h,并重复操作一次以去除SiO2模板,再用去离子水洗涤数次;最后将样品在 105 ℃ 下干燥过夜,研磨过筛(100~120目)得到催化剂。下标0.65表示La/(X+La)(物质的量之比)之值,0.35表示X/(X + La)(物质的量之比)之值。
-
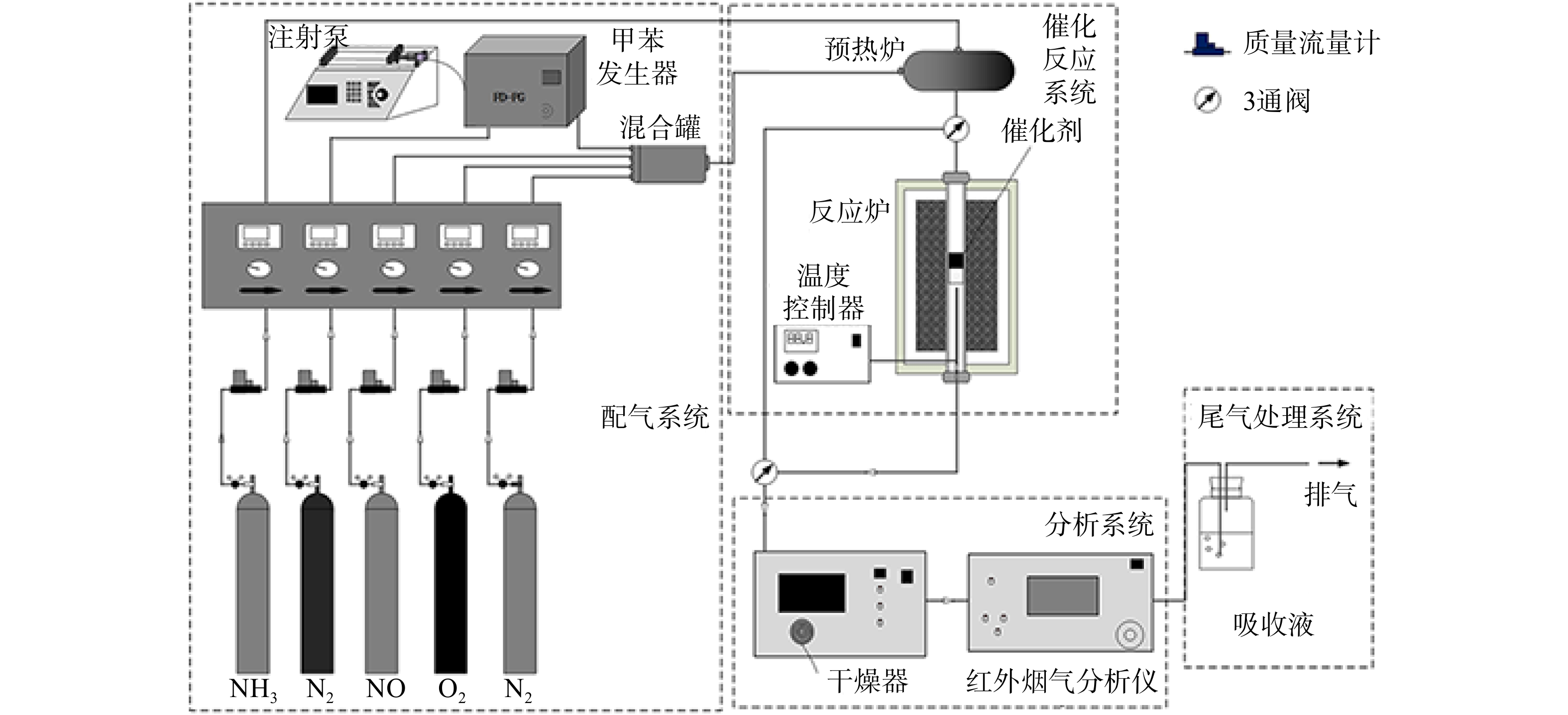
如图1 所示,La0.65X0.35FeO3(X=Cu、Ce、Mn、Co)催化剂协同催化氧化NO和甲苯的活性测试在固定床催化反应装置内进行(内径为 6 mm),测试温度为100~400 ℃。由质量浓度为804 mg·m−3的NO、1 645 mg·m−3的甲苯、0或571 mg·m−3 (使用时)的SO2、体积分数10% 的O2 ,以及平衡气体N2组成反应气体,总流量为300 mL·min−1。催化剂用量为0.2 g,空速(GHSV)为30 000 h−1。甲苯质量浓度由VOCs 发生装置(FD-PG,中国)精确控制。待反应稳定后,通过C600便携式NOx分析仪(Seitron,意大利)来检测进、出口气体中NO的质量浓度,采用Photon马杜红外烟气分析仪(深圳市昂为电子有限公司,奥地利)来检测进、出口气体中甲苯的质量浓度。NO和甲苯氧化效率按式(1)和(2)计算。
式中:
ηNO η 在动力学状态下确定了同时氧化NO 和甲苯的反应速率,通过控制流量使不同温度下NO 和甲苯的转化率低于 20%,使得体系对传热几乎没有影响。 由质量浓度为402 mg·m−3 的NO、822 mg·m−3的甲苯、0或285 mg·m−3 的SO2(使用时)、 体积分数5%的 O2 和N2组成反应气体,总流量为 150 mL·min−1。 反应速率 (rT/rNO, μmol·(g·h)−1), BET 表面积归一化的比反应速率 (r*T/r*NO, μmol·(h·m2)−1),TOF (TOFT/TOFNO, S−1 ),表观活化能 (Ea, kJ·mol−1)根据式(3)~(6)计算。
式中:F是总流量,m3·h−1;mcat是催化剂的质量,g;SBET是Brunauer-Emmett-Teller表面积,m2·g−1;表观活化能Ea是采用阿伦尼乌斯定律(k = A exp(Ea/RT) )的线性拟合斜率计算,kJ·mol−1;R和T分别表示理想气体常数8.314 J·mol−1和反应温度(K);
SCO2 -
采用X射线衍射(XRD)研究催化剂的物相组成和晶体结构。测试条件:在Cu-Kα辐射下,λ=0.154 18 nm,最大工作电压和电流为60 kV,最大工作电流为300 mA。使用Micrometeritics的TriStar II 3020分析仪(BET)对催化剂的比表面积和孔径分布进行表征。测试条件:取0.1 g样品预处理后,N2作为吸附质,在温度为77 K条件下进行测试。采用扫描电子显微镜(SEM)观察催化剂的形貌特征;通过氢气程序升温还原实验(H2-TPR)评价新鲜和反应后催化剂的氧化还原能力。反应后催化剂的反应条件为:在质量浓度为804 mg·m−3 的NO、1 645 mg·m−3的甲苯、571 mg·m−3的SO2,体积分数10%的O2,平衡气体为N2,总流量为300 mL·min−1,空速为30 000 h−1,处理时长为8 h。此时的催化剂表达式为S-La0.65X0.35FeO3。使用STA449 F5同步热分析仪测试热重分析(TGA)。测试条件:取10 mg催化剂, 在50 mL·min−1纯N2气流中以10 ℃·min−1的升温速率加热至1 000 ℃后进行测试。SO2-TPD的程序升温解吸实验使用AutoChem II 2920仪器进行,以研究SO2与催化剂样品表面的相互作用。测试条件:取100 mg催化剂预处理后,100 ℃下吸附SO2至饱和,在50 mL·min−1纯He气流中加热至800 ℃进行解析。采用X射线光电子能谱技术(XPS)分析催化剂掺杂前后和反应前后表面元素化学价态变化,基础压力为101.010 Pa。
-
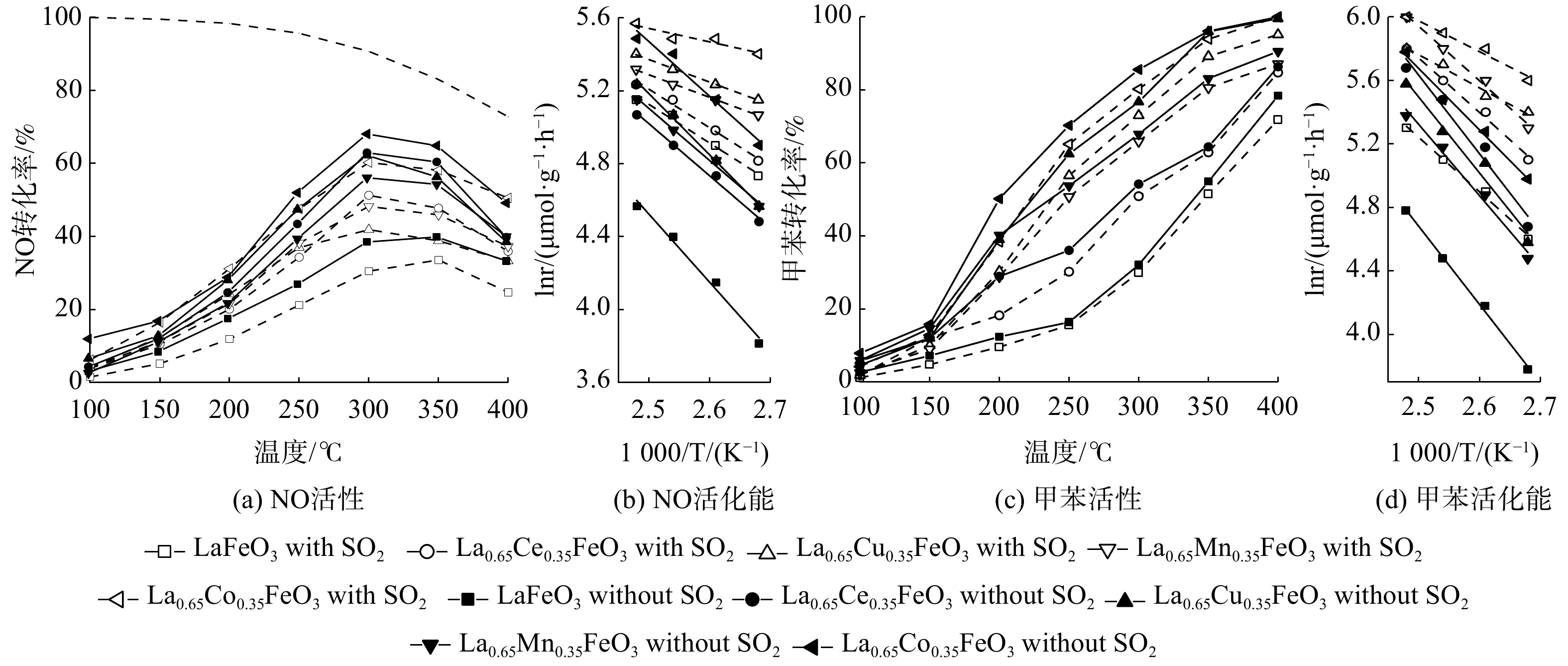
图2展示了SO2对La0.65X0.35FeO3(X=Ce、Cu、Mn、Co)催化剂协同催化氧化NO和甲苯活性的影响。所有催化剂的NO转化率均随温度升高呈先升高后降低的趋势,甲苯转化率则随温度升高而逐渐升高。当通入SO2后,所有催化剂的NO和甲苯转化率均显著降低,表明SO2抑制了La0.65X0.35FeO3催化剂的催化性能。这归因于SO2在La0.65X0.35FeO3催化剂的表面产生了硫酸盐化,导致活性位点减少,从而催化剂活性降低。此外,不管有无SO2,不同过渡金属元素X掺杂后催化剂的活性均优于LaFeO3催化剂。这表明过渡金属元素X掺杂改性有效提升了催化活性。其中,Co元素A位掺杂的La0.65Co0.35FeO3催化剂具有最佳活性,在300 ℃时,NO转化率达到最高(60%),T90为330 ℃,这表明Co与Fe之间存在良好的协同效应。另外,无论是通入或不通入SO2,La0.65X0.35FeO3催化剂均显示出比LaFeO3更低的EaNO和EaT,其中La0.65Co0.35FeO3表现出最低Ea(表1)。
-
图3为La0.65X0.35FeO3催化剂的SEM图。LaFeO3催化剂表面粗糙,形成了一些 FeOx 团聚物,孔结构不显著(图3(a))。La0.65Ce0.35FeO3催化剂颗粒排列紧密、分布均匀,没有看到团聚现象,且形成较小的孔,这表明Ce掺杂促进了Fe的分散(图3(b))。La0.65Cu0.35FeO3和La0.65Mn0.35FeO3催化剂内部有不规则的较大孔道结构,但表面粗糙、颗粒较大(图3(c)和(d))。而La0.65Co0.35FeO3催化剂表面光滑、孔结构丰富,颗粒为纳米结构,颗粒直径为5~10 nm,分散性良好(图3(e))。结合XRD分析得出,过渡金属Ce和Co的掺杂促进了Fe活性组分的分散,而La0.65Co0.35FeO3中介孔和大孔的多孔结构明显增加了比表面积,有利于提升 La0.65Co0.35FeO3催化剂的性能。
-
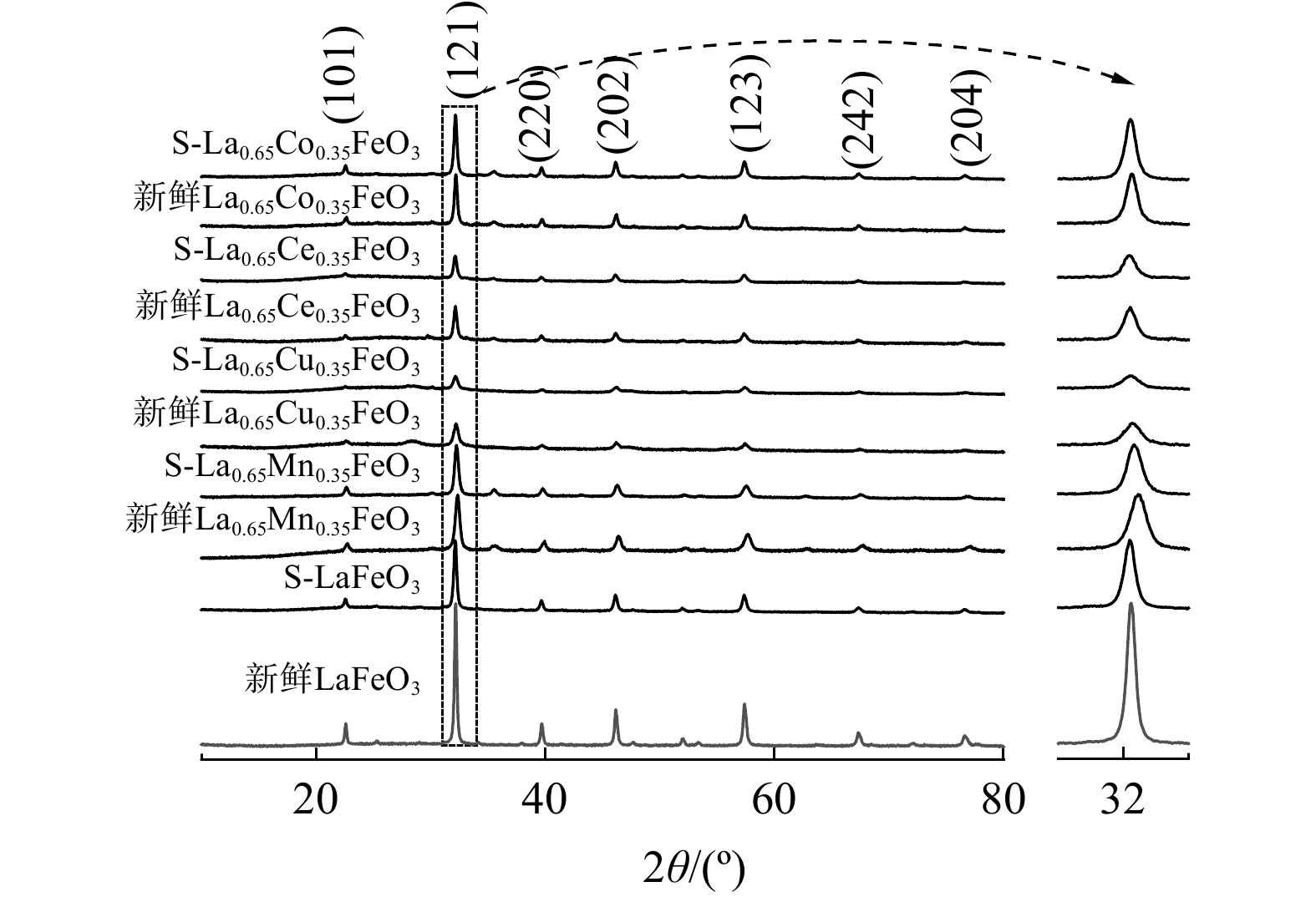
研究了SO2对La0.65X0.35FeO3催化剂晶体结构的变化,如图4所示。新鲜LaFeO3催化剂的衍射峰为正交相钙钛矿结构的LaFeO3衍射峰(JCPDS PDF NO.88-0641)[4]。在过渡金属掺杂后,并未观察到新的衍射峰。这表明过渡金属元素X掺杂进了LaFeO3晶格中,且保持了正交相钙钛矿结构。此外,掺杂后衍射峰强度减弱、半峰宽变宽、晶胞参数变小(见表1)。这表明过渡金属元素X掺杂使得LaFeO3催化剂晶胞和晶粒尺寸减小,引起晶格畸变,提升了氧迁移率。另外,反应后的钙钛矿催化剂衍射峰强度变弱、晶粒尺寸减小。这可能是SO2与钙钛矿催化剂作用,促使钙钛矿结构遭到破坏的结果。
-
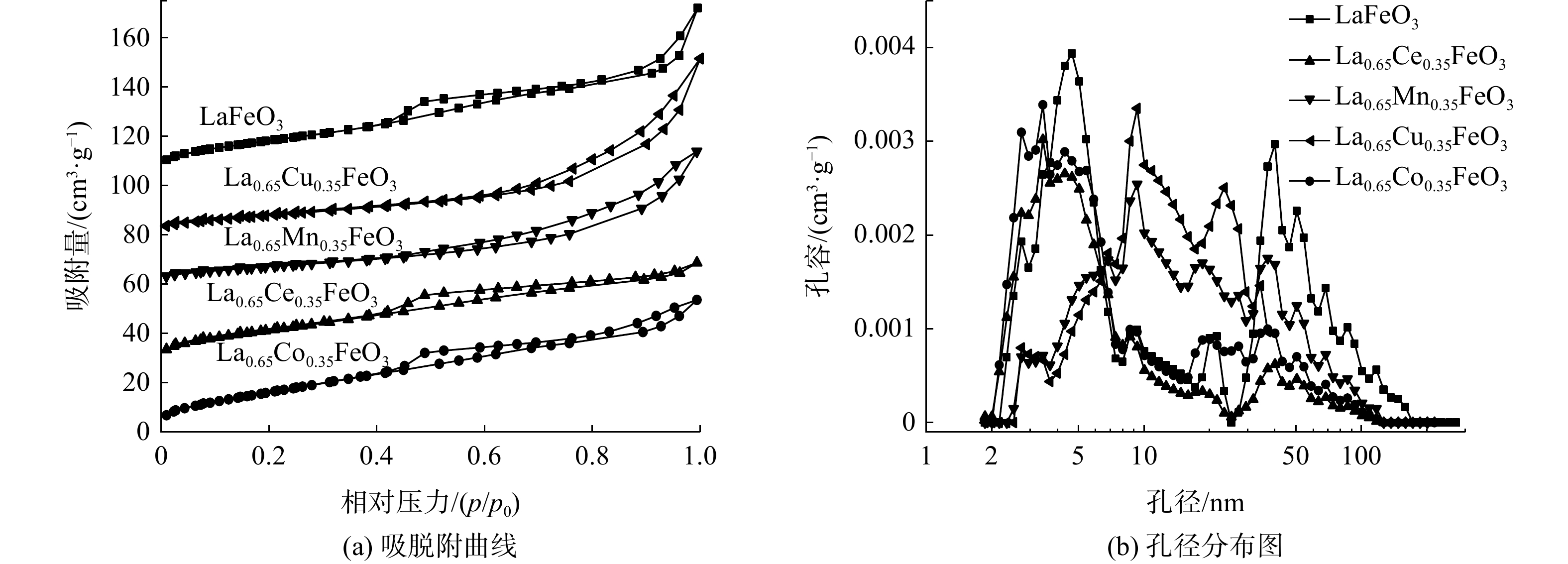
图5为La0.65X0.35FeO3催化剂的N2吸附-脱附等温线和孔径分布图,比表面积、孔容和平均孔径列于表2。所有催化剂的等温线均为IV型,在相对压力为0.4~1.0时存在H3型滞回环.。这表明所有催化剂均存在大孔和介孔结构。此外,LaFeO3催化剂比表面积为63.9 m2·g−1。Ce掺杂后,比表面积变化不明显。Cu和Mn掺杂后,比表面积降低。然而,Co掺杂明显增大了比表面积(74.6 m2·g−1),这是存在丰富的介孔和大孔结构所致。以上结果表明:不同过渡金属元素X掺杂对催化剂比表面积和孔结构影响不同;结合活性结果表明催化剂的性能除了与比表面积有关,还与孔结构有关;高比表面积可提供更多反应位点,而多孔结构有利于甲苯分子的吸附和扩散[15]。
-
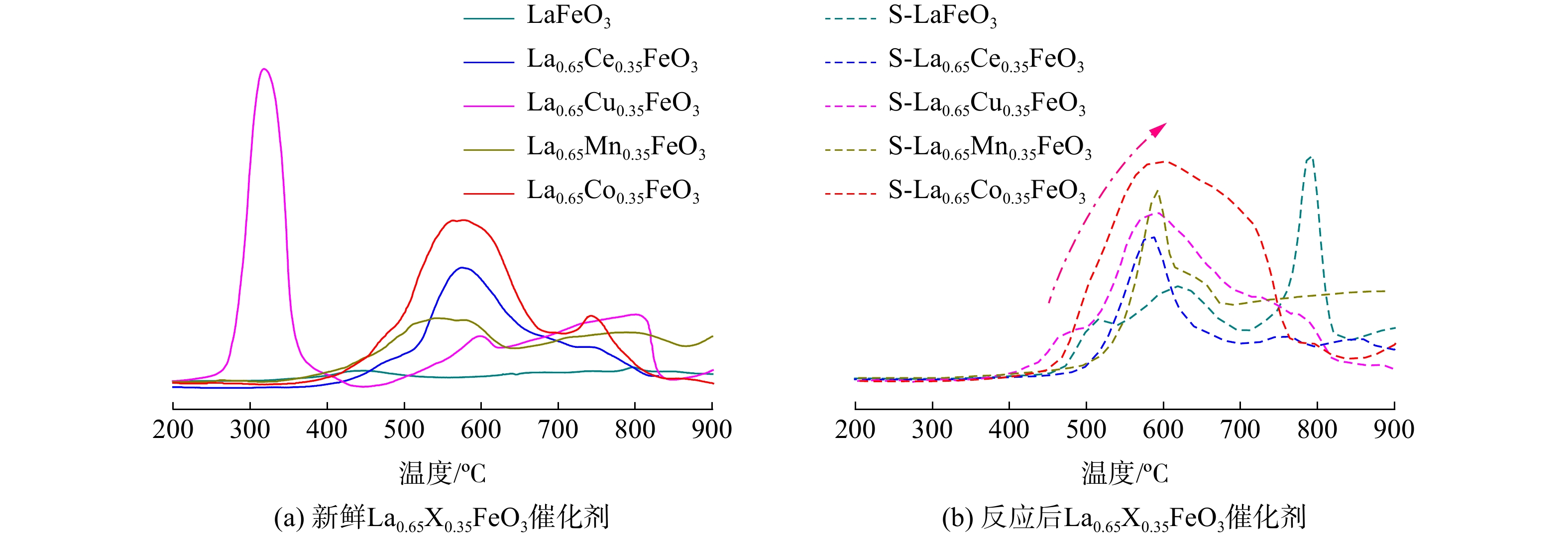
采用H2-TPR方法考察SO2对La0.65X0.35FeO3催化剂氧化还原性能的影响,结果如图6所示。新鲜的LaFeO3催化剂在460 ℃处有一个归因于Fe的弱还原峰[16]。反应后LaFeO3催化剂则在500、600和800 ℃处出现3个还原峰。这归因于表面吸附的硫酸盐被还原为硫化氢[9]。新鲜的La0.65Ce0.35FeO3催化剂在570 ℃处有一个归因于Ce4+→Ce3+的宽还原峰[17],反应后催化剂的该峰变窄。这是因为部分CeO2物质与SO3生成了稳定的硫酸铈盐。新鲜的La0.65Cu0.35FeO3催化剂在低温310 ℃处有一个归因于CuO→Cu2O的还原峰[18],反应后催化剂的低温还原峰消失,这表明CuO→Cu2O的还原失效。在475 ℃、600 ℃处出现宽的强还原峰,这归因于吸附的硫酸盐被还原为硫化氢和高温下CuO→Cu的还原[18]。新鲜的La0.65Mn0.35FeO3催化剂在高温区域520~900 ℃出现的宽还原峰为Mn3+→Mn2+的还原[19]。反应后的催化剂在520 ℃处还原峰增强,这归因于金属和硫酸盐还原峰的叠加[20]。新鲜的La0.65Co0.35FeO3催化剂还原峰面积最大,这表明Co与Fe的相互协同作用增强了氧化还原能力[17]。而在570 ℃处的还原峰则归因于Co3+→Co2+→Co的还原。反应后La0.65Co0.35FeO3催化剂的还原峰强度增强,这同样归因于金属和硫酸盐还原峰的叠加。值得注意的是,反应后H2消耗量增加,但不代表催化剂氧化能力的提高[20];相反,硫酸盐的存在严重阻塞金属位点并影响了催化剂的氧化还原能力。
-
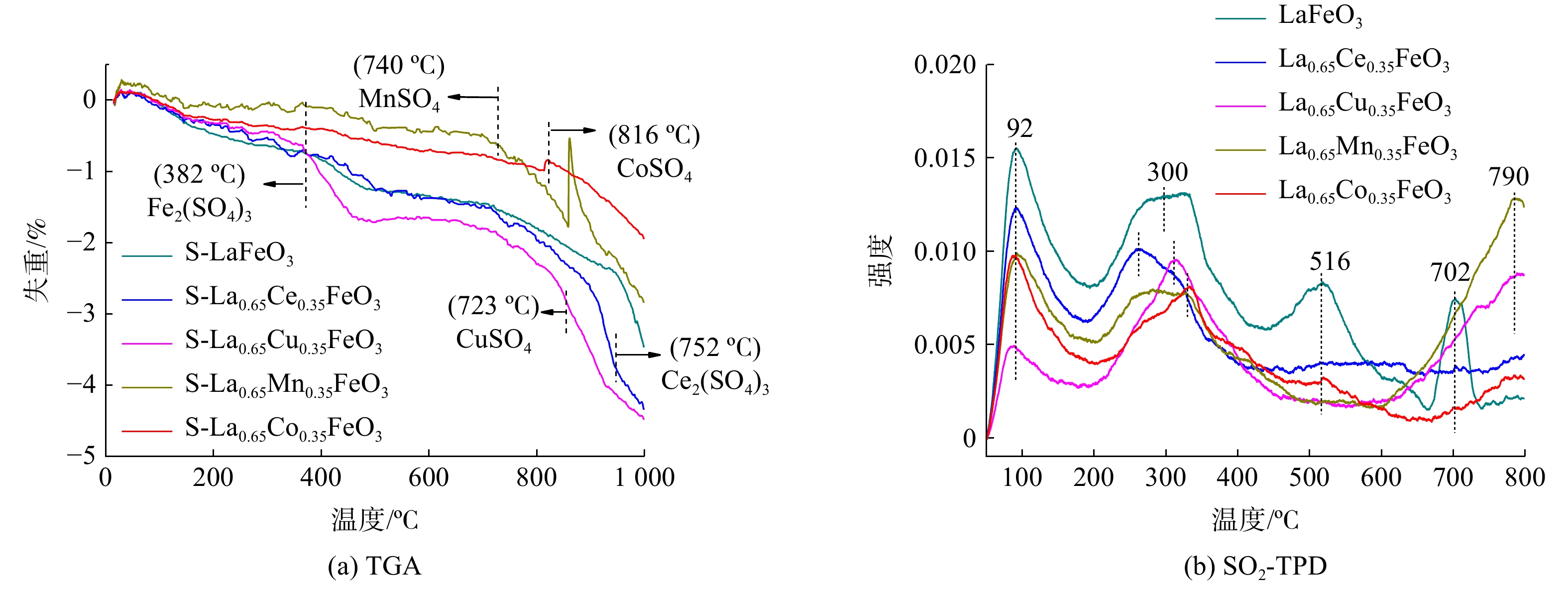
采用TG方法进一步考察反应后S-La0.65X0.35FeO3催化剂上的表面硫物种,如图7(a)所示。所有催化剂在温度升至1 000 ℃之前一直处于失重状态。结合XPS结果,反应后S-LaFeO3在382 ℃处出现的失重峰归因于Fe2(SO4)3分解生成氧化铁并释放SO2。在温度为723 ℃、752 ℃、740 ℃和816 ℃处的失重峰分别对应于硫酸铜、硫酸铈、硫酸锰、硫酸钴等硫酸盐物质[20-21]。通常重量损失大小与硫酸盐生成量有关,重量损失大小排列为: S-La0.65Cu0.35FeO3> S-La0.65Ce0.35FeO3>S-LaFeO3>S-La0.65Mn0.35FeO3> S-La0.65Co0.35FeO3。以上结果表明,SO2在催化剂表面形成硫酸盐的含量越多,对催化活性的影响越大。
-
SO2-TPD用于探索SO2在La0.65X0.35FeO3催化剂表面上的吸附,如图7(b)所示。所有催化剂在90 ℃和300 ℃都存在低温峰,这归因于吸附在弱酸性中心的SO2。另外,LaFeO3催化剂在516 ℃和702 ℃出现的峰归因于FeSO4、Fe2(SO4)3的热分解及SO2的解吸[22]。过渡金属X掺杂后,100 ℃和300 ℃的峰强度降低,中心峰向高温移动。这是因为金属之间相互协同作用使得SO2在催化剂表面上的吸附变弱,生成较少的硫酸盐物质。La0.65Ce0.35FeO3催化剂没有新峰出现。而La0.65Co0.35FeO3、La0.65Cu0.35FeO3和La0.65Mn0.35FeO3催化剂则在790 ℃出现失重峰。这分别归因于CoSO4、CuSO4和MnSO4的硫酸盐物质分解[20, 23]。再结合反应后催化剂的H2-TPR和TGA结果分析表明,O2在催化剂上的表面硫酸盐化会导致金属位点减少,从而降低催化性能。另外,金属元素间的协同作用及氧物种数量亦会对金属的硫酸盐化产生影响。
-
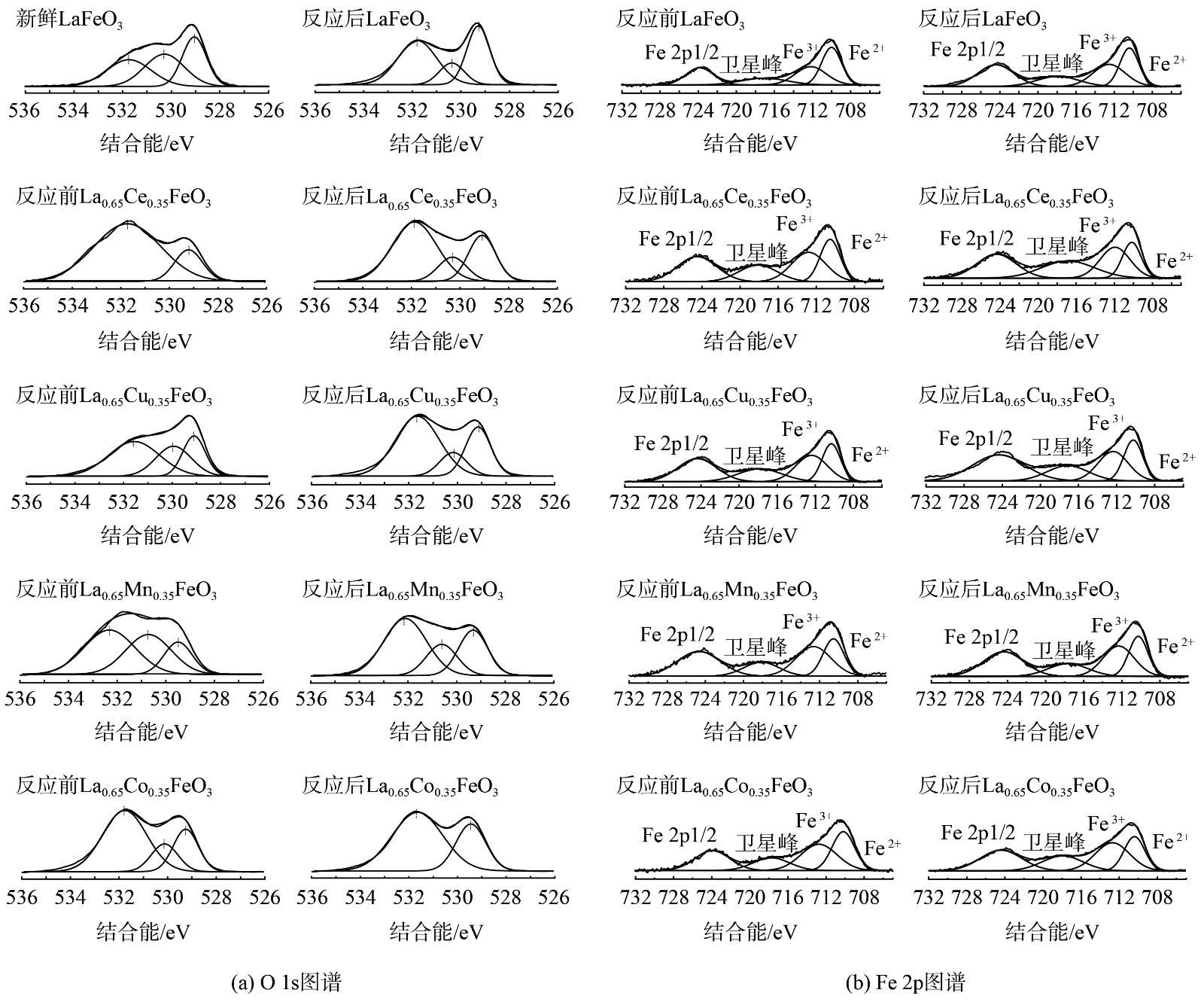
La0.65X0.35FeO3催化剂反应前后O1s的XPS图谱如图8 (a)~(j)所示。在529.0、530.1和531.7 eV处的峰分别为晶格氧(Olatt,O2−)和化学吸附氧(Oads,如O2−、O22−)[24]。通常,用 Oads/Olatt来评估样品表面的氧空位浓度。反应前的LaFeO3催化剂Oads/Olat比例为2∶1,这表明主要氧物种为化学吸附氧。掺杂后,Oads/Olat比例增加且Co掺杂的Oads/Olat比例最高[25],这表明过渡金属元素A位掺杂增加了氧空位,气相氧吸附在氧空位上形成化学吸附氧,从而提高催化氧化反应。反应后所有催化剂表面Oads/Olatt的比例均下降,这表明反应过程中消耗了化学吸附氧,这是由于SO2会与催化剂表面的化学吸附氧结合生成SO3[26]。值得注意的是,在532 eV处峰值显著增加,这对应于硫酸盐形式的氧的特征电子状态,证明了这是来自于SO42−的氧,也进一步证明了在催化剂表面生成了硫酸盐。
图8(k)~(t)为Fe 2p的XPS图谱。所有催化剂均在710.1 eV和723.8 eV处有2个峰,分别对应于Fe 2p3/2和Fe 2p1/2轨道[27]。Fe 2p3/2轨道分裂的2个峰分别为Fe2 + (710.0 eV)和Fe3+ (712.1 eV)[28]。新鲜的LaFeO3催化剂主要以Fe2+为主要物种。在掺杂后,Fe3+/Fe2+比例增加,这表明过渡金属X元素A位掺杂导致了Fe2+→Fe3+的转化。此外,Fe 2p3/2的峰向低结合能方向移动,这表明掺杂金属与Fe之间存在一定的相互作用从而改变了Fe的配位环境。在反应后,所有催化剂表面Fe3+/Fe2+的比例增加,这是因为发生Fe2++Xn+1→Fe3++Xn氧化还原反应。
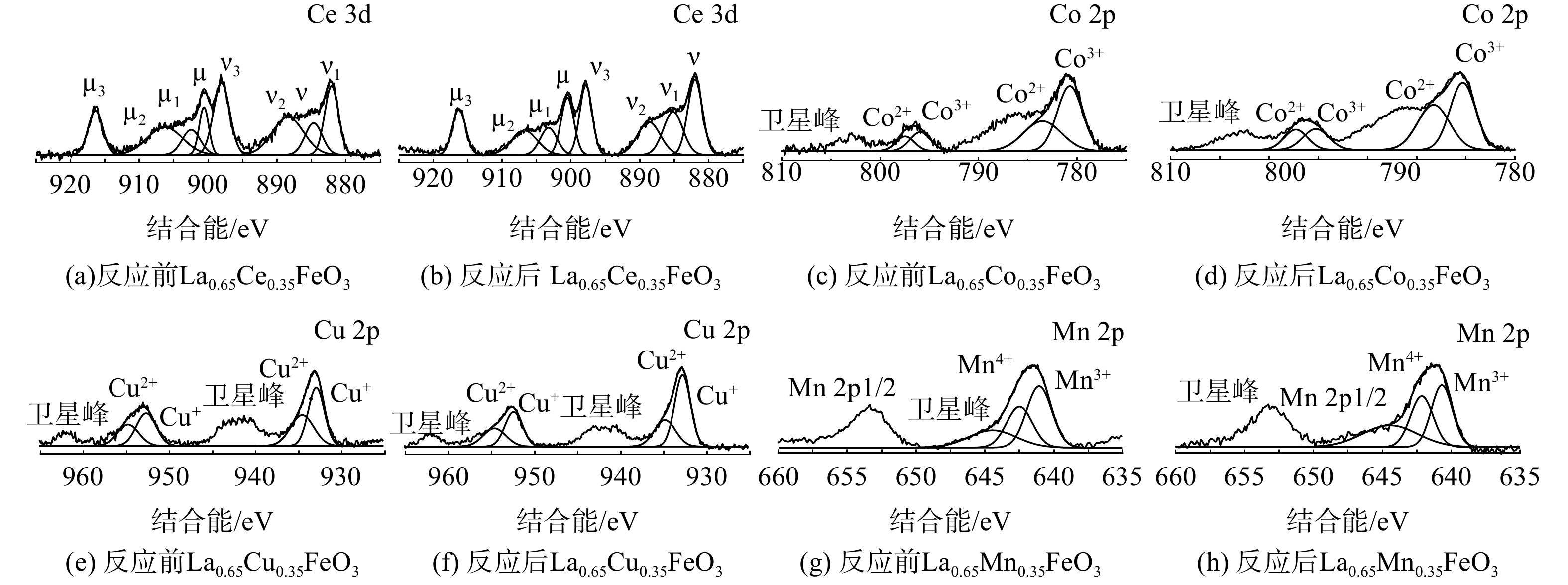
La0.65X0.35FeO3催化剂各掺杂元素X(Ce 3d、Cu 2p、Mn 2p和Co 2p)的 XPS能谱如图9。图9 (a)和(b)为Ce 3d的XPS能谱。标记为µ、µ2、µ3、v、v2和v3的谱带归属于Ce4+,而标记为µ1和v1的峰归属于Ce3+[28]。新鲜的La0.65Ce0.35FeO3催化剂主要以Ce4+存在。在反应后,Ce3+/Ce4+的比例从0.2增至0.3,发生了Ce4+到Ce3+的还原。图9 (e)和(f)为Cu 2p图谱,在932.9和952.7 eV左右的峰被分配给Cu+,在934.5和954.5 eV左右的峰归因于Cu2+,其余为卫星峰[1]。新鲜的La0.65Cu0.35FeO3催化剂表面Cu主要以Cu+形式存在。在反应后,Cu+/Cu2+的比率从1.3降至1.8,且Cu 2p3/2峰向高结合能方向移动,Fe 2p3/2的结合能向低结合能方向移动。这是因为发生了Fe2++Cu2+↔Fe3++Cu+反应[29]。图9 (g)和(h)为Mn 2p XPS图谱,结合能在642.7 eV和641.9 eV的峰分别为Mn4+和Mn3+物种,其余为卫星峰[30]。新鲜的La0.65Mn0.35FeO3催化剂表面Mn主要为Mn4+物种。在反应后,Mn4+/Mn3+的比例从1.5降至1.1。这表明发生了Mn4+到Mn3+的还原。图9(c)和(d)为Co 2p图谱,在783.6和797.4 eV处的峰归属于Co2+物种,而780.8和796.0 eV处的峰归属于Co3+物种[31]。新鲜的La0.65Co0.35FeO3催化剂表面以Co3+物种为主。反应后,Co3+/Co2+的比例从1.5降至0.7。这表明发生了Co3+向Co2+的还原反应(Fe2+ + Co3+ ↔ Fe3+ + Co2+)。根据文献[24] ,Co掺杂改性后存在的高价Co3+物种可充当活性位点,有利于催化氧化反应。
-
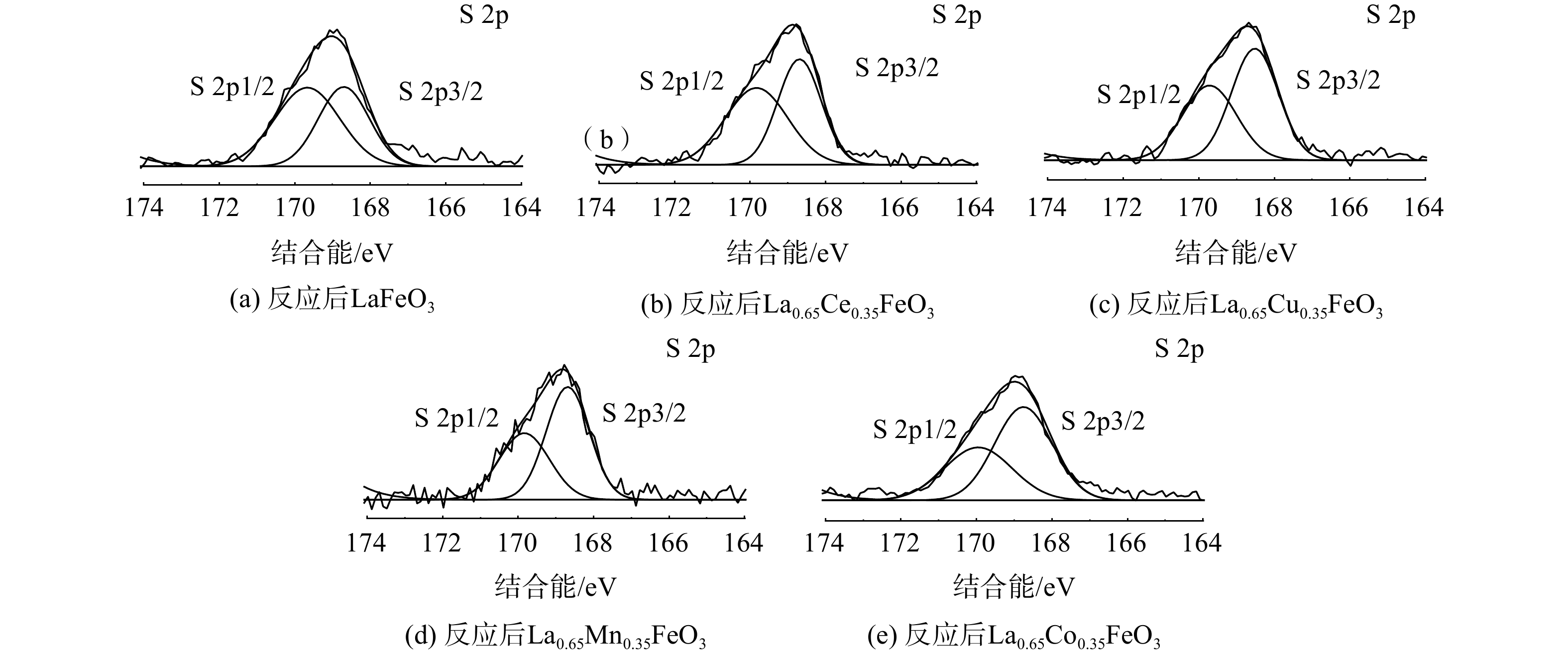
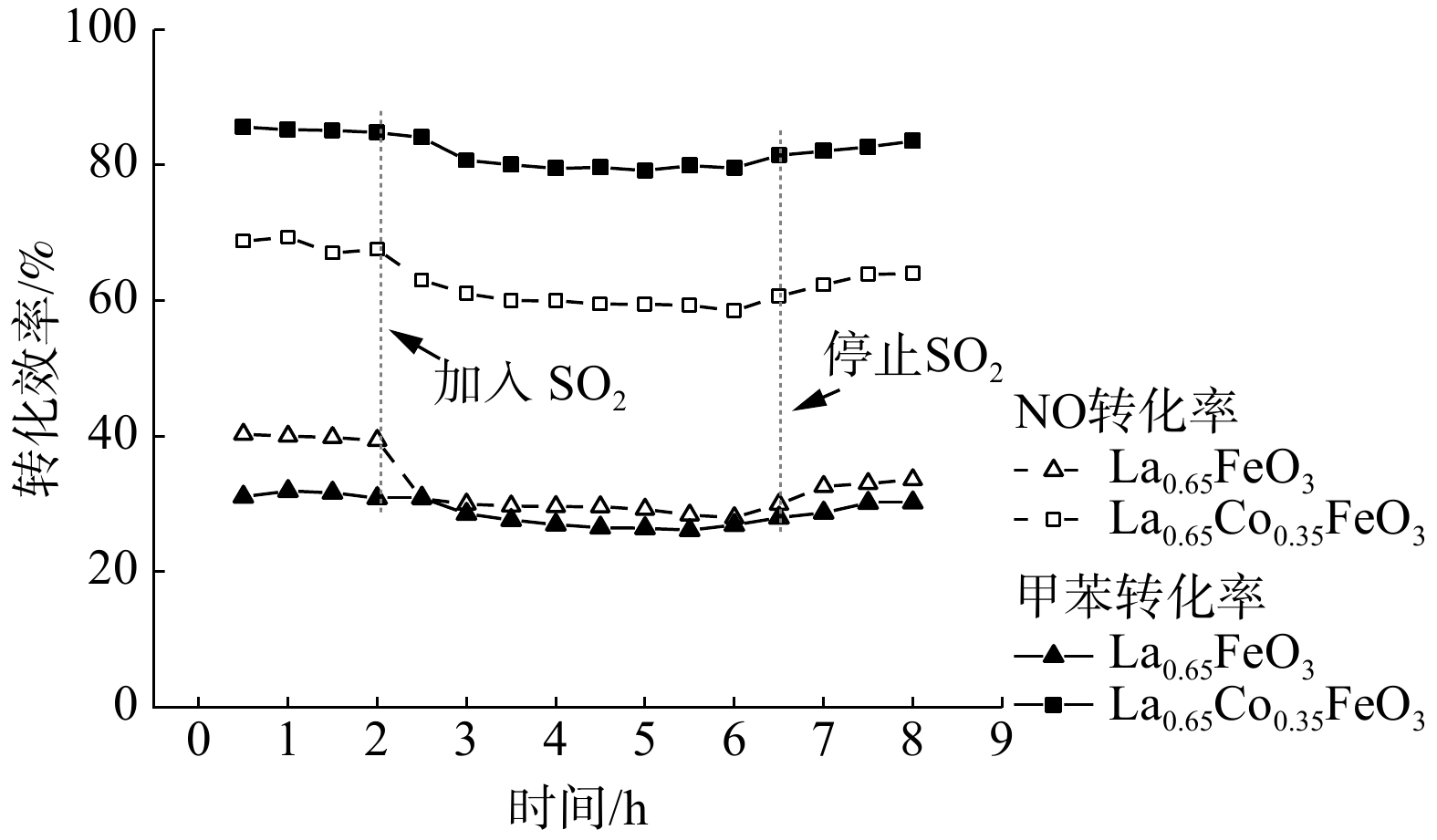
图10为S 2p的XPS图谱,结合能在168.2~168.5 eV和169.2~169.7 eV处的峰归属于S 2p3/2和S 2p1/2[32]。反应后的La0.65X0.35FeO3催化剂均在169.5eV和168.2 eV处存在2个峰,这归因于Fe2(SO4)3的沉积[29]。这表明SO2存在条件下,催化剂表面会沉积硫酸盐和亚硫酸盐,从而降低催化剂的活性。该结果与TGA和SO2-TPD分析结果一致。此外,进一步研究了SO2对La0.65Co0.35FeO3催化剂稳定性的影响(图11)。在添加SO2后,La0.65Co0.35FeO3催化剂活性降低,稳定性在4 h后略微下降,这表明SO2在催化剂表面形成的硫酸盐覆盖了活性位点并破坏了钙钛矿结构。值得注意的是,停止通入SO2后,LaFeO3催化剂的效率不能恢复,而La0.65Co0.35FeO3催化剂则能恢复。结合BET和XRD结果发现,Co掺杂的催化剂具有良好的比表面积、多孔结构,从而削弱了SO2的抑制作用。由此推断SO2的影响机制过程为:SO2被 La0.65X0.35FeO3催化剂表面化学吸附氧氧化成SO3,并与金属阳离子反应生成SO42-硫酸盐物种,覆盖在催化剂表面造成孔道堵塞、减少活性位点,影响反应气体的吸附扩散,从而导致催化活性下降。然而,过渡金属X掺杂提供了丰富氧空位,产生了更多的活性位点和多孔结构,故削弱了这种抑制作用。
-
不同过渡金属(Ce、Cu、Mn、Co)的掺杂使得催化剂拥有更大的表面积,丰富的孔结构,更好的氧化还原能力和更多的活性位点,可显著提高催化剂的催化性能和抗硫性能,并削弱了SO2对催化剂结构和硫酸盐化的影响。SO2对La0.65X0.35FeO3(X=Cu、Ce、Mn、Co)钙钛矿催化剂协同催化氧化NO和甲苯活性具有抑制作用。这是由于SO2竞争吸附活性氧生成的SO3与金属阳离子反应生成硫酸盐,并覆盖在催化剂表面造成孔道堵塞,减少活性位点和减弱催化剂氧化还原能力。




 下载:
下载: