-
挺水植物(emergent macrophytes),作为水生植物的重要类型以及淡水水域重要的初级生产力之一,对淡水生态系统具有重要作用. 挺水植物地上组织(茎和叶)挺出水面,而地下组织(根或根茎)一般生长于水陆交界处浅水区域沉积物中[1 − 2]. 挺水植物主要从沉积物中获取生长所需营养物质[3 − 5],其庞大根系所在区域(根区)微生物数量和种类远高于非根区沉积物,形成明显的根际效应[6 − 8]. 因此,挺水植物根区是沉积物-根系-微生物三者紧密结合相互影响的关键场所,其影响可归纳为以下方面:一方面,挺水植物通过其根系向沉积物输送氧气,促进了好氧条件下营养元素的物质循环[9]. 如成水平等[10]发现植物根系泌氧将增强硝化过程提高沉积物硝态氮(NO3−-N)含量. 王文林等[9]则报道菖蒲成株根系的氧扩散能力显著高于幼苗阶段,这可能与植物叶面积以及根系生物量、根表面积的大小等有密切关系. 可见,挺水植物的氧气扩散能力受物种以及生长阶段的强烈影响;另一方面,挺水植物的根系能释放超过200种的分泌物,如糖、氨基酸、有机酸等,这些分泌物不仅影响根区沉积物的微生境,还为沉积物微生物提供了碳源和营养物质[11],使根际微生物的数量及代谢活性远高于非根际沉积物[12]. 因此,吴林坤等[13]等认为,根系分泌物对根际微生物具有选择塑造作用,其群落结构的独特性与代表性将受植物物种差异以及生长阶段的影响. 可见,物种及其生长阶段将是影响挺水植物根区微生物的关键因子.
菖蒲(Acorus calamus),天南星科菖蒲属,典型的多年生挺水植物,广泛分布于河流、沼泽以及湖泊岸边等浅水水域. 菖蒲根系发达,对氮、磷等营养盐有很强的吸收能力[2,9,14],加之其形态美观,常被用于人工湿地或园林景观中[7]. 近年来,关于菖蒲根区沉积物微生物已有一些研究报告. 如顾诗云等[2]研究了淹水胁迫对菖蒲生理特性及其根际细菌群落特征的影响. 寄博华[15]发现斗南湿地菖蒲植物群丛沉积物细菌群落的丰富度和多样性均最大,高于芦苇和美人蕉植物群从. 赵良元等[16]通过90 d的培养发现,菖蒲的生长可大大提高沉积物中微生物的活性及多样性. 但现有研究均仅为短期内针对菖蒲的培养实验所获得的结果,对不同生长阶段菖蒲根区沉积物微生物的变化特征的认识仍十分不足.
本研究通过为期 175 d的培养时间,基于16S-rRNA高通量测序技术并结合FAPOTAX功能预测,探究菖蒲根区沉积物细菌群落结构和功能特征在三个生长阶段(生长期、成熟期、衰亡期)的差异,以期进一步阐明挺水植物的生长对其根区细菌群落结构及其功能组成的影响.
-
本研究所用菖蒲和沉积物采自江苏大学校内湖泊(119°30′23'' E,32°11′58'' N),所采植物株高约60 cm,块状茎保持完整. 采样完成后,将植物样品迅速带回实验室后,用自来水冲洗根系以及植物表面泥土等供后续实验所用;表层沉积物(0—20 cm)样品带回实验室后用不锈钢网(20目)先过滤掉大颗粒以及各种杂质,然后使用混合器彻底将所采沉积物样品混合均匀,以确保各实验系统沉积物初始状态一致.
-
采用直径40 cm,深度60 cm的圆形桶作为实验容器. 首先在各实验桶中铺设预先混匀的30 cm厚沉积物,将所采植物种植于各实验桶(CA),随后沿桶壁注入自来水,注水深度为桶壁45 cm处;另设一组不种植植物的系统作为对照(CK,仅包含沉积物和水体). 实验组和对照组分别设置3组重复. 实验过程中,定期补充各实验桶中自来水,以确保上覆水始终在同一深度. 实验于2022年5月—11月在室外培养(培养环境可以避免降雨的影响),共培养175 d.
实验第35、105和175 天时分别采集各实验桶内沉积物样品,按照菖蒲生长习性,这3次采样时间可代表菖蒲的旺盛生长期、成熟期和衰亡期. 采集的沉积物随机分成两部分,一部分经干燥、研碎、混匀、过100目筛,自封袋封装,于4 ℃保存,供沉积物理化指标测定,另一部分于 −25 ℃条件下保存用于沉积物NO3−-N和微生物测定.
-
沉积物pH值(固水比为2.5:1)采用pH计测定(雷磁PHSJ-3F,INESA,上海);沉积物全碳(TC)和总氮(TN)采用元素分析仪(Vario EL cube,德国)测定;沉积物硝态氮(NO3−-N)和氨态氮(NH4+-N)用 2 mol·L−1 氯化钾(KCL)浸提后用紫外可见分光光度计(N4)测定;有机物质(O.M)采用水合热重铬酸钾氧化-比色法(《土壤农化分析》)进行测定;总磷(TP)采用高氯酸-浓硫酸(HClO4-H2SO4)消煮后用钼锑抗比色法测定.
-
沉积物样品通过FastDNAchen® Spin Kit for Soil试剂盒提取总DNA,每个样本3个重复. 通过1%的琼脂凝胶电泳检测DNA提取质量,使用NanoDrop 2000测定DNA浓度和纯度. 采用细菌通用引物338F (5'- ACTCCTACGGGAGGCAGCAG-3') 和 806R (5'-GGACTACHVGGGTWTCTAAT-3') 对细菌16S rRNA 基因 V3-V4 区进行 PCR 扩增. PCR体系为 20 μL,含有 5×FastPfu Buffer 缓冲液 4 μL,2.5 mmol.L−1 d NTPs 2 μL,正向引物0.8 μL,反向引物0.8 μL,FastPfu 聚合酶 0.4 μL,BSA 0.2 μL,模板DNA 10 ng,最终ddH2O至 20 μL. PCR扩增程序为:95 ℃ 初始变性3 min,随后95 ℃ 变性30 s,55 ℃ 退火30 s,72 ℃ 延伸45 s共27个循环,最后72 ℃ 延伸10 min,10 ℃ 结束. PCR扩增产物通过2% 琼脂糖凝胶胶电泳检测,后委托上海美吉生物医药科技有限公司(Illumina Miseq PE300平台,美国)完成高通量测序.
-
原始序列经质控、过滤、拼接后利用UPARSE 软件(http://drive5.com/uparse/)进行聚类,得到97% 相似水平下的操作分类单元(OTU). 本研究中按最小样本序列数将各样品抽平处理后共得到13835个OTUs. 基于所获OTUs,经RDP classifier(https://sourceforge.net/projects/rdp-classifier/,RDP:http://rdp.cme.msu.edu/)获得各样品细菌物种分类信息(分类置信度:0.7);通过Mothur软件计算各实验组沉积物样品细菌Alpha多样性指数(Shannon、Simpson、Sobs、ACE和Chao);采用非度量多维尺度分析(non-metric multidimensional scaling,NMDS)解析菖蒲根区及对照系统沉积物细菌群落Beta多样性;基于韦恩图(Venn)和柱形图研究沉积物细菌物种组成和相对丰度的变化;采用冗余分析(RDA)、相关热图分析(Correlation heatmap diagram)、排序回归分析(Sorting regression analysis)和 Mantel Test等方法评价细菌群落与沉积物理化参数之间的关系. 使用FAPROTAX(functional annotation of prokaryotic taxa)对微生物群落进行功能预测. 通过Wilcoxon秩和检验(对照组CK与菖蒲组CA)和 Kruskal-Wallis H检验(3个培养时间)对细菌群落Alpha多样性指数和优势门显著性差异进行检验;通过相似性分析(Analysis of similarities,ANOSIM)以及置换多元方差分析(Permutational Multivariate Analysis Of Variance,PERMANOVA)对群落结构差异进行统计学分析. 以上与微生物相关的分析均在美吉生物云平台在线完成 (http://cloud.majorbio.com). 其他数据(平均值±标准差)采用 Microsoft Excel和 SPSS 软件进行计算与分析. P<0.05和P<0.01分别为差异显著和差异极显著.
-
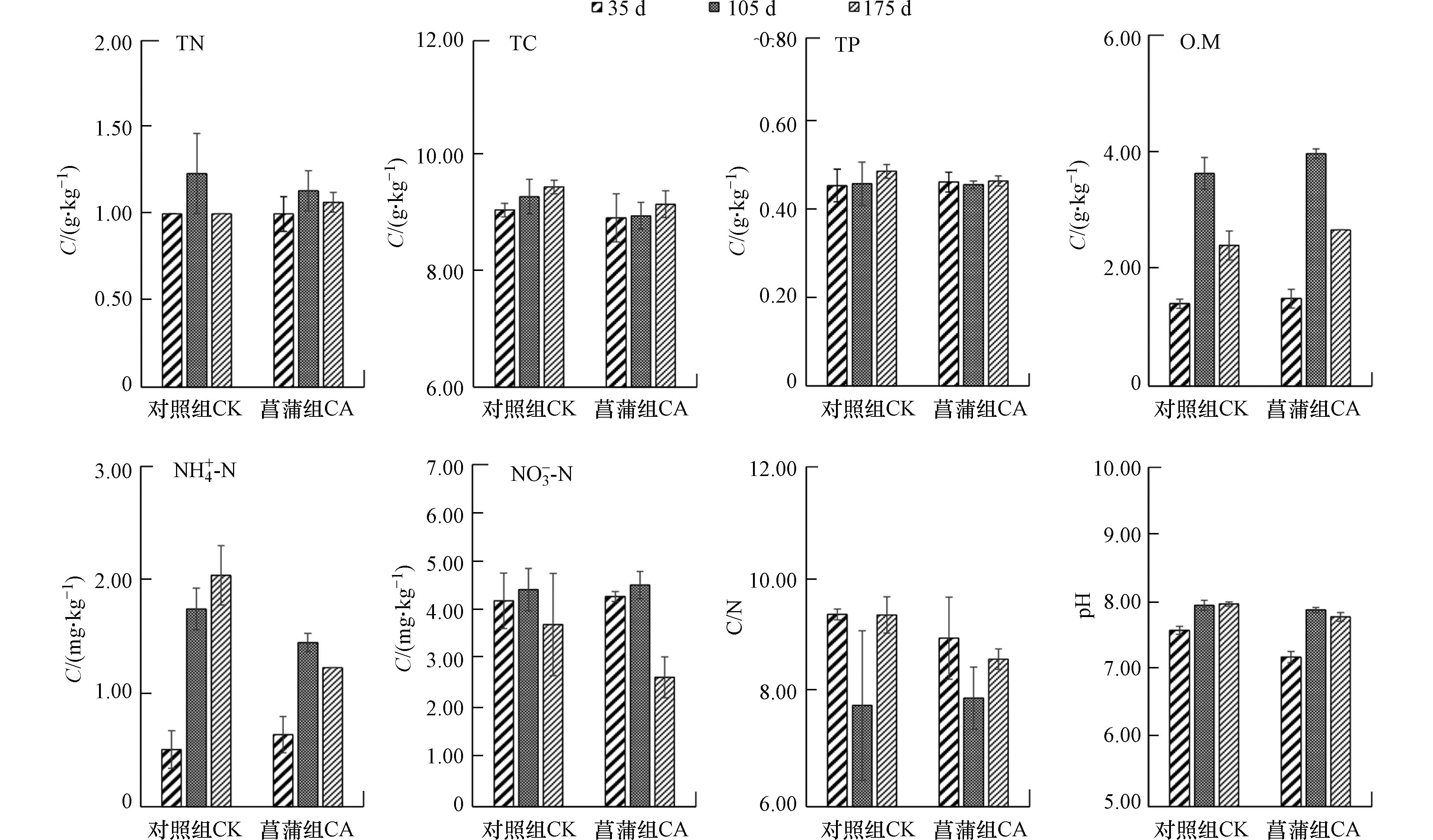
实验期间,菖蒲根区和对照系统中沉积物pH值分别介于7.15—7.91以及之间7.60—8.03,呈弱碱性(图1). 实验过程中菖蒲组沉积物pH值始终低于对照组,这与菖蒲根系活动及其根系分泌物有密切关系,其影响途径表现在:植物根系呼吸所释放的二氧化碳以及分泌的有机酸类等物质,在一定程度上降低了沉积物pH值[17];此外,植物根际微生物的活动所产生的酸性物质也可降低根际土壤pH值[13]. 张金萍[18]针对挺水植物香蒲的研究证实了同样的规律.
菖蒲根区沉积物TN、NH4+-N、NO3−-N的平均含量分别为1.07 g·kg−1、1.10 mg·kg−1和3.83 mg·kg−1,稍低于对照组氮素含量,其值分别为1.08 g·kg−1、1.43 mg·kg−1以及4.13 mg·kg−1(图1). 菖蒲根区沉积物和对照系统沉积物TC含量分别介于8.60—9.40 g·kg−1以及9.00—9.60 g·kg−1之间(图1),表现为对照>菖蒲. 菖蒲庞大的根系组织将吸收沉积物中碳氮磷等营养元素以供植物良好的生长发育,在这一过程中植物根区沉积物元素含量有所下降. 这与余居华等[4]研究的结果一致. 陈登等[19]同样证实水生植物水蕴草(Egeria densa)、狐尾藻(Myriophyllum verticillatum)和苦草(Vallisneria natans)能显著降低了沉积物铵态氮含量,除了植物根系的直接吸收外,根区沉积物氮循环菌所驱动的硝化-反硝化以及厌氧氨氧化等作用也是铵态氮含量降低的原因之一. 此外,生长过程中挺水植物往往通过根系释放氧气和氧化性物质[20],从而在植物根系表面形成铁锰氧化物胶膜等具有胶体性质的物质,可进一步促进植物根系对磷的吸收,降低根际沉积物磷元素的含量[18]. 对于O.M来说,植物根区及对照系统沉积物中含量分别为1.39—4.05 g·kg−1和1.33—3.93 g·kg−1(图1),表现为对照<菖蒲. 以上结果证实了菖蒲的生长对沉积物理化参数将产生一定的影响.
进一步分析了沉积物理化参数随采样时间的变化规律. 结果发现(图1),菖蒲根区沉积物TN、NH4+-N、O.M以及pH值大小顺序为105 d>175 d>35 d;TP表现为:175 d>35 d>105 d;TC含量表现为175 d>105 d>35 d,沉积物C/N则表现为35 d>175 d>105 d,表明植物根区沉积物理化参数随植物生长发育而波动变化. 对于菖蒲而言,从快速生长期到成熟期,植物快速生长,根系活力增强,植物需从沉积物中获取大量氮素用于自身生长发育,对周围环境的影响也较大;如王文林等[9]利用溶氧微电极发现,菖蒲幼苗、成株根系的不同部位均存在从根表面至沉积物氧饱和度由高到低的氧扩散层,证实了不同生长阶段菖蒲根系氧扩散能力的差异. 加之本研究在该时间段环境温度较高(平均温度29.8 ℃),加剧了沉积物中微生物的生长代谢过程. 当植物进入衰亡阶段,植物生理活动减缓,且逐渐开始衰亡,部分植物残体及根系脱落物等进入沉积物并开始腐烂,在短时间内可增加沉积物元素含量. 对于对照系统沉积物而言,沉积物TN、NO3−-N以及O.M值最高值出现在实验第105 d,NH4+-N、TC、TP以及pH值峰值则出现在实验第175 d;沉积物C/N在实验第35 d最高,其次为175 d,最低值出现在实验第105 d. 由此可见,实验过程中,无植物的对照系统以及菖蒲根区沉积物理化因子均随培养时间呈现不同变化趋势的波动.
-
对3个采样时间所采菖蒲根区及对照系统沉积物样品进行高通量测序及数据分析,共得到13835个OTUs,分属64门、201纲、477目、768科、1430属和3256种. 其中,菖蒲根区沉积物样品中共检测到OTUs共计11659个(细菌63门196纲455目733科1339属2991种),对照组沉积物共获得OTUs数量为10337个(细菌62门196纲450目709科1290属2863种). 基于OTUs,对沉积物中细菌群落Alpha多样性、Beta多样性以及物种组成特征等进行分析.
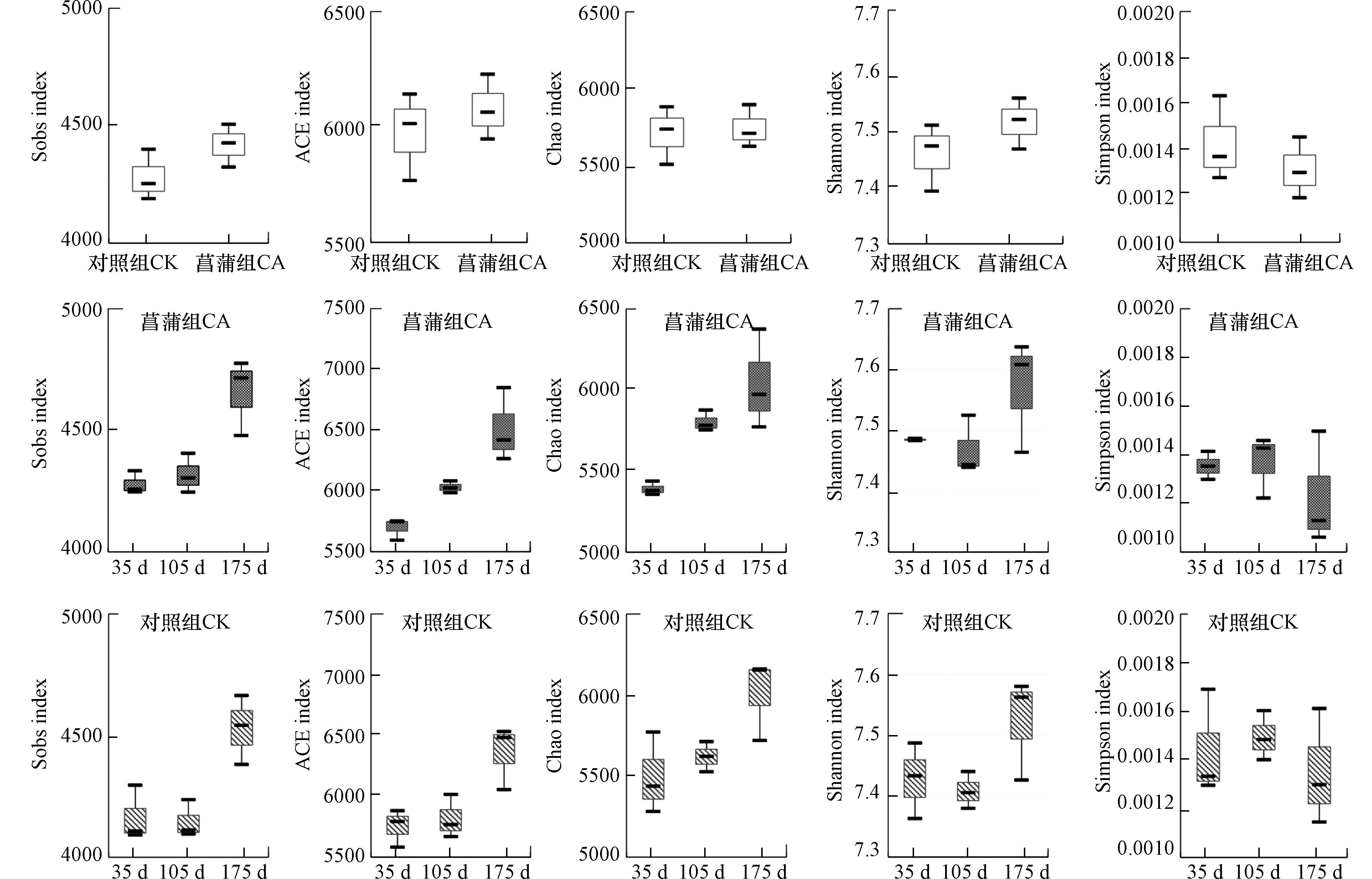
-
细菌群落的多样性对于维持沉积物的稳定性和功能具有重要的生态意义[21 − 22]. Shannon和Simpson指数指示了物种的多样性,Shannon指数与物种多样性成正比,该指数越大,群落多样性就越高[15],而Simpson指数则与物种多样性成反比[23];Sobs、ACE和Chao指数表示了物种的丰富度,指数越大意味着群落丰富度越高[15]. 本研究对菖蒲根区及对照沉积物细菌群落Alpha多样性指数(Shannon、Simpson、Sobs、ACE和Chao)的统计结果见图2所示. 沉积物细菌群落Shannon、Sobs、ACE和Chao指数平均值表现为CA>CK,而Simpson指数平均值则切好相反,表明菖蒲的生长在一定程度上提高了沉积物细菌的丰富度以及多样性(图2). 马玉等[20]利用菖蒲湿地处理含油废水时同样发现菖蒲根区功能性微生物种类和数量多于对照区域,这与植物庞大的根系为微生物附着提供的更大的表面积和附着点[24]以及植物根系分泌物为附着微生物提供碳源和营养物质等有密切关系[19,25]. 此外,植物根系可以通过一系列行为,如改变水流速度、沉降特性和水里传导率等[26],为细菌的粘附和生长提供有力的条件,从而提高沉积物中的微生物的多样性.
进一步,对三个采样时间沉积物样品Alpha多样性指数进行分析(图2). 由图2可知,CA组沉积物Sobs、ACE和Chao指数随实验时间的增加呈增加趋势,表现为35 d<105 d<175 d. 基于Kruskal-Wallis秩和检验,ACE、Chao和Sobs指数在第35和第175 天之间存在显著性差异(P<0.05),ACE、Sobs指数在第105 天与第175 天亦有显著差异(P<0.05). ACE、Chao和Sobs指数的变化证实了菖蒲的不同生长阶段对其根区沉积物细菌群落丰富度将产生不同的影响. CA组沉积物Shannon指数最高值分别出现在实验第175 d,最低值出现在105 d,Simpson指数变化趋势与Shannon值恰好相反,即105 d>35 d>175 d. 线性回归模型显示,ACE、Sobs和Chao指数与培养时间成显著正相关(ACE指数:y=5.058x+5495.908,P<0.01;Sobs指数:y=2.644x+4071.042,P<0.01;Chao指数:y=4.153x+5290.131,P<0.01).
-
细菌群落Beta多样性主要聚焦于不同生境间微生物群落结构多样性的比较[23,27],群落结构特征的差异是微生物与所处生境相互响应的结果[23]. 基于Bray-Curtis距离算法(OTUs水平)通过NMDS对各实验组沉积物细菌群落结构进化了可视化分析(图3). 由图3可知,CK和CA实验组沉积物细菌群落结构可分成重叠的两个区域,PERMANOVA结果证实了两个系统沉积物细菌群落结构无显著差异(F=0.950;R2=0.056;P>0.01). 尽管CK和CA实验组沉积物细菌群落结构呈现重叠,但图3显示,无植物的对照系统各样点间距离较近,意味着对照系统各样点沉积物细菌群落结构波动较小,而菖蒲根区沉积物各样品间更为离散,表明菖蒲系统中沉积物细菌群落结构变化较大,这可能是菖蒲在生长过程对沉积物的影响所致. 由图3可知,同一时间所采样品集聚起来,3个采样时间菖蒲根区沉积物细菌群落则明显区分成3个区域,尤其是第35 天所采样品与第105和175 天时区分明显(ANOSIM,P<0.01). PERMANOVA进一步验证了3个采样时间菖蒲根区沉积物细菌群落结构差异显著(F=1.64;R2=0.353;P<0.01). 张丁予等[28]等同样发现,植物根区沉积物微生物群落结构随着生长周期变化而变化,而且时间越长差异越显著,这与植物不同生长阶段根系活力以及根系分泌物的变化有密切关系. 植物生长过程中,其根系可分泌包括糖、氨基酸、有机酸、生物酶等多达200种以上的物质,这些物质敏感地响应植物的不同生长状态,并因此为微生物的生存创造良好的条件[1, 29].
-
基于OTUs绘制韦恩图对菖蒲根区及对照系统各样品中共有和独有细菌进行分析(图4). 由图4a可知,整个实验过程中,菖蒲根区及对照系统中共有的细菌OTUs为8161,占OTUs总数的58.99%,意味着超50% 的细菌同时存在于菖蒲根区以及无植物的对照系统沉积物中. 进一步分析后发现,菖蒲根区沉积物和对照组沉积物样品中独有的OTUs数量分别为3498和2176,分别占总OTUs的25.28% 以及15.73%,独有的OTUs反映了不同来源样本中细菌群落组成的差异性. 相比于对照组而言,菖蒲根区独有的OTUs数量略高,意味着植物生长可能会丰富根区沉积物细菌的物种组成,在植物根区沉积物中细菌群落的多样性更好,物种组成更为丰富,这与菖蒲根区沉积物细菌Alpha多样性的结果一致.
门水平(Phylum)上(图4b),菖蒲根区和无对照系统沉积物细菌群落相对丰度前10的门主要为变形菌门(Proteobacteria,21.21% 和19.34%),绿弯菌门(Chloroflexi,17.29% 和17.42%)、酸杆菌门(Acidobacteriota,13.05% 和14.30%)、放线菌门(Actinobacteriota,10.60% 和11.69%)、厚壁菌门(Firmicutes,4.539% 和5.474%)、脱硫菌门(Desulfobacterota,5.192% 和4.613%)、拟杆菌门(Bacteroidota,4.258% 和4.358%)、粘菌门(Myxococcota,3.871% 和3.524%)、硝化螺旋门(Nitrospirota,2.569% 和2.384%)和芽单胞菌门(Gemmatimonadota,1.648% 和1.734%),这10类约占总测序序列的84.22%—84.83%. 以上优势菌群在淡水沉积物中已被广泛检出[10,28]. 顾诗云等[2]发现菖蒲根际细菌优势门类为变形菌门、拟杆菌门、绿弯菌门、酸杆菌门和厚壁菌门;秦玉春等[24]发现5种湿地植物根系沉积物优势菌门均为变形菌门、放线菌门和拟杆菌;寄博华等[15]同样发现变形菌门、绿弯菌、放线菌门以及酸杆菌门为滇池湖滨湿地3种优势挺水植物(菖蒲、芦苇、美人蕉)根区沉积物的优势细菌门. 这些优势细菌群落中,变形菌门在生物脱氮除磷和降解污染物等方面均发挥重要作用[11,17,24]. 绿弯菌门为光能自养菌,该类群可通过光合作用产生能量,在湿地中广泛存在,且与沉积物碳循环有关,具有发酵、固定二氧化碳(CO2)和乙酸化作用[23,30]. 绿弯菌门是本研究中相对丰度仅次于变形菌门的第二大优势细菌,现有研究证实菖蒲根际对绿弯菌门具有选择性,且随着菖蒲的生长其选择性不同[31]. 绿弯菌门可从环境中吸收和同化多种生物和非生物来源的有机物,菖蒲根区大量存在的绿弯菌门为其改善沉积物环境提供了有力条件. 放线菌门和酸杆菌门则被认为是重要的根际细菌[15,25],尤其是放线菌门,大部分固氮细菌以及部分硝化、反硝化细菌等菌属于该门类,在氮循环中占有重要地位[32]. 本文研究发现,随菖蒲的生长其根区沉积物芽单胞菌门以及甲基菌门(Methylomirabilota)等细菌类群相对丰度差异显著(Kruskal-wallis秩和检验,P<0.05),具体表现为:根区沉积物细菌芽单胞菌门、甲基菌门相对丰度随着菖蒲的生长而逐渐减少,其原因可能在于同一生境中,优势菌的丰度较高会对其它非优势菌群的生存产生压迫[31],从而导致其相对丰度的下降.
在纲水平(Class)上,相对丰度前10位的优势纲占据菖蒲根区及对照系统沉积物细菌群落的57.21% 和57.11%. γ‐变形菌纲(Gammaproteobacteria)、厌氧蝇菌纲(Anaerolineae)、α-变形菌纲(Alphaproteobacteria)、Vicinamibacteria和拟杆菌纲(Bacteroidia)为菖蒲根区沉积物细菌群落相对丰度前5的纲. 其中,α-变形菌纲和γ-变形菌纲属于变形菌门中2个亚类,该门还包括δ-变形菌纲(Deltaproteobacteria)和ε-变形菌纲(Epsilonproteobacteria)2个亚类. 拟杆菌纲是拟杆菌门中的优势类群,厌氧蝇菌纲则为绿弯菌门中主要亚类. 此外,共有6个纲在植物及对照系统中存在显著差异(Wilcoxon rank-sum test,P<0.05),且相对丰度均小于1%. 研究表明,α-变形菌纲、β-变形菌纲(Betaproteobacteria)和γ-变形菌纲含有许多反硝化细菌,可促使自养或异养反硝化过程[15,26]. 此外,刘忠航等[33]发现,α-变形菌纲中的部分菌群可以利用有机磷,加速有机磷的矿化,在沉积物磷元素循环中亦发挥重要作用.
而在目水平(Order)上,菖蒲根区及对照系统沉积物各样品共有13个目相对丰度小于1%的物种存在显著差异(Wilcoxon rank-sum test,P<0.05). 属水平(Genus),CA和CK组沉积物分别有15个和16个优势物种相对丰度大于1%,分别占26.87% 和29.44%;两组沉积物中细菌群落组成属水平上相对丰度小于 0.5% 的菌属分别占了51.29% 和48.26%. 统计分析后发现共有36个相对丰度低于 0.5% 的属在菖蒲根区以及对照沉积物二者间存在显著性差异(Wilcoxon rank-sum test,P<0.05). 综合纲、目、属水平的分析结果可知,菖蒲的生长可能对沉积物细菌群落中占比较小的物种产生更显著的影响.
植物不同生长阶段,其优势菌群的变化,可能与植物生长不同阶段所分泌的不同根系分泌物对微生物产生促进或抑制作用有关[11,34],也可能受根系泌氧的因素所致. 研究表明,植物根系在促使微生物富集等方面发挥着至关重要的作用[15]. 受植物物种以及所处生长阶段差异等因素的影响,植物根系形态、根系分泌物、根系泌氧量等呈现明显差异,这些因素将驱动植物根区微生物群落的影响变化[15]. 如张丁予[28]报道,根系发达的植物其分泌的营养物质可以有效地提高根际微生物的数量. 菖蒲是典型的挺水植物,其根系非常发达,属于毛发状须根,可扎入沉积物中并从多方面对沉积物产生影响. 一方面:本文研究证实了植物生长对根区沉积物理化参数的影响. 研究发现3次采样所获菖蒲根区沉积物pH值均小于无植物生长的沉积物,其原因在于植物根系呼吸释放二氧化碳以及分泌有机酸类物质,在一定程度上降低了沉积物pH值[20]. 此外,前人研究表明,菖蒲等挺水植物可通过径向泌氧(ROL)补充水体溶解氧[15,31],并因此对水-沉积物界面好氧微生物的生存提供条件. 本文研究证实了这一点,相对于无植物的对照沉积物,菖蒲根区沉积物存在更多的硝化螺旋菌属(Nitrospira)和亚硝酸菌属(Nitrosomonas),这与张丁予等[28]和Cordovez等[35]的研究一致,其发现根系越发达的植物其分泌的营养物质可以更有效地提高根际微生物的数量.
-
细菌是介导沉积物物质循环的主要微生物类群,在营养元素的生物地球化学循环中发挥着重要作用[36]. 沉积物细菌群落结构及物种组成的差异将在一定程度上影响其在物质循环中的潜力. 本文通过FAPROTAX对菖蒲根区及对照系统沉积物细菌代谢及生态功能进行注释,共得到67种细菌群落功能类型,相对丰度最高的为化能异养(chemoheterotrophy)(21.36% 和21.83%),其次为需氧化能异养(aerobic chemoheterotrophy)(14.35% 和14.84%),发酵(fermentation)、固氮作用(nitrogen fixation)、光能自养作用(Photoautotrophy)、硝酸盐还原功能(nitrate reduction)等功能类群的相对丰度介于1%—10% 之间(图5). 有6个功能类型在菖蒲根区及对照系统沉积物样品中表现出显著差异(P<0.05),分别为氮呼吸(nitrogen respiration)、硝酸盐呼吸(nitrate respiration)、无氧光自氧硫氧化(anoxygenic photoautotrophy S oxidizing)、厌氧自养性(anoxygenic photoautotrophy)、动物寄生虫或共生体(animal parasites or symbionts)以及human pathogens all,这些差异性的功能类群涉及到沉积物氮和硫的循环过程.
氮代谢是生物地球化学循环的关键过程. 研究表明,氮代谢一般包括同化、氨化、固氮、硝化、反硝化和厌氧氨氧化过程[36 − 37]. 本研究中发现,硝酸盐呼吸所占丰度最高,其次为尿素分解功能(ureolysis)和亚硝酸盐呼吸(nitrite respiration). 反硝化作用(denitrification)、硝酸盐氨化(nitrate ammoniation)、亚硝酸盐氨化(nitrite ammoniation)、氧化亚氮脱氮(nitrous oxide denitrification)、硝酸盐反硝化(nitrate denitrification)、硝化作用(nitrification)以及氮呼吸等相对丰度在菖蒲根区及对照系统发生变化,相对丰度均表现为CA>CK,例如对功能预测相对丰度前20的菌群进行分析后发现菖蒲根区沉积物细菌群落硝酸盐还原以及氮呼吸作用功能相对丰度分别为无植物的对照系统的1.17倍以及1.31倍,证实菖蒲的存在对沉积物氮循环过程产生一定的影响,这种影响将随菖蒲的不同生长阶段而有所变化.
在硫循环中,菖蒲根区沉积物显著增加了暗硫化物氧化作用(dark sulfide oxidation)(与CK相比相对丰度增加了5.36%). 菖蒲的存在降低了沉积物无氧光自氧硫氧化的相对丰度(仅为对照系统的0.43)(P<0.05).
-
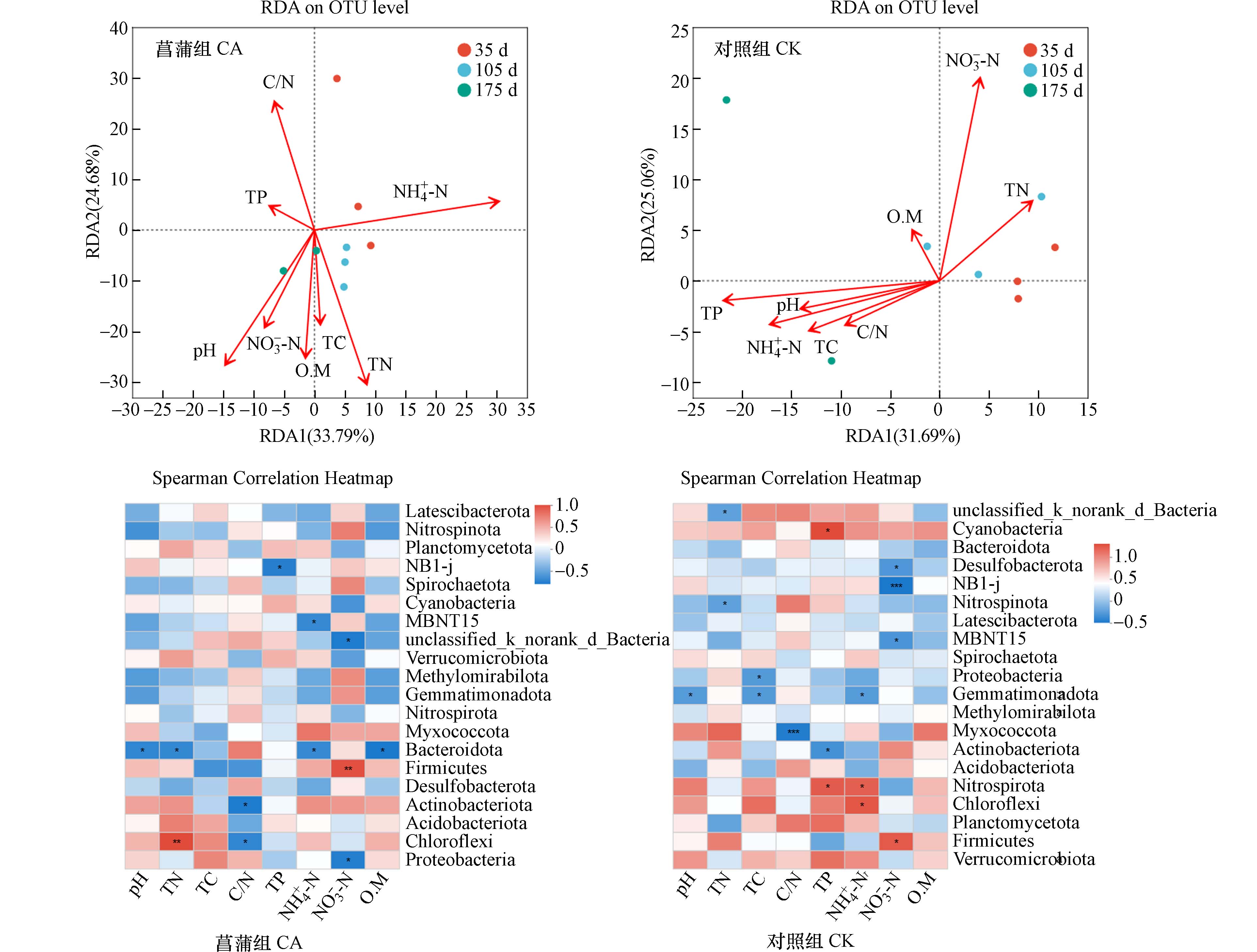
对沉积物理化参数与细菌群落Alpha多样性、Beta多样性以及群落物种组成以及功能特征间的作用关系进行分析. 结果发现,沉积物NO3−-N含量与Chao、Shannon和Sobs指数间呈显著相关关系(P<0.05),这与曹洋等[23]的研究相一致,其认为沉积物中细菌群落多样性随营养盐水平升高而下降.
基于Mantel分析(OTUs水平上)结果,菖蒲根区沉积物(Mantel r statistic:0.4046,P<0.05)和无植物对照系统沉积物(Mantel r statistic:0.4461,P<0.05)理化参数与细菌群落结构间存在显著相关关系(P<0.05). RDA分析(OTUs水平上)结果发现菖蒲根区以及对照沉积物理化特征对细菌群落结构变异的累计解释率分别为58.47% 和56.75%,菖蒲根区细菌群落受TN影响较多,而对照组则更受沉积物TP含量的影响. 这与马率等[17]的研究结果一致,其认为O.M和TN对沉积物微生物群落有明显的驱动作用.
除此之外,沉积物理化因子参数对细菌物种组成具有显著影响(图6). 如,对于菖蒲组而言,优势门变形菌门受沉积物NO3−-N的影响(P<0.05);绿弯菌门受到沉积物TN和C/N的影响(P<0.05);拟杆菌门则与沉积物pH、TN、NH4+-N以及O.M值之间存在显著相关关系(P<0.05);而对照组变形菌门受沉积物TC的显著影响(P<0.05).
-
挺水植物菖蒲的生长将提高植物根区沉积物细菌Alpha多样性并丰富细菌的物种组成,改变细菌群落的结构特征,这种影响随菖蒲生长发育的不同阶段而呈现显著差异. 基于FAPROTAX的功能预测证实了菖蒲的存在将对氮呼吸、硝酸盐呼吸、无氧光自氧S氧化以及无氧光自氧等涉及到沉积物氮和硫的循环过程的功能类群产生显著影响. 总之,本研究证实了菖蒲根区改变了沉积物原有细菌群落结构将引起沉积物细菌代谢及生态功能的变化,研究结果将对进一步揭示水生植物与微生物间的互作关系提供一定的依据.
挺水植物菖蒲根区沉积物细菌群落结构和功能特征分析
The structural and functional characteristics of the sedimentary bacterial community in the root area of Acorus calamus
-
摘要: 挺水植物根区是湖泊等淡水生态系统物质循环最为活跃的微生态区域之一. 为了进一步明确挺水植物在不同生长阶段对根区沉积物微生物的影响,本论文以挺水植物菖蒲(Acorus calamus)为研究对象,构建室外盆栽实验系统,采集实验第35、105和175 天时菖蒲根区及无植物对照系统沉积物样品,研究菖蒲生长发育对根区沉积物细菌群落及功能的影响. 结果表明,菖蒲根区沉积物共检测OTUs数量11659个,无植物的沉积物样品获得OTUs数量为10337个. 基于OTUs结果的分析发现,菖蒲根区沉积物Shannon、Sobs、ACE和Chao指数平均值表现为CA>CK;相比于对照组而言,菖蒲根区独有的OTUs数量略高,意味着菖蒲生长可能会丰富根区沉积物细菌的物种组成,尤其是对于细菌群落中相对丰度占比较小的物种产生显著影响;通过FAPROTAX对菖蒲根区及对照系统沉积物细菌代谢及生态功能进行注释,共得到67种细菌群落功能类型,以化能异养、需氧化能异养、发酵、固氮作用、光合自养、亚硝酸盐还原功能等类群为主,菖蒲的生长将提高氮循环功能类群的相对丰度从而对沉积物氮循环过程产生一定的影响,且这种影响将随菖蒲的不同生长阶段而有所变化. 沉积物理化参数是驱动菖蒲根区细菌群落的关键因子.Abstract: The root zone of emergent plants is one of the most active microecological regions for nutrients biogeochemical cycles in freshwater ecosystems. To further clarify the influence of different growth stages of emergent plants on the bacterial community and function in their root zone, Acorus calamus was chosen and used to construct the outdoor experiment system in this study. The sediments samples were collected from both Acorus calamus' root zone and the control system (non-plant sediment) on the 35, 105 and 175 days, respectively. A total of 11659 and 10337 OTUs were detected in Acorus calamus and control groups, respectively. The average values of Shannon, Sobs, ACE and Chao indexes were CA>CK. The number of unique OTUs in Acorus calamus root zone sediments was higher than in the non-plant control system. This suggests that plant growth may enrich the bacteria composition in their root zone, especially for the lower relative abundance species in the bacterial community. A total of 67 functional types of bacteria were predicted by FAPROTAX from the Acorus calamus root zone sediment and non-plant sediment. The main functional groups are chemoheterotrophic, aerobic heterotrophic, fermentation, nitrogen fixation, photosynthetic autotrophic, and nitrite reduction. The growth of Acorus calamus has the potential to increase the relative abundance of nitrogen cycling functional groups and have a certain impact on the nitrogen cycling process in sediment. This influence will vary with different growth stages of Acorus calamus. The bacterial community was influenced by the physicochemical parameters of the sediment in the root zone of Acorus calamus.
-
Key words:
- Acorus calamus /
- root zone /
- sediment /
- bacterial community /
- function
-
挺水植物(emergent macrophytes),作为水生植物的重要类型以及淡水水域重要的初级生产力之一,对淡水生态系统具有重要作用. 挺水植物地上组织(茎和叶)挺出水面,而地下组织(根或根茎)一般生长于水陆交界处浅水区域沉积物中[1 − 2]. 挺水植物主要从沉积物中获取生长所需营养物质[3 − 5],其庞大根系所在区域(根区)微生物数量和种类远高于非根区沉积物,形成明显的根际效应[6 − 8]. 因此,挺水植物根区是沉积物-根系-微生物三者紧密结合相互影响的关键场所,其影响可归纳为以下方面:一方面,挺水植物通过其根系向沉积物输送氧气,促进了好氧条件下营养元素的物质循环[9]. 如成水平等[10]发现植物根系泌氧将增强硝化过程提高沉积物硝态氮(NO3−-N)含量. 王文林等[9]则报道菖蒲成株根系的氧扩散能力显著高于幼苗阶段,这可能与植物叶面积以及根系生物量、根表面积的大小等有密切关系. 可见,挺水植物的氧气扩散能力受物种以及生长阶段的强烈影响;另一方面,挺水植物的根系能释放超过200种的分泌物,如糖、氨基酸、有机酸等,这些分泌物不仅影响根区沉积物的微生境,还为沉积物微生物提供了碳源和营养物质[11],使根际微生物的数量及代谢活性远高于非根际沉积物[12]. 因此,吴林坤等[13]等认为,根系分泌物对根际微生物具有选择塑造作用,其群落结构的独特性与代表性将受植物物种差异以及生长阶段的影响. 可见,物种及其生长阶段将是影响挺水植物根区微生物的关键因子.
菖蒲(Acorus calamus),天南星科菖蒲属,典型的多年生挺水植物,广泛分布于河流、沼泽以及湖泊岸边等浅水水域. 菖蒲根系发达,对氮、磷等营养盐有很强的吸收能力[2,9,14],加之其形态美观,常被用于人工湿地或园林景观中[7]. 近年来,关于菖蒲根区沉积物微生物已有一些研究报告. 如顾诗云等[2]研究了淹水胁迫对菖蒲生理特性及其根际细菌群落特征的影响. 寄博华[15]发现斗南湿地菖蒲植物群丛沉积物细菌群落的丰富度和多样性均最大,高于芦苇和美人蕉植物群从. 赵良元等[16]通过90 d的培养发现,菖蒲的生长可大大提高沉积物中微生物的活性及多样性. 但现有研究均仅为短期内针对菖蒲的培养实验所获得的结果,对不同生长阶段菖蒲根区沉积物微生物的变化特征的认识仍十分不足.
本研究通过为期 175 d的培养时间,基于16S-rRNA高通量测序技术并结合FAPOTAX功能预测,探究菖蒲根区沉积物细菌群落结构和功能特征在三个生长阶段(生长期、成熟期、衰亡期)的差异,以期进一步阐明挺水植物的生长对其根区细菌群落结构及其功能组成的影响.
1. 材料与方法 (Materials and methods)
1.1 植物和沉积物准备
本研究所用菖蒲和沉积物采自江苏大学校内湖泊(119°30′23'' E,32°11′58'' N),所采植物株高约60 cm,块状茎保持完整. 采样完成后,将植物样品迅速带回实验室后,用自来水冲洗根系以及植物表面泥土等供后续实验所用;表层沉积物(0—20 cm)样品带回实验室后用不锈钢网(20目)先过滤掉大颗粒以及各种杂质,然后使用混合器彻底将所采沉积物样品混合均匀,以确保各实验系统沉积物初始状态一致.
1.2 实验系统构建及样品采集
采用直径40 cm,深度60 cm的圆形桶作为实验容器. 首先在各实验桶中铺设预先混匀的30 cm厚沉积物,将所采植物种植于各实验桶(CA),随后沿桶壁注入自来水,注水深度为桶壁45 cm处;另设一组不种植植物的系统作为对照(CK,仅包含沉积物和水体). 实验组和对照组分别设置3组重复. 实验过程中,定期补充各实验桶中自来水,以确保上覆水始终在同一深度. 实验于2022年5月—11月在室外培养(培养环境可以避免降雨的影响),共培养175 d.
实验第35、105和175 天时分别采集各实验桶内沉积物样品,按照菖蒲生长习性,这3次采样时间可代表菖蒲的旺盛生长期、成熟期和衰亡期. 采集的沉积物随机分成两部分,一部分经干燥、研碎、混匀、过100目筛,自封袋封装,于4 ℃保存,供沉积物理化指标测定,另一部分于 −25 ℃条件下保存用于沉积物NO3−-N和微生物测定.
1.3 沉积物理化指标测定
沉积物pH值(固水比为2.5:1)采用pH计测定(雷磁PHSJ-3F,INESA,上海);沉积物全碳(TC)和总氮(TN)采用元素分析仪(Vario EL cube,德国)测定;沉积物硝态氮(NO3−-N)和氨态氮(NH4+-N)用 2 mol·L−1 氯化钾(KCL)浸提后用紫外可见分光光度计(N4)测定;有机物质(O.M)采用水合热重铬酸钾氧化-比色法(《土壤农化分析》)进行测定;总磷(TP)采用高氯酸-浓硫酸(HClO4-H2SO4)消煮后用钼锑抗比色法测定.
1.4 沉积物细菌测定
沉积物样品通过FastDNAchen® Spin Kit for Soil试剂盒提取总DNA,每个样本3个重复. 通过1%的琼脂凝胶电泳检测DNA提取质量,使用NanoDrop 2000测定DNA浓度和纯度. 采用细菌通用引物338F (5'- ACTCCTACGGGAGGCAGCAG-3') 和 806R (5'-GGACTACHVGGGTWTCTAAT-3') 对细菌16S rRNA 基因 V3-V4 区进行 PCR 扩增. PCR体系为 20 μL,含有 5×FastPfu Buffer 缓冲液 4 μL,2.5 mmol.L−1 d NTPs 2 μL,正向引物0.8 μL,反向引物0.8 μL,FastPfu 聚合酶 0.4 μL,BSA 0.2 μL,模板DNA 10 ng,最终ddH2O至 20 μL. PCR扩增程序为:95 ℃ 初始变性3 min,随后95 ℃ 变性30 s,55 ℃ 退火30 s,72 ℃ 延伸45 s共27个循环,最后72 ℃ 延伸10 min,10 ℃ 结束. PCR扩增产物通过2% 琼脂糖凝胶胶电泳检测,后委托上海美吉生物医药科技有限公司(Illumina Miseq PE300平台,美国)完成高通量测序.
1.5 数据的分析与处理
原始序列经质控、过滤、拼接后利用UPARSE 软件(http://drive5.com/uparse/)进行聚类,得到97% 相似水平下的操作分类单元(OTU). 本研究中按最小样本序列数将各样品抽平处理后共得到13835个OTUs. 基于所获OTUs,经RDP classifier(https://sourceforge.net/projects/rdp-classifier/,RDP:http://rdp.cme.msu.edu/)获得各样品细菌物种分类信息(分类置信度:0.7);通过Mothur软件计算各实验组沉积物样品细菌Alpha多样性指数(Shannon、Simpson、Sobs、ACE和Chao);采用非度量多维尺度分析(non-metric multidimensional scaling,NMDS)解析菖蒲根区及对照系统沉积物细菌群落Beta多样性;基于韦恩图(Venn)和柱形图研究沉积物细菌物种组成和相对丰度的变化;采用冗余分析(RDA)、相关热图分析(Correlation heatmap diagram)、排序回归分析(Sorting regression analysis)和 Mantel Test等方法评价细菌群落与沉积物理化参数之间的关系. 使用FAPROTAX(functional annotation of prokaryotic taxa)对微生物群落进行功能预测. 通过Wilcoxon秩和检验(对照组CK与菖蒲组CA)和 Kruskal-Wallis H检验(3个培养时间)对细菌群落Alpha多样性指数和优势门显著性差异进行检验;通过相似性分析(Analysis of similarities,ANOSIM)以及置换多元方差分析(Permutational Multivariate Analysis Of Variance,PERMANOVA)对群落结构差异进行统计学分析. 以上与微生物相关的分析均在美吉生物云平台在线完成 (http://cloud.majorbio.com). 其他数据(平均值±标准差)采用 Microsoft Excel和 SPSS 软件进行计算与分析. P<0.05和P<0.01分别为差异显著和差异极显著.
2. 结果与讨论 (Result and discussion)
2.1 沉积物的理化参数的变化
实验期间,菖蒲根区和对照系统中沉积物pH值分别介于7.15—7.91以及之间7.60—8.03,呈弱碱性(图1). 实验过程中菖蒲组沉积物pH值始终低于对照组,这与菖蒲根系活动及其根系分泌物有密切关系,其影响途径表现在:植物根系呼吸所释放的二氧化碳以及分泌的有机酸类等物质,在一定程度上降低了沉积物pH值[17];此外,植物根际微生物的活动所产生的酸性物质也可降低根际土壤pH值[13]. 张金萍[18]针对挺水植物香蒲的研究证实了同样的规律.
菖蒲根区沉积物TN、NH4+-N、NO3−-N的平均含量分别为1.07 g·kg−1、1.10 mg·kg−1和3.83 mg·kg−1,稍低于对照组氮素含量,其值分别为1.08 g·kg−1、1.43 mg·kg−1以及4.13 mg·kg−1(图1). 菖蒲根区沉积物和对照系统沉积物TC含量分别介于8.60—9.40 g·kg−1以及9.00—9.60 g·kg−1之间(图1),表现为对照>菖蒲. 菖蒲庞大的根系组织将吸收沉积物中碳氮磷等营养元素以供植物良好的生长发育,在这一过程中植物根区沉积物元素含量有所下降. 这与余居华等[4]研究的结果一致. 陈登等[19]同样证实水生植物水蕴草(Egeria densa)、狐尾藻(Myriophyllum verticillatum)和苦草(Vallisneria natans)能显著降低了沉积物铵态氮含量,除了植物根系的直接吸收外,根区沉积物氮循环菌所驱动的硝化-反硝化以及厌氧氨氧化等作用也是铵态氮含量降低的原因之一. 此外,生长过程中挺水植物往往通过根系释放氧气和氧化性物质[20],从而在植物根系表面形成铁锰氧化物胶膜等具有胶体性质的物质,可进一步促进植物根系对磷的吸收,降低根际沉积物磷元素的含量[18]. 对于O.M来说,植物根区及对照系统沉积物中含量分别为1.39—4.05 g·kg−1和1.33—3.93 g·kg−1(图1),表现为对照<菖蒲. 以上结果证实了菖蒲的生长对沉积物理化参数将产生一定的影响.
进一步分析了沉积物理化参数随采样时间的变化规律. 结果发现(图1),菖蒲根区沉积物TN、NH4+-N、O.M以及pH值大小顺序为105 d>175 d>35 d;TP表现为:175 d>35 d>105 d;TC含量表现为175 d>105 d>35 d,沉积物C/N则表现为35 d>175 d>105 d,表明植物根区沉积物理化参数随植物生长发育而波动变化. 对于菖蒲而言,从快速生长期到成熟期,植物快速生长,根系活力增强,植物需从沉积物中获取大量氮素用于自身生长发育,对周围环境的影响也较大;如王文林等[9]利用溶氧微电极发现,菖蒲幼苗、成株根系的不同部位均存在从根表面至沉积物氧饱和度由高到低的氧扩散层,证实了不同生长阶段菖蒲根系氧扩散能力的差异. 加之本研究在该时间段环境温度较高(平均温度29.8 ℃),加剧了沉积物中微生物的生长代谢过程. 当植物进入衰亡阶段,植物生理活动减缓,且逐渐开始衰亡,部分植物残体及根系脱落物等进入沉积物并开始腐烂,在短时间内可增加沉积物元素含量. 对于对照系统沉积物而言,沉积物TN、NO3−-N以及O.M值最高值出现在实验第105 d,NH4+-N、TC、TP以及pH值峰值则出现在实验第175 d;沉积物C/N在实验第35 d最高,其次为175 d,最低值出现在实验第105 d. 由此可见,实验过程中,无植物的对照系统以及菖蒲根区沉积物理化因子均随培养时间呈现不同变化趋势的波动.
2.2 菖蒲根区及对照系统沉积物细菌群落特征分析
对3个采样时间所采菖蒲根区及对照系统沉积物样品进行高通量测序及数据分析,共得到13835个OTUs,分属64门、201纲、477目、768科、1430属和3256种. 其中,菖蒲根区沉积物样品中共检测到OTUs共计11659个(细菌63门196纲455目733科1339属2991种),对照组沉积物共获得OTUs数量为10337个(细菌62门196纲450目709科1290属2863种). 基于OTUs,对沉积物中细菌群落Alpha多样性、Beta多样性以及物种组成特征等进行分析.
2.2.1 菖蒲根区及对照系统沉积物细菌群落Alpha多样性差异分析
细菌群落的多样性对于维持沉积物的稳定性和功能具有重要的生态意义[21 − 22]. Shannon和Simpson指数指示了物种的多样性,Shannon指数与物种多样性成正比,该指数越大,群落多样性就越高[15],而Simpson指数则与物种多样性成反比[23];Sobs、ACE和Chao指数表示了物种的丰富度,指数越大意味着群落丰富度越高[15]. 本研究对菖蒲根区及对照沉积物细菌群落Alpha多样性指数(Shannon、Simpson、Sobs、ACE和Chao)的统计结果见图2所示. 沉积物细菌群落Shannon、Sobs、ACE和Chao指数平均值表现为CA>CK,而Simpson指数平均值则切好相反,表明菖蒲的生长在一定程度上提高了沉积物细菌的丰富度以及多样性(图2). 马玉等[20]利用菖蒲湿地处理含油废水时同样发现菖蒲根区功能性微生物种类和数量多于对照区域,这与植物庞大的根系为微生物附着提供的更大的表面积和附着点[24]以及植物根系分泌物为附着微生物提供碳源和营养物质等有密切关系[19,25]. 此外,植物根系可以通过一系列行为,如改变水流速度、沉降特性和水里传导率等[26],为细菌的粘附和生长提供有力的条件,从而提高沉积物中的微生物的多样性.
进一步,对三个采样时间沉积物样品Alpha多样性指数进行分析(图2). 由图2可知,CA组沉积物Sobs、ACE和Chao指数随实验时间的增加呈增加趋势,表现为35 d<105 d<175 d. 基于Kruskal-Wallis秩和检验,ACE、Chao和Sobs指数在第35和第175 天之间存在显著性差异(P<0.05),ACE、Sobs指数在第105 天与第175 天亦有显著差异(P<0.05). ACE、Chao和Sobs指数的变化证实了菖蒲的不同生长阶段对其根区沉积物细菌群落丰富度将产生不同的影响. CA组沉积物Shannon指数最高值分别出现在实验第175 d,最低值出现在105 d,Simpson指数变化趋势与Shannon值恰好相反,即105 d>35 d>175 d. 线性回归模型显示,ACE、Sobs和Chao指数与培养时间成显著正相关(ACE指数:y=5.058x+5495.908,P<0.01;Sobs指数:y=2.644x+4071.042,P<0.01;Chao指数:y=4.153x+5290.131,P<0.01).
2.2.2 菖蒲根区及对照系统沉积物细菌群落Beta多样性
细菌群落Beta多样性主要聚焦于不同生境间微生物群落结构多样性的比较[23,27],群落结构特征的差异是微生物与所处生境相互响应的结果[23]. 基于Bray-Curtis距离算法(OTUs水平)通过NMDS对各实验组沉积物细菌群落结构进化了可视化分析(图3). 由图3可知,CK和CA实验组沉积物细菌群落结构可分成重叠的两个区域,PERMANOVA结果证实了两个系统沉积物细菌群落结构无显著差异(F=0.950;R2=0.056;P>0.01). 尽管CK和CA实验组沉积物细菌群落结构呈现重叠,但图3显示,无植物的对照系统各样点间距离较近,意味着对照系统各样点沉积物细菌群落结构波动较小,而菖蒲根区沉积物各样品间更为离散,表明菖蒲系统中沉积物细菌群落结构变化较大,这可能是菖蒲在生长过程对沉积物的影响所致. 由图3可知,同一时间所采样品集聚起来,3个采样时间菖蒲根区沉积物细菌群落则明显区分成3个区域,尤其是第35 天所采样品与第105和175 天时区分明显(ANOSIM,P<0.01). PERMANOVA进一步验证了3个采样时间菖蒲根区沉积物细菌群落结构差异显著(F=1.64;R2=0.353;P<0.01). 张丁予等[28]等同样发现,植物根区沉积物微生物群落结构随着生长周期变化而变化,而且时间越长差异越显著,这与植物不同生长阶段根系活力以及根系分泌物的变化有密切关系. 植物生长过程中,其根系可分泌包括糖、氨基酸、有机酸、生物酶等多达200种以上的物质,这些物质敏感地响应植物的不同生长状态,并因此为微生物的生存创造良好的条件[1, 29].
2.2.3 菖蒲根区及对照系统沉积物细菌群落组成
基于OTUs绘制韦恩图对菖蒲根区及对照系统各样品中共有和独有细菌进行分析(图4). 由图4a可知,整个实验过程中,菖蒲根区及对照系统中共有的细菌OTUs为8161,占OTUs总数的58.99%,意味着超50% 的细菌同时存在于菖蒲根区以及无植物的对照系统沉积物中. 进一步分析后发现,菖蒲根区沉积物和对照组沉积物样品中独有的OTUs数量分别为3498和2176,分别占总OTUs的25.28% 以及15.73%,独有的OTUs反映了不同来源样本中细菌群落组成的差异性. 相比于对照组而言,菖蒲根区独有的OTUs数量略高,意味着植物生长可能会丰富根区沉积物细菌的物种组成,在植物根区沉积物中细菌群落的多样性更好,物种组成更为丰富,这与菖蒲根区沉积物细菌Alpha多样性的结果一致.
门水平(Phylum)上(图4b),菖蒲根区和无对照系统沉积物细菌群落相对丰度前10的门主要为变形菌门(Proteobacteria,21.21% 和19.34%),绿弯菌门(Chloroflexi,17.29% 和17.42%)、酸杆菌门(Acidobacteriota,13.05% 和14.30%)、放线菌门(Actinobacteriota,10.60% 和11.69%)、厚壁菌门(Firmicutes,4.539% 和5.474%)、脱硫菌门(Desulfobacterota,5.192% 和4.613%)、拟杆菌门(Bacteroidota,4.258% 和4.358%)、粘菌门(Myxococcota,3.871% 和3.524%)、硝化螺旋门(Nitrospirota,2.569% 和2.384%)和芽单胞菌门(Gemmatimonadota,1.648% 和1.734%),这10类约占总测序序列的84.22%—84.83%. 以上优势菌群在淡水沉积物中已被广泛检出[10,28]. 顾诗云等[2]发现菖蒲根际细菌优势门类为变形菌门、拟杆菌门、绿弯菌门、酸杆菌门和厚壁菌门;秦玉春等[24]发现5种湿地植物根系沉积物优势菌门均为变形菌门、放线菌门和拟杆菌;寄博华等[15]同样发现变形菌门、绿弯菌、放线菌门以及酸杆菌门为滇池湖滨湿地3种优势挺水植物(菖蒲、芦苇、美人蕉)根区沉积物的优势细菌门. 这些优势细菌群落中,变形菌门在生物脱氮除磷和降解污染物等方面均发挥重要作用[11,17,24]. 绿弯菌门为光能自养菌,该类群可通过光合作用产生能量,在湿地中广泛存在,且与沉积物碳循环有关,具有发酵、固定二氧化碳(CO2)和乙酸化作用[23,30]. 绿弯菌门是本研究中相对丰度仅次于变形菌门的第二大优势细菌,现有研究证实菖蒲根际对绿弯菌门具有选择性,且随着菖蒲的生长其选择性不同[31]. 绿弯菌门可从环境中吸收和同化多种生物和非生物来源的有机物,菖蒲根区大量存在的绿弯菌门为其改善沉积物环境提供了有力条件. 放线菌门和酸杆菌门则被认为是重要的根际细菌[15,25],尤其是放线菌门,大部分固氮细菌以及部分硝化、反硝化细菌等菌属于该门类,在氮循环中占有重要地位[32]. 本文研究发现,随菖蒲的生长其根区沉积物芽单胞菌门以及甲基菌门(Methylomirabilota)等细菌类群相对丰度差异显著(Kruskal-wallis秩和检验,P<0.05),具体表现为:根区沉积物细菌芽单胞菌门、甲基菌门相对丰度随着菖蒲的生长而逐渐减少,其原因可能在于同一生境中,优势菌的丰度较高会对其它非优势菌群的生存产生压迫[31],从而导致其相对丰度的下降.
在纲水平(Class)上,相对丰度前10位的优势纲占据菖蒲根区及对照系统沉积物细菌群落的57.21% 和57.11%. γ‐变形菌纲(Gammaproteobacteria)、厌氧蝇菌纲(Anaerolineae)、α-变形菌纲(Alphaproteobacteria)、Vicinamibacteria和拟杆菌纲(Bacteroidia)为菖蒲根区沉积物细菌群落相对丰度前5的纲. 其中,α-变形菌纲和γ-变形菌纲属于变形菌门中2个亚类,该门还包括δ-变形菌纲(Deltaproteobacteria)和ε-变形菌纲(Epsilonproteobacteria)2个亚类. 拟杆菌纲是拟杆菌门中的优势类群,厌氧蝇菌纲则为绿弯菌门中主要亚类. 此外,共有6个纲在植物及对照系统中存在显著差异(Wilcoxon rank-sum test,P<0.05),且相对丰度均小于1%. 研究表明,α-变形菌纲、β-变形菌纲(Betaproteobacteria)和γ-变形菌纲含有许多反硝化细菌,可促使自养或异养反硝化过程[15,26]. 此外,刘忠航等[33]发现,α-变形菌纲中的部分菌群可以利用有机磷,加速有机磷的矿化,在沉积物磷元素循环中亦发挥重要作用.
而在目水平(Order)上,菖蒲根区及对照系统沉积物各样品共有13个目相对丰度小于1%的物种存在显著差异(Wilcoxon rank-sum test,P<0.05). 属水平(Genus),CA和CK组沉积物分别有15个和16个优势物种相对丰度大于1%,分别占26.87% 和29.44%;两组沉积物中细菌群落组成属水平上相对丰度小于 0.5% 的菌属分别占了51.29% 和48.26%. 统计分析后发现共有36个相对丰度低于 0.5% 的属在菖蒲根区以及对照沉积物二者间存在显著性差异(Wilcoxon rank-sum test,P<0.05). 综合纲、目、属水平的分析结果可知,菖蒲的生长可能对沉积物细菌群落中占比较小的物种产生更显著的影响.
植物不同生长阶段,其优势菌群的变化,可能与植物生长不同阶段所分泌的不同根系分泌物对微生物产生促进或抑制作用有关[11,34],也可能受根系泌氧的因素所致. 研究表明,植物根系在促使微生物富集等方面发挥着至关重要的作用[15]. 受植物物种以及所处生长阶段差异等因素的影响,植物根系形态、根系分泌物、根系泌氧量等呈现明显差异,这些因素将驱动植物根区微生物群落的影响变化[15]. 如张丁予[28]报道,根系发达的植物其分泌的营养物质可以有效地提高根际微生物的数量. 菖蒲是典型的挺水植物,其根系非常发达,属于毛发状须根,可扎入沉积物中并从多方面对沉积物产生影响. 一方面:本文研究证实了植物生长对根区沉积物理化参数的影响. 研究发现3次采样所获菖蒲根区沉积物pH值均小于无植物生长的沉积物,其原因在于植物根系呼吸释放二氧化碳以及分泌有机酸类物质,在一定程度上降低了沉积物pH值[20]. 此外,前人研究表明,菖蒲等挺水植物可通过径向泌氧(ROL)补充水体溶解氧[15,31],并因此对水-沉积物界面好氧微生物的生存提供条件. 本文研究证实了这一点,相对于无植物的对照沉积物,菖蒲根区沉积物存在更多的硝化螺旋菌属(Nitrospira)和亚硝酸菌属(Nitrosomonas),这与张丁予等[28]和Cordovez等[35]的研究一致,其发现根系越发达的植物其分泌的营养物质可以更有效地提高根际微生物的数量.
2.3 菖蒲根区及对照系统沉积物细菌功能预测分析
细菌是介导沉积物物质循环的主要微生物类群,在营养元素的生物地球化学循环中发挥着重要作用[36]. 沉积物细菌群落结构及物种组成的差异将在一定程度上影响其在物质循环中的潜力. 本文通过FAPROTAX对菖蒲根区及对照系统沉积物细菌代谢及生态功能进行注释,共得到67种细菌群落功能类型,相对丰度最高的为化能异养(chemoheterotrophy)(21.36% 和21.83%),其次为需氧化能异养(aerobic chemoheterotrophy)(14.35% 和14.84%),发酵(fermentation)、固氮作用(nitrogen fixation)、光能自养作用(Photoautotrophy)、硝酸盐还原功能(nitrate reduction)等功能类群的相对丰度介于1%—10% 之间(图5). 有6个功能类型在菖蒲根区及对照系统沉积物样品中表现出显著差异(P<0.05),分别为氮呼吸(nitrogen respiration)、硝酸盐呼吸(nitrate respiration)、无氧光自氧硫氧化(anoxygenic photoautotrophy S oxidizing)、厌氧自养性(anoxygenic photoautotrophy)、动物寄生虫或共生体(animal parasites or symbionts)以及human pathogens all,这些差异性的功能类群涉及到沉积物氮和硫的循环过程.
氮代谢是生物地球化学循环的关键过程. 研究表明,氮代谢一般包括同化、氨化、固氮、硝化、反硝化和厌氧氨氧化过程[36 − 37]. 本研究中发现,硝酸盐呼吸所占丰度最高,其次为尿素分解功能(ureolysis)和亚硝酸盐呼吸(nitrite respiration). 反硝化作用(denitrification)、硝酸盐氨化(nitrate ammoniation)、亚硝酸盐氨化(nitrite ammoniation)、氧化亚氮脱氮(nitrous oxide denitrification)、硝酸盐反硝化(nitrate denitrification)、硝化作用(nitrification)以及氮呼吸等相对丰度在菖蒲根区及对照系统发生变化,相对丰度均表现为CA>CK,例如对功能预测相对丰度前20的菌群进行分析后发现菖蒲根区沉积物细菌群落硝酸盐还原以及氮呼吸作用功能相对丰度分别为无植物的对照系统的1.17倍以及1.31倍,证实菖蒲的存在对沉积物氮循环过程产生一定的影响,这种影响将随菖蒲的不同生长阶段而有所变化.
在硫循环中,菖蒲根区沉积物显著增加了暗硫化物氧化作用(dark sulfide oxidation)(与CK相比相对丰度增加了5.36%). 菖蒲的存在降低了沉积物无氧光自氧硫氧化的相对丰度(仅为对照系统的0.43)(P<0.05).
2.4 沉积物细菌群落影响因子分析
对沉积物理化参数与细菌群落Alpha多样性、Beta多样性以及群落物种组成以及功能特征间的作用关系进行分析. 结果发现,沉积物NO3−-N含量与Chao、Shannon和Sobs指数间呈显著相关关系(P<0.05),这与曹洋等[23]的研究相一致,其认为沉积物中细菌群落多样性随营养盐水平升高而下降.
基于Mantel分析(OTUs水平上)结果,菖蒲根区沉积物(Mantel r statistic:0.4046,P<0.05)和无植物对照系统沉积物(Mantel r statistic:0.4461,P<0.05)理化参数与细菌群落结构间存在显著相关关系(P<0.05). RDA分析(OTUs水平上)结果发现菖蒲根区以及对照沉积物理化特征对细菌群落结构变异的累计解释率分别为58.47% 和56.75%,菖蒲根区细菌群落受TN影响较多,而对照组则更受沉积物TP含量的影响. 这与马率等[17]的研究结果一致,其认为O.M和TN对沉积物微生物群落有明显的驱动作用.
除此之外,沉积物理化因子参数对细菌物种组成具有显著影响(图6). 如,对于菖蒲组而言,优势门变形菌门受沉积物NO3−-N的影响(P<0.05);绿弯菌门受到沉积物TN和C/N的影响(P<0.05);拟杆菌门则与沉积物pH、TN、NH4+-N以及O.M值之间存在显著相关关系(P<0.05);而对照组变形菌门受沉积物TC的显著影响(P<0.05).
3. 结论 (Conclusion)
挺水植物菖蒲的生长将提高植物根区沉积物细菌Alpha多样性并丰富细菌的物种组成,改变细菌群落的结构特征,这种影响随菖蒲生长发育的不同阶段而呈现显著差异. 基于FAPROTAX的功能预测证实了菖蒲的存在将对氮呼吸、硝酸盐呼吸、无氧光自氧S氧化以及无氧光自氧等涉及到沉积物氮和硫的循环过程的功能类群产生显著影响. 总之,本研究证实了菖蒲根区改变了沉积物原有细菌群落结构将引起沉积物细菌代谢及生态功能的变化,研究结果将对进一步揭示水生植物与微生物间的互作关系提供一定的依据.
-
-
[1] 寻亚非, 李映雪, 王佳俊, 等. 拉鲁湿地植物和底泥氮磷生态化学计量学特征[J]. 环境化学, 2021, 40(7): 2105-2114. doi: 10.7524/j.issn.0254-6108.2020082901 XUN Y F, LI Y X, WANG J J, et al. Ecological stoichiometry characteristics of nitrogen and phosphorus in plants and sediments in Lhalu wetland[J]. Environmental Chemistry, 2021, 40(7): 2105-2114 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020082901
[2] 顾诗云, 杨飞, 张毅敏, 等. 淹水胁迫对菖蒲生理特性及其根际细菌群落特征的影响[J]. 生态与农村环境学报, 2020, 36(4): 488-498. GU S Y, YANG F, ZHANG Y M, et al. Effects of flooding stress on physiological characteristics and rhizosphere bacterial community of Acorus calamus[J]. Journal of Ecology and Rural Environment, 2020, 36(4): 488-498 (in Chinese).
[3] CRUMP B C, AMARAL-ZETTLER L A, KLING G W. Microbial diversity in Arctic freshwaters is structured by inoculation of microbes from soils[J]. The ISME Journal, 2012, 6(9): 1629-1639. doi: 10.1038/ismej.2012.9 [4] 余居华, 王乐豪, 康得军, 等. 湖滨带芦苇恢复过程中沉积物氮赋存形态及含量变化: 以巢湖为例[J]. 湖泊科学, 2021, 33(5): 1467-1477. doi: 10.18307/2021.0514 YU J H, WANG L H, KANG D J, et al. Temporal changes in fractions and loading of sediment nitrogen during the holistic growth period of Phragmites australis in littoral Lake Chaohu, China[J]. Journal of Lake Sciences, 2021, 33(5): 1467-1477 (in Chinese). doi: 10.18307/2021.0514
[5] 黄红林, 吕丽丽, 吕继涛, 等. 根际化学与生物多样性的表征方法: 组学技术的机遇与挑战[J]. 环境化学, 2024, 43(1): 210-223. doi: 10.7524/j.issn.0254-6108.2022083002 HUANG H L, LYU L L, LYU J T, et al. Characterization methods of rhizosphere chemo-and biodiversity: Opportunities and challenges of omics technology[J]. Environmental Chemistry, 2024, 43(1): 210-223 (in Chinese) doi: 10.7524/j.issn.0254-6108.2022083002
[6] 方娇慧. 湿地类型/挺水植物对淡水湿地沉积物微生物群落的影响机制[D]. 济南: 山东大学, 2020. FANG J H. The Influence Mechanisms of Wetland Types/Emergent Plants on the Microbial Communities in Freshwater Wetland Sediments[D]. Jinan: Shandong University, 2020 (in Chinese).
[7] 陈信含, 张建, 胡振, 等. 典型人工湿地系统中植物对苯并[a]芘的去除作用及机制[J]. 环境化学, 2023, 42(3): 1042-1048. doi: 10.7524/j.issn.0254-6108.2022101706 CHEN X H, ZHANG J, HU Z, et al. Removal of benzo[a]pyrene by plants in typical constructed wetland system and its mechanism[J]. Environmental Chemistry, 2023, 42(3): 1042-1048 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022101706
[8] LI X, LI Y Y, WU J S. Different in root exudates and rhizosphere microorganisms effect on nitrogen removal between three emergent aquatic plants in surface flow constructed wetlands[J]. Chemosphere, 2023, 337: 139422. doi: 10.1016/j.chemosphere.2023.139422 [9] 王文林, 王国祥, 万寅婧, 等. 光照和生长阶段对菖蒲根系泌氧的影响[J]. 生态学报, 2013, 33(12): 3688-3696. doi: 10.5846/stxb201209091269 WANG W L, WANG G X, WAN Y J, et al. The influence of light and growth stage on oxygen diffusion capacity of Acorus calamus roots[J]. Acta Ecologica Sinica, 2013, 33(12): 3688-3696 (in Chinese). doi: 10.5846/stxb201209091269
[10] 成水平, 吴振斌, 夏宜琤. 水生植物的气体交换与输导代谢[J]. 水生生物学报, 2003, 27(4): 413-417. doi: 10.3321/j.issn:1000-3207.2003.04.016 CHENG S P, WU Z B, XIA Y C. Review on gas exchange and transportation in macrophytes[J]. Acta Hydrobiologica Sinica, 2003, 27(4): 413-417 (in Chinese). doi: 10.3321/j.issn:1000-3207.2003.04.016
[11] 刘相粉, 王川, 何鹏, 等. 宁夏沙湖沉水植物恢复初期沉积物细菌群落特征研究[J]. 水生态学杂志, 2023, 44(1): 92-100. LIU X F, WANG C, HE P, et al. Sediment bacterial community structure during restoration of submerged macrophytes in Shahu Lake, Ningxia[J]. Journal of Hydroecology, 2023, 44(1): 92-100 (in Chinese).
[12] ZHANG F, SHEN J, LI L, et al. An overview of rhizosphere processes related with plant nutrition in major cropping systems in China[J]. Plant and Soil, 2004, 260(1): 89-99. [13] 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3): 298-310. doi: 10.3724/SP.J.1258.2014.00027 WU L K, LIN X M, LIN W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates[J]. Chinese Journal of Plant Ecology, 2014, 38(3): 298-310 (in Chinese). doi: 10.3724/SP.J.1258.2014.00027
[14] 郭鹤方, 甄志磊, 赵林婷, 等. 潮汐流-潜流人工湿地对城市污染水体中氮的去除[J]. 环境化学, 2021, 40(12): 3887-3897. doi: 10.7524/j.issn.0254-6108.2021053002 GUO H F, ZHEN Z L, ZHAO L T, et al. Research on the removal effect of tidal flow–subsurface flow constructed wetland on nitrogen in urban polluted water[J]. Environmental Chemistry, 2021, 40(12): 3887-3897 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021053002
[15] 寄博华, 李玮, 常军军, 等. 滇池湖滨湿地不同挺水植物区沉积物细菌群落结构特征[J]. 生态与农村环境学报, 2020, 36(3): 390-398. JI B H, LI W, CHANG J J, et al. Characteristics of bacterial community structure in sediments with different emergent plants in Dianchi lakeside wetland[J]. Journal of Ecology and Rural Environment, 2020, 36(3): 390-398 (in Chinese).
[16] 赵良元, 陶晶祥, 刘敏. 水生植物对沉积物微生物群落功能多样性的影响[J]. 长江科学院院报, 2015, 32(6): 81-86. ZHAO L Y, TAO J X, LIU M. Effects of aquatic macrophyte planting on functional diversity of microbial community in sediment[J]. Journal of Yangtze River Scientific Research Institute, 2015, 32(6): 81-86 (in Chinese).
[17] 马率. 武昌湖挺水植物-沉积物微生物与营养元素的互作机制研究[D]. 北京: 北京科技大学, 2023. MA L. The Research of Interaction Mechanisms between Plant-Sediment Microbial System and Nutrient Elements in the Wuchang Lake[D]. Beijing: University of Science and Technology Beijing, 2023 (in Chinese).
[18] 张金萍. 挺水植物根际沉积物氨氧化微生物生态分布特征及硝化作用研究[D]. 镇江: 江苏大学, 2015. ZHANG J P. Study on ecological distribution characteristics and nitrification of ammonia-oxidizing microorganisms in rhizosphere sediments of emergent plants[D]. Zhenjiang: Jiangsu University, 2015 (in Chinese).
[19] 陈登, 蔡启佳, 田翠翠. 3种沉水植物根际对沉积物中典型氮循环微生物功能基因丰度的影响[J]. 云南农业大学学报(自然科学), 2018, 33(2): 314-323. CHEN D, CAI Q J, TIAN C C. Effects of the rhizospheres of three submerged plants on the abundances of functional genes of typical nitrogen cycle microorganisms in sediments[J]. Journal of Yunnan Agricultural University (Natural Science), 2018, 33(2): 314-323 (in Chinese).
[20] 马玉, 肖昕. 菖蒲湿地处理含油废水中微生物与净化效果[J]. 工业水处理, 2019, 39(8): 81-85. doi: 10.11894/iwt.2018-0647 MA Y, XIAO X. Microorganisms and purification efficiency in oily wastewater treatment by calamus wetland[J]. Industrial Water Treatment, 2019, 39(8): 81-85 (in Chinese). doi: 10.11894/iwt.2018-0647
[21] SHI S J, NUCCIO E, HERMAN D J, et al. Successional trajectories of rhizosphere bacterial communities over consecutive seasons[J]. mBio, 2015, 6(4): e00746. [22] 余俊琪, 徐一峰, 郭瑶, 等. 沉积物镉污染下苦草与根际微生物群落响应特征[J]. 水生生物学报, 2023, 47(11): 1787-1797. doi: 10.7541/2023.2023.0034 YU J Q, XU Y F, GUO Y, et al. Response characteristics of Vallisneria natans and rhizosphere microbial community under sediment-cadmium pollution[J]. Acta Hydrobiologica Sinica, 2023, 47(11): 1787-1797 (in Chinese). doi: 10.7541/2023.2023.0034
[23] 曹洋, 孙鹤铭, 刘利, 等. 冬季衡水湖沉积物微生物群落结构特征及影响因素[J]. 环境工程技术学报, 2023, 13(1): 154-163. doi: 10.12153/j.issn.1674-991X.20210652 CAO Y, SUN H M, LIU L, et al. Microbial community structure characteristics and influencing factors in sediments of Hengshui Lake in winter[J]. Journal of Environmental Engineering Technology, 2023, 13(1): 154-163 (in Chinese). doi: 10.12153/j.issn.1674-991X.20210652
[24] 秦玉春, 邹涛, 张璇, 等. 氧氟沙星胁迫下5种湿地植物及其根系微生物群落的差异性响应[J]. 环境工程技术学报, 2023, 13(3): 1079-1087. doi: 10.12153/j.issn.1674-991X.20220380 QIN Y C, ZOU T, ZHANG X, et al. Differential responses of five wetland plants and their root microbial communities under ofloxacin pollution stress[J]. Journal of Environmental Engineering Technology, 2023, 13(3): 1079-1087 (in Chinese). doi: 10.12153/j.issn.1674-991X.20220380
[25] FRENZEL P, ROTHFUSS F, CONRAD R. Oxygen profiles and methane turnover in a flooded rice microcosm[J]. Biology and Fertility of Soils, 1992, 14(2): 84-89. doi: 10.1007/BF00336255 [26] SHELEF O, GROSS A, RACHMILEVITCH S. Role of plants in a constructed wetland: Current and new perspectives[J]. Water, 2013, 5(2): 405-419. doi: 10.3390/w5020405 [27] 宋超, 裘丽萍, 孟顺龙, 等. 人工模拟不同种植密度下四种水生植物的生长状况及对氮、磷的去除[J]. 农业环境科学学报, 2014, 33(1): 178-184. doi: 10.11654/jaes.2014.01.023 SONG C, QIU L P, MENG S L, et al. Growth of four aquatic plants and their removal of total nitrogen and total phosphorus in eutrophication water under different plant density: A laboratory experiment[J]. Journal of Agro-Environment Science, 2014, 33(1): 178-184 (in Chinese). doi: 10.11654/jaes.2014.01.023
[28] 张丁予. 菹草对沉积物微生物群落结构及磷迁移转化的影响研究[D]. 南京: 南京师范大学, 2016. ZHANG D Y. Effects of Potamogeton crispus on microbial community structure and phosphorus migration and transformation in sediments[D]. Nanjing: Nanjing Normal University, 2016 (in Chinese).
[29] AJILOGBA C F, OLANREWAJU O S, BABALOLA O O. Plant growth stage drives the temporal and spatial dynamics of the bacterial microbiome in the rhizosphere of Vigna subterranea[J]. Frontiers in Microbiology, 2022, 13: 825377. doi: 10.3389/fmicb.2022.825377 [30] FAZAL A, YANG M K, WEN Z L, et al. Differential microbial assemblages associated with shikonin-producing Borage species in two distinct soil types[J]. Scientific Reports, 2021, 11(1): 10788. doi: 10.1038/s41598-021-90251-1 [31] YANG W, JEELANI N, ZHU Z H, et al. Alterations in soil bacterial community in relation to Spartina alterniflora Loisel. invasion chronosequence in the eastern Chinese coastal wetlands[J]. Applied Soil Ecology, 2019, 135: 38-43. doi: 10.1016/j.apsoil.2018.11.009 [32] 程铁涵, 周昕彦, 曹玉成, 等. 氮形态对沉水植物氮磷去除效果及沉积微生物群落结构的影响[J]. 山东农业大学学报(自然科学版), 2022, 53(4): 560-567. CHENG T H, ZHOU X Y, CAO Y C, et al. Effects of nitrogen forms on nitrogen and phosphorus removal efficiency of submerged plants and microbial community structure in sediments[J]. Journal of Shandong Agricultural University (Natural Science Edition), 2022, 53(4): 560-567 (in Chinese).
[33] 刘忠航. 双齿围沙蚕对养殖池塘沉积物氮磷赋存形态和微生物群落的影响[D]. 上海: 上海海洋大学, 2022. LIU Z H. Effects of Perinereis Aibuhitensis on the Occurrence Form of Nitrogen and Phosphorus and Microbial Community Composition in Pond Sediments[D]. Shanghai: Shanghai Ocean University, 2022 (in Chinese).
[34] HEMPEL M, BOTTÉ S E, NEGRIN V L, et al. The role of the smooth cordgrass Spartina alterniflora and associated sediments in the heavy metal biogeochemical cycle within Bahía Blanca Estuary salt marshes[J]. Journal of Soils and Sediments, 2008, 8(5): 289-297. doi: 10.1007/s11368-008-0027-z [35] CORDOVEZ V, ROTONI C, DINI-ANDREOTE F, et al. Successive plant growth amplifies genotype-specific assembly of the tomato rhizosphere microbiome[J]. Science of the Total Environment, 2021, 772: 144825. doi: 10.1016/j.scitotenv.2020.144825 [36] 杨文焕, 甄玉, 姚植, 等. 高原盐化湖泊沉积物氮代谢特征解析[J]. 中国环境科学, 2023, 43(3): 1328-1339. doi: 10.3969/j.issn.1000-6923.2023.03.034 YANG W H, ZHEN Y, YAO Z, et al. Characterization for nitrogen metabolism of sediments in highland saline lake[J]. China Environmental Science, 2023, 43(3): 1328-1339 (in Chinese). doi: 10.3969/j.issn.1000-6923.2023.03.034
[37] LEE S H, KA J O, CHO J C. Members of the Phylum Acidobacteria are dominant and metabolically active in rhizosphere soil[J]. FEMS Microbiology Letters, 2008, 285(2): 263-269. doi: 10.1111/j.1574-6968.2008.01232.x -






 下载:
下载: