-
伴随着人类工业、农业等活动的日益频繁,土壤中抗生素、重金属含量日益超标所引发的环境污染问题,备受社会关注[1]。抗生素对土壤微生物存在低剂量促进和高剂量抑制作用,与重金属共存时,抗生素的含电子供体基团可与重金属离子结合,使得自身的电荷被中和,从而变得更加稳定,导致其在环境中的持久性增强,最终通过生物富集作用,加大对人体和动植物的危害[2-4]。重金属铅(Pb)在血铅水平为10 mg·dL−1时[5],即可对儿童神经发育产生不良影响,伴随着畜禽粪肥施用、工业产出、大气沉积等,其在土壤环境介质中的检出质量分数范围为2.7~300 mg·kg−1[6-7],而其高溶解性和高迁移性,则进一步加剧了它的生态毒性。金霉素 (CTC) 作为四环素类 (TCs) 抗生素家族的一员,在土壤中的检出频率高 (81.3%~91.6%) ,检出质量分数大 (5.85~33.37 mg·kg−1) [6, 8-10],其还会与重金属通过交叉抗性和共选择性对土壤微生物产生长期选择性压力,诱发耐药菌和新污染物-抗性基因 (Antibiotic resistance genes,ARGs) 的产生,威胁生态安全。GUO等[11]研究发现Pb可降低土壤微生物群落的多样性,并且会和土霉素 (OTC) 共同作用,增加土壤ARGs的丰度。WANG等[12]指出Pb会促进土壤-植物系统中植物根生细菌和土壤ARGs的积累。目前,关于土壤抗生素和重金属复合污染环境归趋及相互作用的研究报道较多,对于二者复合污染诱导土壤微生物群落结构、酶活性以及ARGs变化的作用机理也多有研究[3-4, 13-15],但是如何采取绿色经济的技术手段对过量排入土壤中的重金属和抗生素进行固定或去除,对环境生态安全来讲意义重大,却研究较少。
高级氧化法[16]、植物修复法[17]和生物修复法[18]等常被用做重金属和抗生素复合污染土壤的修复,但高级氧化法降解抗生素产生的次生产物会对土壤带来二次危害,植物修复法周期较长,生物修复会带来物种入侵。基于生态安全、经济成本及操作可行性的考虑,向重金属和抗生素污染土壤中投加稳定剂进行原位修复是很好的途径[13]。生物质碳、黏土类矿物、含磷矿物等材料,廉价、易得,常被用于土壤原位修复的稳定剂。然而,生物质碳的加入大大提高了土壤的pH值[19-20],为土壤后续利用带来碱度过高的困扰,而单纯使用天然黏土类矿物,虽然有效但并不高效,含磷矿物的添加虽然可以达到很好的效果,却被视为对磷资源的一种浪费。鸟粪石结晶法同步回收污水氮磷并将回收产品用于重金属和抗生素复合污染土壤修复,由于兼具经济和环保效益,成为土壤修复领域的研究热点[13, 21-23]。有研究[7]将鸟粪石负载沸石用于Cu和TC复合污染土壤的原位修复,可将生物可利用性Cu和TC含量分别降低 73.0%和71.3%。
多项研究表明,氧化镁改性硅藻土可实现沼液中氮磷的同步回收[21-23],回收产品-鸟粪石负载硅藻土 (SD) 可实现污水中Pb (II) 和CTC的同步去除[23]。基于此,本研究以SD为土壤调理剂、以Pb和CTC复合污染土壤作为研究对象,考察SD加入前后土壤Pb和CTC的赋存状态、土壤理化性质和微生物群落的变化,探究SD对Pb和CTC复合污染土壤的修复效果和机制,以期为污水氮磷资源化以及重金属和抗生素复合污染土壤的原位修复提供技术支持。
-
1) 污水氮磷回收产物SD的制备。硅藻土洗净烘干,按镁的质量分数为40%计,将硅藻土加入 MgCl2 溶液中,用NaOH调节Mg2+和OH-的摩尔比为1∶2,沉淀-浸渍法制得Mg(OH)2-D,后400 ℃高温煅烧,即制得MgO负载的硅藻土 (MgO-D) [22]。将一定质量MgO-D加入稀释一定倍数的沼液中 (沼液源自嘉兴某养猪场废水,稀释后溶液pH为8.03,溶液中COD、NH4+-N、PO43--P和Mg2+的质量浓度分别为700、302、23和18 mg·L−1 ,置于摇床内,25 ℃、180 r·min−1下,反应90 min,过滤并45 ℃烘干,即得SD [23]。
实验所用药品均采购自国药集团,分析纯。实验用水皆为超纯水。
2) 供试土壤。取嘉兴某养猪场附近的表层土 (0~20 cm) ,风干后过2 mm筛,即为背景土壤。向背景土壤中加入一定量Pb (NO3)2溶液,使土壤中Pb总量达到土壤环境质量标准 (GB 15618-2018) 风险筛选值 (6.5≤pH≤7.5) 的约2倍,向背景土壤中加入一定量CTC溶液,使CTC浓度达到土壤环境检出范围 (10~100 mg·kg−1) [24]。用去离子水调节土壤含水量至其最大持水量的60%左右以维持土壤微生物活性[25-27],所得土壤置于气候箱中稳定49 d后,自然风干,即为Pb和CTC复合污染土壤。供试土壤的基本理化性质如表1所示。
-
1) 吸附-解吸实验。SD投加量以及溶液中Pb(II)和CTC的浓度范围根据预试验确定的固液比来确定。该固液比应保证吸附前后液相溶质浓度的变化范围在20%~80%之间,以保证分析可靠性[28]。背景溶液均采用 0.01 mol·L−1 NaNO3 和 0.003 mol·L−1 NaN3的混合溶液。用Pb(NO3)2分别配置Pb(II)浓度范围为150~350 mg·L−1、共存CTC浓度为20 mg·L−1的混合溶液40 mL,放入50 mL离心管中,加入SD和干净土壤各0.012 g,调节pH至5.5,25 ℃下避光、循环振荡反应12 h,过滤,分析滤液中Pb(II)的浓度。使用盐酸金霉素配置CTC浓度范围为10~100 mg·L−1、共存Pb(II)浓度为40 mg·L−1的混合溶液40 mL,其余操作同上。吸附实验结束后,将初始含有200和350 mg·L−1 Pb(II) 的溶液加入40 mL稀释剂 (H2O/1 mol·L−1 CaCl2/2 mol·L−1乙酸) ,将初始含有20和50 mg·L−1 CTC的溶液加入40 mL稀释剂 (H2O/0.02 mol·L−1 CaCl2/0.2 mol·L−1柠檬酸) [29],25 ℃下避光、循环振荡反应24 h,过滤,分析溶液中剩余污染物浓度。
2) 稳定化试验。按原土、空白对照、稳定剂质量分数为0.2%、1%和3%向污染土壤中加入SD材料,混合均匀后稳定49 d,测定土壤试样理化性质以及Pb和CTC的各形态浓度,每个条件的测定重复3次,取均值。预留部分样品,送至上海某生物检测公司分析微生物群落结构。
-
1) 材料表征。采用扫描电子显微镜&能谱分析仪 (Ultra55,德国Zeiss公司) 进行形貌和组分分析;采用X射线衍射仪 (X’pert Pro X,德国Bruker公司) 进行晶体结构分析;采用傅里叶变换红外光谱仪 (Nicolet 5700,美国Thermo公司) 进行材料官能团分析。
2) 样品理化性质和污染物浓度分析。土壤pH按水土比为2.5∶1,称取4 g风干土壤于50 mL离心管中,加入10 mL无二氧化碳的水,剧烈搅动1~2 min,静置30 min,用pH计测定。参照CEN/TS 14429:2005 (pHstat) 实验来确定经SD稳定后土壤在pH变化下Pb浸出量。pHstat实验包含2部分:预实验 (酸碱缓冲能力估算实验) 和正式实验[29]。采用DTPA提取法提取土壤中生物有效态Pb,采用改进的BCR法对土壤中各种形态的Pb进行提取,并用电感耦合等离子体光谱仪-ICP (Agilent 720ES,美国Agilent公司) 测定。采用水、0.1 mol·L−1 CaCl2溶液、Mcllvaine缓冲溶液和磷酸盐/EDTA溶液对土壤CTC的水溶态、可交换态、不稳定结合态和稳定结合态进行提取[24-25],用超高效液相色谱-三重四级杆串联质谱仪 (Waters ACQUITY UPLC Xevo TQ,美国Waters公司) 测定上述步骤所得的上清液中CTC含量。采用0.5 mol·L−1碳酸氢钠浸提-钼锑抗比色法进行土壤速效磷的测定。采用16S rRNA高通量测序,借助I-Sanger生物信息云平台分析土壤样品微生物群落结构变化[30]。
3) 数据分析。基于Originpro 2021软件,采用Langmuir模型 (式(1)) 和Freundlich模型 (式(2)) 对吸附-解吸实验中Pb 和CTC在SD和土壤上的吸附等温线进行拟合。
式中:Ce为污染物平衡浓度,mg·L−1;Qe为污染物平衡吸附量,mg·g−1;qmax为材料最大吸附容量,mg·g−1;KL为Langmuir常数,L·mg−1;KF为与吸附亲合力有关的Freundlich常数,(mg·g−1) · (mg·L−1) −n,n为常数。
滞后系数 (HI) [31-33]表示Pb和CTC在SD和土壤上的吸附可逆性。HI越接近于零,吸附的可逆程度越高[34]。HI的计算公式见式(3)。
式中:Ce是解吸实验中污染物的平衡浓度,mg·L−1;T是解吸实验吸附过程温度,K;qe为解吸实验中材料对Pb(II)和CTC的吸附容量,mg·g−1;Qe为将解吸实验的平衡浓度代入吸附实验拟合所得的Freundlich模型,计算得出的材料对Pb(II)和CTC的吸附容量,mg·g−1。
-
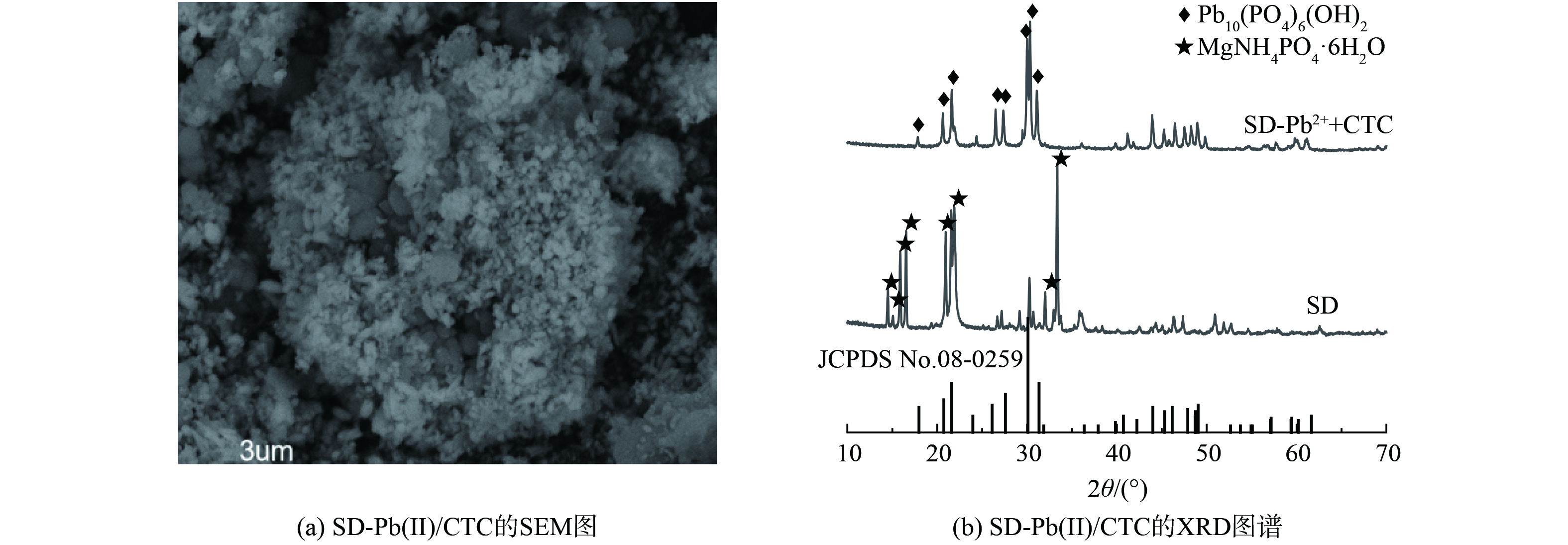
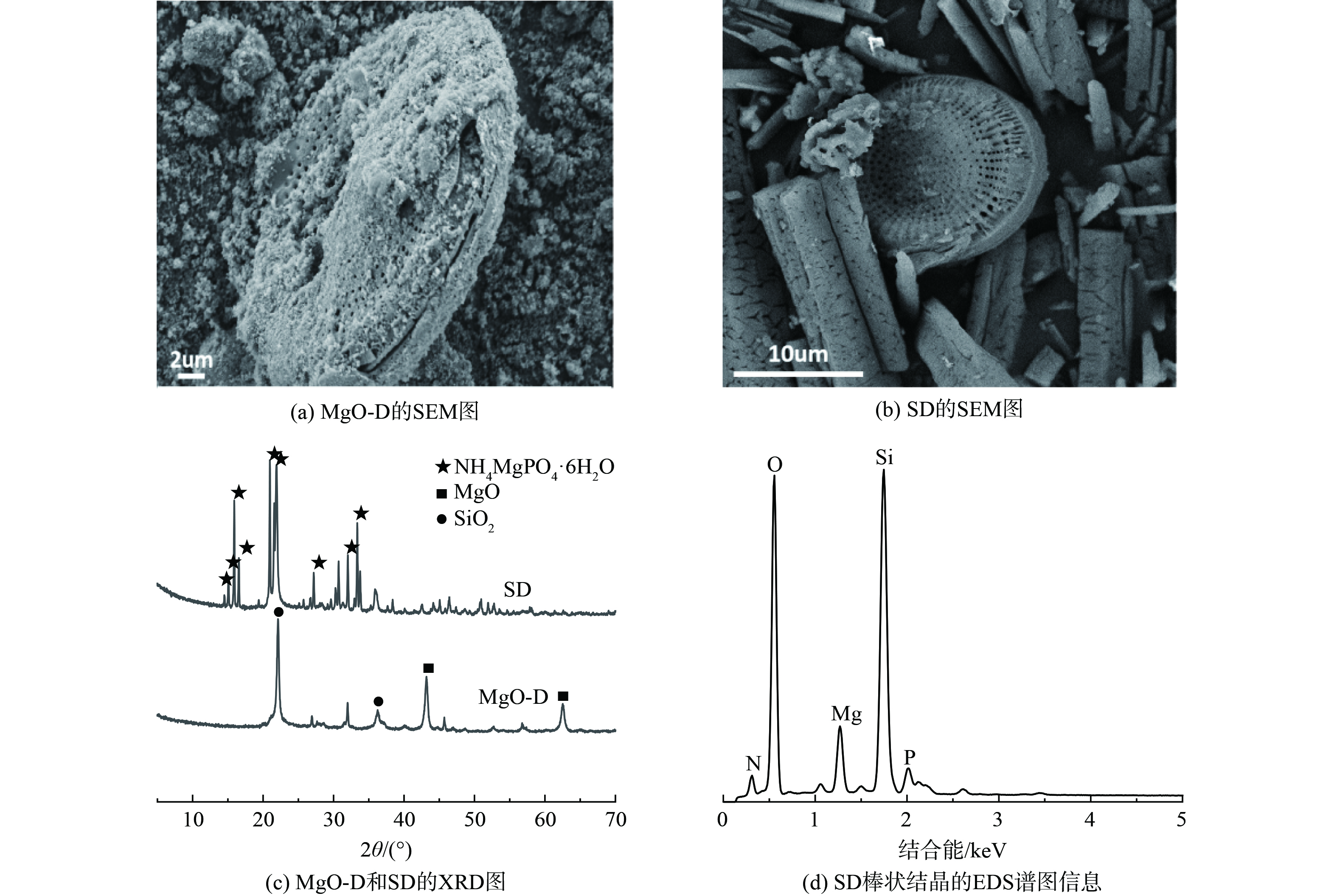
MgO-D和SD的SEM谱图见图1(a)~(b),氧化镁纳米片在硅藻土表面的沉积使得MgO-D表面较粗糙,用于沼液中氮磷回收时,MgO-D表面的MgO水化生成Mg (OH)2中间体,与溶液中NH4+-N和PO43-快速反应,生成棒状鸟粪石沉淀[22-23]。XRD的结果指出 (图1(c)) ,进行氮磷回收后,MgO-D中的MgO (JCPDS 65-0476) 特征衍射峰消失,回收产物SD中出现一系列对应于MgNH4PO4·6H2O (JCPDS 07-0239) 的特征峰,标明鸟粪石的生成。图1(d)为SD棒状结晶的EDS谱图信息,结合表2可知,其主要构成元素为 Mg、O、N 和 P,与鸟粪石的组成元素相对应。
-
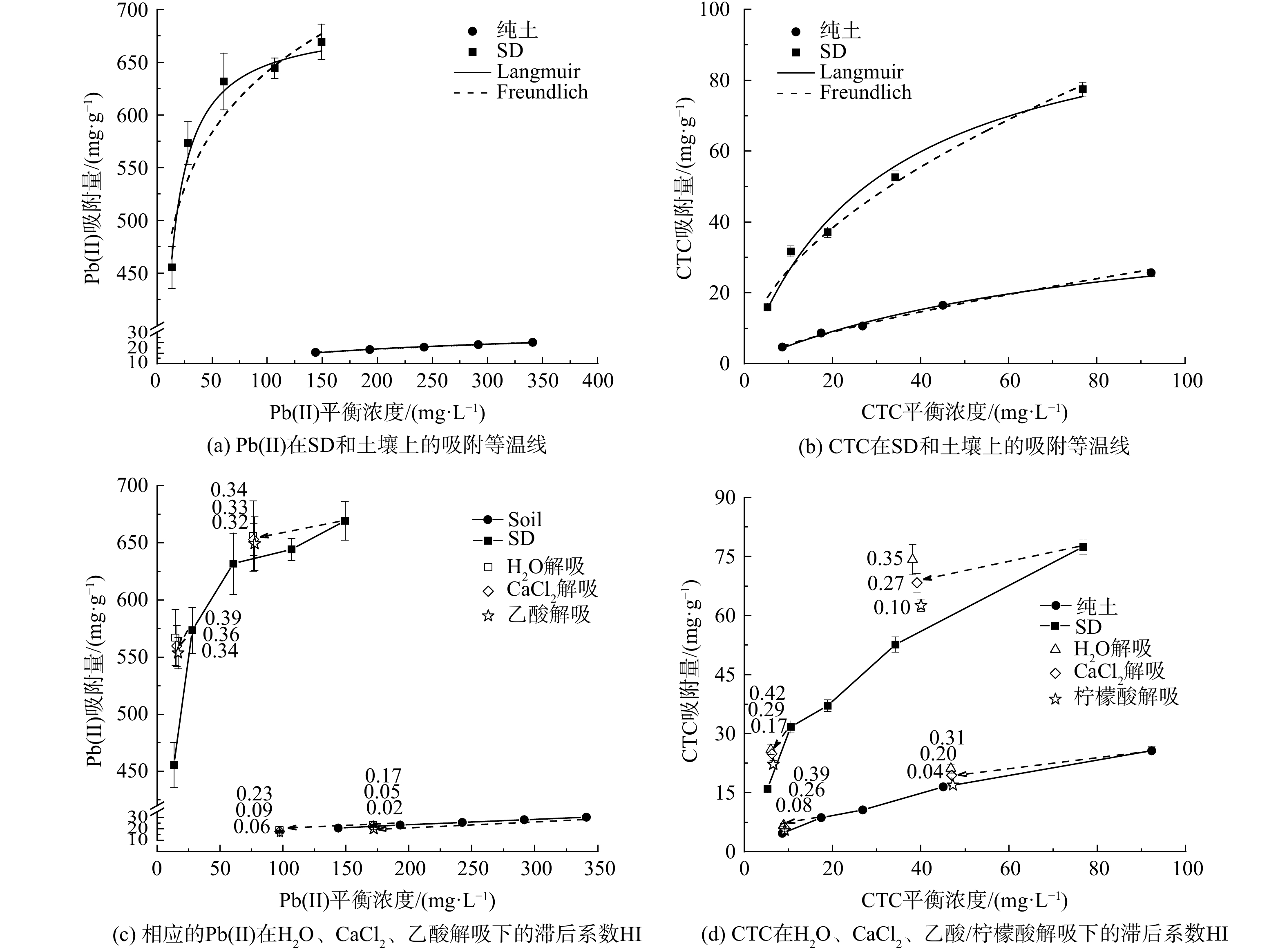
为探究SD对土壤Pb和CTC迁移特性的影响,本研究对比了Pb和CTC在SD和土壤中的吸附-解吸行为。图2(a)~(b)为Pb和CTC在SD和土壤中的吸附等温线,采用Langmuir和Freundlich等温线模型拟合吸附数据,拟合常数见表3。由Langmuir等温线模型的拟合结果可知,Pb在SD和土壤的上最大吸附容量分别为689.40和45.71 mg·g−1,但Pb在SD上的吸附更符合Langmuir等温线模型,而Pb在土壤上的吸附更符合Freundlich模型,说明Pb在SD上的吸附主要为均匀的单层化学吸附,而Pb在土壤上的吸附则为非均一的多层吸附;CTC在SD上的吸附更符合Langmuir模型,最大吸附容量为104.27 mg·g−1,其在土壤上的吸附更符合Freundlich模型,就拟合结果而言,SD对CTC的吸附能力要远大于土壤对CTC的吸附能力。
由于有机污染物从固体吸附剂上解吸之后会恢复其在环境中的迁移特性和生物有效性。因此,对重金属和抗生素解吸行为的研究将为准确评价其和SD材料的环境行为和环境风险提供依据。由图2(c)~(d)的滞后系数HI可以看出,SD对于Pb和CTC 的固化能力要强于土壤对二者的固化能力,并且Pb在土壤上的吸附-解吸几乎可逆,这可能是因为土壤对于Pb的吸附能力有限,导致土壤在比较高的Pb浓度范围内吸附容量不会大幅增加,反而会随着解吸溶液的加入,通过物理作用附着在土壤表面的Pb更易释放到溶液中去。柠檬酸对于CTC的解吸能力要远高于CaCl2和水对于CTC的解吸能力,可能是由于CTC在SD和土壤上的结合态主要是松散结合态[31],乙酸对于Pb在SD上吸附的影响却比较弱,这可能是因为SD对于Pb和CTC吸附的机制不同。
吸附Pb(II) 和CTC后,SD上棒状的鸟粪石晶体溶解 (图3(a)) ,生成米粒状Pb5 (PO4) 3OH晶体,与文献报道[35]的棒状Pb5 (PO4) 3OH晶体不一致的原因是CTC通过界面吸附作用附着在Pb5 (PO4) 3OH晶体表面,抑制了其晶体生长[23]。XRD图谱 (图3(b)) 显示,吸附Pb(II) 和CTC之后,Pb5 (PO4) 3OH (JCPDS卡号08-0259) 的特征衍射峰,取代了原SD中MgNH4PO4·6H2O的特征衍射峰。
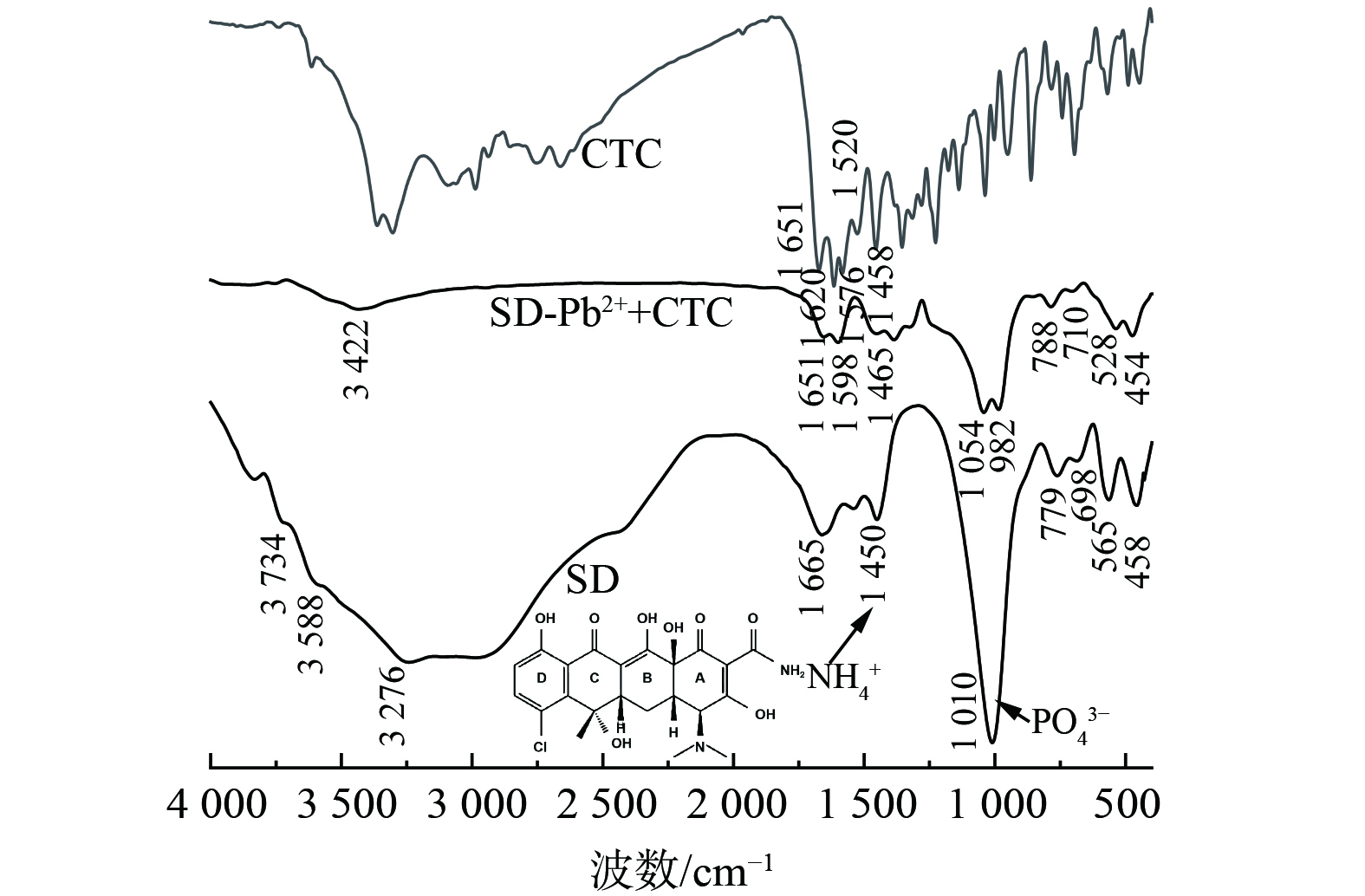
SD中对应于PO43--P和NH4+-N的特征峰[21],在吸附了Pb(II) 和CTC之后明显减弱 (图4) 。一方面可能跟CTC与MgNH4PO4·6H2O表面的≡MgOH和≡POH的羟基络合有关,另一方面可能跟MgNH4PO4·6H2O溶解和Pb5 (PO4) 3OH生成有关[23]。1 651 cm−1、1 620 cm−1、1 576 cm−1和1 520 cm−1处的衍射峰分别对应于CTC分子A环和C环中的C=O以及A环=NH2和与C=O相连的NH2的骨架振动[8]。吸附了Pb(II) 和CTC之后, SD-Pb2++CTC中出现了1 651 cm−1、1 598 cm−1和1 465 cm−1处CTC的衍射峰,并且发生了不同程度的迁移,但是1 620 cm−1处的特征峰消失,可能是因为Pb2+与B环-OH和C环C=O发生紧密键合的缘 [8, 35-38]。因此,SD作用下,CTC的固定主要通过MgNH4PO4·6H2O表面羟基络合、Pb(II)的离子架桥和Pb5 (PO4) 3OH晶体界面吸附作用进行。
-
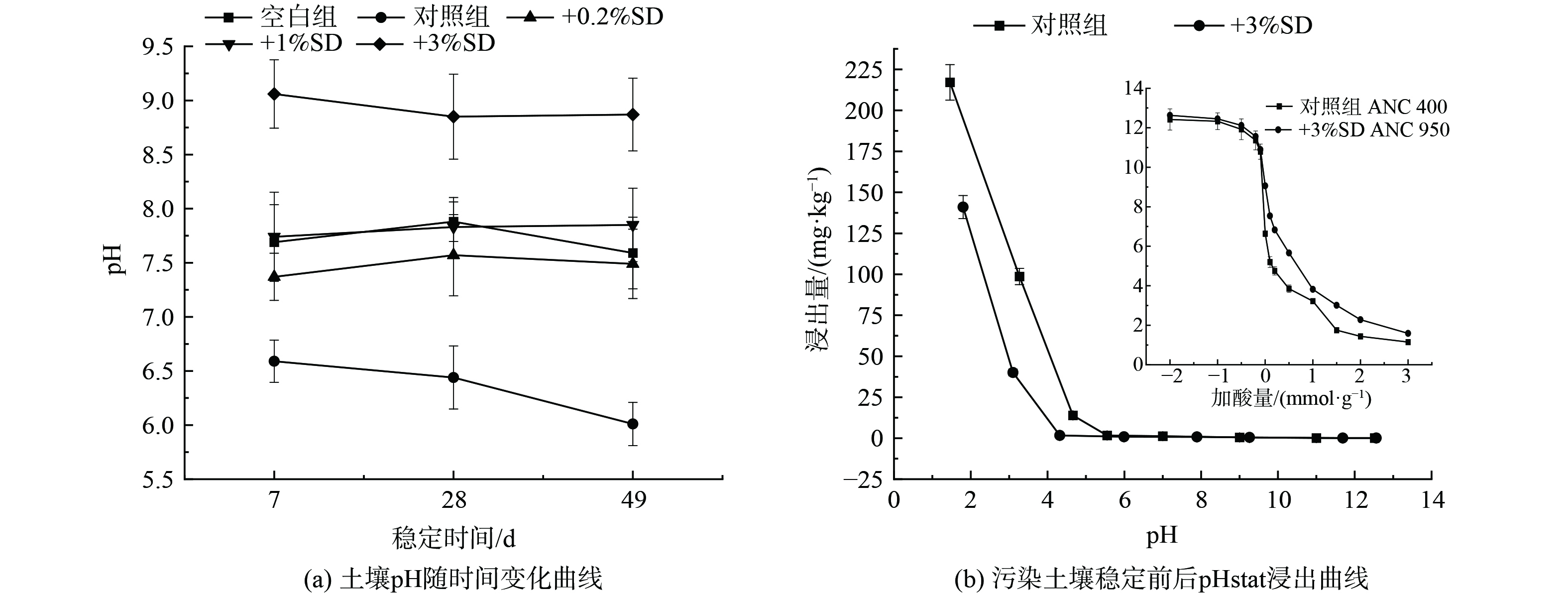
1) 对土壤pH的影响。土壤pH值是溶解-沉淀、吸附-解吸等反应的重要影响因素[39]。pH值较低时,不利于土壤对重金属离子的吸附,因为H+与重金属离子之间存在竞争;随着土壤pH值的升高,土壤对重金属离子的吸附能力增强,当pH值达到一定值,重金属离子达到Ksp值后,吸附能力形成饱和,强碱条件下,金属离子与OH- 络合,反而会降低土壤对重金属离子的吸附能力[40-41]。因此适当提高土壤pH值,可增加土壤表面负电荷对重金属离子的吸附。本研究中SD富含的鸟粪石晶体溶解后提高了土壤pH。
图5(a)为49 d内SD3种加剂量下土壤pH变化过程图,SD引入后,土壤pH开始上升,其变化趋势与重金属有效态浓度类似,在第7 d内快速达到平衡,随后缓慢趋于稳定,且投加量越大,上升的pH越大。据前述分析,SD作用下,溶液中的Pb(II)主要通过鸟粪石溶解和Pb5 (PO4) 3OH沉淀生成得以固定,CTC则主要通过表面络合作用、Pb(II) 的离子架桥作用和Pb5 (PO4) 3OH晶体表面附着作用得以固定。因而土壤Pb 的长效稳定性对Pb 和CTC的生态风险影响较大,且更易收到环境pH的影响,考察Pb的浸出作用既有利于评估土壤Pb的长效稳定性,也能间接反应CTC的长效稳定性。据此,本研究聚焦污染土壤中Pb的pHstat浸出曲线进行研究 (图5(b)) 。随土壤pH降低,Pb浸出量增加,当pH高于4时,Pb浸出量显著降低;投加SD后,Pb浸出量相对对照组出现抑制,说明SD对土壤Pb的固化稳定有抗酸化溶出作用。图5b内插图为加入SD前后污染土壤对外来酸碱加入的pH应变情况以及到达ANC能力 (降低土壤pH到4所需要的酸量,以H+计,mmol·g−1) 。由图可知,钝化剂SD的施入,对污染土壤的ANC能力有所提升,对外来碱的缓冲能力变化不大。说明SD施入后,土壤抵抗酸雨能力增强,Pb溶出危害降低,间接降低CTC的迁移风险。
2) 对Pb 和CTC固定效果的影响。以往研究表明[42],重金属总量并不能准确评估土壤重金属的潜在环境风险和人类健康风险,有效态重金属才直接决定其生物有效性和对生态环境的危害程度[29],BCR连续提取法将Pb进一步分为可交换态、可还原态、可氧化态和残渣态,可交换态重金属具有最大的迁移性,其他形态重金属只有在一定条件下通过化学反应转变成可交换态才能产生危害,残渣态被认为迁移性最弱、危害性最小[43]。如图6(a)所示,随SD投加量的增加,土壤中重金属Pb的有效态质量分数显著下降。SD投加质量分数为3%、稳定49 d后,土壤 Pb的有效态质量分数从268.1 mg·kg−1降至198.3 mg·kg−1,减少了26%。随着SD的加入和稳定时间的增长,可交换态、可氧化态和可还原态Pb的占比均出现不同程度下降,残渣态含量均有所上升 (图6(b)) 。其中,土壤酸溶态Pb降低7%~12%,残渣态Pb增加11%~18%,说明SD对Pb的钝化作用属强结合作用,难溶性Pb5 (PO4) 3OH的生成降低了土壤Pb的生物有效性,使得可迁移、可生物利用态的Pb向稳定态、不可生物利用态转移[44]。
LIU等[45]指出水溶态、可交换态和不稳定结合态的抗生素比较容易释放到土壤环境中,具有生物可利用性,以水溶态、可交换态和不稳定结合态3者之和代表生物可利用态抗生素的浓度[30-31]。如图6(c)所示,生物有效态CTC质量分数随着SD的引入和稳定时间的增加,呈逐渐下降的趋势,在土壤引入质量分数3%的SD、稳定49 d后,其质量分数由11.1 mg·kg−1降至4.9 mg·kg−1,减少了56%;进一步地,水溶态CTC占比由16%分别降至14%、14%和11%,松散结合态CTC占比由43%分别降至32%、30%和30%,紧密结合态CTC占比由25%分别增至26%、27%和36% (图6(d)) 。但是,可交换态CTC却随着SD的引入,占比略有增加,这可能是由于SD的投加导致土壤pH增加,使CTC从H3CTC+转化为H2CTC0和PbCTC0,逐渐从土壤表面脱落,或通过界面相互作用固定在Pb5 (PO4) 3OH表面[23],或以络合物形式附着在SD表面,最终导致土壤可交换态CTC占比增加。
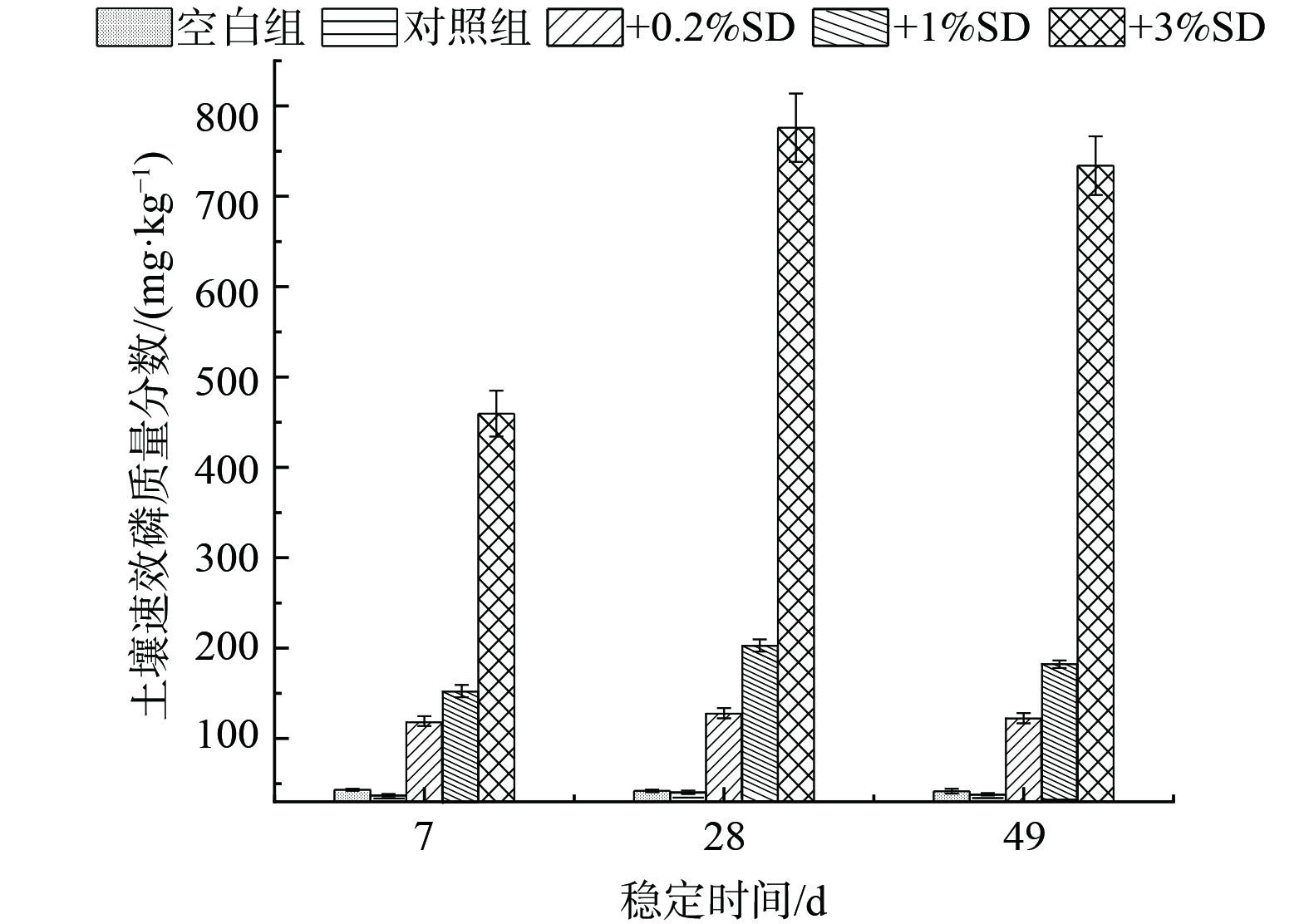
3) 对土壤速效磷的影响。作为能被植物直接吸收和利用的无机磷或者小分子有机磷,土壤速效磷成为评价土壤磷素供磷能力的重要指标[46]。如图7所示,原土中速效磷质量分数在41.7 mg·kg−1左右,投加Pb+CTC 后,土壤中速效磷含量降至38.2 mg·kg−1左右,这可能是因Pb会与土壤中溶解性磷酸盐生成难溶性沉淀,降低了土壤速效磷含量[47],这也是Pb能够在SD修复剂作用下残渣态相对含量上升、生物可利用态含量下降的原因。稳定49 d后,随SD投加量的增加,污染土壤速效磷质量分数由38.2 mg·kg−1分别增至122.8、182.6和734.3 mg·kg−1。随着稳定时间的增加,土壤速效磷质量分数先增加后下降,说明除与重金属生成难溶沉淀外,鸟粪石充分溶解所释放出的磷酸根离子还可作为土壤微生物活动的营养源,得以消耗。
4) 对Pb(II) 和CTC复合污染土壤微生物群落的影响。土壤微生物是地球生物化学循环的重要参与者和贡献者。表4为OTU水平下样品的Chao指数和Shannon 指数图。研究表明[30],Chao指数越大,群落的丰富度越高;Shannon 指数越大,群落的多样性越高。与原土相比,Pb 和CTC污染土壤的Chao指数和Shannon 指数大幅下降,说明二者对土壤微生物毒害作用较强。添加SD后土壤样品的Chao指数及Shannon指数有所恢复,说明SD有助于提升土壤微生物的物种丰度和多样性。一方面由于SD对Pb和CTC的固定作用,大大削弱了二者对土壤微生物的生态毒性;另一方面SD本身富含的Mg、N和P可为微生物提供生长所需元素。
如图8所示,变形菌门 (Proteobacteria) 、放线菌门 (Actinobacteria) 、绿弯菌门 (Chloroflexi) 、厚壁菌门 (Firmicutes) 和拟杆菌门 (Bacteroidetes) 的累加相对丰度占全部的65%以上,为土壤主要菌群。与复合污染土壤相比,当添加不同质量比的SD时,污染土样放线菌门 (Actinobacteria) 和厚壁菌门 (Firmicutes) 微生物相对丰度均有下降,而酸杆菌门 (Acidobacteria) 、绿弯菌门 (Chloroflexi) 和芽单胞菌门 (Gemmatimonadetes) 的相对丰度均有所回升,土壤的微生物多样性变得丰富,这可能与SD投加后,载有同步吸收氮磷微生物的活性增强有关[48]。有研究称,放线菌门 (Actinobacteria) 和厚壁菌门 (Firmicutes) 通常为抗性基因的宿主载体,这两类微生物丰度的下降,在一定程度上也有望降低土壤来自抗性基因的生态风险[49-50],实现土壤生态修复的目的。 基于SD对土壤Pb和CTC形态和总量的影响状况、对微生物相对丰度和群落多样性影响状况以及经济成本的多重考量,SD投加量的建议值按质量分数计,为1%。
-
1) SD对Pb和CTC的固化能力要远高于土壤对二者的固化能力,可有效降低二者在土壤中的迁移特性。
3)施加SD后的Pb和CTC复合污染土壤,在28 d内基本稳定,有效态Pb和CTC质量分数显著降低,化学形态发生较大变化,酸溶态Pb占比降低10%,残渣态Pb占比升高18%,CTC的水溶态和松散结合态占比分别降低5%和13%,CTC的紧密结合态占比则升高11%。SD还可通过调节土壤pH来增强土壤胶体本身对Pb的吸附能力,降低Pb的浸出量。最终,土壤Pb和CTC的生物有效性在SD作用下有效降低。
3) SD可降低土壤Pb和CTC的环境风险、增加土壤速效磷质量分数、提高土壤微生物丰度和多样性,适用于Pb和CTC复合污染土壤的原位修复,是实现污水氮磷资源化及其高值化利用的有效途径。
鸟粪石负载硅藻土对土壤铅和金霉素的同步修复作用
Simultaneous remediation of lead and chlortetracycline in contaminated soil by addition of struvite-loaded diatomite
-
摘要: 使用镁盐改性硅藻土回收沼液中氮磷制得鸟粪石负载硅藻土 (Struvite-loaded diatomite,SD) ,将其用于土壤中铅 (Pb) 和金霉素 (CTC) 复合污染的原位修复。采用吸附-解吸实验评估SD对Pb和CTC迁移特性的影响,同时,通过测定土壤pH和酸缓冲能力、土壤Pb和CTC的有效态和形态、土壤速效磷和微生物群落结构变化等考察SD对土壤Pb和CTC的钝化能力,借助SEM、XRD、FT-IR等表征手段揭示其修复机理。结果表明,SD能有效降低Pb和CTC在土壤中的迁移特性;SD投加质量分数为3%,稳定49 d后,土壤酸中和能力提升1倍以上,土壤有效态Pb和CTC含量分别降低26%和56%,酸溶态Pb占比降低10%,残渣态Pb占比升高18%, CTC的水溶态和松散结合态占比分别降低5%和13%,紧密结合态CTC升高11%,一定程度上降低了Pb和CTC在土壤中的生物有效性;SD的投加可提升土壤速效磷含量,提高土壤微生物的相对丰度和多样性,尤其增加酸杆菌门 (Acidobacteria) 、绿弯菌门 (Chloroflexi) 和芽单胞菌门 (Gemmatimonadetes) 的相对丰度,降低放线菌门 (Actinobacteria) 和厚壁菌门 (Firmicutes) 的相对丰度;SD对土壤Pb和CTC的钝化机制主要为吸附和沉淀的协同作用。该研究可为污水氮磷资源化利用和重金属抗生素复合污染土壤原位修复提供参考。Abstract: Struvite-loaded diatomite (SD), a product of nutrient recovery process from biogas slurry, has been applied as a soil amendment for soil multi-polluted with Pb and chlortetracycline (CTC). In this study, the effect of SD on the mobility characteristics of Pb and CTC in soil were evaluated by adsorption-desorption experiments. The passivation ability of SD on Pb and CTC were investigated through measuring soil pH, soil acid neutralization capacity, the bioavailable states and different binding states to soil of Pb and CTC, the bioavailable phosphorus and microbial community structure and so on. Also, the properties of the adsorbents were characterized by SEM, XRD, and FT-IR to reveal the the potential mechanisms during this process as well. The results showed that the immobilization ability of SD for Pb and CTC was much higher than that of soil, which can effectively reduce the migration properties of these two pollutants. Compared with the control group, the acid neutralization capacity of soil can be doubled by adding 3 wt% SD after stabilizing for 49 d. Meanwhile, the content of bioavailable Pb and CTC in soil was decreased by 26% and 56%, respectively. Specifically, the proportion of Pb in acid-soluble state has been cut down by 10%, and there was a 18% growth of Pb in residual state. The proportions of water-soluble state and loosely bound state of CTC reduced by 5% and 13%, and the proportion of its tightly bound state raised by 11%. Moreover, the usage of SD increased the content of bioavailable phosphorus and promoted the relative abundance and diversity of soil microorganisms, especially increasing the relative abundance of Acidobacteria, Chloroflexi and Gemmatimonadetes, accompanied by decreasing the relative abundance of Actinobacteria and Firmicutes. The passivation mechanisms of the SD to Pb and CTC were mainly adsorption and precipitation. The results of this study provide a useful guideline for the resource utilization of nitrogen and phosphorus in sewage and in-situ remediation of soil contaminated by heavy metals and antibiotics.
-
Key words:
- struvite /
- lead /
- chlortetracycline /
- combined pollution /
- in-situ remediation of soil
-

-
图 2 Pb(II) 和CTC在SD和土壤上的吸附等温线以及Pb(II)和CTC在H2O、CaCl2、乙酸/柠檬酸解吸下的滞后系数HI
Figure 2. Pb(II) and CTC adsorption by SD and soil in aqueous solution: Adsorption isotherms of Pb(II) adsorption on SD and soil with 50 mg L−1 CTC; adsorption isotherms of CTC adsorption on SD and soil with 200 mg L−1 Pb(II); the corresponding hysteresis index (HI) for Pb(II) and CTC desorption by using H2O, CaCl2, acetic acid/citric acid
表 1 供试土壤的基本理化性质
Table 1. Basic physiochemical properties of the tested soil
土壤类型 pH 黏土质量比/% 沙质土质量比/% 砂质土质量比/% 背景土壤 7.69 15.15 43.22 41.63 Pb(II) 和CTC污染土壤 6.59 15.15 43.22 41.63 土壤类型 土壤TOC含量/% 速效磷/ (mg·kg−1) 总Pb /(mg·kg−1) 总CTC/ (mg·kg−1) 背景土壤 0.049 43.27 1.15 1.02 Pb(II) 和CTC污染土壤 0.051 37.23 303.74 30.68 表 2 磷回收产物SD的EDS图谱元素原子占比和质量比
Table 2. Atomic proportion and mass ratio of EDS atlas for SD
元素 原子占比/% 质量比/% Mg 5.17 6.69 N 3.03 2.26 P 1.91 3.15 Si 17.60 26.32 表 3 纯土和SD吸附Pb(II)和CTC的Langmuir和Freundlich模型参数
Table 3. Langmuir and Freundlich isotherm parameters for adsorption of Pb(II) and CTC on soil and SD
吸附质 吸附剂 Langmuir 模型 Freundlich 模型 qmax
/(mg·g−1)KL
/(L·mg−1)R2 KF
/( (mg·g−1) · (mg·L−1) −n)n R2 Pb(II) 纯土 45.71 0.01 0.987 2.15 0.43 0.998 SD 689.40 0.15 0.985 304.27 0.11 0.918 CTC 纯土 47.11 0.01 0.989 1.06 0.71 0.992 SD 104.27 0.03 0.982 7.32 0.55 0.981 表 4 OTU水平下土壤样品的Chao指数和Shannon指数
Table 4. Chao index and Shannon index of soil samples on OTU level
组别 Chao Shannon 原土 4578.3 6.87 对照组 3945.8 6.44 +0.2%SD 3986.2 6.79 +1%SD 4301.5 6.82 +3%SD 4268.4 6.83 -
[1] 徐艳, 师荣光, 李厚禹, 等. 抗生素-重金属复合污染对土壤中细菌耐药的影响[J]. 土壤通报, 2019, 50(2): 457-462. doi: 10.19336/j.cnki.trtb.2019.02.29 [2] HE C F, ZHOU J N, YANG C, et al. Accumulation, transportation, and distribution of tetracycline and cadmium in rice[J]. Journal of Environmental Sciences, 2023, 126: 58-69. doi: 10.1016/j.jes.2022.03.034 [3] WU Y Q, WEN Q X, CHEN Z Q, et al. Response of antibiotic resistance to the co-exposure of sulfamethoxazole and copper during swine manure composting[J]. Science of the Total Environment, 2022(805): 150086. [4] SU Y, XIONG J P, FANG C, et al. Combined effects of amoxicillin and copper on nitrogen transformation and the microbial mechanisms during aerobic composting of cow manure[J]. Journal of Hazardous Materials, 2023, 455: 131569. doi: 10.1016/j.jhazmat.2023.131569 [5] ZHANG P, SIDA O Y, LI P, et al. Ultrahigh removal performance of lead from wastewater by tricalcium aluminate via precipitation combining flocculation with amorphous aluminum[J]. Journal of Cleaner Production, 2020, 246: 118728. doi: 10.1016/j.jclepro.2019.118728 [6] JI X L, SHEN Q H, LIU F, et al. Antibiotic resistance gene abundances associated with antibiotics and heavy metals in animal manures and agricultural soils adjacent to feedlots in Shanghai; China[J]. Journal of Hazardous Materials, 2012, 235-236: 178-185. doi: 10.1016/j.jhazmat.2012.07.040 [7] VANESA S M, AVELINO N D, ESPERANZA A R, et al. Tolerance of soil bacterial community to tetracycline antibiotics induced by As, Cd, Zn, Cu, Ni, Cr, and Pb pollution[J]. Soil, 2022, 8(1): 437-449. doi: 10.5194/soil-8-437-2022 [8] YUAN L, YAN M, HUANG Z, et al. Influences of pH and metal ions on the interactions of oxytetracycline onto nano-hydroxyapatite and their co-adsorption behavior in aqueous solution[J]. Journal of Colloid Interface Science, 2019, 541: 101-113. doi: 10.1016/j.jcis.2019.01.078 [9] PAN X, QIANG Z M, BEN W W, et al. Residual veterinary antibiotics in swine manure from concentrated animal feeding operations in Shandong Province, China[J]. Chemosphere, 2011, 84: 695-700. doi: 10.1016/j.chemosphere.2011.03.022 [10] CHEN Z Q, WANG Y, WEN Q X. Effects of chlortetracycline on the fate of multi-antibiotic resistance genes and the microbial community during swine manure composting[J]. Environmental Pollution, 2018, 237: 977-987. doi: 10.1016/j.envpol.2017.11.009 [11] GUO T F, LI Z Y, SHAO Y Q, et al. Effects of Oxytetracycline/Lead Pollution Alone and in the Combined Form on Antibiotic Resistance Genes, Mobile Genetic Elements, and Microbial Communities in the Soil[J]. 2022, 19: 15619. [12] WANG L J, YAN X J, ZHU L S, et al. Spread and driving factors of antibiotic resistance genes in soil-plant system in long-term manured greenhouse under lead (Pb) stress[J]. Science of the Total Environment, 2023, 855: 158756. doi: 10.1016/j.scitotenv.2022.158756 [13] WANG Y, WANG X J, LI Y, et al. Effects of struvite-loaded zeolite amendment on the fate of copper, tetracycline and antibiotic resistance genes in microplastic-contaminated soil[J]. Chemical Engineering Journal, 2022, 430: 130478. doi: 10.1016/j.cej.2021.130478 [14] SUN M, YE M, WU J, et al. Positive relationship detected between soil bioaccessible organic pollutants and antibiotic resistance genes at dairy farms in Nanjing, Eastern China[J]. Environmental Pollution, 2015, 206: 421-428. doi: 10.1016/j.envpol.2015.07.022 [15] LIU K, SUN M M, YE M, et al. Coexistence and association between heavy metals, tetracycline and corresponding resistance genes in vermicomposts originating from different substrates[J]. Environmental Pollution, 2019, 244: 28-37. doi: 10.1016/j.envpol.2018.10.022 [16] LI Y, DENG M J, WANG X J, et al. In-situ remediation of oxytetracycline and Cr(VI) co-contaminated soil and groundwater by using blast furnace slag-supported nanosized Fe0/FeSx[J]. Chemical Engineering Journal, 2021, 412: 128706. doi: 10.1016/j.cej.2021.128706 [17] CUI E P, CUI B J, FAN X Y, et al. Ryegrass (Lolium multiflorum L. ) and Indian mustard (Brassica juncea L.) intercropping can improve the phytoremediation of antibiotics and antibiotic resistance genes but not heavy metals[J]. Science of the Total Environment, 2021, 784: 147093. [18] ZHANG X R, GONG Z G, ALLINSON G, et al. Joint effects of bacterium and biochar in remediation of antibiotic-heavy metal contaminated soil and responses of resistance gene and microbial community[J]. Chemosphere, 2022, 299: 134333. doi: 10.1016/j.chemosphere.2022.134333 [19] FANG S E, TSANG D C W, ZHOU F S, et al. Stabilization of cationic and anionic metal species in contaminated soils using sludge-derived biochar[J]. Chemosphere, 2016, 149: 263-271. doi: 10.1016/j.chemosphere.2016.01.060 [20] BEESLEY L, MARMIROLI M. The immobilisation and retention of soluble arsenic, cadmium and zinc by biochar[J]. Environmental Pollution, 2011, 159: 474-480. doi: 10.1016/j.envpol.2010.10.016 [21] XIA P, WANG X J, WANG X, et al. Struvite crystallization combined adsorption of phosphate and ammonium from aqueous solutions by mesoporous MgO loaded diatomite[J]. Colloid Surface A, 2016, 506: 220-227. doi: 10.1016/j.colsurfa.2016.05.101 [22] LI J, WANG X J, WANG J, et al. Simultaneous recovery of microalgae, ammonium and phosphate from simulated wastewater by MgO modified diatomite[J]. Chemical Engineering Journal, 2019, 362: 802-811. doi: 10.1016/j.cej.2019.01.094 [23] LI J, WANG X J, WANG Y, et al. Insight into the co-adsorption behaviors and interface interactions mechanism of chlortetracycline and lead onto struvite loaded diatomite[J]. Journal of Hazardous Materials, 2021, 405: 124210. doi: 10.1016/j.jhazmat.2020.124210 [24] 曾巧云, 丁丹, 檀笑. 中国农业土壤中四环素类抗生素污染现状及来源研究进展[J]. 生态环境学报, 2018, 27(9): 1774-1782. [25] 潘霞, 陈励科, 卜元卿, 等. 畜禽有机肥对典型蔬果地土壤剖面重金属与抗生素分布的影响[J]. 生态与农村环境学报, 2012, 28(5): 518-525. [26] 王瑾, 韩剑众. 饲料中重金属和抗生素对土壤和蔬菜的影响[J]. 生态与农村环境学报, 2008(4): 90-93. [27] 卢信, 罗佳, 高岩, 等. 畜禽养殖废水中抗生素和重金属的污染效应及其修复研究进[J]. 江苏农业学报, 2014, 30(3): 671-681. [28] 王驰. 磺胺甲恶唑和卡马西平在碳纳米材料上的竞争和补充吸附行为研究[D]. 昆明: 昆明理工大学, 2015. [29] 王健, 夏鹏, 张志昊, 等. 鸟粪石负载硅藻土复合材料对土壤中锌的稳定化作用[J]. 环境工程学报, 2018, 12(4): 1164-1170. [30] WANG H, WANG X J, LI J, et al. Comparison of palygorskite and struvite supported palygorskitederived from phosphate recovery in wastewater for in-situimmobilization of Cu, Pb and Cd in contaminated soil[J]. Journal of Hazardous Materials, 2018, 346: 273-284. doi: 10.1016/j.jhazmat.2017.12.042 [31] YAN Y, XING B S, RAO C S P, et al. Importance of adsorption (hole-filling) mechanism for hydrophobic organic contaminants on an aquifer kerogen isolate[J]. Environmental Science & Technology, 2004, 38: 4340-4348. [32] LIU J, MA Y N, ZHU D Q, et al. Polystyrene nanoplastics-enhanced contaminant transport: role of irreversible adsorption in glassy polymeric domain[J]. Environmental Science & Technology, 2018, 52: 2677-2685. [33] HUANG W L, JR W J W. A distributed reactivity model for sorption by soils and sediments. 10. relationships between desorption, hysteresis, and the chemical characteristics of organic domains[J]. Environmental Science & Technology, 1997, 31: 2562-2569. [34] 万莹. 土壤中典型抗生素与福的二元竞争吸附一解吸行为研究[D]. 天津: 南开大学, 2010. [35] 吴盈秋, 夏鹏, 李远, 等. 镁改性硅藻土回收废水氮磷产物对水中Pb2+和Zn2+的去[J]. 环境科学, 2022, 43(2): 5667-5675. [36] ZHU Y, HUANG B, ZHU Z, et al. Characterization, dissolution and solubility of the hydroxypyromorphite-hydroxyapatite solid solution [ (PbxCa1-x)5(PO4)3OH] at 25 degrees C and pH 2-9[J]. Geochemical Transactions, 2016, 17(2): 1-18. [37] MONIKA K K, MATUSIK J, BAJDA T, et al. Fourier transform infrared spectroscopic study of hydroxylpyromorphite Pb10(PO4)6OH2-hydroxylmimetite Pb10(AsO4)6(OH)2 solid solution series[J]. Polyhedron, 2015, 99: 103-111. doi: 10.1016/j.poly.2015.07.002 [38] WESSELS J M, FORD W E, SZYMCZAK W, et al. The complexation of tetracycline and anhydrotetracycline with Mg2+ and Ca2+: a spectroscopic study[J]. Journal of Physical Chemistry B, 1998, 102: 9323-9331. doi: 10.1021/jp9824050 [39] 周世伟, 徐明岗. 磷酸盐修复重金属污染土壤的研究进展[J]. 生态学报, 2007, 27(7): 3043-3050. doi: 10.3321/j.issn:1000-0933.2007.07.046 [40] ELZAHABI M, YONG R N. pH influence on sorption characteristics of heavy metal in the vadose zone[J]. Engineering Geology, 2001, 60(1-4): 61-68. doi: 10.1016/S0013-7952(00)00089-2 [41] 孙晓铧, 黄益宗, 钟敏, 等. 沸石、磷矿粉和石灰对土壤铅锌化学形态和生物可给性的影响[J]. 环境化学, 2013, 32(9): 1693-1699. doi: 10.7524/j.issn.0254-6108.2013.09.014 [42] 孙丽娟, 段德超, 彭程, 等. 硫对土壤重金属形态转化及植物有效性的影响研究[J]. 应用生态学报, 2014, 25(7): 2141-2148. doi: 10.13287/j.1001-9332.2014.0139 [43] 张志昊, 陈杰, 夏鹏, 等. 沸石-鸟粪石复合材料对土壤中铅的稳定化作用[J]. 农业环境科学学报, 2016, 35(11): 2101-2106. doi: 10.11654/jaes.2016-0760 [44] 梁媛, 王晓春, 曹心德. 基于磷酸盐、碳酸盐和硅酸盐材料化学钝化修复重金属污染土壤的研究进展[J]. 环境化学, 2012, 31(1): 16-25. [45] LIU Y X, BAO Y Y, ZHANG C, et al. The effect of aging on sequestration and bioaccessibility of oxytetracycline in soils[J]. Environmental Science and Pollution Research, 2015, 22: 10425-10433. doi: 10.1007/s11356-015-4190-7 [46] WANG T, LIU M Q, LI H X. Inoculation of phosphate-solubilizing bacteria Bacillus thuringiensis B1 increases available phosphorus and growth of peanut in acidic soil[J]. Acta Agriculturae Scandinavica Section B-Soil and Plant Science, 2014, 64(3): 252-259. [47] 依艳丽, 周咏春, 张大庚, 等. 重金属 (Zn、Cd) 污染对土壤中速效磷的影响[J]. 土壤通报, 2009, 40(3): 668-672. [48] 唐聪聪. 菌藻共生序批式泥膜系统脱氮除磷效能及作用机制研究[D]. 哈尔滨: 哈尔滨工业大学, 2018. [49] LI Y, WANG X J, LI J, et al. Effects of struvite-humic acid loaded biochar/bentonite composite amendment on Zn (II) and antibiotic resistance genes in manure-soil[J]. Chemical Engineering Journal, 2019, 375: 122013. doi: 10.1016/j.cej.2019.122013 [50] HUERTA B, MARTI E, GROS M, et al. Exploring the links between antibiotic occurrence, antibiotic resistance, and bacterial communities in water supply reservoirs[J]. Science of the Total Environment, 2013, 456: 161-170. -



 下载:
下载: