-
邻苯二甲酸正二丁酯 (din-butyl phthalate,DBP) 是邻苯二甲酸酯 (phthalic acid esters,PAEs) 的一种,在我国农田土壤中被普遍检出[1-2]。土壤中的DBP能被作物吸收累积,从而对农产品安全和人体健康构成潜在威胁[3-4]。虽然目前国内外广泛开展了对污染土壤修复的研究,提出了许多较为实用的修复方法,但从目前我国实际情况来看,通过选育吸收污染物少和/或在可食部位污染物积累少的作物品种,降低污染物进入食物链的风险,仍是我国中低度污染土壤安全利用的重要途径[5-7]。
研究表明,植物根系分泌物能促进土壤颗粒或土壤-植物界面中的有机污染物的吸附/解吸行为,从而改变其被植物吸收的程度[8-11]。其主要机理是根系分泌物中的低分子有机酸 (含有1~6个碳原子和1~3个羧基的短链碳化合物 (分子量<250) ) 结合土壤阳离子,促进通过阳离子键与矿物连接的有机污染物的解吸;或/和破坏有机污染物与土壤矿物结合的桥键,增加土壤可溶性有机质,促进有机污染物的解吸[12-16]。GAO等[17-18]的研究表明,黑麦草 (Lolium multiflorum) 根系分泌物中的低分子有机酸可以促进土壤吸附态多环芳烃 (polycyclic aromatic hydrocarbons,PAHs) 转变为可提取态PAHs,从而提高对其的吸收累积。向日葵 (Helianthus annuus) 地上部邻苯二甲酸邻苯二甲酸二 (2-乙基己基) 酯 ( (di-(2-ethylhexyl) phthalate,DEHP) ) 的含量随土壤柠檬酸添加浓度的增加而增加[11]。XIANG等[15]基于核磁共振光谱、紫外光谱和对金属离子、铁/铝有机金属络合物和溶解有机碳的分析,证实了生菜根系分泌物中的草酸可以通过增强土壤金属离子、铁铝氧化物和有机物的溶解,形成草酸盐-金属络合物,提高土壤全氟辛烷磺酸 (perfluorooctanoic acid,PFOA) 的解吸,从而导致不同品种生菜对PFOA的吸收累积程度不同。
根系分泌物中低分子有机酸对土壤有机污染物解吸行为的促进作用不仅是有机污染土壤植物修复的理论依据[17-18],也可作为筛选有机污染物低累积作物品种的科学依据[15,19]。XIANG等[15]和DU等[19]分别对比研究了PFOA高/低吸收累积型生菜和PAEs高/低吸收累积型水稻根系分泌物中低分子有机酸组成特征及其对土壤PFOA和PAEs的解吸差异,以及这种差异与生菜和水稻中PAEs和PFOA含量的相关性,研究结果表明,根系分泌物中低分子有机酸种类和质量浓度的差异是导致不同品种生菜和水稻中PFOA和PAEs含量的重要因素。因此,本研究选取前期筛选出的DBP高/低累积型菜心品种,采用溶液培养方法,对比研究DBP污染下2种菜心根系分泌物中低分子有机酸的组成特性及其对土壤DBP解吸的影响,为DBP低累积作物品种的筛选提供科学依据。
-
供试菜心品种为课题组前期筛选得到的DBP高/低累积型菜心[20],分别为油青60天菜心和特青60天菜心 (以下分别简称油青和特青) 。其中油青菜心种子购自广东省农业科学研究院;特青菜心种子由国家蔬菜种质资源中期库提供。供试土壤取自华南农业大学试验农场水稻田,其pH为 7.57,有机质含量为22.19 mg·kg−1,阳离子交换量 (CEC) 为17.34 cmol·kg−1,2~0.05 mm土粒占31%,0.05~0.002 mm 土粒占52.0%,<0.002 mm土粒占17.0%。
-
采用Hoagland配方溶液培养方法培养2种菜心。设置培养液中DBP (分析纯) 质量浓度为20 mg·L−1和50 mg·L−1 (用小于总体积的0.2%甲醇促溶) ,同时设置未添加DBP的处理为对照处理,各处理3个重复。采用移栽方法将育苗板中长到3片真叶的菜心幼苗移至100%营养液中,每盆移植6株幼苗,每盆营养液的体积为1.0 L,随机排列。营养液每天通气以保证植株供氧量,并用0.01 mol·L−1 HCl或0.01 mol·L−1 NaOH调节各处理营养液的pH值,使其保持在6.2~6.5之间。每周更换1~2次营养液。
根系分泌物的收集采用灭菌蒸馏水收集法。在菜心生长的第12 d (叶片生长期) 、32 d (菜薹形成期) 和48 d (开花期) 上午8:00开始,用灭菌蒸馏水清洗菜心根部3~5次,然后用滤纸吸干根表面水分,将洗净根系的菜心转移至装有1 000 mL灭菌蒸馏水的玻璃罐内培养。玻璃罐的外壁用2层黑色塑料薄膜包住,培养8 h。将玻璃罐内灭菌蒸馏水过0.45 µm的滤膜,滤液为根系分泌物溶液,即刻测定或保存于0~4 ℃的冰箱中不超过24 h。
-
采用离子色谱法 (ion chromatography, IC) 对根系分泌物中的6种低分子有机酸 (包括甲酸、乙酸、丙酸、苹果酸、草酸和柠檬酸) 进行测定。离子色谱仪为ICS-900 (黛安) ,柱子为AS11,内径4 mm。采用梯度洗脱法,OH−初始浓度为1 mmol·L−1,保留10 min;梯度洗脱15 min;最终浓度45 mmol·L−1,保留5 min。将1 mL通过0.45 µm滤膜的根系分泌物直接进样。
甲酸、乙酸、丙酸和苹果酸 (色谱纯) 的最低检测质量浓度为0.05 mg·L−1,草酸 (色谱纯) 的最低检测质量浓度为0.1 mg·L−1,柠檬酸 (色谱纯) 的最低检测质量浓度为2.0 mg·L−1。采用标准曲线定量。
-
通过向体系中添加蒸馏水或根系分泌物溶液来研究2种根系分泌物对土壤吸附态DBP的解吸效应。按文献[21]的方法配制20 mg·kg−1 DBP污染土壤,用万分之一天平称取0.5 g污染土壤于70 mL的玻璃离心管中,然后向每管加入含有CaCl2 (质量分数为0.01%) 和NaN3 (质量分数为0.05%,控制微生物的生长) 溶液的根系分泌物溶液25 mL,加入一定的甲醇溶液促溶 (甲醇溶液的体积不超过体系总体积的0.5%) 。然后将离心管放置于25 ℃的摇床振荡,避光,以200 r·min−1的速度振荡24 h (前期研究表明DBP在土壤-根系分泌物溶液两相中达到解吸平衡时间为24 h) 。以2 000 r·min−1离心10 min,采用0.22 µm的滤纸过滤,获得解吸液,测定其DBP的质量浓度。同时,选取根系分泌物中含量较高的2种低分子有机酸 (草酸和苹果酸) ,按照以上程序进行单一低分子有机酸对土壤DBP的解吸效应研究。
-
采用液液萃取方法提取解吸液中DBP,具体提取方法参考广州市地方技术规范[22]。提取过程中,每批样品选取1~2个样品加入硝基苯-d5作为替代物,设置空白、空白加标和试样加标,用以控制整个提取过程中样品的污染和方法中替代物的回收率。
DBP的检测采用气相色谱-质谱联用 (GC-MS) ,检测方法参考US EPA 8270C方法。GC参数为:进样口温度250 ℃,初始柱温40 ℃,总压力为49.7 Kpa, 总流量为24 mL·min−1,柱流量为1 mL·min−1,线速率为36.1 cm·s−1。 升温程序为:初始温度40 ℃ (保持2 min) ,以35 ℃·min−1的速度升至110 ℃,然后以15 ℃·min−1的速度升至275 ℃,最后25 ℃·min−1的速度升至280 ℃ (停留10 min) 。MS参数为:离子源温度220 ℃,接口温度250 ℃,溶剂截出时间为5.5 min;采用SIM方法采集特征离子。采用内标法 (菲-d10) 定量。空白中未检测出目标化合物,硝基苯-d5的回收率为82.69%~90.25%。
-
整个生长周期2种菜心根系分泌物的pH值介于5.54~6.13 (油青) 和5.60~6.20 (特青) 。总体来看,随培养液中DBP污染质量浓度增加,2种菜心根系分泌物在第12 d (叶片生长期) 和第32 d (菜薹形成期) 的pH值先略升高后下降,差异不显著;而在第48 d (开花期) ,2种菜心污染处理根系分泌物的pH值则显著高于对照处理 (表1) 。
随着培养时间的延长,2种菜心根系分泌物的pH值均呈现升高的趋势,对照处理pH值在第48 d比第12 d提高了0.4~0.5个单位。这可能与2种菜心根系分泌物中低分子有机酸含量随着培养时间的增加而降低有关 (见2.2) 。2种菜心品种相比,特青根系分泌物pH值整体高于油青,但数值较接近,不存在显著差异。
-
2种菜心根系分泌物中均检出甲酸、乙酸、草酸和苹果酸。其中乙酸只在油青的第12 d与特青的第12 d和32 d根系分泌物中被检出,质量浓度低于0.5 mg·L−1 (数据未列出) ,其他3种低分子有机酸在所有取样阶段均被检出。与草酸和苹果酸相比,2种菜心根系分泌物中甲酸的质量浓度相对较低,绝大部分处理低于1.0 mg·L−1 (数据未列出) 。因此,草酸和苹果酸为2种菜心根系分泌中的2种主要低分子有机酸。
根系分泌物中草酸的质量浓度为2.07~9.28 mg·L−1 (油青) 和1.56~3.97 mg·L−1 (特青) (图1) 。DBP污染下,油青根系分泌物中草酸质量浓度在第12 d和32 d显著下降,其中第12 d的50 mg·L−1处理是对照处理72.4%;而在第48 d根系分泌物中草酸质量浓度则随DBP污染水平的增加而显著增加,其中50 mg·L−1处理比对照处理增加了152.7%。特青根系分泌物中草酸质量浓度对DBP污染胁迫的响应较弱,第12 d和48 d的污染处理与对照处理之间无显著差异,只在第32 d随DBP污染水平的增加而显著增加,50 mg·L−1处理比对照处理增加了19.4%。
随着生长时间的延长,油青对照处理根系分泌物中草酸质量浓度显著下降,第32 d和48 d分别是第12 d的37.4%和22.3%;而污染处理根系分泌物中草酸质量浓度先显著下降,后显著增加,其中50 mg·L−1处理第32 d和48 d分别是第12 d的36.5%和2.14倍。特青根系分泌物中草酸质量浓度随培养时间的延长而下降,其中对照处理第32 d和48 d分别是第12 d的56.6%和45.9%;50 mg·L−1处理第32 d和48 d分别是第12 d的68.9%和49.0%。
-
蒸馏水处理解吸液中DBP的质量浓度约为70 μg·L−1,2种菜心根系分泌物解吸液中DBP的质量浓度分别介于140~262 μg·L−1 (第12 d) 、183~325 μg·L−1 (第32 d) 、136~211 μg·L−1 (第48 d) (图2) ,是蒸馏水处理的2.03~4.58倍,差异显著,说明2种菜心根系分泌物均能显著促进土壤DBP的解吸。其中特青根系分泌物解吸液中DBP的质量浓度是油青的56.6%~89.7%,差异显著,说明特青根系分泌物对土壤DBP的解吸作用显著低于油青。
添加油青根系分泌物解吸液中DBP的质量浓度与菜心培养液中DBP污染水平和生长阶段密切相关。随着菜心培养液中DBP污染水平的增加,解吸液中DBP质量浓度呈现增加趋势,其中第32 d达到显著水平,20 mg·L−1处理和50 mg·L−1处理解吸液中DBP的质量浓度分别比对照处理增加了19.6%和59.3%。随菜心培养时间的延长,油青根系分泌物解吸液中DBP的质量浓度先增加而后下降, 20 mg·L−1处理和50 mg·L−1处理第32 d解吸液中DBP的质量浓度分别比第12 d增加了9.42%和24.0%,第48 d解吸液中DBP的质量浓度分别是第12 d的84.8%和80.5%。
添加特青根系分泌物解吸液中DBP的质量浓度随菜心培养液中DBP污染水平的增加而增加,但影响程度较弱,除第32 d 的50 mg·L−1处理根系分泌物解吸液中DBP质量浓度显著高于对照处理以外,第12 d和48 d各处理间无显著差。随菜心生长时间的延长,特青根系分泌物解吸液中DBP质量浓度先增加而后下降,第32 d根系分泌物解吸液中DBP质量浓度比第12 d增加了30.7%~41.9%,差异显著;而第48 d根系分泌物解吸液中DBP质量浓度与第12 d接近,无显著差异。
特青根系分泌物对土壤DBP的解吸率 (解吸液中DBP的含量占DBP添加量的百分比) 为35.0%~37.0% (第12 d) 、45.8%~52.5% (第32 d) 和34.0%~36.6% (第48 d) ,油青根系分泌物对土壤中DBP的解吸率,分别为54.1%~65.4% (第12 d) 、51.0%~81.1% (第32 d) 和45.8%~52.6% (第48 d) (表2) ,特青显著低于油青。
-
实验质量浓度范围内,添加草酸解吸液中DBP质量浓度随草酸质量浓度的增加而显著增加,最大质量浓度为194 μg·L−1;添加苹果酸解吸液中DBP质量浓度随苹果酸质量浓度的增加而增加,其中4 mg·L−1处理和6 mg·L−1处理解吸液中DBP质量浓度差异不显著,其他处理间差异均达显著水平,最大质量浓度为175 μg·L−1 (图3) 。草酸和苹果酸对土壤DBP的解吸率为分别为17.5%~48.5%和17.5%~43.8%。同一质量浓度下 (2 mg·L−1) ,草酸对土壤DBP的解吸促进作用显著高于苹果酸,前者解吸液中DBP质量浓度是后者的1.68倍,差异显著 (表3) 。
-
虽然LIN等[23]的研究表明,含有根系分泌物的白菜根际土壤对DBP的吸附量高于非根际土,认为根系分泌物能促进土壤对DBP的吸附,但更多的研究表明,根系分泌物能促进土壤有机污染物的解吸。如,添加玉米、小麦和黑麦草根系分泌物土壤滴滴涕 (dichloro-diphenyl-trichloroethane,p,p’-DDT) 的解吸率比添加蒸馏水处理分别提高了8.4%~35.8%,9.7%~36.8%和3.1%~23.7%[14];添加水稻根系分泌物土壤中DBP和DEHP的解吸量比添加蒸馏水处理分别增加了117%~432%和107%~389%[19]。黄菖蒲属植物 (Holcus lanatus) 、芦苇 (Scirpus triqueter) 和生菜根系分泌物可以促进土壤六氯环己烷 (hexachlorocyclohexane,HCH) 、芘 (pyrene,PYR) 和PFOA的解吸[9,12,15]。本研究添加2种菜心根系分泌物土壤DBP的解吸率分别为34.0%~52.5% (特青) 和45.8%~81.1% (油青) ,显著高于添加蒸馏水处理 (约为17.0%) ,说明添加2种菜心根系分泌物能显著提高土壤DBP的解吸,与已有研究结论一致。
根系分泌物中的低分子有机酸是其促进土壤有机污染物解吸的主要活性成分,但根系分泌物中低分子有机酸组成特征与植物种类和污染胁迫条件等密切相关。生菜根系分泌物中检测出草酸、丙二酸、柠檬酸和乙酸,其中草酸是最主要的低分子有机酸,其次是乙酸[15];而一年生早熟禾 (Poa annua) 、南苜蓿 (Medicago polymorpha) 和大叶锦葵 (Malva sylvestris) 3种植物根系分泌物中均检测出草酸、苹果酸和富马酸,其中草酸和苹果酸是主要的低分子有机酸[24]。根系分泌物中低分子有机酸组成差异不仅存在于植物种间,还存在于植物种内。如,PAEs低累积型水稻根系分泌物中低分有机酸以酒石酸、苹果酸、乙酸和丙二酸为主,而PAEs高累积型水稻根系分泌物中低分有机酸以草酸、苹果酸、酒石酸和丙二酸为主,且前者根系分泌物中低分子有机酸质量浓度显著高于后者[19]。污染胁迫下植物根系分泌物中低分子有机酸组成特征会产生相应的变化,且不同植物变化特征不同[25-27]。一年生早熟禾 (Poa annua) 根系分泌物中草酸质量浓度随污染质量浓度的增加而下降,而大叶锦葵 (Malva sylvestris) 根系分泌物中草酸质量浓度随污染质量浓度的增加而增加[24]。裸子甘蓝根分泌物低分子有机酸 (以酒石酸为主) 质量浓度随PAHs污染质量浓度的增加而先增加 (第15 d达到最高水平) 后下降[28]。本研究2种菜心根系分泌物中均检测出甲酸、乙酸、草酸和苹果酸,其中以草酸和苹果酸为主。总体来看,特青根系分泌物中低分子有机酸质量浓度低于油青。DBP污染胁迫下,特青根系分泌物中草酸和苹果酸质量浓度的变化程度较弱,部分处理间差异显著;而油青根系分泌物中草酸和苹果酸的质量浓度的变化较为复杂,与菜心生长阶段和低分子有机酸种类有关。
低分子有机酸对土壤有机污染物解吸的促进程度与低分子有机酸的质量浓度和种类密切相关。GAO等[18]的研究表明,柠檬酸、苹果酸和草酸均能提高土壤单个PAH和∑PAH (文献中8种PAH之和) 的解吸 (单个PAH提高54%~745%;∑PAH提高58%~605%) ,且实验质量浓度范围内,单个PAH和∑PAH的解吸率随添加低分子有机酸质量浓度的增加而升高。柠檬酸、草酸和苹果酸对红树林沉积物中菲 (phenanthrene,PHE) 和PYR的解吸和迁移影响大小顺序为:柠檬酸>草酸>苹果酸[29]。本研究实验浓度范围内,同一质量浓度下 (2 mg·L−1) 草酸对土壤DBP的解吸促进作用显著高于苹果酸。这主要是因为,一方面,草酸和苹果酸均为二元酸,但草酸 (分子量为90) 的分子量小于苹果酸 (分子量为134) ;另一方面,草酸的解离常数 (Ka1=5.9×10−2) 大于苹果酸 (Ka1=1.4×10−3) ,因此,同等质量浓度下,草酸具有更多羧基可以促进土壤结合态DBP的释放,与GAO等[18]和YUAN等[16]的研究结论一致。草酸和苹果酸对土壤中DBP解吸的促进程度均随其质量浓度的升高而增加,分别高达177.1%和150.0%,与已有研究结论一致。相关性分析表明,单一的草酸或苹果酸对土壤DBP解吸的促进作用与其质量浓度呈显著正相关 (r>0.883,P<0.05) ,但2种菜心根系分泌物对土壤DBP解吸的促进程度与其根系分泌物中草酸或苹果酸质量浓度相关性较弱 (r<0.146,P>0.05) ,说明低分子有机酸不是2种菜心根系分泌促进土壤DBP解吸作用的主要因素,这与已有的研究结论不同。除了低分子有机酸,根系分泌物溶解性有机碳等指标也是促进土壤有机污染物吸附/解吸的主要活性成分[19],后续可以开展相关研究。
-
1) 2种菜心根系分泌物中检测出甲酸、乙酸、草酸和苹果酸,其中草酸和苹果酸是2种菜心根系分泌物中主要的低分子有机酸。油青根系分泌物中草酸和苹果酸质量浓度分别为2.07~9.28 mg·L−1和1.15~14.33 mg·L−1,特青根系分泌物中草酸和苹果酸质量浓度分别为1.56~3.97 mg·L−1和1.06~15.38 mg·L−1。特青根系分泌物中草酸质量浓度显著低于油青 (第32 d的50 mg·L−1处理之外) ,前者是后者的39.2%~53.1%;特青根系分泌物中苹果酸质量浓度与油青接近,少部分处理差异显著。
2) 2种菜心根系分泌物均能显著提高土壤中DBP的解吸。与添加蒸馏水处理相比,添加根系分泌物解吸液中DBP的质量浓度提高了161.4%~357.7% (油青) 和94.3%~195.8% (特青) ,2种菜心根系分泌物对土壤DBP的解吸率分别为45.8%~81.1%和34.0%~52.5%,特青根系分泌物显著低于油青。
3) 相关性分析表明,草酸或苹果酸对土壤DBP解吸的促进作用与其质量浓度呈显著正相关 (r>0.883,P<0.05) ,但2种菜心根系分泌物对土壤DBP解吸的促进程度与其草酸或苹果酸质量浓度相关性较弱 (r<0.146,P>0.05) ,说明低分子有机酸不是2种菜心根系分泌物促进土壤DBP解吸作用的主要因素。
2种菜心根系分泌物低分子有机酸组成特征及对土壤邻苯二甲酸正二丁酯解吸的影响
Characteristics of low molecular organic acid composition in the root exudates of two cultivars of Brassica parachinensis L. and their impacts on DBP desorption in soil
-
摘要: 为探究邻苯二甲酸正二丁酯 (DBP) 高/低累积型菜心对DBP吸收累积差异的机理,采用溶液培养和室内批量实验方法,对比研究DBP污染下DBP高/低累积型菜心根系分泌物中低分子有机酸组成特征及其对土壤DBP解吸的影响。研究结果表明,2种菜心根系分泌物中均检测出甲酸、乙酸、草酸和苹果酸,其中草酸和苹果酸为2种菜心根系分泌物中主要的低分子有机酸,其在2种菜心根系分泌物中的质量浓度分别为1.56~9.28和1.06~15.38 mg·L−1。总体来看,特青根系分泌物中低分子有机酸的质量浓度低于油青。添加2种菜心根系分泌物土壤DBP的解吸率分别为45.8%~81.1% (油青) 和34.0%~52.5% (特青) ,显著高于添加蒸馏水处理 (17.0%) ,特青根系分泌物对土壤DBP的解吸率显著低于油青。相关性分析表明,2种菜心根系分泌物对土壤DBP的解吸程度与其草酸或苹果酸质量浓度相关性较弱 (r<0.146,P>0.05) ,这说明低分子有机酸不是2种菜心根系分泌促进土壤DBP解吸作用的主要因素。本研究结果可为DBP低累积作物品种的筛选提供参考。Abstract: To explore the mechanisms for different absorption and accumulation of the high/low DBP(din-butyl phthalate)-accumulation Brassica parachinensis L. cultivars for DBP, this study used solution culture and indoor batch experiments to compare the composition characteristics of low molecular organic acid in root exudates of high/low DBP-accumulation Brassica parachinensis L and their effects on the desorption of DBP in soil. The results showed that formic acid, acetic acid, oxalic acid, and malic acid were detected in the root exudates of two cultivars of Brassica parachinensis L., among which oxalic acid and malic acid were the main low-molecular organic acids in the root exudates of the two cultivars. The concentrations of oxalic acid and malic acid were 1.56~9.28 and 1.06~15.38 mg·L−1, respectively, in the root exudates of the two cultivars. Overall, the mass concentrations of low-molecular organic acids in the root exudates of Teqing were significantly lower than those of Youqing. The desorption percentages of DBP in soil supplemented with the root exudates of the two cultivars were 45.8%~81.1% (Youqing) and 34.0%~52.5% (Teqing), which were significantly higher than those supplemented with distilled water (17.0%). The desorption percentages of the root exudates of Teqing were significantly lower than those of Youqing. Correlation analysis showed that the effects of root exudates of the two cultivars on desorption percentages of DBP from soil were weakly correlated with the mass concentrations of oxalic acid or malic acid in the root exudates (r<0.146, P>0.05), indicating that low-molecular organic acids were not major factors in promoting DBP desorption from soil by the root exudates of the two cultivars. The research conclusions provide scientific basis for the screening of low DBP-accumulation crop species.
-
目前,国内外开发页岩气主要采用水力压裂的方法。水力压裂法主要是将压裂液(即水和化学试剂组成的混合液)和固体颗粒支撑剂在高压条件下泵入地层深处的岩石,压裂页岩层,形成缝隙,使页岩气更流畅地从岩石裂缝中释放[1]。压裂完成后,压裂液与页岩中的水混合作为返排液返回地面。非常规页岩气快速发展产生了许多环境问题,压裂过程中耗水量大和压裂液中添加的化学物质可能导致地下水和地表水污染[2]。页岩气压裂返排液具有成分复杂[3]、较高的化学需氧量(COD)[4]、处理难度大[5-6]的特点,因而是目前最具有挑战性的工业污水之一[2, 7]。因此,有必要找到具有成本效益的处理方案,以实现这种快速增长的非常规能源的可持续发展。
“深井回注技术”是前几年页岩气压裂返排液较普遍的处理方式,由于基础设施限制并且只有在地下深层地层具有足够的孔隙度能接收压裂返排液的地方才能使用深井回注技术,因此,许多井场由于地理位置的限制无法进行深井回注[8-9]。同时,深井回注有诱导地震发生的潜在风险[10],故其可行性越来越低。目前,为了减轻水资源的压力并节约成本,业界更趋向于将返排液重复用于压裂或处理达标后直接外排[11-12]。
混凝沉降是油气行业普遍采用的污水处理工艺,适用于大体积压裂返排液处理[13],可用于页岩气压裂返排液的预处理阶段[14-15]。混凝-吸附联用的实质属于强化混凝技术范畴[16],主要是利用吸附剂大的比表面积、微孔结构和表面反应性来吸附难以被混凝去除的溶解性有机物质[17],同时密度大的吸附剂可作为絮体的凝结核,可加快絮体沉降速度而且能减少混凝产生的污泥量[18],将两者优势互补,可提高废水有机污染物的去除率[19-20]。
本研究对四川省长宁地区页岩气压裂返排液进行预处理,旨在研究混凝-吸附联用作为页岩气压裂返排液中有机污染物去除的预处理工艺的可行性,为后续研究提供参考。
1. 材料与方法
1.1 实验材料、药剂和仪器
实验以四川省宜宾市长宁县某页岩气井场压裂返排液为研究对象,所取水样呈黄褐色,浑浊,黏度较低,有异味,含有悬浮物和杂质。对压裂返排液的基本性能进行测试,测试方法参见文献中的方法[21],测试结果如下:溶液pH为7~8,水温50~60 ℃,浊度22.8 NTU,化学需氧量(COD)为580 mg·L−1,氯离子浓度24 389 mg·L−1,总悬浮物浓度74.13 mg·L−1,溶液Zeta电位为−17.35 mV。
表 1 主要有机污染物种类分析Table 1. Analysis of main organic pollutants处理方法 GC-MS检出物质/种 GC-MS检出主要有机污染物 实验原水 43 2,3,6-三甲基辛烷;正己烷;甲基环己烷;间二甲基环己烷;2-甲基辛烷;异丙基环己烷;3-二甲基壬烷;2-环己基丁烷;3-甲基癸烷;正十一烷;2,3-二甲基癸烷;3-甲基十一烷;1,1-二甲氧基壬烷;2,10-二甲基十一烷;2,6-二甲基十一烷;2,5-二甲基十一烷;2-甲基十二烷;7-亚甲基十三烷;4-甲基十四烷;十五烷;十六烷;2,6,10-三甲基十五烷;十七烷;10-甲基十九烷;2-甲基二十烷;二十烷;1-戊基-2-丙基环戊烷;二乙基环戊烷;反式十氢化萘;硝基氯仿;2-溴壬烷;1,11-二溴十一烷;1-碘十一烷;2-己基-1-癸醇;环庚烷甲醇;2-丁基-1-辛醇;1-癸醇;2-己基-1-辛醇;癸基十四醇;2-甲基癸醇;3,7,11-三甲基-1-十二烷醇;邻苯二甲酸二丁酯;戊基环戊环烯酮 仅投加硅藻土J 36 2,3,6-三甲基辛烷;正己烷;甲基环己烷;间二甲基环己烷;2-甲基辛烷;异丙基环己烷;3-二甲基壬烷;2-环己基丁烷;3-甲基癸烷;正十一烷;2,3-二甲基癸烷;3-甲基十一烷;1,1-二甲氧基壬烷;2,10-二甲基十一烷;2,6-二甲基十一烷;2,5-二甲基十一烷;2-甲基十二烷;7-亚甲基十三烷;4-甲基十四烷;十五烷;十六烷;2,6,10-三甲基十五烷;十七烷;2-甲基二十烷;二十烷;反式十氢化萘;2-己基-1-癸醇;环庚烷甲醇;2-丁基-1-辛醇;1-癸醇;2-己基-1-辛醇;癸基十四醇;2-甲基癸醇;3,7,11-三甲基-1-十二烷醇;邻苯二甲酸二丁酯;戊基环戊环烯酮 先投加硅藻土J再投加PAC 21 2,3,6-三甲基辛烷;甲基环己烷;间二甲基环己烷;2-甲基辛烷;异丙基环己烷;3-二甲基壬烷;2-环己基丁烷;3-甲基癸烷;3-甲基十一烷;2,10-二甲基十一烷;2,6-二甲基十一烷;2,5-二甲基十一烷;2-甲基十二烷;7-亚甲基十三烷;4-甲基十四烷;2,6,10-三甲基十五烷;2-甲基二十烷;反式十氢化萘;2-甲基癸醇;3,7,11-三甲基-1-十二烷醇;戊基环戊环烯酮 药剂:硅藻土J购于吉林省嘉鹏硅藻土研发有限责任公司;聚合氯化铝(PAC)购于巩义市新一代净水材料厂;COD测定试剂购于哈希公司。
仪器:MY3000-6F六联搅拌仪(武汉市梅宇仪器有限公司);DRB200数字消解器(哈希公司);ET76020浊度测定仪(罗威邦公司);PALS 190 Plus Zeta电位分析仪(美国布鲁克海文公司);7890A-5925C气质联用仪(美国安捷伦科技有限公司)。
1.2 实验方法
1) 混凝-吸附联用实验。实验在室温下(25 ℃)进行,取页岩气压裂返排液样品500 mL,使用六联搅拌仪进行搅拌。投加PAC后,以300 r·min−1快搅1 min,再以50 r·min−1慢搅5 min;投加吸附剂后,100 r·min−1慢搅30 min,最后静置沉降30 min。先投加PAC或同时加入PAC和硅藻土J时,300 r·min−1快搅1 min后,100 r·min−1慢搅30 min,最后静置沉降30 min。除了联用顺序实验,所有实验均在PAC之前投加硅藻土J。在沉降结束后,使用移液管在水面下3 cm处取上清液以测定溶液浊度,将处理后样品用0.45 μm醋酸纤维滤膜过滤,测定溶液COD。
2) 处理后挥发性有机污染物分析。固相微萃取对水样进行前处理之后进样,通过7890A-5925C气质联用仪对处理前后水中有机污染物进行表征。气相色谱条件:柱箱温度40 ℃,进样温度250 ℃。载气:氦气,不分流进样。升温程序:40 ℃保持3 min,以5 ℃·min−1的速率升温至150 ℃保持2 min, 以10 ℃·min−1的速率升温至300 ℃保持5 min;总流量为7 mL·min−1,平衡时间为0.5 min。质谱条件:电子轰击(EI)离子源;离子源温度200 ℃,接口温度220 ℃,溶剂延迟时间0.1 min,扫描速度1 000 u·s−1,质荷比m/z为33.00~500.00。
2. 结果与讨论
2.1 混凝-吸附联用可行性研究
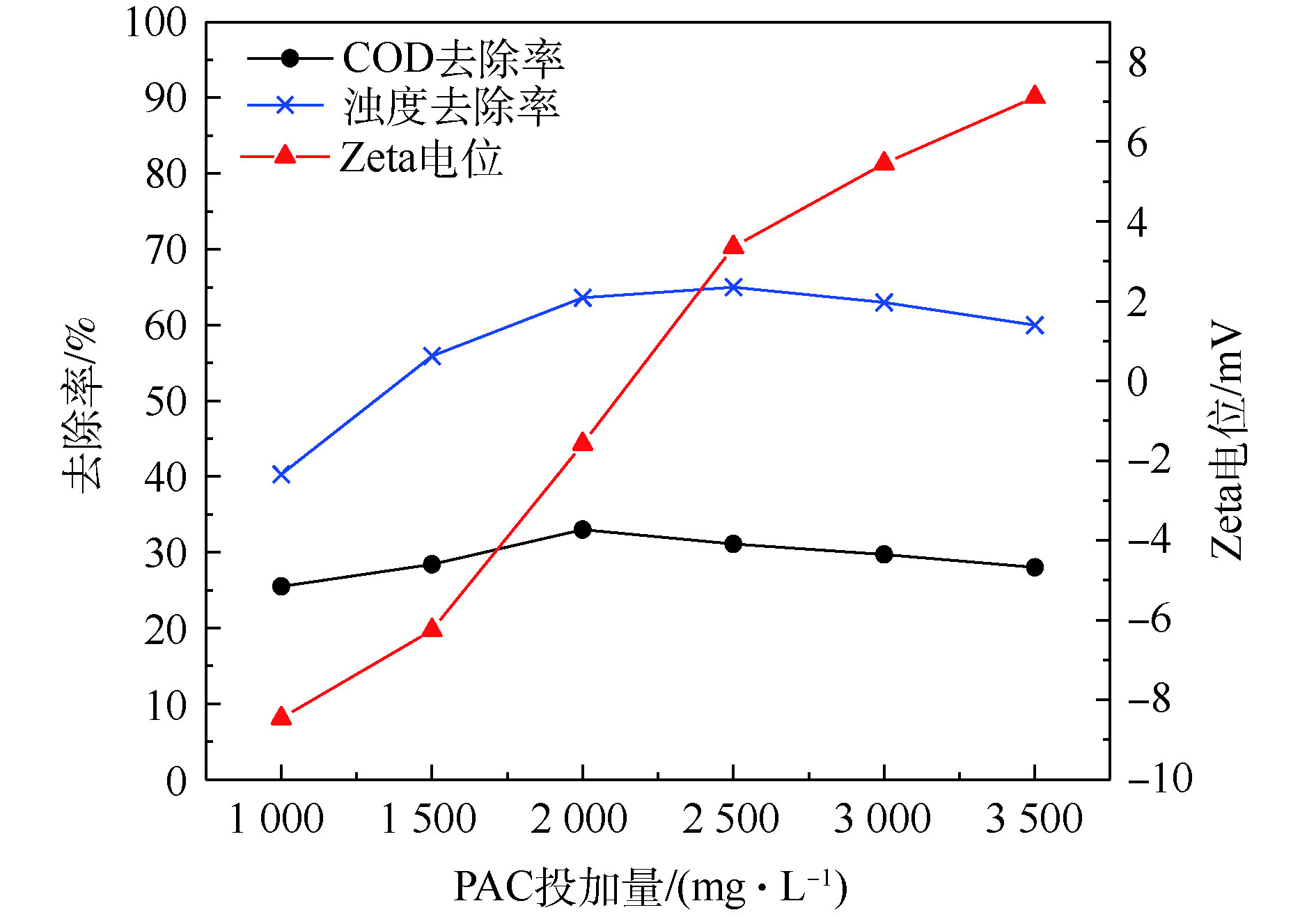
由图1可知,随着PAC投加量的增加,COD和浊度去除率先升高后呈下降趋势,ξ电位最初保持为负值逐渐接近0并最终变为正值。当PAC投加量增加到2 000 mg·L−1时,ξ电位接近等电点,COD和浊度去除率达到最大,分别为33.0%和63.6%;当投加量>2 000 mg·L−1时,COD和浊度去除率下降但变化不大,ξ电位值继续增大,由负值变为正值。
水样ξ电位为−17.35 mV,投加PAC后,ξ电位迅速上升。随着PAC投加量的逐渐增加,其水解产生带正电荷的水和羟基离子逐渐增多,阳离子进入胶体压缩扩散层,ξ电位逐渐趋近于0并靠近等电点,胶体脱稳开始集聚,形成絮体并沉降[22],混凝效果达到最佳。当PAC用量继续增加,污染物处理效果变化不大且呈下降趋势,这可能归因于混凝剂的过量添加造成多羟基金属络合离子电荷剩余,ξ电位变成正值并逐渐增大,它们之间的排斥力使体系重新稳定,凝聚效果下降。因此,可选择PAC投加量2 000 mg·L−1进行后续混凝-吸附联用实验。结果表明,仅投加硅藻土J进行吸附时,COD去除率随着投加量的升高而升高,达到8 mg·L−1时,COD去除率最大为24.9%,再增加投加量,去除率几乎不再变化。
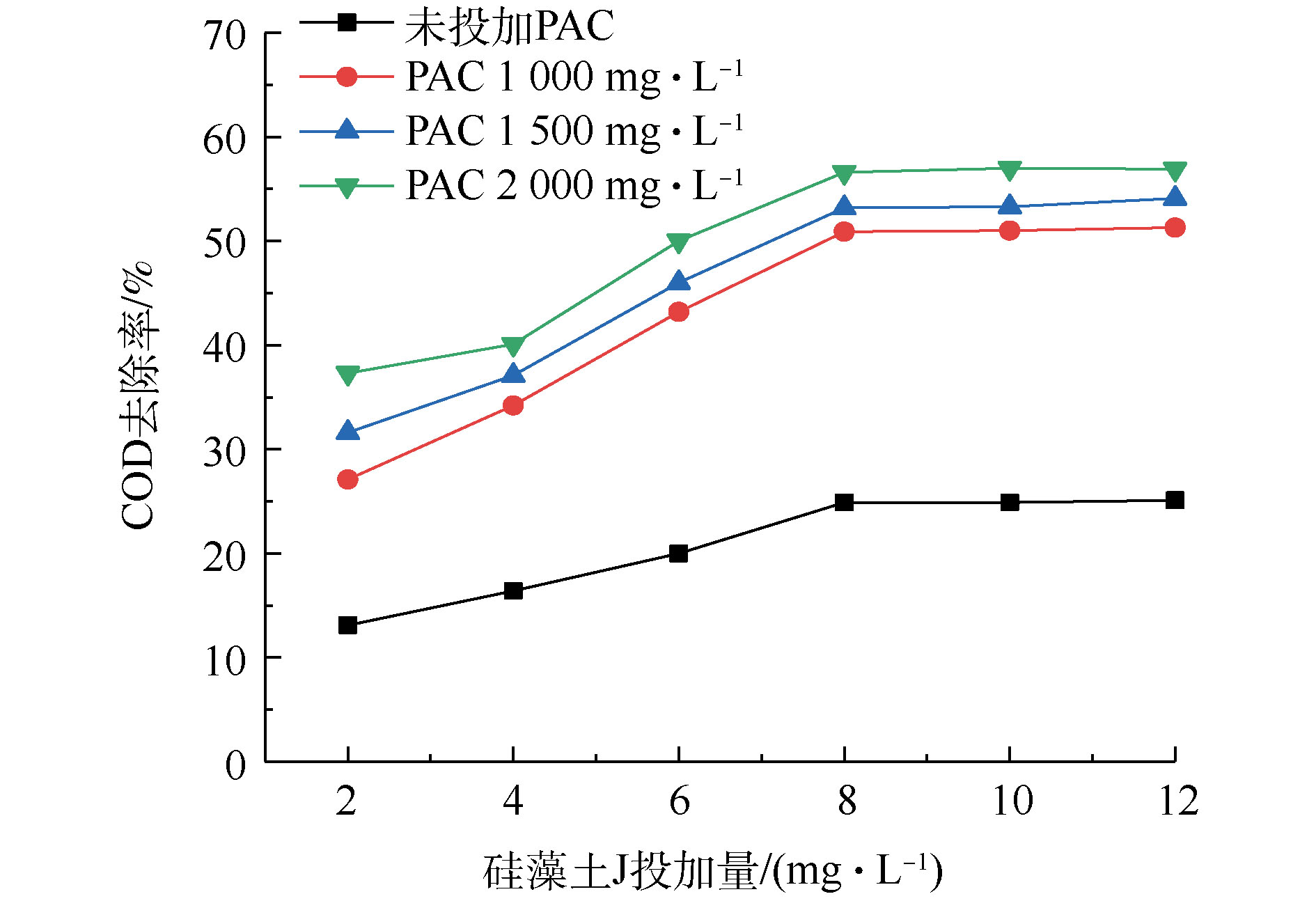
与单独投加硅藻土J相比,PAC的投加有利于COD去除效果的提升(图2)。随着2种处理剂投加量的增加,COD去除率逐渐升高。在PAC投加量为2 000 mg·L−1和硅藻土J剂量为8 mg·L−1时,COD去除率可以达到57%,比只投加PAC或硅藻土J时去除率分别提升了24%和27%。可以看出,投加硅藻土J可以达到强化混凝的目的,混凝-吸附联用是一种有效可行的处理方法。
2.2 混凝-吸附联用顺序的确定
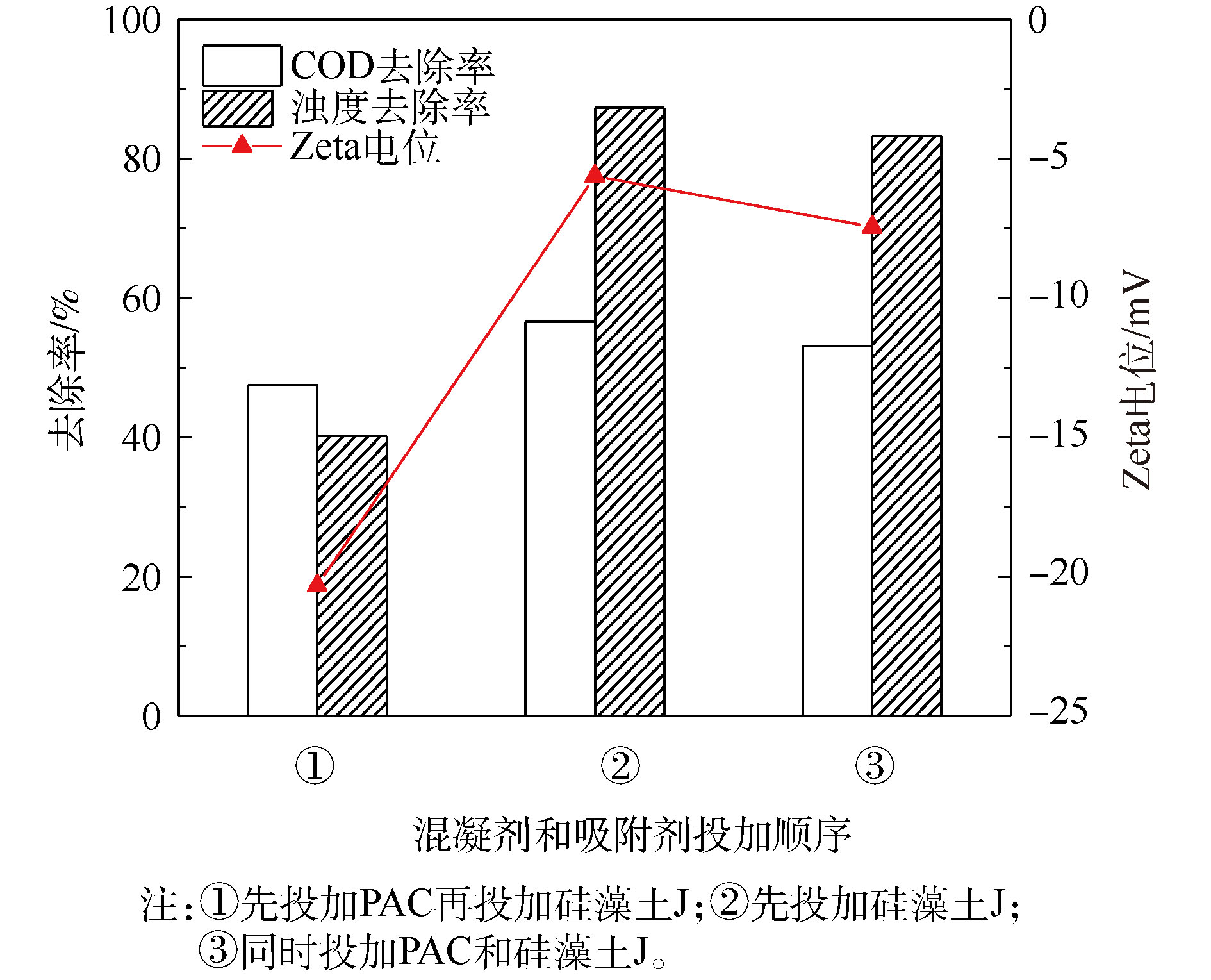
从图3可以看出,混凝剂和吸附剂的投加顺序对污染物的去除效果影响很大。先投加硅藻土J或2种处理剂同时投加的处理效果较先投加PAC效果好,先投加吸附剂时处理效果最佳,达到了溶液的最大污染物去除率,COD的去除率达到57%,浊度降低87%。先投加硅藻土J或2种处理剂同时投加时,ξ电位分别为−5.62 mV和−7.45 mV,更接近等电点,絮体形成迅速且致密;而在PAC之后加入硅藻土,ξ电位为−20.33 mV,远离等电点,絮体松散,残留浊度高。
已有研究表明:硅藻土表面在pH 2~12时带负电荷[23],先向水样中投加硅藻土J,能将小分子有机物和呈电中性的有机物吸附[24];继而投加混凝剂,混凝对胶体态物质和大分子有机物有良好的去除[25-26];此外,硅藻土可以嵌入絮体中作为絮体凝结核,改善絮状物的结构并增加絮体密度,使沉降速度加快。先投加PAC后再加入硅藻土J时,大多数硅藻土颗粒可能仅吸附在絮体的表面,使絮体ξ电位降低,水中胶体物质重新稳定,其余的硅藻土颗粒分散在溶液中会导致样本浊度升高,故采用先投加硅藻土J进行混凝-吸附联用实验。
2.3 混凝-吸附时间的确定
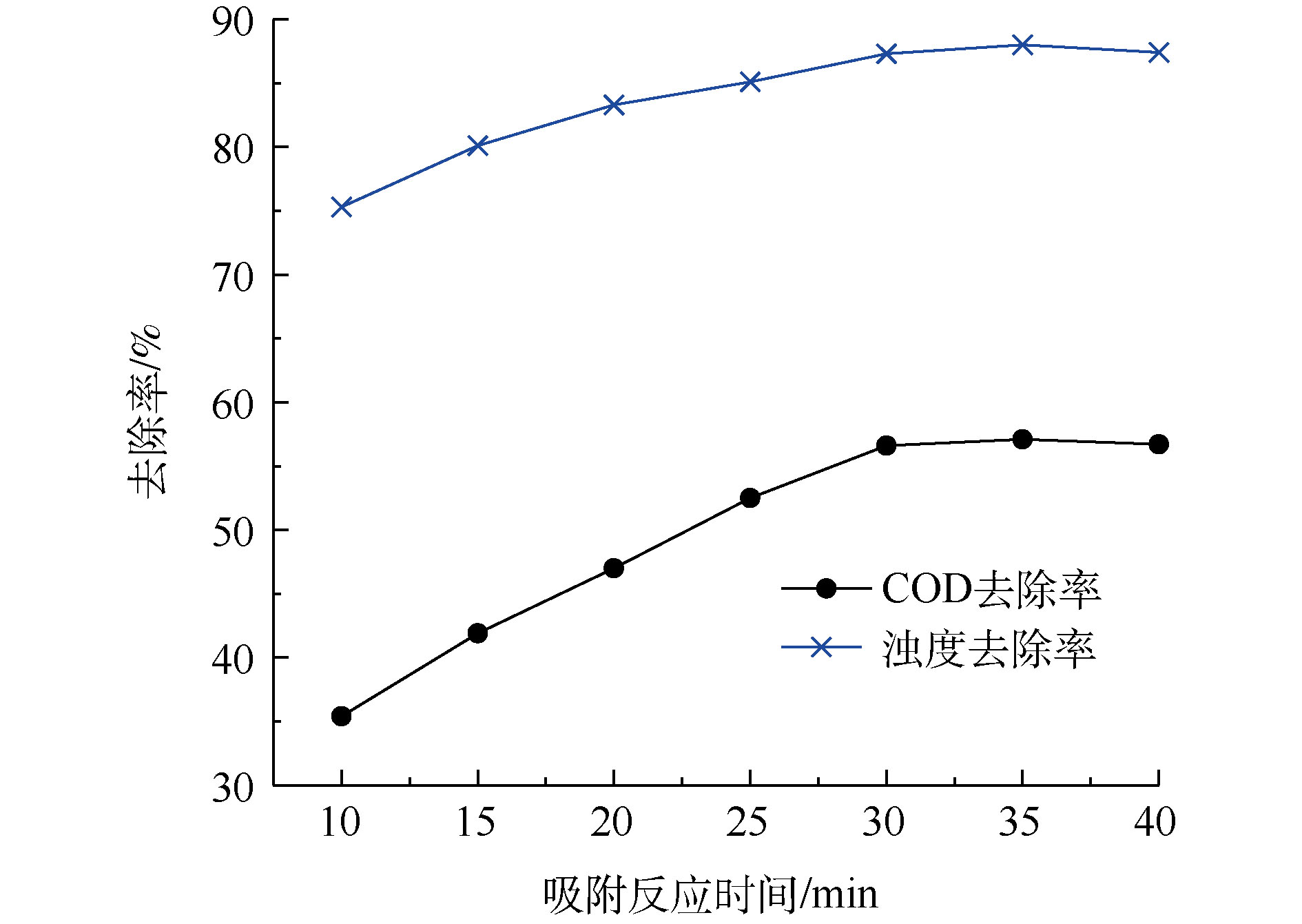
吸附剂对吸附质的吸附过程需要一定的反应时间才能取得较好的效果。因此,采用先投加硅藻土J后投加PAC的方式,考察其中吸附段反应时间对污染物去除效果的影响,如图4所示。由图4可知,30 min前,随着吸附时间的延长,污染物去除效果变好;30 min后,吸附过程逐渐达到平衡,去除效果不再随时间的变化而有明显改变。当吸附时间为30 min时,COD和浊度去除率分别达到57%和87%。
刚投加吸附剂时,水相中的污染物浓度与吸附剂表面浓度差较大,吸附剂表面的孔道和基团化学活性较高,污染物会迅速转移到吸附剂表面的吸附位点上[27];随着时间的推移,水相中竞争能力较强的污染物在吸附剂上已逐渐达到饱和,吸附速度变缓。为了使混凝和吸附时间具有更好的匹配性,并考虑综合处理成本,确定先投加硅藻土J吸附30 min后再投加PAC。
2.4 处理前后挥发性有机物分析
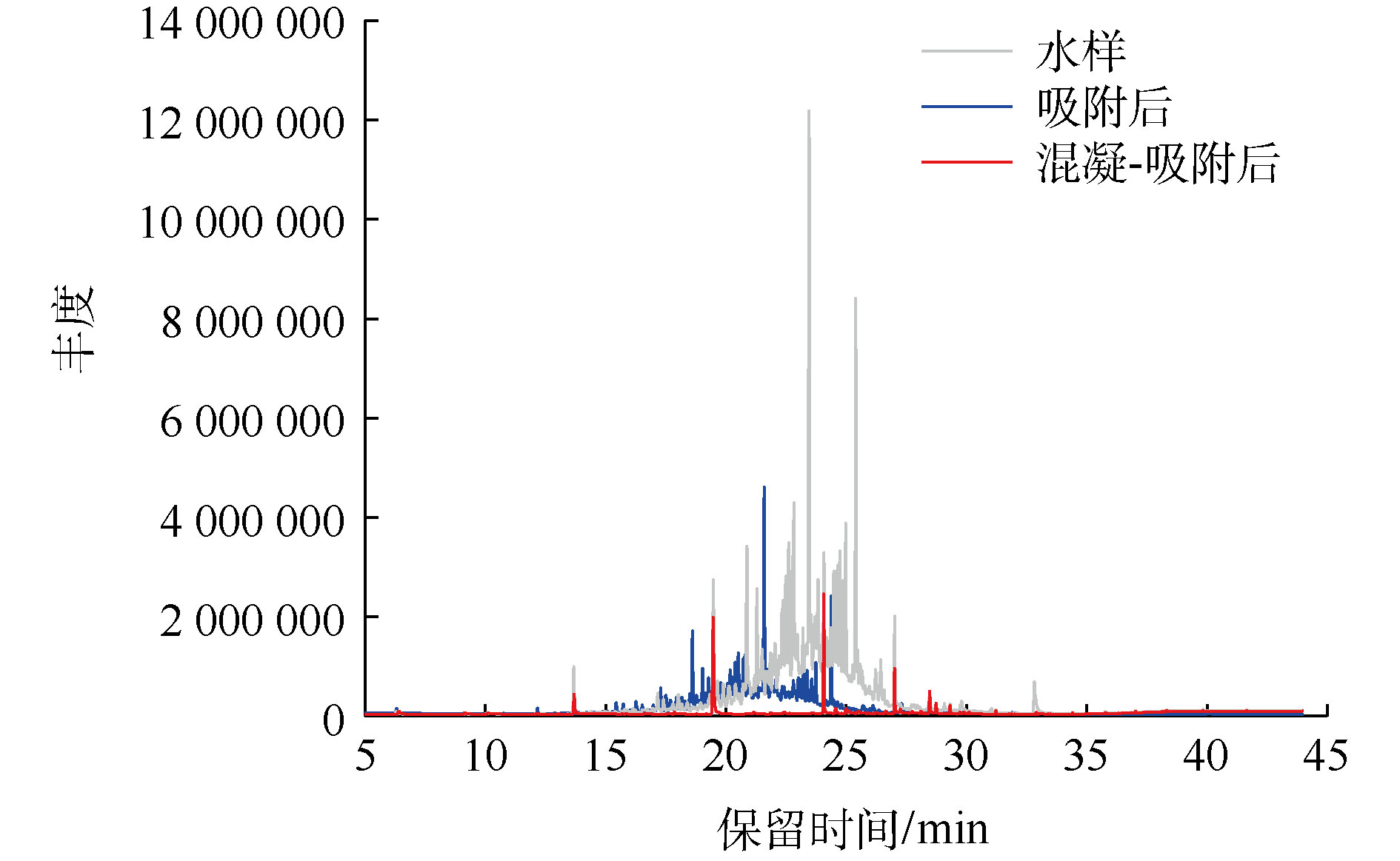
页岩气压裂返排液中含有压裂时用于钻井的残留化学添加剂,含量不高但是成分复杂[5]。图5显示了页岩气压裂返排液处理前后的总离子丰度,原水水样中检测到43种有机污染物。表1列出了检出的6类主要有机污染物。
在原水中检测到的有机污染物中包括烷烃类28种、芳香烃类1种、卤代烃类4种、醇类8种、酯类1种和酮类1种。投加硅藻土J后,有机污染物减少7种,卤代烃类得到良好的去除;进一步投加PAC后,有机物种类较原水水样减少了22种,可以将C20以下的饱和直链烷烃和邻苯二甲酸二丁酯完全去除,醇类物质可部分消除。
综合上述分析,混凝-吸附联用能够有效去除多种有机物,可为后续浓缩分离除盐段出水和不凝气COD达标提供保障。因此,混凝-吸附联用可以作为一种有效的页岩气压裂返排液预处理方法。
3. 结论
1)混凝剂PAC和硅藻土J联用具有去除页岩气压裂返排液中COD和浊度的能力。与仅投加PAC相比,硅藻土J的添加能有效加强吸附架桥作用,产生高密度、高强度的可沉降絮体。在PAC投加量为2 000 mg·L−1和硅藻土J剂量为8 mg·L−1时,有更好的污染物去除率和沉降效果。
2)联用顺序和硅藻土J作用时间可影响污染物的处理效果。在PAC之前或同时添加硅藻土可以大幅提高COD和浊度的去除率,吸附剂硅藻土J在PAC前30 min投加时处理效果最佳,COD的去除率达到57%,浊度降低87%。
3)混凝-吸附联用能去除多种有机污染物,有效降低页岩气压裂返排液有机负荷。硅藻土J-PAC联用,可处理去除页岩气压裂返排液种污染物22种,去除了大部分烷烃类、醇类、卤代烃和邻苯二甲酸二丁酯。
4) PAC和硅藻土J作为混凝剂和吸附剂进行混凝-吸附联用处理液页岩气压裂返排液,比传统的混凝/吸附处理工艺更有效、可行,能更好地降低有机负荷,并可为降低后续处理难度和成本提供参考。
-
表 1 不同生长期2种菜心根系分泌物的pH值
Table 1. The pH values of root exudates of two cultivars Brassica parachinensis L. at different growth stages
菜心品种 DBP质量浓度/(mg·L−1) pH值 第12 d 第32 d 第48 d 油青 0 (对照) 5.54±0.05a 5.66±0.09a 5.99±0.01b* 20 5.67±0.10a 5.76±0.00a 6.10±0.02a 50 5.58±0.02a 5.68±0.04a 6.13±0.09a 特青 0 (对照) 5.60±0.09a 5.72±0.06a 6.09±0.04b 20 5.63±0.05a 5.74±0.04a 6.17±0.04a 50 5.74±0.11a 5.80±0.13a 6.20±0.02a 注:表中数据为平均值 (n=3)±标准误。同一品种菜心同一生长阶段数据标有相同字母者表示差异不显著 (P>0.05) 。 表 2 2种菜心根系分泌物对土壤中DBP的解吸率
Table 2. Desorption percentages of DBP in soil by the root exudates of two cultivars of Brassica parachinensis L.
添加溶液 DBP质量浓度/(mg·kg−1) DBP解吸率/% 第12 d 第32 d 第48 d 蒸馏水 — 17.2±0.5d 17.8±1.0e 17.6±0.3d 油青根系分泌物 0 54.1±1.4b 51.0±2.3cd 45.8±2.0b 20 55.8±1.6b 60.9±1.3b 47.3±1.9ab 50 65.4±1.4a 81.1±2.5a 52.6±2.6a 特青根系分泌物 0 35.0±1.0c 45.8±2.2d 34.0±2.9c 20 35.5±1.1c 47.3±0cd 35.4±0.5c 50 37.0±1.1c 52.5±2.0c 36.0±1.5c 注:表中数据为平均值(n=3)±标准误。同一列含有相同字母者表示差异不显著 (P>0.05) 。 表 3 低分子有机酸对土壤DBP的解吸率
Table 3. Desorption rate of DBP in soil by low molecular organic acids
低分子有机酸种类 质量浓度/(mg·L−1) 解吸率/% 草酸 0 17.5±0.4e 1 26.8±1.2d 2 37.0±0.9c 5 43.8±0.8b 10 48.5±0.9a 苹果酸 0 17.5±0.4d 2 22.0±0.7c 4 25.5±0.9b 6 26.2±0.7b 8 43.8±0.6a 注:表中数据为平均值(n=3)±标准误。同一种低分子有机酸数据含有相同字母者表示差异不显著 (P>0.05) 。 -
[1] 陈玉玉, 张光全, 张杨, 等. 甘肃省农业土壤邻苯二甲酸酯累积特征及来源分析[J]. 环境科学, 2022, 43(10): 4622-4629. doi: 10.13227/j.hjkx.202111310 [2] LÜ H X, MO C H, ZHAO H M, et al. Soil contamination and sources of phthalates and its health risk in China: a review[J]. Environmental Research, 2018, 164: 417-429. doi: 10.1016/j.envres.2018.03.013 [3] REN W J, WANG Y T, HUANG Y W, et al. Uptake, translocation and metabolism of di-n-butyl phthalate in alfalfa ( Medicago sativa)[J]. Science of the Total Environment, 2020, 731: 138974. doi: 10.1016/j.scitotenv.2020.138974 [4] SUN J, WU X, GAN J. Uptake and metabolism of phthalate esters by edible plants[J]. Environmental Science & Technology, 2015, 49: 8471-8478. [5] CAI Q Y, XIAO P Y, ZHAO H M, et al. Variation in accumulation and translocation of di-n-butyl phthalate (DBP) among rice ( Oryza sativa L. ) genotypes and selection of cultivars for low DBP exposure[J]. Environmental Science and Pollution Research, 2017, 24: 7298-7309. doi: 10.1007/s11356-017-8365-2 [6] XIANG L, CHEN L, YU L Y, et al. Genotypic variation and mechanism in uptake and translocation of perfluorooctanoic acid (PFOA) in Lettuce ( Lactuca Sativa L. ) cultivars grown in PFOA-polluted soils[J]. Science of the Total Environment, 2018, 636: 999-1008. doi: 10.1016/j.scitotenv.2018.04.354 [7] YU P F, XIANG L, LI X H, et al. Cultivar-dependent accumulation and translocation of perfluorooctanesulfonate among lettuce ( Lactuca Sativa L. ) cultivars grown on perfluorooctanesulfonate-contaminated soil[J]. Journal of Agricultural and Food Chemistry, 2018, 66(50): 13096-13106. doi: 10.1021/acs.jafc.8b04548 [8] GAO Y, REN L, LING W, et al. Desorption of phenanthrene and pyrene in soils by root exudates[J]. Bioresource Technology, 2010, 101: 1159-1165. doi: 10.1016/j.biortech.2009.09.062 [9] RODRÍGUEZ-GARRIDO B, BALSEIRO-ROMERO M, KIDD P S, et al. Effect of plant root exudates on the desorption of hexachlorocyclohexane isomers from contaminated soils[J]. Chemosphere, 2020, 241: 124920. doi: 10.1016/j.chemosphere.2019.124920 [10] PEÑA A. A comprehensive review of recent research concerning the role of low molecular weight organic acids on the fate of organic pollutants in soil[J]. Journal of Hazardous Materials, 2022, 434: 128875. doi: 10.1016/j.jhazmat.2022.128875 [11] MUSTAFA A E Z M A, ALKAHTANI J, ELSHIKH M S, et al. Enhanced uptake of di-(2-ethylhexyl) phthalate by the influence of citric acid in Helianthus annuus cultivated in artificially contaminated soil[J]. Chemosphere, 2021, 264: 128485. doi: 10.1016/j.chemosphere.2020.128485 [12] HOU Y, LIU X, ZHANG X, et al. Identification of Scirpus triqueter root exudates and the effects of organic acids on desorption and bioavailability of pyrene and lead in co-contaminated wetland soils[J]. Environmental Science and Pollution Research, 2015, 22: 17780-17788. doi: 10.1007/s11356-015-4995-4 [13] LING W, REN L, GAO Y, et al. Impact of low-molecular-weight organic acids on the availability of phenanthrene and pyrene in soil[J]. Soil Biology and Biochemistry, 2009, 41(10): 2187-2195. doi: 10.1016/j.soilbio.2009.08.003 [14] LUO L, ZHANG S, SHAN X Q, et al. Oxalate and root exudates enhance the desorption of p, p”-DDT from soils[J]. Chemosphere, 2006, 63: 1273-1279. doi: 10.1016/j.chemosphere.2005.10.013 [15] XIANG L, CHEN X T, YU P F, et al. Oxalic acid in root exudates enhances accumulation of perfluorooctanoic acid in lettuce[J]. Environmental Science & Technology, 2020, 54: 13046-13055. [16] YUAN L, WU Y, FAN Q, et al. Influence mechanism of organic matter and low-molecular-weight organic acids on the interaction between minerals and PAHs[J]. Science of the Total Environment, 2023, 862: 160872. doi: 10.1016/j.scitotenv.2022.160872 [17] GAO Y, HU X, ZHOU Z, et al. Phytoavailability and mechanism of bound PAH residues in filed contaminated soils[J]. Environmental Pollution, 2017, 222: 465-476. doi: 10.1016/j.envpol.2016.11.076 [18] GAO Y, YUAN X, LIN X, et al. Low-molecular-weight organic acids enhance the release of bound PAH residues in soils[J]. Soil and Tillage Research, 2015, 145: 103-110. doi: 10.1016/j.still.2014.09.008 [19] DU P P, HUANG Y H, LÜ H X, et al. Rice root exudates enhance desorption and bioavailability of phthalic acid esters (PAEs) in soil associating with cultivar variation in PAE accumulation[J]. Environmental Research, 2020, 186: 109611. doi: 10.1016/j.envres.2020.109611 [20] 曾巧云, 莫测辉, 蔡全英, 等. 邻苯二甲酸二丁酯在不同品种菜心-土壤系统的累积[J]. 中国环境科学, 2006, 26(3): 333-336. doi: 10.3321/j.issn:1000-6923.2006.03.018 [21] 曾巧云, 卫泽斌, 龙新宪. 环境土壤学实验教程[M]. 1版. 北京: 中国农大出版社, 2022: 221-224. [22] 广州市质量技术监督局. 广州市地方技术规范水质半挥发性有机污染物(SVOCs)的测定——液液萃取-气相色谱/质谱分析法DBJ 440100/T 75-2010 [S]. 广州: 广州市环境保护局. [23] LIN Y L, WANG L, LI R, et al. How do root exudates of bok choy promote dibutyl phthalate adsorption on mollisol?[J]. Ecotoxicology and Environmental Safety, 2018, 161: 129-136. doi: 10.1016/j.ecoenv.2018.05.072 [24] MONTIEL-ROZAS M M, MADEJÓN E, MADEJÓN P. Effect of heavy metals and organic matter on root exudates (low molecular weight organic acids) of herbaceous species: An assessment in sand and soil conditions under different levels of contamination[J]. Environmental Pollution, 2016, 216: 273-281. doi: 10.1016/j.envpol.2016.05.080 [25] LAPIE C, STERCKEMAN T, PARIS C, et al. Impact of phenanthrene on primary metabolite profiling in root exudates and maize mucilage[J]. Environmental Science and Pollution Research, 2020, 27(3): 3124-3142. doi: 10.1007/s11356-019-07298-x [26] WANG Y, REN W, LI Y, et al. Nontargeted metabolomic analysis to unravel the impact of di(2-ethylhexyl) phthalate stress on root exudates of alfalfa ( Medicago sativa)[J]. Science of the Total Environment, 2019, 646: 212-219. doi: 10.1016/j.scitotenv.2018.07.247 [27] WANG J, FAROOQ T H, ASLAM A, et al. Non-targeted metabolomics reveal the impact of phenanthrene stress on root exudates of ten urban greening tree species[J]. Environmental Research, 2021, 196: 110370. doi: 10.1016/j.envres.2020.110370 [28] LIU B, WU L, PAN P, et al. Response of root exudates of Bruguiera gymnorrhiza (L. ) to exposure of polycyclic aromatic hydrocarbons[J]. Frontiers in Environmental Science, 2022, 9: 787002. doi: 10.3389/fenvs.2021.787002 [29] JIA H, LU H L, LIU J C, et al. Effects of root exudates on the leachability, distribution, and bioavailability of phenanthrene and pyrene from mangrove sediments[J]. Environmental Science and Pollution Research, 2016, 23: 5566-5576. doi: 10.1007/s11356-015-5772-0 -




 DownLoad:
DownLoad: