-
好氧高温堆肥过程中通常伴随着严重的氮素损失,散发恶臭、释放温室气体的现象,导致养分流失,影响堆肥产品的实际使用价值[1]。如何有效地控制氮素损失一直是好氧堆肥技术中的难点。研究结果表明,氨的累积挥发是堆肥过程中氮素损失的主要途径[2],并且该过程集中发生在微生物高度活跃的升温阶段和高温阶段[3]。堆肥底物中丰富的易降解有机质在微生物代谢作用下迅速分解,代谢过程释放的热量及产生的铵态氮 (NH4+-N) 在堆体中大量积累,使堆体处于较高温度与pH值,从而导致固相中NH4+-N转化为氨气 (NH3) 逸散造成严重氮素损失[4]。投加外源添加剂被认为是减少堆肥过程中减少氮素损失最便捷有效的方法[5]。常见的添加剂,如沸石与生物炭因比表面积较高,能通过吸附、离子交换等物理作用减少氨的释放[5-8 ]。镁盐与磷酸盐等化学添加剂能够降低堆肥系统pH值,以此来减少铵盐向氨的转化[9-10]。目前对于堆肥过程中氮素损失调控的研究多集中于对无机氮的调控,然而有机氮才是堆体中氮素存在的主要形式,含氮有机质在堆肥高温阶段快速矿化导致氨的累积挥发才是堆肥过程中氮素损失更深层次的原因[11]。
腐殖化过程实际上就是堆肥底物经过系列生化反应最终形成稳定类腐殖质的过程[12]。腐殖质前体物主要包括多糖、还原糖、多酚、氨基酸类物质及其不同组分的混合物,但是糖类物质作为能源物质会被微生物迅速分解转化,使其在堆肥系统中的作用受到极大限制[13]。酚类物质具有构建类腐殖质的原始骨架的作用[14],故多会选用以酚类作为前体物质去模仿腐殖化反应体系,譬如能代表多酚物质的儿茶酚。研究表明,添加儿茶酚可以促进腐殖质形成的非生物 (多酚-美拉德)途径,且相较于氨基酸、还原糖等易被生物代谢的前体物质更能在堆肥体系中发挥作用[13,15]。MnO2具有催化腐殖化的能力,且与生物酶活性中心具有相似的化学结构,能够通过非生物途径强化腐殖化过程,加强小分子有机质的缩聚,强化腐殖质的生成[16-20]。
基于强化腐殖化的理论基础,本研究通过添加儿茶酚和MnO2作为堆肥添加剂,旨在诱导堆肥初期易分解有机质向结构更稳定的类腐殖质物质转化,抑制其矿化作用,从源头上减少无机氮的产生,实现对氮素损失的调控,以期为以后的堆肥氮素保留研究提供新的研究思路和科学依据。
-
堆肥原料采用的新鲜猪粪取自重庆某养猪场;木屑购于江苏连云港尚兮木质品商行公司,其作为辅料以调节水分和C/N,具体理化性质见表1。所用药品皆购置于上海阿拉丁生化科技股份有限公司,二氧化锰 (MnO2,分子量86.94,优级纯);儿茶酚 (C6H6O2,分子量110.11,分析纯)。
-
堆肥装置以箱型有机玻璃为主体 (V=100 L),并配有流量计、气泵、曝气管、穿孔板气体洗脱瓶等配套设施,装置外壁包裹棉质保温膜,上方采用液封形式,并选用土工布覆盖于堆体上进行保温,曝气系统安装于装置底部,曝气量为1 L·min−1,0.5 moL·L−1的氢氧化钠溶液用于空气中CO2的洗脱,0.2 moL·L−1硫酸溶液用于尾气氨吸收 (图1)。堆肥基质以新鲜猪粪为主,以杨木木屑调节水分至60%,C/N约20,以MnO2及儿茶酚作为添加剂共设计4个处理,分别记为对照组 (CK),不添加外源物质;MnO2处理 (T1),仅添加1% MnO2 (以堆肥干重计,下同);儿茶酚处理 (T2),仅添加3%儿茶酚;混合处理 (T3),添加1% MnO2和3%儿茶酚。各处理药剂添加量基于前期试验确定,每个堆体总重量约23 kg。
堆肥周期为42 d,每间隔6 d进行人工翻堆,样品采集时间分别为第0、2、6、12、18、24、30、42 d。采集的样品分作2个部分处理:一部分作为鲜样,4 ℃冰箱中存放;另一部分制作风干样,自然风干后粉碎,过0.15 mm筛后存放于密封袋。气体采用5 L铝箔采气袋在氨吸收瓶后进行采集,收集时间为90 s。在堆肥运行前20 d,气体采集于每日7:00、13:00、19:00和1:00进行4次,堆肥运行后期,于每日9:00和21:00进行2次取样,氨气吸收瓶每日进行更换。
-
使用电导率仪 (Mettler-Toledo,瑞士)和pH计 (Sartorius,德国)[21],测定电导率 (EC)和pH值;使用便携式沼气分析仪 (Geotech,UK)测定CO2[22];总凯氏氮 (TKN)采用凯氏定氮法测定[23];NH3:收集后使用凯氏定氮法测定;铵态氮 (NH4+-N)与硝态氮 (NO3−-N)分别采用靛酚蓝显色法和紫外分光光度法测定[24];氨基酸、有机氮 (包括总酸解有机氮,total acid hydrolysis nitrogen,THN;酸解氨态氮,amine nitrogen,AN;氨基糖态氮,amino sugar nitrogen,ASN;氨基酸态氮,amino acid nitrogen,AAN)使用酸水解法测定[25-26];未知水解氮 (hydrolysis unknown nitrogen,HUN)采用差减法获得,即HUN= THN-AN-ASN-AAN;使用Horiba公司Aqualog®荧光光谱仪进行EEM荧光表征分析[25,27]
-
种子发芽指数 (GI):用去离子水 1∶10 (w/v)浸提鲜样后,取5 mL浸提液于无菌环境中培养萝卜种子72 h后 (温度25 ℃,湿度80%,避光)测量发芽数和根长,按式(1)计算GI值[28]。
-
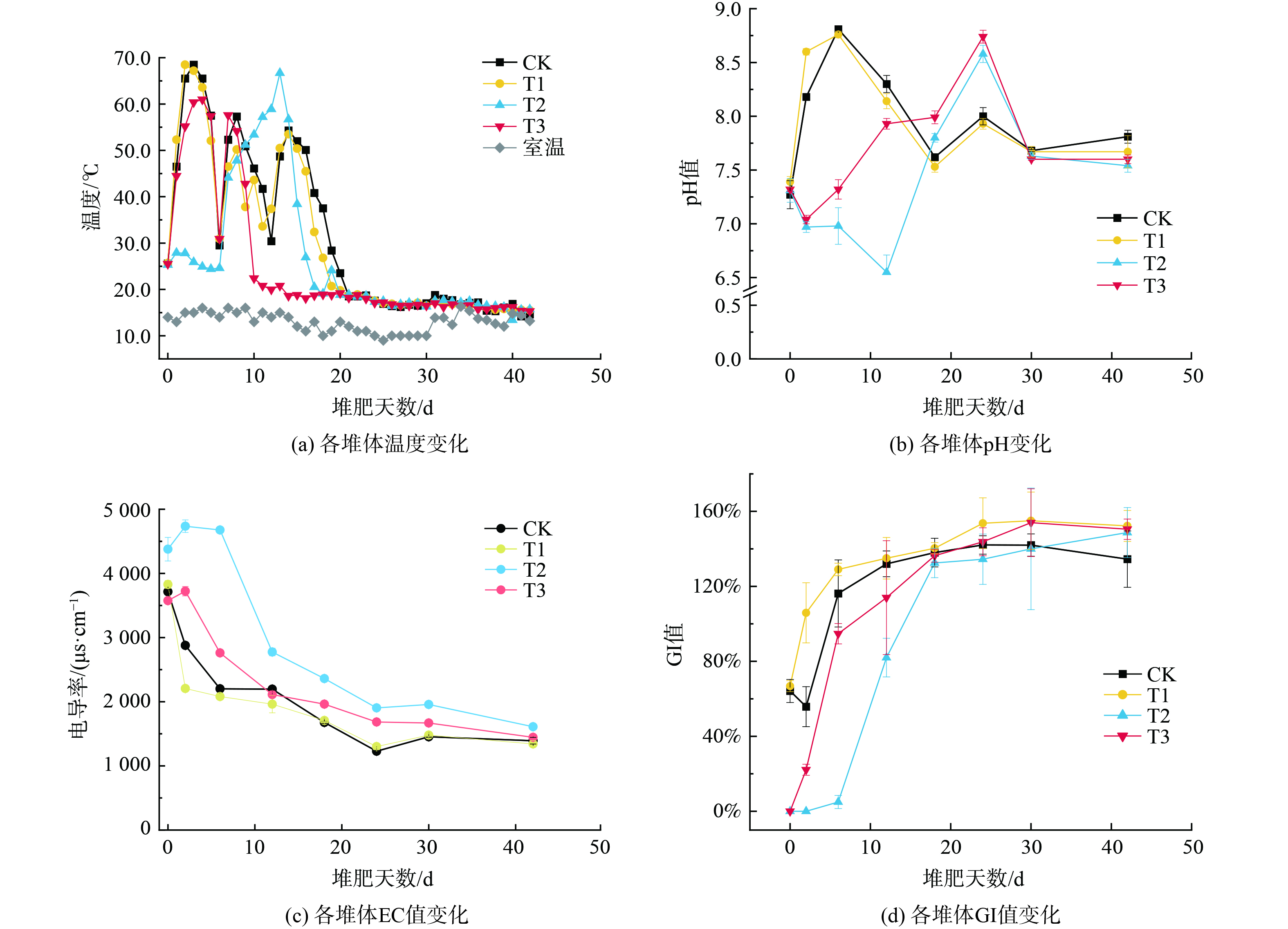
1)温度和pH。堆肥开始后,各堆体间温度变化趋势相似 (图2(a)),CK、T1、T3温度迅速升至45 ℃以上,并维持不少于3 d的高温状态 (≥55 ℃),T2的高温期明显滞后于其他处理 (P<0.05)。堆肥期间,各处理的pH值介于7.27~7.39 (图2(b))。整体上看,CK、T1的pH值变化曲线呈先上升后下降趋势,CK,T1的pH值在堆肥第6 d达到最大值,分别为8.81和8.76,T2与T3则表现出相反的变化趋势。
堆体温度是评价堆肥品质的重要指标之一,直接反映好氧堆肥微生物是否正常发酵[29]。本研究中T1相较于CK在升温期温度上升更为迅速,这可能是由于MnO2作为催化剂加速了堆肥系统的反应速率,而T2的高温期表现出明显的滞后现象,可能是由于儿茶酚的添加在堆肥初期对微生物活性具有明显的抑制作用,使得该阶段处于“停滞”状态,而1周后,由于微生物种群完成了筛选竞争过程,部分微生物适应了堆肥环境,堆体重新“启动”,而T3中并未表现出明后的滞后性,说明MnO2的引入加速了儿茶酚的分解转化,从而缓解其生物毒性,使堆肥系统正常升温。各堆体均在55 ℃以上保持了4~6 d,满足卫生要求[30]。
pH值的变化与堆肥过程中有机质的稳定程度与氮素的损失也存在紧密联系[31-32]。T1中由于Mn(IV)对H+的吸附作用使其堆肥初期pH值相较于CK上升地更快,这可能会加速堆肥系统中的固相的NH4+-N转化为气相的NH3,导致素氮素损失[33],因此,MnO2的单独添加可能会加速堆肥初期的氮素损失。儿茶酚的分解过程中H+的释放,促使pH值下降,而当儿茶酚消耗完全后,堆体pH值又回归正常变化趋势。与T2相比,儿茶酚与MnO2的联合添加使得pH下降的过程变短,说明MnO2能够催化儿茶酚进行快速分解转化,这与温度变化曲线一致。随着堆肥反应的进行,所有处理均满足腐熟要求 (pH<8.5)[34] 。
2) EC和GI。4种处理中,T2的EC初始值显著高于其余3种处理 (P<0.05),整体看来,CK、T1中EC值存在相似变化特征,即堆肥初期骤降,而后随着堆肥降速逐渐放缓,最终保持相对平稳状态,而T2与T3在前期出现短暂上升后开始骤降 (图2(c))。堆肥结束后,CK、T1、T2与T3的EC值分别为1.39、1.34、1.61和1.44 mS·cm−1均符合无公害堆肥处理标准 (EC<4 mS·cm−1)[35]。
EC值能够反映堆肥腐熟程度与生物毒性大小,其变化受到堆体中可溶性盐含量的影响。堆肥初期,由于高温期NH4+-N及其它挥发性物质大量损失所致,可溶性盐总量减少导致EC值的骤降。本研究中T1的EC值骤降可能是由于MnO2加速了堆体中小分子的降解,而T2与T3中由于儿茶酚的加入了水溶性物质的含量,进而增加了堆体的EC值。
堆肥初期,CK、T1的GI值约为60%左右,而T2与T3的种子发芽率几乎为0,但随着时间的推移,4种处理的GI值均呈现出上升趋势 (图2(d)),至堆肥结束时CK、T1、T2和T3的GI值分别为134.52%、152.25%、148.73%和150.48%,均达到安全利用的合格水平 (GI>80%)[36]。GI值受堆体中小分子有机酸、含盐量、氨氮等因素影响。本研究中,堆肥初期儿茶酚对生物生长的抑制作用表现强烈,但随着时间的推移,抑制作用被削弱,GI值逐步上升。而儿茶酚与MnO2的联合添加加速了儿茶酚的分解转化,缩短了堆肥的“解毒期”。
-
1) CO2释放量。各处理间CO2的释放量均呈先迅速升高再降低最后趋于稳定的变化趋势 (图3(a))。其中CK、T1、T2和T3的二氧化碳最高释放量分别为508.29、633.91、239.17、462.69 g·d−1。T2处理中,堆肥初期CO2的释放速率受到儿茶酚添加影响,明显低于其他处理,而T3处理中MnO2的添加削减了儿茶酚的抑制作用,使其初期CO2的释放速率与CK、T1基本无异,但释放总量却明显低于CK、T1处理 (图3(b)),说明MnO2和儿茶酚的同时添加,对堆肥初期有机质的矿化过程存在抑制作用。堆肥结束后,T2、T3的CO2累积释放量分别为72.05、67.92 mol,相较于CK分别减少了18.08%和22.77%。
堆肥的底物中畜禽粪便和木屑富含碳元素,有机质矿化会伴随大量CO2的产生,CO2的释放情况能有效反映堆肥反应情况和微生物活性[37]。随着堆肥的继续进行,易分解有机质被消耗殆尽,较低的碳源使得CK和T1的CO2释放量在腐熟期达到稳定。此外,本研究中T2与T3均在堆肥后期出现了CO2释放的小高峰,这可能是因为儿茶酚和MnO2作为添加剂可能促使小分子含氮有机质发生缩聚反应,在高温期形成聚合物以削减矿化作用,但这种聚合物并不稳定,在腐熟期发生了分解,因此出现了波动性的释放CO2的现象。
2) NH3挥发量。堆肥过程中氨挥发情况如图3(c)所示CK与T1氨挥发量均于第4 d达到峰值,分别为2.47、3.47 g·d−1。与CK相比,T1中每日氨挥发量高出40.72%,堆肥结束后氨挥发总量高出32.8% (图3(d))。而整个过程中T2与T3的氨挥发量显著的低于CK与T1 (P<0.05)。
高温阶段氨的挥发是堆肥过程中氮素损失最主要的途径[38]。MnO2作为催化剂加速了堆肥系统中生化反应速率,促使堆肥初期小分子分解速率加快,加速了堆肥系统中NH4+-N的累积并且产生更多的热量,使T1相较于CK具有更快的氨挥发速率,挥发总量更多。FLAIG等[39]研究提出游离铵被酚类化合物固定形成杂环键合的机理,且酚类氧化反应所得的产物醌也可以通过脱水而固定大量NH3成为含氮杂环联苯的结构。此外,儿茶酚与MnO2的混合添加降低了系统的pH,同时强化了堆肥初期的合成作用,有效控制了堆肥初期含氮有机物的矿化,从而减少无机氮的产生实现保氮。
-
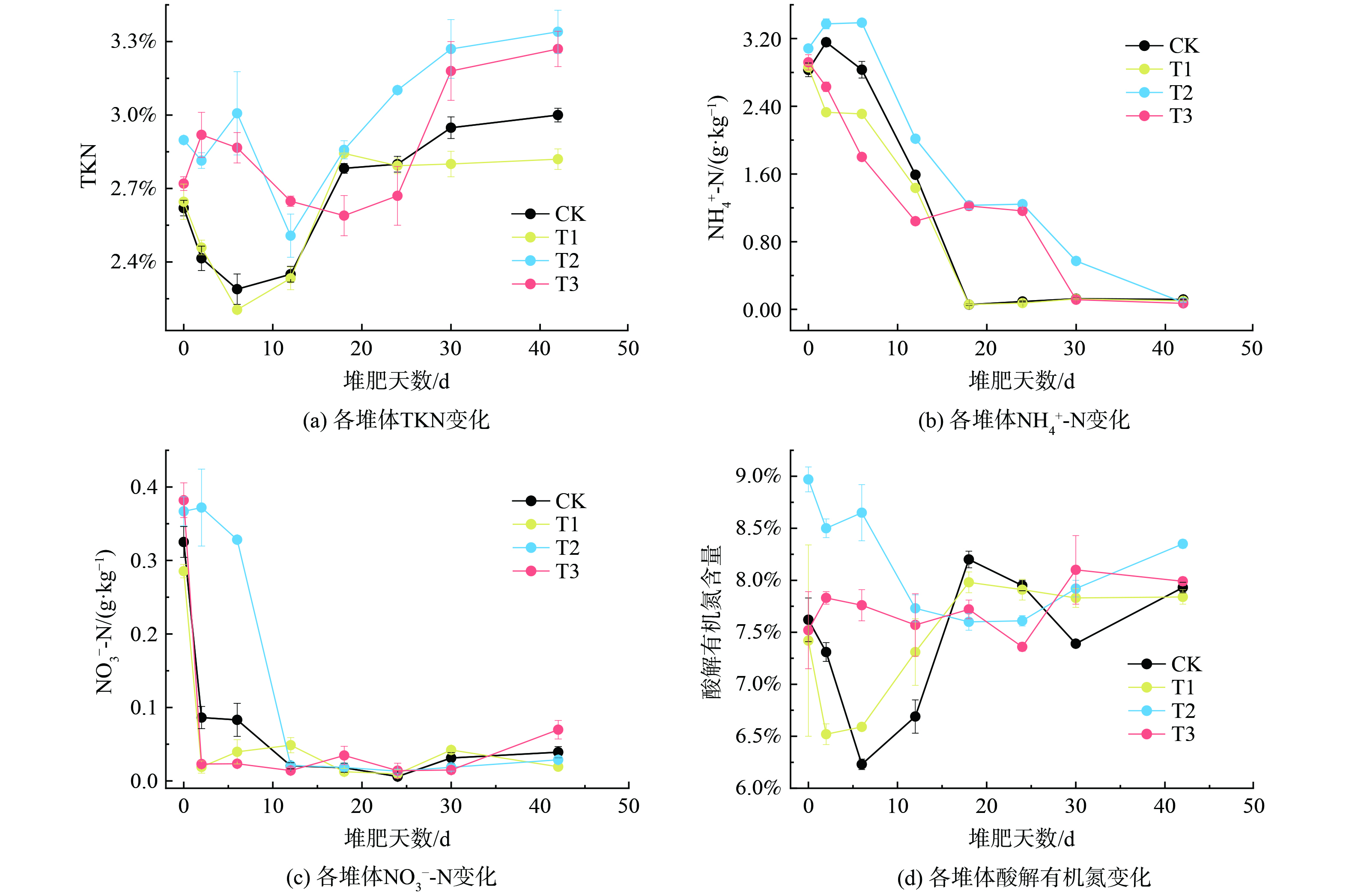
1)总凯氏氮。TKN含量是量化描述堆肥品质的重要指标,也是评价氮素保留效果的重要依据[40]。堆肥结束时,CK、T1、T2和T3处理中TKN相较于初始值增幅分别为14.50%、6.58%、15.25%、20.22%。整体看来 (图4(a)),初期氨的挥发使CK、T1处理中TKN含量在第0~6 d 内迅速下降。由于浓缩效应[4],堆体中TKN含量开始上升并趋于稳定。T2、T3与其余处理TKN的变化趋势存在差异,T2中TKN的初始值显著高于其余处理且初期总量没有下降。T3处理TKN含量在高温阶段整体上高于同时期的CK和T1处理,且变化过程相对平缓。堆肥结束后,T2、T3与CK相比分别提升了11.3%和9.0%,说明儿茶酚单独添加和MnO2与儿茶酚联合添加均能起到氮素保留的作用。
堆肥初期,由于微生物的持续分解作用致使NH4+-N大量积累,并于高温期以NH3的形式损失[41],造成TKN的下降。在堆体进入腐熟期后由于有机质的持续矿化,且氮素的损失量低于挥发性有机质的损失总量[40],使得后续堆肥过程中TKN逐步增长。值得注意的是,T2与T3初期并未出现TKN大幅度减小的现象且含量高于其他处理,这可能是由于儿茶酚的引入导致系统pH降低,抑制了微生物的活性[42]。尽管在高温期后T2与T3均出现了减小的趋势,但T3的下降过程更为缓慢,这可能是MnO2促成儿茶酚与含氮有机小分子形成的物质更为稳定[43-45],从而实现了氮素的保留。
2)铵态氮和硝态氮。实验期间,铵态氮为所有堆体中无机氮的主要成分。整体看来,铵态氮与硝态氮的含量均呈整体下降的趋势 (图4(b)、(c))堆肥过程中所有堆体中铵态氮的含量均呈整体下降的趋势,但硝态氮的下降更为迅速。直至堆肥结束时CK、T1、T2和T3各处理中铵态氮含量分别为0.17、0.101、0.081和0.071 g·kg−1,均小于0.4 g·kg−1,满足腐熟要求[41]。
堆肥初期由于有机氮矿化速率大于损失速率[46],导致CK在0~2 d内铵态氮含量出现短暂上升的现象,而后铵态氮含量逐步减少并趋于稳定。堆肥系统中含氮有机质的降解将增加堆肥系统中铵态氮的含量,而氨挥发与有机氮的合成则是铵态氮含量降低的主要原因[36]。在堆肥的中后期,T2和T3中铵态氮含量分别出现了小幅度增长的现象,而这一现象并未在CK和T1中观察到,说明此时发生了部分含氮有机质的矿化,该部分有机质是在儿茶酚存在的前提下催生的,且可能正是由于这部分含氮有机质的形成才抑制了堆肥初期的矿化作用,实现了氮素的保留与缓释。
3)有机氮。堆肥第0~12 d堆体生化反应程度最为剧烈,含氮有机质的迅速分解使得CK中THN含量迅速降低 (图4(d)),而T3处理中THN含量却保持相对稳定状态,此阶段有机氮的变化过程对于T3处理的保氮机制具有关键作用。根据有机氮组分含量变化情况 (图5),此阶段CK中HUN含量呈快速下降趋势,而AAN含量相对有所增加,说明了HUN向AAN的转化过程是堆体铵态氮累积、挥发的重要原因。T3处理中,第12 d堆体中HUN含量占比明显高于CK,且AAN明显低于CK,说明此阶段MnO2与儿茶酚的混合添加可能通过促进部分AAN向HUN的转化,减少铵态氮的累积,以此实现氮素的保留。第18~42 d 堆肥进入腐熟阶段后,T3处理中AN含量占比明显高于CK,结合前文分析这部分氮素可能来自于高温期合成的部分有机氮分解释放而来,此变化过程与CO2释放曲线、铵态氮含量变化曲线形成对照。
含氮有机质的矿化分解是堆体中氨的主要来源[47]。有机氮组分中HUN包含了腐殖化产物、杂环有机氮及部分固定态铵,在所有氮素组分中含量占比最高[11]。CK中HUN在初期快速下降,而在后期缓慢增加的变化趋势反映了堆体中含氮有机质由初期快速分解到腐殖质合成的变化过程;AAN主要来源于堆体中的蛋白质和多肽[48],其含量变化与堆体中氨基酸含量密切相关;AAN主要包含了堆体中固定态和吸附态的铵以及部分结构简单的含氮化合物[39],其含量受氨挥发直接影响;ASN作为较为活跃的氮素形态,在微生物作用下迅速发生转化[49],其含量占比一直保持较低的状态。
-
为进一步了解MnO2和儿茶酚添加剂对堆肥过程中有机质产生的影响,对各个时期不同处理的堆肥样品水体取有机质 (WEOM)进行三维荧光分析 (图6(a)、(b)、(c)、(d))。自堆肥开始时底物中携带的酚类物质缓慢下降至第18 d回归到正常水平不再变化。由于儿茶酚的添加,T2与T3中多酚的含量显著高于CK和T1,三维荧光光谱中高浓度的儿茶酚将产生内滤效应,干扰其他有机质组分的荧光信号[50],鉴于T3处理中儿茶酚含量于第6 d 后下降至正常水平图 (7 (a)),因此仅对之后的样品进行检测分析。根据荧光光谱图可知,高温期结束后,T3的WEOM中存在明显吸收峰 (Ex/Em=275/325 nm)且强度远大于CK,已有研究表明该荧光组分为固定态或游离态的氨基酸,又称类蛋白质物质[51]。正常情况下,堆肥中的氨基酸来源于大分子物质降解的中间产物,其会随着堆体中高度活跃的微生物作用快速分解,总量呈逐步下降的趋势[52-53]。本研究中,相较于CK和T1,T2和T3分别在堆肥的12 d和18 d中出现了短暂的上升现象 (图7 (b)),这可能是由于堆肥初期在MnO2和儿茶酚的驱动下合成的新物质度过高温期后,由于自身的不稳定结构重新释放,使得氨基酸含量小幅度的上升,这一结果与铵态氮的变化一致。
为进一步探究该组分在堆肥过程中的变化情况,借助平行因子分析将荧光图谱信号分解为3种组分 (图6(e)、(f)、(g)),分别为C1 (初峰Ex/Em=235/410 nm,次峰310/410 nm)代表类富里酸物质[54];C2 (MAX Ex/Em=275/325 nm)代表固定态或游离态的氨基酸;C3 (MAX Ex/Em=375/460 nm)代表类腐殖酸物质[55]。分组结果通过残差分析和拆半检验,并且与相关研究契合。
最大荧光强度 (Fmax)指的是特定组分受光源激发后所发射荧光强度的得分值,一定程度上反映该物质的浓度变化。通过C2组分的Fmax值的变化曲线 (图7(c))可知,经过高温期第一次发酵过后CK处理C2的Fmax值仅为1 097.72,相较于初始值下降了57.8%,表明C2组分中包含的物质在高温阶段被微生物大量代谢分解,导致其荧光强度大幅下降。T3中各个时期C2的Fmax均显著高于CK,说明MnO2和儿茶酚的联合添加存在着对氨基酸类物质的固定作用,抑制了其矿化过程以此达到氮素的保留。堆肥第12 d后,T3中Fmax值陡降,同时期堆体中氨基酸含量出现上升,说明此聚合具有不稳定性,在腐熟阶段再次分解,固定的氨基酸被重新释放并快速转化,使堆体中铵态氮含量同时升高,但此时堆体已接近室温不再产生进一步的氮素挥发[4],以此实现了氮素的保留与缓释。
-
1)单独添加MnO2能显著促进堆肥初期的生化反应,而单独添加儿茶酚则表现出生物抑制性,使得堆肥反应延时一周,2者同时添加时,生物抑制性被迅速分解,一段时间后各指标均回归正常水平。堆肥结束后,所有处理的温度、pH值、GI值等指标均满足堆肥产品安安全利用标准 (NY/T 3442-2019)。表明添加适量的MnO2和儿茶酚,不会影响堆肥产品的品质。
2) MnO2与儿茶酚的混合处理使堆肥初期的AAN向结构更稳定的HUN转化,以此来抑制高温阶段氮素的矿化,以实现堆肥过程的氮素保留。
3) MnO2与儿茶酚混合添加促进了堆肥初期氨基酸物质的缩合,此后氨基酸物质与儿茶酚形成的聚合物有效抑制了堆肥初期的有机质矿化,直至堆肥结束,氨累积挥发量仅为CK的16.61%,总凯氏氮相较于CK提升了9.00%。
外源MnO2和儿茶酚对猪粪好氧堆肥氨挥发与氮素形态转化的影响
Effects of exogenous MnO2 and catechol on ammonia volatilization and nitrogen transformation in aerobic composting of swine manure
-
摘要: 为探究儿茶酚与MnO2的添加对强化堆肥腐殖化及氮素保留效果的影响,以猪粪与木屑为堆肥原材料,分别设置对照组 (CK,儿茶酚与MnO2质量分数均为0%),实验组 (T1,儿茶酚0%与MnO2 1%;T2,儿茶酚3%与MnO2 0%;T3,儿茶酚3%与MnO2 1%)4个处理,借助冗余分析、UV-vis、3D-EEM光谱技术,探究不同处理对堆肥基本理化性质、氮素转化过程及氮素保留机理的影响。结果表明,1% MnO2和3%儿茶酚的混合处理 (T3)堆肥过程中类氨基酸组分荧光强度显著增强,氨挥发受到明显抑制,堆肥结束时,混合处理氨累积挥发量为1.39 g,仅为CK的16.61%;有机氮组分中酸解氨态氮占比为17%,高于CK的14%;总凯氏氮相较于CK提升了9.00%,温度、pH值、EC值和GI值等基础指标均满足安全利用标准。三维荧光平行因子分析表明MnO2和儿茶酚的混合添加可有效削减堆肥初期含氮有机质的矿化分解,从而明显降低堆体升温阶段和高温阶段的氨挥发总量,实现氮素的保留。Abstract: In order to investigate the effects of catechol and MnO2 additions on the composting humification and nitrogen retention. four treatment groups were set including the control groups (CK, catechol and MnO2 witch mass fraction were both 0%), and the experimental groups (T1, catechol 0% and MnO2 1%; T2, catechol 3% and MnO2 0%; T3, catechol 3% and MnO2 1%) by using swine manure and wood chips as raw materials. Through redundancy analysis, UV-vis, and 3D-EEM spectroscopic analysis, the effects of different treatments on the basic physicochemical properties of compost, nitrogen transformation process, and nitrogen retention mechanism were revealed. The results showed that during the composting process of 1% MnO2 and 3% catechol, the fluorescence intensity of amino acid-like fraction in water-extracted organic matter was obviously enhanced, and the volatilization of ammonia was obviously inhibited, and the cumulative volatilization of ammonia in the mixed treatment (1.39 g at the end of composting) was only 16.61% of CK. And the amount of acidolyzed ammoniacal nitrogen in organic nitrogen fraction was 17% and the total Kjeldahl nitrogen was 9.00%, which was both also higher than those of CK. The basic indexes such as temperature, pH, EC and GI values all met the safety utilization standards. Three-dimensional fluorescence parallel factor analysis showed that the mixed addition of MnO2 and catechol could effectively reduce the mineralization and decomposition of nitrogen-containing organic matter in the initial compost stage, which could be the reason for obviously reducing the total amount of ammonia volatilization in the high temperature stage, and finally achieving nitrogen retention.
-
Key words:
- swine manure /
- aerobic composting /
- nitrogen transformation /
- MnO2 /
- catechol
-

-
表 1 堆肥原料基本理化性质
Table 1. Physiochemical properties of composting materials
材料 水分/% pH值 电导率/
(mS·cm−1)有机质/
%总凯氏氮/
(g·kg−1)总磷/
(g·kg−1)猪粪 78.53 7.39 3.91 67.24 39.58 20.5 木屑 11.45 7.65 0.23 89.6 4.4 0.09 -
[1] NASSER A E K, PAUL R, PAILLAT J M, et al. Turning, compacting and the addition of water as factors affecting gaseous emissions in farm manure composting[J]. Bioresource Technology. 2007, 98(14): 2619-2628. doi: 10.1016/j.biortech.2006.07.035 [2] BECK F B, SMÅRS S, JŐNSSON H, et al. SE—structures and environment: gaseous emissions of carbon dioxide, ammonia and nitrous oxide from organic household waste in a compost reactor under different temperature regimes[J]. Journal of Agricultural Engineering Research. 2001, 78(4): 423-430. doi: 10.1006/jaer.2000.0662 [3] WOLTER M, PRAYITNO S, SCHUCHARDT F. Greenhouse gas emission during storage of pig manure on a pilotscale[J]. Bioresource technology. 2005, 95(3): 235-244. [4] 刘玉婷. 禽粪好氧堆肥过程中氮素转化与菌群互作规律的研究[D]. 大连: 大连理工大学, 2018. [5] 李云. 添加剂对好氧堆肥过程中含氮气体排放和氮素化合物转化的影响[D]. 兰州: 甘肃农业大学, 2022. [6] WANG X, ZHANG W, GU J, et al. Effects of different bulking agents on the maturity, enzymatic activity, and microbial community functional diversity of kitchen waste compost[J]. Environmental technology. 2016, 37(20): 2555-2563. doi: 10.1080/09593330.2016.1155650 [7] 李其胜, 殷小冬, 董青君, 等. 生物炭和微生物菌剂添加对菇渣好氧堆肥过程及其养分变化的影响[J]. 江苏农业科学, 2023, 51(11): 212-218. [8] 何远灵, 邢泽炳, 吴晓东. 生物炭对鸡粪好氧堆肥基质降解的影响与氨气排放研究 (英文)[J]. Agricultural Science & Technology, 2018, 19(3): 58-66. [9] 胡明勇, 刘强, 陈雄鹰, 等. 两种钙化合物在猪粪-稻草堆肥中除臭及保氮效果研究[J]. 湖南农业科学, 2009(7): 51-54. doi: 10.3969/j.issn.1006-060X.2009.07.018 [10] 李云, 邱慧珍, 张建斌, 等. 添加过磷酸钙和糠醛渣对好氧堆肥过程中氨气排放和氮素转化的影响[J]. 环境工程学报, 2021, 15(12): 3992-4000. doi: 10.12030/j.cjee.202110008 [11] SHAN G, LI W, GAO Y, et al. Additives for reducing nitrogen loss during composting: A review[J]. Journal of Cleaner Production. 2021, 307: 127308. doi: 10.1016/j.jclepro.2021.127308 [12] SCHAUB S M, LEONARD J J. Composting: An alternative waste management option for food processing industries[J]. Trends in food science & technology. 1996, 7(8): 263-268. [13] SÁNCHEZ M M A, ROIG A, CEGARRA J, et al. Relationships between water-soluble carbohydrate and phenol fractions and the humification indices of different organic wastes during composting[J]. Bioresource Technology. 1999, 70(2): 193-201. doi: 10.1016/S0960-8524(99)00018-8 [14] STEVENSON F J. Humus chemistry: genesis, composition, reactions[M]. John Wiley & Sons, 1994. [15] QI H S, WANG J, ZHANG L Y, et al. Activation effect of catechol on biotic and abiotic factors of humus formation during chicken manure composting.[J]. Waste management. 2022, 149(15): 146-155. [16] WU J, QI H, HUANG X, et al. How does manganese dioxide affect humus formation during bio-composting of chicken manure and corn straw?[J]. Bioresource technology. 2018, 269: 169-178. doi: 10.1016/j.biortech.2018.08.079 [17] Qi H, WEI Z M, ZHANG Y, et al. Effect of MnO2 on biotic and abiotic pathways of humic-like substance formation during composting of different raw materials[J]. Waste Management. 2019, 87: 326-334. doi: 10.1016/j.wasman.2019.02.022 [18] SHINDO H. HUANG P M. Significance of Mn (IV)oxide in abiotic formation of organic nitrogen complexes in natural environments[J]. Nature. 1984, 308: 57-58. doi: 10.1038/308057a0 [19] YUE D, LU X, et al. Role of ferric oxide in abiotic humification enhancement of organic matter[J]. Journal of Material Cycles and Waste Management. 2017, 19(1): 585-591. doi: 10.1007/s10163-015-0435-2 [20] QI G, YUE D, FUKUSHIMA M, et al. Enhanced humification by carbonated basic oxygen furnace steel slag–II. Process characterization and the role of inorganic components in the formation of humic-like substances[J]. Bioresource technology. 2012, 114: 637-643. doi: 10.1016/j.biortech.2012.03.064 [21] SHINDO H. HUANG P M. Role of Mn (IV)oxide in abiotic formation of humic substances in the environment[J]. Nature. 1982, 298(5872): 363-365. doi: 10.1038/298363a0 [22] 曹云, 黄红英, 吴华山, 等. 畜禽粪便超高温堆肥产物理化性质及其对小白菜生长的影响[J]. 农业工程学报, 2018, 34(12): 251-257. doi: 10.11975/j.issn.1002-6819.2018.12.031 [23] 张丽. 利用沼液培养微藻净化沼气的研究[D]. 上海: 复旦大学, 2014. [24] 蔡函臻, 宁西翠, 王权, 等. 碱性固体对污泥的调质堆肥影响及产品对土壤的改良潜力[J]. 环境科学, 2016, 37(12): 4848-4856. doi: 10.13227/j.hjkx.201606104 [25] ZHAO X, WEI Y, FAN Y, et al. Roles of bacterial community in the transformation of dissolved organic matter for the stability and safety of material during sludge composting[J]. Bioresource Technology. 2018, 267: 378. doi: 10.1016/j.biortech.2018.07.060 [26] KEENEY D R, BREMNER J M. Effect of Cultivation on the Nitrogen Distribution in Soils1[J]. Soil Science Society of America Journal. 1964, 28(5): 653-656. doi: 10.2136/sssaj1964.03615995002800050022x [27] ZHOU H X, ZHAO Y, YANG H Y, et al. Transformation of organic nitrogen fractions with different molecular weights during different organic wastes composting[J]. Bioresource Technology: Biomass, Bioenergy, Biowastes, Conversion Technologies, Biotransformations, Production Technologies, 2018, 262: 221-228. [28] WANG Z, AWASTHI M K. Evaluation of medical stone amendment for the reduction of nitrogen loss and bioavailability of heavy metals during pig manure composting[J]. Bioresource Technology. 2016, 220: 297-304. doi: 10.1016/j.biortech.2016.08.081 [29] 李季. 堆肥工程实用手册[M]. 彭生平. 北京: 化学工业出版社, 2011. [30] BERNAL M P, ALBURQUERQUE A, MORAL R. Composting of animal manures and chemical criteria forcompost maturity assessment: a review[JJ]. Bioresource Technology, 2009, 100 (22): 5444-5453. [31] 贾兴永. 生物炭及翻堆频率对鸡粪堆肥过程中温室气体排放的影响[D]. 北京: 中国农业大学, 2015. [32] HACHICHA R, REKIK O, HACHICHA S, et al. Co-composting of spent coffee ground with olive mill wastewater sludge and poultry manure and effect of Trametes versicolor inoculation on the compost maturity[J]. Chemosphere. 2012, 88(6): 677-682. doi: 10.1016/j.chemosphere.2012.03.053 [33] 孟利强. 碳源调控污泥堆肥氮素转化与含氮气体释放生物机制研究[D]. 哈尔滨工业大学, 2019. [34] WANG Q, AWASTHI M K, ZHAO J, et al. Utilization of medical stone to improve the composition and quality of dissolved organic matter in composted pig manure[J]. Journal of cleaner production. 2018, 197: 472-478. doi: 10.1016/j.jclepro.2018.06.230 [35] ZHANG S, WANG J, CHEN X, et al. Industrial-scale food waste composting: Effects of aeration frequencies on oxygen consumption, enzymatic activities and bacterial community succession[J]. Bioresource Technology. 2021, 320: 124357. doi: 10.1016/j.biortech.2020.124357 [36] CUI H, ZHAO Y, CHEN Y, et al. Assessment of phytotoxicity grade during composting based on EEM/PARAFAC combined with projection pursuit regression[J]. Journal of Hazardous Materials. 2017, 326(15): 10-17. [37] 李新添. 有机固体废弃物堆肥中腐殖化过程强化及细菌群落结构演替的研究[D]. 南宁: 广西大学, 2021. [38] 杜梦菲. 畜禽粪便堆肥甲烷生成-氧化特征及其影响因素研究[D]. 哈尔滨工业大学, 2020. [39] 陈孟立. 蔬菜废弃物堆肥过程中有机氮转化的机理[D]. 杨陵: 西北农林科技大学, 2019. [40] Flaig W. Chemistry of humic substances in relation to coalification[M]. 1996: 58-68. [41] 钱靖华. 畜禽粪便堆肥高效固氮添加剂研究[J]. 安徽农学通报, 2021, 27(1): 134-136. doi: 10.3969/j.issn.1007-7731.2021.01.052 [42] 梁晓烽, 王虹, 李玉中等. 沼液与园林废弃物共堆肥下的氮素转化及其微生物作用机制[J/OL]. 应用生态学报: 1-11. (3-08-09 3-08-09]. [43] 卢佳伟, 王铭泽, 汪棋, 等. 辅料及微生物菌剂对羊粪好氧堆肥腐熟度的影响[J]. 中国农学通报, 2021, 37(15): 39-46. [44] ZHANG F, GU W, XU P, et al. Effects of S and FeSO4 agents on nitrogen conservation in aerobic composting of chicken manure[J]. Chinese journal of environmental engineering. 2011, 5(10): 2347-2352. [45] JUAN M, KAI J, LIANGHU S, et al. Effects of FeSO4 dosage on nitrogen loss and humification during the composting of cow dung and corn straw[J]. Bioresource Technology. 2021, 341: 125867. doi: 10.1016/j.biortech.2021.125867 [46] LHADI E K, TAZI H, AVLAJ M, et al. Organic matter evolution during co-composting of the organic fraction of municipal waste and poultry manure[J]. Bioresource technology. 2006, 97(16): 2117-2123. doi: 10.1016/j.biortech.2005.09.012 [47] ZUCCONI F, MONACO A, et al. Biological evaluation of compost maturity[J]. Biocycle. 1981, 22: 27-29. [48] KELLY K R, STEVENSON F J. Forms and nature of organic N in soil[J]. Fertilizer research. 1995, 42: 1-11. doi: 10.1007/BF00750495 [49] 徐阳春, 沈其荣, 茆泽圣. 长期施用有机肥对土壤及不同粒级中酸解有机氮含量与分配的影响[J]. 中国农业科学, 2002, 35(4): 403-409. doi: 10.3321/j.issn:0578-1752.2002.04.011 [50] WARREN C R. Organic N molecules in the soil solution: what is known, what is unknown and the path forwards[J]. Plant and Soil. 2014, 375(1): 1-19. [51] ZHANG W, LIU J, ZHANG L, et al. A fluorescence nanosensor for lipase activity: enzyme-regulated quantum dots growth in situ[J]. RSC Advances. 2015, 5(89): 73051-73057. doi: 10.1039/C5RA08902F [52] CHEN X, LIU R, HAO J, et al. Protein and carbohydrate drive microbial responses in diverse ways during different animal manures composting[J]. Bioresource Technology. 2018, 271(1): 482-486. [53] LU Q, ZHAOY, GAO X, et al. Effect of tricarboxylic acid cycle regulator on carbon retention and organic component transformation during food waste composting[J]. Bioresource Technology. 2018, 256(5): 128-136. [54] JULIANA D A, CHRISTINE M, MICHAEL S, et al. A 21 000-year record of fluorescent organic matter markers in the WAIS Divide ice core[J]. Climate of the Past. 2017, 13(5): 1-15. [55] KIM J, KIM Y, KANG H W, et al. Tracing water mass fractions in the deep western Indian Ocean using fluorescent dissolved organic matter[J]. Marine Chemistry. 2020, 218: 103720. doi: 10.1016/j.marchem.2019.103720 -




 下载:
下载: