-
自2020年1月1日起“限硫令”实施后,低硫燃料油(low sulphur fuel oil, LSFO)已逐步取代普通船用高硫燃料油(high sulphur fuel oil, HSFO)成为市场主流,且在生态环境脆弱的硫排放控制海域(如北极地区)应用最广. 由于与传统汽缸油不匹配[1]、催化剂残留颗粒过多[2]、润滑性不足[3]等原因,多项研究指出LSFO会对船舶动力系统造成异常磨损、腐蚀[4-5],进而增加船舶航行过程中的漏油风险. 溢油事故一旦发生,其对水生生态系统造成的影响和随食物链传递威胁人类健康的风险不容忽视[6-7]. 因此,针对LSFO的潜在生物毒性与生态风险亟待研究.
2020年7月25日在毛里求斯海域搁浅的“若潮号”货轮泄露了超过1.0×103 t LSFO,这是首次发生的大型LSFO泄漏事故,相关研究[8-9]报道了事故对附近海域造成的严重生态灾难. 在LSFO对水生生物的毒性效应方面,Hansen等[10]比较了一种轻质LSFO和一种HSFO对大西洋鳕鱼仔鱼的毒性作用,通过对燃料油介导的芳香烃受体(aryl hydrocarbon receptor, AhR)基因激活以及与骨生成等通路相关基因的研究,发现轻质LSFO与HSFO的毒理学机制类似,高浓度的轻质LSFO暴露组甚至表现出比HSFO暴露组更严重的形态学畸形. 而在其它研究中[11],轻质LSFO对海洋浮游动物表现出较低的毒性,另外一种重质LSFO对浮游动物群落多样性的影响则更为显著. 以上事故和研究表明,LSFO的泄漏风险及其对水生生物的危害不可小觑,且不同类型LSFO间性质差异较大,其毒性影响还有待进一步验证.
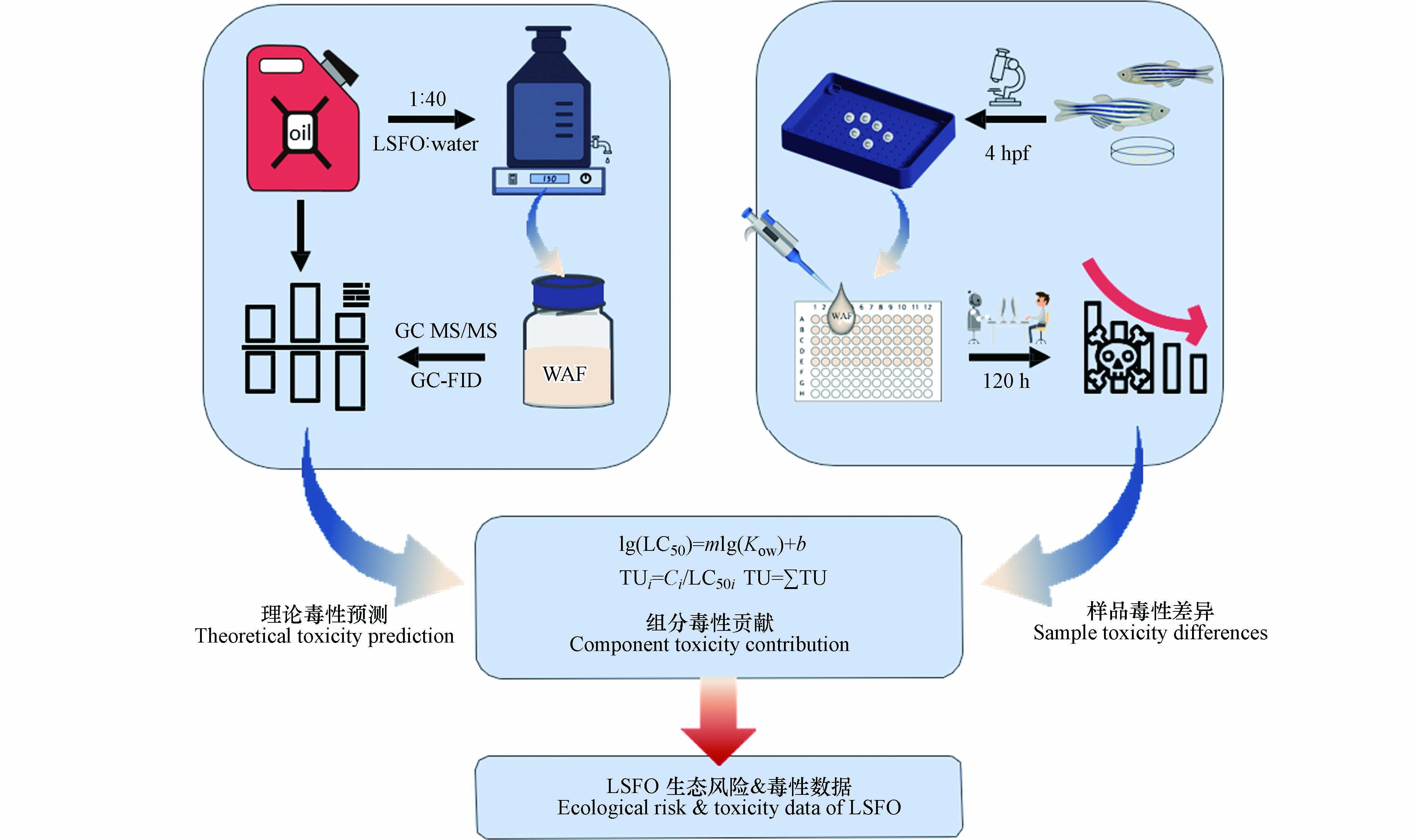
虽然“深水地平线”[12]事件后,已有大量学者开展了原油和HSFO的水生生物毒理学研究[13-14],但因生产工艺不同,LSFO与以上二者在性质、成分上存在差异[15-16],作为国际海事组织及我国交通运输部指定的船用燃料类型,目前有关LSFO的研究数据较少,其毒性作用特征尚未得到关注. 因此,本研究以模式生物斑马鱼胚胎及仔鱼为受试生物,选取了市场上广泛应用的3种LSFO:WRG(wide range gas oil(RMB 30型))、MGO(marine gas oil(DMA型))和VLSFO(very low sulphur fuel oil(RMG 180型)),综合分析不同类型LSFO及其水溶性组分(water accommodated fractions, WAFs)溶液的性质和组成,通过120 h急性毒性实验,系统研究了LSFO WAFs对斑马鱼胚胎/仔鱼的影响. 同时,针对目前斑马鱼仔鱼形态学评估方法耗时费力且评价标准不明确的局限性,本研究开发了一种基于深度学习的自动化致畸效应评分系统,以实现对仔鱼畸形图像的批量处理及自动评分;最后,应用毒性单位(toxic unit, TU)模型评估LSFO WAFs中不同组分的毒性差异. 实验结果可为进一步研究LSFO对水生生物的毒性效应及其生态风险评估提供一定参考.
-
LSFO由挪威科学和工业研究基金会(SINTEF)提供,其密度、倾点、闪点、运动黏度和硫含量等理化性质的测定分别参照美国材料试验协会(American society of testing materials, ASTM)ASTM D4052-18a(密度)[17]、ASTM D97-17b(倾点)[18]、ASTM D93-20(闪点)[19]、ASTM D445-19a(运动黏度)[20]、ASTM D4294-16ε1(硫含量)[21]、ASTM D6560-17(沥青质)[22]的方法进行,蜡含量根据EN 12606-1-2015测定[23].
-
LSFO和水按照质量体积比25 g:1 L加入到装有10 L标准稀释水(NaHCO3:200 mg·mL−1,KCl:0.05 mg·mL−1,NaCl:3.5 mg·mL−1,CaCl2·2H2O:117.5 mg·mL−1)的玻璃下口瓶中,以恒定速率(150 r·min−1)在磁力搅拌器(H03-A 10 L,上海梅颖浦仪器仪表制造有限公司,中国)上避光搅拌71.5 h,静置0.5 h后分离下层水相即为WAFs储备液. 储备液密封后在防爆冰箱(4 ℃)中避光保存,使用时用标准稀释水配制成不同浓度的WAFs暴露液,暴露液均现用现配,并在24 h内使用完毕. 该制备程序主要参考了生态效应研究论坛[24]所报道的原油水溶性溶液制备方法,并在此基础上结合实际情况调整所得.
-
LSFO及其WAFs中所含半挥发性有机物(semi-volatile organic compounds, SVOCs)[25]、挥发性有机物(volatile organic compounds, VOCs)[26]和总石油烃(total petroleum hydrocarbon, TPH)[27]分别通过气相色谱-质谱联用仪(gas chromatography-tandem mass spectrometry, GC-MS/MS, Thermo Fisher Scientific, 美国)、吹扫捕集气相色谱-质谱(purge and trap gas chromatography mass spectrometry, P&T GC-MS, Agilent, 美国)和气相色谱仪结合火焰离子化检测器(gas chromatography/flame ionization detection, GC-FID, Agilent, 美国)测定. 色谱/质谱条件如表1所示.
-
野生型成年斑马鱼(AB型)由国家斑马鱼中心购入,在斑马鱼循环水系统(上海海圣生物设备有限公司,中国)中饲养,光照周期为14 h:10 h,水温为(28
± 0.5)°C,每天喂食2次活体丰年虾. 暴露实验前1 天晚上,将3条雄鱼和2条雌鱼置于产卵盒内,并用隔板分开. 第二天早上抽掉隔板,光线将触发雌雄鱼受精行为,雌鱼产卵结束后,收集鱼卵并分别用0.5 mg·L−1亚甲基蓝溶液和27.5 ℃标准稀释水冲洗,随后将其转移至无菌培养皿中,受精后4 h(hours post-fertilization, hpf)内使用体视显微镜(SZ61, Olympus, 日本)筛选健康的胚胎以备后续实验. 本研究遵循OECD化学品测试指南[28]进行,根据预实验结果,暴露浓度设置为100%、58.8%、34.6%、20.4%、12.0%、7.00%、4.10%和对照组(Control,标准稀释水). 胚胎置于96孔石英细胞培养板中,每孔1颗并注入200 μL暴露液,每行12个孔,每3行为一个暴露组的3个平行,通过3D打印微孔板模具实现快速铺板[29]. 胚胎于恒温培养箱(LRH-250,上海一恒科学技术有限公司,中国)中暴露120 h,每24 h更新80%(体积比)暴露液. 实验过程如图1所示. -
暴露实验期间,每24 h记录各组斑马鱼胚胎/仔鱼死亡和孵化情况;暴露120 h时,对各组仔鱼进行形态学评估. 目前已经有学者开发了几种斑马鱼形态学致畸性评价体系[30-31],其基本原理都是通过给特定发育终点打分,记录具体畸形情况,累计结果并系统衡量化学物质对胚胎/仔鱼的影响程度. 但现有评价体系存在畸形终点难以确定、观察过程耗时费力、观察结果受主观影响较大等局限性,因此本研究结合深度学习技术建立了斑马鱼致畸效应评分(general teratogenic score, GTS)系统[32],通过对1024张预实验积累图像的训练,该系统可实现对斑马鱼仔鱼背部畸形、尾部畸形、心包水肿、卵黄水肿和鱼鳔发育异常五类常见畸形类型的识别,识别结果平均交并比可达到0.76,输出速率1.6 s·sheet−1(处理器:NVIDIA GeForce RTX2080Ti GPU). 使用一体式数码液晶显微镜对麻醉(1.68 × 104 mg·L−1三卡因)后的仔鱼进行拍摄,调整姿态,获取各组存活仔鱼的侧视图像,输入致畸效应评分系统进行自动化处理和评分,其规则为:每条仔鱼形态学总分为5分,每出现一种畸形类型扣1分,GTS得分越低,表明暴露造成的畸形情况越严重.
-
急性毒性实验结果表明,LSFO WAFs暴露液浓度超过20.4%时,胚胎存活率明显下降. 因此,氧化损伤实验将暴露液浓度设为20.4%. 采用活性氧荧光探针法(2,7-dichlorodihydrofluorescein diacetate, DCFH-DA)测定仔鱼体内活性氧物种(reactive oxygen species, ROS)水平,将仔鱼转移至6孔板,每孔20条,标准稀释水冲洗仔鱼3次,每孔加入1 μmol·L−1 DCFH-DA溶液1 mL,避光孵育30 min,染料冲洗干净后匀浆,在480 nm / 530 nm激发/发发射波长条件下用酶标仪(Varioskan ™ LUX, Thermo Fisher Scientific, 美国)测定荧光值. 吸干仔鱼表面水分,加入0.9%生理盐水,离心后得到2%匀浆液,按照南京建成生物工程研究所试剂盒说明书分别测定总蛋白含量,超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)活性,每暴露组设置3个平行,每个平行重量控制在1.7—2.0 g. 上述指标每24 h测定1次.
-
TU模型可以对毒性作用模式类似的多组分混合物的毒性进行评估. TU
≥ 1表示具有毒性,即WAFs预计在实验生物中造成50%的死亡率. 本研究中WAFs的理论TU(Theoretical TU)由62个单独组分(SVOCs和VOCs)的TU加和而得,基于化合物辛醇-水分配系数(lgKow )的目标脂质模型将单独组分的测量浓度除以其化合物的水效应浓度[33-34](式1)来计算单独组分的TU. McCarty[35-36]和Neff[37]等给出了公式(1)中涉及到的每类组分:单环芳烃(mononuclear aromatic hydrocarbon, MAH)类、多环芳烃(polycyclic aromatic hydrocarbon, PAH)类和苯酚(phenol)类的斜率(m)和截距(b)(式2—6). 考虑到上述公式在斑马鱼胚胎/仔鱼中的适用性未知,为了更加全面地比较WAFs中各类组分的实际毒性和贡献,本研究基于实际测量的WAFs浓度和它们产生50%效应时浓度的比值计算了实际TU(Actual TU)(式7). -
实验结果以“平均值
± 标准差”表示,使用GraphPad Prism8.4.3软件进行统计分析并绘图. 统计显著性通过双因素方差分析(Two-way ANOVA)和Tukey事后多重比较进行评估,P≤ 0.05(*)表示组间有显著性差异,P≤ 0.01(* *)表示组间有极显著差异. -
LSFO的物理参数总结于表2. 结果表明,WRG和MGO的密度、倾点、闭口闪点均较低,相对低的密度和闪点反映出其轻质组分含量较高,导致其黏度也较低,溢油事故一旦发生,上述特征会使其在风力和波浪的作用下逐渐被分散、风化、溶解而稀释,影响环境的时间相对较短. VLSFO的密度、倾点、闭口闪点均较高,高密度和高闪点反映出其轻质组分含量相对较低,导致其粘黏度也较高,此类重质燃料油的风化速度较慢,溢油易形成油球,在水流作用下可长距离移动黏附至海岸线,对近海海岸环境影响持续时间较长.
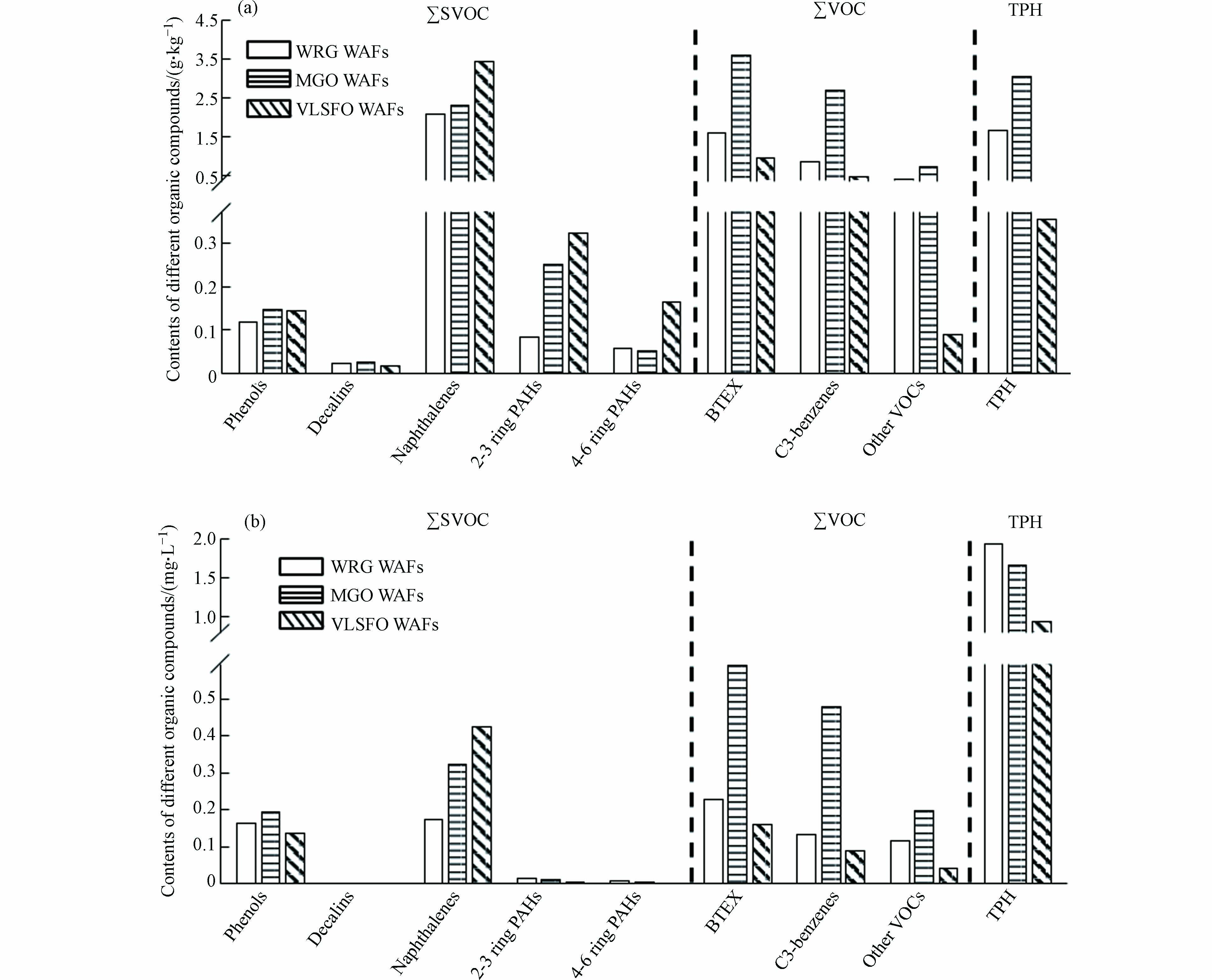
LSFO中TPH含量和62种有机组分的含量如图2(a)所示. MGO中有机物组分总量(SVOCs、VOCs和TPH含量之和)最高,为13.03 g·kg−1,WRG(7.04 g·kg−1)次之,VLSFO最少(6.04 g·kg−1);萘类化合物(Naphthalenes)是SVOCs中的主要成分,在VLSFO(3.46 g·kg−1)中的含量均高于WRG(2.10 g·kg−1)和MGO(2.35 g·kg−1);苯系物(BTEX)和C3-苯(C3-benzenes)是VOCs中主要成分,二者均在MGO中最高. 3种LSFO有机组分总量在6.04—13.0 g·kg−1范围内,远低于传统船用燃料油的有机组分含量[38],但LSFO中萘类化合物的含量却达到了传统船用燃料油[38]的4—7倍,这可能与制备燃料油的原油属性、不同炼油厂的脱硫程序(加氢脱硫、催化裂化等)等因素有关[39]. 由于不同组分的水溶性不同,LSFO WAFs中各组分含量与原始油组分含量之间存在差异(图2b),但总有机物组分含量和各组分含量比例变化与原始油基本一致,WRG WAF为2.80 mg·L−1,MGO WAF为3.49 mg·L−1,VLSFO WAF为1.83 mg·L−1. 萘类化合物和苯系物因其较高的水溶性,在SVOCs和VOCs中仍分别占据主导地位. 萘类化合物在VLSFO WAF中含量最高(0.35 mg·L−1),以苯系物(0.59 mg·L−1)和C3-苯(0.48 mg·L−1)为主要成分的VOCs在MGO WAF中含量较高.
-
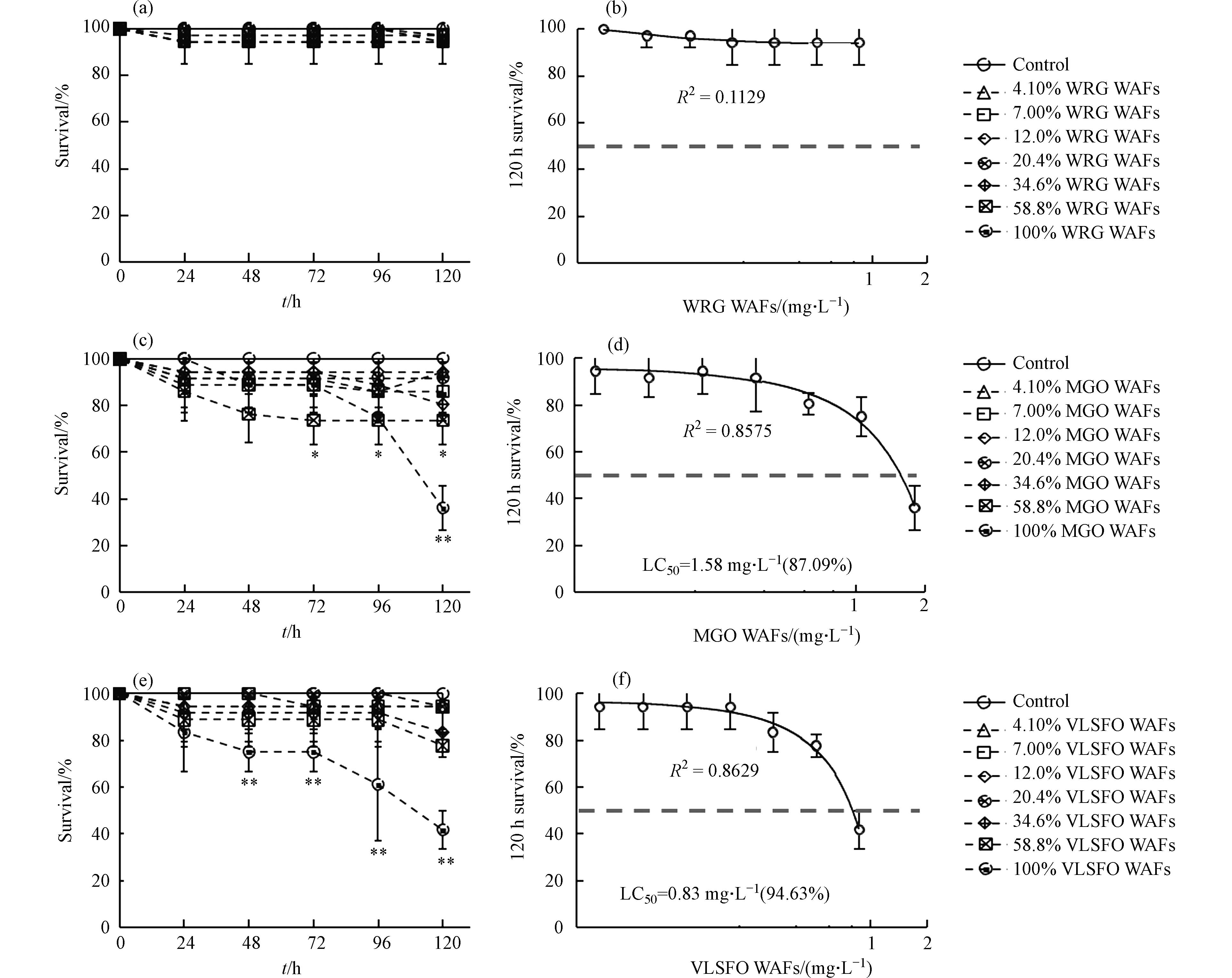
3种LSFO WAFs不同稀释比下暴露120 h对斑马鱼胚胎存活率的影响情况如图3所示. 相较于对照组,不同暴露组的WRG WAFs暴露(图3a)均未对胚胎产生显著致死效应(P
> 0.05),不同暴露组之间也不存在显著性差异(P> 0.05). 暴露前期(24 h、48 h),MGO WAFs(图3c)各组的胚胎存活率与对照组相比均不存在显著统计学差异(P> 0.05);72 h后,高浓度(≥ 58.8%)暴露组的胚胎存活率显著低于对照组(P< 0.05);120 h时,100% MGO WAFs组的存活率仅为36%左右,极显著低于对照组和低、中浓度暴露组(≤ 24.60%)的存活率(P< 0.01). VLSFO WAFs暴露(图3e)24 h时,各组胚胎存活率与对照组相比均不存在显著统计学差异(P> 0.05),随暴露时间延长,稀释比< 100%的各组存活率仍未低于80%,而100% VLSFO WAFs组的存活率显著下降,96 h后与对照组和其余各暴露组均存在极显著差异(P< 0.01),120 h时存活率仅为43%左右(P< 0.01). 分别以稀释比(%)和WAFs浓度(mg·L−1)为基底进行各组存活率数据的非线性拟合,来分析LSFO WAFs暴露与斑马鱼胚胎存活率之间的“剂量-效应”关系,计算半数致死浓度(medium lethal concentration, LC50)如图3(b)、(d)、(f)所示,WRG WAFs暴露对斑马鱼胚胎影响较小;以稀释比(%)为基底,MGO和VLSFO WAFs暴露组的胚胎LC50分别为87.09%和94.63%;以WAFs浓度(mg·L−1)为基底,MGO和VLSFO WAFs暴露组的胚胎LC50分别为1.58 mg·L−1和0.83 mg·L−1.与Philibert等[40-41]、Li等[42]和Johann等[43]不同原油暴露后斑马鱼胚胎LC50(0.13—50.2 mg·L−1)值相比,本研究中LSFO WAFs的LC50处于较低水平,说明LSFO毒性较强. 根据《水和废水监测分析方法》[44]设置的分级标准,WRG WAFs的急性毒性为低毒,MGO WAFs为高毒,VLSFO WAFs为极高毒,这与不同类型WAFs的有机组分含量有关. 现有研究将石油烃类污染物的毒性主要归因于其中的碳氢化合物[45],无论是直链烃类、MAHs还是PAHs,石油烃类污染物中绝大多数成分在结构上被归类为Ⅰ类麻醉品,麻醉毒性的目标脂类模型表明,辛醇-水分配系数较低(lg
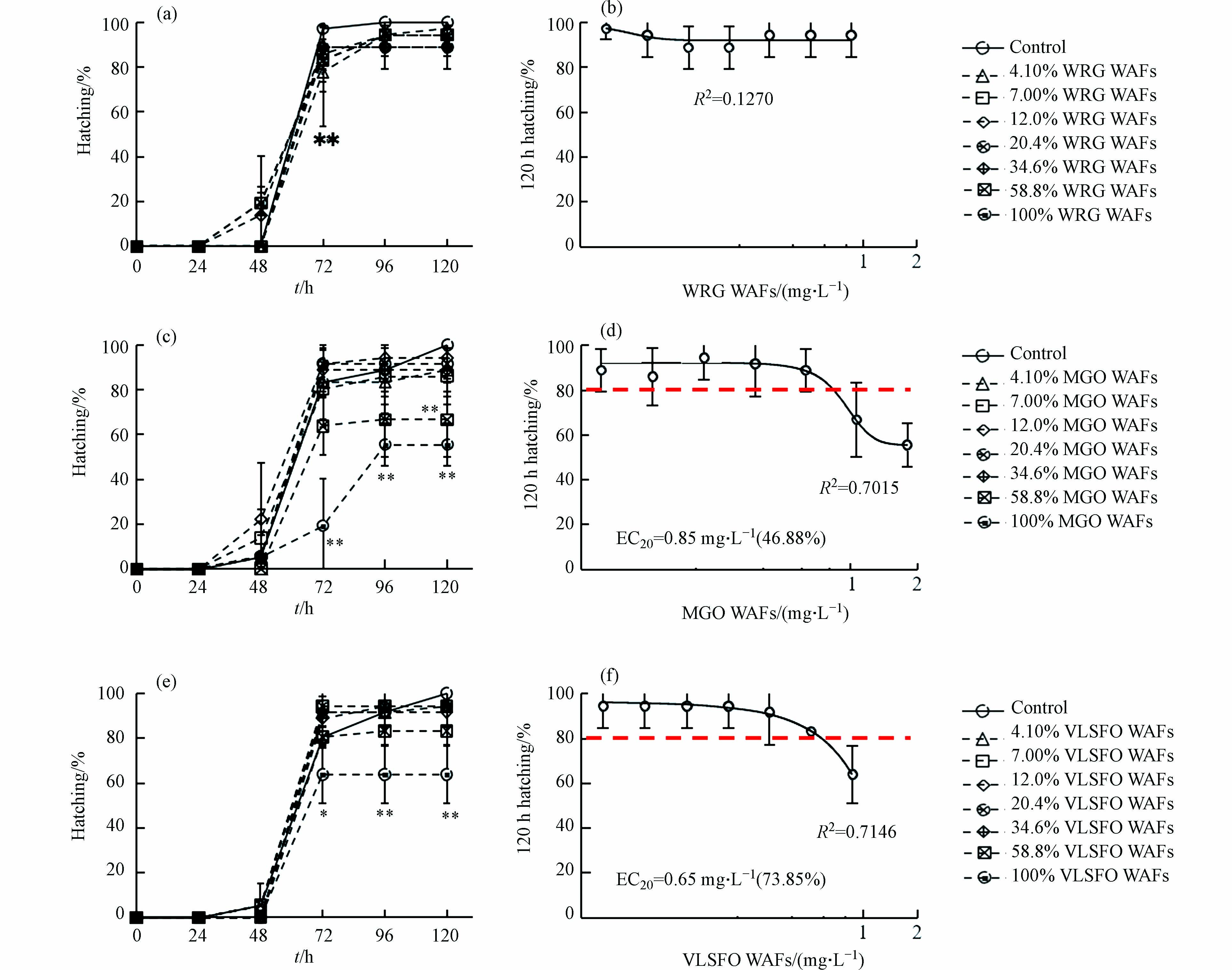
Kow < 5)的低分子量PAHs(萘、菲等)易挥发,在水环境中保留时间较短,但其毒性往往大于4环及以上的高分子量PAHs(lgKow> 5)[46],故虽然WRG WAFs的有机组分总量和VOCs含量高于VLSFO WAFs,但后者中萘类化合物等低分子量PAHs的比例和含量均较高,导致其急性毒性更强. 因此溢油事故发生时,使用风化等手段去除潜在毒性更大的低分子量(lgKow < 5)化学物质,可在一定程度上降低油水混合后水相的生物毒性.3种LSFO WAFs不同稀释比下暴露120 h对斑马鱼胚胎孵化率的影响情况如图4所示. 暴露周期内,4.10% WRG WAFs暴露组(图4a)的胚胎孵化率在72 h时显著低于对照组(P
< 0.05),随后(96 h 至120 h)逐渐恢复正常(P> 0.05),表明4.1% WRG WAFs暴露对胚胎孵化造成的延迟效应可能会随着时间逐渐减弱,甚至消失. 暴露周期内,MGO WAFs(图4c)低、中浓度暴露组(≤ 34.6%)与对照组均不存在显著统计学差异(P> 0.05),而72 h后100% MGO WAFs组的孵化率极显著低于对照组和其余各暴露组(P< 0.01). 由图4e可知,VLSFO WAFs暴露期间内,只有100%VLSFO WAFs暴露能够诱导胚胎出现极显著的孵化延迟现象(P< 0.01),与MGO WAFs暴露类似,72 h后100% VLSFO WAFs组的孵化率极显著低于对照组和低、中浓度暴露组(≤ 34.6%). 分别以稀释比(%)和WAFs 浓度(mg·L−1)为基底进行各组孵化率数据的非线性拟合,计算效应浓度(effect concentration, EC20),如图4(b)、(d)、(f)所示:以稀释比(%)为基底,MGO和VLSFO WAFs暴露对斑马鱼胚胎孵化抑制的EC20分别为46.88%和73.85%;以WAFs浓度为基底,对斑马鱼胚胎孵化抑制的EC20分别为0.85 mg·L−1和0.65 mg·L−1.本研究中胚胎出现不同程度孵化延迟/抑制的情况与Li等[47]针对Oman原油的研究结果相近,这可能与LSFO WAFs中有毒组分在胚胎表面积累和内化,导致与绒毛膜裂解相关的孵化蛋白功能受损有关[48];绒毛膜裂解后,胚胎还需依靠收缩运动分解弱化的绒毛膜来完成孵化,而PAHs污染物会严重损害水生生物神经和骨骼肌发育相关的的胆碱能系统[49-51],因此高浓度LSFO WAFs可能通过影响斑马鱼胚胎自发运动的能力,进一步降低其孵化成功率.
-
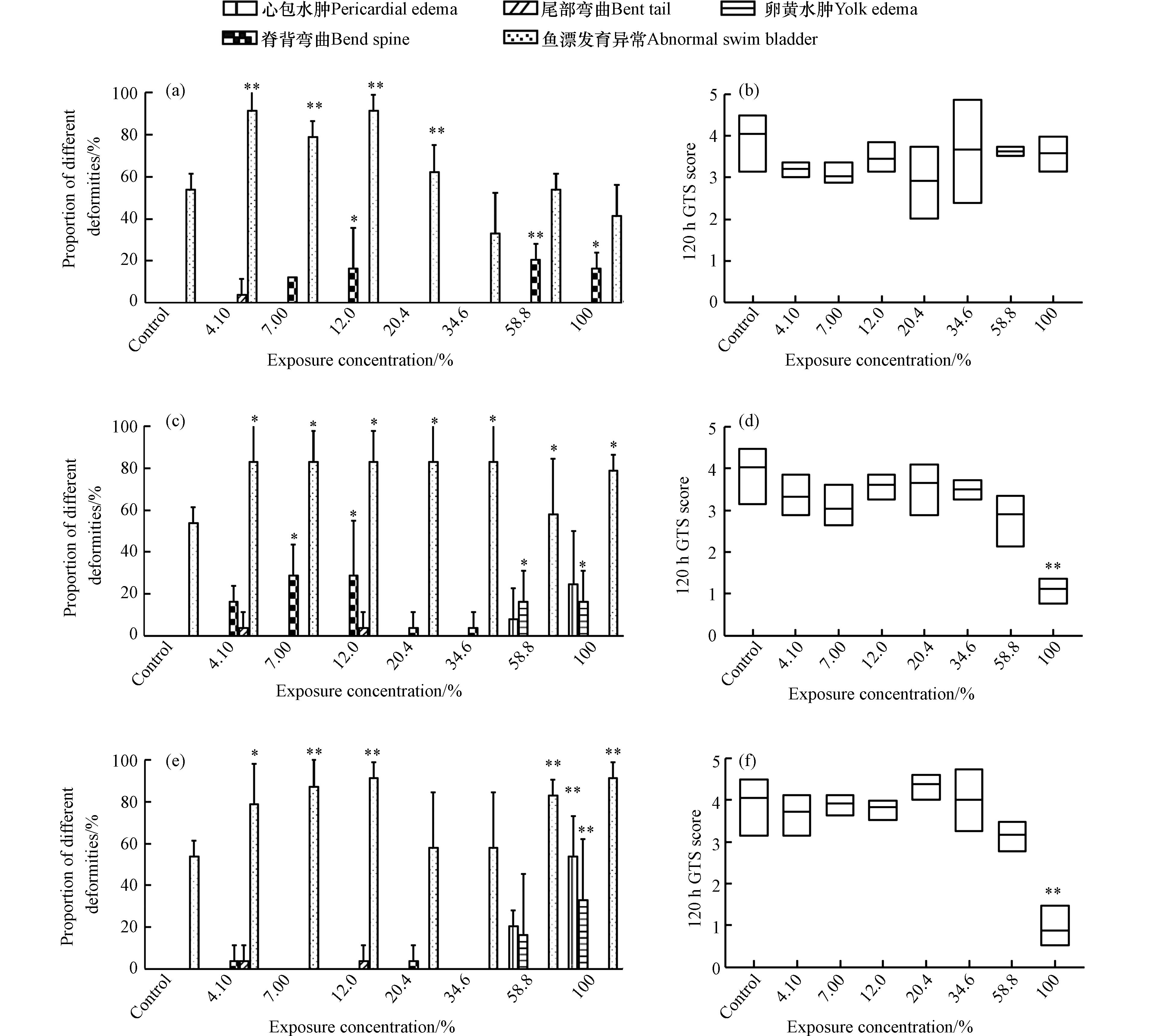
暴露至120 h时,各组仔鱼均出现不同类型和程度的畸形(图5). 对403张实验图像进行畸形器官识别和自动评分. 结果表明,WRG WAFs暴露组的畸形仔鱼明显存在鱼鳔发育不完全/未充气、脊背轻微弯曲(图6a)的特征,各暴露组GTS得分均略低于对照组(图6b),但不存在显著统计学差异(P > 0.05). 如图6(c—f)所示,斑马鱼仔鱼在MGO和VLSFO WAFs高浓度暴露组(58.8%、100%)的GTS得分较低,且100% WAFs暴露组的仔鱼畸形严重(P < 0.01);除鱼鳔发育不完全/未充气这一普遍特征外,MGO和VLSFO WAFs各暴露组还出现了明显的心胞水肿和卵黄水肿(图6c、e).
石油烃类污染物暴露会对鱼类胚胎发育进程产生影响并引起不同程度的致畸效应,如Philibert等[41]观察到原油WAFs暴露会导致斑马鱼胚胎出现严重的发育迟缓和心包积液;Everitt等[52]在研究斑马鱼胚胎暴露于风化沉积物结合稀释沥青的水溶液时发现,高浓度暴露组的胚胎发生了以心胞水肿、卵黄水肿和鱼鳔发育异常为主要表现形式的明显畸形. 心脏毒性已被广泛证明是鱼类胚胎暴露于原油WAFs后的敏感终点之一[53]. Li等[42]通过对原油暴露后斑马鱼胚胎的心输出量进行研究后发现,鱼鳔发育异常与心功能损伤之间存在强烈的相关关系. 心脏收缩性缺陷会引起血液循环的缺失,使氧气和二氧化碳无法通过血管网络正常扩散到鱼鳔中,导致其无法正常膨胀;其对鱼鳔发育关键基因标志物的研究结果显示,高剂量TPH诱导斑马鱼胚胎中hb9和anxa5基因表达显著下调,表示石油烃类污染物暴露可能会影响斑马鱼鱼鳔上皮和外间皮的发育. 此外,鱼鳔发育还受到自主神经系统的控制,PAHs急性毒性的麻醉作用可能导致原始气腺介导的鱼鳔膨胀调节神经受损[54],使其膨胀失败. 本研究中,LSFO WAFs中TPH含量和引起急性麻醉作用的主要组分低分子量 PAHs含量均处于较高水平,因此鱼鳔发育不完全这一显著特征可能是由LSFO WAFs中有毒成分引起的心脏功能障碍和自主神经系统受损等综合因素作用导致的.
-
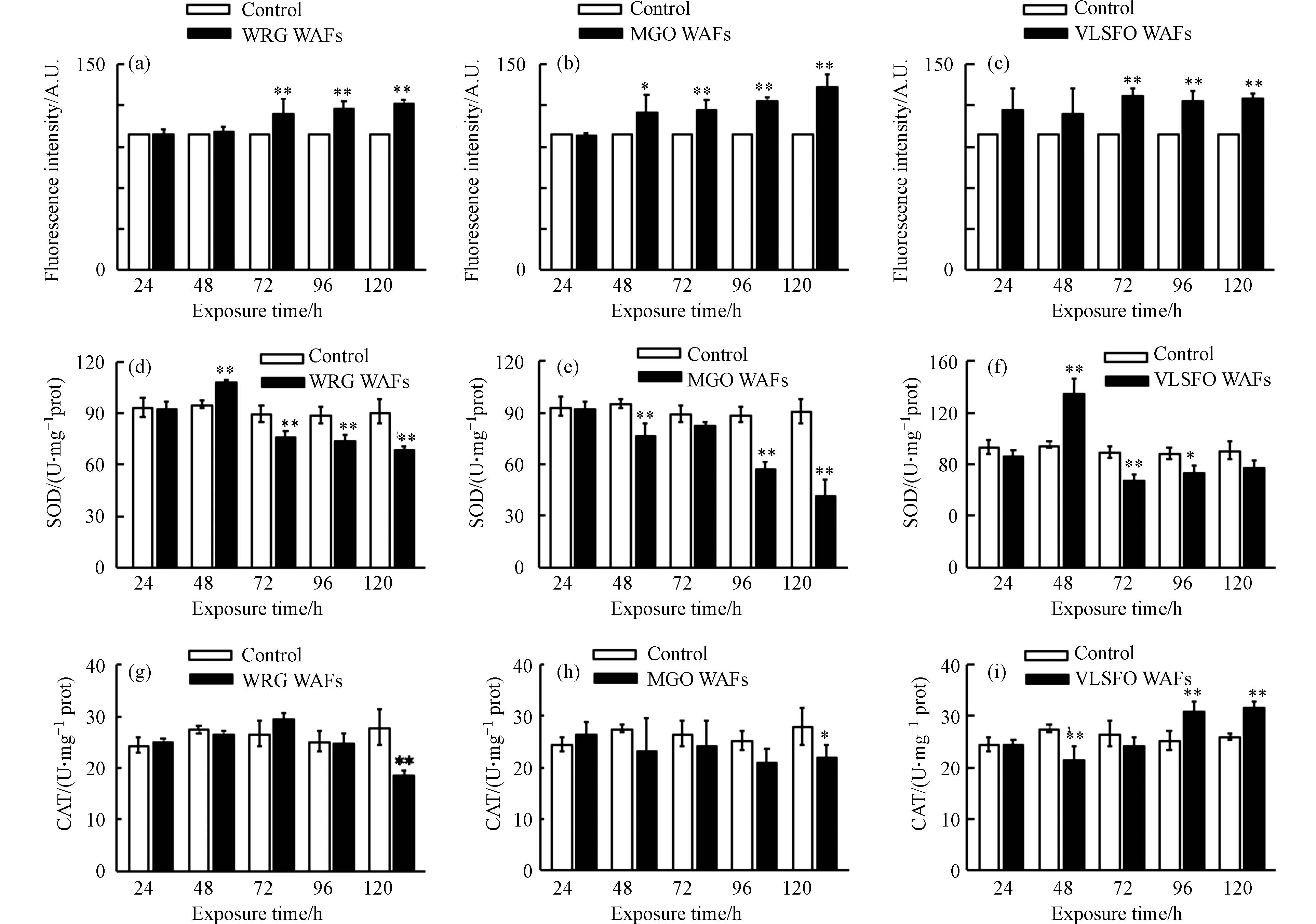
水生生物对PAHs和其它外源性物质解毒的过程会产生ROS(如O2·−、·OH、H2O2)等异生物质代谢副产物,因此斑马鱼会受到来自LSFO WAFs中有毒成分(主要为碳氢化合物)本身和解毒过程中产生的反应性副产物的毒性影响. 如果机体产生的ROS超出其自身氧化防御能力,就会造成氧化应激和组织损伤[55]. 利用荧光染料DCFH-DA测定斑马鱼体内氧化应激水平,荧光信号与体内氧化应激水平呈正比,如图7(a—c)所示,与对照组相比,暴露于WRG、MGO和VLSFO WAFs 短时间内(24 h)对斑马鱼体内ROS水平无显著影响(P > 0.05),表明未孵化时绒毛膜对斑马鱼胚胎起到了一定的保护作用. 随着暴露时间增加,72 h后荧光信号明显增强(P < 0.05),说明斑马鱼体内的氧化应激水平明显升高,表现出一定的氧化胁迫.
SOD作为抗氧化防御体系中的第一道防线,可以催化O2·−歧化生成H2O2和O2,在防御氧自由基对机体危害方面有重要作用. 暴露48 h时,为清除WRG WAFs(图7d)诱导胚胎产生的过量ROS,SOD活性升高(P < 0.01),但随着暴露时间延长(48 h后),LSFO WAFs中有毒成分胁迫胚胎产生的ROS过度积累,生物体受到危害,SOD活性被抑制(P < 0.01),此时斑马鱼体内ROS开始显著升高. 在MGO WAFs 暴露期间(图7e),SOD活性始终被抑制,说明相同浓度(20.4%)下MGO WAFs对斑马鱼胚胎的刺激更强,为清除MGO WAFs诱导产生的ROS,SOD被大量消耗;同时,过量积累的H2O2会改变SOD构象[56],进一步抑制酶活性,使机体始终处在抗氧化失衡状态. 暴露于VLSFO WAFs中的斑马鱼体内SOD活性变化趋势与WRG WAFs组类似(图7f),随暴露时间延长先升高后降低;但暴露96 h时,斑马鱼体内SOD活性被显著抑制,而ROS无明显变化,可能是由于谷胱甘肽(GSH)等其它抗氧化剂也会参与O2·−到H2O2的还原过程,弥补SOD活性下降的影响,使机体内ROS维持在正常水平. CAT可以将SOD歧化后产生的H2O2分解为H2O和O2,以防止毒性更大的·OH产生,但当CAT不足以清除过量H2O2时,其活性会受到抑制,导致机体损伤. 如图7(g—h)所示,暴露前96 h,WRG和MGO WAFs均未对斑马鱼体内CAT活性造成显著影响(P > 0.05),暴露至120 h时,二者均诱导仔鱼体内CAT活性降低(P < 0.01),且同时期SOD活性受到抑制,导致斑马鱼体内氧化应激水平明显升高. 随着时间增加,VLSFO WAFs组(图7i)CAT活性先下降后上升,可能是由于机体短时间内产生的O2·−先抑制了CAT活性,随着SOD酶催化O2·−生成H2O2反应的进行,CAT活性随着H2O2浓度的增加而被激活[57].
-
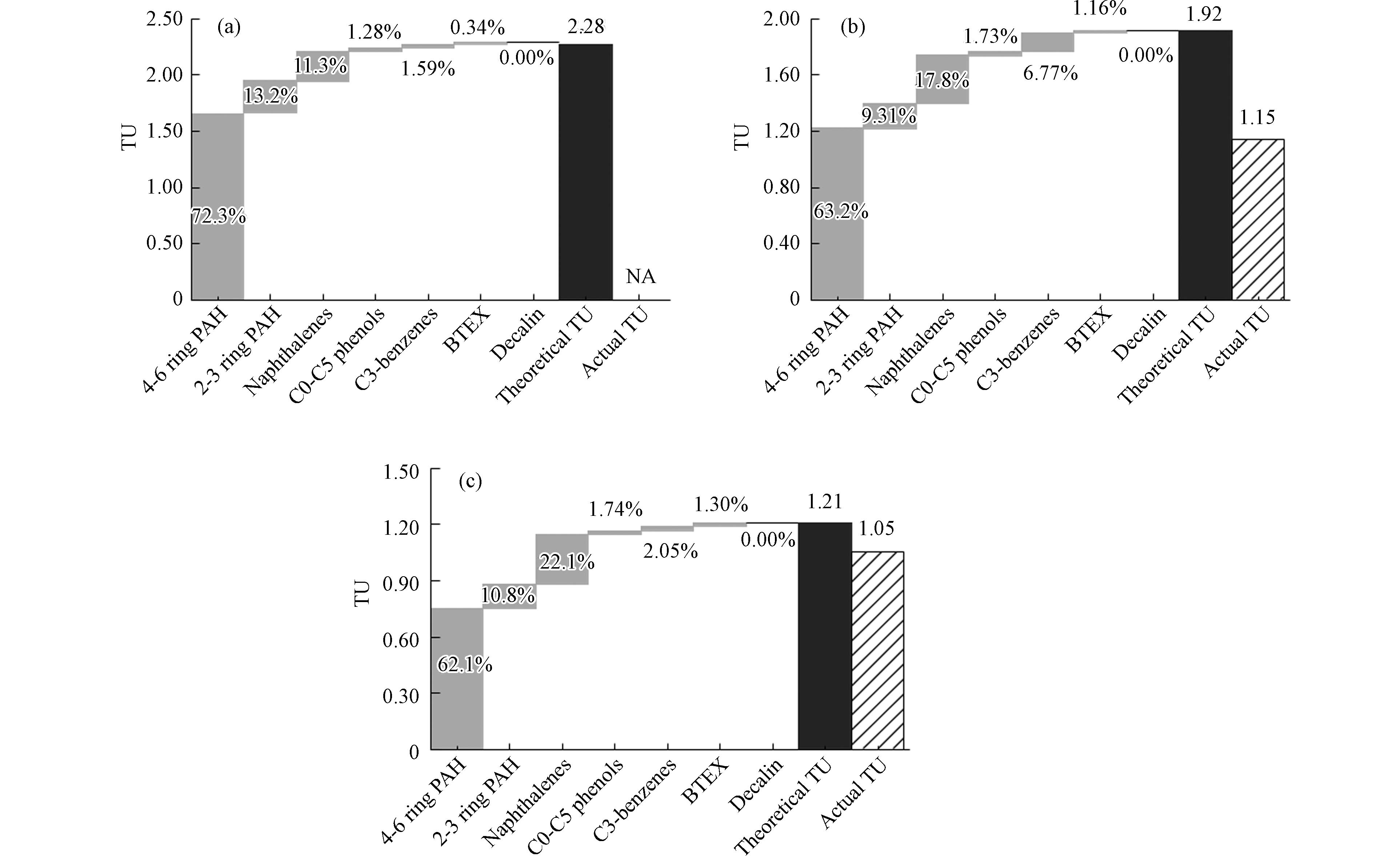
根据WAFs中单独组分含量及其LC50与lg
Kow 值之间的线性关系,对LSFO WAFs的预测毒性(图8 Theoretical TU)进行了计算;根据WAFs有机组分总量及斑马鱼120 h急性毒性实验的LC50,通过计算LSFO WAFs的实际毒性(图8 Actual TU)对预测毒性进行了验证. 3种LSFO WAFs的Theoretical TU在1.21—2.28之间,均预测会导致50%以上的胚胎死亡率;高分子量 PAHs被判断为主要毒性因子,其次是萘类化合物和低分子量 PAHs,共占Theoretical TU的90%左右,这与之前的研究结果相近[58],分散剂的使用增加了原油WAFs中4—6环PAHs和萘类化合物的含量,使其对海胆的毒性高于单一原油WAFs. 本研究中,3种LSFO WAFs对斑马鱼胚胎/仔鱼毒性效应大小与其萘类化合物含量呈正比(VLSFO WAFs> MGO WAFs> WRG WAFs),综合TU预测结果和前文毒性数据,推测萘类化合物可能是LSFO WAFs中主要毒性因子,这与此前关于原油组分毒性贡献的研究结果类似[59];同时,现有LSFO生产过程以加氢脱硫为主[60],这一过程会促进高分子量PAHs开环,使饱和烃和低分子量PAHs含量增加,前已述及,低分子量PAHs对水生生物的急性毒性更强[46],再次印证了萘类化合物可能是LSFO WAFs中主要毒性因子的合理性. MGO和VLSFO WAFs组的预测毒性与实际毒性趋势一致(会造成50%实验生物死亡),但预测值偏高(1.2—1.7倍),WRG WAFs组的预测值也比实际结果明显偏高,这可能与PAHs在生物体内的代谢机制有关,PAHs需要代谢激活才能形成最终毒性物质,而一种酶(以细胞色素P450家族为主)通常可以代谢多种PAHs[61],这会导致混合物中不同类型的PAHs作为同一酶的底物发生竞争性抑制作用,从而降低某/多种PAHs的代谢程度,如Nichols等[62]在鳟鱼肝脏S9组分中观察了到菲、芘和和苯并[a]芘之间的代谢抑制,Stringfellow等[63]在细菌种观察到了萘、甲基萘和芴之间的代谢抑制. 由此推测,LSFO WAFs多类型组分之间也存在类似的竞争机制会“削弱”其对生物体的实际毒性,而基于有机组分脂质浓度简单加和的预测模型不能模拟这一代谢过程,故预测数值普遍偏高. 总体而言,基于化合物lgKow 的目标脂质模型估算的Theoretical TU在毒性趋势预测方面有一定的准确性,但仍需要一个更加精确的模型,通过综合衡量单一组分与其生物利用度[64]、化学活性、平衡脂质浓度[65]等之间的关系,或者其它能够反映物质结构和毒性机制相关关系的指标来计算TU,从而更好地预测石油产品混合物的生物毒性. -
(1)3种LSFO及其WAFs有机组分总量:MGO
> WRG> VLSFO. WRG和MGO WAFs中以VOCs为主,VLSFO WAFs中以SVOCs为主. 萘类化合物是SVOCs的主要组分,苯系物是VOCs的主要组分.(2)3种LSFO WAFs对胚胎急性毒性大小(LC50):VLSFO WAFs(0.83 mg·L−1)
> MGO WAFs(1.58 mg·L−1)> WRG WAFs(NA);对胚胎孵化抑制程度(EC20):VLSFO WAFs(0.65 mg·L−1)> MGO WAFs(0.85 mg·L−1)> WRG WAFs(NA);对仔鱼造成畸形情况:VLSFO WAFs≈ MGO WAFs> WRG WAFs,畸形类型中以鱼鳔发育不完全/未充气为主. 3种LSFO WAFs均会诱导胚胎/仔鱼体内ROS含量显著升高,SOD和CAT在MGO WAFs组主要被抑制,在WRG 和VLSFO WAFs组随时间变化表现出不同程度的被诱导和抑制作用.(3)3种LSFO WAFs的Theoretical TU值均被预测偏高,表明其组分间可能存在的拮抗作用会减弱对机体的实际毒性效应. PAHs是比硫含量更加关键的毒性决定因素,以加氢脱硫为主的生产工艺导致LSFO中以萘类化合物为主的低分子量 PAHs含量增加,使其对水生生物的急性毒性增强.
(4)除严格控制硫含量以减少大气污染外,还应关注LSFO使用过程中的溢油风险及对水生生物的毒性效应,如提升船舶燃油系统匹配性以减少意外泄漏,提高LSFO的溢油响应能力和优化成分配比以降低对水生生物的急性毒性.
低硫燃料油对斑马鱼早期发育阶段的毒性效应
Toxic effects of low sulphur fuel oil on early life stages of zebrafish (Danio rerio)
-
摘要: 低硫燃料油(low sulphur fuel oil,LSFO)是指硫含量小于0.5%的燃料油. 为控制航行过程中尾气硫化物的排放,减少大气污染,LSFO正逐步取代传统高硫燃料油在全球海域被广泛使用,但有关LSFO的环境风险和毒理学研究仍十分有限. 本研究选取3种不同类型的LSFO:中质油WRG(wide range gas oil)、轻质油MGO(marine gas oil)和重质油VLSFO(very low sulphur fuel oil),通过制备其水溶性组分(water accommodated fractions,WAFs)溶液,综合分析LSFO及其WAFs的理化性质和组成成分;并以斑马鱼胚胎/仔鱼为受试生物,探究3类LSFO的WAFs的潜在生物毒性. 结果表明,轻质油MGO及其WAFs中半挥发性有机物(semi-volatile organic compounds,SVOCs)、挥发性有机物(volatile organic compounds,VOCs)和总石油烃(total petroleum hydrocarbon,TPH)含量之和最高,中质油WRG次之,重质油VLSFO最低. WAFs的浓度由SVOCs和VOCs浓度之和表示,根据《水和废水监测分析方法(第四版)》分级标准,WRG的WAFs急性毒性特征为低毒,而MGO的WAFs和VLSFO的WAFs分别为高毒和极高毒,其半数致死浓度(LC50)分别为1.58 mg·L−1和0.83 mg·L−1. MGO和VLSFO的WAFs对胚胎孵化抑制浓度(EC20)分别为0.85 mg·L−1和0.65 mg·L−1. 未稀释的MGO和VLSFO的WAFs会导致仔鱼出现鱼鳔发育不完全/未充气等畸形. 3种LSFO的WAFs均会诱导胚胎/仔鱼体内活性氧物种含量显著升高. 基于毒性单位模型的组分毒性差异分析表明,以萘类化合物为主的轻质多环芳烃是主要毒性贡献因子,LSFO的WAFs组分间可能存在拮抗作用从而减弱其生物毒性.Abstract: Low Sulphur Fuel Oil (LSFO) is an emerging category of fuel oil with a sulphur content of less than 0.5%. To control the emission of sulphur dioxide and to reduce atmospheric pollution, LSFO is steadily replacing the marine traditional high-sulphur fuel oil for wider utilizations. However, environmental risks and toxicological studies on LSFO are scarce. In this study, three different LSFOs: medium oil WRG (wide range gas oil), light oil MGO (marine gas oil), and heavy oil VLSFO (very low sulphur fuel oil) were investigated. These LSFOs and their water-accommodated fractions (WAFs) were thoroughly characterized for chemical compositions and physicochemical properties. The zebrafish (Danio rerio) embryos/larvae were selected as test organism to investigate the toxic effects of LSFO WAFs. The results showed that the total amount of semi-volatile organic compounds (SVOCs), volatile organic compounds (VOCs), and total petroleum hydrocarbons (TPH) in the light oil MGO and its WAFs was the highest, followed by the medium oil WRG, and the heavy oil VLSFO being the lowest. The concentration of WAFs is expressed as the sum of the concentrations of SVOCs and VOCs, according to the classification standard of “Water and Wastewater Monitoring and Analysis Methods (fourth edition)”, the acute toxicity of WRG WAFs to zebrafish embryos was minimal, whereas MGO WAFs and VLSFO WAFs were highly and extremely toxic, with LC50 values of 1.58 mg·L−1and 0.83 mg·L−1, respectively. MGO and VLSFO WAFs had inhibitory concentrations (EC20) on embryo hatching of 0.85 mg·L−1 and 0.65 mg·L−1, respectively; undiluted MGO and VLSFO WAFs could induce serious deformities in larvae, such as incomplete swim bladder development or inflation failure. All three LSFO WAFs induced significant increases in the content of reactive oxygen species in embryos/larvae. Based on the toxic unit model, the toxicity difference analysis of components revealed low molecular weight PAHs, mainly the naphthalenes, were the main toxicity contributors. And the possible antagonistic effect among the components of LSFO WAFs likely weakened their toxic effects on the organism.
-
Key words:
- low sulphur fuel oil (LSFO) /
- zebrafish /
- embryos /
- larval /
- acute toxicity /
- oxidative damage.
-
热脱附修复技术对于多环芳烃、石油烃等有机污染物的去除具有良好的效果。异位热脱附技术更是具有修复周期短、普适性强的显著优势,在目前有机污染场地修复中应用较为广泛[1]。然而,由于异位热脱附修复工程涉及污染土壤的清挖和转运,施工过程中极易产生有机污染物挥发,造成二次污染,对施工区域及运输路线周边环境产生不良的影响。因此,为了保障修复效果、尽可能地避免二次污染,对污染场地异位热脱附修复工程的全过程环境监理尤为重要。
污染场地修复工程的处理处置对象多为可能危害人体健康的污染物,修复过程具有专业性强、技术复杂及风险高等特点,由此对相应的环境监理工作提出了更高的要求[2]。2014年2月19日,国家环境保护主管部门批准了《场地环境调查技术导则》,并于7月1日起正式实施,首次将环境监理纳入我国污染场地修复工作范畴,标志着污染场地修复工程环境监理开始规范化、系统化和法律化。一些开展污染场地修复相关工作较早的省市(如北京、上海和广东等)积累了若干项目经验,参考国际相关程序和方法,编制了污染场地修复工程环境监理地方性规范。但目前关于环境污染修复工程环境监理方面的研究和案例仍相对匮乏[3]。
本研究以北京某污染场地异位热脱附修复工程为例,结合实际情况对其环境监理工作要点进行了研究,并分析了本案例的典型意义,对环境监理过程中存在的问题进行梳理,提出了若干建议,为污染场地修复工程环境监理研究与实践、为相关管理制度制定都提供了案例参考。
1. 场地与修复工程概况
场地原为钢铁企业辅助设施(如运输、料仓、旧货场等)所在地,已有30年生产经营历史。根据场地环境调查与风险评估结果,场内零散分布29个多环芳烃污染地块,最大污染深度4.5 m,污染面积3.1万m2,污染土方量3.9万m3。土壤中16种多环芳烃均超标,超标率范围0.43%~34.89%,超标率最大的是苯并(a)芘。根据《北京城市总体规划(2004年−2020年)》[4],场地所在区域规划为生态友好型产业集聚地,该场地未来为居住用地、商业用地及公共设施用地。
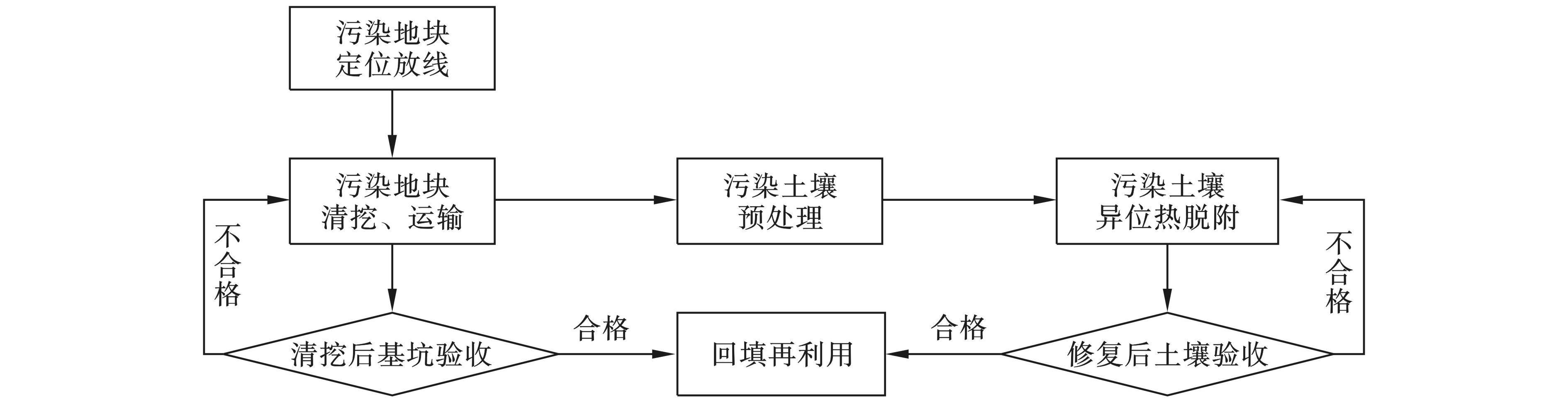
根据项目实施方案及相关批复文件,该场地采用异位热脱附技术修复。对场地内污染土壤进行清挖后,用密闭式专用运输车运往热脱附设施,经筛分、破碎等预处理后,送入回转窑加热至500 ℃并停留20 min。污染土壤热脱附处理后达到《污染场地修复后土壤再利用环境评估导则:DB11/T 1281—2015》[5]的一级再利用筛选值,达标后的土壤可用于原址回填。污染地块清挖后基坑内各目标污染物的检测结果须满足场地管控值方为合格。总体修复技术路线见图1。
修复过程涉及污染土壤的清挖、运输及热脱附处理等阶段,极易产生废气、噪声、废水和固体废物,对场地及其周边环境造成不良影响。因此,需开展严格的环境监理工作,对可能产生二次污染的各环节进行监管,尽可能地降低施工对周边环境带来的负面影响。
2. 本工程环境监理工作要点
污染场地修复工程环境监理工作一般包括3个阶段:修复工程设计阶段环境监理、修复设施建设阶段环境监理和修复工程实施阶段环境监理[5]。本工程环境监理工作除了上述3个阶段外,还包括在修复工程验收阶段的协助工作。
2.1 工程设计阶段环境监理工作要点
工程设计阶段环境监理工作的目的在于“事前控制”和“主动控制”[6],需熟悉修复工程环评报告与设计文件,审查施工单位的施工方案并提出审查意见和修改要求,同时编写环境监理方案等用于指导本工程环境监理工作的技术文件。
2.1.1 文件审核
通过资料梳理、现场踏勘和人员访谈等方式,在熟悉本项目场地污染调查评估状况、场地及周边环境状况、环保主管部门相关批复情况、场地修复工程施工条件等的基础上,对修复技术方案和施工方案进行审核。
核查施工方案是否满足污染场地修复技术方案的要求,如污染场地清挖位置、运输路线、暂存场地、热脱附场所和回填去向等。核查修复方案、施工方案及其中的污染防治措施是否符合相关法律法规与技术规范、环保主管部门批复文件的要求,如产尘点抑尘、污染土遗撒处理和施工期雨废水收集等。经核查,本工程施工方案中缺少针对装载污染土车辆的清洁措施,向建设单位反馈后,要求施工方补充完善,并在后续施工阶段督促该措施的落实。
2.1.2 环境监理方案编制
编制环境监理方案的目的在于指导环境监理工作。根据场地污染情况、场地环境调查与评估报告、修复技术方案和施工方案及修复目标,结合现场踏勘情况编制环境监理方案。在环境监理方案中明确工作目标与范围、工作程序与方法以及各施工环节注意事项,并针对工程实际情况提出可能出现的问题,做好预防措施。
2.2 设施建设阶段环境监理工作要点
规范环境监理工作是设施建设阶段环境监理的主要目的。在本工程环境监理工作中,该阶段工作要点如下:一是建立环境监理体系和制度,督促建设单位针对修复工程产生的废水、废气、噪声、固废等污染物建立相应的污染防治措施和操作规程;督促建设单位落实各类环保协议、相关环保手续的办理工作;督促建设单位建立完善有效的环保责任体系,明确分工、责任到人。二是核查污染防治措施落实情况:核实配套环保设施是否与主体修复设施同时建设,其主要技术指标是否满足修复工程实施方案的要求;核查试运行期间的排放指标是否符合相关标准要求;未达到相关要求的,及时反馈建设单位并监督其整改。
2.3 工程实施阶段环境监理工作要点
工程实施阶段环境监理工作是对修复工程的“事中控制”,其重点工作是监督施工全过程、督促污染防治措施落实,并记录日常工作事项与编制环境监理报告。具体体现在检查施工情况是否符合修复方案要求、环境保护措施是否落实到位,对施工过程进行监督性环境监测,同时参与修复工程管理,对不符合环保要求及修复方案的环节提出整改要求[6]。
2.3.1 监督施工全过程
监督施工全过程是环境监理工作的重点之一。对于异位热脱附修复工程而言,主要包括挖掘、运输、暂存、处理、回填/外运等环节,需按照修复方案和施工方案核实工程位置、挖掘工程量、运输路线、运输量、暂存场地、修复设施以及修复后土壤去向等的达标性。本工程各施工环节环境监理工作要点见表1。
表 1 本工程各施工环节环境监理工作要点施工环节 环境监理工作要点 施工准备 参加环境监理工作交底会,向建设单位、施工单位明确环境监理要求,建立沟通机制。督促施工单位设置必要的施工安全措施及安全标志,如围挡和项目信息告知牌等 挖掘 根据修复方案确认清挖位置,监督测量放线工作。清挖时旁站,核查清挖范围与深度,监督二次污染防治措施落实情况,如洒水抑尘、裸土苫盖等。基坑清挖完成后协助验收取样,并跟踪检测结果,将超标点位告知建设单位和施工单位,督促开展扩挖工作。直至基坑取样检测合格 运输 向装载污染土壤的运输车辆签发运输五联单,沿途确保运输车辆将污染土壤运至修复方案指定的暂存与处理区域。核查运输车次和运输量。运输过程中检查是否有污染土壤遗撒或扬尘,如有则通知施工单位及时清理 暂存 检查污染土壤暂存区的密闭情况及地面防渗情况,防止污染物挥发至空气中或下渗至土壤中 热脱附处理 检查热脱附及尾气处理设备是否符合修复方案要求,监督处理过程,督促施工单位及时对处置后土壤进行取样检测,并对检测合格的土壤进行抽检,发现超标则通知施工单位对该样品代表的土壤批次进行再次处理,直至检测合格 原址回填 督促施工单位对验收合格的修复后土壤及时原址回填,检查回填过程的二次污染防治措施,如洒水抑尘和密闭运输等。检查回填土壤是否满足修复方案的相关要求 2.3.2 督促污染防治措施落实
与一般建设项目相比,污染场地修复工程的施工对象为污染土壤,施工过程中现场及周边环境易受到污染,因此施工期废气、废水、固废和噪声的二次污染防治是环境监理工作的重中之重[7]。本工程针对二次污染防治的环境监理工作要点见表2。
表 2 本工程二次污染防治工作要点施工环节 环境影响 污染源 环境监理工作要点 清挖 大气环境影响 开挖时产生扬尘、重金属及VOCs/SVOCs等污染物挥发,挖掘机、铲车和运输车辆等运行产生尾气,表土临时堆放产生扬尘 核查施工时是否尽可能减小开挖面,是否洒水抑尘,是否有刺鼻气味,裸土是否及时苫盖 水环境影响 污染土壤堆存期间的雨水淋滤,污染土壤清挖后遇雨天坑内积水,工作人员生活污水 核查是否尽量避免污染土壤堆存,基坑是否有排水沟,生活污水是否统一排放 土壤环境影响 污染土壤及废物堆存期间经雨水淋滤产生下渗 核查是否尽量避免污染土壤堆存,如有堆存,是否有防渗措施 固体废弃物 污油及废油,报废的一般设施、设备、工具及器具,一般生活及餐厨垃圾 核查是否将固废统一收集处理 噪声 清挖过程中挖掘机、铲车、运输车辆等运行产生噪声 核查机械车辆是否状况良好,是否严格控制作业范围,是否避免夜间施工,是否采取其他降噪措施 运输 大气环境影响 土方运输产生扬尘,车辆运输时排放尾气 车辆是否密闭运输,是否满载超载,运输道路是否及时洒水抑尘 水环境影响 污染土壤运输过程中发生遗撒经雨水冲刷,设施、设备、工具及器具清洗产生废水 核查运输过程是否有遗撒,如有是否立即采取清洁措施,机械设备清洗废水是否统一收集处理 土壤环境影响 污染土壤运输过程中遗撒 污染土壤装车后是否对车轮及车身进行清扫,运输车轮是否密闭,是否满载超载,是否减速慢行 噪声 车辆运输时产生噪声 运输时是否避开环境敏感区,是否尽可能减少鸣笛,是否减速慢行 热脱附处理 大气环境影响 热脱附尾气,污染土壤临时堆存产生扬尘 核查热脱附设备的尾气处理装置是否运行良好,活性炭是否及时更换,污染土壤临时堆存区域是否密闭 水环境影响 热脱附产生的冷却水、含酸废水 是否统一收集处理后达标排放 土壤环境影响 污染土壤临时堆存期间雨水淋滤,污染治理所用化学品渗漏遗洒 污染土壤临时堆存区域是否有防渗措施, 固体废弃物 热脱附过程收集的除尘灰,尾气处理装置更换下来的活性炭,经过处理后的土壤或废物 是否统一收集后送有资质的单位处理 噪声 施工过程机械噪声 是否尽量选用低噪声设备,是否采取有效的降噪措施 原址回填 大气环境影响 扬尘,推土机、铲车、车辆等运行时排放尾气 是否洒水抑尘,裸土是否及时苫盖,回填后是否及时压实 水环境影响 设施、设备、工具及器具清洗排放废水,工作人员生活污水 废水是否统一收集处理后达标排放 固体废弃物 污油及废油,报废的一般设施、设备、工具及器具,一般生活及餐厨垃圾 核查是否将固废统一收集处理 噪声 推土机、运输车辆等运行产生噪声 核查机械车辆是否状况良好,是否严格控制作业范围,是否避免夜间施工,是否采取其他降噪措施 2.3.3 开展施工期环境监测
对修复工程污染物排放和环境影响进行监督性监测是修复工程环境监理工作的重要组成部分,主要包括大气环境监测、水污染排放监测以及场界环境噪声监测等。通过监测判断修复工程污染物排放是否满足修复方案及其他相关规定的要求,如有不达标情况,督促施工单位整改。
本工程环境监理在污染土壤清挖及热脱附处理环节针对大气环境与场界噪声均开展了监督性监测(无废水排放),及时掌握工程的污染物排放情况,尽可能确保对周边环境的不良影响最小化。具体监测情况见表3。
表 3 本工程环境监理监督性监测施工环节 监测对象 监测位置 监测方式 监测频次 清挖 现场VOCs/SVOCs 清挖作业现场 手持PID 每天2次 环境空气 根据修复方案在场地四周环境敏感点及场界布设监测点位 大气综合采样仪器 每2周1次,每次1天 场界噪声 根据修复方案在场地四周环境敏感点及场界布设监测点位 积分平均声级计 每天2次 热脱附处理 现场VOCs/SVOCs 清挖作业现场 手持PID 每天2次 热脱附尾气 / 烟气在线监测系统 每天检查汇总自动监测数据 环境空气 根据修复方案在场地四周环境敏感点布设监测点位 大气综合采样仪器 每2周1次,每次1天 场界噪声 根据修复方案在场地四周环境敏感点及场界布设监测点位 积分平均声级计 每天2次 2.3.4 记录日常工作事项与编制报告
在修复工程启动后,环境监理员对每天的工作情况进行记录,包括:环境监理日志、现场巡视和旁站记录、监理会议记录和监测记录等,记录方法采用文字、数据、图表和影像等多种方式。
当修复工程出现实施与设计不符、环保措施落实不到位或其他重大环保问题时,环境监理员根据问题的严重程度,及时下达一般联系单、整改通知单或停/复工指令单,将问题反馈至建设单位,督促施工单位及时处理。
当修复工程进行到一定阶段时,环境监理根据现场工作日常记录编写总结材料,包括环境监理定期报告(月报、季报、年报)、阶段报告和总结报告,作为修复工程竣工验收与效果评估的技术材料之一。
2.4 工程验收阶段环境监理要点
工程验收阶段环境监理工作主要集中在2个方面:一是在开展工程效果评估前,环境监理对施工单位提交的施工过程资料进行完整性和准确性检查,如工程量出错或资料中出现与实际施工不符的内容,及时查清原因,督促施工单位修改完善。二是在开展效果评估期间,协助效果评估单位进行基坑土壤样品采集和热脱附后土壤样品采集,跟踪样品检测结果,如有不合格情况,督促施工单位及时采取处理措施,直至样品检测结果满足修复方案中的相关要求。同时,要协助开展效果评估阶段的其他相关工作。
3. 本案例的典型意义
3.1 修复技术代表性
异位热脱附是一种较为成熟的土壤修复技术,目前已广泛应用于国内外有机污染场地修复实践中。我国自2009年首次引进异位热脱附设备[1],异位热脱附修复技术更是在国内得到快速发展,截至2017年已开展23例污染场地异位热脱附修复项目,同时以其修复工期短、修复效率高的显著优势在现阶段土壤修复中逐渐占据更大比例[8]。保障异位热脱附技术的修复效果对于有机污染土壤修复意义重大。本研究通过案例分析,明确了在异位热脱附修复工程环境监理实际工作中应重点关注的事项,对于开展类似工程的环境监理工作、加强异位热脱附修复工程的环境监管具有一定的指导意义。
3.2 参与过程全面性
环境监理工作的重点在于对修复工程过程的把控,只有对工程全过程进行有效监管,确保施工质量与二次污染防治措施落实到位,才能保障最终的修复效果。本案例的环境监理工作涵盖了污染土壤异位热脱附修复工程的全过程,即:自施工前的文件审核至污染土壤修复后的原址回填,在工作内容方面具有全面性,在工作流程上具有较好的衔接性,基本覆盖了此类工程环境监理工作的关键环节,可对类似工程提供良好的借鉴与参考。
3.3 存在问题普遍性
本工程环境监理工作中存在的主要问题如下:一是环境监理地位不明确,工作范围模糊,在实际工作中易与工程监理产生职责混淆或推诿等问题,造成工作不畅。二是缺乏专业的环境监理人员,环境监理人员应兼备工程管理与环境保护相关专业知识技能,任何一方面的缺失即有可能造成修复工程中的偏差,对修复效果产生负面影响。三是修复工程组织方式协调不足,修复工程一般由建设单位、施工单位、工程监理单位、验收单位等多家参与,在实际工作中由于缺乏有效的协调机制,导致施工受阻或沟通断层,从而降低了工作效率。
上述问题也存在于多个案例中[9-11],通过案例分析,梳理问题、探索解决途径,对于改进污染场地异位热脱附修复环境监理工作具有一定的普适性。
4. 讨论与建议
4.1 讨论
目前,有关污染场地修复工程环境监理的研究日益增多。从研究对象上看,主要涉及焦化厂[3]、蓄电池厂[12]、尾矿库[13]、公路项目[14]和石化项目[11, 15-16]等。然而,鲜有针对钢铁企业污染场地修复工程的案例研究。钢铁企业多为重污染企业,随着全国各地有关钢铁企业退城搬迁政策的出台,城市建成区内遗留大量钢铁企业污染场地。在对其实施污染修复时,须密切关注修复工程中的环保措施落实和二次污染防治情况,尽可能地削弱修复工程对周边人居环境的不良影响。本研究可为钢铁企业污染场地修复工程环境监理提供案例参考。
从研究内容上看,主要集中在环境监理工作方式方法[17-18]和问题对策[10, 19]这2个方面。类似研究并未根据修复工程所采用的技术而进一步对环境监理内容加以区分。然而,目前污染场地修复常用技术种类较多,不同修复技术对应的环境监理工作要点存在一定差异。如“3.1修复技术代表性”中所述,异位热脱附修复技术在国内污染场地修复中应用普遍且发展迅速,但在目前能够检索到的中文文献中鲜有关于异位热脱附修复工程环境监理的研究。本研究则专门针对异位热脱附修复工程的各个环节,进行全过程的环境监理要点分析,对于实践工作有着较强的指导意义。
4.2 建议
根据本案例研究情况,针对目前环境监理工作存在的问题,提出以下建议:
1)出台权威的环境监理工作指南。目前污染场地环境监理工作缺乏较为统一的标准,导致实际工作中工作范围不清晰等问题。因此,亟需根据实际情况建立一套科学合理的标准以指导实践;同时还需与地方环境政策相结合,最大限度地做到因地制宜。
2)优化环境监理工作模式。在工程准备期做好组织体系构建工作,细化工作内容,明确各方职责,建立良好的沟通协调机制,保障污染场地修复工作的过程完整性和结果有效性。与工程监理充分合作,在施工期临时组建共同的领导部门,在统一领导下开展工作,权责分明,沟通顺畅,全方位保障修复工程质量[18, 20]。
3)组建环境监理人才队伍。环境监理人员需对相关环保的法律法规等相关规定要有较为全面的认知,掌握必要的环保知识,有针对性地将工程建设项目中的环境污染和生态保护的特点进行归类总结,准确分析施工环境影响、环保措施实施效果及环境监测结果。同时,需熟悉项目施工流程及其特点,尽可能全面地预防和控制可能造成的环境问题。
-
图 6 LSFO WAFs暴露120 h后斑马鱼仔鱼各畸形类型比例和GTS得分情况
Figure 6. Proportion of different deformities and GTS scores of zebrafish larvae after exposure to LSFO WAFs for 120 h. Proportion of different deformities and GTS scores of exposures to WRG WAFs (a-b), MGO WAFs (c-d) and VLSFO WAFs (e-f) (* means P ≤ 0.05, * * means P ≤ 0.01)
表 1 LSFO及其WAFs化学表征色谱/质谱条件
Table 1. Chromatographic/mass spectrometry conditions for chemical characterization of the LSFOs and WAFs
仪器名称Instrument 色谱柱 Column 载气/(mL·min−1) Carrier flow 进样模式Injection mode 离子源温度/℃ Ion source temperature 进样口温度/℃ Inlet temperature 升温程序 Temperature program GC-MS/MS DB-5MS (30 m × 0.25 μm × 0.25 mm) 氦气:1.20 不分流 280 250 40 ℃(4 min)→10 ℃·min−1→320 ℃(2 min) GC-FID DB-1(30 m × 0.53 mm × 1.5 μm) 氢气:40.0空气:350氮气:30.0 不分流 330 280 40 ℃(1 min)→6 ℃·min−1→330 ℃(10 min) P&T GC-MS DB-624 (60 m × 0.25 μm × 1.4 μm) 氦气:1.30 分流,30:1 230 225 35 ℃(3 min→6 ℃·min−1→100 ℃→12 ℃·min−1→180 ℃→20 ℃·min−1→200 ℃(7 min) 表 2 低硫燃料油的基础理化性质
Table 2. Physicochemical properties of the LSFO
受试油品类型Type of oil tested 密度/(kg·m-3)density 倾点/℃Pour point 闭口闪点/℃Flash point 运动黏度/(mm2·s−1)Viscosity(20 ℃) 硫含量/%Sulphur content 蜡含量/%Wax content 沥青质含量/%Asphaltene content WRG 0.873 -6.00 108 90.4 0.04 0.00 <0.05 MGO 0.865 -30.0 70.0 8.21 0.08 0.00 <0.05 VLSFO 0.970 12.0 >120 1156 0.48 0.80 2.78 -
[1] RAO X, SHENG C X, GUO Z W, et al. Corrosion behaviors of cylinder liner in marine diesel engine burning low sulfur fuel oil: An experimental and molecular dynamics simulation study [J]. Tribology International, 2022, 171: 107575. doi: 10.1016/j.triboint.2022.107575 [2] 杨世知. 船用低硫燃油潜在风险不容忽视 [J]. 中国船检, 2020(9): 59-64. doi: 10.3969/j.issn.1009-2005.2020.09.016 YANG S Z. The potential risk of marine low sulfur fuel can not be ignored [J]. China Ship Survey, 2020(9): 59-64(in Chinese). doi: 10.3969/j.issn.1009-2005.2020.09.016
[3] QU J, TRUHAN J J, BLAU P J, et al. Scuffing transition diagrams for heavy duty diesel fuel injector materials in ultra low-sulfur fuel-lubricated environment [J]. Wear, 2005, 259(7/8/9/10/11/12): 1031-1040. [4] BETHA R, RUSSELL L M, SANCHEZ K J, et al. Lower NOx but higher particle and black carbon emissions from renewable diesel compared to ultra low sulfur diesel in at-sea operations of a research vessel [J]. Aerosol Science and Technology, 2017, 51(2): 123-134. doi: 10.1080/02786826.2016.1238034 [5] 徐峥, 胡晓和, 杨城. 浅谈船用主机使用低硫燃油面临的挑战与应对措施 [J]. 柴油机, 2020, 42(6): 59-63. doi: 10.3969/j.issn.1001-4357.2020.06.014 XU Z, HU X H, YANG C. Discussion on challenges and countermeasures of marine diesel engines running with low sulfur fuel [J]. Diesel Engine, 2020, 42(6): 59-63(in Chinese). doi: 10.3969/j.issn.1001-4357.2020.06.014
[6] BARRON M G, VIVIAN D N, HEINTZ R A, et al. Long-term ecological impacts from oil spills: Comparison of Exxon valdez, Hebei spirit, and deepwater horizon [J]. Environmental Science & Technology, 2020, 54(11): 6456-6467. [7] 王传远, 贺世杰, 李延太, 等. 中国海洋溢油污染现状及其生态影响研究 [J]. 海洋科学, 2009, 33(6): 57-60. WANG C Y, HE S J, LI Y T, et al. Study on the state and ecological effect of spilled oil pollution in Chinese Coastal Waters [J]. Marine Sciences, 2009, 33(6): 57-60(in Chinese).
[8] LEWIS D. How Mauritius is cleaning up after major oil spill in biodiversity hotspot [J]. Nature, 2020, 585(7824): 172. doi: 10.1038/d41586-020-02446-7 [9] SEVESO D, LOUIS Y D, MONTANO S, et al. The Mauritius oil spill: What’s next? [J]. Pollutants, 2021, 1(1): 18-28. doi: 10.3390/pollutants1010003 [10] HANSEN B H, NORDTUG T, FARKAS J, et al. Toxicity and developmental effects of Arctic fuel oil types on early life stages of Atlantic cod (Gadus morhua) [J]. Aquatic Toxicology, 2021, 237: 105881. doi: 10.1016/j.aquatox.2021.105881 [11] JÖNANDER C, DAHLLÖF I. Short and long-term effects of low-sulphur fuels on marine zooplankton communities [J]. Aquatic Toxicology, 2020, 227: 105592. doi: 10.1016/j.aquatox.2020.105592 [12] JOYE S B. Deepwater horizon, 5 years on [J]. Science, 2015, 349(6248): 592-593. doi: 10.1126/science.aab4133 [13] TAKESHITA R, BURSIAN S J, COLEGROVE K M, et al. A review of the toxicology of oil in vertebrates: What we have learned following the Deepwater Horizon oil spill [J]. Journal of Toxicology and Environmental Health, Part B, 2021, 24(8): 355-394. doi: 10.1080/10937404.2021.1975182 [14] SHEN A L, TANG F H, XU W T, et al. Toxicity testing of crude oil and fuel oil using early life stages of the black porgy (Acanthopagrus schlegelii) [J]. Biology and Environment:Proceedings of the Royal Irish Academy, 2012, 112B(1): 35-41. doi: 10.1353/bae.2012.0037 [15] 安伟, 郭鹏, 张庆范, 等. IMO2020限硫令下船用燃料油使用分析 [J]. 船海工程, 2021, 50(3): 135-137,146. doi: 10.3963/j.issn.1671-7953.2021.03.033 AN W, GUO P, ZHANG Q F, et al. Analysis on the use of marine fuel oil under IMO 2020 sulfur limitation regulation [J]. Ship & Ocean Engineering, 2021, 50(3): 135-137,146(in Chinese). doi: 10.3963/j.issn.1671-7953.2021.03.033
[16] 王红星, 刘瑜. 船用超低硫重油的特性与应用分析 [J]. 世界海运, 2017, 40(8): 33-37. doi: 10.16176/j.cnki.21-1284.2017.08.007 WANG H X, LIU Y. Characteristics and application analysis of marine ultra-low sulfur heavy oil [J]. World Shipping, 2017, 40(8): 33-37(in Chinese). doi: 10.16176/j.cnki.21-1284.2017.08.007
[17] Standard Test Method for Density, Relative Density, and API Gravity of Liquids by Digital Density Meter: ASTM D4052-18a[S]. ASTM International, 2018. [18] Standard Test Method for Pour Point of Petroleum Products: ASTM D97-17b[S]. ASTM International, 2017. [19] Standard Test Methods for Flash-Point by Pensky-Martens Closed Cup Tester: ASTM D93-20[S]. ASTM International, 2020. [20] Standard Test Method for Kinematic Viscosity of Transparent and Opaque Liquids (and Calculation of Dynamic Viscosity): ASTM D445-19a[S]. ASTM International, 2019. [21] Standard Test Method for Sulfur in Petroleum and Petroleum Products by Energy Dispersive X-ray Fluorescence Spectrometry: ASTM D4294-16e1[S]. ASTM International, 2016. [22] Standard Test Method for Determination of Asphaltenes (Heptane Insolubles) in Crude Petroleum and Petroleum Products: ASTM D6560-17[S]. ASTM International, 2017. [23] Bitumen and bituminous binders - Determination of the paraffin wax content - Part 1: Method by distillation: German version EN 12606-1: 2015 [S]. 2015. [24] AURAND D, G COELHO. Cooperative aquatic toxicity testing of dispersed oil and the "chemical response to oil spills: ecological research forum (CROSERF)" [R]. Lusby: Ecosystem Management & Associates, Inc. , 2005, 30-31. [25] USEPA 8270E, Semi-volatile organic compounds by gas chromatography/mass spectrometry[S]. [26] USEPA 8260D, Volatile organic compounds by gas chromatography/mass spectrometry[S]. [27] USEPA 8015D, Nonhalogenated organics using GC/FID[S]. [28] Organization for economic co-operation and development. OECD guidelines for the testing of chemicals. section 2: effects on biotic systems test No. 236: fish embryo acute toxicity (FET) test[M]. Paris: OECD Publishing, 2013. 22. [29] YU T Y, JIANG Y, LIN S J. A 3-dimensional (3D)-printed template for high throughput zebrafish embryo arraying [J]. Journal of Visualized Experiments:JoVE, 2018(136): 57892. [30] HERMSEN S A B, van den BRANDHOF E J, van der VEN L T M, et al. Relative embryotoxicity of two classes of chemicals in a modified zebrafish embryotoxicity test and comparison with their in vivo potencies [J]. Toxicology in Vitro, 2011, 25(3): 745-753. doi: 10.1016/j.tiv.2011.01.005 [31] BEEKHUIJZEN M, de KONING C, FLORES-GUILLÉN M E, et al. From cutting edge to guideline: A first step in harmonization of the zebrafish embryotoxicity test (ZET) by describing the most optimal test conditions and morphology scoring system [J]. Reproductive Toxicology, 2015, 56: 64-76. doi: 10.1016/j.reprotox.2015.06.050 [32] 梁靖雨, 姜越, 董公卿, 等. 一种基于DeepLabV3Plus的斑马鱼形态学评分方法: CN113361353A[P]. 2021-09-07. LIANG J Y, JIANG Y, DONG G Q, et al. Zebrafish morphological scoring method based on DeepLabV3Plus: CN113361353A[P]. 2021-09-07(in Chinese).
[33] MCCARTY L S. The relationship between aquatic toxicity QSARs and bioconcentration for some organic chemicals [J]. Environmental Toxicology and Chemistry, 1986, 5(12): 1071-1080. doi: 10.1002/etc.5620051207 [34] McCARTY L S, MACKAY D. Enhancing ecotoxicological modeling and assessment body residues and modes of toxic action [J]. Environmental Science & Technology, 1993, 27(9): 1718-1728. [35] McCARTY L S, DIXON D G, MacKAY D, et al. Residue-based interpretation of toxicity and bioconcentration QSARs from aquatic bioassays: Neutral narcotic organics [J]. Environmental Toxicology and Chemistry, 1992, 11(7): 917-930. doi: 10.1002/etc.5620110705 [36] MCCARTY L S, MACKAY D, SMITH A D, et al. Residue-based interpretation of toxicity and bioconcentration QSARs from aquatic bioassays: Polar narcotic organics [J]. Ecotoxicology and Environmental Safety, 1993, 25(3): 253-270. doi: 10.1006/eesa.1993.1024 [37] NEFF J M. Bioaccumulation in marine organisms: Effect of contaminants from oil well produced water[M]. Amsterdam: Elsevier, 2002 [38] UHLER A D, STOUT S A, DOUGLAS G S, et al. Chemical character of marine heavy fuel oils and lubricants//Standard Handbook Oil Spill Environmental Forensics[M]. Boston: Academic Press, 2016: 641-683. [39] 李元钟. 低硫燃油对燃烧特性和环境的影响 [J]. 船舶工业技术经济信息, 1994(10): 26-27. LI Y Z. Influence of low sulfur fuel on combustion characteristics and environment [J]. Technology and Economy Information of Ship Bulldings Industry, 1994(10): 26-27(in Chinese).
[40] PHILIBERT D A, LYONS D, PHILIBERT C, et al. Field-collected crude oil, weathered oil and dispersants differentially affect the early life stages of freshwater and saltwater fishes [J]. Science of the Total Environment, 2019, 647: 1148-1157. doi: 10.1016/j.scitotenv.2018.08.052 [41] PHILIBERT D A, PHILIBERT C P, LEWIS C, et al. Comparison of diluted bitumen (dilbit) and conventional crude oil toxicity to developing zebrafish [J]. Environmental Science & Technology, 2016, 50(11): 6091-6098. [42] LI X S, XIONG D Q, DING G H, et al. Exposure to water-accommodated fractions of two different crude oils alters morphology, cardiac function and swim bladder development in early-life stages of zebrafish [J]. Chemosphere, 2019, 235: 423-433. doi: 10.1016/j.chemosphere.2019.06.199 [43] JOHANN S, NÜßER L, GOßEN M, et al. Differences in biomarker and behavioral responses to native and chemically dispersed crude and refined fossil oils in zebrafish early life stages [J]. Science of the Total Environment, 2020, 709: 136174. doi: 10.1016/j.scitotenv.2019.136174 [44] 魏复盛. 国家环境保护总局, 水和废水监测分析方法编委会编. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. WEI F S. State Environmental Protection Administration. Analysis methods for water and wastewater (4th edition) [M]. Beijing: China Environmental Science Press, 2002(in Chinese).
[45] INCARDONA J P. Molecular mechanisms of crude oil developmental toxicity in fish [J]. Archives of Environmental Contamination and Toxicology, 2017, 73(1): 19-32. doi: 10.1007/s00244-017-0381-1 [46] Di TORO D M, McGRATH J A, STUBBLEFIELD W A. Predicting the toxicity of neat and weathered crude oil: Toxic potential and the toxicity of saturated mixtures [J]. Environmental Toxicology and Chemistry, 2007, 26(1): 24-36. doi: 10.1897/06174R.1 [47] LI X S, DING G H, XIONG Y J, et al. Toxicity of water-accommodated fractions (WAF), chemically enhanced WAF (CEWAF) of Oman crude oil and dispersant to early-life stages of zebrafish (Danio rerio) [J]. Bulletin of Environmental Contamination and Toxicology, 2018, 101(3): 314-319. doi: 10.1007/s00128-018-2413-6 [48] ELFAWY H A, ANUPRIYA S, MOHANTY S, et al. Molecular toxicity of Benzo(a)pyrene mediated by elicited oxidative stress infer skeletal deformities and apoptosis in embryonic zebrafish [J]. The Science of the Total Environment, 2021, 789: 147989. doi: 10.1016/j.scitotenv.2021.147989 [49] MAISANO M, CAPPELLO T, NATALOTTO A, et al. Effects of petrochemical contamination on caged marine mussels using a multi-biomarker approach: Histological changes, neurotoxicity and hypoxic stress [J]. Marine Environmental Research, 2017, 128: 114-123. doi: 10.1016/j.marenvres.2016.03.008 [50] SANO K, INOHAYA K, KAWAGUCHI M, et al. Purification and characterization of zebrafish hatching enzyme - an evolutionary aspect of the mechanism of egg envelope digestion [J]. The FEBS Journal, 2008, 275(23): 5934-5946. doi: 10.1111/j.1742-4658.2008.06722.x [51] DRAPEAU P, SAINT-AMANT L, BUSS R R, et al. Development of the locomotor network in zebrafish [J]. Progress in Neurobiology, 2002, 68(2): 85-111. doi: 10.1016/S0301-0082(02)00075-8 [52] EVERITT S, FUJITA K K, MacPHERSON S, et al. Toxicity of weathered sediment-bound dilbit to early life stages of zebrafish (Danio rerio) [J]. Environmental Science & Technology, 2021, 55(3): 1721-1729. [53] BRETTE F, MACHADO B, CROS C, et al. Crude oil impairs cardiac excitation-contraction coupling in fish [J]. Science, 2014, 343(6172): 772-776. doi: 10.1126/science.1242747 [54] BARRON M G, CARLS M G, HEINTZ R, et al. Evaluation of fish early life-stage toxicity models of chronic embryonic exposures to complex polycyclic aromatic hydrocarbon mixtures [J]. Toxicological Sciences, 2004, 78(1): 60-67. doi: 10.1093/toxsci/kfh051 [55] LUSHCHAK V I. Environmentally induced oxidative stress in aquatic animals [J]. Aquatic Toxicology, 2011, 101(1): 13-30. doi: 10.1016/j.aquatox.2010.10.006 [56] 高惠滢, 胡薇. 生物体的抗氧化酶系统概述 [J]. 生物学教学, 2018, 43(10): 3-5. doi: 10.3969/j.issn.1004-7549.2018.10.002 GAO H Y, HU W. An overview of the antioxidant enzyme system in organisms [J]. Biology Teaching, 2018, 43(10): 3-5(in Chinese). doi: 10.3969/j.issn.1004-7549.2018.10.002
[57] REGOLI F, FRENZILLI G, BOCCHETTI R, et al. Time-course variations of oxyradical metabolism, DNA integrity and lysosomal stability in mussels, Mytilus galloprovincialis, during a field translocation experiment [J]. Aquatic Toxicology, 2004, 68(2): 167-178. doi: 10.1016/j.aquatox.2004.03.011 [58] DEMIGUEL-JIMÉNEZ L, ETXEBARRIA N, LEKUBE X, et al. Influence of dispersant application on the toxicity to sea urchin embryos of crude and bunker oils representative of prospective oil spill threats in Arctic and Sub-Arctic Seas [J]. Marine Pollution Bulletin, 2021, 172: 112922. doi: 10.1016/j.marpolbul.2021.112922 [59] PAGE D S, BOEHM P D, STUBBLEFIELD W A, et al. Hydrocarbon composition and toxicity of sediments following the Exxon Valdez oil spill in Prince William Sound, Alaska, USA [J]. Environmental Toxicology and Chemistry, 2002, 21(7): 1438-1450. doi: 10.1002/etc.5620210715 [60] 李丽娜. 燃料油脱硫技术的研究进展 [J]. 精细石油化工进展, 2022, 23(2): 48-54. doi: 10.13534/j.cnki.32-1601/te.2022.02.010 LI L N. A review of the research progress in desulfurization technology for fuel oil [J]. Advances in Fine Petrochemicals, 2022, 23(2): 48-54(in Chinese). doi: 10.13534/j.cnki.32-1601/te.2022.02.010
[61] SMITH J N, GAITHER K A, PANDE P. Competitive metabolism of polycyclic aromatic hydrocarbons (PAHs): An assessment using in vitro metabolism and physiologically based pharmacokinetic (PBPK) modeling [J]. International Journal of Environmental Research and Public Health, 2022, 19(14): 8266. doi: 10.3390/ijerph19148266 [62] NICHOLS J W, LADD M A, HOFFMAN A D, et al. Biotransformation of polycyclic aromatic hydrocarbons by trout liver S9 fractions: Evaluation of competitive inhibition using a substrate depletion approach [J]. Environmental Toxicology and Chemistry, 2019, 38(12): 2729-2739. doi: 10.1002/etc.4595 [63] STRINGFELLOW W T, AITKEN M D. Competitive metabolism of naphthalene, methylnaphthalenes, and fluorene by phenanthrene-degrading pseudomonads [J]. Applied and Environmental Microbiology, 1995, 61(1): 357-362. doi: 10.1128/aem.61.1.357-362.1995 [64] BICHEREL P, THOMAS P C. Aquatic toxicity calculation of mixtures: A chemical activity approach incorporating a bioavailability reduction concept [J]. Environmental Science & Technology, 2021, 55(16): 11183-11191. [65] SCHMIDT S N, HOLMSTRUP M, SMITH K E C, et al. Passive dosing of polycyclic aromatic hydrocarbon (PAH) mixtures to terrestrial springtails: Linking mixture toxicity to chemical activities, equilibrium lipid concentrations, and toxic units [J]. Environmental Science & Technology, 2013, 47(13): 7020-7027. -






 下载:
下载: