-
饮用水消毒始于20世纪初,其目的是为了杀死水中的病原微生物,切断介水传染病的传播和流行,保障饮用水的安全. 然而,在消毒过程中,消毒剂会不可避免地与水中的天然有机物、外源污染物、无机物等发生反应,生成一类对人体有致畸、致癌、致突变作用的物质——消毒副产物(disinfection by-products, DBPs). 1974年,Rook[1]等发现,氯消毒会产生三卤甲烷(trihalomethanes, THMs),两年后美国癌症协会宣布三氯甲烷对人体具有致癌性,使得DBPs成为了饮用水处理领域关注的热点. 由于氯消毒会产生较多的THMs、卤乙酸(haloacetic acids, HAAs)等受到严格管控的含碳消毒副产物(carbonaceous disinfection by-products, C-DBPs),不少饮用水厂转而采用氯胺、臭氧、二氧化氯等其他消毒方式来代替氯消毒. 氯胺作为消毒剂,它与消毒副产物前体物的反应活性远小于氯,能够有效减少消毒后THMs和HAAs的生成,且氯胺在管网中形成余氯的持续时间长,能够有效抑制管网中残留细菌的再繁殖. 然而,有研究发现,氯胺消毒会导致消毒后水中含氮消毒副产物(nitrogenous disinfection by-products, N-DBPs)生成的增加[2],N-DBPs是一种新兴的DBPs,包括卤代乙腈(haloacetonitrile, HANs)、卤代乙酰胺(haloacetamides, HAcAms)、卤代硝基甲烷(halogenated nitromethanes, HNMs)、亚硝胺类(nitrosamines, NAs)等,相对于C-DBPs,N-DBPs虽然生成浓度较低,但却具有更高的遗传毒性和细胞毒性[3-4].
近年来,有研究发现,当原水中存在溴离子和碘离子时,消毒后的水中不仅会生成氯代DBPs,还会有溴代和碘代DBPs生成[5-6],且溴代和碘代DBPs的细胞毒性和遗传毒性都较氯代DBPs强[4,7]. 例如,Plewa等[8]研究发现,溴乙酸和碘乙酸的细胞毒性分别是氯乙酸的125倍和500倍;Muellner等[9]研究发现,碘乙腈(iodoacetonitrile, IAN)的遗传毒性是目前已知的DBPs中最高的,是二氯乙腈的74倍. 在我国,大部分沿海地区的水源是潮汐河流,靠近入海口,经常会受到咸潮入侵的影响,而海水中溴离子和碘离子的浓度是一般淡水的三千多倍和十几倍[10-12],这将使得这些地区的水源水中有存在较高浓度溴离子和碘离子的风险,进而导致消毒过程中更容易生成溴代和碘代的DBPs. 此外,在我国北方地区的一些城镇生活饮用水中的碘含量可以超过100 μg·L−1[13-14]. 水体中较高的碘含量,不仅会增加人类患甲状腺疾病的风险,而且还会增加消毒过程中I-DBPs的形成. 目前,对于溴代和碘代DBPs的研究多集中在常规的C-DBPs如THMs和HAAs等方面,例如Zha等[15]的研究发现,当溴离子的浓度从0.5 mg·L−1增加至2 mg·L−1时,消毒后生成的三溴甲烷从18.31 μg·L−1增加至127.60 μg·L−1;当碘离子浓度从0增加至2 mg·L−1时,三碘甲烷的生成量从0 μg·L−1增加到317.20 μg·L−1,同等条件下,氯仿的生成量则从241.97 μg·L−1下降至96.23 μg·L−1,表明溴、碘离子的存在会使得氯代THMs向溴代和碘代THMs转变. 而且即使在溴离子浓度较低时,溴代THMs与溴代HAAs的生成量仍然会随之增加. 如Zhang等[16]的研究表明,溴离子浓度为500 μg·L−1的水体经消毒后生成的溴代THMs与溴代HAAs分别是溴离子浓度为65 μg·L−1时的5倍与10倍. 对于溴、碘离子的存在对消毒过程中N-DBPs生成的影响,目前的研究多集中在溴代N-DBPs. 研究发现,HANs、HNMs与HAcAms等N-DBPs的生成总量均会随着溴离子浓度的增加而增加[17-18],并且溴代N-DBPs的占比也会随着溴离子浓度的增加而增加,表明在有溴离子存在的情况下,氯代N-DBPs会向溴代N-DBPs转变. 此外,氯胺消毒过程中溴的反应活性要强于氯消毒[19],并且在碘离子存在的情况下,氯胺消毒不能像氯和臭氧消毒一样进一步将次碘酸氧化为碘酸盐[20],因而在氯胺消毒过程中,可能有更高的溴代和碘代N-DBPs生成的风险.
此外,原水中有机前体物的种类、含量及组成对后续消毒过程中溴代和碘代DBPs的生成也具有重要影响. 目前,我国湖泊、水库等水源水仍存在着富营养化严重,藻类季节性爆发等问题,使原水中含有较多的藻类有机物等生物源有机物,而这些生物源有机物已经成为DBPs,特别是N-DBPs的重要前体物[21-22]. 考虑到实际水体中的有机物来源广泛,种类繁多,成分复杂,难以进行直接研究,采用模拟化合物来模拟实际水体中的有机物是广泛采用的研究方法. Hua等[23]采用牛血清蛋白、鱼油和淀粉来模拟藻类有机物的生化成分中的蛋白质、脂肪以及多糖,结果表明鱼油生成的三氯甲烷分别是牛血清蛋白和淀粉的1.8倍和16倍. Wei等[24]采用腐殖酸、牛血清蛋白、DNA、淀粉与鱼油模拟化合物模拟生物源有机物的主要生化成分腐殖酸、蛋白质、核酸、多糖和脂肪,研究溴、碘离子对C-DBPs的生成影响时发现,鱼油模拟的脂肪类结构经氯化消毒后,形成的I-DBPs比其他模拟化合物都要多,在碘离子浓度为2 mg·L−1时,生成了16.97 μg·L−1的一碘二氯甲烷,而腐殖酸经消毒后仅生成3.87 μg·L−1的一碘二氯甲烷. Yang等[25]的研究发现,含有较多脂肪族结构的亲水性天然有机物(natural organic matter, NOM)较芳香族结构的疏水性NOM更易形成I-DBPs. 而鱼油的重要成分二十二碳六烯酸提取于藻类,其主要成分不饱和脂肪酸均属于脂肪族化合物.
本研究将选择鱼油作为模拟化合物,模拟原水中广泛存在的天然有机物和生物源有机物的脂肪类组成成分,采用氯胺作为消毒剂,分别考察无机前体物(溴、碘离子)浓度、总有机碳(Total Organic Carbon, TOC)、氯胺投加量、消毒时间、初始pH等因素对溴代和碘代N-DBPs生成的影响. 整个研究对于控制溴代和碘代N-DBPs的生成,保障人民群众的饮用水安全具有重要意义.
-
一溴乙腈(bromoacetonitrile, BAN, 97%)购自Macklin,二溴乙腈(dibromoacetonitrile, DBAN, 97%)与无水硫酸钠(分析纯)购自Aladdin, IAN(>98%)购自上海梯希爱,一溴硝基甲烷(bromonitromethane, BNM, 97%)购买自海晟泰,内标物1,2-二溴丙烷(1000 mg·L−1于甲基叔丁基醚)购自上海安谱,鱼油(18%EPA, 20%Ώ3)购买自罗恩试剂,甲基叔丁基醚(色谱纯)购买自TEDIA,氯化钠(优级纯)、次氯酸钠(分析纯)、溴化钠(分析纯)、硫代硫酸钠(分析纯)均购自西陇科学,碘化钾(分析纯)购买自汕头市达濠精细化学品有限公司、氯化铵(分析纯)购自国药集团化学试剂有限公司.
-
取15 mL鱼油,采用超纯水溶解并定容至1000 mL,配置成鱼油储备液,静置过夜后,用定量滤纸过滤,置于棕色瓶中并于4 ℃下保存. 模拟水样的TOC采用总有机碳分析仪(TOC-VCPN,岛津,日本)测定,分析方法为燃烧氧化-非分散红外吸收法. 测定TOC与使用前都要先通过添加硫酸(0.1 mol·L−1)和氢氧化钠(0.1 mol·L−1)将pH调节至中性,再加入浓度为5 mmol·L−1的磷酸盐缓冲液调节水样的pH= 7.2.
-
一氯胺溶液由NaClO与NH4Cl溶液(保持二者质量比为4 mg·L−1 Cl2:1 mg·L−1 NH4+-N)于冰水浴下暗处混合反应30 min制得,需现用现配. 制得的溶液采用N,N-二乙基-1,4-苯二胺分光光度法测定其一氯胺含量(以氯计).
准确量取20 mL1.2节中配制好的模拟水样于带聚四氟乙烯瓶垫的圆底离心管中,加入一定量的溴化钠(C(Br-)= 500 mg·L−1)或碘化钾(C(I-)= 100 mg·L−1)溶液,然后以C(TOC):C(Cl2)= 1:5加入氯胺消毒剂,于恒温培养箱内25 ℃避光反应72 h. 反应完毕后,取出水样,用100 mg·L−1的Na2S2O3溶液终止反应.
-
采用液液萃取[26]. 具体方法为:取消毒完毕后的水样,加入盐酸(1 mol·L−1)将pH调节至2.0,加入50 µL 1 mg·L−1的1,2-二溴丙烷作为内标物,加入5 mL的MTBE作为萃取剂,再加入8 g氯化钠以促进分层,涡旋振荡1.5 min,静置5 min分层,将上层有机相吸出,加入3 g无水硫酸钠(使用前需经马弗炉400 °C灼烧并用MTBE洗涤)过滤至吹脱管中,氮吹至有机相剩余0.5 mL,最后用MTBE定容至1 mL,转移至棕色进样小瓶中等待后续检测.
-
本研究中进行定量分析的溴代和碘代N-DBPs包括HANs与HNMs两大类,其中,HANs类为BAN、DBAN、IAN,HNMs类为BNM. HANs与HNMs的定量分析方法参考EPA551.1和Carter[27]等的方法. 所用仪器为Thermo Trace-1300 ISQ-Mass气相色谱-质谱联用仪,色谱柱型号为HP-5MS UI(30 m × 250 µm × 0. 25 µm). 进样口温度为150 ℃,传输线温度为280 ℃,检测器温度为290 ℃. 升温程序为35 ℃保持5 min后,以10 ℃·min−1的速度升至65 ℃保持3 min,最后以20 ℃·min−1的速度升至260 ℃保持5 min,共26 min;进样方式为不分流进样,进样量为2 µL,载气为高纯氦,氦气流速为1.0 mL·min−1,采用EI电离源,电离电压为70 eV.
-
有研究表明,溴或碘离子的存在,会使消毒过程中的DBPs氯代向溴代和碘代转变. 因此,本研究首先考察鱼油在不同浓度的溴离子和碘离子存在的情况下,经氯胺消毒后,溴代和碘代N-DBPs的生成情况.
-
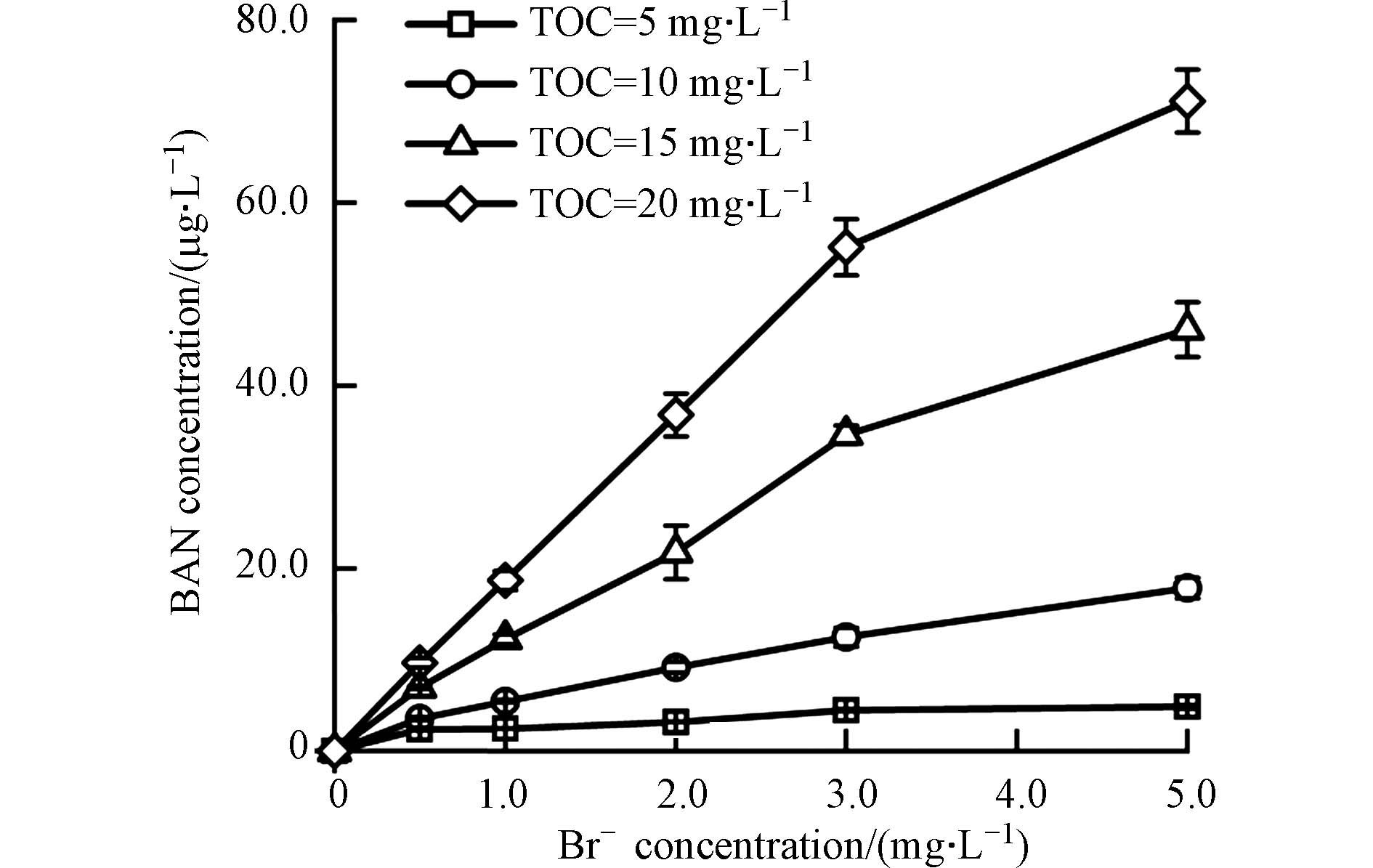
图1是在不同的TOC与溴离子浓度下,鱼油模拟水样经氯胺消毒后BAN的生成情况. 从图中可以看出,在未投加溴离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到BAN的生成,而当溴离子浓度增加到0.5 mg·L−1时,4种不同TOC浓度下的模拟水样均检测到了少量的BAN,且BAN的生成量随着水样TOC浓度的增加而增加.
此外,当溴离子的浓度从0 mg·L−1增加至5 mg·L−1时,4种不同TOC浓度下BAN的生成量均逐渐增加,当溴离子浓度为5 mg·L−1时,4种不同TOC浓度下的BAN的生成量均达到最大值,分别为4.83、17.82、46.13、71.15 μg·L−1. 一方面,增加水样的TOC,提供了更多的DBPs的有机前体物,使得BAN的生成量也随之增加,这说明鱼油模拟的脂肪成分为BAN的有效前体物. 另一方面,当水样中有溴离子存在时,氯胺水解释放的次氯酸会先与溴离子反应[28],产生次溴酸,次溴酸与水中的胺或氯胺反应,生成溴胺与溴氯胺,它们的反应活性比氯胺强[29],更容易与有机前体物反应生成BAN. 当水样的TOC一定时,溴胺与溴氯胺的生成量会随着溴离子浓度的增加而不断增加,其不断地与有机前体物反应,最终表现为BAN的生成量的增加.
此外,从图1还可以发现,当模拟水样的TOC浓度保持不变,BAN的生成量虽然会随着溴离子浓度的增加而逐渐升高,但增长速率会逐渐放缓. 这可能是因为当水样的TOC不变的情况下,水样中能够提供的有机前体物是有限的,而随着溴离子浓度的不断增加,氯胺与溴离子反应形成的溴胺会通过可逆的歧化反应形成二溴胺,二溴胺在水中会快速地分解[30],因此继续增加溴离子浓度可能不会使得BAN的生成量大幅增长;另一方面可能是由于溴离子浓度增加使得生成的BAN向DBAN转变,因此BAN的生成量增幅有所下降.
-
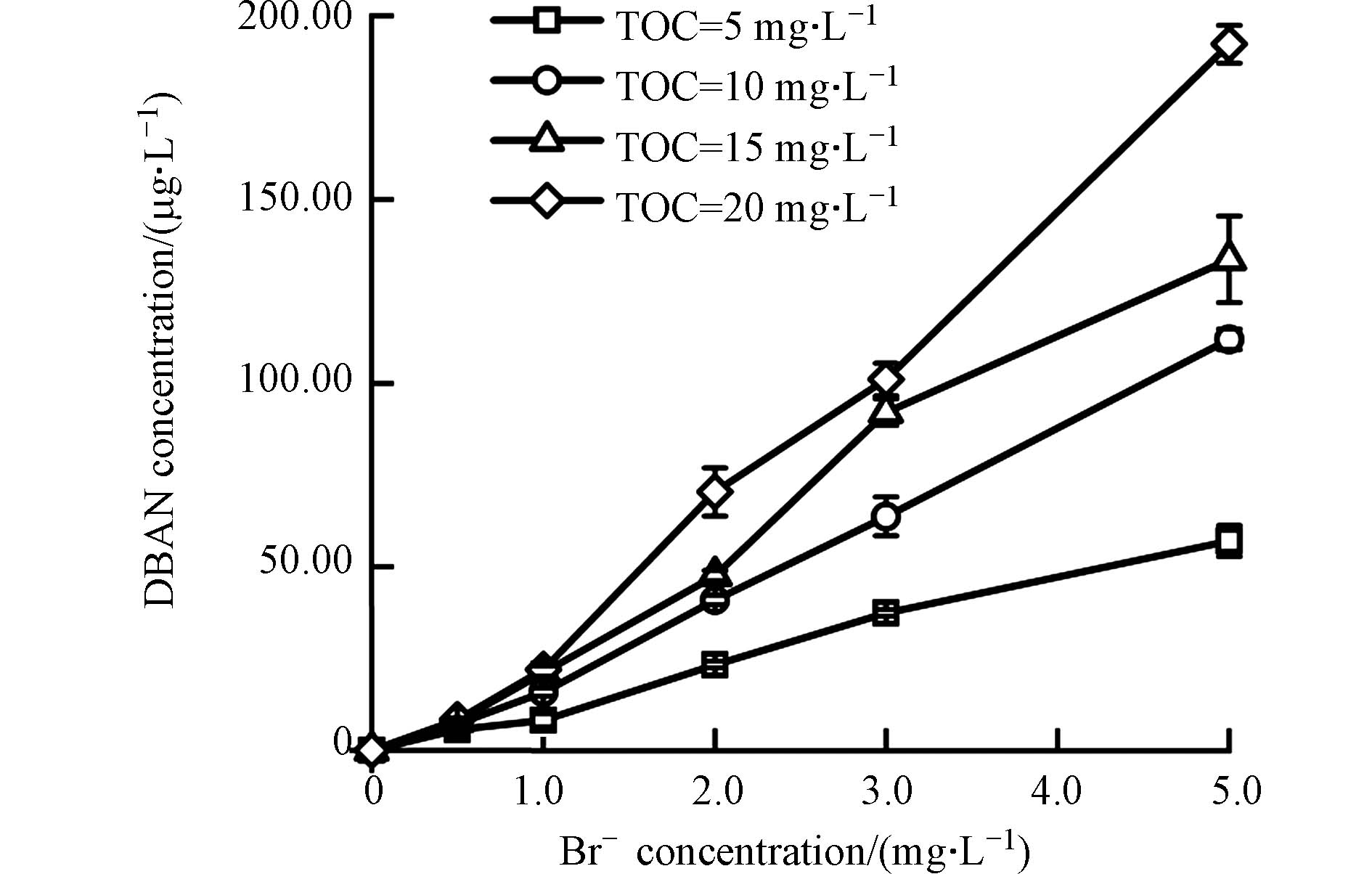
图2是在不同的TOC与溴离子浓度下,鱼油模拟水样经氯胺消毒后DBAN的生成情况. 从图中可以看出,在未投加溴离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到DBAN的生成. 当溴离子浓度增加到0.5 mg·L−1时,4种不同TOC浓度下的模拟水样均检测到了少量的DBAN,生成浓度分别为5.60、7.13、7.96、8.35 μg·L−1,且DBAN的生成量随着水样TOC浓度的增加而增加. 这是由于水样TOC的增加,使得水中含有更多的DBPs的前体物,因而DBAN的生成量随之增加,说明脂肪类结构是DBAN的有效前体物,这与BAN的生成规律一致. 在溴离子浓度较低时,溴的取代反应进行的不完全,生成的DBAN含量较少,随着溴离子浓度逐渐增加,4种不同TOC浓度下DBAN的生成量均迅速增加,当溴离子浓度为5 mg·L−1时,4种不同TOC下DBAN的生成量分别达到57.03、111.97、133.71、192.36 μg·L−1. 增加溴离子的浓度,一方面使水中产生的溴胺与溴氯胺增加[28],二者不断地与有机前体物发生反应;另一方面,溴离子的浓度增加使水样中生成的BAN向DBAN转变,最终表现为DBAN生成量的增加.
-
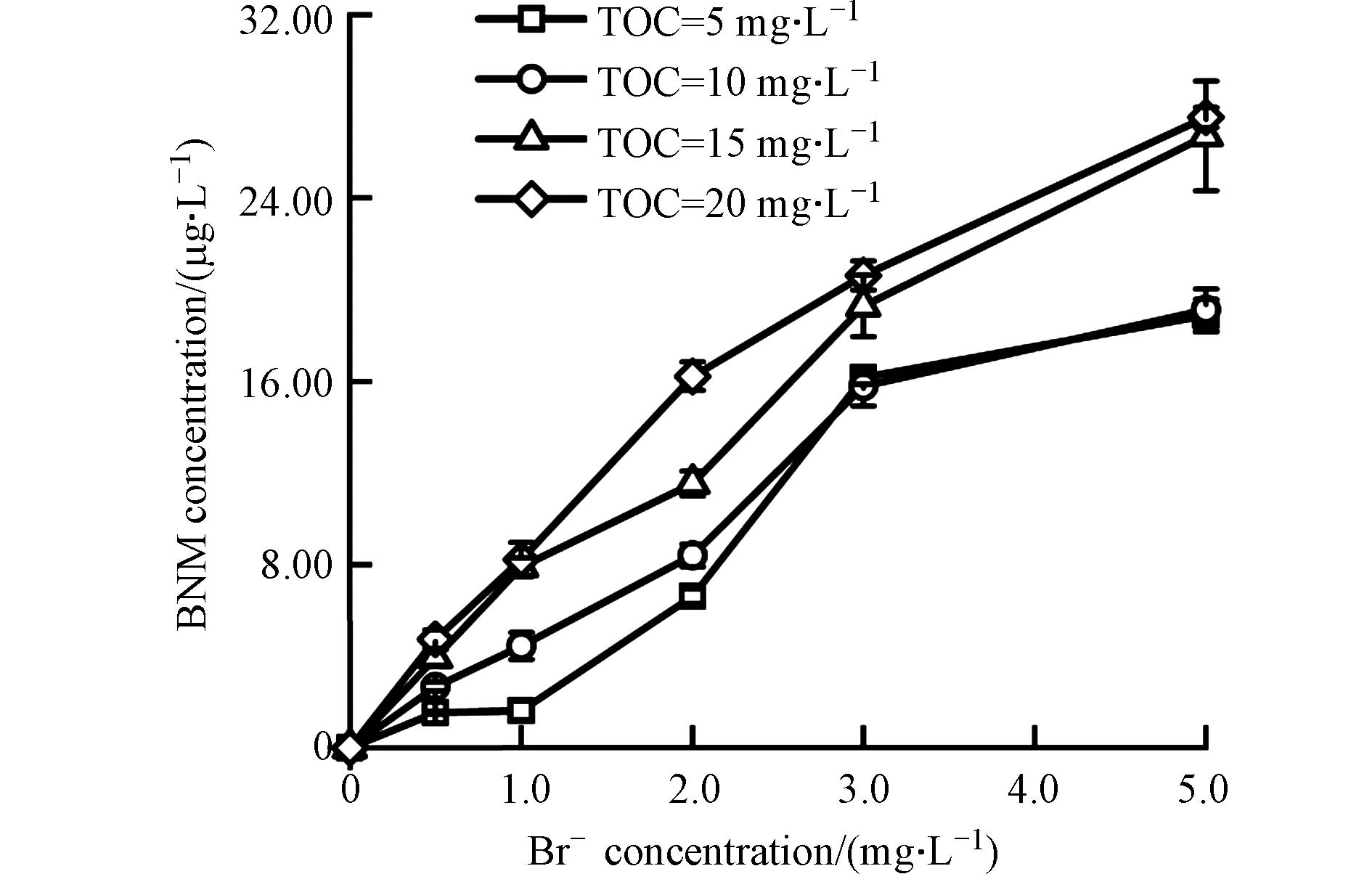
图3是在不同的TOC与溴离子浓度下,鱼油模拟水样经氯胺消毒后BNM的生成情况. 从图中可以看出,在未投加溴离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到BNM的生成. 当溴离子的浓度增加到0.5 mg·L−1时,4种不同浓度TOC下的模拟水样均检测到了BNM的生成. 但是与BAN的生成规律不同,BNM的生成量没有随着TOC浓度的增加而出现大幅的增长. 这可能是因为,HNMs的重要前体物是硝基化合物[31],而本研究选取的模型化合物鱼油作为一种典型的支链脂肪烃类有机物,并不是BNM的重要前体物. 另一方面,模拟水样中并不存在对HNMs的形成有重要影响的亚硝酸盐类物质,且亚硝酸盐经氯化后形成的NO2Cl,与脂肪族化合物相比,更易与含有芳香族和共轭双键的化合物发生亲电取代产生硝基化合物[32].
另外,当水样的TOC浓度一定时,随着溴离子浓度的增加,BNM的生成量也逐渐增加,在溴离子浓度为5 mg·L−1时,4种不同TOC下BNM的生成量分别为18.87、19.12、26.71、27.52 μg·L−1. 说明溴离子浓度的增加,使得水中生成的溴胺与溴氯胺增加,溴胺与溴氯胺与有机物反应进而生成更多的BNM.
-
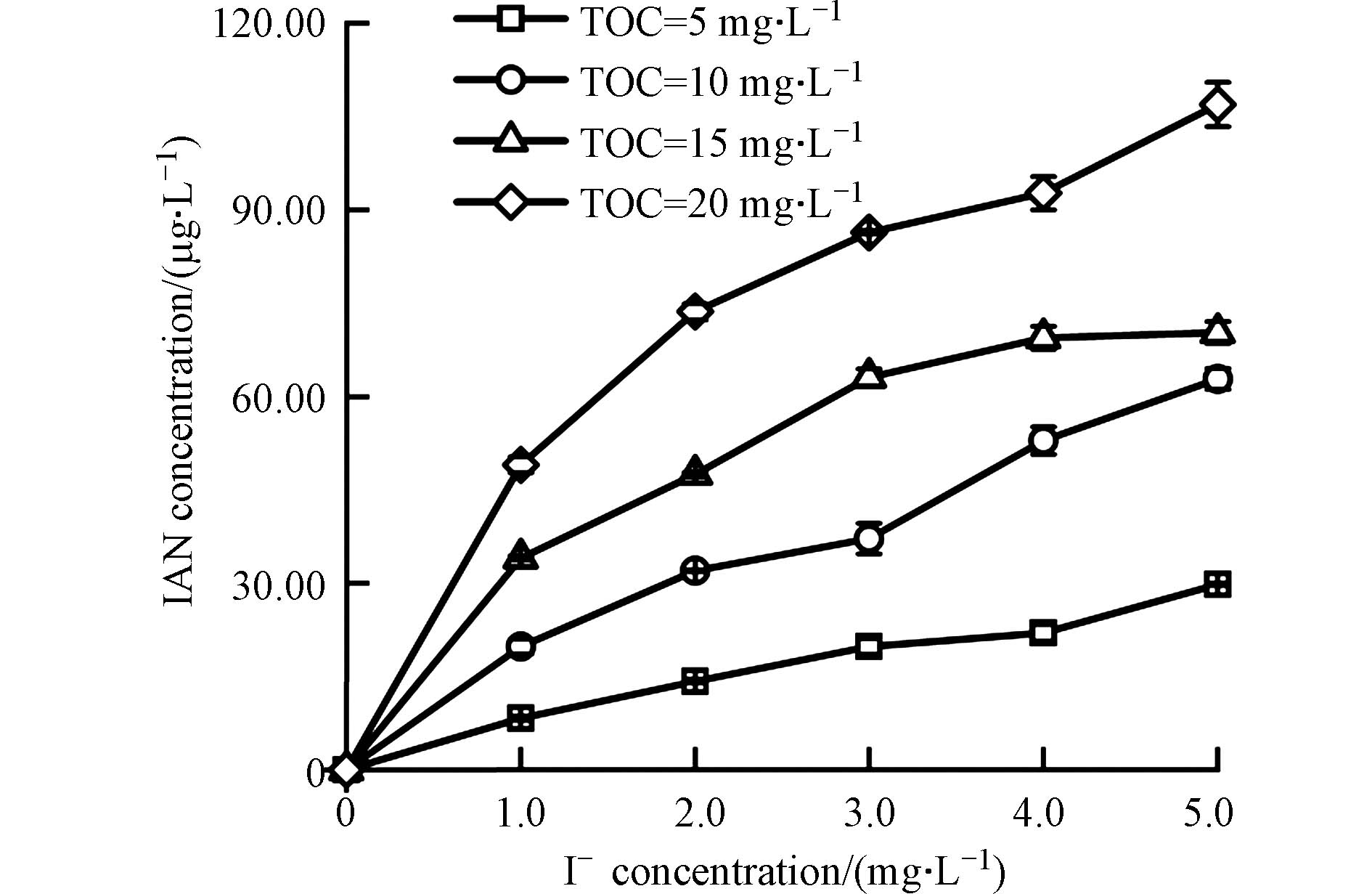
图4是在不同的TOC与碘离子浓度下,鱼油模拟水样经氯胺消毒后IAN的生成情况. 从图4中可以看出,在未投加碘离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到IAN的生成,而当碘离子的浓度增加到0.1 mg·L−1时,4种不同TOC浓度下的模拟水样均检测到了IAN的生成,且IAN的生成量会随着水样TOC浓度的增加而出现明显的增长. 在TOC一定时,随着碘离子投加量从0 mg·L−1增加到0.5 mg·L−1,IAN的生成量逐渐增加. 当TOC为20 mg·L−1,碘离子浓度为0.5 mg·L−1时,IAN的生成量达到最大值,为106.95 μg·L−1,远高于在5 mg·L−1溴离子情况下BAN的生成量. 这可能是因为碘相比于溴,具有更强的与有机前体物发生亲核取代的能力,而Liu等[33]也发现,在消毒过程中,卤素的消耗遵循碘>溴>氯的顺序. 此外,对比Wei等[24]研究可以发现,氯胺消毒下,IAN的生成规律与I-THMs的生成规律一致,生成量都是随着碘离子浓度的增加而增加.
-
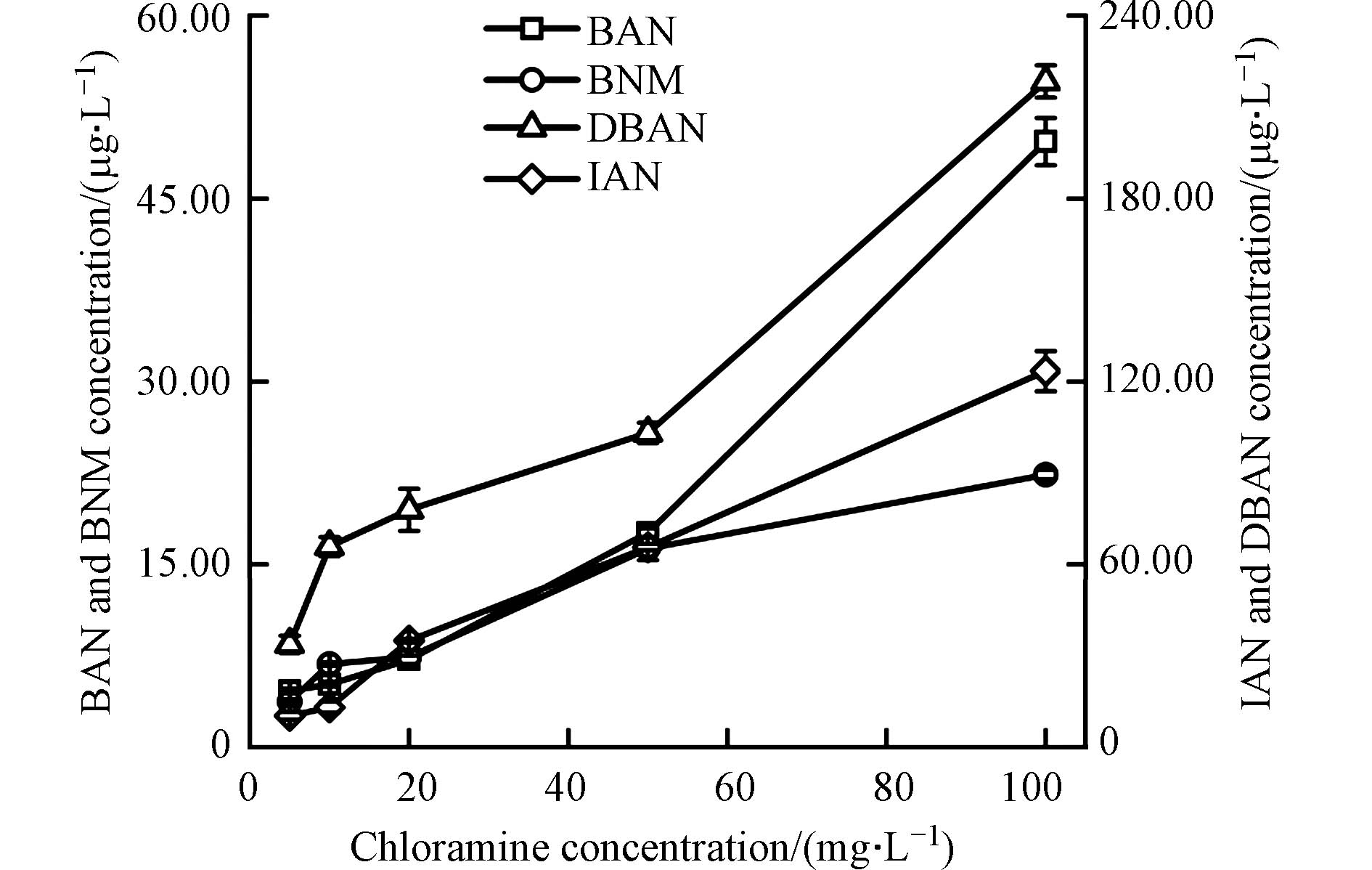
图5是在不同的氯胺投加量下,鱼油模拟水样经氯胺消毒后BAN、DBAN、BNM与IAN的生成情况. 从图5可以看出,当氯胺的投加量为5 mg·L−1时,BAN、DBAN、BNM、IAN的生成量分别为4.62、33.75、3.75、10.29 μg·L−1;而当氯胺的投加量增加到100 mg·L−1时,4种N-DBPs的生成量均达到最大值,分别为49.69、218.40、22.34、123.44 μg·L−1. BAN、DBAN、BNM、IAN的生成量均随着氯胺投加量的增加而增大. 这可能是因为增加氯胺的投加量,能够加速氧化溴离子产生更多的次溴酸,促进次溴酸与胺或氯胺反应,产生更多的溴胺和溴氯胺,从而促进了溴胺、溴氯胺与有机前体物反应,形成更多的溴代N-DBPs. 另一方面,氯胺浓度增加能够加速氧化碘离子成为次碘酸,次碘酸的亲核取代能力远远超过了次氯酸[33],它与有机前体物反应产生使得碘代N-DBPs的生成量快速增加.
-
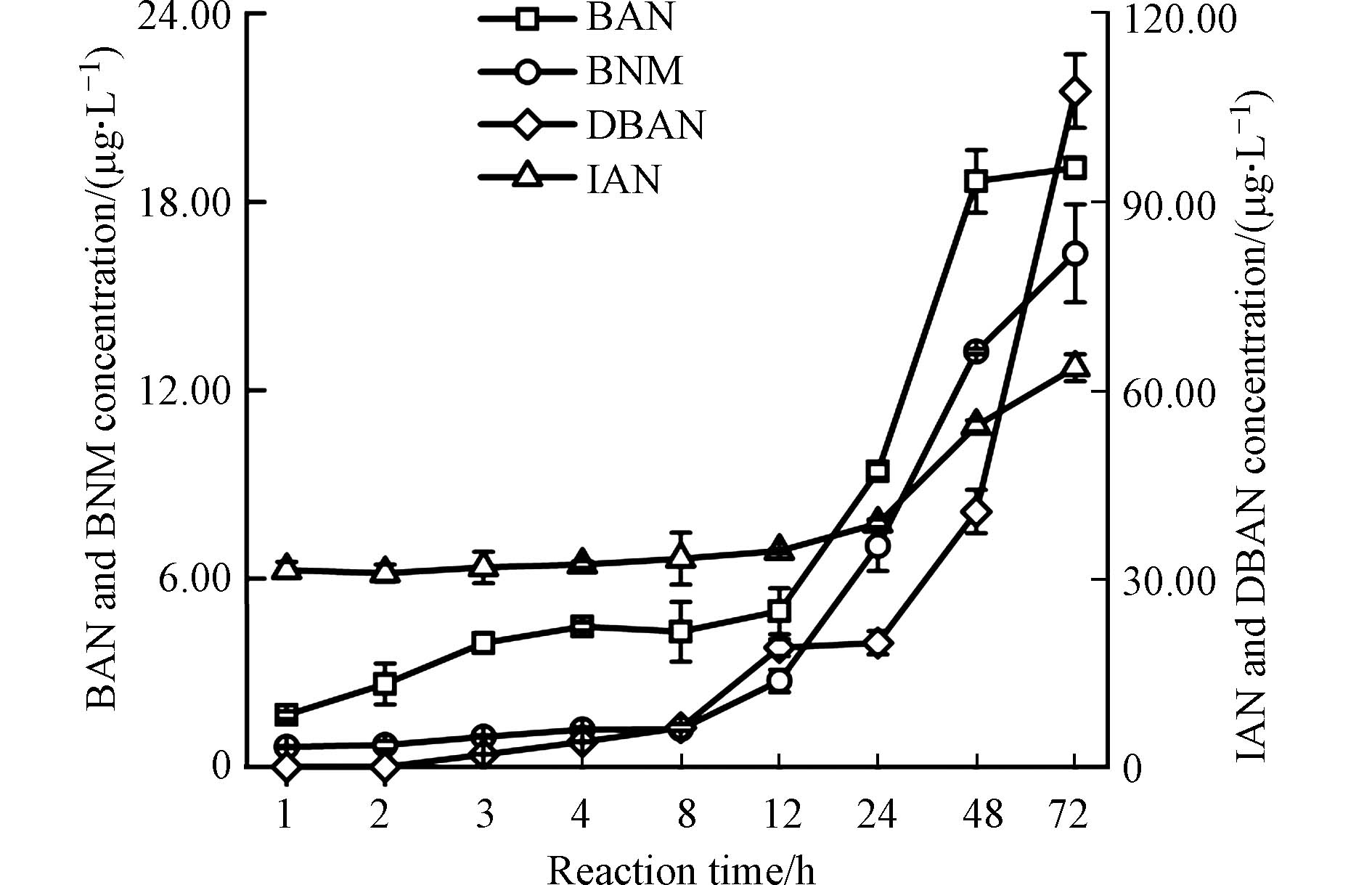
图6展示了氯胺消毒时间对BAN、DBAN、BNM和IAN生成的影响. 从图6中可以看出,在反应的前12 h,BAN与BNM的生成量缓慢增加,从12 h时开始,BAN与BNM的生成量出现明显的增加,到反应的72 h,BAN与BNM的生成量均达到最大值,分别为19.09 μg·L−1与16.36 μg·L−1. DBAN在反应的前2 h未检测到,之后随着反应时间的延长而缓慢增加,反应24 h后DBAN的生成量开始快速增加,到反应的72 h达到最大生成量,为107.62 μg·L−1. 在反应的前24 h,IAN生成量基本保持在35 μg·L−1,从24 h时开始,IAN的生成量出现明显的增加,到反应的72 h,IAN的生成量达到最大值,为63.60 μg·L−1. 4种N-DBPs的生成量均随着消毒时间的延长而增加. 这是由于氯胺相对于氯,是更加稳定的化合物,氯胺在水中的分解较为缓慢,使得其与有机前体物反应的活性低于氯,难以在较短的时间氧化有机物进而产生DBPs. 此外,消毒72 h时,水样中溴代和碘代N-DBPs的生产量仍旧有增加的趋势,但是由于饮用水经水厂消毒后,通过供水系统到达用户,经过的时间一般在72 h以内,因此将消毒时间控制在72 h.
-
pH不仅可以影响一氯胺在水中的形态及其水解速率,还会干扰N-DBPs的稳定性. 一般来说,在酸性条件下,氯胺更易水解释放游离氯,在碱性条件下,卤乙腈类物质容易发生水解. 此外,当有机前体物不同时,氯胺消毒后N-DBPs的生成也会随着pH的变化有着不同的规律. Yang[34]与Nihemaiti[35]等发现,酪氨酸作为前体物时,当水样的pH从5增加至9,DCAN生成量一直减少,而天冬酰胺作为前体物时,DCAN随pH增加一直增加,甲基吡咯与间二苯酚做前体物时,DCAN先增加后减少. 因此,本研究考察了鱼油在不同的初始pH情况下,经氯胺消毒后,溴代和碘代N-DBPs的生成情况.
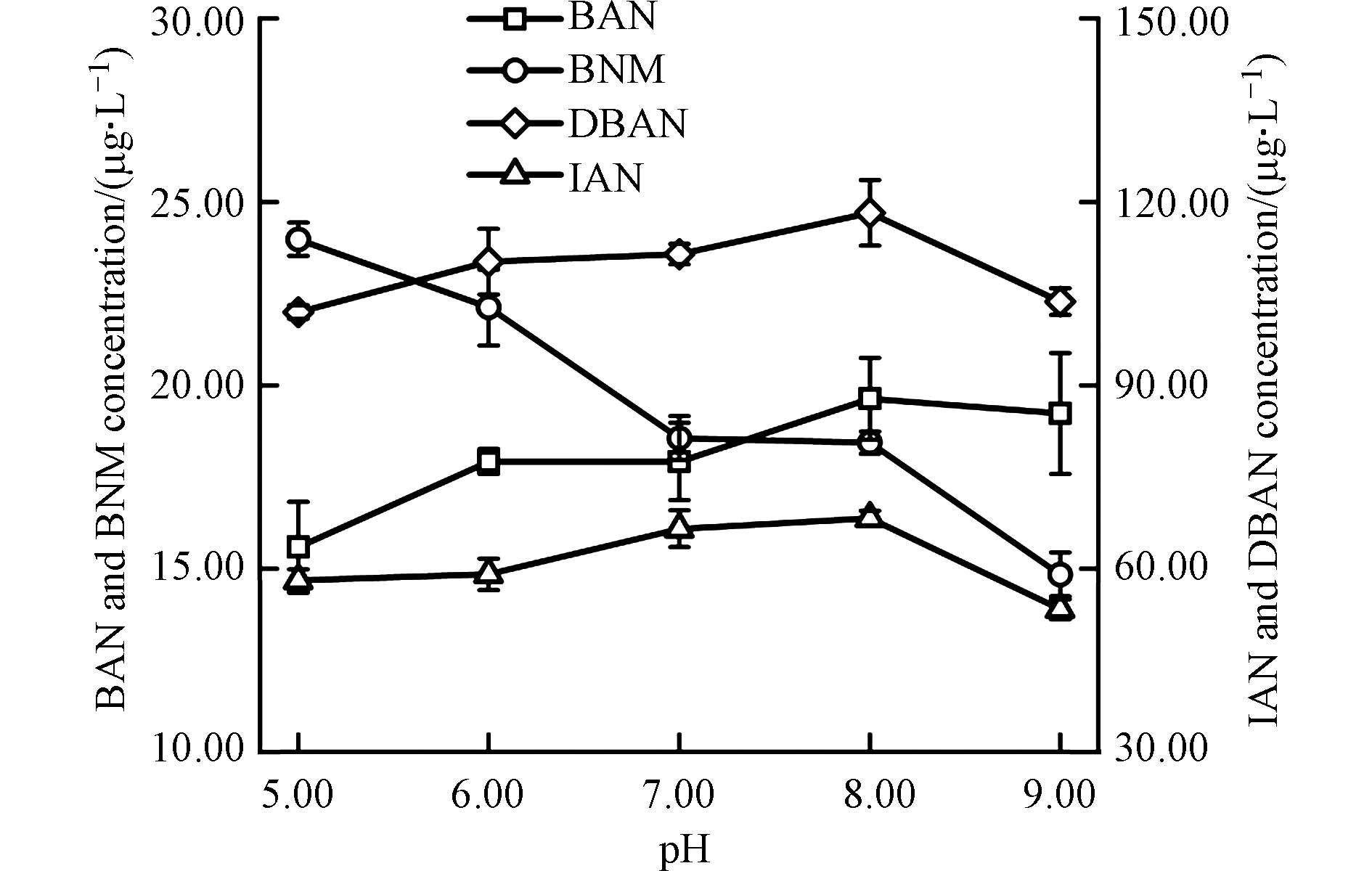
图7是在不同的初始pH下,鱼油模拟水样经氯胺消毒后BAN、DBAN、BNM、IAN的生成情况. 从图7中可以看出,3种卤乙腈类N-DBPs包括BAN、DBAN与IAN的生成量均随着pH的增加先增加再减少,当pH= 8时,BAN、DBAN与IAN的生成量均最大,分别为19.64 μg·L−1、118.21 μg·L−1与68.24 μg·L−1,当pH继续增大至9时,由于在碱性环境中卤乙腈类物质更容易发生水解,因而形成的卤乙腈类物质减少. 而HNMs的生成规律与HANs不同,随着pH的增加,BNM的生成量缓慢减少,当pH= 5时,BNM的生成量最大,为23.98 μg·L−1. 这可能是由于酸性条件下,氯胺更易水解释放游离氯,与溴离子结合形成更多的次溴酸,促进了与有机前体物反应,生成更多的BNM.
-
本研究选择鱼油作为模型化合物来模拟原水中广泛存在的天然有机物和生物源有机物的脂肪类组成成分,采用氯胺作为消毒剂,分别考察无机前体物(溴、碘离子)浓度、氯胺投加量、消毒时间、初始pH等因素对溴代和碘代N-DBPs生成的影响,得出了以下结论:
鱼油经氯胺消毒后,生成的溴代和碘代N-DBPs主要包括BAN、DBAN、BNM和IAN. 其中,BAN、DBAN与BNM的生成量随溴离子和TOC浓度的增加而增加,IAN的生成量则随碘离子浓度和TOC的增加而增加.
增加氯胺的投加量可使N-DBPs的生成量快速增加;当氯胺的投加量从5 mg·L−1增加到100 mg·L−1时,BAN、DBAN、BNM与IAN的生成量分别从4.62 μg·L−1、33.75 μg·L−1、3.75 μg·L−1和10.29 μg·L−1增加到49.69 μg·L−1、218.40 μg·L−1、22.34 μg·L−1和123.44 μg·L−1.
消毒时间与4种NDBPs的生成量高度正相关, 在氯胺消毒72 h后,4种N-DBPs的生成量均达到最大值.
pH能够影响一氯胺的形态、水解速率与N-DBPs的稳定性,进而影响溴代和碘代N-DBPs的生成. 3种卤乙腈类N-DBPs(BAN、DBAN与IAN)的生成量均随初始pH的增加呈现出先增加后减少的趋势,而BNM的生成量则随初始pH的增加而不断减少.
N-DBPs作为一类新兴的消毒副产物,由于具有较高的细胞毒性和遗传毒性,已成为当前消毒副产物领域研究的热点,未来关于N-DBPs的研究将从以下几个方面展开:一、目前关于N-DBPs的研究多集中在HNMs、HANs、HAcAms、NAs这几类物质,而其他的含氮消毒副产物,特别是一些极性较强的溴代和碘代N-DBPs,尚未被识别和检测出;二、氯代、溴代和碘代含氮消毒副产物间的相互转换路径及溴代和碘代含氮消毒副产物的生成机理仍未得到确定;三、溴代和碘代含氮消毒副产物的生成对水体整体生物毒性变化的影响仍有待毒理学研究进行确定.
鱼油氯胺消毒过程中溴代和碘代含氮消毒副产物的生成
The formation of brominated and iodinated nitrogenous disinfection by-products during the chloramination of fish oil
-
摘要: 本研究采用鱼油作为模拟化合物,模拟微污染原水中广泛存在的生物源有机物的脂肪类组成成分,考察氯胺消毒过程中溴代和碘代含氮消毒副产物(nitrogenous disinfection by-products,N-DBPs)的生成情况. 结果表明,鱼油经氯胺消毒后,生成的溴代和碘代N-DBPs主要包括一溴乙腈(bromoacetonitrile,BAN)、二溴乙腈(dibromoacetonitrile,DBAN)、一溴硝基甲烷(bromonitromethane,BNM)、一碘乙腈(iodoacetonitrile,IAN). 其中,在本研究考察范围内,BAN、DBAN与BNM的生成量会随溴离子和总有机碳(Total Organic Carbon,TOC)浓度的增加而增加;当溴离子浓度为5 mg·L−1,TOC为20 mg·L−1时,BAN、DBAN与BNM的最大生成量分别为71.15、192.36、27.52 μg·L−1. IAN的生成量则随碘离子和TOC浓度的增加而增加;当碘离子浓度为0.5 mg·L−1,TOC为20 mg·L−1时,IAN的最大生成量为106.95 μg·L−1. 当氯胺的投加量从5 mg·L−1增加到100 mg·L−1时,BAN、DBAN、BNM与IAN的生成量分别从4.62、33.75、3.75、10.29 μg·L−1增加到49.69、218.40、22.34、123.44 μg·L−1. 4种N-DBPs的生成量均随消毒时间的延长而增加,在消毒72 h后,4种N-DBPs的生成量均达到最大值. 3种卤乙腈类N-DBPs(BAN、DBAN与IAN)的生成量均随初始pH的增加呈现出先增加后减少的趋势,而BNM的生成量则随初始pH的增加而不断减少.Abstract: In this study, fish oil was adopted as the surrogate model compound to simulate the lipid composition of biologically derived organic matter which widely presented in micro-polluted raw water. The formation of brominated and iodinated nitrogenous disinfection by-products (N-DBPs) during the chloramination of fish oil were also investigated. The results showed that four brominated and iodinated N-DBPs including bromoacetonitrile (BAN), dibromoacetonitrile(DBAN), bromonitromethane (BNM) and iodoacetonitrile (IAN) were generated from the chloramination of fish oil. The concentration of BAN, DBAN, and BNM were gradually increased with the increasing bromide ion concentration from 0 to 5 mg·L−1. Specifically, the maximum formation yield of BAN, DBAN and BNM was 71.15 μg·L−1, 192.36 μg·L−1 and 27.52 μg·L−1, respectively, with the bromide ion concentration of 5 mg·L−1 and the total organic carbon (TOC) concentration of 20 mg·L−1. Similarly, the concentration of IAN was gradually increased with the increasing iodide ion concentration from 0 to 0.5 mg·L−1. The maximum yield of IAN was 106.95 μg·L−1 with the iodide ion concentration of 0.5 μg·L−1 and the TOC concentration of 20 mg·L−1. In addition, the concentrations of BAN, DBAN, BNM and IAN were increased from 4.62 , 33.75, 3.75, 10.28 μg·L−1 to 49.69, 218.40, 22.34, 123.44 μg·L−1 when the chloramine dose increased from 5 mg·L−1 to 100 mg·L−1. The yields of four N-DBPs were highly positively correlated with the disinfection time which reached the maximum yield after 72 h disinfection. The formation of BAN, DBAN and IAN were firstly increased and then decreased with the increase of inital pH, while the formation of BNM was decreased constantly with the increase of inital pH.
-
Key words:
- nitrogenous disinfection by-products /
- chloramination /
- iodide ion /
- bromide ion /
- fish oil.
-
自20世纪以来,抗生素对医药的发展具有重要的贡献,极大地保护了人类和动植物免受细菌性疾病的危害[1]. 由于抗生素在临床和养殖业上的滥用,加剧了细菌抗生素抗性(耐药性)的进化和传播[2]. 抗生素抗性基因(antibiotic resistance genes, ARGs)作为编码细菌抗生素耐药性的功能基因,于2006年被定义为一种新型“污染物”[3]. 致病菌可以通过水平基因转移(horizontal gene transfer, HGT)获得外源性抗生素抗性基因,并通过食物链或环境接触等途径进入人体,使抗生素药效明显降低,对人类健康造成极大威胁[4].
自然环境中的一些微生物可以生物合成抗生素,抑制其它微生物生长并获得更多的营养物质,这些微生物必然携带抗生素抗性基因以免受抗生素的影响[5]. 此外,与外排泵耐药机理相关的蛋白也参与信号分子的运输或中间代谢产物的排放等过程[6]. 在深海、高原等几乎没有人类活动干扰的地区能检测到抗生素抗性基因[7-9]. 然而,在人类活动影响严重的水、土壤、大气等环境介质中均检测到多样性和丰度更高的抗生素抗性基因[10-13]. 上述研究表明,抗生素耐药性是一种自然现象,但人类活动,特别是抗生素的生产和使用,加速了抗生素抗性基因在环境中的传播和富集.
大陆边缘海是陆源污染物向远洋传输的重要过渡区域. 渤海是处于半封闭状态的内海,水体更新周期较长,易于富集陆源污染物,是中国污染最严重的海域之一[14- 15]. 黄海和南海海域也受到不同程度的人类活动影响[16-19]. 目前,对中国边缘海中抗生素抗性基因和致病菌的研究较少,且缺乏边缘海沉积物中抗生素抗性基因和致病菌的完整图谱信息. 因此,研究我国边缘海中抗生素抗性基因和致病菌的多样性和丰度,不仅有助于认识海洋环境中的抗生素抗性基因的特征,而且对进一步评价陆源污染对边缘海的影响有着重要的意义. 本研究旨在使用宏基因组学方法分析我国边缘海沉积物中抗生素抗性基因的组成、丰度及其潜在致病菌群落,探讨抗生素抗性基因和致病菌的组成特征和污染现状.
1. 材料与方法(Materials and methods)
1.1 样品采集
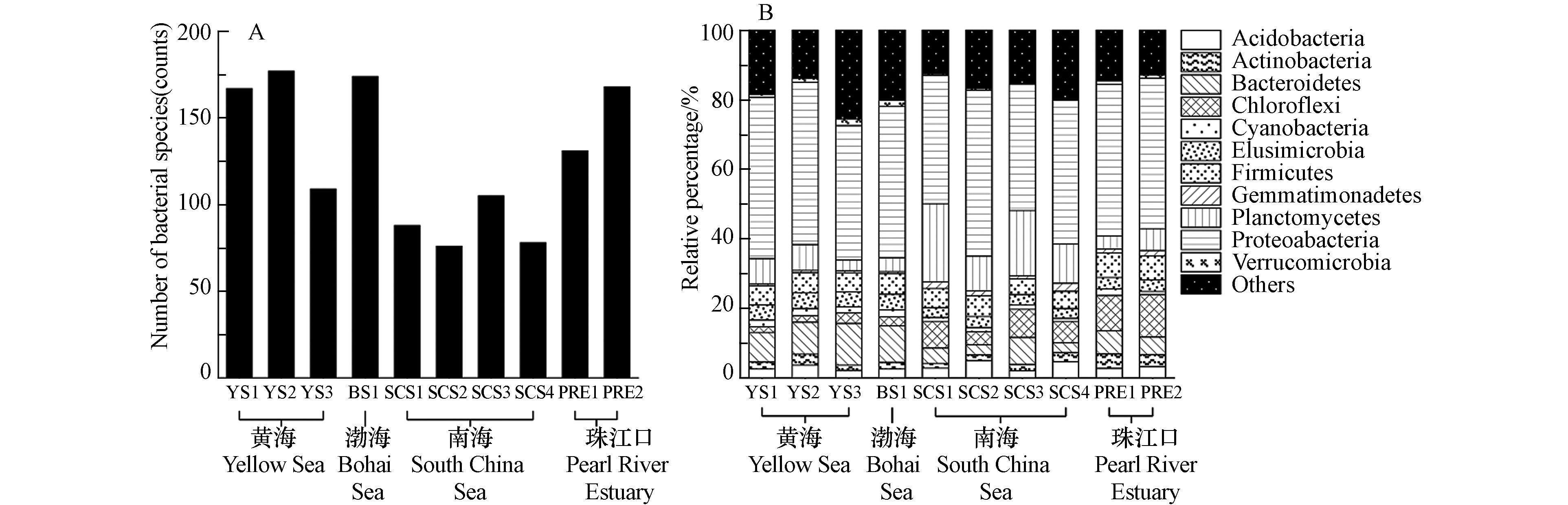
本研究的两个珠江口沉积物样品是于2011年6月在狮子洋通道水域(PRE1)与珠江口中部(PRE2)采集,代表人类活动干扰严重的河口区域. 4个南海沉积物样品(SCS1至SCS4)来源于2011年8月的南海北部航次. 2016年7月采集了3个黄海沉积物样品(YS1至YS3)以及靠近渤海海峡处的1个渤海沉积物样品(BS1). 所有沉积物样品均使用表层沉积物采样器采集,在采集后都储存在无菌的密封聚乙烯塑料袋中并在4 ℃冰箱保存,运送至实验室后立即进行DNA的提取.
1.2 沉积物DNA提取和高通量测序
使用FastDNA Spin Kit for Soil(MP Biomedical,Santa Ana,CA)试剂盒提取沉积物中的DNA,提取方法见试剂盒使用手册[20]. 由于海洋沉积物中的DNA丰度低,为减少批次效应或样品异质性产生的误差,对每个沉积物样品进行多次DNA提取后合并. 使用Thermo Scientific NanoDrop 2000分光光度计测定DNA的纯度和浓度. 每个样品约5 μg的DNA被超声剪切后使用T4 DNA聚合酶与Klenow酶进行末端修复,随后使用T4多核苷酸激酶进行修复末端的磷酸化. 使用T4 DNA连接酶将接头与DNA片段连接,并通过凝胶电泳得到长度合适的DNA目标片段,随后使用PCR扩增目标片段,以此构建样品的DNA文库. DNA在安诺优达基因科技有限公司(浙江,中国)使用Illumina HiSeq 2500平台完成测序. 所有样品总宏基因组数据约60 Gb,每个样本的测序数据约为2—6 Gb不等. 对所有原始测序数据进行数据过滤,去除低质量碱基序列(含有测序质量值低于20的碱基或者包含不明确碱基的序列).
1.3 生物信息学分析
使用BLAST(Linux版本2.2.29)程序将测序数据与相关的数据库进行数据比对[21]. 使用BLASTN将宏基因组测序数据与SILVA数据库(SILVA_132_SSURef_Nr99)进行比对,识别样品中的16S rRNA基因,E-value阈值为10-20[22]. 随后,使用MEGAN(MEGAN community 6.21.16)最低共同祖先(Lowest Common Ancestor)算法来注释沉积物中的细菌群落,其中BLAST的绝对截止值为50[23].
从NCBI RefSeq数据库(NCBI Reference Sequence Database)下载质粒序列并建立质粒数据库,从INTEGRALL数据库中挑选整合酶及基因盒序列建立整合子数据库. 将样品DNA序列与质粒和整合子数据库进行了比对,识别这两种可移动遗传元件(Mobile genetic elements, MGEs)相关的基因序列. 识别质粒序列的阈值是比对长度大于90%且相似度大于95%[24];识别整合子序列的阈值是比对长度大于70%且相似度大于90%[25].
DeepARG数据库(deepARG-DB,v1.0.2)是将CARD(The Comprehensive Antibiotic Resistance Database)、ARDB(Antibiotic Resistance Genes Database)以及UNIPROT(Universal Protein)合并后去除重复序列得到的抗生素抗性基因数据库[26]. 使用BLASTX将样品测序数据与deepARG数据库进行比对,抗生素抗性基因序列的识别阈值是序列相似度大于90%且比对长度大于75%的测序读长. 此外,从测序宏基因组数据中提取抗生素抗性基因序列,再与质粒数据库比对,识别质粒携带的抗生素抗性基因[27]. 通过PHI-base和VFDB提供的致病菌分类和NCBI参考序列,从SILVA数据库中提取致病菌16S rRNA基因序列,建立非冗余的致病菌16S rRNA基因数据库. 使用BLASTN算法将样品测序数据与致病菌16S rRNA基因数据库进行比对,识别致病菌16S rRNA序列的E-value阈值为10-20,比对结果也使用MEGAN进行物种注释.
1.4 统计分析
使用RStudio(版本4.1.3)中的vegan软件包(版本2.6-2)进行Pearson相关性分析与ANOSIM检验,置换检验次数为999次,P < 0.05被认为具有统计学意义. 使用OriginPro 2021(版本9.8.0.200)绘制直方图、韦恩图与主成分分析图.
2. 结果与讨论(Results and discussion)
2.1 细菌群落组成和结构
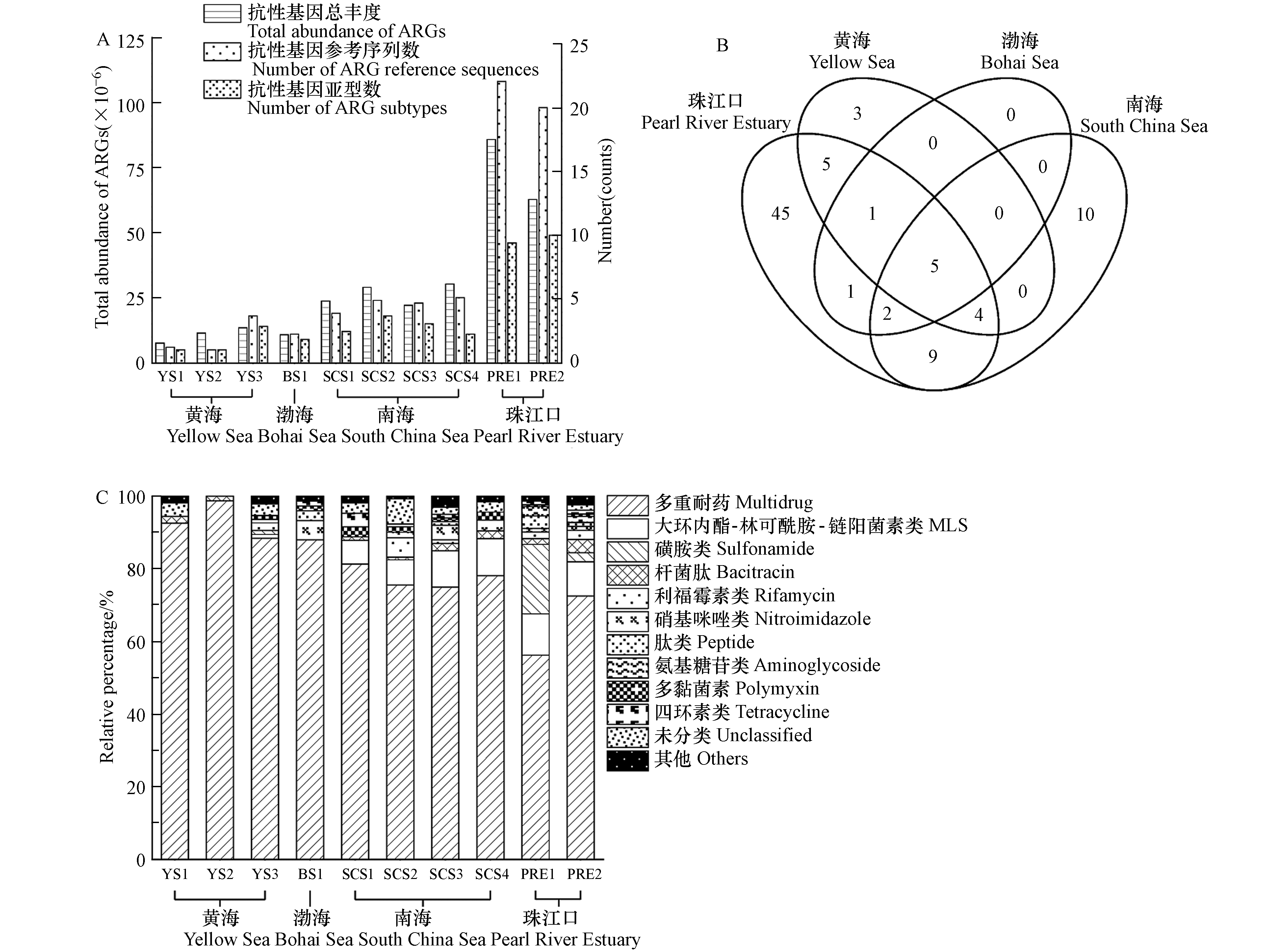
通过数据比对和MEGAN注释中国边缘海沉积物样品中的16S rRNA基因,并输出在门、种水平上的细菌分类结果,如图1所示. 图1A是各采样点种水平上的细菌多样性,所有中国边缘海沉积物中共发现542种细菌,各样品的检出率从12.7%(SCS2和SCS4,69种)到28.4%(YS2,154种)不等. 南海的细菌物种多样性显著低于其他边缘海,可能由于南海沉积物的采样深度大,深海极端环境中细菌多样性较低. 在我国边缘海沉积物中占比最高的是变形菌门(Proteobacteria, 42.5%),随后是浮霉菌门(Planctomycetes, 8.0%),拟杆菌门(Bacteroidetes,7.8%),厚壁菌门(Firmicutes,5.8%),绿弯菌门(Chloroflexi,5.2%),如图1B所示.
有研究报道,渤海沉积物中变形菌门、拟杆菌门、放线菌门(Actinobacteria)和浮霉菌门是渤海海域的优势菌门[28]. 也有研究发现,变形菌门与浮霉菌门在渤海、黄海和南海的沉积物中相对丰度都是最高的[29]. 这些研究与本研究的分析结果一致,说明变形菌门和浮霉菌门是中国边缘海沉积物中的优势菌门. 在沉积物细菌群落的相对组成上,黄渤海的拟杆菌门占比显著高于其他海域,南海的浮霉菌门占比显著高于其他海域. 绿弯菌门是一类通过光合作用产能的细菌,该菌门在珠江口沉积物的占比明显高于边缘海沉积物.
2.2 抗生素抗性基因的丰度和多样性
各海域沉积物中的抗生素抗性基因总丰度以及比对上的抗性基因参考序列数和亚型数如图2A所示. 南海沉积物中抗生素抗性基因总丰度约是黄渤海的2倍. 与珠江口相比,边缘海沉积物中的抗生素抗性基因总丰度较低. 沉积物中抗生素抗性基因亚型与序列多样性在各区域的分布趋势与其总丰度相似. 其中,5个抗生素抗性基因亚型在渤海、黄海和南海沉积物中均被检出,包括多黏菌素(arnA)、多重耐药(mexF, rpoB2, smeR)、硝基咪唑(msbA)抗性基因(图2B). 同时,上述5个抗生素抗性基因亚型在珠江口沉积物中也均有检出.
各个区域沉积物中的抗生素抗性基因按照抗性类型分类,相对百分比如图2C所示. 在我国边缘海沉积物中多重耐药基因的丰度最高,其平均相对占比为89.1%(南海:85.9%;黄海:93.6%;渤海:88.0%). 在人类活动干扰严重的珠江口水域,沉积物中多重耐药基因的相对丰度仅为64.4%,但对人类常用抗生素(如磺胺类、氨基糖苷类、β-内酰胺类、四环素类等)相关的抗性基因相对占比显著提高,与人类常用抗生素相关的抗性基因普遍具有单一耐药特性. 比较我国边缘海和珠江口,发现珠江口沉积物中表达单一抗性的抗性基因平均相对占比是边缘海沉积物的约3倍,平均总丰度比边缘海高约13倍.
在几乎不受到人类活动影响的海洋环境中,微生物抗生素抗性基因组有其自身特征,这些抗性基因除抗生素耐药性之外,还具有其他生物学功能. 例如,在我国边缘海沉积物中都检出的rpoB2基因所编码的蛋白能参与碳和氮循环,mexF和mexW两种多重耐药基因编码的蛋白可参与磷循环[30]. 相比自然环境,受到人类活动影响大的区域中对人类常用抗生素具有单一抗性的抗性基因丰度大,占比高,且出现了许多抗生素的新型抗性基因[31-32]. 这一差异可能是由于抗生素的使用污染周边环境,诱导产生新型抗生素抗性基因并加速抗性基因在微生物之间传播[33]. 区域性抗生素抗性基因的组成特征说明了人类活动和环境抗性基因污染之间的关系,其中一些抗生素抗性基因亚型可以作为基因标志物指示环境受人类影响的程度[34].
2.3 可移动基因元件丰度和质粒携带的抗生素抗性基因
在中国边缘海沉积物中可广泛检测到可移动遗传元件相关的基因,包括质粒和整合子基因. 如图3A所示,中国边缘海沉积物中整合子基因丰度在1.44 × 10−6—5.31 × 10−6之间,显著低于珠江口沉积物中整合子基因的平均丰度(1.75 × 10−5);中国边缘海沉积物中质粒基因丰度远高于整合子基因,其丰度范围是2.29 × 10−4—8.68 × 10−4,质粒基因丰度在中国边缘海和珠江口之间差异并不显著. 此外,中国边缘海沉积物中可能由质粒携带的抗生素抗性基因如图3B所示. 结果表明,各边缘海沉积物中检出的质粒携带的抗性基因极少,并且主要是多重耐药基因;珠江口沉积物中可能由质粒携带的抗生素抗性基因在所有抗性基因中的占比约是20%,主要与磺胺类、氨基糖苷类、大环内酯-林可酰胺-链阳菌素类(MLS)和四环素类等常用抗生素相关,其比例和丰度均显著高于边缘海(P < 0.01).
质粒、整合子等可移动遗传元件是功能基因在微生物之间水平转移的重要载体[35]. 在自然环境中(如西藏高原和南极)均可检测到与质粒、整合子相关的基因片段,结合中国边缘海沉积物的分析结果,说明可移动遗传元件在环境中是广泛存在的[9,36]. 但是,自然环境中的可移动遗传元件与抗生素抗性基因传播的关系不大,在中国边缘海沉积物中极少检出可能由质粒携带的抗生素抗性基因. 而珠江口沉积物中可能由质粒携带的抗生素抗性基因的多样性和丰度的显著提高,表明在污染环境中可移动遗传元件有助于抗生素抗性基因的传播,即抗生素抗性基因的高传播性是其在污染环境中的一个重要特征.
2.4 致病菌的多样性和相对组成
中国边缘海沉积物中人类致病菌的群落结构如图4所示. 图4A是各采样点沉积物中门水平上致病菌的相对组成,属于变形菌门的致病菌在中国边缘海沉积物中平均相对占比最高(60.5%),其次是厚壁菌门(27.5%)、放线菌门(7.6%)等. 图4B是各采样点沉积物种水平上致病菌的相对百分比. 在种水平上,肺炎链球菌(Streptococcus pneumoniae)是中国边缘海沉积物中相对丰度最高的致病菌种(24.4%),随后是肺炎克雷伯菌(Klebsiella pneumoniae, 19.9%)、无乳链球菌(Streptococcus agalactiae, 9.2%)、铜绿假单胞菌(Pseudomonas aeruginosa, 6.9%)和牙龈卟啉单胞菌(Porphyromonas gingivalis, 3.4%). 渤海的肺炎克雷伯菌、无乳链球菌、铜绿假单胞菌和牙龈卟啉单胞菌占比均高于其他区域. 中国边缘海沉积物中检出的相对占比超过1%的致病菌共有16种,其中有3种是生物安全等级为Ⅲ级的高风险致病菌,分别是贝氏柯克斯体(Coxiella burnetii)、土拉弗朗西斯菌(Francisella tularensis)以及结核分枝杆菌(Mycobacterium tuberculosis). 研究报道,海洋沉积物中有高丰度的肺炎链球菌、肺炎克雷伯菌和铜绿假单胞菌,亚穆纳河中也发现了大量肺炎链球菌和铜绿假单胞菌,这些研究与本文的分析结果一致[37-38].
使用16S rRNA基因总丰度对人类致病菌进行归一化处理,并对中国边缘海沉积物样品进行主成分分析,如图4C所示. 前两个主成分可以解释不同区域间人类致病菌总方差的65.7%. 根据人类致病菌的组成特征,沉积物样品可以聚为3类,即黄渤海、南海和珠江口. 与其它区域相比,4种致病菌(包括肺炎链球菌、肺炎克雷伯菌、无乳链球菌和铜绿假单胞菌)在黄渤海沉积物中的占比相对较高. 肺炎链球菌是引起败血症、脑膜炎、肺炎等侵袭性疾病的重要病原体,无论是在发达国家还是欠发达国家,其给幼儿以及老年人带来的疾病负担都是最高的[39]. 南海沉积物中的特征人类致病菌是沙眼衣原体(Chlamydia trachomatis)和土拉弗朗西斯菌. 土拉弗朗西斯菌作为生物安全等级为Ⅲ级的高风险人类致病菌,可以通过空气传播,具有高度传染性[40]. 珠江口沉积物中的特征人类致病菌则为副溶血性弧菌(Vibrio parahaemolyticus)和空肠弯曲杆菌(Campylobacter jejuni). 研究表明河口副溶血性弧菌丰度显著高于近海[41]. 空肠弯曲杆菌能引起食源性细菌感染,可以由水生动物通过食物链感染人类[42]. 空肠弯曲杆菌具有微需氧、适宜中等盐度、低温下难以存活的特性,这可能导致其在珠江口沉积物中含量比边缘海高[43]. 总的来说,各区域人类致病菌群落结构的差异可归因于人类活动、环境因子等多方面因素共同作用[44].
3. 结论(Conclusion)
中国边缘海沉积物中广泛检测到抗生素抗性基因,其中南海沉积物中的抗性基因丰度和多样性比黄渤海高,这些边缘海环境中抗生素抗性基因水平传播能力低. 与边缘海沉积物相比,珠江口沉积物中的抗生素抗性基因具有丰度、多样性以及传播能力高的特征,说明抗生素的使用能引起抗生素抗性基因的进化和传播. 不同区域沉积物中人类致病菌群落结构显著不同,边缘海沉积物中发现3种高风险致病菌,包括贝氏柯克斯体、土拉弗朗西斯菌等,将产生较高的潜在环境健康风险.
-
-
[1] ROOK J. Formation of haloform during chlorination of natural water [J]. Water Treatment and Examination, 1972, 21: 259. [2] HU J, SONG H, ADDISON J W, et al. Halonitromethane formation potentials in drinking waters [J]. Water Research, 2010, 44(1): 105-114. doi: 10.1016/j.watres.2009.09.006 [3] JEONG C H, POSTIGO C, RICHARDSON S D, et al. Occurrence and comparative toxicity of haloacetaldehyde disinfection byproducts in drinking water [J]. Environmental Science & Technology, 2015, 49(23): 13749-13759. [4] WAGNER E D, PLEWA M J. CHO cell cytotoxicity and genotoxicity analyses of disinfection by-products: An updated review [J]. Journal of Environmental Sciences, 2017, 58: 64-76. doi: 10.1016/j.jes.2017.04.021 [5] XIA Y, LIN Y L, XU B, et al. Iodinated trihalomethane formation during chloramination of iodate-containing waters in the presence of zero valent iron [J]. Water Research, 2017, 124: 219-226. doi: 10.1016/j.watres.2017.07.059 [6] ZHANG H F, YANG M. Characterization of brominated disinfection byproducts formed during chloramination of fulvic acid in the presence of bromide [J]. Science of the Total Environment, 2018, 627: 118-124. doi: 10.1016/j.scitotenv.2018.01.215 [7] LI X F, MITCH W A. Drinking water disinfection byproducts (DBPs) and human health effects: Multidisciplinary challenges and opportunities [J]. Environmental Science & Technology, 2018, 52(4): 1681-1689. [8] PLEWA M J, WAGNER E D, RICHARDSON S D, et al. Chemical and biological characterization of newly discovered iodoacid drinking water disinfection byproducts [J]. Environmental Science & Technology, 2004, 38(18): 4713-4722. [9] MUELLNER M G, WAGNER E D, McCALLA K, et al. Haloacetonitriles vs. regulated haloacetic acids: Are nitrogen-containing DBPs more toxic? [J]. Environmental Science & Technology, 2007, 41(2): 645-651. [10] WHITEHEAD D C. The distribution and transformations of iodine in the environment [J]. Environment International, 1984, 10(4): 321-339. doi: 10.1016/0160-4120(84)90139-9 [11] SIDDIQUI M S, AMY G L, RICE R G. Bromate ion formation: A critical review [J]. Journal - American Water Works Association, 1995, 87(10): 58-70. doi: 10.1002/j.1551-8833.1995.tb06435.x [12] MAGAZINOVIC R S, NICHOLSON B C, MULCAHY D E, et al. Bromide levels in natural waters: Its relationship to levels of both chloride and total dissolved solids and the implications for water treatment [J]. Chemosphere, 2004, 57(4): 329-335. doi: 10.1016/j.chemosphere.2004.04.056 [13] WANG N, ZHANG G, XIONG R X, et al. Synchronous moderate oxidation and adsorption on the surface of γ-MnO2 for efficient iodide removal from water [J]. Environmental Science & Technology, 2022, 56(13): 9417-9427. [14] WANG Y, CUI Y S, CHEN C, et al. Stopping the supply of iodized salt alone is not enough to make iodine nutrition suitable for children in higher water iodine areas: A cross-sectional study in Northern China [J]. Ecotoxicology and Environmental Safety, 2020, 188: 109930. doi: 10.1016/j.ecoenv.2019.109930 [15] ZHA X S, LIU Y, LIU X, et al. Effects of bromide and iodide ions on the formation of disinfection by-products during ozonation and subsequent chlorination of water containing biological source matters [J]. Environmental Science and Pollution Research, 2014, 21(4): 2714-2723. doi: 10.1007/s11356-013-2176-x [16] ZHANG Y, ZHANG N, ZHAO P, et al. Characteristics of molecular weight distribution of dissolved organic matter in bromide-containing water and disinfection by-product formation properties during treatment processes [J]. Journal of Environmental Sciences, 2018, 65: 179-189. doi: 10.1016/j.jes.2017.03.013 [17] KRISTIANA I, LIEW D, HENDERSON R K, et al. Formation and control of nitrogenous DBPs from Western Australian source waters: Investigating the impacts of high nitrogen and bromide concentrations [J]. Journal of Environmental Sciences, 2017, 58: 102-115. doi: 10.1016/j.jes.2017.06.028 [18] 高乃云, 赵璐, 楚文海. 饮用水中典型含氮消毒副产物卤乙腈的质量浓度分布 [J]. 同济大学学报(自然科学版), 2012, 40(2): 251-255. doi: 10.3969/j.issn.0253-374x.2012.02.016 GAO N Y, ZHAO L, CHU W H. Concentration distribution of typical nitrogenous disinfection by-products HANs in drinking water [J]. Journal of Tongji University (Natural Science), 2012, 40(2): 251-255(in Chinese). doi: 10.3969/j.issn.0253-374x.2012.02.016
[19] ZHAI H Y, CHENG S Z, ZHANG L Y, et al. Formation characteristics of disinfection byproducts from four different algal organic matter during chlorination and chloramination[J]. Chemosphere, 2022, 308(Pt 1): 136171. [20] 付顺, 孙越. 碘代消毒副产物在净水工艺中的生成机制与控制措施 [J]. 环境化学, 2016, 35(6): 1153-1163. doi: 10.7524/j.issn.0254-6108.2016.06.2015111203 FU S, SUN Y. Formation mechanism and control measures of iodinated disinfection by-products in drinking water process [J]. Environmental Chemistry, 2016, 35(6): 1153-1163(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.06.2015111203
[21] LI X, RAO N R H, LINGE K L, et al. Formation of algal-derived nitrogenous disinfection by-products during chlorination and chloramination [J]. Water Research, 2020, 183: 116047. doi: 10.1016/j.watres.2020.116047 [22] WANG X X, LIU B M, LU M F, et al. Characterization of algal organic matter as precursors for carbonaceous and nitrogenous disinfection byproducts formation: Comparison with natural organic matter [J]. Journal of Environmental Management, 2021, 282: 111951. doi: 10.1016/j.jenvman.2021.111951 [23] HONG H C, MAZUMDER A, WONG M H, et al. Yield of trihalomethanes and haloacetic acids upon chlorinating algal cells, and its prediction via algal cellular biochemical composition [J]. Water Research, 2008, 42(20): 4941-4948. doi: 10.1016/j.watres.2008.09.019 [24] WEI Y Y, LIU Y, MA L M, et al. Speciation and formation of iodinated trihalomethane from microbially derived organic matter during the biological treatment of micro-polluted source water [J]. Chemosphere, 2013, 92(11): 1529-1535. doi: 10.1016/j.chemosphere.2013.04.019 [25] YANG Y, KOMAKI Y, KIMURA S Y, et al. Toxic impact of bromide and iodide on drinking water disinfected with chlorine or chloramines [J]. Environmental Science & Technology, 2014, 48(20): 12362-12369. [26] YE Z, LIU W J, SUN W J, et al. Role of ammonia on haloacetonitriles and halonitromethanes formation during Ultraviolet irradiation followed by chlorination/chloramination [J]. Chemical Engineering Journal, 2018, 337: 275-281. doi: 10.1016/j.cej.2017.12.073 [27] CARTER R A A, LIEW D S, WEST N, et al. Simultaneous analysis of haloacetonitriles, haloacetamides and halonitromethanes in chlorinated waters by gas chromatography-mass spectrometry [J]. Chemosphere, 2019, 220: 314-323. doi: 10.1016/j.chemosphere.2018.12.069 [28] 顾允轩, 仇付国, 刘子奇, 等. 水中溴代消毒副产物的生成综述 [J]. 环境化学, 2022, 41(6): 1934-1946. doi: 10.7524/j.issn.0254-6108.2021021801 GU Y X, QIU F G, LIU Z Q, et al. Brominated disinfection by-products formation in water: A review [J]. Environmental Chemistry, 2022, 41(6): 1934-1946(in Chinese). doi: 10.7524/j.issn.0254-6108.2021021801
[29] ALLARD S, HU W, le MENN J B, et al. Method development for quantification of bromochloramine using membrane introduction mass spectrometry [J]. Environmental Science & Technology, 2018, 52(14): 7805-7812. [30] ALLARD S, CADEE K, TUNG R, et al. Impact of brominated amines on monochloramine stability during in-line and pre-formed chloramination assessed by kinetic modelling [J]. Science of the Total Environment, 2018, 618: 1431-1439. doi: 10.1016/j.scitotenv.2017.09.281 [31] BOND T, TEMPLETON M R, GRAHAM N. Precursors of nitrogenous disinfection by-products in drinking water: A critical review and analysis [J]. Journal of Hazardous Materials, 2012, 235/236: 1-16. doi: 10.1016/j.jhazmat.2012.07.017 [32] HONG H C, QIAN L Y, XIAO Z Q, et al. Effect of nitrite on the formation of halonitromethanes during chlorination of organic matter from different origin [J]. Journal of Hydrology, 2015, 531: 802-809. doi: 10.1016/j.jhydrol.2015.10.046 [33] LIU Y S, LIU K Q, PLEWA M J, et al. Formation of regulated and unregulated disinfection byproducts during chlorination and chloramination: Roles of dissolved organic matter type, bromide, and iodide [J]. Journal of Environmental Sciences, 2022, 117: 151-160. doi: 10.1016/j.jes.2022.04.014 [34] YANG X, SHEN Q Q, GUO W H, et al. Precursors and nitrogen origins of trichloronitromethane and dichloroacetonitrile during chlorination/chloramination [J]. Chemosphere, 2012, 88(1): 25-32. doi: 10.1016/j.chemosphere.2012.02.035 [35] NIHEMAITI M, le ROUX J, HOPPE-JONES C, et al. Formation of haloacetonitriles, haloacetamides, and nitrogenous heterocyclic byproducts by chloramination of phenolic compounds [J]. Environmental Science & Technology, 2017, 51(1): 655-663. -




 下载:
下载: