-
赤泥是氧化铝生产工业产生的一种固体废弃物,据统计每生产1 t氧化铝,就产生0.8~1.5 t赤泥。世界范围内的赤泥堆存量大约为5.0×109 t,并仍以每年1.2×108 t的增长速率在不断增长[1]。中国作为氧化铝生产大国,目前赤泥堆存量达6×108 t以上[2],且以每年7×107 t的速率增长[3]。赤泥强碱性、高盐分、细粒度,使其资源化综合利用面临诸多难题[4]。同时,赤泥大量堆存所造成的环境安全问题不仅严重制约着氧化铝工业的高质量发展,也给区域生态保护带来严峻挑战。
赤泥壤质化改良既可改善赤泥的理化性质,又能恢复其生态系统。因此,在赤泥规模化安全处置方面引起了国内外的广泛关注[5-6]。近年来,围绕赤泥壤质化改良,国内外学者分别以石膏、沸石等无机矿物材料,有机肥、活性污泥等有机质材料以及嗜碱微生物等生物材料为改良剂,开展了系统研究并取得了显著成效[7-10]。其中,有机材料在促进赤泥壤质化改良、维持其生态可持续性方面的功能优于其他改良材料[3,8]。如DONG等[10]的研究表明,有机材料不仅在促进赤泥颗粒团聚方面的作用优于Ca2+作用,且随着培养时间的增加显著提升了微生物群落的代谢能力及其胞外酶活性,使其基质理化环境、生物学特征逐渐趋于赤泥堆场周围自然土壤。有研究表明,增施老化生物炭可提高赤泥对氮肥的持留能力,改善赤泥的肥力条件[11-13],但鉴于赤泥的堆存量巨大,该措施的经济可行性值得商榷。而相比之下,价格低廉的堆肥、干草等有机质,既可有效降低赤泥的盐碱性、改善物理性质,还可促进赤泥有机碳积累,提高赤泥的肥力水平,进而为维持赤泥堆场的生态可持续性奠定良好的基础[14-16]。因此,选取成本低廉、环保、易得的有机材料 (如农作物秸秆) 作为改良剂,用于赤泥堆场的植被重建和生态修复,被认为是一种经济可行的方法[6,14]。作物秸秆具有来源广泛、价格低廉和环保可再生等优点,是用于赤泥壤质化改良的理想材料。前期研究表明,与有机肥和活性污泥相比,作物秸秆在改善赤泥的生物地球化学特性和肥力条件方面效果更好[10]。但目前关于农作物秸秆促进赤泥壤质化改良的过程、生物驱动机制及其地球生物化学循环特征尚缺乏深入了解,故对生物质应用于赤泥壤质化改良工程尚存在异议[6]。
本研究以玉米秸秆为改良材料,通过分析不同培育时间赤泥基质的盐碱性、颗粒团聚特征,并结合土壤酶活性和微生物群落代谢功能等生物指标分析,评估和探讨玉米秸秆对赤泥壤质化改良的促进作用及其作用机理,以明确生物质改良促进赤泥壤质化改良的有效性和可持续性,从而为赤泥规模化生态处理提供参考。
-
拜耳法赤泥取自山东铝业公司赤泥堆场,经自然风干后,粉碎,过2 mm筛备用。其pH为12.80、电导率(EC)为1.98 mS·cm−1、盐碱度(ESP)为91.2%。其主要化学成分为,SiO2(16.32%)、Fe2O3(33.74%)、Al2O3(19.32%)、Na2O(7.98%)、CaO(4.13%)、TiO2(2.13%)、k2O(0.05%);主要矿物组成为,赤铁矿、铝针铁矿、石英、三水铝石、方钠石、锐钛矿等。本研究所用的生物质为经破碎处理的玉米秸秆(20目、pH为7.35)。以赤泥堆场周围自然土壤作为参照土壤。
-
本研究共设4个处理,分别为赤泥(RM)、3%生物质+赤泥(3-RM)、5%生物质+赤泥(5-RM)、10%生物质+赤泥(10-RM),每个处理均设3个重复。生物质与赤泥充分混合后装入30 cm×22 cm(内径×盆高)底部带孔的塑料花盆并编号,放置在室外自然环境中培养,定期浇水,使其含水率保持在70%田间持水量左右。分别在培养后的30、180、360 d取样,过2 mm筛后,分成2部分:一部分风干后用于分析改良赤泥的理化指标;另一部分剩余鲜样置于4 ℃冰箱冷藏保存用于土壤微生物群落功能多样性和土壤酶活性等生物指标的测定。
-
1) 赤泥的基本理化指标分析。将各处理样品按1∶5土液比浸提后,pH值采用pH计(801型,杭州联测自动化技术有限公司)测定,EC值采用电导率测试仪(6061型,武汉中仪百控仪表有限公司)测定。阳离子交换量(CEC)采用醋酸铵方法提取、电感耦合等离子体光谱仪(ICP-AES,Optima 5300DV,美国Perkin Elmer公司)测定浸出液中的阳离子浓度,以各阳离子的总量作样品的阳离子交换量,以Na+占阳离子交换量的占比作为各处理样品的盐碱度(Exchangeable sodium saturation percentage, ESP)。容重ρ1和颗粒密度ρ2分别采用环刀法和比重瓶法测定,利用ρ1和ρ2计算各处理的孔隙度[17]。各处理团聚体的颗粒组成采用湿筛法测定,并计算平均重量直径(MWD),MWD的计算公式如式(1)所示。
式中:
¯χi 为每相邻2个样筛的平均直径,mm;wi 为该样筛中赤泥样品重量占总重的比例。2) 土壤微生物群落代谢活性分析。微生物群落代谢水平采用Biolog Eco-plateTM(BIOLOG, USA)分析[18-19],其中用孔颜色平均变化率(Average well color development, AWCD)表征微生物群落整体代谢活性,分别用Shannon指数(H)和Simpson指数(D)描述微生物种群的丰富度和物种的优势度[18-19],相应的计算公式如式(2)~(4)所示。
式中:Ci为每孔在590 nm处的吸光值;R为对照孔吸光值;Pi为第i孔相对吸光值与整板相对吸光值总和之比。
3) 土壤酶活性分析。采用土壤酶试剂盒 (苏州科铭生物技术有限公司) 分析各处理组土壤脲酶、脱氢酶和碱性磷酸酶的活性。土壤脲酶活性采用苯酚钠-次氯酸钠比色法测定,土壤脱氢酶活性采用TTC分光光度法测定,土壤碱性磷酸酶活性采用磷酸苯二钠比色法测定[20]。
-
通过测定不同培养阶段各处理组的pH、EC和ESP(图1),以分析生物质改良对赤泥基质盐碱性的调控作用[21]。由图1(a)~图1(c)可以看出,添加不同比例生物质均可显著降低赤泥基质的pH、EC和ESP值(p<0.05),且随着添加比例的增加,呈逐渐降低的趋势。培养30 d时,与RM组相比,3-RM组pH、EC和ESP变化不明显,5-RM组则呈明显的下降趋势,10-RM组各指标则显著降低(p<0.05),其pH、EC和ESP分别降至10.82、0.96 mS·cm−1和79.8%;且随着培养时间的延长,这种下降趋势更明显。培养360 d后,尽管各生物质改良处理组的相关指标仍显著低于参照土壤,但与培养30 d时相比,各生物质改良处理组pH、EC和ESP均有显著降低(p<0.05)。其中,10-RM组pH、EC和ESP分别降至9.89、0.46 mS·cm−1和35.2%,均显著低于RM组的对应指标值(p<0.05)。其原因可能是,生物质腐化降解为微生物生长代谢提供了丰富的C、N、P、Ca、Mg等必需元素,刺激了微生物活性恢复,进而微生物又可通过代谢产酸中和赤泥中碱性物质,从而降低其盐碱性[22]。此外,与培养初期相比,经过室外自然条件下培养360 d后,RM组的pH、EC和ESP也有一定程度的降低。这说明,长期的自然风化作用也可使赤泥盐碱性得到一定程度的改善,但是自然修复过程历时较为漫长[23]。
除赤泥盐碱性得以改善之外,生物质添加显著提升了赤泥基质中交换性Ca2+浓度。在整个培养实验阶段,各处理组的交换性Ca2+浓度均呈上升趋势。培养至360 d时,3-RM、5-RM和10-RM组交换性Ca2+浓度分别增至16.7、18.2和22.7 cmol·kg−1,显著高于RM组可交换性Ca2+浓度(14.32 cmol·kg−1,图1(d))。这可能是因为,生物质中含有丰富的Ca(含量为9.46 g·kg−1),其腐化降解过程可释放更多的Ca2+,增加了赤泥中游离Ca2+浓度。此外,因Ca2+与土壤胶体表面亲和力大于Na+,可以把原来胶体表面的吸附的Na+交换出来,进而加速了赤泥中Na+流失[24]。这在一定程度上解释了各生物质改良处理组的ESP均有明显降低的原因(图1(c))。同时,Ca2+也可通过与OH—等碱性阴离子发生沉淀反应[25],起到降低赤泥基质盐碱性的作用。因此,生物质添加可从多个途径对赤泥盐碱性起到调控作用。
-
为评价生物质添加对赤泥物理性质的改良效果,测定了不同培养阶段各处理组的容重、孔隙度和平均重量直径(MWD)等指标(图2)。由图2(a)~图2(b)可以看出,随着培养时间延长各处理组的容重和孔隙度分别呈降低和上升趋势。培养至360 d时,各生物质添加处理组的容重和孔隙度均优于赤泥对处理组(RM)。其中,3-RM、5-RM和10-RM组容重分别降至0.92、0.76和0.55 g∙cm−3,孔隙度分别达到了59.9%、64.9%和71.2%,较RM组均有显著的改善(容重,1.22 g·cm−3;孔隙度,53.2%)。另由图2(c)可以看出,随培养时间的延长,各生物质改良处理组的MWD值逐渐增加。培养360 d后,3-RM、5-RM、10-RM的MWD值分别达到0.28、0.31和0.38 mm。尽管仍小于参照土壤的MWD值(0.56 mm),但仍均显著高于对照组(RM)的MWD值(0.19 mm)。这表明,生物质添加可有效改善赤泥基质的物理性质。其原因可能为,生物质质地松散、孔隙度大、容重较低,其与赤泥物理混合不仅可机械性改善赤泥基质颗粒的组成,提升其疏松程度,进而改善其容重和孔隙度[26]。同时,生物质腐化降解释放的Ca2+可通过与赤泥中Na+置换作用,削弱Na+对微细颗粒的分散作用,促进赤泥基质中微细颗粒的团聚,增加微团聚体的稳定性[27]。此外,生物质腐化降解还产生了丰富的腐殖酸[28]和黄腐酸[29]等具有吸附和胶结作用的物质,易与赤泥中铁铝氧化物结合形成土壤有机-无机复合胶体[30],促进赤泥黏粒团聚并形成水稳性大团聚体[31]。然而,赤泥基质中微生物也可通过分泌的多糖、菌丝的缠绕等作用促进赤泥微团粒结构向大团粒结构转变[32]。因此,利用生物质腐化降解过程,促进赤泥微小颗粒团聚,形成稳定大颗粒团聚体的作用,是改善赤泥基质结构性能、促进其壤质化改良的有效途径。
-
不同培养阶段各处理组的微生物代谢水平见表1。由表1可以看出,各生物质改良处理组的AWCD值随着培养时间的延长而逐渐增加。这表明,各生物质改良处理组中微生物的代谢活性在逐渐恢复。尤其在180 d至360 d期间,微生物活性快速提升。其中,培养至360 d时,3-RM、5-RM和10-RM组的AWCD值分别增加至0.766、0.933和1.080,均显著高于RM组(p<0.05)。相应地,伴随着微生物代谢活性的增加,各生物质改良处理组微生物物种丰富度指数H及种群优势度指数D也有明显提升。其中,在培养至360 d时,3-RM、5-RM和10-RM的多样性指数H分别达到5.75±0.061、6.88±0.091和7.34±0.084,较RM组分别增加了10.8%、32.6%和41.4%。尽管各生物质改良处理组之间的种群优势度指数D差异不显著,但各生物质添加处理组的指数D明显高于RM组。
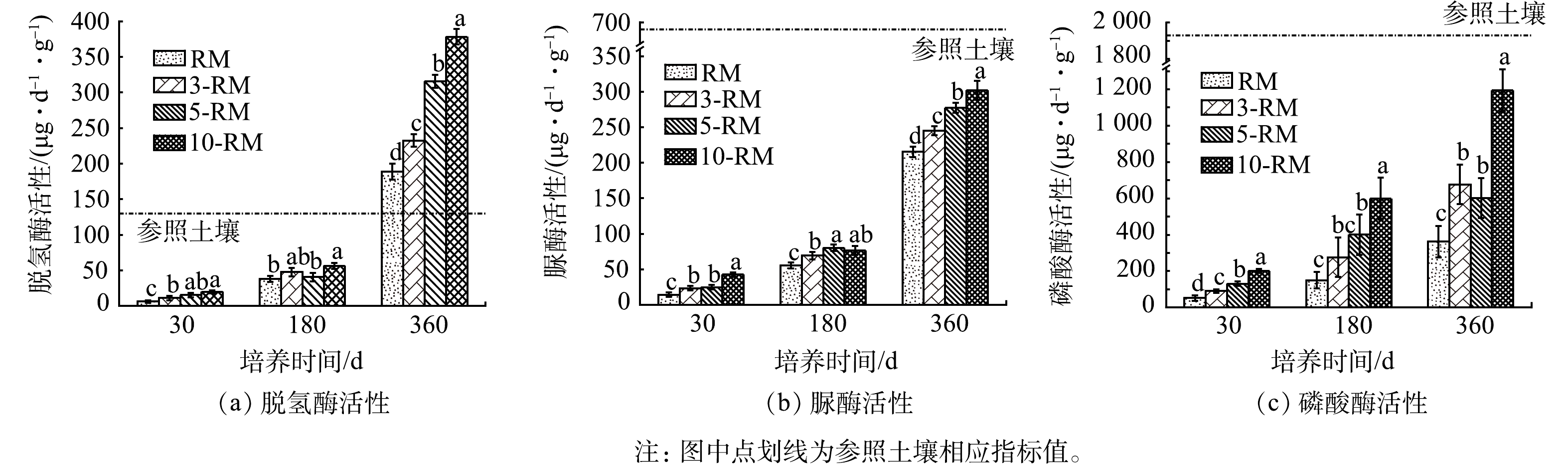
不同培养阶段各处理组的土壤脱氢酶、脲酶、碱性磷酸酶的活性见图3。由图3可以看出,在整个培养实验阶段,未添加生物质处理组(RM)的脱氢酶、脲酶、碱性磷酸酶活性长期处于较低水平,而在添加生物质处理组中3种土壤酶活性均有显著的提升,且呈现随着添加量的增加而显著增强的变化趋势。与微生物群落代谢活性变化相似,在前期培养30 d至180 d时间段内,各土壤酶活性增长较为缓慢,而在培养180 d至360 d时间段,其活性迅速增加。在培养360 d时,与RM组相比,3-RM组的土壤脱氢酶、脲酶、磷酸酶活性分别增长了23.0%、13.9%和87.2%;5-RM组相比增长了67.2%、28.8%和66.7%;10-RM组相比增长了100.2%、40.3%和230.2%。
-
以上实验结果表明,生物质添加可有效促进赤泥基质中微生物群落及功能的恢复。首先,生物质本身携带的易利用活性物质为基质中的微生物提供了丰富的养分和碳源,缓解了微生物之间对营养元素的竞争[33],有效促进了微生物在赤泥中大量定殖扩增及优势种群的建立。其次,微生物群落多样性的增加也与生物质改良后赤泥基质环境质量的改善密切相关[34]。这是因为,高水平的pH、EC和Na+对土壤微生物和植物有明显的毒害作用,是赤泥中微生物群落建立的主要障碍[26,35],而生物质腐化降解降低了赤泥基质的盐碱度,削弱其对微生物群落生长的负面影响[36]。本研究中,进一步的微生物群落功能多样性与赤泥环境变化间的冗余分析(图4)表明,AWCD值与pH、EC、ESP和交换性Na+浓度之间存在负相关;而相对于微生物群落建立,赤泥基质团聚体平均重量直径(MWD)增加和ESP降低是驱动微生物物种丰富度增长关键因素,而pH和EC改善是促进赤泥基质中优势种群的演替的重要因素。同时,微生物和土壤酶之间的共代谢效应也可促进微生物的繁衍增殖,即微生物的繁衍增殖使得各种土壤酶活性和种类得到提升;土壤酶也可通过分解生物质中较难分解的物质,为赤泥基质中微生物生命活动提供更多的营养成分[37]。本研究结果也表明,培养至360 d,各生物质改良处理组的脱氢酶活性均高于参照土壤,磷酸酶和脲酶活性也逐渐趋于参照土壤。这说明,生物质添加有利于赤泥基质中土壤酶活性的提升,尽管其仍受到较高盐碱性水平的胁迫[38]。另冗余分析也表明,3种土壤酶活性与赤泥盐碱性参数呈负相关,与土壤微生物群落多样性参数呈正相关(图4)。这说明,生物质添加降低赤泥盐碱性,促进土壤微生物群落建立,有利于实现赤泥微生物生态功能的恢复。
综上所述,生物质改良可刺激赤泥中土壤微生物活性,提升有机质降解代谢产酸及其腐化过程,进而降低赤泥基质的盐碱性。赤泥基质盐碱性和物理性质的改善,也为微生物增殖和发育提供了良好的生存环境,促进微生物群落活性和优势种群的快速发展,这为赤泥的壤质化持续改良创造了有利条件。
-
1) 生物质改良显著降低了赤泥盐碱性,培养至360 d时10-RM组pH、EC和ESP分别降低至9.89±0.01、0.46±0.05mS·cm−1和35.2±0.7%。其容重和孔隙度显著改善,水稳团聚体的平均重量直径增加。赤泥盐碱性和物理性质的改善为微生物增殖和发育提供了良好的条件。
2) 生物质改良可大幅度提升赤泥基质中微生物群落的活性和多样性,并增强土壤酶活性,这些改善均对赤泥壤质化改良有着积极的促进作用。
3) 在生物质添加量方面,10%添加处理对赤泥壤质化改良的促进作用最为显著,但5%和3%添加处理也取得了显著的改良效果,而从赤泥壤质化改良的经济性方面考虑,这2个添加量更适宜应用于赤泥规模化生态处理。
生物质对赤泥壤质化改良的促进作用
Effect of biomass on soil amelioration of red mud
-
摘要: 为解决赤泥的规模化安全处置问题,以拜耳法赤泥为研究对象,选用玉米秸秆为改良剂,通过分析各改良处理的基本理化指标、土壤酶活性以及微生物群落代谢水平等指标的变化,探究了生物质改良对赤泥壤质化改良的促进作用。结果表明,生物质添加可显著降低赤泥的盐碱性。其中,pH、电导率(EC)和盐碱度(Exchangeable sodium saturation percentage, ESP)分别降至9.89、0.461 mS·cm−1和35.2%,且随添加比例的增加改良效果更佳。经生物质添加处理,赤泥基质容重显著降低、孔隙度显著增加,颗粒平均重量直径(Mean weight diameter, MWD)增加至0.38 mm。经生物质改良处理,赤泥中微生物群落的生长代谢水平、多样性以及土壤脲酶、磷酸酶和脱氢酶的活性均有显著升高。冗余分析(Redundancy analysis, RDA)结果表明,微生物群落多样性参数与pH、EC和ESP呈负相关,与MWD呈正相关。本研究结果可为赤泥规模化生态处理提供参考。Abstract: To explore the large-scale safe disposal of red mud produced by the Bayer process of bauxites, the soil amelioration of biomass on red mud was evaluated by amending the crashed cornstalk over a year of outdoor cultivation. The physico-chemical and biological properties of the amended red mud were determined regularly, including pH, EC, EPS, bulk density, aggregates distribution, soil enzyme activity and microbial indicators. The results showed that, the addition of biomass could reduce the alkalinity and salinity of red mud significantly (p<0.05), and with increase of biomass addition, the pH, EC and ESP (Exchangeable sodium saturation percentage) of red mud decreased to 9.89, 0.461 mS∙cm−1 and 35.2%, respectively. Biomass addition could significantly improve the bulk density and porosity of red mud by increasing the mean weight diameter (MWD, up to 0.38 mm) of red mud matrix particles. The microbial metabolic levels and diversity, as well as soil enzyme activities were significantly increased with the amendment of cornstalk biomass (p<0.05). The further redundancy analysis indicated that the selected biological indicators were significantly negative to the alkaline indexes (to pH, EC, and ESP) and positive to MWD. The results of this study can provide the basis for large-scale soil amelioration of red mud.
-
Key words:
- red mud /
- cornstalk biomass /
- soil genesis /
- salinity /
- microbial community /
- soil enzymes
-
表 1 各改良处理的微生物群落功能多样性指数
Table 1. Functional diversity indexes of soil microbial community
培养时间/d 处理组 平均颜色变化率 (AWCD) Shannon指数(H) Simpson指数(D) 30 RM 0.059±0.022c 0.70±0.032d 0.85±0.007b 3-RM 0.145±0.032b 1.41±0.046c 0.91±0.008a 5-RM 0.143±0.021b 1.56±0.056b 0.89±0.005a 10-RM 0.185±0.017a 1.84±0.071a 0.89±0.012a 180 RM 0.149±0.015d 2.15±0.095c 0.86±0.015c 3-RM 0.274±0.013c 2.61±0.086b 0.91±0.015b 5-RM 0.334±0.035b 2.61±0.075b 0.91±0.014b 10-RM 0.399±0.014a 3.25±0.050a 0.95±0.007a 360 RM 0.599±0.012d 5.19±0.072d 0.92±0.013a 3-RM 0.766±0.017c 5.75±0.061c 0.93±0.016a 5-RM 0.933±0.032b 6.88±0.091b 0.94±0.012a 10-RM 1.080±0.012a 7.34±0.084a 0.95±0.021a 注:数据后字母不同表示同一取样时间不同处理5%差异显著水平。 -
[1] KLAUBER C, GRAFE M, POWER G. Bauxite residue issues: II. options for residue utilization[J]. Hydrometallurgy, 2011, 108(1/2): 11-32. [2] ZHU F, XUE S G, HARTLEY W, et al. Novel predictors of soil genesis following natural weathering processes of bauxite residues[J]. Environmental Science and Pollution Research, 2016, 23(3): 2856-2863. doi: 10.1007/s11356-015-5537-9 [3] JONES B E H, HAYNES R J. Bauxite Processing Residue: A Critical Review of Its Formation, Properties, Storage, and Revegetation[J]. Critical Reviews in Environmental Science & Technology, 2011, 41(3): 271-315. [4] KHAIRUL M A, ZANGANEH J, MOGHTADERI B. The composition, recycling and utilisation of Bayer red mud[J]. Resources, Conservation & Recycling, 2019, 141: 483-498. [5] XUE S G, KONG X F, ZHU F, et al. Proposal for management and alkalinity transformation of bauxite residue in China[J]. Environmental Science and Pollution Research, 2016, 23(13): 12822-12834. doi: 10.1007/s11356-016-6478-7 [6] CARLO E D, BOULLEMENT A, COURTNEY R. A field assessment of bauxite residue rehabilitation strategies[J]. Science of the Total Environment, 2019, 663: 915-926. doi: 10.1016/j.scitotenv.2019.01.376 [7] XUE S G, ZHU F, KONG X F, et al. A review of the characterization and revegetation of bauxite residues (Red mud)[J]. Environmental Science and Pollution Research, 2016, 23(2): 1120-1132. doi: 10.1007/s11356-015-4558-8 [8] BRAY A W, STEWART D I, COURTNEY R, et al. Sustained Bauxite Residue Rehabilitation with Gypsum and Organic Matter 16 years after Initial Treatment[J]. Environmental Science & Technology, 2018, 52(1): 152-161. [9] CARLO E D, CHEN C R, HAYNES R J, et al. Soil quality and vegetation performance indicators for sustainable rehabilitation of bauxite residue disposal areas: a review[J]. Soil Research, 2019, 57: 419-446. doi: 10.1071/SR18348 [10] Dong Y P, SHAO Y F, LIU A J, et al. Insight of soil amelioration process of bauxite residues amended with organic materials from different sources[J]. Environmental Science and Pollution Research, 2019, 26: 29379-29387. doi: 10.1007/s11356-019-06007-y [11] ESFANDBOD M, PHILLIPS I R, MILLER B, et al. Aged acidic biochar increases nitrogen retention and decreases ammonia volatilization in alkaline bauxite residue sand[J]. Ecological Engineering, 2017, 98: 157-165. doi: 10.1016/j.ecoleng.2016.10.077 [12] RASHTI M R, ESFANDBOD M, PHILLIPS I R, et al. Rhizosphere management by biochar and leaching improved plant performance in fresh bauxite residue sand[J]. Journal of Cleaner Production, 2019, 219: 66-74. doi: 10.1016/j.jclepro.2019.02.013 [13] RASHTI M R, ESFANDBOD M, PHILLIPS I R, et al. Aged biochar alters nitrogen pathways in bauxite-processing residue sand: Environmental impact and biogeochemical mechanisms[J]. Environmental Pollution, 2019, 247: 438-446. doi: 10.1016/j.envpol.2019.01.034 [14] CHAVEZ-GARCIA E, SIEBE C. Rehabilitation of a highly saline-sodic soil using a rubble barrier and organic amendments[J]. Soil and Tillage Research, 2019, 189: 176-188. doi: 10.1016/j.still.2019.01.003 [15] JONES B E H, HAYNES R J, PHILLIPS I R. Addition of an organic amendment and/or residue mud to bauxite residue sand in order to improve its properties as a growth medium[J]. Journal of Environmental Management, 2012, 95(1): 29-38. [16] SANTINI T C, FEY M V. Assessment of Technosol formation and in situ remediation in capped alkaline tailings[J]. Catena, 2016, 136: 17-29. doi: 10.1016/j.catena.2015.08.006 [17] 鲁如坤. 土壤农业化学分析方法[J]. 北京:中国农业科技出版社, 2000: 266-271. [18] 林先贵. 土壤微生物研究原理与方法[J]. 北京:高等教育出版社, 2010: 134-158. [19] 董梦阳, 董远鹏, 徐子文, 等. 赤泥改良过程中微生物群落及酶活性恢复研究[J]. 中国环境科学, 2021, 41: 913-922. doi: 10.3969/j.issn.1000-6923.2021.02.045 [20] 关松荫. 土壤酶及其研究法[J]. 北京:农业出版社, 1986: 294-322. [21] GRAFE M, POWER G, KLAUBER C. Bauxite residue issues: III. Alkalinity and associated chemistry[J]. Hydrometallurgy, 2011, 108(1/2): 60-79. [22] ZHANG J T, CHUN-SHENG M U. Effects of saline and alkaline stresses on the germination, growth, photosynthesis, ionic balance and anti-oxidant system in an alkali-tolerant leguminous forage Lathyrus quinquenervius(Plant Nutrition)[J]. Soil Science & Plant Nutrition, 2009. [23] 朱锋, 韩福松, 薛生国, 等. 氧化铝赤泥堆场团聚体的分形特征[J]. 中国有色金属学报, 2016, 26(6): 1316-1323. [24] 黄昌勇. 土壤学[J]. 北京:中国农业出版社, 2000: 80-89. [25] 薛生国, 李晓飞, 孔祥峰, 等. 赤泥碱性调控研究进展[J]. 环境科学学报, 2017, 37(8): 2815-2828. doi: 10.13671/j.hjkxxb.2017.0144 [26] JONES B E H, HAYNES R J, PHILLIPS I R. Influence of organic waste and residue mud additions on chemical, physical and microbial properties of bauxite residue sand[J]. Environmental Science & Pollution Research, 2011, 18(2): 199-211. [27] SMITH R, TONGWAY D, TIGHE M, et al. When does organic carbon induce aggregate stability in vertosols?[J]. Agriculture Ecosystems & Environment, 2015, 201: 92-100. [28] TEJADA M, GARCIA C, GONZALEZ J L, et al. Use of organic amendment as a strategy for saline soil remediation: influence on the physical, chemical and biological properties of soil[J]. Soil Biology & Biochemistry, 2006, 38(6): 1413-1421. [29] REN J, REN X Q, CHEN J, et al. Humic-mineral interactions modulated by pH conditions in bauxite residues–Implications in stable aggregate formation[J]. Geoderma, 2021, 385: 114856. doi: 10.1016/j.geoderma.2020.114856 [30] 李佳佳. 秸秆-膨润土-PAM对土壤理化性质和作物生长的调控效应[D]. 重庆: 西南大学, 2011. [31] ELIZAVETA K, EVGENY M. Aromaticity and humification of dissolved organic matter (lysimetricexperiment)[J]. 期刊名?2015, 178-182. [32] SINHA R K, AGARWAL S, CHAUHAN K, et al. The wonders of earthworms & its vermicompost in farm production: Charles Darwin's 'friends of farmers', with potential to replace destructive chemical fertilizers[J]. Agricultural Sciences, 2010, 1(2): 76-94. doi: 10.4236/as.2010.12011 [33] GE T D, YUAN H Z, ZHAO Z W, et al. Tracking the photosynthesized carbon input into soil organic carbon pools in a rice soil fertilized with nitrogen[J]. Plant & Soil, 2015, 392(1/2): 17-25. [34] LI Y, HAYNES R J, CHANDRAWANA I, et al. Properties of seawater neutralized bauxite residues and changes in chemical, physical and microbial properties induced by additions of gypsum and organic matter[J]. Journal of Environmental Management, 2018, 223: 489-494. [35] ANAM G B, REDDY M S, AHN Y H. Characterization of Trichoderma asperellum RM-28 for its sodic/saline-alkali tolerance and plant growth promoting activities to alleviate toxicity of red mud[J]. Science of the Total Environment, 2019, 662: 462-469. doi: 10.1016/j.scitotenv.2019.01.279 [36] FOURRIER C, LUGLIA M, HENNEBERT P, et al. Effects of increasing concentrations of unamended and gypsum modified bauxite residues on soil microbial community functions and structure – A mesocosm study[J]. Ecotoxicology and Environmental Safety, 2020, 201: 110847. doi: 10.1016/j.ecoenv.2020.110847 [37] 滕菲, 杨雪莲, 李凤梅, 等. 微生物对环境中难降解有机污染物共代谢作用[J]. 微生物学杂志, 2016, 36(3): 6. doi: 10.3969/j.issn.1005-7021.2016.03.015 [38] JONES B E, HAYNES R, PHILLIPS I. Effect of amendment of bauxite processing sand with organic materials on its chemical, physical and microbial properties[J]. Journal of Environmental Management, 2010, 91(11): 2281-2288. doi: 10.1016/j.jenvman.2010.06.013 -







 下载:
下载: