-
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是挥发性或半挥发性碳氢化合物,由生物质、石化燃料等有机物不完全燃烧产生[1],是一类广泛存在于大气降尘中的持久性有机污染物[2],其易在含有脂肪的组织和器官中生物蓄积,且具有持久性、致畸致癌性,是一类高毒性环境污染物[3−4]。PAHs可随呼吸吸入进入人体、到达人体深肺区,由呼吸暴露导致的终生致癌风险(incremental lifetime cancer risk,ILCR),全球平均值为3.1×10−5[5−6]。参照国际癌症研究署给出的污染物致癌毒性判定,苯并[a]蒽是一种具有致癌效应[7]的典型PAHs。
外源污染物进入肺泡首先与覆盖于肺泡内衬层的肺表面活性物质(pulmonary surfactant, PS)接触,PS是抵御污染物进入血液循环系统的最后一道屏障[8]。PS主要由肺泡II型上皮细胞合成和分泌,是一种具有特殊生物活性的复合物,能有效降低肺泡表面张力,防止肺泡在呼气的最后阶段发生塌陷[9−10]。1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(1,2-dipalmitoyl-sn-glycero-3- phosphocholine,DPPC)是PS发挥生物活性最重要的物质基础,通常作为体外研究PS的模拟物和替代物[11−13]。
PAHs经呼吸到达肺部,可与PS发生作用[14]。Sosnowski等[15]通过分子动力学模拟研究发现苯并[a]芘会诱导磷脂膜表面活性的异常并降低其流动性。Liland等[16]研究了菲、萘、苯并[a]芘3种PAHs对磷脂膜相行为的影响,结果表明苯并[a]芘对磷脂膜的液相有序相具有亲和力,能降低DPPC囊泡从固体到液晶相转变时的转变温度和焓值。Zhao等[17]发现Curosurf(肺表面活性物质制剂)与菲在纳米管上的吸附存在相互竞争作用,彼此起到一定的抑制作用。Beata等[18]借助分子动力学模拟研究了苯并[a]芘对肺表面活性物质单分子膜性质的影响,结果表明苯并[a]芘会对磷脂单层造成破坏,降低磷脂亲水区的水化作用。关于PAHs对肺表面活性剂的毒性行为,目前主要集中在分子动力学模拟,虽然可以证实PAHs能导致各种负面的呼吸系统效应,但PAHs暴露与肺功能下降之间的关系证据仍不充分,二者间的界面化学作用有待进一步确立和完善。
鉴于此,本文选取DPPC及PAHs中具有代表性的苯并[a]蒽[7,19−20]作为研究对象,进一步探究PAHs与PS相互作用的界面化学特征。通过表面张力仪,分析苯并[a]蒽对DPPC降低气-液界面张力性能的影响。借助Langmuir-Wilhelmy膜天平对肺呼吸循环进行体外模拟,获取DPPC的压缩-扩张循环曲线,结合弹性模量观测苯并[a]蒽存在/不存在情况下DPPC压缩及扩张性能。通过布儒斯特角显微镜(brewster angle microscopy,BAM),对DPPC单分子膜的微观形貌进行原位观察,借助激光共聚焦显微拉曼光谱分析苯并[a]蒽对DPPC分子内部结构构象的影响, 进一步揭示苯并[a]蒽对DPPC单分子膜的影响机制。这项研究旨在从微观角度分析PAHs对肺表面活性物质的负面效应,以期对后续学者研究PAHs的肺部毒理行为给予一定的参考及启示。
-
1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(DPPC,纯度≥99%)购自Sigma公司;苯并[a]蒽(Benz(a)anthracene),购自百灵威科学有限公司(北京);氯仿、无水乙醇、氯化钠均为分析纯,购自成都市科龙化工试剂厂;实验用水均为超纯水,其室温下的电阻率为18.25 MΩ·cm。以生理盐水(0.9%NaCl溶液)作为所有实验的亚相溶液。
DPPC分子式为C40H80NO8P,分子量734.04。苯并[a]蒽分子式C18H12,分子量:228.29。DPPC及苯并[a]蒽分子结构如下:

-
电子天平(AL204,Mettle Toledo,美国);超纯水仪(EU-K1-10TY,南京欧凯环境);超声波清洗仪(SK06G,上海科导);自动表面张力仪(BZY,上海方瑞仪器有限公司);多功能Langmuir-Wilhelmy膜天平(JML04C2,上海中晨数字技术设备有限公司);布儒斯特角显微镜(Nanofilm-EP4 BAM,Accurion GmbH,德国);激光共聚焦显微拉曼光谱仪(DXRxi,ThermoScientific,美国)。
-
通过白金板法测定苯并[a]蒽对DPPC膜表面张力的影响。用0.9%氯化钠溶液为亚相溶液,将DPPC、苯并[a]蒽分别溶于氯仿[14]中,制备出浓度为1.0 mmol·L−1的DPPC及摩尔比为8∶1的DPPC/苯并[a]蒽混合膜液,待测。配制含有(18—25) mg/25 mL的DPPC/氯仿溶液作为储备膜液。将一定量的亚相溶液加入自动表面张力仪配套的液槽中,在气-液界面用汉密尔顿微量注射器滴加适量膜液,待15—20 min氯仿挥发完毕,测定气-液界面的表面张力。以DPPC表面铺展量(单位面积的气-液界面所含的DPPC的物质的量,单位10−3 mmol·m−2)为横坐标、DPPC膜的表面张力为纵坐标,绘制苯并[a]蒽对DPPC膜表面张力的影响曲线。
实验中苯并蒽浓度的确定主要基于以下两点:1、污染物浓度较小(在PAHs污染的大气环境中如受机动车尾气污染的空气,经人体吸入并在肺泡内积累的PAHs经估算以ng·min−1为参考[15,21]),会使苯并[a]蒽分子数量太少,实验结果不明显。2、长期暴露于被污染的空气中,疏水性苯并[a]蒽可能在磷脂层中累积,造成局部高浓度苯并[a]蒽的存在。因此选取DPPC/苯并[a]蒽摩尔比8:1作为实验浓度,将有利于短期内明显实验现象的获取,以明确阐释苯并[a]蒽对DPPC膜的不利反应。
-
表面压-面积(π-A)等温线通过配备有液槽(聚四氟乙烯材质,有效面积280 mm×100 mm)和恒温装置(温度控制在(37 ± 0.5)℃)的Langmuir-Wilhelmy膜天平进行测量。该系统配备了超灵敏的表面压力传感器,并采用两个对称移动的屏障对空气-水界面的磷脂单分子膜进行压缩。实验开始前,依次用二氯甲烷和超纯水清洗液槽以确保液槽的干净。将260 mL的亚相溶液倒入液槽中,用汉密尔顿微量注射器滴加适量的磷脂/氯仿膜液于空气-水界面[22−23]。静置15—20 min待氯仿挥发完毕、磷脂单分子膜完全铺展,控制滑障以15.5 mm·min−1 的速率开始对称压缩,直至表面积剩下10%,同时设备将自动获取表面压力与表面积的关系曲线,即可得到相应的磷脂单分子膜表面π-A等温线。每次测量后,完全移除亚相溶液并彻底清洁滑障、铂片和液槽。通过水浴恒温装置,控制实验温度为(37±0.5)℃。所有的实验至少测量3次以确保其重现性。
-
PS膜微观形貌原位观测借助BAM仪器进行[24−25],该仪器配备有波长为658 nm的50 mW激光发射p偏振光、10倍放大物镜、偏振器、分析仪和CCD摄像机。实验用聚四氟乙烯原位槽测定,将适量的亚相溶液加入到液槽中,并放置在防振台上。如π-A等温线实验所述,亚相为生理盐水,在气-液界面上滴加适量的磷脂膜液,待膜液中的氯仿挥发完毕后,激光束以布儒斯特角a入射到空气-水界面。折射光束携带超过99%的入射能量,被放置在槽底部的一块黑色玻璃吸收。同时,通过布儒斯特角显微镜观察常压(π=20 mN·m−1、π=30 mN·m−1)条件下,气-液界面处存在/不存在苯并[a]蒽时DPPC单分子膜的微观结构。
-
分别将适量的DPPC膜液及摩尔比为8:1的DPPC/苯并[a]蒽混合膜液铺于空气-水界面,待氯仿挥发完毕,利用激光共聚焦显微拉曼光谱仪在常温下检测DPPC分子的构象变化信息。 激光器633 nm激发波长,激光功率6.8 mW,曝光时间0.00833 s,扫描次数900,50 μm共聚焦针孔模式。
-
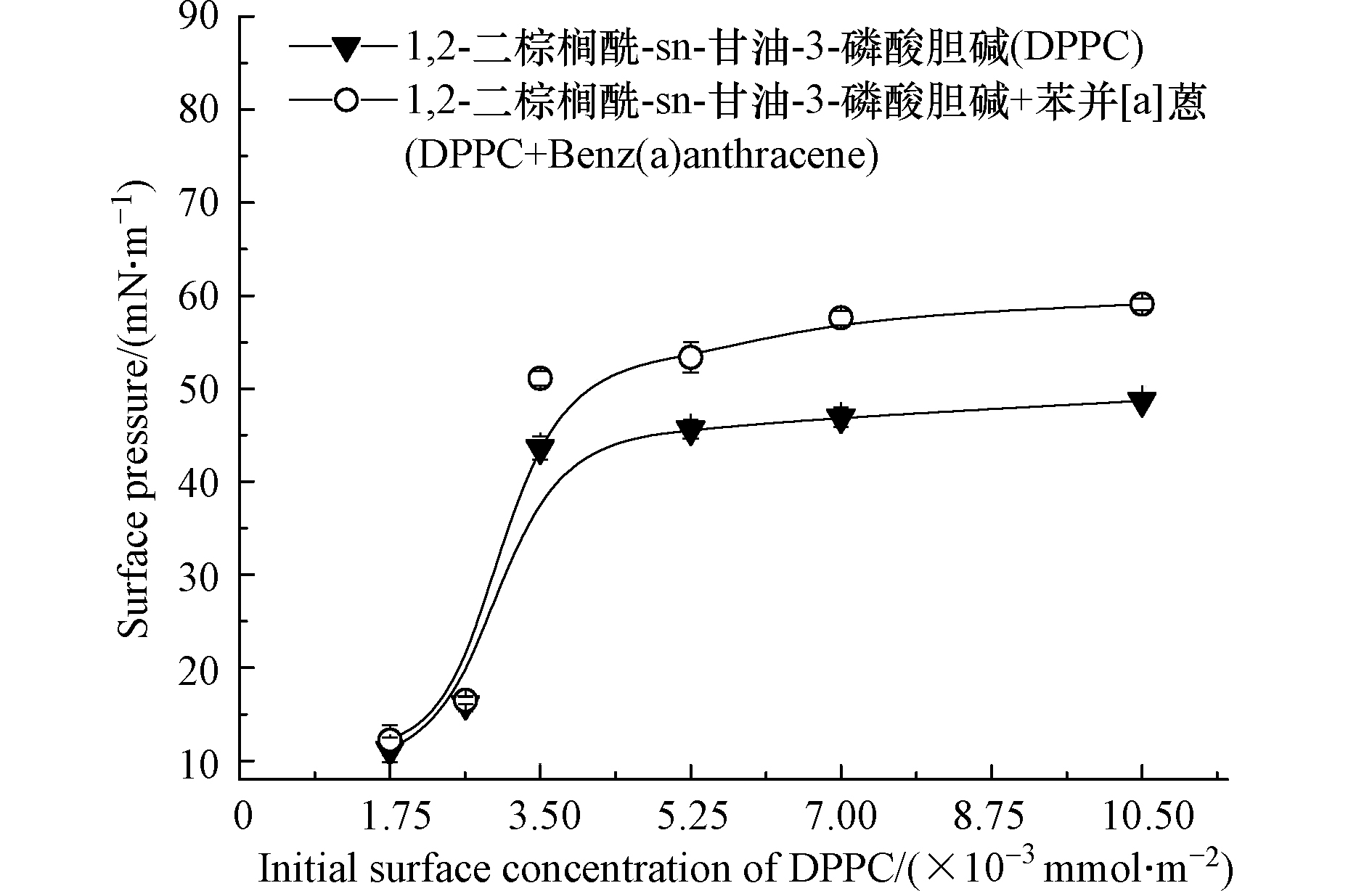
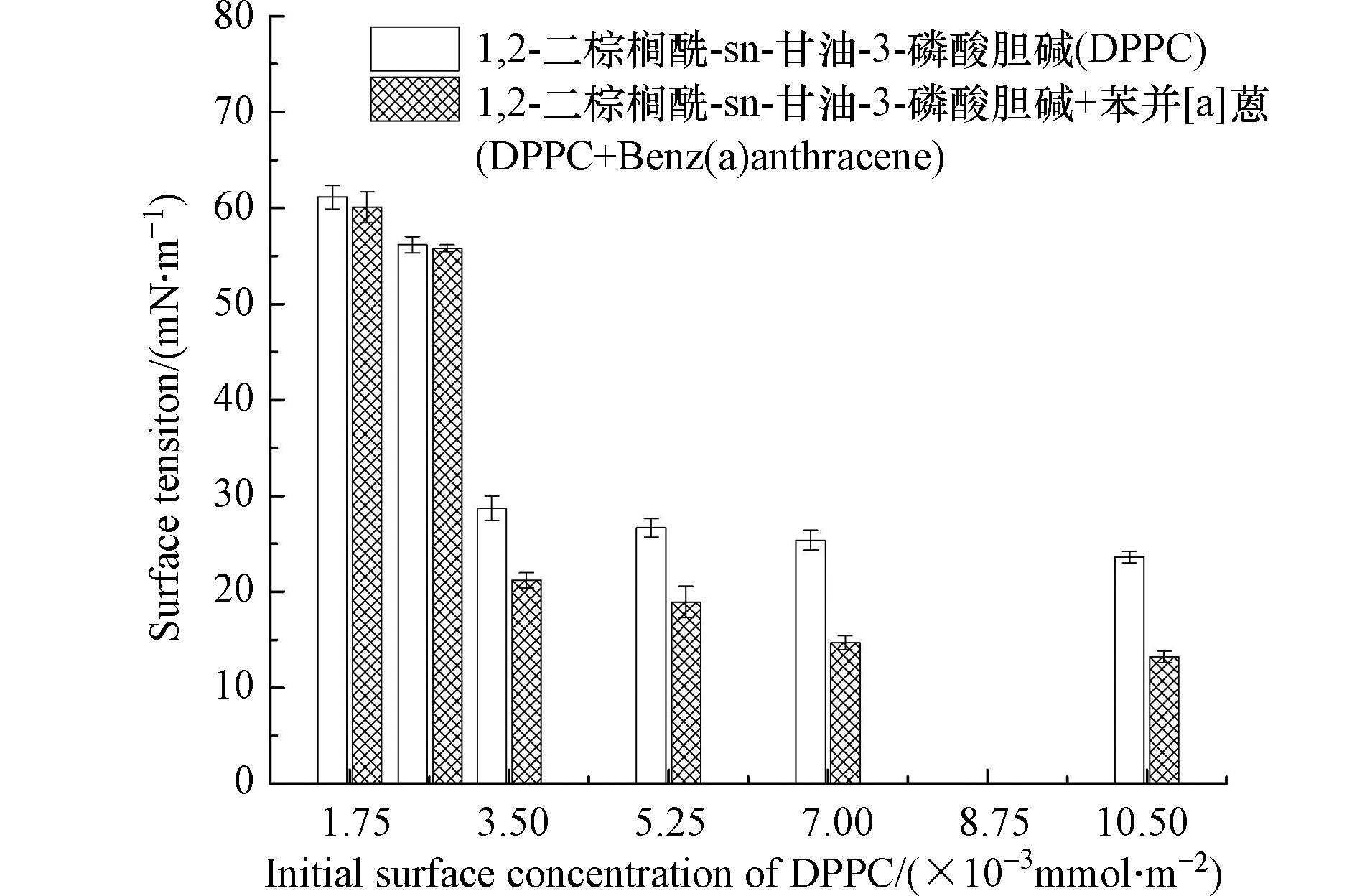
PS可显著降低肺泡的表面张力,对维持肺泡稳定、减少呼吸功十分重要,是其界面活性的重要指标之一 [26−27]。由图1可知,DPPC可显著降低气-液界面表面张力,随着DPPC铺展量的增多,水的表面张力逐渐降低并最终趋于平稳。说明当C=3.5×10−3 mmol·m−2,DPPC在气-液界面的表面富集量趋于饱和。膜液中加入苯并[a]蒽,表面张力下降,当膜液加入量为5.25×10−3 mmol·m−2时,表面张力由26.7 mN·m−1降低为18.9 mN·m−1。
PS在表面膜上降低表面张力的量,可以用表面压力(π)表示,二者间的关系可用下式表示[27]:
式中,γ0指亚相生理盐水的气-液界面表面张力,37 ℃ 生理盐水的表面张力约为72.3 mN·m−1;γ指DPPC膜铺展于亚相表面时的表面张力;π指DPPC单分子膜的表面压力。
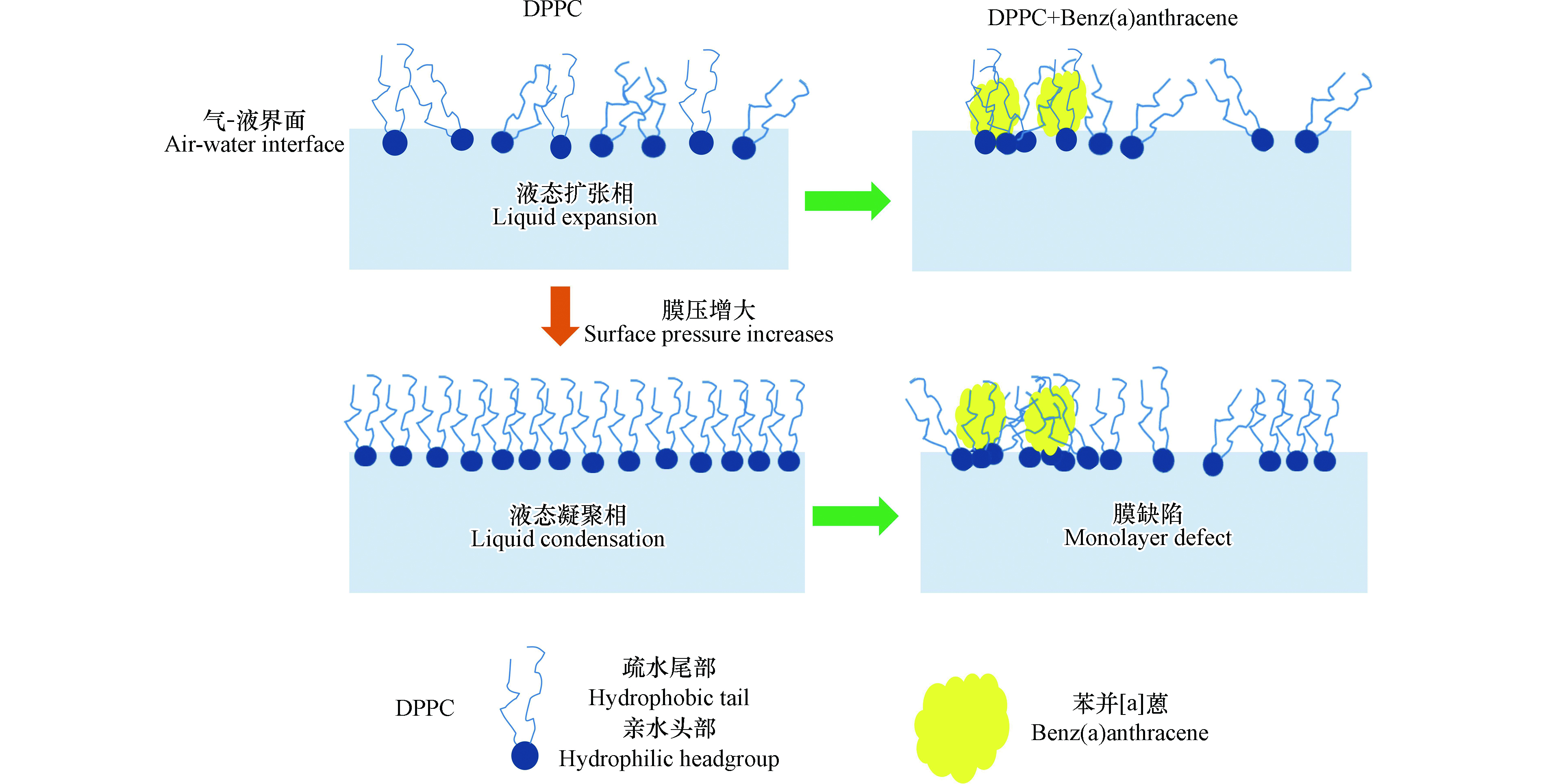
苯并[a]蒽造成DPPC单分子膜表面张力降低,说明苯并[a]蒽的存在,膜的表面压力增加,如图2所示。这说明苯并蒽以一种特殊的方式存在于DPPC分子之间,二者间的相互作用削弱了DPPC分子间的相互吸引。为进一步分析呼吸时单分子膜循环压缩-扩张过程中,苯并[a]蒽对DPPC膜表面压力的影响,通过下述Langmuir–Wilhelmy膜天平实验获取π-A等温线,对膜表面压力变化做系统性分析[28−31],以期阐明苯并[a]蒽对DPPC膜分子的作用细节。
-
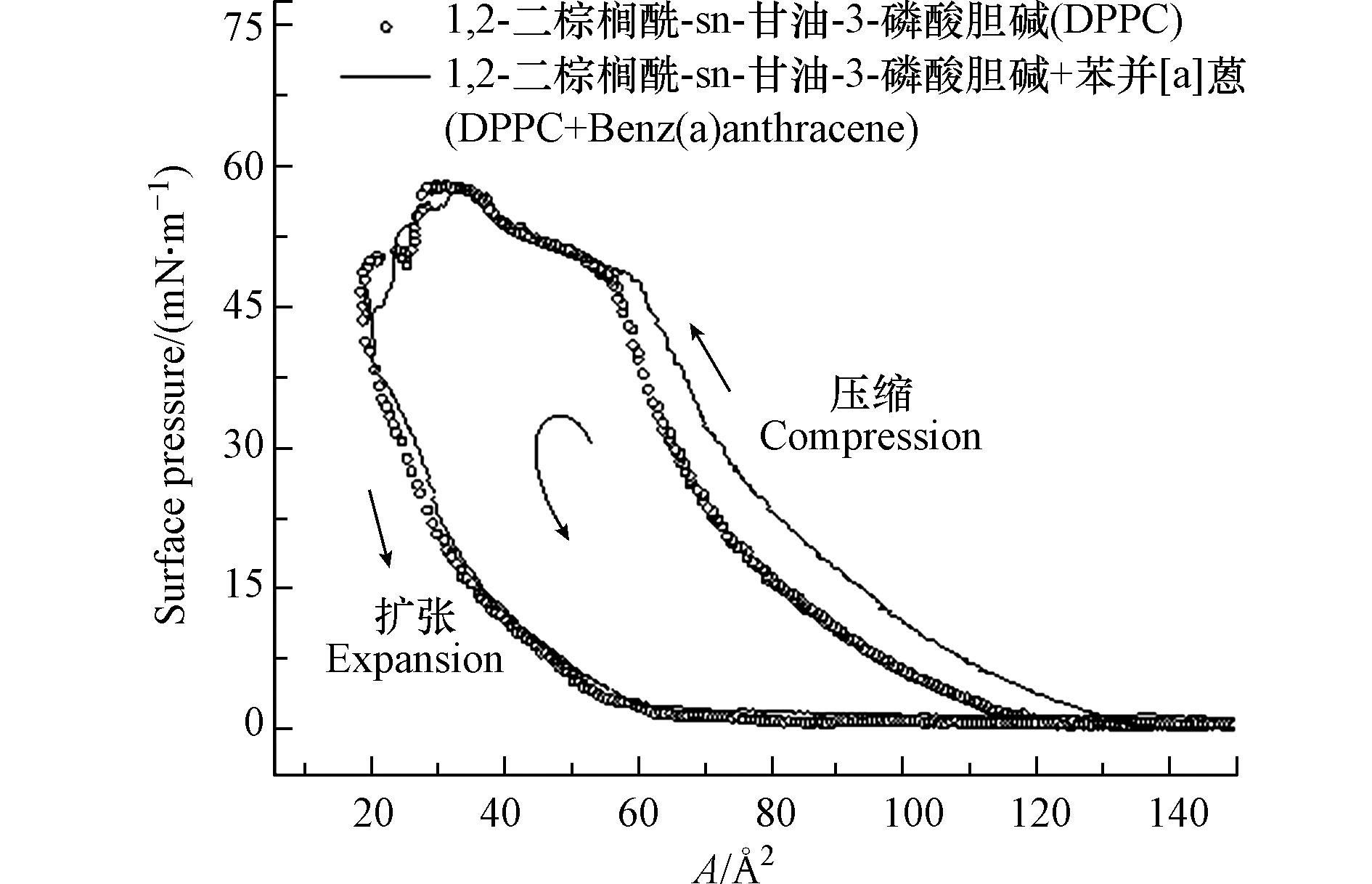
π-A等温线是表征肺表面活性物质呼吸活性的重要指标,直观的体现了较宽的表面压力下单分子膜压缩、扩张过程的物理化学性质变化,通过等温线可获得单分子膜的物理变化特征等信息[32−33]。图3给出了苯并[a]蒽存在/不存在条件下,DPPC单分子膜π-A等温线的变化。由图3可知,整个压缩过程中,DPPC单分子膜的π-A等温线主要呈现液态扩张相和液态凝聚相, 与前人研究一致[34−35]。苯并[a]蒽的加入,π-A等温线呈现出明显的“外扩”行为,即在同样的表面积下,混合组分的表面张力,明显高于纯组分DPPC单分子膜,等温线向高分子面积区域移动。当5 mN·m−1<π<25 mN·m−1, 曲线“外扩”行为最为显著,随着压缩进一步推进,两条曲线逐渐靠近,并在固相阶段基本重合,直至扩张阶段结束。
滞回曲线是DPPC单分子膜的一个重要特征,反映了呼吸功能活性的相关信息[36]。使用以下定量标准进行评估:归一化滞回面积(normalized hysteresis area,HAn)见公式(2),稳定性指数(Stability index, SI)见公式(3)。
SI表示单分子膜降低界面表面张力的效果,SI值越高,代表单分子膜越稳定,表面活性越好[24,37]。式中,Amax:滞回环中DPPC分子所占的最大面积;Amin:滞回环中DPPC分子所占的最小面积;πmax:滞回环中DPPC分子间最大表面压力;πmin:滞回环中DPPC分子间最小表面压力。
由完整的滞回曲线可以看出,两个滞回环呈现出相似的特征,扩张曲线均在压缩曲线的下方,并出现较大的分离,近似呈封闭、两端尖的长梭形状,且滞回面积明显增大。“回线”的存在说明DPPC分子被紧密压缩后,以某种方式缔合,而在扩张阶段,缔合体并不解离[38]。苯并[a]蒽存在下,π-A等温线向高分子面积区域移动,说明苯并[a]蒽的存在使DPPC分子间引力减弱,相互排斥作用增强。而这种不利影响随着压缩过程的进行,被较强的外界压力逐渐抵消,对DPPC固相膜的形成不会造成显著影响。由表1可知,苯并[a]蒽的加入使DPPC单分子膜的最大表面压力(πmax)降低,由58.17 mN·m−1降低为57.52 mN·m−1。
πmax代表磷脂膜被压缩到崩解时产生最大降低表面张力的能力[27],πmax值的大小与肺功能的正常发挥有重要联系。πmax降低说明苯并[a]蒽的存在导致了DPPC膜对抗外界强力压缩的能力降低,一定区域的界面对DPPC分子的容纳能力减弱,DPPC分子将提前被挤出。同时在苯并[a]蒽影响下归一化滞回面积HAn及稳定性指数SI有小幅度的衰减,说明苯并[a]蒽的加入使膜的稳定性降低。滞回环面积反映了单分子膜的能量耗散能力,说明苯并[a]蒽存在下,DPPC单分子膜在压缩-扩张过程中,能量耗散增大。由于Langmuir膜是处于亚稳态的动态体系,内部不断产生熵,为了形成有序致密的DPPC液态凝聚膜需不断地从外界引入负熵流。这一作用使呼吸过程尤其是呼气过程中呼吸功增加。由于部分呼吸功用于对抗表面张力和扩张肺泡,因此能量耗散增大会影响肺泡与肺泡之间的稳定性以及肺通气的顺应性。
-
压缩系数CS或压缩模量
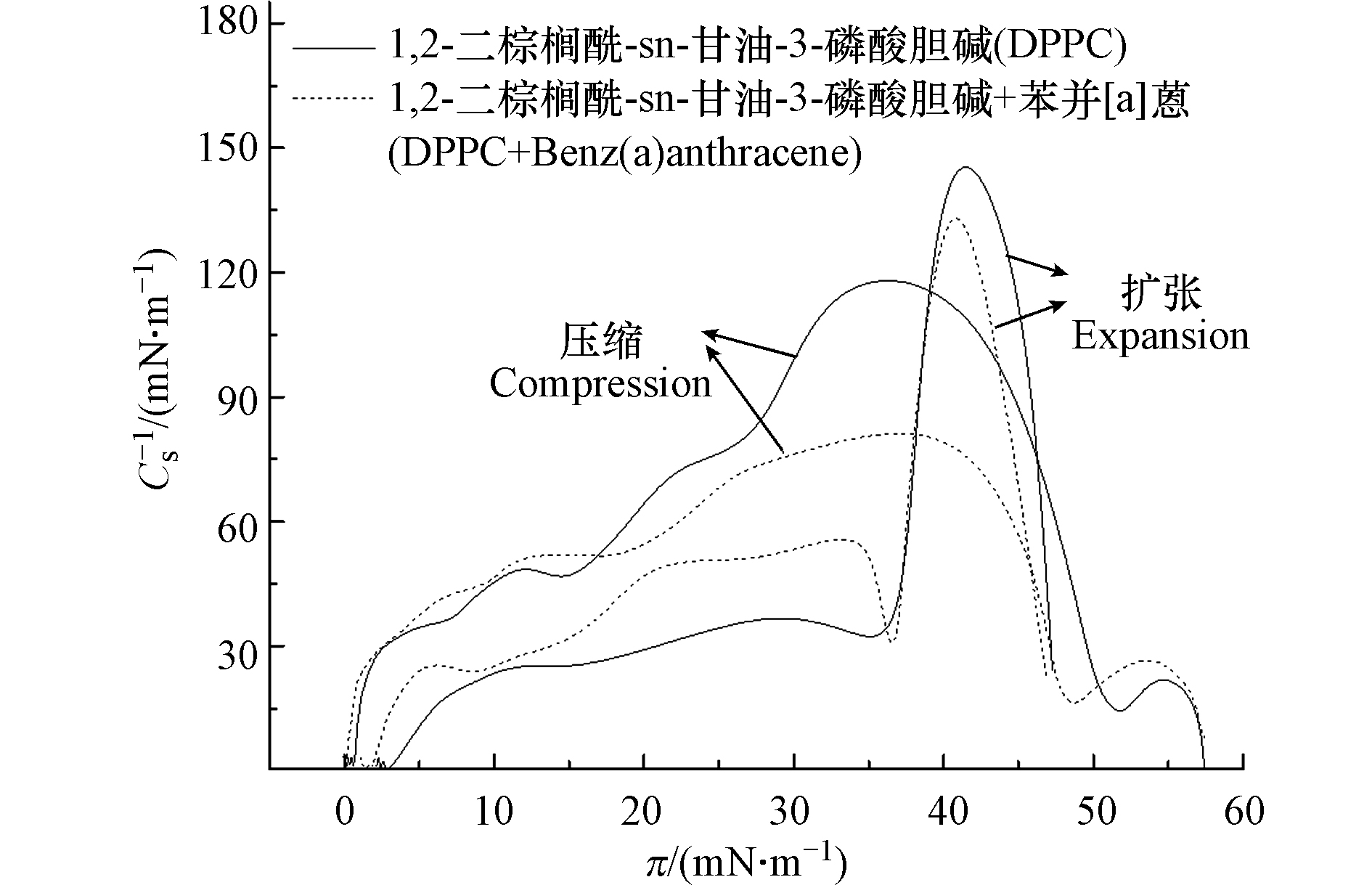
C−1S 是表征单层膜物理状态的重要参数。C−1S 可由公式(4)计算得出,值越大,表明膜的刚性越强。式中,π表示单分子膜的表面压力, A 表示分子面积, T 表示温度[38−39]。图4给出了单分子膜的弹性模量
C−1S 与表面压力π的关系。由图4可知,在压缩-扩张两阶段,DPPC单层膜的C−1S 值均呈现先增大后减小的趋势。加入苯并[a]蒽,C−1S 呈现出类似的变化趋势,并均在π=40 mN·m−1附近出现最大值。纯组分DPPC的C−1S 的值高达122.4 mN·m−1,说明在对抗外界压力下,DPPC单分子膜体现出较好的刚性及稳定性。不同的是压缩阶段,苯并[a]蒽存在下,弹性模量最大值为81.7 mN·m−1,降低了40 mN·m−1;而扩张阶段,C−1S 的值并没有因苯并[a]蒽而改变。由弹性模量结果可知,在压缩阶段,苯并[a]蒽对DPPC单分子膜弹性性能影响显著。这是由于苯并[a]蒽对DPPC膜造成扰动,影响了膜的流动性,削弱了膜的抗挤压能力。同时磷脂分子的流动性与其再扩散能力密切相关,流动性改变则膜的再扩散能力也会发生变化。这会造成呼吸循环过程中肺泡内部的表面压力松弛时间变化,不同区域、受不同剂量苯并[a]蒽影响的肺泡再扩展能力不同,影响肺泡收缩扩张的一致性。 -
BAM技术依据表面膜在不同相区时折光指数不同而有不同的反射强度,能直接观察气-液界面单分子层的形貌及相变,可实现单分子膜在液体中的动态原位观测。PS膜微观形貌与实验时的膜压有关,研究表明,单层膜在较高表面压力(π=30−35 mN·m−1)时接近真实的生物膜状态[13,40]。鉴于π-A等温线中,5 mN·m−1<π< 25 mN·m−1, 曲线“外扩”行为最为显著,本实验分别选择在π=20 mN·m−1、π=30 mN·m−1的膜压下,观察苯并[a]蒽对气-液界面处DPPC单分子膜微观形貌的影响。
由图5a可知,π=20 mN·m−1时,纯组分DPPC分子分布均匀,主要以液态扩张相存在。加入苯并[a]蒽后,DPPC分布不均匀,苯并[a]蒽附近区域分布密集,远离处分布稀疏,以区域性聚集的形式存在,如图5b、图5c所示。这是由于苯并[a]蒽的加入,对DPPC分子的排布产生了扰动,DPPC以区域性聚集的方式降低自由能,以达到一种稳态。在π=30 mN·m−1的恒定膜压下,纯DPPC分子膜排列致密有序,分布均匀、连续性好,呈现出典型的液态凝聚相特征,与上述π-A等温线的结果一致。在相同的表面压力下,随着苯并[a]蒽的添加,DPPC单分子膜的聚集程度减弱,个别区域DPPC排列疏松,呈现出液态扩张相,出现相的分离,如图5-e、图5-f所示。
由BAM原位形貌观察分析得出,气-液界面处苯并[a]蒽以团簇形式嵌入DPPC单层之间。苯并[a]蒽由于强疏水性,在气-液界面以相互聚集的形式存在,几个分子堆集在一起形成一个个团簇体(见图5b、图5e中白色亮斑区域)。从图5可以看出,团簇体的尺寸小至几百纳米大到20 μm。因为苯并[a]蒽具有强亲脂性,会和DPPC分子紧密结合、嵌入DPPC膜之间。这会导致靠近苯并[a]蒽区域DPPC分子较密集,远离区域DPPC分布稀疏、个别区域出现相的分离(图5f)。这一结果的出现可能由于苯并[a]蒽更倾向与DPPC分子的烷基链作用,插入于DPPC单层的烃链深处,由于较强的相互作用对DPPC造成束缚,磷脂分子流动性降低。BAM形貌观察可以详细获悉膜表面横向结构信息,为进一步深入分析苯并[a]蒽对DPPC分子结构构象以及在气-液界面亲水头部和疏水尾部的影响,借助激光共聚焦显微拉曼光谱进行分析。
-
拉曼光谱对研究分子内和分子间的相互作用非常敏感,是研究磷脂膜结构和构象变化的有力工具[41−42]。利用共聚焦显微拉曼光谱进一步研究苯并[a]蒽对DPPC单层膜结构的影响,通过分析极性头部区域C—N伸缩(650—850 cm−1)、疏水烷基链C—C伸缩(1000—1600 cm−1)以及C—H伸缩(2800—3000 cm−1)等几种振动模式,进一步揭示DPPC分子的构象变化信息,阐明苯并[a]蒽对DPPC分子的作用机制。DPPC分子的拉曼光谱特征峰归属情况如表2所示[43−44]。
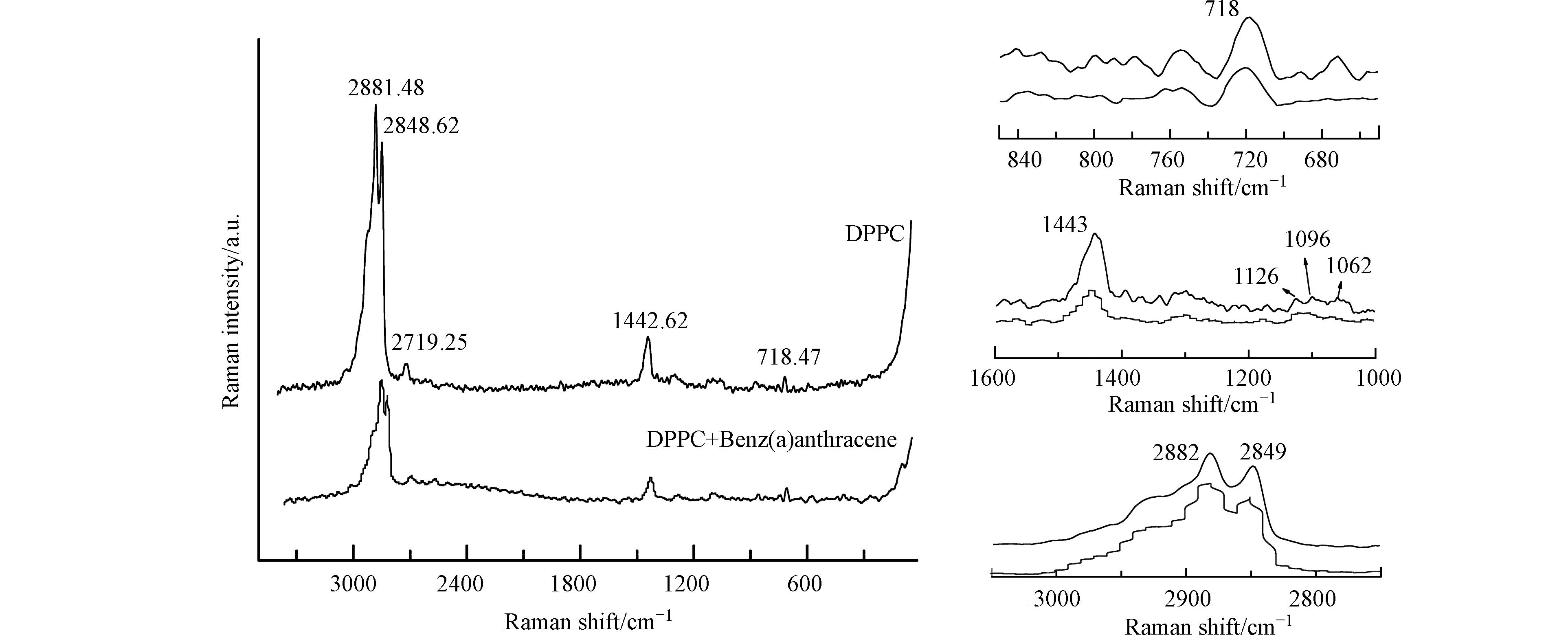
DPPC分子在650—850cm−1、1000—1600 cm−1、2800—3100 cm−1的拉曼光谱如图6所示。当DPPC极性头部的O—C—C—N+骨架处于旁式构象时,C—N伸缩振动出现在718 cm−1;处于反式构象时,则在770 cm−1出现振动峰[44−45]。加入苯并[a]蒽后,718 cm−1峰保持不变,在770 cm−1处没有出现振动峰,说明苯并[a]蒽并未造成DPPC分子极性头部骨架构象的改变,极性头部平行于DPPC单分子膜的表面。光谱区1000—1200 cm−1范围内代表C—C骨架的伸缩振动,可用来表征磷脂烷基链的反式/旁式构象变化。面内和面外的C—C伸缩振动主要表现为1062 cm−1、l096 cm−1、1126 cm−1的3个峰。1062 cm−1和1126 cm−1处的振动归因于烷基链C—C骨架反式构象的拉伸振动,分别为全反式振动的B1g和Ag模式。1096 cm−1归因于烷基链C—C骨架的旁式构象的振动模式[44, 46]。
通常用I1096/1126和I1096/1062表示脂链的无序程度。由表3可以看出,苯并[a]蒽的加入,I1096/1126降低,说明脂链中C—C骨架的旁式构象减少,脂链的有序性增强。I1096/1062增加,说明全反式脂链片段振动的B1g模式增强。I2849/2882降低,说明脂链侧向耦合能力降低,有序性增强。亚甲基C—H键伸缩振动出现在2750—3000 cm−1区域内,2849 cm-1和2882 cm−1分别为DPPC分子中亚甲基的对称和反对称伸缩振动,峰值比I2849/2882是表征C—H链间和链内有序-无序过程的灵敏指标,常用I2849/2882表征脂链侧向耦合能力以及有序-无序排列[43, 47]。从表3可以看出,加入苯并[a]蒽后I2849/2882降低,说明苯并[a]蒽分子的加入增加了侧链间的有序性排列,膜的流动性减弱。
拉曼光谱结果表明苯并[a]蒽的加入对DPPC分子极性头部构象未造成影响,极性头部仍然平行于膜表面。对疏水烷基链C—C骨架作用明显,脂链中有序构象增多,有序性增强。同时亚甲基C—H伸缩振动表明侧链间的相互作用减弱,进一步说明苯并[a]蒽的加入降低了DPPC膜分子的流动性。结合布儒斯特角实验结果可以推断,苯并[a]蒽对DPPC单层膜的作用主要体现在苯并[a]蒽对DPPC分子烷基链的作用,作用过程如图7所示。由于高亲脂性,处于气-液界面的苯并[a]蒽优先于疏水烷基链结合,在较强作用力影响下,DPPC在靠近苯并[a]蒽区域紧密聚集,限制磷脂分子的自由移动。而远离苯并[a]蒽区域,DPPC分子量减少,单分子所占面积增大,DPPC尾链之间的范德华引力较弱[18,48],由液态凝聚相转为液态扩张相。在苯并[a]蒽影响下,磷脂分子呈现不均匀排布,进一步导致膜的稳定性减弱即弹性模量降低。这一负面效应并没有对DPPC的亲水头部基团造成影响,极性头部仍平行于DPPC单分子膜的表面。
-
本文主要研究了苯并[a]蒽对肺表面活性物质的表面活性单层的界面化学性质的影响。综合分析上述实验结果,可得如下结论:
(1)苯并[a]蒽可显著影响DPPC单层的压缩扩张循环曲线,表面压-面积等温线向高的分子面积区域移动。DPPC单层的相行为发生改变,主要体现在低表面压力下的液态扩张及液态凝聚相阶段。
(2)苯并[a]蒽对DPPC单分子膜弹性性能影响显著,可明显削弱膜的稳定性及抗形变能力,这一影响主要体现在压缩阶段。
(3)在接近真实生物膜状态下,苯并[a]蒽的扰动会导致靠近苯并[a]蒽区域DPPC分子排列紧密,远离区域单层膜排列疏松,对单层膜整体有序聚集造成影响。
(4)苯并[a]蒽对DPPC分子的作用主要体现为对疏水烷基链C—C骨架及C—H伸缩振动造成影响,使得脂链有序构象增多、膜的流动性减弱。
以上结果对于研究多环芳烃暴露的肺健康风险评价具有十分重要的意义。一方面苯并[a]蒽会导致DPPC单分子膜呼吸循环扩张的稳定性及液态凝聚阶段液态凝聚膜的形成,使呼吸功增加,影响肺通气的顺应性。另一方面,苯并[a]蒽在气-液界面与DPPC分子的结合对苯并[a]蒽在肺部的迁移、归趋造成影响,造成苯并[a]蒽在磷脂层的沉积时间变长。同时团簇体的形成可能影响呼吸性颗粒表面携带的苯并[a]蒽迁移,加速苯并[a]蒽从细颗粒物上转移到肺表面活性组分中。这将导致更多的苯并[a]蒽沉积于肺泡,形成恶性循环,最终影响呼吸相关活性功能的发挥甚至造成肺功能紊乱。
典型多环芳烃对肺表面活性组分界面化学性质的影响
Effects of typical polycyclic aromatic hydrocarbons on the interface chemical properties of pulmonary surfactant
-
摘要: 多环芳烃由于其高亲脂性,随呼吸到达肺部可在深肺区沉积,并与覆盖于肺泡内衬层的肺表面活性物质接触并反应,进而影响肺表面活性物质的界面活性。选取典型多环芳烃苯并[a]蒽为研究对象,研究其对气-液界面处DPPC单分子膜界面化学性质的影响,以此来探究多环芳烃对肺功能的毒性行为。采用Langmuir膜天平获得DPPC单分子膜的压缩-扩张循环曲线;通过弹性模量分析苯并[a]蒽对单分子膜弹性性能的影响;借助布儒斯特角显微镜,对DPPC单分子膜的微观形貌进行原位观测;通过激光共聚焦显微拉曼光谱分析苯并[a]蒽对DPPC分子内部结构的影响。结果表明,苯并[a]蒽可显著影响磷脂单层的相行为,表面压-面积等温线向高的分子面积区域移动,在压缩阶段,膜的刚性及稳定性减弱。布儒斯特角原位实验表明,苯并[a]蒽以嵌入的形式存在于DPPC单层之间,DPPC单分子膜分布不均,靠近苯并[a]蒽区域较密集,远离区域排列疏松、出现相的分离。拉曼光谱进一步说明,苯并[a]蒽影响DPPC分子疏水烷基链C—C及C—H的伸缩振动,造成脂链有序构象增多、膜的流动性减弱,进而影响呼吸相关功能的发挥。
-
关键词:
- 多环芳烃 /
- 1, 2-二棕榈酰-sn-甘油-3-磷酸胆碱 /
- 肺表面活性剂 /
- 界面化学性质 /
- 微观形貌
Abstract: Polycyclic aromatic hydrocarbons (PAHs) are highly hydrophobic, thus on first contacting with pulmonary surfactant, they will accumulate in the monolayer, leading to pulmonary surfactant malfunctioning and respiratory disorders. 1,2-dipalmitoyl-sn-glycero -3-phospho-choline (DPPC) is the main active component of pulmonary surfactant, and it is usually used as the mimic and substitute of pulmonary surfactant. The effect of benz[a]anthracene on the interface chemical properties of DPPC monolayers at the gas-liquid interface was investigated. The compression expansion cycle curves of DPPC monolayers were obtained by Langmuir membrane balance; the effect of benz[a]anthracene on the elastic properties of DPPC monolayers was analyzed by elastic modulus; the micro morphology of DPPC monolayers was observed by Brewster angle microscope; the internal structure of DPPC was analyzed by laser confocal micro Raman spectroscopy. The results show that the presence of benz[a]anthracene can cause the surface pressure area isotherm to move to the region with high molecular area, reduce the aggregation degree of DPPC monolayers, and loose arrangement of individual regions, resulting in phase separation. Raman spectra further showed that benz[a]anthracene affected the stretching vibration of hydrophobic alkyl chain C—C and C—H of DPPC molecule, resulting in the increase of ordered conformation of lipid chain and the decrease of membrane fluidity, which further affected the respiratory related function. -
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是挥发性或半挥发性碳氢化合物,由生物质、石化燃料等有机物不完全燃烧产生[1],是一类广泛存在于大气降尘中的持久性有机污染物[2],其易在含有脂肪的组织和器官中生物蓄积,且具有持久性、致畸致癌性,是一类高毒性环境污染物[3−4]。PAHs可随呼吸吸入进入人体、到达人体深肺区,由呼吸暴露导致的终生致癌风险(incremental lifetime cancer risk,ILCR),全球平均值为3.1×10−5[5−6]。参照国际癌症研究署给出的污染物致癌毒性判定,苯并[a]蒽是一种具有致癌效应[7]的典型PAHs。
外源污染物进入肺泡首先与覆盖于肺泡内衬层的肺表面活性物质(pulmonary surfactant, PS)接触,PS是抵御污染物进入血液循环系统的最后一道屏障[8]。PS主要由肺泡II型上皮细胞合成和分泌,是一种具有特殊生物活性的复合物,能有效降低肺泡表面张力,防止肺泡在呼气的最后阶段发生塌陷[9−10]。1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(1,2-dipalmitoyl-sn-glycero-3- phosphocholine,DPPC)是PS发挥生物活性最重要的物质基础,通常作为体外研究PS的模拟物和替代物[11−13]。
PAHs经呼吸到达肺部,可与PS发生作用[14]。Sosnowski等[15]通过分子动力学模拟研究发现苯并[a]芘会诱导磷脂膜表面活性的异常并降低其流动性。Liland等[16]研究了菲、萘、苯并[a]芘3种PAHs对磷脂膜相行为的影响,结果表明苯并[a]芘对磷脂膜的液相有序相具有亲和力,能降低DPPC囊泡从固体到液晶相转变时的转变温度和焓值。Zhao等[17]发现Curosurf(肺表面活性物质制剂)与菲在纳米管上的吸附存在相互竞争作用,彼此起到一定的抑制作用。Beata等[18]借助分子动力学模拟研究了苯并[a]芘对肺表面活性物质单分子膜性质的影响,结果表明苯并[a]芘会对磷脂单层造成破坏,降低磷脂亲水区的水化作用。关于PAHs对肺表面活性剂的毒性行为,目前主要集中在分子动力学模拟,虽然可以证实PAHs能导致各种负面的呼吸系统效应,但PAHs暴露与肺功能下降之间的关系证据仍不充分,二者间的界面化学作用有待进一步确立和完善。
鉴于此,本文选取DPPC及PAHs中具有代表性的苯并[a]蒽[7,19−20]作为研究对象,进一步探究PAHs与PS相互作用的界面化学特征。通过表面张力仪,分析苯并[a]蒽对DPPC降低气-液界面张力性能的影响。借助Langmuir-Wilhelmy膜天平对肺呼吸循环进行体外模拟,获取DPPC的压缩-扩张循环曲线,结合弹性模量观测苯并[a]蒽存在/不存在情况下DPPC压缩及扩张性能。通过布儒斯特角显微镜(brewster angle microscopy,BAM),对DPPC单分子膜的微观形貌进行原位观察,借助激光共聚焦显微拉曼光谱分析苯并[a]蒽对DPPC分子内部结构构象的影响, 进一步揭示苯并[a]蒽对DPPC单分子膜的影响机制。这项研究旨在从微观角度分析PAHs对肺表面活性物质的负面效应,以期对后续学者研究PAHs的肺部毒理行为给予一定的参考及启示。
1. 实验部分(Experimental section)
1.1 实验材料
1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(DPPC,纯度≥99%)购自Sigma公司;苯并[a]蒽(Benz(a)anthracene),购自百灵威科学有限公司(北京);氯仿、无水乙醇、氯化钠均为分析纯,购自成都市科龙化工试剂厂;实验用水均为超纯水,其室温下的电阻率为18.25 MΩ·cm。以生理盐水(0.9%NaCl溶液)作为所有实验的亚相溶液。
DPPC分子式为C40H80NO8P,分子量734.04。苯并[a]蒽分子式C18H12,分子量:228.29。DPPC及苯并[a]蒽分子结构如下:

1.2 实验设备
电子天平(AL204,Mettle Toledo,美国);超纯水仪(EU-K1-10TY,南京欧凯环境);超声波清洗仪(SK06G,上海科导);自动表面张力仪(BZY,上海方瑞仪器有限公司);多功能Langmuir-Wilhelmy膜天平(JML04C2,上海中晨数字技术设备有限公司);布儒斯特角显微镜(Nanofilm-EP4 BAM,Accurion GmbH,德国);激光共聚焦显微拉曼光谱仪(DXRxi,ThermoScientific,美国)。
1.3 实验方法
1.3.1 DPPC膜表面张力的测定
通过白金板法测定苯并[a]蒽对DPPC膜表面张力的影响。用0.9%氯化钠溶液为亚相溶液,将DPPC、苯并[a]蒽分别溶于氯仿[14]中,制备出浓度为1.0 mmol·L−1的DPPC及摩尔比为8∶1的DPPC/苯并[a]蒽混合膜液,待测。配制含有(18—25) mg/25 mL的DPPC/氯仿溶液作为储备膜液。将一定量的亚相溶液加入自动表面张力仪配套的液槽中,在气-液界面用汉密尔顿微量注射器滴加适量膜液,待15—20 min氯仿挥发完毕,测定气-液界面的表面张力。以DPPC表面铺展量(单位面积的气-液界面所含的DPPC的物质的量,单位10−3 mmol·m−2)为横坐标、DPPC膜的表面张力为纵坐标,绘制苯并[a]蒽对DPPC膜表面张力的影响曲线。
实验中苯并蒽浓度的确定主要基于以下两点:1、污染物浓度较小(在PAHs污染的大气环境中如受机动车尾气污染的空气,经人体吸入并在肺泡内积累的PAHs经估算以ng·min−1为参考[15,21]),会使苯并[a]蒽分子数量太少,实验结果不明显。2、长期暴露于被污染的空气中,疏水性苯并[a]蒽可能在磷脂层中累积,造成局部高浓度苯并[a]蒽的存在。因此选取DPPC/苯并[a]蒽摩尔比8:1作为实验浓度,将有利于短期内明显实验现象的获取,以明确阐释苯并[a]蒽对DPPC膜的不利反应。
1.3.2 表面压-面积等温线的测定
表面压-面积(π-A)等温线通过配备有液槽(聚四氟乙烯材质,有效面积280 mm×100 mm)和恒温装置(温度控制在(37 ± 0.5)℃)的Langmuir-Wilhelmy膜天平进行测量。该系统配备了超灵敏的表面压力传感器,并采用两个对称移动的屏障对空气-水界面的磷脂单分子膜进行压缩。实验开始前,依次用二氯甲烷和超纯水清洗液槽以确保液槽的干净。将260 mL的亚相溶液倒入液槽中,用汉密尔顿微量注射器滴加适量的磷脂/氯仿膜液于空气-水界面[22−23]。静置15—20 min待氯仿挥发完毕、磷脂单分子膜完全铺展,控制滑障以15.5 mm·min−1 的速率开始对称压缩,直至表面积剩下10%,同时设备将自动获取表面压力与表面积的关系曲线,即可得到相应的磷脂单分子膜表面π-A等温线。每次测量后,完全移除亚相溶液并彻底清洁滑障、铂片和液槽。通过水浴恒温装置,控制实验温度为(37±0.5)℃。所有的实验至少测量3次以确保其重现性。
1.3.3 BAM测定
PS膜微观形貌原位观测借助BAM仪器进行[24−25],该仪器配备有波长为658 nm的50 mW激光发射p偏振光、10倍放大物镜、偏振器、分析仪和CCD摄像机。实验用聚四氟乙烯原位槽测定,将适量的亚相溶液加入到液槽中,并放置在防振台上。如π-A等温线实验所述,亚相为生理盐水,在气-液界面上滴加适量的磷脂膜液,待膜液中的氯仿挥发完毕后,激光束以布儒斯特角a入射到空气-水界面。折射光束携带超过99%的入射能量,被放置在槽底部的一块黑色玻璃吸收。同时,通过布儒斯特角显微镜观察常压(π=20 mN·m−1、π=30 mN·m−1)条件下,气-液界面处存在/不存在苯并[a]蒽时DPPC单分子膜的微观结构。
1.3.4 激光共聚焦显微拉曼光谱检测
分别将适量的DPPC膜液及摩尔比为8:1的DPPC/苯并[a]蒽混合膜液铺于空气-水界面,待氯仿挥发完毕,利用激光共聚焦显微拉曼光谱仪在常温下检测DPPC分子的构象变化信息。 激光器633 nm激发波长,激光功率6.8 mW,曝光时间0.00833 s,扫描次数900,50 μm共聚焦针孔模式。
2. 结果与讨论(Results and discussion)
2.1 苯并[a]蒽对DPPC膜表面张力的影响
PS可显著降低肺泡的表面张力,对维持肺泡稳定、减少呼吸功十分重要,是其界面活性的重要指标之一 [26−27]。由图1可知,DPPC可显著降低气-液界面表面张力,随着DPPC铺展量的增多,水的表面张力逐渐降低并最终趋于平稳。说明当C=3.5×10−3 mmol·m−2,DPPC在气-液界面的表面富集量趋于饱和。膜液中加入苯并[a]蒽,表面张力下降,当膜液加入量为5.25×10−3 mmol·m−2时,表面张力由26.7 mN·m−1降低为18.9 mN·m−1。
PS在表面膜上降低表面张力的量,可以用表面压力(π)表示,二者间的关系可用下式表示[27]:
π=γ0−γ (1) 式中,γ0指亚相生理盐水的气-液界面表面张力,37 ℃ 生理盐水的表面张力约为72.3 mN·m−1;γ指DPPC膜铺展于亚相表面时的表面张力;π指DPPC单分子膜的表面压力。
苯并[a]蒽造成DPPC单分子膜表面张力降低,说明苯并[a]蒽的存在,膜的表面压力增加,如图2所示。这说明苯并蒽以一种特殊的方式存在于DPPC分子之间,二者间的相互作用削弱了DPPC分子间的相互吸引。为进一步分析呼吸时单分子膜循环压缩-扩张过程中,苯并[a]蒽对DPPC膜表面压力的影响,通过下述Langmuir–Wilhelmy膜天平实验获取π-A等温线,对膜表面压力变化做系统性分析[28−31],以期阐明苯并[a]蒽对DPPC膜分子的作用细节。
2.2 苯并[a]蒽对DPPC单分子膜π-A等温线的影响
π-A等温线是表征肺表面活性物质呼吸活性的重要指标,直观的体现了较宽的表面压力下单分子膜压缩、扩张过程的物理化学性质变化,通过等温线可获得单分子膜的物理变化特征等信息[32−33]。图3给出了苯并[a]蒽存在/不存在条件下,DPPC单分子膜π-A等温线的变化。由图3可知,整个压缩过程中,DPPC单分子膜的π-A等温线主要呈现液态扩张相和液态凝聚相, 与前人研究一致[34−35]。苯并[a]蒽的加入,π-A等温线呈现出明显的“外扩”行为,即在同样的表面积下,混合组分的表面张力,明显高于纯组分DPPC单分子膜,等温线向高分子面积区域移动。当5 mN·m−1<π<25 mN·m−1, 曲线“外扩”行为最为显著,随着压缩进一步推进,两条曲线逐渐靠近,并在固相阶段基本重合,直至扩张阶段结束。
滞回曲线是DPPC单分子膜的一个重要特征,反映了呼吸功能活性的相关信息[36]。使用以下定量标准进行评估:归一化滞回面积(normalized hysteresis area,HAn)见公式(2),稳定性指数(Stability index, SI)见公式(3)。
HAn=[∫πdA]1−[∫πdA]2Amax−Amin (2) SI=πmax−πmin12(πmax+πmin) (3) SI表示单分子膜降低界面表面张力的效果,SI值越高,代表单分子膜越稳定,表面活性越好[24,37]。式中,Amax:滞回环中DPPC分子所占的最大面积;Amin:滞回环中DPPC分子所占的最小面积;πmax:滞回环中DPPC分子间最大表面压力;πmin:滞回环中DPPC分子间最小表面压力。
由完整的滞回曲线可以看出,两个滞回环呈现出相似的特征,扩张曲线均在压缩曲线的下方,并出现较大的分离,近似呈封闭、两端尖的长梭形状,且滞回面积明显增大。“回线”的存在说明DPPC分子被紧密压缩后,以某种方式缔合,而在扩张阶段,缔合体并不解离[38]。苯并[a]蒽存在下,π-A等温线向高分子面积区域移动,说明苯并[a]蒽的存在使DPPC分子间引力减弱,相互排斥作用增强。而这种不利影响随着压缩过程的进行,被较强的外界压力逐渐抵消,对DPPC固相膜的形成不会造成显著影响。由表1可知,苯并[a]蒽的加入使DPPC单分子膜的最大表面压力(πmax)降低,由58.17 mN·m−1降低为57.52 mN·m−1。
表 1 DPPC单分子膜滞回曲线的定量分析Table 1. Comparison of quantitative criteria ( HAn, SI ) used for evaluation of the DPPC monolayersπmax/(mN·m−1) πmin/(mN·m−1) Amax/nm2 Amin/nm2 HAn/(mN·m−1) SI 1,2-二棕榈酰-sn-甘油-3-磷酸胆碱 (DPPC) 58.17 1.33 1.16 0.18 22.87 1.91 1,2-二棕榈酰-sn-甘油-3-磷酸胆碱+苯并[a]蒽(DPPC+Benz(a)anthracene) 57.52 1.44 1.29 0.19 22.48 1.90 πmax代表磷脂膜被压缩到崩解时产生最大降低表面张力的能力[27],πmax值的大小与肺功能的正常发挥有重要联系。πmax降低说明苯并[a]蒽的存在导致了DPPC膜对抗外界强力压缩的能力降低,一定区域的界面对DPPC分子的容纳能力减弱,DPPC分子将提前被挤出。同时在苯并[a]蒽影响下归一化滞回面积HAn及稳定性指数SI有小幅度的衰减,说明苯并[a]蒽的加入使膜的稳定性降低。滞回环面积反映了单分子膜的能量耗散能力,说明苯并[a]蒽存在下,DPPC单分子膜在压缩-扩张过程中,能量耗散增大。由于Langmuir膜是处于亚稳态的动态体系,内部不断产生熵,为了形成有序致密的DPPC液态凝聚膜需不断地从外界引入负熵流。这一作用使呼吸过程尤其是呼气过程中呼吸功增加。由于部分呼吸功用于对抗表面张力和扩张肺泡,因此能量耗散增大会影响肺泡与肺泡之间的稳定性以及肺通气的顺应性。
2.3 苯并[a]蒽对DPPC单分子膜压缩模量的影响
压缩系数CS或压缩模量
C−1S C−1S C−1S=−A(dπdA)T (4) 图4给出了单分子膜的弹性模量
C−1S C−1S C−1S C−1S C−1S 2.4 苯并[a]蒽对DPPC单分子膜原位微观形貌的影响
BAM技术依据表面膜在不同相区时折光指数不同而有不同的反射强度,能直接观察气-液界面单分子层的形貌及相变,可实现单分子膜在液体中的动态原位观测。PS膜微观形貌与实验时的膜压有关,研究表明,单层膜在较高表面压力(π=30−35 mN·m−1)时接近真实的生物膜状态[13,40]。鉴于π-A等温线中,5 mN·m−1<π< 25 mN·m−1, 曲线“外扩”行为最为显著,本实验分别选择在π=20 mN·m−1、π=30 mN·m−1的膜压下,观察苯并[a]蒽对气-液界面处DPPC单分子膜微观形貌的影响。
由图5a可知,π=20 mN·m−1时,纯组分DPPC分子分布均匀,主要以液态扩张相存在。加入苯并[a]蒽后,DPPC分布不均匀,苯并[a]蒽附近区域分布密集,远离处分布稀疏,以区域性聚集的形式存在,如图5b、图5c所示。这是由于苯并[a]蒽的加入,对DPPC分子的排布产生了扰动,DPPC以区域性聚集的方式降低自由能,以达到一种稳态。在π=30 mN·m−1的恒定膜压下,纯DPPC分子膜排列致密有序,分布均匀、连续性好,呈现出典型的液态凝聚相特征,与上述π-A等温线的结果一致。在相同的表面压力下,随着苯并[a]蒽的添加,DPPC单分子膜的聚集程度减弱,个别区域DPPC排列疏松,呈现出液态扩张相,出现相的分离,如图5-e、图5-f所示。
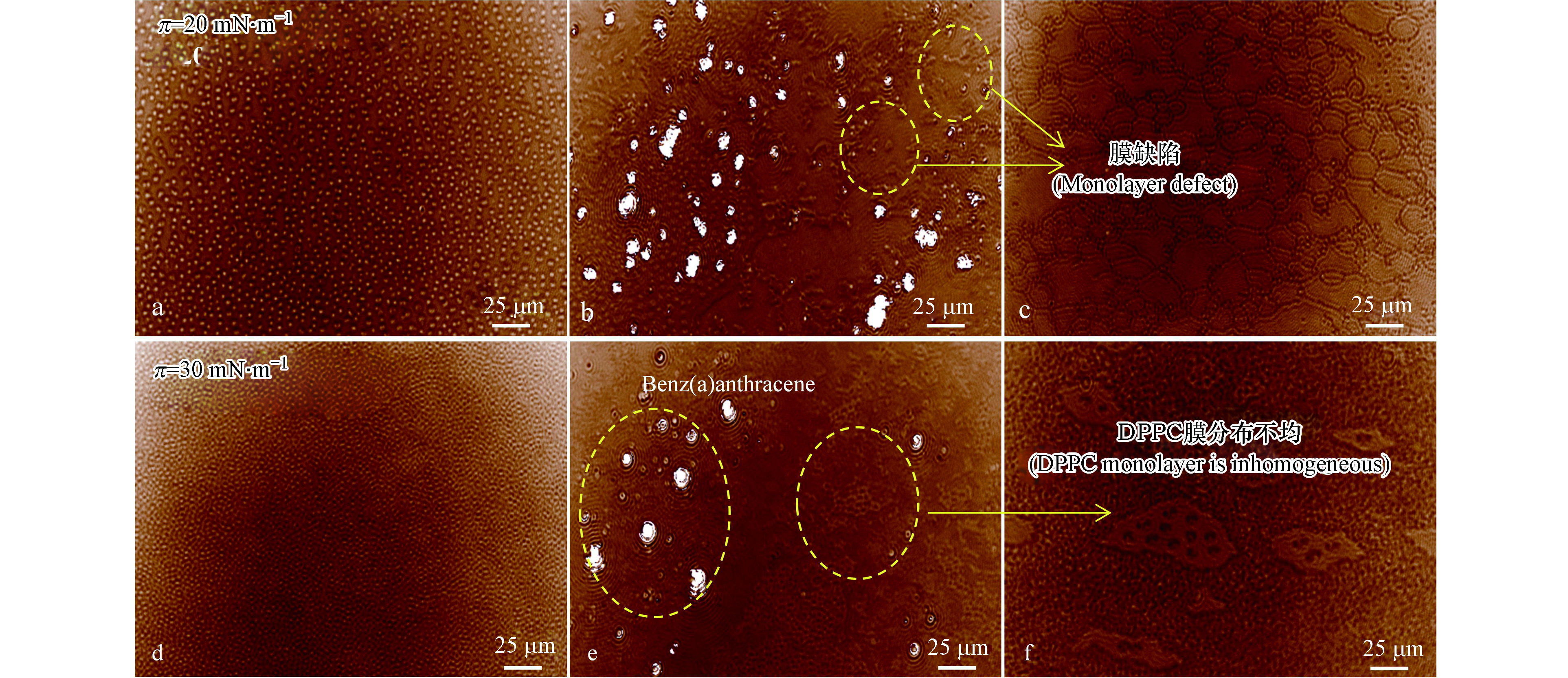 图 5 气-液界面处存在/不存在苯并[a]蒽时DPPC的原位微观形貌Figure 5. BAM micrographs of air-liquid interface for DPPC/Benz (a) anthracene monolayers.a: π=20 mN·m−1,纯组分DPPC单分子膜;b、c : π=20 mN·m−1,苯并[a]蒽存在下DPPC单分子膜;d: π=30 mN·m−1,纯组分DPPC单分子膜;e、f : π=30 mN·m−1,苯并[a]蒽存在下DPPC单分子膜.a: π=20 mN·m−1, pure component DPPC monolayers; b、c : π=20 mN·m−1, DPPC monolayers in the presence of benzo[a] anthracene;d: π=30 mN·m−1, pure component DPPC monolayers; e、f : π=30 mN·m−1,DPPC monolayers in the presence of benzo[a] anthracene.
图 5 气-液界面处存在/不存在苯并[a]蒽时DPPC的原位微观形貌Figure 5. BAM micrographs of air-liquid interface for DPPC/Benz (a) anthracene monolayers.a: π=20 mN·m−1,纯组分DPPC单分子膜;b、c : π=20 mN·m−1,苯并[a]蒽存在下DPPC单分子膜;d: π=30 mN·m−1,纯组分DPPC单分子膜;e、f : π=30 mN·m−1,苯并[a]蒽存在下DPPC单分子膜.a: π=20 mN·m−1, pure component DPPC monolayers; b、c : π=20 mN·m−1, DPPC monolayers in the presence of benzo[a] anthracene;d: π=30 mN·m−1, pure component DPPC monolayers; e、f : π=30 mN·m−1,DPPC monolayers in the presence of benzo[a] anthracene.由BAM原位形貌观察分析得出,气-液界面处苯并[a]蒽以团簇形式嵌入DPPC单层之间。苯并[a]蒽由于强疏水性,在气-液界面以相互聚集的形式存在,几个分子堆集在一起形成一个个团簇体(见图5b、图5e中白色亮斑区域)。从图5可以看出,团簇体的尺寸小至几百纳米大到20 μm。因为苯并[a]蒽具有强亲脂性,会和DPPC分子紧密结合、嵌入DPPC膜之间。这会导致靠近苯并[a]蒽区域DPPC分子较密集,远离区域DPPC分布稀疏、个别区域出现相的分离(图5f)。这一结果的出现可能由于苯并[a]蒽更倾向与DPPC分子的烷基链作用,插入于DPPC单层的烃链深处,由于较强的相互作用对DPPC造成束缚,磷脂分子流动性降低。BAM形貌观察可以详细获悉膜表面横向结构信息,为进一步深入分析苯并[a]蒽对DPPC分子结构构象以及在气-液界面亲水头部和疏水尾部的影响,借助激光共聚焦显微拉曼光谱进行分析。
2.5 苯并[a]蒽对DPPC分子结构的影响
拉曼光谱对研究分子内和分子间的相互作用非常敏感,是研究磷脂膜结构和构象变化的有力工具[41−42]。利用共聚焦显微拉曼光谱进一步研究苯并[a]蒽对DPPC单层膜结构的影响,通过分析极性头部区域C—N伸缩(650—850 cm−1)、疏水烷基链C—C伸缩(1000—1600 cm−1)以及C—H伸缩(2800—3000 cm−1)等几种振动模式,进一步揭示DPPC分子的构象变化信息,阐明苯并[a]蒽对DPPC分子的作用机制。DPPC分子的拉曼光谱特征峰归属情况如表2所示[43−44]。
表 2 DPPC拉曼光谱特征峰指认Table 2. Raman spectral assignments of DPPC molecule峰位/cm−1 Raman shift 峰位指认 Raman spectral assignments 718 C—N伸缩振动,O—C—C—N+旁式构象Headgroup CN-Stretch 770 C—N伸缩振动,O—C—C—N+反式构象Trans CN-Stretch 1062 C—C伸缩振动,全反式脂链片段振动的B1g模式Trans Sym. C-C Stretch 1096 C—C反对称伸缩振动,旁式构象Gauche CC-Stretch 1126 C—C伸缩振动,全反式脂链片段振动的Ag模式Trans Asym.CC Stretch 2849 C—H 对称伸缩振动Sym.CH-Stretch 2882 C—H 反对称伸缩振动Asym.CH-Stretch DPPC分子在650—850cm−1、1000—1600 cm−1、2800—3100 cm−1的拉曼光谱如图6所示。当DPPC极性头部的O—C—C—N+骨架处于旁式构象时,C—N伸缩振动出现在718 cm−1;处于反式构象时,则在770 cm−1出现振动峰[44−45]。加入苯并[a]蒽后,718 cm−1峰保持不变,在770 cm−1处没有出现振动峰,说明苯并[a]蒽并未造成DPPC分子极性头部骨架构象的改变,极性头部平行于DPPC单分子膜的表面。光谱区1000—1200 cm−1范围内代表C—C骨架的伸缩振动,可用来表征磷脂烷基链的反式/旁式构象变化。面内和面外的C—C伸缩振动主要表现为1062 cm−1、l096 cm−1、1126 cm−1的3个峰。1062 cm−1和1126 cm−1处的振动归因于烷基链C—C骨架反式构象的拉伸振动,分别为全反式振动的B1g和Ag模式。1096 cm−1归因于烷基链C—C骨架的旁式构象的振动模式[44, 46]。
通常用I1096/1126和I1096/1062表示脂链的无序程度。由表3可以看出,苯并[a]蒽的加入,I1096/1126降低,说明脂链中C—C骨架的旁式构象减少,脂链的有序性增强。I1096/1062增加,说明全反式脂链片段振动的B1g模式增强。I2849/2882降低,说明脂链侧向耦合能力降低,有序性增强。亚甲基C—H键伸缩振动出现在2750—3000 cm−1区域内,2849 cm-1和2882 cm−1分别为DPPC分子中亚甲基的对称和反对称伸缩振动,峰值比I2849/2882是表征C—H链间和链内有序-无序过程的灵敏指标,常用I2849/2882表征脂链侧向耦合能力以及有序-无序排列[43, 47]。从表3可以看出,加入苯并[a]蒽后I2849/2882降低,说明苯并[a]蒽分子的加入增加了侧链间的有序性排列,膜的流动性减弱。
表 3 苯并[a]蒽对DPPC拉曼光谱特征峰及峰高比的影响Table 3. Peak intensity ratios (Ia/Ib) corresponding to the DPPC/Benz (a) anthracene monolayers718 cm−1 770 cm−1 I1096/1126 I1096/1062 I2849/2882 1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(DPPC) 7.59 2.24 1.00 0.96 0.88 1,2-二棕榈酰-sn-甘油-3-磷酸胆碱+苯并[a]蒽(DPPC+Benz(a)anthracene) 4.48 1.79 0.80 1.11 0.83 拉曼光谱结果表明苯并[a]蒽的加入对DPPC分子极性头部构象未造成影响,极性头部仍然平行于膜表面。对疏水烷基链C—C骨架作用明显,脂链中有序构象增多,有序性增强。同时亚甲基C—H伸缩振动表明侧链间的相互作用减弱,进一步说明苯并[a]蒽的加入降低了DPPC膜分子的流动性。结合布儒斯特角实验结果可以推断,苯并[a]蒽对DPPC单层膜的作用主要体现在苯并[a]蒽对DPPC分子烷基链的作用,作用过程如图7所示。由于高亲脂性,处于气-液界面的苯并[a]蒽优先于疏水烷基链结合,在较强作用力影响下,DPPC在靠近苯并[a]蒽区域紧密聚集,限制磷脂分子的自由移动。而远离苯并[a]蒽区域,DPPC分子量减少,单分子所占面积增大,DPPC尾链之间的范德华引力较弱[18,48],由液态凝聚相转为液态扩张相。在苯并[a]蒽影响下,磷脂分子呈现不均匀排布,进一步导致膜的稳定性减弱即弹性模量降低。这一负面效应并没有对DPPC的亲水头部基团造成影响,极性头部仍平行于DPPC单分子膜的表面。
3. 结论(Conclusion)
本文主要研究了苯并[a]蒽对肺表面活性物质的表面活性单层的界面化学性质的影响。综合分析上述实验结果,可得如下结论:
(1)苯并[a]蒽可显著影响DPPC单层的压缩扩张循环曲线,表面压-面积等温线向高的分子面积区域移动。DPPC单层的相行为发生改变,主要体现在低表面压力下的液态扩张及液态凝聚相阶段。
(2)苯并[a]蒽对DPPC单分子膜弹性性能影响显著,可明显削弱膜的稳定性及抗形变能力,这一影响主要体现在压缩阶段。
(3)在接近真实生物膜状态下,苯并[a]蒽的扰动会导致靠近苯并[a]蒽区域DPPC分子排列紧密,远离区域单层膜排列疏松,对单层膜整体有序聚集造成影响。
(4)苯并[a]蒽对DPPC分子的作用主要体现为对疏水烷基链C—C骨架及C—H伸缩振动造成影响,使得脂链有序构象增多、膜的流动性减弱。
以上结果对于研究多环芳烃暴露的肺健康风险评价具有十分重要的意义。一方面苯并[a]蒽会导致DPPC单分子膜呼吸循环扩张的稳定性及液态凝聚阶段液态凝聚膜的形成,使呼吸功增加,影响肺通气的顺应性。另一方面,苯并[a]蒽在气-液界面与DPPC分子的结合对苯并[a]蒽在肺部的迁移、归趋造成影响,造成苯并[a]蒽在磷脂层的沉积时间变长。同时团簇体的形成可能影响呼吸性颗粒表面携带的苯并[a]蒽迁移,加速苯并[a]蒽从细颗粒物上转移到肺表面活性组分中。这将导致更多的苯并[a]蒽沉积于肺泡,形成恶性循环,最终影响呼吸相关活性功能的发挥甚至造成肺功能紊乱。
-
表 1 DPPC单分子膜滞回曲线的定量分析
Table 1. Comparison of quantitative criteria ( HAn, SI ) used for evaluation of the DPPC monolayers
πmax/(mN·m−1) πmin/(mN·m−1) Amax/nm2 Amin/nm2 HAn/(mN·m−1) SI 1,2-二棕榈酰-sn-甘油-3-磷酸胆碱 (DPPC) 58.17 1.33 1.16 0.18 22.87 1.91 1,2-二棕榈酰-sn-甘油-3-磷酸胆碱+苯并[a]蒽(DPPC+Benz(a)anthracene) 57.52 1.44 1.29 0.19 22.48 1.90 表 2 DPPC拉曼光谱特征峰指认
Table 2. Raman spectral assignments of DPPC molecule
峰位/cm−1 Raman shift 峰位指认 Raman spectral assignments 718 C—N伸缩振动,O—C—C—N+旁式构象Headgroup CN-Stretch 770 C—N伸缩振动,O—C—C—N+反式构象Trans CN-Stretch 1062 C—C伸缩振动,全反式脂链片段振动的B1g模式Trans Sym. C-C Stretch 1096 C—C反对称伸缩振动,旁式构象Gauche CC-Stretch 1126 C—C伸缩振动,全反式脂链片段振动的Ag模式Trans Asym.CC Stretch 2849 C—H 对称伸缩振动Sym.CH-Stretch 2882 C—H 反对称伸缩振动Asym.CH-Stretch 表 3 苯并[a]蒽对DPPC拉曼光谱特征峰及峰高比的影响
Table 3. Peak intensity ratios (Ia/Ib) corresponding to the DPPC/Benz (a) anthracene monolayers
718 cm−1 770 cm−1 I1096/1126 I1096/1062 I2849/2882 1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(DPPC) 7.59 2.24 1.00 0.96 0.88 1,2-二棕榈酰-sn-甘油-3-磷酸胆碱+苯并[a]蒽(DPPC+Benz(a)anthracene) 4.48 1.79 0.80 1.11 0.83 -
[1] 郭瑾, 葛蔚, 柴超, 等. 化学工业区周边土壤中多环芳烃含量、来源及健康风险评估 [J]. 环境化学, 2018, 37(2): 296-309. GUO J, GE W, CHAI C, et al. Concentrations, sources, and health risk of polycyclic aromatic hydrocarbons in soils around chemical plants [J]. Environmental Chemistry, 2018, 37(2): 296-309(in Chinese).
[2] 麦麦提·斯马义, 帕丽达·牙合甫, 韩梦鑫, 等. 2017年春节前后乌鲁木齐市大气颗粒物中多环芳烃的污染特征、来源分析及健康风险评价 [J]. 环境化学, 2018, 37(11): 2433-2442. doi: 10.7524/j.issn.0254-6108.2018031301 MAI MAI TI·S M Y, PA LI DA·Y H F, HAN M X, et al. Characteristics, sources apportionment and toxicity assessment of polycyclic aromatic hydrocarbons in atmospheric particulate matters 2017 Chinese New Year in Urumqi [J]. Environmental Chemistry, 2018, 37(11): 2433-2442(in Chinese). doi: 10.7524/j.issn.0254-6108.2018031301
[3] LI W, WANG C, WANG H Q, et al. Atmospheric polycyclic aromatic hydrocarbons in rural and urban areas of Northern China [J]. Environmental Pollution, 2014, 192: 83-90. doi: 10.1016/j.envpol.2014.04.039 [4] KI-HYUN K, SHAMIN A J, EHSANUL K, et al. A review of airborne polycyclic aromatic hydrocarbons (PAHs) and their human health effects [J]. Environment International, 2013, 60: 71-80. doi: 10.1016/j.envint.2013.07.019 [5] 彭彬, 苏玉红, 杜伟, 等. 湖北农村燃柴和燃煤家庭大气多环芳烃污染特征和呼吸暴露风险 [J]. 生态毒理学报, 2018, l3(5): 171-181. doi: 10.7524/AJE.1673-5897.20180306002 PENG B, SU Y H, DU W, et a1. Household air pollution by polycyclic aromatic hydrocarbons in homes burning wood and coals and inhalation exposure risks in rural Hubei [J]. Asian Journal of Ecotoxicology, 2018, l3(5): 171-181(in Chinese). doi: 10.7524/AJE.1673-5897.20180306002
[6] SHEN H Z, TAO S, LIU J F, et al. Global lung cancer risk from PAH exposure highly depends on emission sources and individual susceptibility [J]. Scientific Reports, 2014, 10: 1-8. [7] 刘丹青, 朱梦杰, 汤琳. 多环芳烃的健康风险评价以及暴露参数的敏感性分析 [J]. 中国环境监测, 2019, 35(1): 75-82. LIU D Q, ZHU M J, TANG L. Health risk assessment and sensitivity analysis of exposure parameters for polycyclic aromatic hydrocarbons [J]. Environmental Monitoring of China, 2019, 35(1): 75-82(in Chinese).
[8] ZHAO Q, LI Y J, CHAI X L, et al. Interaction of inhalable volatile organic compounds and pulmonary surfactant: Potential hazards of VOCs exposure to lung [J]. Journal of Hazardous Materials, 2019, 369: 512-520. doi: 10.1016/j.jhazmat.2019.01.104 [9] KADOYA C, LEE B W, OGAMI A, et al. Analysis of pulmonary surfactant in rat lungs after inhalation of nanomaterials: Fullerenes, nickel oxide and multi-walled carbon nanotubes [J]. Nanotoxicology, 2016, 10(2): 194-203. [10] YUE T, WANG X, ZHANG X, et al. Molecular modeling of interaction between lipid monolayer and graphene nanosheets: Implications for pulmonary nanotoxicity and pulmonary drug delivery [J]. RSC Advances, 2015, 5(38): 30092-30106. doi: 10.1039/C5RA04922A [11] AGNIESZKA O, PAULINE D, TEREZA D, et al. Properties of lipid models of lung surfactant containing cholesterol and oxidized lipids: A mixed experimental and computational study [J]. Langmuir, 2020, 36: 1023-1033. doi: 10.1021/acs.langmuir.9b02469 [12] WANG F F, LIU J F, ZENG H B. Interactions of particulate matter and pulmonary surfactant: Implications for human health [J]. Advances in Colloid and Interface Science, 2020, 284: 102244. doi: 10.1016/j.cis.2020.102244 [13] EDUARDO G, LIBERO L, EVA S, et al. Effect of hydrophilic and hydrophobic nanoparticles on the surface pressure response of DPPC monolayers [J]. The Journal of Physical Chemistry C, 2011, 115: 21715-21722. doi: 10.1021/jp207713x [14] ZHAO Q, LI Y J, CHAI X L, et al. Interaction of pulmonary surfactant with silica and polycyclic aromatic hydrocarbons: Implications for respiratory health [J]. Chemosphere, 2019, 222: 603-610. doi: 10.1016/j.chemosphere.2019.02.002 [15] SOSNOWSKI T R, KOLINSKI M, GRADON L. Interactions of Benzo[a]pyrene and diesel exhaust particulate matter with the lung surfactant system [J]. Annals of Occupational Hygiene, 2011, 55(3): 329-338. [16] LILAND N S, SIMONSEN A C, DUELUND L, et al. Polyaromatic hydrocarbons do not disturb liquid-liquid phase coexistence, but increase the fluidity of model membranes [J]. Chemistry and Physics of Lipids, 2014, 184: 18-24. doi: 10.1016/j.chemphyslip.2014.08.004 [17] ZHAO J, WANGZ, MASHAYEKHI H, et al. Pulmonary surfactant suppressed phenanthrene adsorption on carbon nanotubes through solubilization and competition as examined by passive dosing technique [J]. Environment Science & Technology, 2012, 46: 5369-5377. [18] BEATA K, ANNA S K, JACEK K. The role of DPPG in lung surfactant exposed to benzo[a]pyrene [J]. Environmental Science:Processes & Impacts, 2019, 21(3): 438-445. [19] 杜士林, 丁婷婷, 董淮晋, 等. 沙颍河流域水环境中多环芳烃污染及风险评价 [J]. 农业环境科学学报, 2020, 39(3): 601-611. doi: 10.11654/jaes.2019-1211 DU S L, DING T T, DONG H J, et al. Pollution and ecological risk assessment of polycyclic aromatic hydrocarbons in the water environment of Shaying River Basin, China [J]. Journal of Agro-Environment Science, 2020, 39(3): 601-611(in Chinese). doi: 10.11654/jaes.2019-1211
[20] 周海军, 杜远江, 都达古拉, 等. 呼和浩特市冬季PMl0中多环芳烃的污染特征及来源解析 [J]. 环境化学, 2016, 35(8): 1707-1714. doi: 10.7524/j.issn.0254-6108.2016.08.2016010802 ZHOU H J, DU Y J, DUDA G L, et al. Characterization and surcer apportionment of polycyclic aromatic hydrocarbons bound to PM10 during winter in Hohhot [J]. Environmental Chemistry, 2016, 35(8): 1707-1714(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.08.2016010802
[21] TOMASZ R S, MICHAL K, LEON G. Alteration of surface properties of dipalmitoyl phosphatidylcholine by Benzo[a]pyrene: A model of pulmonary effects of diesel exhaust inhalation [J]. Journal of Biomedical Nanotechnology, 2012, 8: 818-825. doi: 10.1166/jbn.2012.1436 [22] EDUARDO G, LIGGIERI L, SANTNI E, et al. Effect of hydrophilic and hydrophobic nanoparticles on the surface pressure response of DPPC monolayers [J]. Journal of Physical Chemistry C, 2017, 115(44): 21715-21722. [23] 赵群. 大气细颗粒物与肺表面活性物质间的界面化学作用研究[D]. 昆明: 昆明理工大学, 2019: 21-22. ZHAO Q. Interfacial chemical interactions between fine particulate matter and pulmonary surfactant[D]. Kunming: Kunming University of Science and Technology, 2019: 21-22 (in Chinese).
[24] KATARZYNA H W, MICHAL F, MARCIN B, et al. Properties of b-sitostanol/DPPC monolayers studied with Grazing Incidence X-ray Diffraction (GIXD) and Brewster Angle Microscopy [J]. Journal of Colloid and Interface Science, 2011, 364: 133-139. doi: 10.1016/j.jcis.2011.08.030 [25] KIRILKA M, SYETLA DP, GEORG A G, et al. DoumanovInteraction of Bestrophin-1 with 1-palmitoyl-2-oleoyl-sn- glycero-3-phosphocholine (POPC) in surface films [J]. Colloids and Surfaces B:Biointerfaces, 2014, 122: 432-438. doi: 10.1016/j.colsurfb.2014.01.045 [26] YUAN Y, LIU X, LIU T, et al. Molecular dynamics exploring of atmosphere components interacting with lung surfactant phospholipid bilayers [J]. Science of The Total Environment, 2020, 743: 140547. doi: 10.1016/j.scitotenv.2020.140547 [27] 董声焕. 肺表面活性物质基础与临床[M]. 北京: 人民军医出版社, 2012: 57-58. DONG S H. Pulmonary surfactant basic and clinical studies[M]. Beijing: People’s Military Medical Press, 2012: 57-58 (in Chinese).
[28] 徐琳桢, 赵群, 田森林, 等. 重金属离子对肺表面活性物质单层膜的影响 [J]. 中国环境科学, 2020, 40(2): 857-864. doi: 10.3969/j.issn.1000-6923.2020.02.047 XU L Z, ZHAO Q, TIAN S L, et al. Effect of heavy metal ions on the surface activity of pulmonary surfactant monolayer membrane [J]. China Environmental Science, 2020, 40(2): 857-864(in Chinese). doi: 10.3969/j.issn.1000-6923.2020.02.047
[29] RAGESH G, IRYNA S, ROBERT L, et al. Phage langmuir monolayers and Langmuir-Blodgett films [J]. Colloids and Surfaces B:Biointerfaces, 2011, 82: 182-189. doi: 10.1016/j.colsurfb.2010.08.032 [30] JUAN T B. Thermodynamic behaviour of mixed films of an unsaturated and a saturated polar lipid. (Oleic Acid-Stearic Acid and POPC-DPPC) [J]. Colloids Interfaces, 2018, 2: 17. doi: 10.3390/colloids2020017 [31] CHAKRABORTY, HERTEL, DITMARS, et al. Impact of engineered carbon nanodiamonds on the collapse mechanism of model lung surfactant monolayers at the air-water interface [J]. Molecules, 2020, 25(3): 714. doi: 10.3390/molecules25030714 [32] WANG R, GUO Y, LIU H, et al. The effect of chitin nanoparticles on surface behavior of DPPC/DPPG langmuir monolayers [J]. Journal of Colloid & Interface Science, 2018, 519: 186-193. [33] LI J H, SUN R G, HAO C C, et al. The behavior of the adsorption of cytochrome C on lipid monolayers: A study by the Langmuir-Blodgett technique and theoretical analysis [J]. Biophysical Chemistry, 2015, 205: 33-40. doi: 10.1016/j.bpc.2015.05.008 [34] ZENG Z X, LI D, XUE W, et al. Structural models and surface equation of state for pulmonary surfactant monolayers [J]. Biophysical Chemistry, 2007, 131: 88-95. doi: 10.1016/j.bpc.2007.09.006 [35] CARLO D R J, LUCIANO C. Adsorption and enzyme activity of asparaginase at lipid Langmuir and Langmuir-Blodgett films [J]. Materials Science and Engineering C, 2017, 73: 579-584. doi: 10.1016/j.msec.2016.12.041 [36] 张超. 单分子膜成膜性能及循环曲线研究[D]. 开封: 河南大学, 2004: 47-48. ZHANG C. Study of monoayer properties and the cyclic isotherms of Langmuir monolayers[D]. Kaifeng: Hannan University, 2004: 47-48 (in Chinese).
[37] SOSNOWSKI TR, GRADON L, PDGORSKI A. Influence of insoluble aerosol deposits on the surface activity of the pulmonary surfactant: A possible mechanism of alveolar clearance retardation? [J]. Aerosol Sci Technol, 2010, 32(1): 52-60. [38] THAPA A, VERNON BC, PENA KDL, et al. Membrane-mediated neuroprotection by curcumin from amyloid-β-peptideinduced toxicity [J]. Langmuir, 2013, 29: 11713-11723. doi: 10.1021/la4020459 [39] WYDRO P. The interactions between cholesterol and phospholipids located in the inner leaflet of human erythrocytes membrane (DPPE and DPPC) in binary and ternary films-the effect of sodium and calcium ions [J]. Colloids and Surfaces B:Biointerfaces, 2011, 82: 209-216. doi: 10.1016/j.colsurfb.2010.08.041 [40] ANNA STACHOWICZ-KUNIERZ, TROJAN S, CWIKLIK L, et al. Modeling lung surfactant interactions with Benzo[a]pyrene [J]. Chemistry-A European Journal, 2017, 23(22): 5307-5316. doi: 10.1002/chem.201605945 [41] SUROVTSEV N V, ADICHTCHEV S V. Low-wavenumber raman scattering of phospholipid bilayers in fluid, ripple, and gel phases [J]. Journal of Raman Spectroscopy, 2020, 51: 952-958. doi: 10.1002/jrs.5861 [42] GHARIB R, FOURMENTIN S, CHARCOSSET C, et al. Effect of hydroxypropyl-β-cyclodextrin on lipid membrane fluidity, stability and freeze-drying of liposomes [J]. Journal of Drug Delivery ence & Technology, 2018, 44: 101-107. [43] 惠歌, 赵雨, 张巍, 等. 拉曼光谱研究人参皂苷Rbl与DPPC双层膜的作用 [J]. 光谱学与光谱分析, 2010, 30(9): 2393-2396. doi: 10.3964/j.issn.1000-0593(2010)09-2393-04 HUI G, ZHAO Y, ZHANG W, et al. Raman spectroscopy study on the interaction of ginsenoside Rbl with DPPC bilayers [J]. Spectroscopy and Spectral Analysis, 2010, 30(9): 2393-2396(in Chinese). doi: 10.3964/j.issn.1000-0593(2010)09-2393-04
[44] GARDIKIS K, HATZIANTONIOU S, VIRAS K, et al. A DSC and Raman spectroscopy study on the effect of PAMAM dendrimer on DPPC model lipid membranes [J]. International Journal of Pharmaceutics, 2006, 318: 118-123. doi: 10.1016/j.ijpharm.2006.03.023 [45] 惠歌, 刘威, 张景洲, 等. 变温拉曼光谱和DSC探讨人参皂苷Rb1分子与DPPC双层膜的作用 [J]. 光谱学与光谱分析, 2015, 35(8): 2176-2179. doi: 10.3964/j.issn.1000-0593(2015)08-2176-04 HUI G, LIU W, ZHANG J Z, et al. Study on the effects of ginsenoside Rbl on DPPC bilayers by using thermo-Raman spectrum and DSC [J]. Spectroscopy and Spectral Analysis, 2015, 35(8): 2176-2179(in Chinese). doi: 10.3964/j.issn.1000-0593(2015)08-2176-04
[46] JAY P. KITT, DAVID A. BRYCE, SHELLEY D. MINTEER, et al. Raman spectroscopy reveals selective interactions of cytochromec with cardiolipin that correlate with membrane permeability [J]. Journal of the American Chemical Society, 2017, 139(10): 3851-3860. doi: 10.1021/jacs.7b00238 [47] GARDIKIS K, HATZIANTONIOU S, KYRIAKOS V, et al. Effect of a bioactive curcumin derivative on DPPC membrane: A DSC and Raman spectroscopy study [J]. Thermochimica Acta, 2006, 447: 1-4. doi: 10.1016/j.tca.2006.03.007 [48] HELMUT I PC, TEOBALDO RC G, ANDRE S P. Molecular dynamics of dibenz[a, h]anthracene and its metabolite interacting with lung surfactant phospholipid bilayers [J]. Physical Chemistry Chemical Physics, 2015, 17(32): 20912-20922. doi: 10.1039/C5CP01443C -






 下载:
下载: