-
化工生产及皮革制造等相关行业生产废水中所含的硫化物(S2−)具有高毒性、腐蚀性和臭味,可对人类健康造成危害[1-7]。目前S2−常用的去除方法包括酸化吸收法、化学絮凝法和化学氧化法[8]。其中,酸化吸收法设备易腐蚀且操作复杂;化学絮凝法药剂成本高且二次污泥产量大。化学氧化法有过渡金属催化氧化、过氧化氢、次氯酸钠、高锰酸钾、臭氧氧化等。其中以锰盐为催化剂,催化空气氧化法成本最低,且具有条件温和、去除率高等优点[5]。但均相锰盐在处理含硫废水的过程中会产生大量沉淀,且重金属锰离子对水体会造成二次污染。
近年来,众多学者致力于开发高效的金属氧化物等非均相催化剂用于含硫废水的处理[6-13]。郭二亮等[10]采用等体积浸渍法制得MnO2负载γ-Al2O3催化材料,该材料对初始质量浓度为1 000 mg∙L−1的模拟废水中的Na2S去除率可达98%。NHI等[11]制备了Mn-Co-Cr-聚乙烯棒,用于催化氧化初始质量浓度为1 000 mg·L−1的Na2S模拟废水,在60 ℃下,3 h内Na2S去除率可达90%。以上反应体系均已取得较好的含硫废水处理效果,但难以实现单质硫(S0)的有效回收利用。目前,将富氮材料应用于硫化物选择性氧化的研究工作已取得有效进展[14-22]。SUN等[14]通过在碳中掺杂高浓度的氮原子,制备了无金属催化剂(NMC),该NMC在低温下对H2S的氧化展现出较高的催化活性和选择性;进一步的研究表明,吡啶氮原子对H2S氧化的催化活性起到了关键作用。YANG等[15]通过直接热处理商用聚苯胺(PANI)获得了富氮碳,用于在相对较低的温度(180 ℃)下连续选择性氧化H2S,可实现99%的催化转化率和95%的选择性。据文献调研,目前还未见关于将锰氧化物负载于富氮材料表面且将其用于水溶性硫化物催化氧化的报道。
基于此,本研究以PANI为载体,以高锰酸钾(KMnO4)为前驱体,通过化学浸渍法制得了锰氧化物复合聚苯胺材料(MnxOy-PANI),并以空气为氧化剂,在常温、常压下将该材料应用于S2−的催化氧化。评价了该催化剂对S2−的选择性氧化性能,并探究了反应体系中可能的反应机理,以期为含硫废水的处理及有效利用提供参考。
-
1)实验试剂。高锰酸钾(KMnO4)、聚苯胺(PANI)、硫化钠(Na2S)、碘(I2)、淀粉((C6H10O5 )n)、碘化钾(KI)、碘酸钾(KIO3)、硫代硫酸钠(Na2S2O3)、盐酸(HCl,99%)、氯仿(CHCl3)、乙醇(C2H5OH)、甲醛(CH2O)、亚硫酸钠(Na2SO3)、醋酸(CH3COOH)、磷酸二氢钾(KH2PO4)、磷酸氢二钾(K2HPO4)、碳酸钠(Na2CO3)均购于国药控股集团化学试剂有限公司。
2)实验仪器。纯水仪(PCDX,武汉品冠仪器公司),烘箱(DZG-6020,天津华北实验有限公司),恒温磁力搅拌水浴锅(ZNCL-S,科尔仪器设备有限公司),紫外分光光度计(UV-2600,Shimadzu,Japan),离子色谱(Dionex,ICS-1100),电感耦合等离子体发射光谱(ICP‒OES, Optima 8300, PerkinElmer, U.S.)。
-
采用化学浸渍法,以KMnO4为前驱体,向1 000 mL浓度为2 mmol·L−1的KMnO4溶液中缓慢投加1.0 g聚苯胺,常温下搅拌24 h使其充分反应。将反应后溶液固液分离,对所得材料进行洗涤,置于60 ℃烘箱内干燥24 h,即得到锰氧化物复合聚苯胺材料MnxOy-PANI。
-
通过N2物理吸脱附仪表征材料比表面积和孔容;使用傅立叶红外分析仪(FTIR)表征材料表面含有的官能团;使用场发射扫描电子显微镜(FE-SEM)对材料进行形貌分析;使用X射线光电子能谱仪(XPS)对材料表面锰物种的化学价态进行分析;使用X射线衍射技术(XRD)表征材料的物相和晶体结构。
-
分别配制质量浓度为50、100、150、200 mg·L−1的Na2S溶液,通过NaOH溶液调节溶液pH为10.4,向其中加入一定量催化剂,反应于恒温磁力搅拌水浴锅中进行。在一定的时间间隔内,取10 mL反应溶液,经20 μm滤头过滤后进行分析测定。
采用国标HJ/T60-2 000测定反应溶液中S2−质量浓度,按式(1)计算S2−的去除率。通过离子色谱测定反应后溶液中
${\rm{S}}_2{\rm{O}}_3^{2-} $ 、${\rm{SO}}_3^{2-} $ 、${\rm{SO}}_4^{2-} $ 质量浓度。离子色谱测定条件:淋洗液为4.5 mmol·L−1碳酸钠和0.8 mmol·L−1碳酸氢钠,流速为1.0 mL∙min−1,进样量为20 μL。S0的测定方法:通过氯仿萃取,并旋转蒸发体系中氯仿,用氯仿反复萃取反应体系中产生的单质硫,旋转蒸发去除氯仿后加入无水乙醇,稀释后为待测溶液。向其中加入pH=7.6的磷酸盐缓冲溶液、0.01 mol·L−1亚硫酸钠溶液、0.5 mol·L−1甲醛溶液、15 mol·L−1醋酸溶液,KIO3-KI混合标准溶液(1.67×10−4 mol·L−1KIO3,0.6 mol·L−1KI,0.5 g∙L−1Na2CO3)。混合溶液中单质硫通过紫外分光光度计进行测定,检测波长为350 nm。式中:η为S2−的去除率,%;C0为含硫废水中S2−初始质量浓度,mg∙L−1;Ct为含硫废水中反应t时刻S2−的质量浓度,mg∙L−1。
-
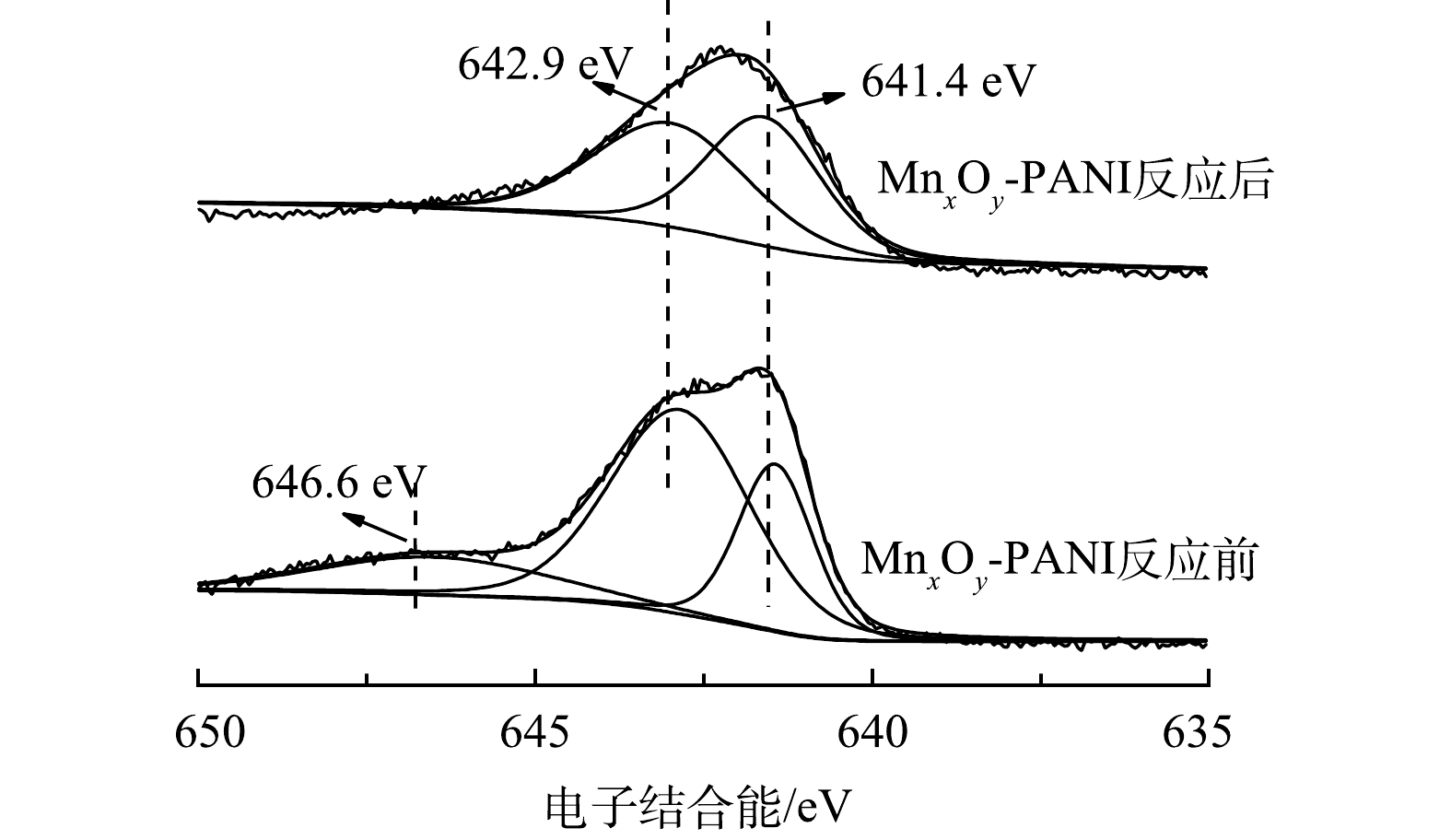
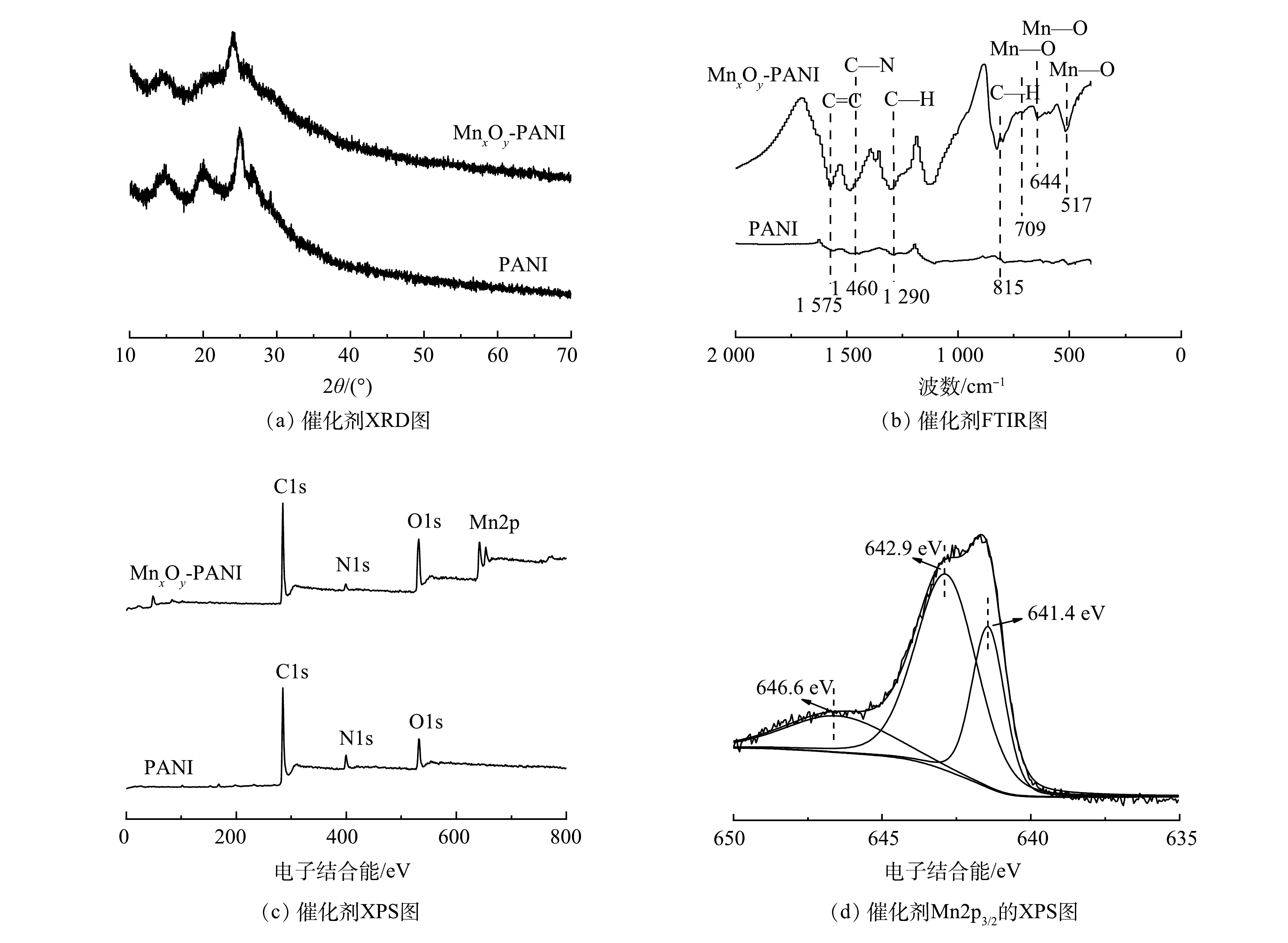
图1(a)为PANI和MnxOy-PANI的XRD图。在15.1°、20.0°、25.2°处的特征峰分别对应PANI的(010)、(100)、(011)平面衍射。这些峰可以归因于聚苯胺的聚合物链平行或垂直的周期性[23]。然而,MnxOy-PANI图谱中并未出现锰氧化物的特征衍射峰。这一结果可归因于MnxOy-PANI中锰氧化物的低结晶度和无定形结构[24]。催化剂的红外图谱如图1(b)所示。1 575、1 460、1 290、815 cm−1处出现的特征峰分别对应PANI的C=C伸缩振动峰、C—N伸缩振动峰、C—H弯曲振动峰以及C—H在平面内外的振动峰[24]。而在MnxOy-PANI红外图谱中,709 cm−1和517 cm−1处出现对应MnO2中Mn-O的特征峰,644 cm−1处出现对应Mn2O3中Mn—O的特征峰[25-26]。这表明,生成的锰氧化物为MnO2和Mn2O3。图1(c)为催化剂的XPS图谱。PANI图谱中只出现了C1s、N1s、O1s的结合能峰;而MnxOy-PANI的图谱中出现了明显的Mn2p结合能峰。如图1(d)所示,对MnxOy-PANI的Mn2p3/2峰进行分峰拟合,在646.6 eV和642.9 eV处的峰归属于Mn(Ⅳ),641.4 eV处的峰归属于Mn(Ⅲ)[27]。这与红外表征结果一致。XRD、FTIR、XPS表征结果共同证明,锰氧化物以MnO2和Mn2O3的形式成功负载于PANI载体上。
由图2(a)、图2(b)中可观察到PANI堆积团簇呈珊瑚状,而图2(c)、图2(d)中MnxOy-PANI的表面结构更为粗糙。这说明锰氧化物包覆在PANI表面。由图2(e)可以看出,PANI和MnxOy-PANI吸附脱附等温曲线为典型Ⅱ型等温线。表明其为介孔材料,这一结果可以由其孔径分布图(图2(f))进一步证实。样品比表面积和孔径数据如表1所示。MnxOy-PANI的比表面积(22 m2∙g−1)远大于PANI(8 m2∙g−1)。这可归因于聚苯胺载体上高孔隙率锰氧化物的形成[27]。MnxOy-PANI比表面积的增大能为其吸附和氧化提供更多反应活性位点。
-
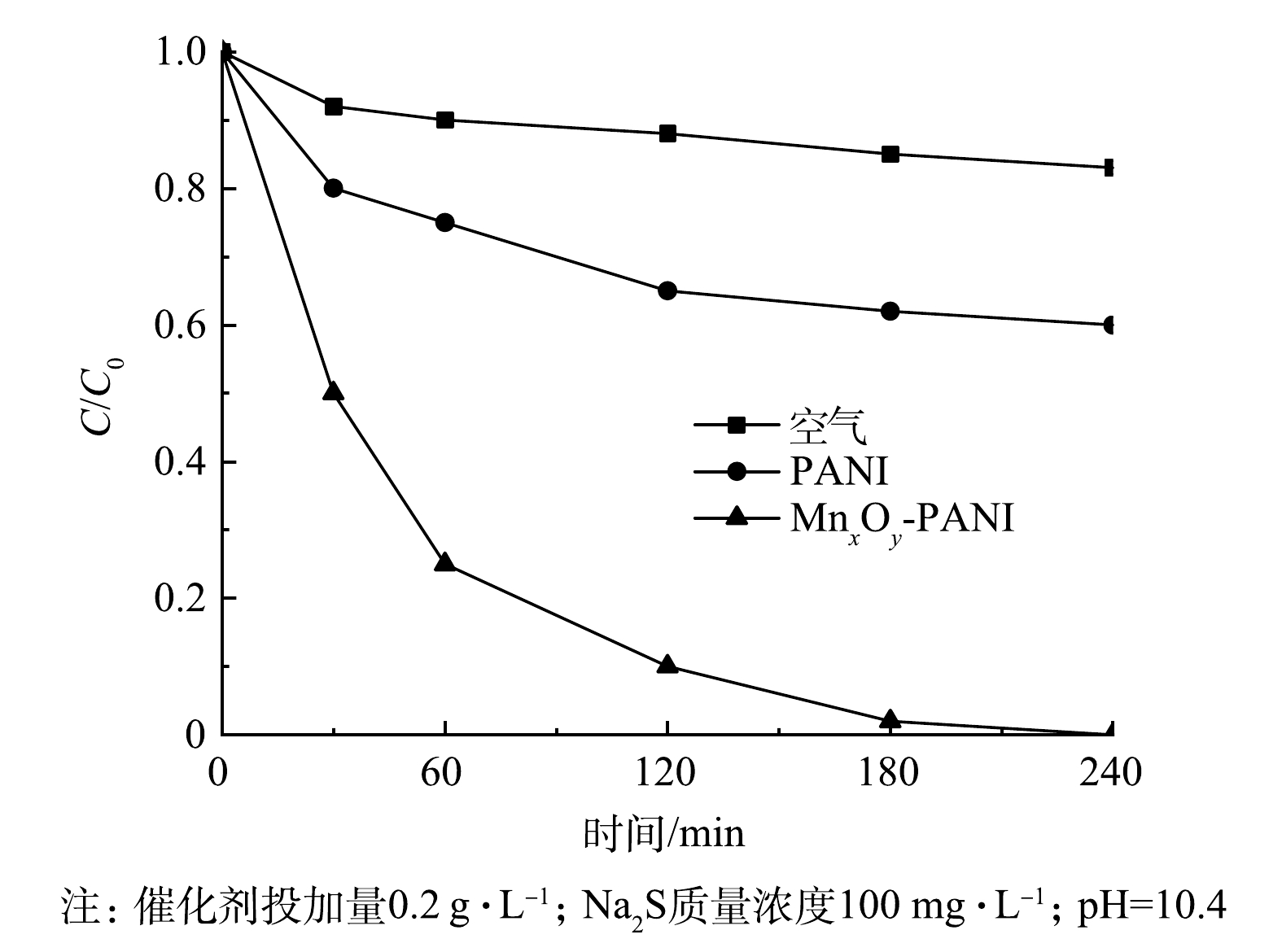
如图3所示,在仅有空气而没有催化剂的条件下,Na2S几乎没有被去除。加入单一PANI后,在240 min内Na2S的去除率为40%。以MnxOy-PANI为催化剂,以空气为氧化剂时,Na2S的去除速率显著提升,在240 min内Na2S可被完全去除。这表明MnxOy-PANI具有较好的催化氧化性能。
-
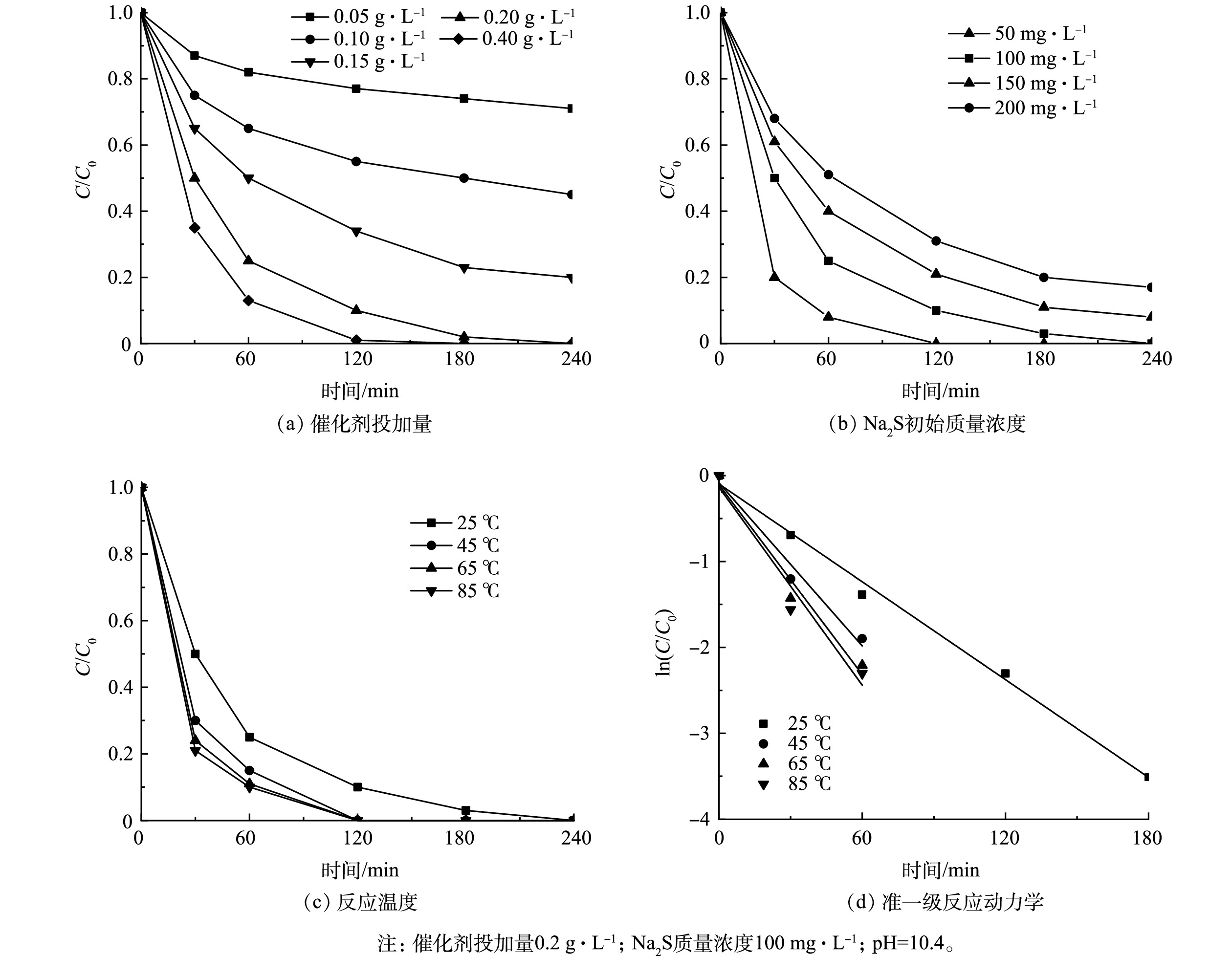
如图4(a)所示,当催化剂投加量为0.05 g∙L−1时,Na2S的氧化去除率仅为23%;增大投加量至0.1 g∙L−1和0.15 g∙L−1时,Na2S的去除率显著提升至50%和78%;继续增大投加量至0.2 g∙L−1时,Na2S可被完全氧化。这主要归因于催化剂活性位点的增多。进一步增大催化剂投加量至0.4 g∙L−1时,Na2S的去除率则提升不大,因此,后续实验催化投加量采用0.2 g∙L−1。Na2S初始质量浓度对Na2S去除率的影响如图4(b)所示。随着初始浓度的增加,Na2S的去除率逐渐降低。这可能是由于催化剂上的反应活性位点不足。但即使Na2S质量浓度高达200 mg∙L−1,MnxOy-PANI仍保持较好的催化氧化性能,反应240 min内可去除80% Na2S。当初始质量浓度为100 mg∙L−1时,反应240 min内Na2S可被完全去除,因此,后续实验的Na2S初始质量浓度设为100 mg∙L−1。
不同反应温度对Na2S去除率的影响及准一级动力学拟合速率如图4(c)、图4(d)所示。当反应温度为25、45和65 ℃时,反应速率分别为0.019 0、0.031 6、0.036 7 min−1。当继续升高温度至85 ℃时,反应速率的提升并不明显。这表明,此时反应已达到平衡,温度不再继续影响反应去除速率[10]。因此,后续实验均在室温25 ℃下进行。在25 ℃,Na2S初始质量浓度为100 mg∙L−1,催化剂投加量为0.2 g∙L−1时,考察了初始pH对MnxOy-PANI催化氧化性能的影响。由图5(a)可见,随着pH的升高,反应240 min内Na2S均可被完全去除。这表明MnxOy-PANI具有良好的适用性。在反应体系自然pH(10.4)下探究了不同反应气氛对Na2S去除的影响。如图5(b)和图5(c)所示,在氧气饱和条件下,Na2S氧化速率为3.87 min−1,是空气的91倍(0.042 1 min−1)。这说明氧气在反应体系中扮演着重要角色。向反应体系中通入足够的氩气排除氧气,240 min内Na2S的去除率不超过10%。这一结果进一步证实氧气在氧化中的关键作用。
-
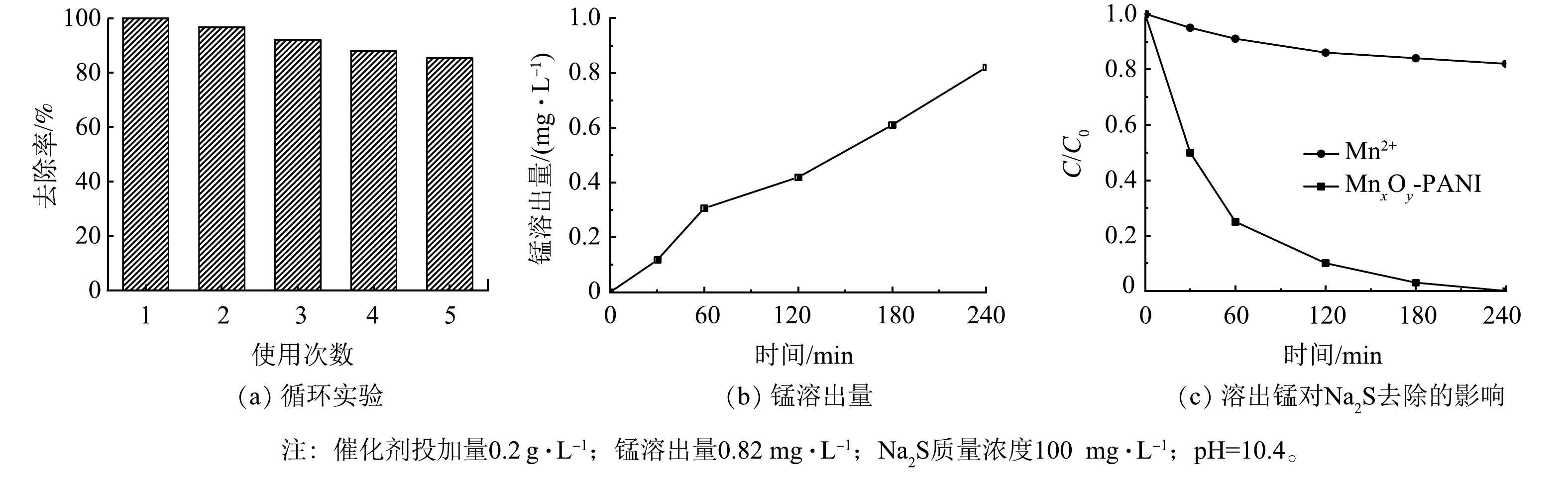
将反应后的催化剂在60 ℃下干燥后再重复利用,以考察MnxOy-PANI的循环利用性。由图6可以看出,催化剂连续重复使用5次后,反应240 min内Na2S的去除率仍可达85%。这表明该催化剂具有良好的循环稳定性。MnxOy-PANI催化氧化Na2S反应过程中锰的溶出量变化如图6(a)所示。240 min时溶液中锰离子含量为0.82 mg∙L−1,未超过《污水综合排放标准》(GB 8978—1996)中总锰最高允许排放质量浓度1.0 mg·L−1。因此,可认为不会对水体造成二次污染。采用同等锰含量的硫酸锰在相同条件下催化氧化Na2S,结果如图6(b)所示。反应240 min内Na2S的去除率为18%,表明溶出的锰对Na2S去除贡献并不大。
-
据文献报道[5,8,11],含硫废水处理体系中可能的含硫产物包括硫酸根(
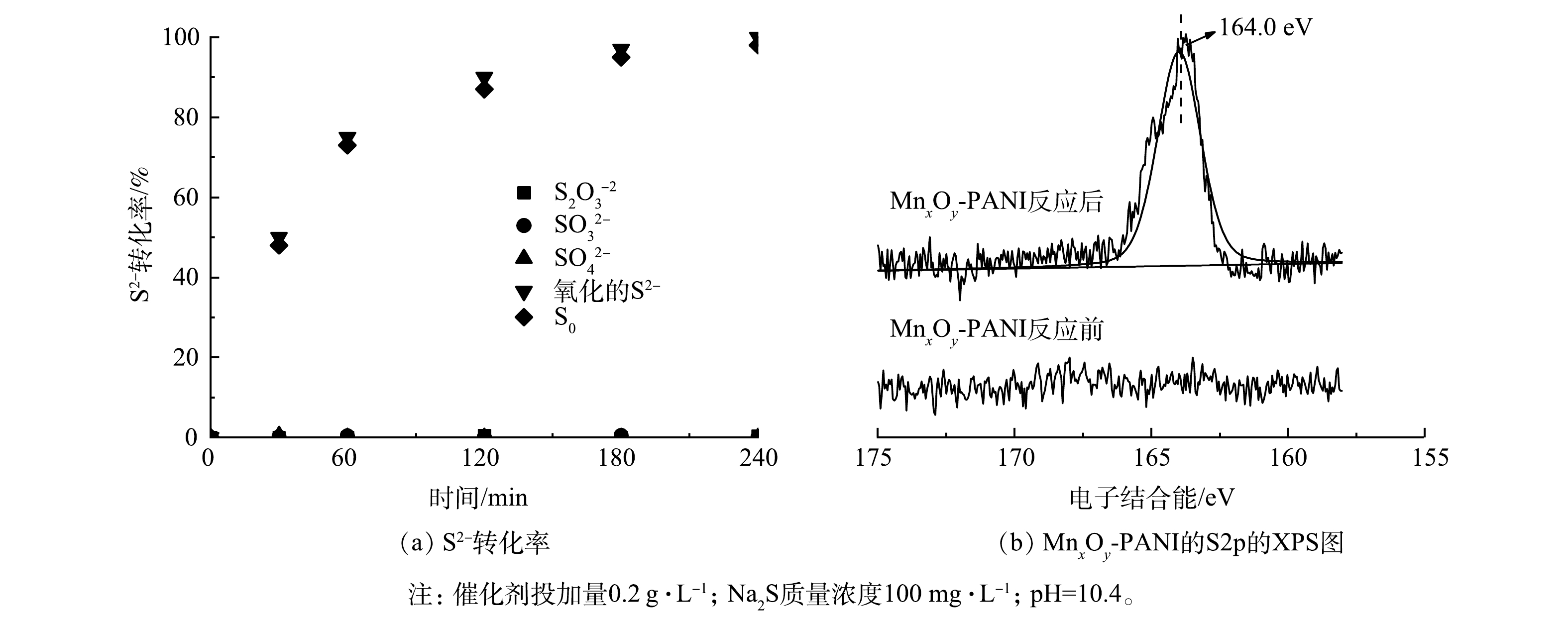
${\rm{SO}}_{4}^{2-} $ )、亚硫酸根(${\rm{SO}}_{3}^{2-} $ )、硫代硫酸根(${\rm{S}}_2{\rm{O}}_{3}^{2-} $ )以及单质硫(S0)。具体反应机制如式(2)~式(6)所示。对反应后可能存在的各类含硫物种进行了测定,结果如图7(a)所示。反应过程中并未检测到
${\rm{S}}_{2}{\rm{O}}_{3}^{2-} $ 、${\rm{SO}}_{3}^{2-} $ 、${\rm{SO}}_{4}^{2-} $ ,而S2−浓度随时间的延长不断下降,S0含量逐渐增多,且反应240 min内S2−几乎完全转化为S0。图7(b)为MnxOy-PANI反应前后S2p的XPS图谱。反应前催化剂图谱中未出现任何含硫物种信号峰,而反应后催化剂图谱中在164.0 eV处出现明显对应S0的信号峰[28],且并未出现对应其他含硫物种的信号峰,这证明S2−最终已完全氧化为S0。反应生成的S0可通过氯仿萃取与催化剂分离,将氯仿旋馏蒸发后可得到S0。 -
催化剂上的缺电子金属离子有利于结合溶液中的富电子离子[29],负载锰氧化物后的MnxOy-PANI对S2−的吸附能力增强。反应物S2−被吸附在活性位点上后,被催化剂上的Mn4+和吸附的氧气氧化为S0,Mn4+转化为Mn3+,催化剂表面的氧空位又将Mn3+重新氧化为Mn4+,从而实现MnxOy-PANI持续催化氧化Na2S,具体过程如式(7)~式(9)所示。MnxOy-PANI反应前后Mn2p3/2的XPS图谱如图8所示。在646.6 eV和642.9 eV处的峰归属于Mn(Ⅳ),641.4 eV处的峰归属于Mn(Ⅲ)。反应前Mn(Ⅳ)和Mn(Ⅲ)含量分别为75%和25%,反应后Mn(Ⅳ)和Mn(Ⅲ)含量分别为52%和48%,这表明部分Mn4+转化为Mn3+。
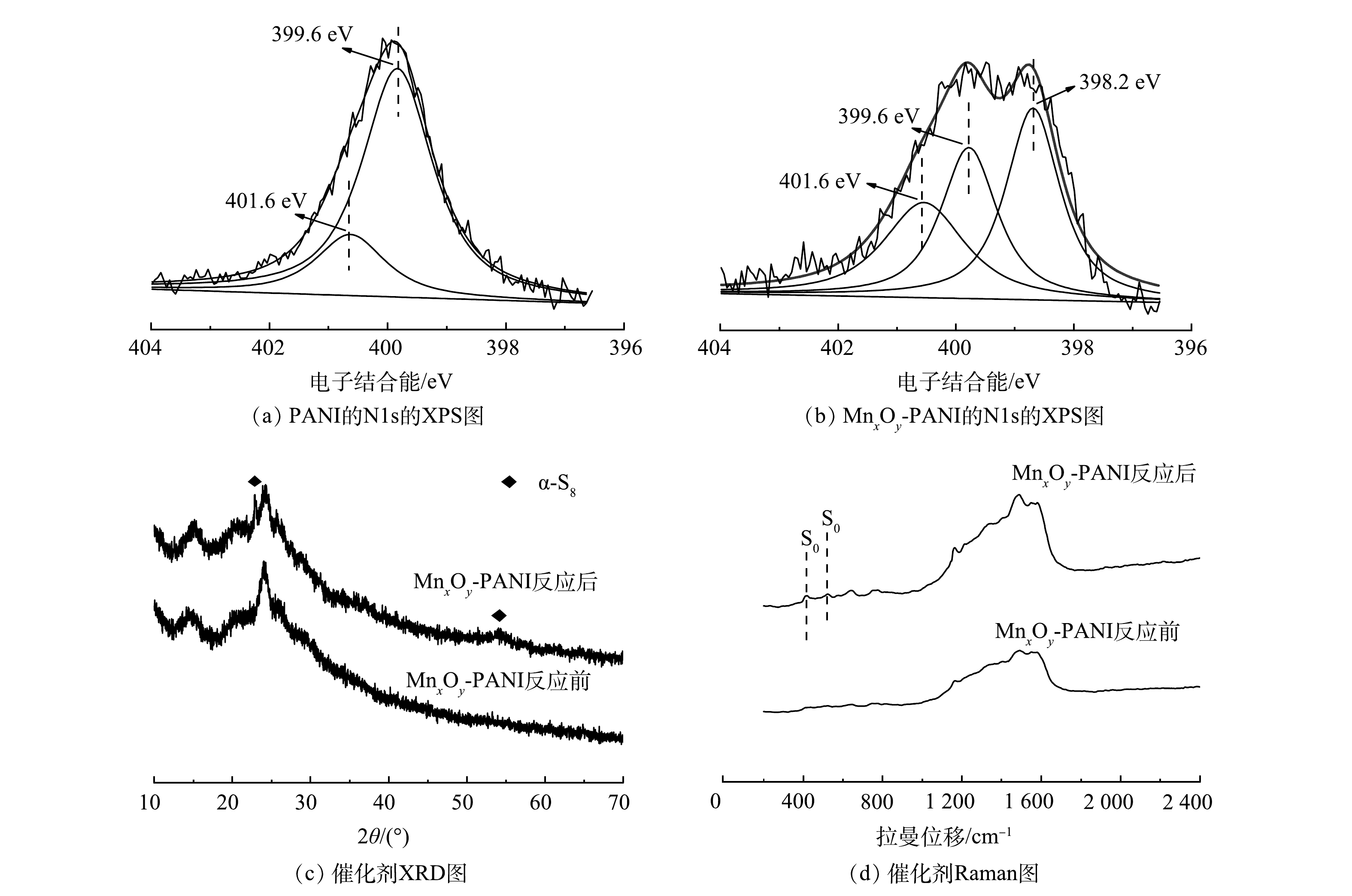
在这个过程中,催化剂MnxOy-PANI上氮的含量也十分关键,其主要作用表现在以下2个方面。1)如图9(a)、图9(b)所示,PANI的N 1s的XPS图谱中在399.6 eV和401.6 eV处分别出现了对应吡咯氮和四价氮的信号峰[15]。此外,MnxOy-PANI的谱图中在398.2 eV处出现了对应吡啶氮的信号峰[15]。氧分子扩散到催化剂孔中更容易被缺陷位点的吡啶氮原子吸附[14],吡啶氮含量的增加使得MnxOy-PANI催化剂对氧分子吸附能力增强,从而使催化氧化S2−反应更易发生。2)有研究[30]表明,在碱性较强的情况下,S2−氧化生成的S0之间会通过相互作用生成以稳定的链状或者环状结构存在的聚硫化物(α-S8分子);在碱性较弱的情况下,S2−氧化生成的S0高度分散,会被进一步氧化成更高价态的含硫化合物;在酸性条件下,S2−易转换成H2S分子,通常难以被O2或其他氧化剂氧化至S0或更高价态的含硫化合物。MnxOy-PANI催化氧化S2−反应在通常碱性溶液中进行,催化剂上的碱性含氮基团使得反应活性位点的局部碱性进一步增加。因此,在MnxOy-PANI催化氧化S2−的最终产物以S0的形式稳定的存在于催化剂的孔隙中。图9(c)为MnxOy-PANI催化剂反应前后的XRD图谱。催化剂反应后的XRD图谱中出现了对应α-S8的特征衍射峰(JCPDS: 83-2284),这表明反应后生成了α-S8分子[31]。MnxOy-PANI反应前后的拉曼图谱如图9(d)所示。反应后的图谱中在411 cm−1和516 cm−1处出现对应S0的信号峰[32],这表明催化剂上S0的存在。XRD、Raman表征结果共同证明:MnxOy-PANI催化氧化S2−的最终产物S0已在催化剂上稳定存在。
-
1)以聚苯胺(PANI)为载体,以高锰酸钾为前驱体,通过化学浸渍法制备了MnxOy-PANI催化剂;XRD、FTIR、XPS和SEM表征结果表明,锰氧化物已成功负载到PANI表面。
2)在常温、常压下,以空气为氧化剂,MnxOy-PANI催化剂投加量为0.2 g∙L−1时,催化氧化初始质量浓度为100 mg∙L−1的Na2S模拟废水,在反应240 min内,Na2S的去除率达到100%。同时,该催化剂具有较好的循环稳定性,连续循环5次后,Na2S去除率未见明显下降。
3) MnxOy-PANI对Na2S的氧化表现出较高的催化活性和选择性。这得益于催化剂上的Mn4+/Mn3+氧化还原对和表面含氮基团。催化剂表面的含氮基团一方面能够增强对氧气的吸附能力,协同Mn4+氧化S2−;另一方面起可增强反应活性位点局部碱性,催化氧化S2−并生成难以被进一步氧化的聚硫化物,最后以S0的形式稳定存在于系统中。
锰氧化物负载聚苯胺选择性氧化硫化物的效能及机理
Efficiency and mechanism of sulfide selective oxidation by manganese oxides supported polyaniline
-
摘要: 目前关于含硫废水处理技术的研究已取得有效进展,但难以在去除含硫污染物的同时实现硫资源的回收利用。为此,通过化学浸渍法制得了锰氧化物负载聚苯胺(MnxOy-PANI)催化剂。XRD、FTIR、XPS和SEM表征结果表明,MnxOy已成功负载于PANI载体。以空气为氧化剂,探究了该催化剂对含硫废水(以Na2S为模拟污染物)的选择性氧化性能。结果表明:MnxOy-PANI催化剂表现出优异的Na2S选择氧化性;当催化剂用量为0.2 g∙L−1、Na2S初始质量浓度为100 mg∙L−1时,240 min内S2−可被完全氧化为单质硫(S0)。MnxOy-PANI反应后的XPS、XRD、Raman表征结果证明,S0在催化剂上稳定存在。此外,考察了催化剂投加量、Na2S初始浓度、反应温度、初始pH和不同反应气氛对催化氧化Na2S的影响。循环实验结果表明,MnxOy-PANI具有较好的稳定性。最后,提出了选择性氧化的可能反应机理,为含硫废水的治理和回收提供参考。Abstract: An effective progress has been made for sulfide wastewater treatment technology development, but the recovery of sulfur resources is hard to be achieved while alleviating environmental pollution. Here a manganese oxides supported polyaniline material(MnxOy-PANI) was prepared by a chemical impregnation method. XRD, FTIR, XPS and SEM results indicated that manganese oxides were successfully loaded on the polyaniline substrate. When air was taken as the oxidant, effect of catalyst on sulfide wastewater (Na2S as simulated contaminant) selective oxidation was investigated. The results demonstrated that MnxOy-PANI catalyst had an excellent catalytic activity and selectivity on Na2S oxidation. When the catalyst dosage was 0.2 g∙L-1 and the initial Na2S concentration was 100 mg∙L−1, S2− could be completely oxidized to element sulfur(S0) within 240 minutes. S0 existence on catalyst was confirmed by XPS, XRD and Raman detection of used MnxOy-PANI. Besides, the influences of catalyst dosage, reaction temperature, initial Na2S concentration, initial pH and different reaction atmospheres on the catalytic oxidation of Na2S were studied. Cycling experiments suggested that MnxOy-PANI had a superior stability. Finally, the possible mechanism of selective oxidation was proposed, providing a new insight into the treatment and recovery technology of sulfide wastewater.
-
Key words:
- manganese oxides /
- polyaniline /
- selective oxidation /
- elemental sulfur
-

-
表 1 PANI和MnxOy-PANI的比表面积和孔径
Table 1. Surface area and pore size of PANI and MnxOy-PANI
样品 比表面积/(m2∙g−1) 总孔容/(cm3∙g−1) 孔径/nm PANI 7 0.023 210 23.581 9 MnxOy-PANI 22 0.093 676 19.805 1 -
[1] 卢信, 冯紫艳, 商景阁, 等. 不同有机基质诱发的水体黑臭及主要致臭物(VOSCs)产生机制研究[J]. 环境科学, 2012, 33(9): 3152-3159. [2] 王兵, 王丹, 李永涛, 等. 基于单质硫回收的高含硫废水氧化[J]. 环境工程学报, 2015, 9(11): 5408-5414. doi: 10.12030/j.cjee.20151144 [3] 杨德敏, 袁建梅, 谢崇文, 等. 气田高浓度含硫废水的化学氧化处理[J]. 环境工程学报, 2014, 8(11): 4757-4761. [4] 龚文莉. 浅析制革工业废水处理的技术现状[J]. 广东化工, 2012, 39(2): 136-141. doi: 10.3969/j.issn.1007-1865.2012.02.072 [5] 魏世林. 制革废水中的硫化物对环境的污染及其治理方法[J]. 中国皮革, 2003, 32(1): 3-5. doi: 10.3969/j.issn.1001-6813.2003.01.002 [6] DINH V N, DINH B N, THI M T, et al. The oxidation of sulfur-containing compounds using heterogeneous catalysts of transition metal oxides deposited on the polymeric matrix[J]. Journal of Electronic Materials, 2015, 45(5): 2316-2321. [7] 苏帝翰, 王春华, 周加境, 等. 氧化锰/AT复合吸附材料去除废水中硫化物的研[J]. 中国皮革, 2013, 42(23): 24-28. [8] 林奇, 樊欣蕊, 邹丽蓉. 含硫废水处理技术的研究进展[J]. 油气田环境保护, 2020, 30(5): 27-30. doi: 10.3969/j.issn.1005-3158.2020.05.007 [9] 罗瑶, 李珊, 谭文峰, 等. 水锰矿氧化水溶性硫化物过程及其影响因素[J]. 环境科学, 2016, 37(4): 1539-1545. [10] 郭二亮, 崔雯谣, 吴迪, 等. MnO2/γ-Al2O3的制备及催化空气氧化处理制革含硫废水[J]. 中国皮革, 2019, 48(2): 36-42. [11] NHI B D, MARATOVICH A R, GARIPOVN A A, et al. Investigation of factors influencing sodium sulfide oxidation in the presence of polymeric heterogeneous catalysts of transition metal oxides[J]. Journal of Sulfur Chemistry, 2013, 35(1): 74-85. [12] LIAO X, HU Z, MA L, et al. Cu location onto spherical SiO2@Mn make a profound difference for catalytic oxidative removal Na2S in waste water with air as an oxidant at ambient conditions[J]. Chemical Engineering Journal, 2018, 351: 280-294. doi: 10.1016/j.cej.2018.06.079 [13] 王瑀婷. 制革污水处理方法研究进展[J]. 当代化工研究, 2017, 5(1): 58-59. doi: 10.3969/j.issn.1672-8114.2017.01.031 [14] SUN F, LIU J, CHEN H, et al. Nitrogen-rich mesoporous carbons: Highly efficient, regenerable metal-free catalysts for low-temperature oxidation of H2S[J]. ACS Catalysis, 2013, 3(5): 862-870. doi: 10.1021/cs300791j [15] YANG C, YE H F, BYUN J, et al. N-rich carbon catalysts with economic feasibility for the selective oxidation of hydrogen sulfide to sulfur[J]. Environmental Science & Technology, 2020, 54(19): 12621-12630. [16] LI S Y, GU Q Q, CAO N, et al. Defect enriched N-doped carbon nanoflakes as robust carbocatalysts for H2S selective oxidation[J]. Journal of Materials Chemistry A, 2020, 8(18): 8892-8902. doi: 10.1039/D0TA00212G [17] XIONG W, WANG Z N, HE S L, et al. Nitrogen-doped carbon nanotubes as a highly active metal-free catalyst for nitrobenzene hydrogenation[J]. Applied Catalysis B:Environmental, 2020, 260: 118105. doi: 10.1016/j.apcatb.2019.118105 [18] CHEN Q J, WANG Z, LONG D H, et al. Role of pore structure of activated carbon fibers in the catalytic oxidation of H2S[J]. Industrial & Engineering Chemistry Research, 2010, 49(7): 3152-3159. [19] LIU Y F, DUONG-VIET C, LUO J J, et al. One-pot synthesis of a nitrogen-doped carbon composite by electrospinning as a metal-free catalyst for oxidation of H2S to sulfur[J]. Chemcatchem, 2015, 7(18): 2957-2964. doi: 10.1002/cctc.201500353 [20] ZANG Z X, WANG J T, LI W C, et al. Millimeter-sized mesoporous carbon spheres for highly efficient catalytic oxidation of hydrogen sulfide at room temperature[J]. Carbon, 2016, 96: 608-615. doi: 10.1016/j.carbon.2015.10.001 [21] BA H, LIU Y F, LAI T P, et al. A highly N-doped carbon phase "dressing'' of macroscopic supports for catalytic applications[J]. Chemical Communications, 2015, 51(76): 14393-14396. doi: 10.1039/C5CC05259A [22] DUONG-VIET C, BA H, EL-BERRICHI Z, et al. Silicon carbide foam as a porous support platform for catalytic applications[J]. New Journal of Chemistry, 2016, 40(5): 4285-4299. doi: 10.1039/C5NJ02847G [23] WANG S M, SHANG J Y, WANG Q G, et al. Enhanced electrochemical performance by strongly anchoring highly crystalline polyaniline on multiwalled carbon nanotubes[J]. ACS Applied Materials & Interfaces, 2017, 9(50): 43939-43949. [24] LIU J N, JIA Q H, LONG J L, et al. Amorphous NiO as co-catalyst for enhanced visible-light-driven hydrogen generation over g-C3N4 photocatalyst[J]. Applied Catalysis B:Environmental, 2018, 222: 35-43. doi: 10.1016/j.apcatb.2017.09.073 [25] FENG L, YUAN G, XIAO L, et al. Biochar Modified by nano-manganese dioxide as adsorbent and oxidant for oxytetracycline[J]. Bulletin of Environmental Contamination and Toxicology, 2021, 107(2): 269-275. doi: 10.1007/s00128-020-02813-0 [26] WANG J W, YUAN Y F, ZHNG D, et al. Constructing metal-organic framework-derived Mn2O3 multishelled hollow nanospheres for high-performance cathode of aqueous zinc-ion batteries[J]. Nanotechnology, 2021, 32(43): 435401. doi: 10.1088/1361-6528/ac15cb [27] DINH V C, PO-CHANG W, LO-I C, CHIA-HUNG H, et al. Active MnO2/biochar composite for efficient As(III) removal: Insight into the mechanisms of redox transformation and adsorption[J]. Water Research, 2021, 188: 116495. doi: 10.1016/j.watres.2020.116495 [28] ZHENG X, L Y, ZHNG Y, et al. Highly efficient porous FexCe1–xO2−δ with three-dimensional hierarchical nanoflower morphology for H2S-Selective oxidation[J]. ACS Catalysis, 2020, 10(7): 3968-3983. doi: 10.1021/acscatal.9b05486 [29] NHI B D, MARATOVICH A R, GARIPOVNA A A, et al. Investigation of factors influencing sodium sulfide oxidation in the presence of polymeric heterogeneous catalysts of transition metal oxides[J]. Journal of Sulfur Chemistry, 2014, 35(1): 74-85. doi: 10.1080/17415993.2013.800062 [30] 左宋林, 刘斌. 活性炭深度脱除硫化氢的研究进展[J]. 林业工程学报, 2021, 6: 1-12. [31] GAO T, SHI Y, LIU F, et al. Oxidation process of dissolvable sulfide by synthesized todorokite in aqueous systems[J]. Journal of Hazardous Materials, 2015, 290: 106-116. doi: 10.1016/j.jhazmat.2015.02.018 [32] LI M Y, FU K, WANG Z X, et al. Enhanced adsorption of polysulfides on carbon nanotubes/boron nitride fibers for high-performance lithium-sulfur batteries[J]. Chemistry:A European Journal, 2020, 26(72): 17567-17573. doi: 10.1002/chem.202003807 -



 下载:
下载: