-
过氧化氢作为一种绿色氧化剂[1],在催化剂作用下可产生氧化性极强的活性自由基,能够无选择地氧化降解水中的有机污染物,被广泛应用于有机物的氧化和工业废水的处理[2-3]。目前,常用的H2O2催化活化剂包括无机催化剂和有机活化剂。无机催化剂种类有金属离子、金属氧化物、金属配位体等。例如,金属离子催化剂Fenton试剂,Fe2+催化H2O2产生·OH把有机物氧化成CO2、H2O等小分子物质。Fenton反应对pH要求苛刻,并产生大量污泥,因此,类Fenton技术不断发展[4]。杨迦等[5]利用硫酸钠-过氧化氢-氯化钠加合物类芬顿试剂降解了苯胺。金属氧化物催化剂常用的有Fe、Mn、Cu、Ce、Ni、Co、Cr等的氧化物以及钼酸盐[6-7]。在中性条件下,钼酸根催化过氧化氢处理2,4,6-三氯酚和五氯酚废水,降解率可达95%以上[8]。但在酸性条件下,钼酸根催化过氧化氢的效率相对较低[9]。金属配合物催化剂包括酞菁配合物[10]、卟啉配合物、含氮大环配合物、席夫碱配合物[11]和杂多酸(盐)[12]。其中,合成的席夫碱镧系配位体LaL(NO3)3.xH2O和LnL2(NO3)3.xH2O催化H2O2降解苯胺具有很好的选择性[13]。DONG等[14]通过制备杂多酸盐Mg3Al-LDH-Nb6催化H2O2得到高活性氧化体系,对2-CEES(2-氯乙基乙基硫醚)有很好的降解效果。面对催化剂催化条件要求高的问题,寻找条件温和、活性高、适用范围广的过氧化氢催化剂显得尤为重要。
苯胺作为重要的工业原料主要用于制造染料、药物、树脂,还可以作为橡胶硫化促进剂,因此,在相关生产中不可避免地会产生大量苯胺污染水[15]。本文以苯胺为研究对象,依据上述相关文献和市售大宗化学品种类,从过氧化氢金属离子、金属氧化物和金属配位体等3类催化剂中选择了6种化合物(Fe、Cu、磷钼酸等),研究了其催化H2O2降解苯胺的效果;采用电子顺磁共振法、氧化还原电位测定法、化学发光法以及拉曼光谱法检测了PMA催化H2O2产生的活性物质及分布规律,探讨了H2O2催化机制;此外,进一步考察了催化剂用量、pH以及活性氧与苯胺的摩尔比对苯胺降解效果的影响,以获得H2O2/PMA催化体系的最佳反应条件;最后,利用GC/MS、LC/MS和IC等仪器分析方法检测苯胺的降解产物,探讨苯胺在H2O2/PMA催化体系中的降解途径。
-
实验设备:SI Vortex Genie 2涡旋振荡器(美国);5975T气质联用仪(安捷伦);6460型液相色谱质谱仪(安捷伦);拉曼光谱仪(上海如海光电);AQ-1100离子色谱(赛默飞)。IFFM-E化学发光分析仪(西安瑞迈);IVIUM电化学工作站(天津德尚)。
实验试剂:H2O2(30%,北京化工);二氯甲烷(HPLC等级,迈瑞尔);苯胺、硫代硫酸钠、无水硫酸钠、纳米四氧化三铁、氧化亚铜、磷钨酸水合物、磷钼酸水合物、硫酸亚铁、五水合硫酸铜(均为分析纯,麦克林)。
-
1)苯胺降解反应。在15 mL玻璃样品瓶中加入一定体积的苯胺液滴,然后,加入5 mL质量分数为1%的H2O2溶液与一定体积的0.1 mol·L−1催化剂,再置于25 ℃的恒温箱中以600 r·min−1的转速涡旋振荡反应一定时间后,用1 mL 5% Na2S2O3溶液中止反应;最后,加入5 mL二氯甲烷超声萃取10 min,静置分层后取下层有机相进行GC/MS分析,取上层水样进行LC/MS分析;采用IC进行
NO−3 的检测分析。2)苯胺及降解产物分析方法。GC/MS检测条件:毛细管柱HP-5(30 m×25 mm×0.25 μm);升温程序为初始温度50 ℃,以10 ℃·min−1升温至280 ℃(保持1 min)。质谱EI源、全扫描、扫描范围为50~500。
降解产物LC/MS检测条件:色谱柱C18(150 mm×2.1 mm×1.8 μm);流动相0.1%(v/v)甲酸水溶液-0.1%(v/v)甲酸甲醇溶液体系;梯度洗脱;流速0.3 mL·min−1。质谱条件:电喷雾离子化源(ESI);正离子、负离子全扫描。
3)催化机理的研究方法。使用电化学工作站监测反应体系的氧化还原电位,得到电势随时间的变化(E-t)曲线;使用EPR检测催化体系中的活性氧·
O−2 、·OH和1O2[16]。利用化学发光分析仪,依次加入H2O2、化学发光试剂、催化剂,监测催化体系的发光强度随时间的变化。分别对H2O2、催化剂溶液以及二者混合液的拉曼光谱进行检测,比较拉曼位移的变化。 -
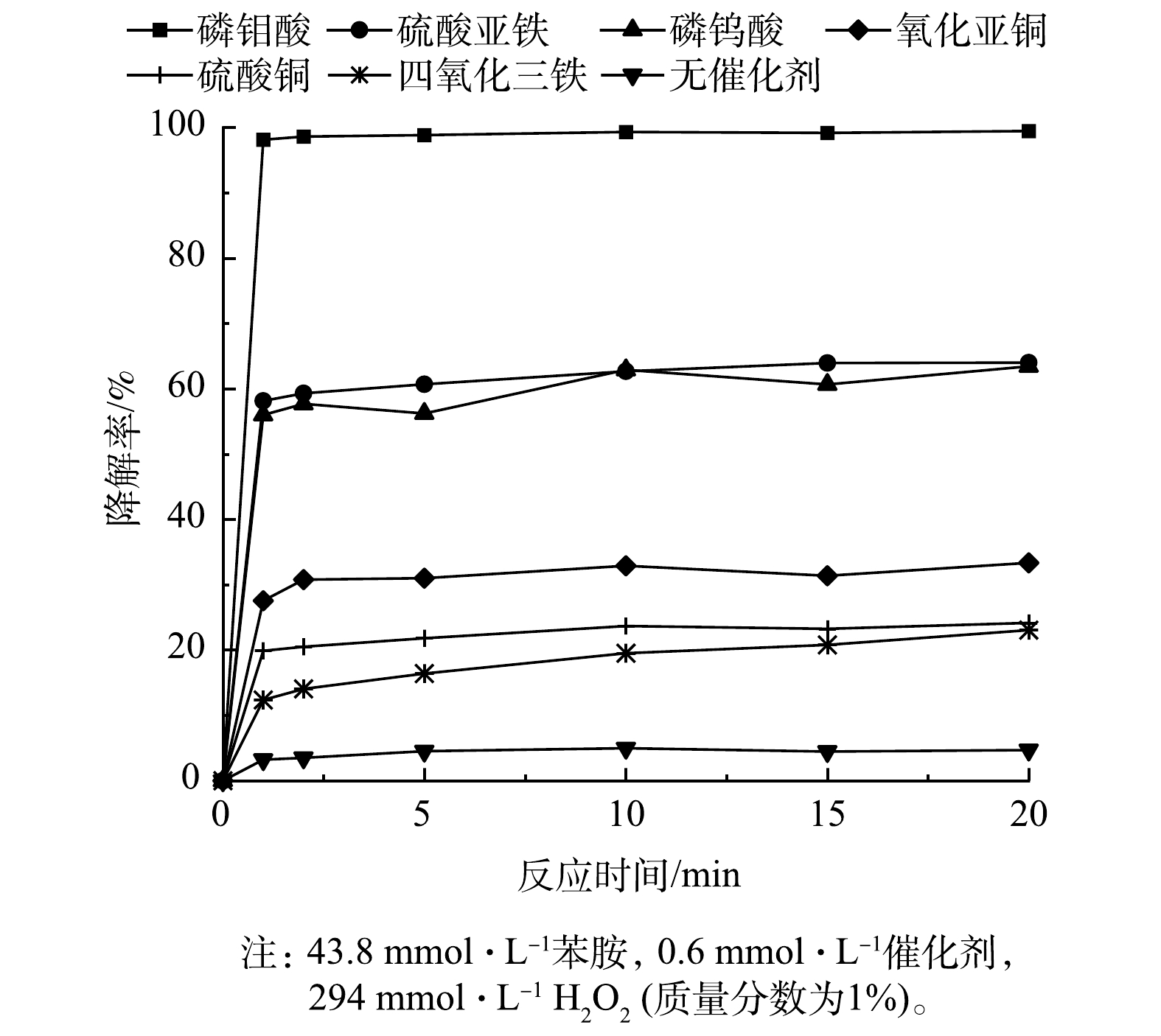
以苯胺为目标物,按照降解反应方法,考察硫酸亚铁、硫酸铜、纳米四氧化三铁、氧化亚铜、磷钨酸以及磷钼酸(PMA)等6种催化剂催化H2O2降解苯胺的效果。由图1可见,未加入催化剂时,H2O2降解苯胺的效果较差,降解率在10%以内;加入催化剂后,H2O2催化体系降解苯胺的效果明显提高,且在5 min内降解反应基本完成。这说明此类催化体系反应活性高,降解速度快。同时,通过比较不同催化剂催化H2O2降解苯胺的降解率,发现6种催化剂中PMA的催化效果最好,反应1 min后苯胺的降解率可达95%以上。
-
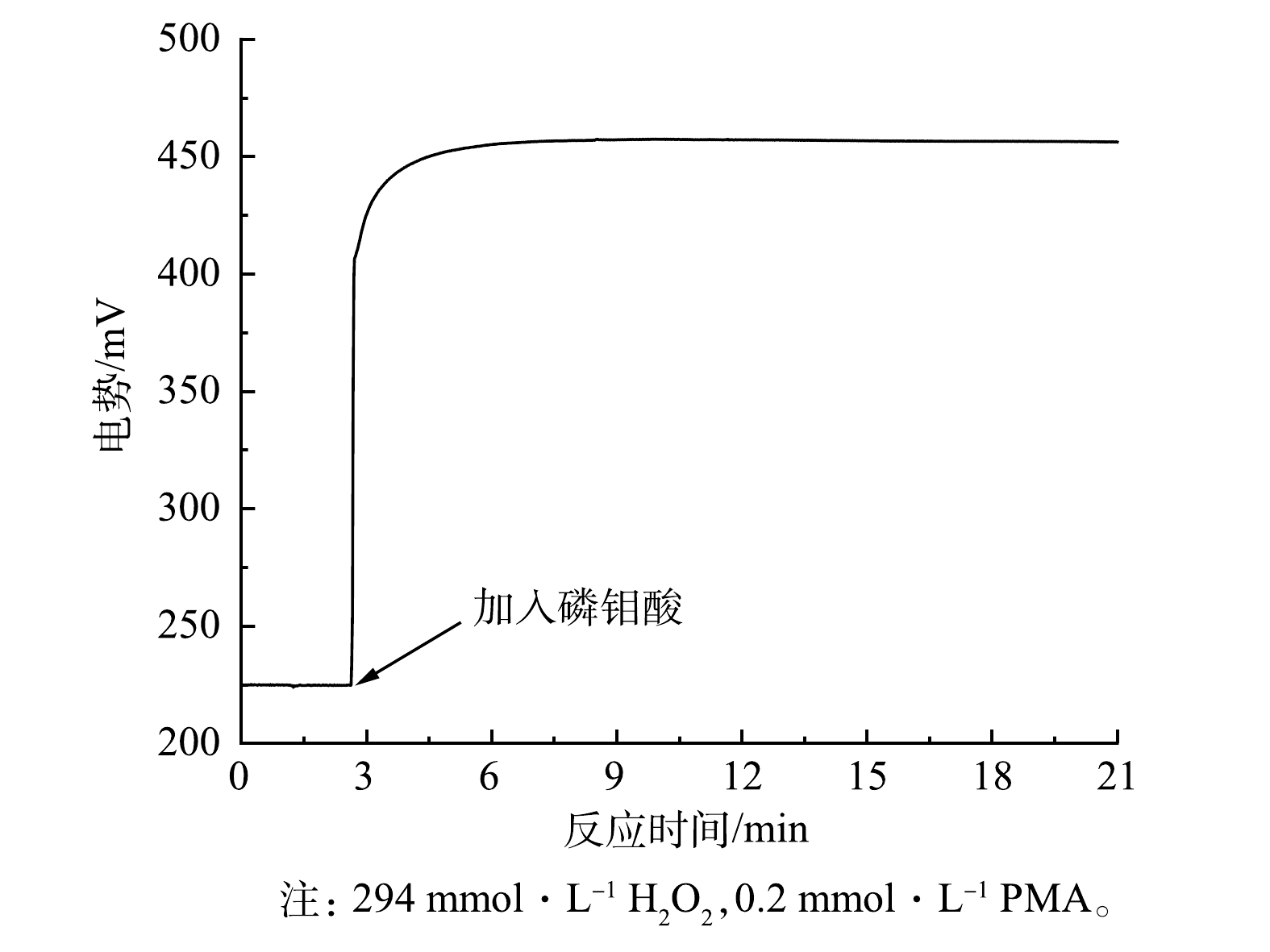
通过对H2O2/PMA催化体系氧化还原电位的监测(图2),发现PMA的加入能够迅速提高H2O2溶液的氧化势,且较为稳定,电势变化量ΔE为231.6 mV。这说明H2O2/PMA催化体系催化反应快、活性高且相对稳定。
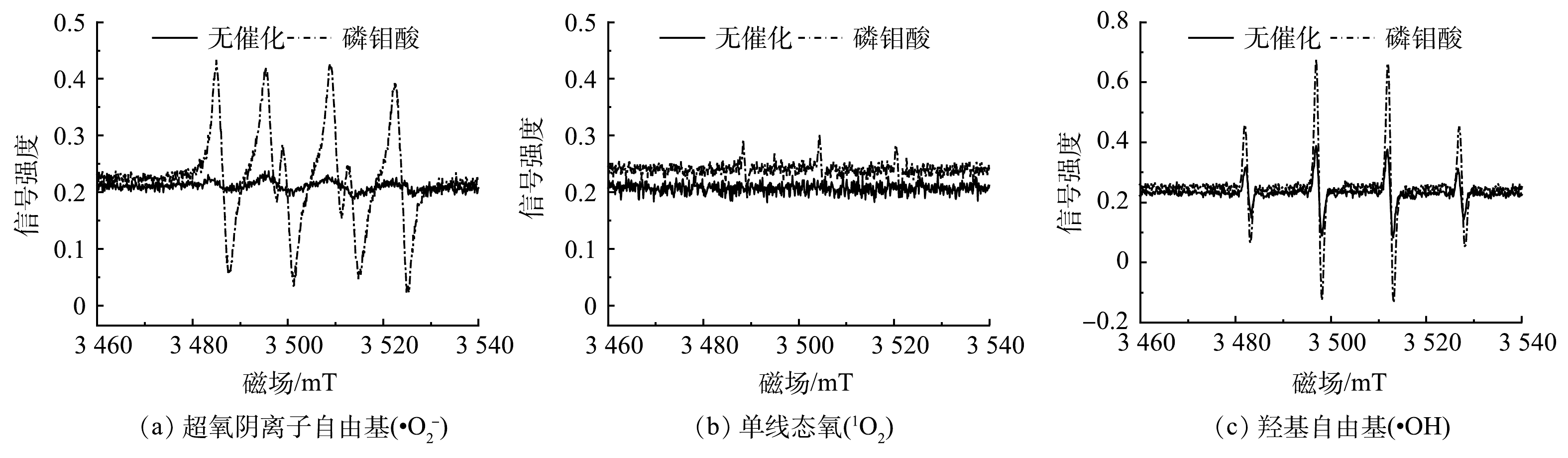
为了进一步确定H2O2/PMA催化体系中的活性物种,利用EPR检测H2O2在有无PMA催化条件下·
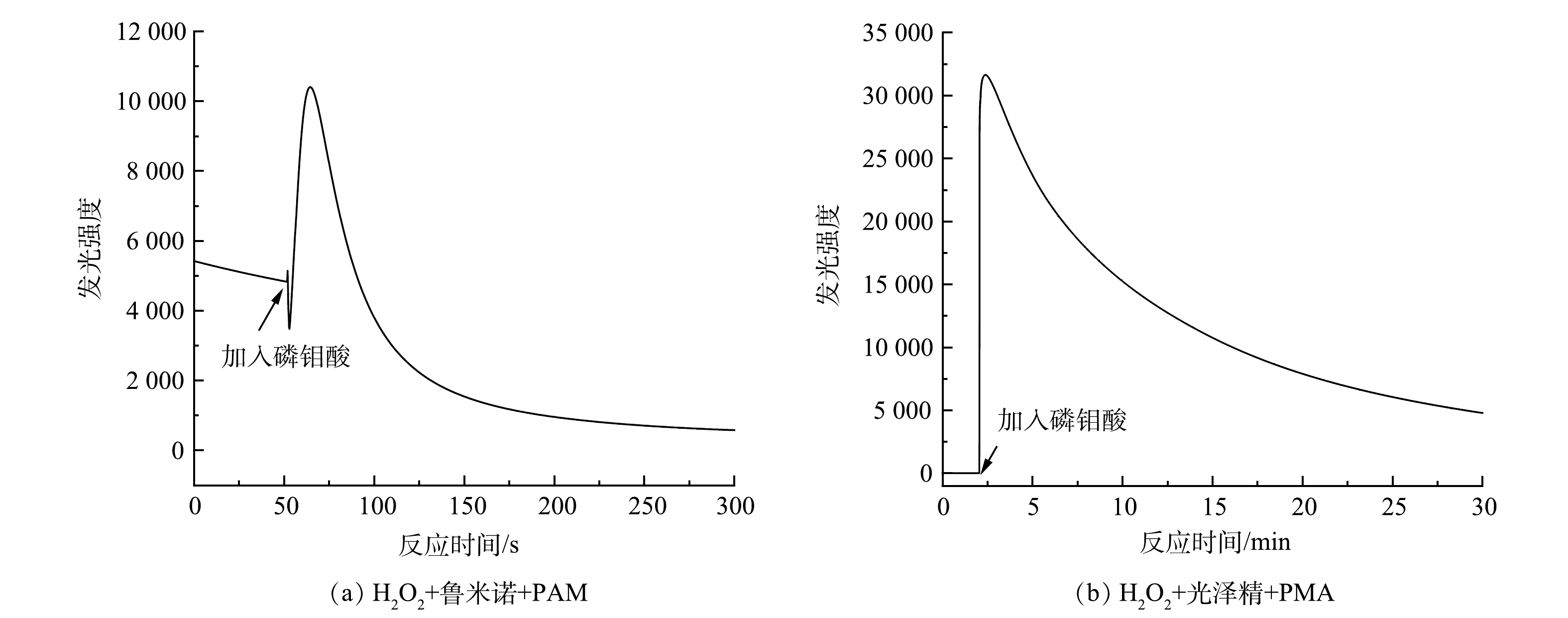
O−2 、·OH和1O2 3种活性氧的生成情况。由图3可以看出,PMA催化H2O2产生·O−2 和·OH较多、1O2较少。为了进一步确定H2O2/PMA催化体系中活性物种的浓度分布情况,利用化学发光法检测了3种活性物质随反应时间的变化情况。鲁米诺试剂可与H2O2、1O2、·OH以及·
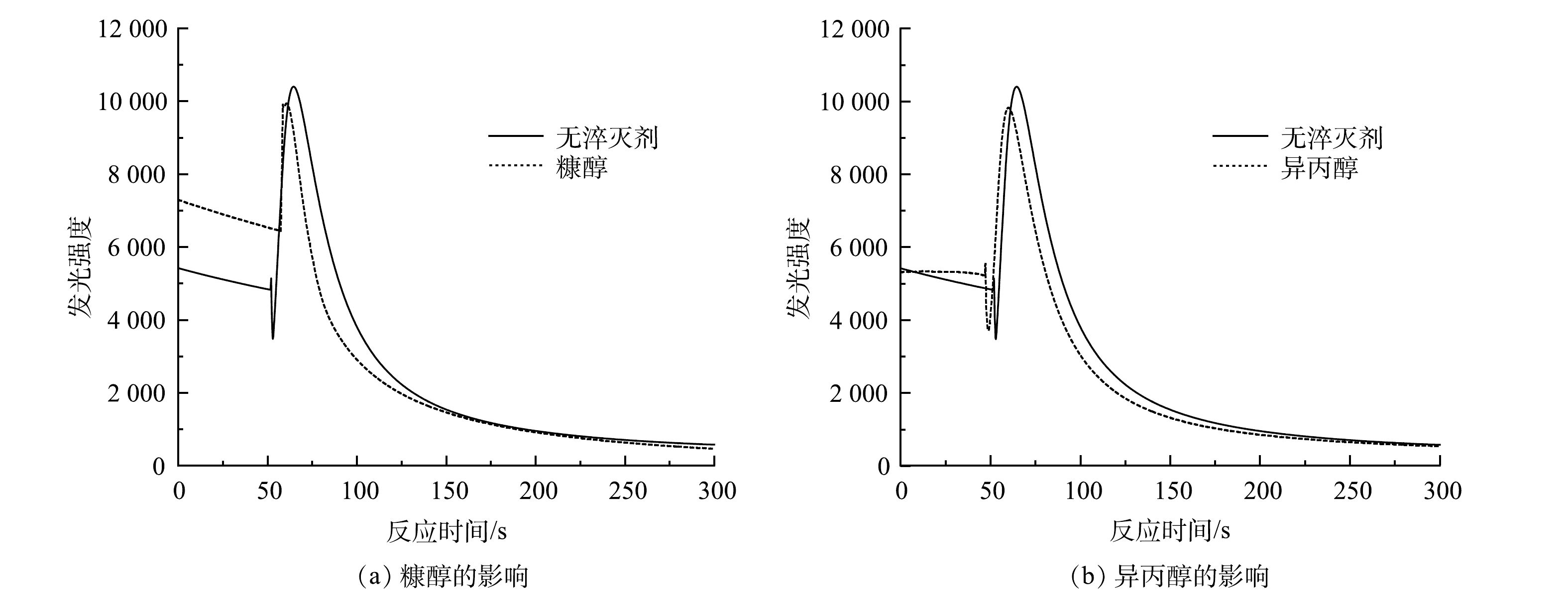
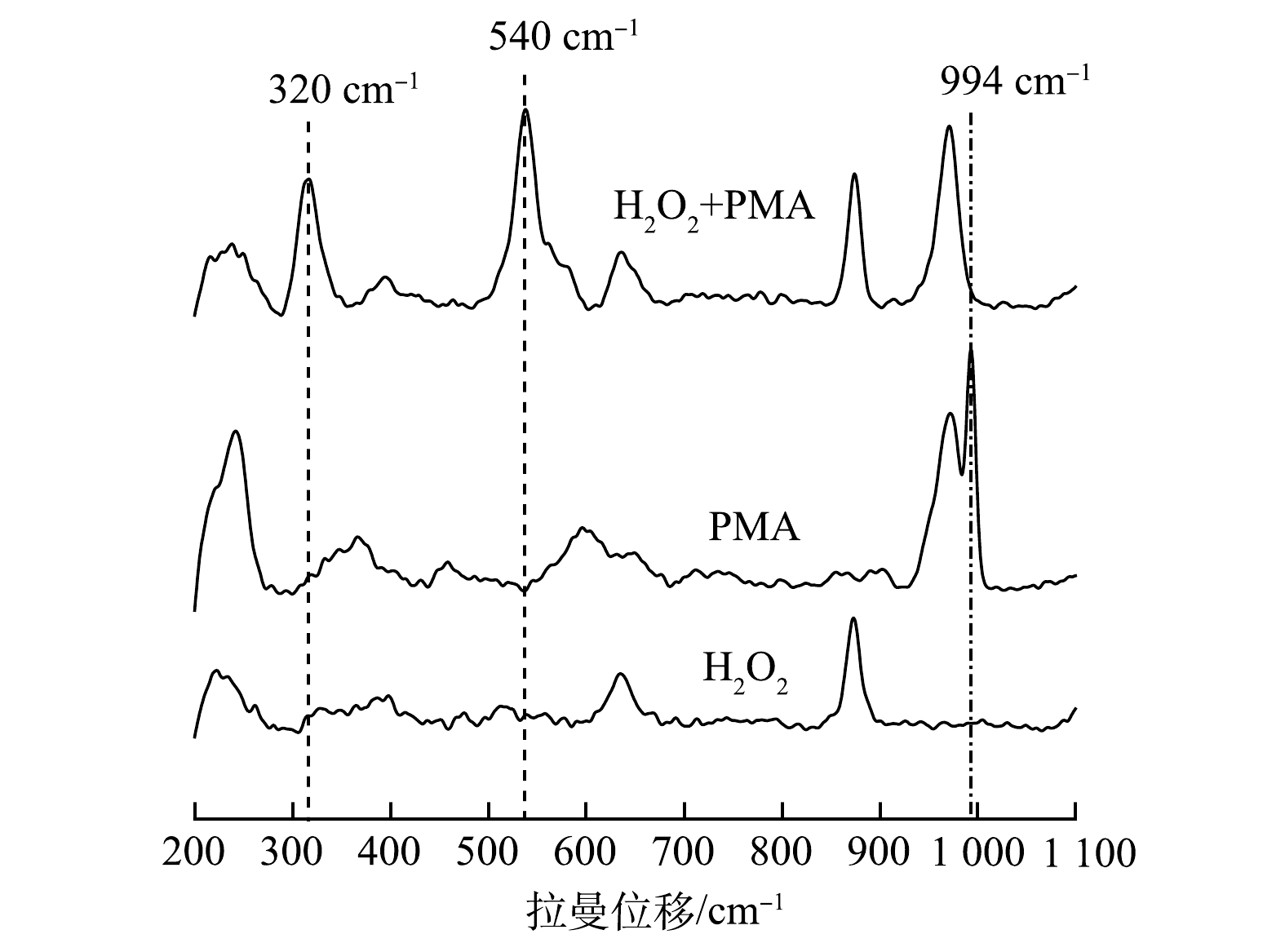
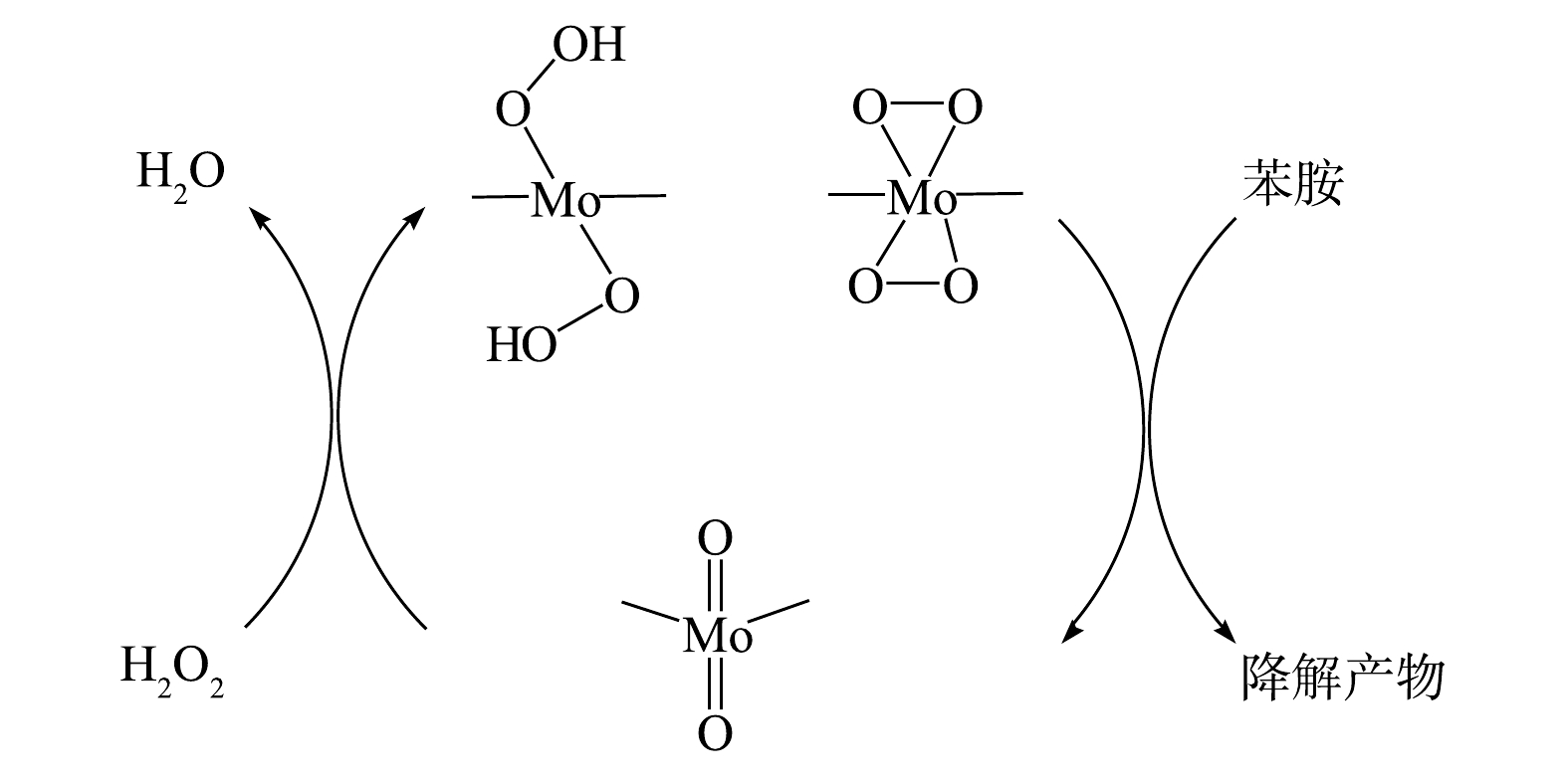
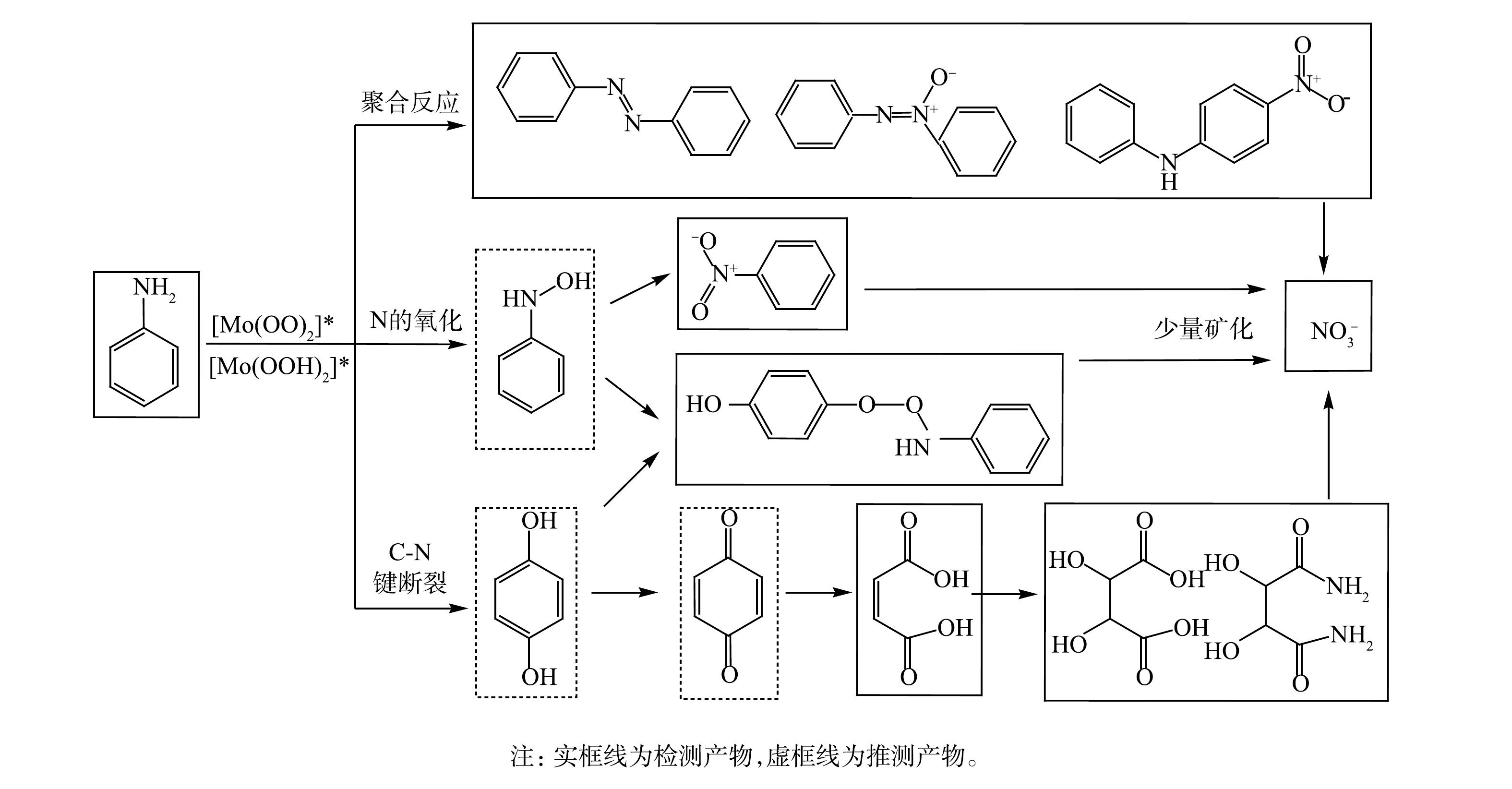
O−2 反应发光,光泽精可特异性与·O−2 反应发光,异丙醇和糠醇分别可特异性淬灭·OH和1O2[16-21]。因此,利用化学发光法检测H2O2催化体系中产生的活性氧种类和含量,结果如图4和图5所示。由图4(a)可见,加入PMA后发光强度明显上升。说明PMA催化H2O2产生了大量活性氧。由图4(b)可见,未加入PMA时光泽精与H2O2溶液不发光,加入PMA后产生较大的发光强度,且持续时间较长(30 min)。说明PMA催化H2O2可持续产生·O−2 。由图5可见,加入淬灭剂糠醇后发光强度有所降低。说明该催化体系产生了1O2。加入淬灭剂异丙醇后发光强度稍有降低。说明催化体系产生了·OH。实验中加入异丙醇(·OH淬灭剂)和糠醇(1O2淬灭剂)后,苯胺降解率基本没有变化。由此可推测,该体系的催化机理可能是非自由基反应。郭芬草等[22]和DONG等[14]认为,杂多酸在催化H2O2过程中生成多氧、过氧活性物质,其可作为氧化反应的高活性中间体。比较PMA、H2O2以及PMA催化H2O2体系的拉曼光谱图(图6),PMA催化H2O2后出现了320 cm−1和540 cm−1 2个新峰,同时在PMA溶液中994 cm−1的峰消失,245 cm−1的峰明显降低。PMA溶液中230~250 cm−1的峰归属于端Mo=O和整个骨架的振动频率[23],994 cm−1的峰归属于Mo=O的振动[24],混合后新产生的峰320 cm−1归属于四配位体Mo-O键的弯曲振动[25]。因此,进一步推测PMA催化H2O2生成高活性过氧化物[Mo(OO)2]*和[Mo(OOH)2]*作为反应的中间体(图7)。此类活性中间体相比自由基有更好的稳定性,在溶液中不会快速分解,可提升活性氧的利用率。
-
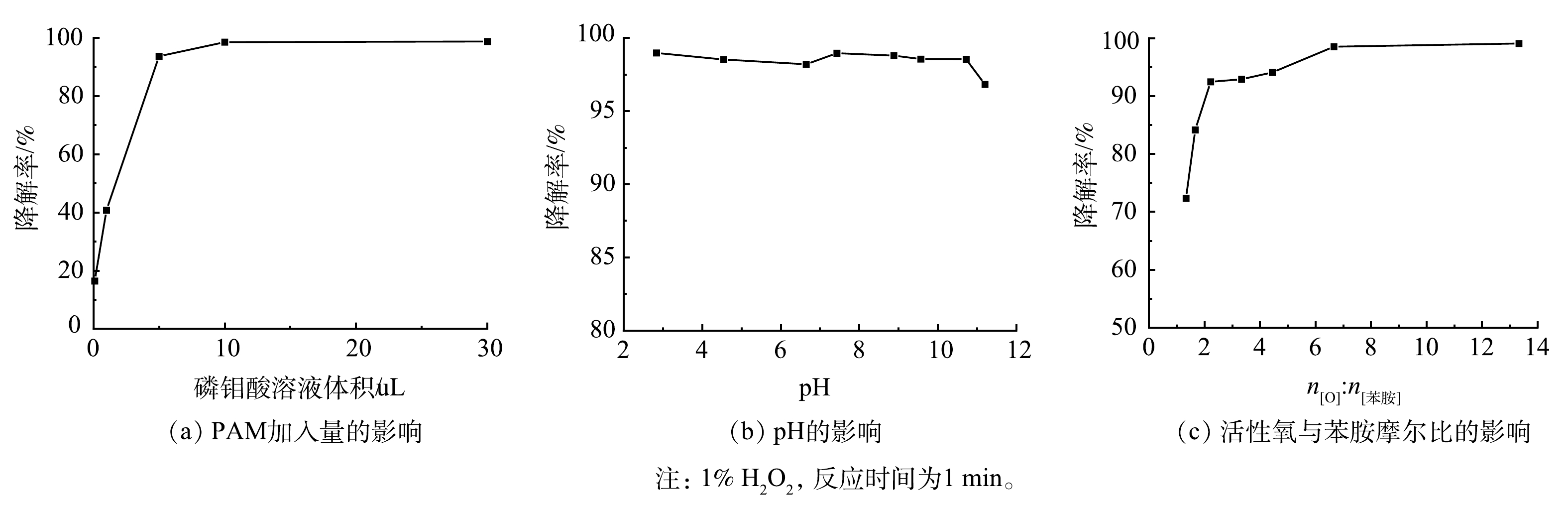
以苯胺降解率为评价指标,考察H2O2与PMA的浓度比、催化体系pH以及活性氧与苯胺的摩尔比等因素,从而获得H2O2/PMA催化体系最佳反应条件。由图8(a)可以看出,在PMA用量为0~30 μL(以0.1 mol·L−1的PMA溶液计)时,随着PMA用量的增加,苯胺的降解率先升高后趋于稳定,当PMA用量超过10 μL(即PMA质量分数为0.365‰)之后,降解率基本保持不变。在PMA质量分数为0.365‰时,用NaOH溶液与稀H2SO4溶液调节体系pH,考察pH对苯胺降解率的影响。由图8(b)可见,pH在3~10时苯胺的降解率变化不明显。这说明该催化体系受pH影响不大。在PMA和H2O2的质量分数分别为0.365‰和1%时,考察了活性氧与苯胺摩尔比对降解率的影响。如图8(c)所示,随着n[O]:n[苯胺](活性氧与苯胺的摩尔比)的增加,苯胺降解率逐渐升高。当n[O]:n[苯胺]>2时,降解率在90%以上;当n[O]:n[苯胺]>6时,苯胺降解效果基本保持不变,降解率在98%以上。总之,当H2O2和PMA分别为1%和0.365‰,溶液的pH为4,在1 min内对4 mg·mL−1的苯胺降解率可达98%以上。
-
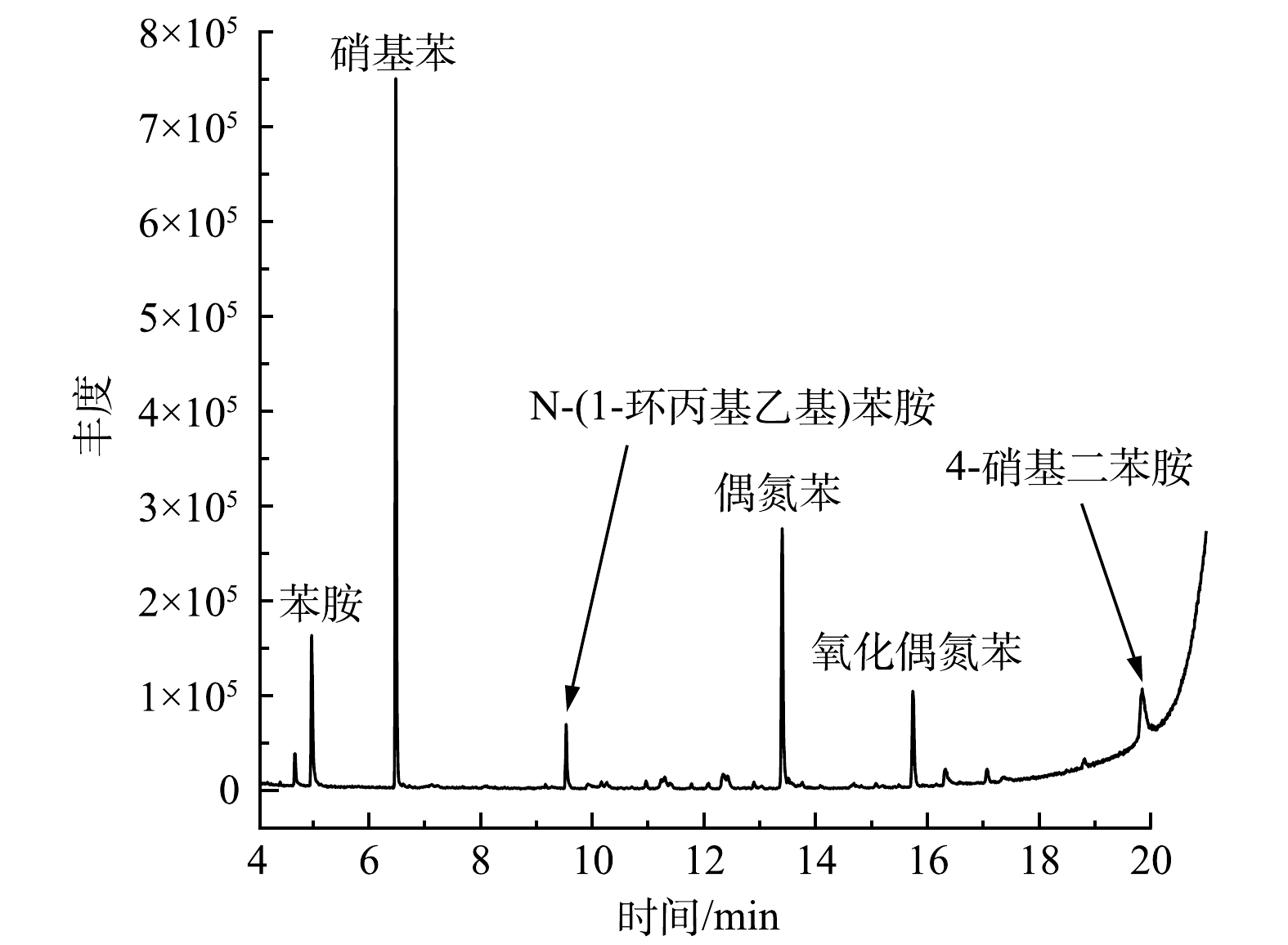
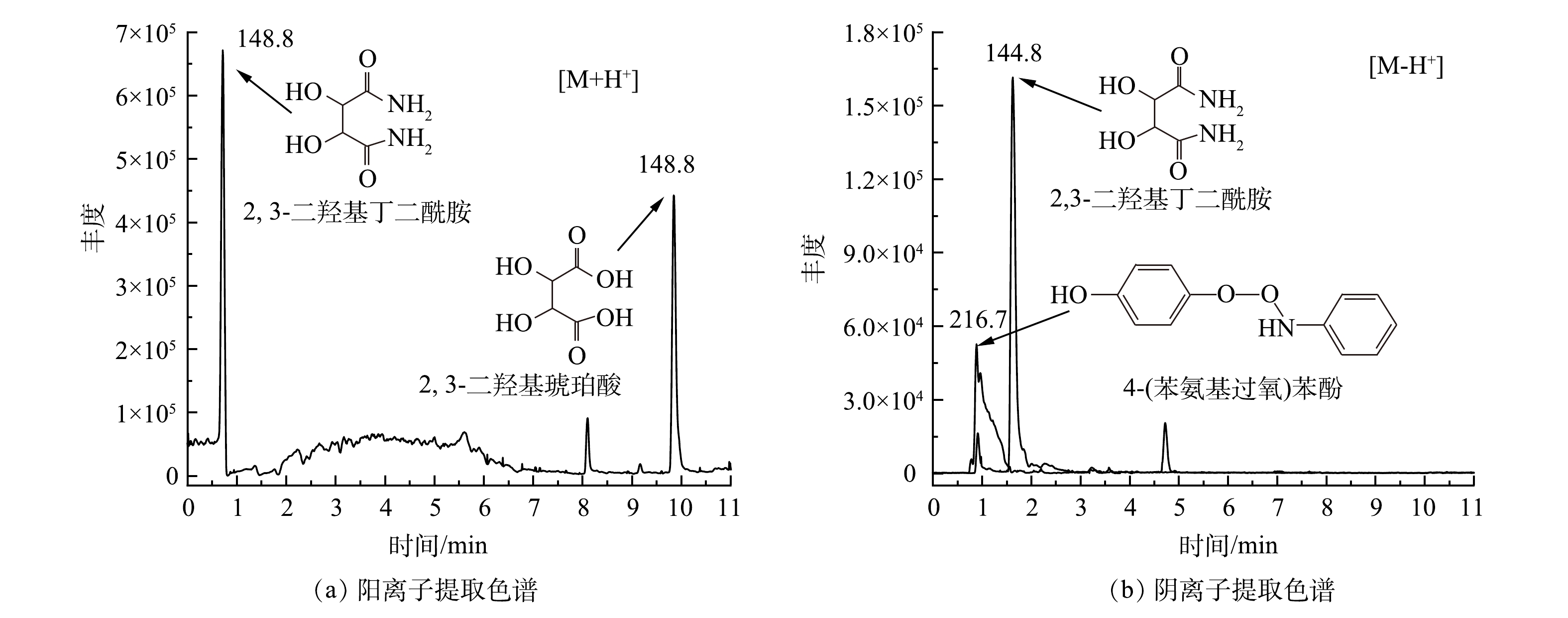
为了确定苯胺在H2O2/PMA催化体系中的降解途径,利用GC/MS、LC/MS和IC等分析方法检测了苯胺降解产物。苯胺在H2O2/PMA体系中反应1 d后降解产物的GC/MS总离子流图和可能降解产物主要有硝基苯和苯胺聚合物(图9)。经IC检测,反应后
NO−3 的含量为51.03 mg·kg−1。据此计算,苯胺矿化率约为9.2%。苯胺在H2O2/PMA催化体系中降解产物的LC/MS提取离子色谱图如图10所示。可见,苯胺降解生成的主要化合物为2,3-二羟基琥珀酸、4-(苯氨基过氧)苯酚和2,3-二羟基丁二酰胺。根据检测到的产物和苯胺在类Fenton体系中的降解机理[26-27],可推测苯胺在H2O2/PMA催化体系中降解途径可能有以下3种(图11):一是苯胺首先被氧化成对苯酚,然后被氧化成对苯醌、马来酸、2,3-二羟基琥珀酸,部分2,3-二羟基琥珀酸可与体系中生成的氨反应生成2,3-二羟基丁二酰胺;二是苯胺被氧化成羟基苯胺,一部分羟基苯胺被氧化成硝基苯,另一部分羟基苯胺与对苯酚反应生成4-(苯氨基过氧)苯酚;三是苯胺相互之间反应生成苯胺类聚合物偶氮苯和4-硝基二苯胺,偶氮苯经氧化形成氧化偶氮苯。这些产物都可矿化成
NO−3 。 -
1)金属配位体类催化剂杂多酸PMA,对H2O2催化速度快、活性高且相对稳定。
2) PMA催化H2O2主要产生高活性的过氧化物[Mo(OO)2]*和[Mo(OOH)2]*;对苯胺的降解主要是非自由基反应。
3) PMA的最佳加入量为0.2 mmol·L−1,该体系在pH为3~10内,降解能力不受pH影响;为了使降解率在90%以上,H2O2中活性氧与苯胺的摩尔比不宜低于2;当H2O2和PMA分别为1%和0.365‰,溶液pH为4,在1 min内对4 mg·mL−1苯胺的降解率可达98%以上。
4)在H2O2/PMA体系中,苯胺的中间产物主要有硝基苯、苯胺聚合物、硝酸盐等。初步推测,其降解反应途径主要以N、C原子的氧化和聚合反应为主。
过氧化氢/磷钼酸体系的催化机制及对苯胺的降解效果
Catalytic mechanism and performance of the hydrogen peroxide/phosphomolybdic acid system on aniline degradation
-
摘要: 以苯胺为目标污染物,通过苯胺的降解实验从3类6种过氧化氢催化剂中筛选出催化效果较好的杂多酸催化剂磷钼酸(PMA)。利用氧化还原电位测定法、电子顺磁共振波谱法、化学发光法以及拉曼光谱法分析了H2O2/PMA催化体系的催化机制,初步推测PMA催化H2O2生成高活性的[Mo(OO)2]*和[Mo(OOH)2]*中间体。同时,考察了PMA用量、pH以及苯胺与活性氧的摩尔比对苯胺降解效果的影响,获得了H2O2/PMA体系最佳反应条件。当H2O2和PMA质量分数分别为1%和0.365‰、溶液pH为4,在1 min内对4 mg·mL−1苯胺的降解率可达98%以上。通过气相色谱质谱联用仪(GC/MS)、液相色谱质谱联用仪(LC/MS)和离子色谱(IC)等仪器分析方法检测确定苯胺的降解产物,推测其在H2O2/PMA催化体系的降解途径主要以N、C原子的氧化和聚合反应为主。Abstract: In this study, aniline was taken as a pollutant object, a heteropolyacid catalyst of phosphomolybdic acid(PMA) with better catalytic effect was screened out among six kinds of catalysts combined with hydrogen peroxide solution which could be divided as three types. The catalysis mechanism of H2O2/PMA system was anayzed through redox potential measurement, electron paramagnetic resonance, chemiluminescence and Raman spectroscopy. The experimental results indicated that H2O2 was catalyzed by PMA to produce highly active [Mo(OO)2]* and [Mo(OOH)2]* intermediate species. Meanwhile, the effects of PMA dosage, pH value and the molar ratio of aniline to reactive oxygen species on aniline degradation efficiency were studied to determine the optimum degradation conditions of H2O2/PMA system. When the mass concentrations of H2O2 and PMA were 1% and 0.365‰, respectively, over 98% aniline could be degraded within 1min for the solution with pH=4 and initial concentration of 4 mg·mL-1. The degradation products of aniline were determined by gas chromatography-mass spectrometry(GC/MS), liquid chromatography-mass spectrometry(LC/MS) and ion chromatography(IC), then it can be predicted that the main pathway of aniline degradation was oxidation and polymerization of N and C atom in H2O2/PMA oxidation system.
-
Key words:
- hydrogen peroxide /
- phosphomolybdic acid /
- aniline /
- catalytic mechanism /
- degradation pathway
-
过氧化氢作为一种绿色氧化剂[1],在催化剂作用下可产生氧化性极强的活性自由基,能够无选择地氧化降解水中的有机污染物,被广泛应用于有机物的氧化和工业废水的处理[2-3]。目前,常用的H2O2催化活化剂包括无机催化剂和有机活化剂。无机催化剂种类有金属离子、金属氧化物、金属配位体等。例如,金属离子催化剂Fenton试剂,Fe2+催化H2O2产生·OH把有机物氧化成CO2、H2O等小分子物质。Fenton反应对pH要求苛刻,并产生大量污泥,因此,类Fenton技术不断发展[4]。杨迦等[5]利用硫酸钠-过氧化氢-氯化钠加合物类芬顿试剂降解了苯胺。金属氧化物催化剂常用的有Fe、Mn、Cu、Ce、Ni、Co、Cr等的氧化物以及钼酸盐[6-7]。在中性条件下,钼酸根催化过氧化氢处理2,4,6-三氯酚和五氯酚废水,降解率可达95%以上[8]。但在酸性条件下,钼酸根催化过氧化氢的效率相对较低[9]。金属配合物催化剂包括酞菁配合物[10]、卟啉配合物、含氮大环配合物、席夫碱配合物[11]和杂多酸(盐)[12]。其中,合成的席夫碱镧系配位体LaL(NO3)3.xH2O和LnL2(NO3)3.xH2O催化H2O2降解苯胺具有很好的选择性[13]。DONG等[14]通过制备杂多酸盐Mg3Al-LDH-Nb6催化H2O2得到高活性氧化体系,对2-CEES(2-氯乙基乙基硫醚)有很好的降解效果。面对催化剂催化条件要求高的问题,寻找条件温和、活性高、适用范围广的过氧化氢催化剂显得尤为重要。
苯胺作为重要的工业原料主要用于制造染料、药物、树脂,还可以作为橡胶硫化促进剂,因此,在相关生产中不可避免地会产生大量苯胺污染水[15]。本文以苯胺为研究对象,依据上述相关文献和市售大宗化学品种类,从过氧化氢金属离子、金属氧化物和金属配位体等3类催化剂中选择了6种化合物(Fe、Cu、磷钼酸等),研究了其催化H2O2降解苯胺的效果;采用电子顺磁共振法、氧化还原电位测定法、化学发光法以及拉曼光谱法检测了PMA催化H2O2产生的活性物质及分布规律,探讨了H2O2催化机制;此外,进一步考察了催化剂用量、pH以及活性氧与苯胺的摩尔比对苯胺降解效果的影响,以获得H2O2/PMA催化体系的最佳反应条件;最后,利用GC/MS、LC/MS和IC等仪器分析方法检测苯胺的降解产物,探讨苯胺在H2O2/PMA催化体系中的降解途径。
1. 实验部分
1.1 实验材料
实验设备:SI Vortex Genie 2涡旋振荡器(美国);5975T气质联用仪(安捷伦);6460型液相色谱质谱仪(安捷伦);拉曼光谱仪(上海如海光电);AQ-1100离子色谱(赛默飞)。IFFM-E化学发光分析仪(西安瑞迈);IVIUM电化学工作站(天津德尚)。
实验试剂:H2O2(30%,北京化工);二氯甲烷(HPLC等级,迈瑞尔);苯胺、硫代硫酸钠、无水硫酸钠、纳米四氧化三铁、氧化亚铜、磷钨酸水合物、磷钼酸水合物、硫酸亚铁、五水合硫酸铜(均为分析纯,麦克林)。
1.2 实验方法
1)苯胺降解反应。在15 mL玻璃样品瓶中加入一定体积的苯胺液滴,然后,加入5 mL质量分数为1%的H2O2溶液与一定体积的0.1 mol·L−1催化剂,再置于25 ℃的恒温箱中以600 r·min−1的转速涡旋振荡反应一定时间后,用1 mL 5% Na2S2O3溶液中止反应;最后,加入5 mL二氯甲烷超声萃取10 min,静置分层后取下层有机相进行GC/MS分析,取上层水样进行LC/MS分析;采用IC进行
NO−3 2)苯胺及降解产物分析方法。GC/MS检测条件:毛细管柱HP-5(30 m×25 mm×0.25 μm);升温程序为初始温度50 ℃,以10 ℃·min−1升温至280 ℃(保持1 min)。质谱EI源、全扫描、扫描范围为50~500。
降解产物LC/MS检测条件:色谱柱C18(150 mm×2.1 mm×1.8 μm);流动相0.1%(v/v)甲酸水溶液-0.1%(v/v)甲酸甲醇溶液体系;梯度洗脱;流速0.3 mL·min−1。质谱条件:电喷雾离子化源(ESI);正离子、负离子全扫描。
3)催化机理的研究方法。使用电化学工作站监测反应体系的氧化还原电位,得到电势随时间的变化(E-t)曲线;使用EPR检测催化体系中的活性氧·
O−2 2. 结果与讨论
2.1 催化剂的筛选
以苯胺为目标物,按照降解反应方法,考察硫酸亚铁、硫酸铜、纳米四氧化三铁、氧化亚铜、磷钨酸以及磷钼酸(PMA)等6种催化剂催化H2O2降解苯胺的效果。由图1可见,未加入催化剂时,H2O2降解苯胺的效果较差,降解率在10%以内;加入催化剂后,H2O2催化体系降解苯胺的效果明显提高,且在5 min内降解反应基本完成。这说明此类催化体系反应活性高,降解速度快。同时,通过比较不同催化剂催化H2O2降解苯胺的降解率,发现6种催化剂中PMA的催化效果最好,反应1 min后苯胺的降解率可达95%以上。
2.2 催化机理分析
通过对H2O2/PMA催化体系氧化还原电位的监测(图2),发现PMA的加入能够迅速提高H2O2溶液的氧化势,且较为稳定,电势变化量ΔE为231.6 mV。这说明H2O2/PMA催化体系催化反应快、活性高且相对稳定。
为了进一步确定H2O2/PMA催化体系中的活性物种,利用EPR检测H2O2在有无PMA催化条件下·
O−2 O−2 为了进一步确定H2O2/PMA催化体系中活性物种的浓度分布情况,利用化学发光法检测了3种活性物质随反应时间的变化情况。鲁米诺试剂可与H2O2、1O2、·OH以及·
O−2 O−2 O−2 郭芬草等[22]和DONG等[14]认为,杂多酸在催化H2O2过程中生成多氧、过氧活性物质,其可作为氧化反应的高活性中间体。比较PMA、H2O2以及PMA催化H2O2体系的拉曼光谱图(图6),PMA催化H2O2后出现了320 cm−1和540 cm−1 2个新峰,同时在PMA溶液中994 cm−1的峰消失,245 cm−1的峰明显降低。PMA溶液中230~250 cm−1的峰归属于端Mo=O和整个骨架的振动频率[23],994 cm−1的峰归属于Mo=O的振动[24],混合后新产生的峰320 cm−1归属于四配位体Mo-O键的弯曲振动[25]。因此,进一步推测PMA催化H2O2生成高活性过氧化物[Mo(OO)2]*和[Mo(OOH)2]*作为反应的中间体(图7)。此类活性中间体相比自由基有更好的稳定性,在溶液中不会快速分解,可提升活性氧的利用率。
2.3 H2O2/PMA体系降解苯胺的影响因素
以苯胺降解率为评价指标,考察H2O2与PMA的浓度比、催化体系pH以及活性氧与苯胺的摩尔比等因素,从而获得H2O2/PMA催化体系最佳反应条件。由图8(a)可以看出,在PMA用量为0~30 μL(以0.1 mol·L−1的PMA溶液计)时,随着PMA用量的增加,苯胺的降解率先升高后趋于稳定,当PMA用量超过10 μL(即PMA质量分数为0.365‰)之后,降解率基本保持不变。在PMA质量分数为0.365‰时,用NaOH溶液与稀H2SO4溶液调节体系pH,考察pH对苯胺降解率的影响。由图8(b)可见,pH在3~10时苯胺的降解率变化不明显。这说明该催化体系受pH影响不大。在PMA和H2O2的质量分数分别为0.365‰和1%时,考察了活性氧与苯胺摩尔比对降解率的影响。如图8(c)所示,随着n[O]:n[苯胺](活性氧与苯胺的摩尔比)的增加,苯胺降解率逐渐升高。当n[O]:n[苯胺]>2时,降解率在90%以上;当n[O]:n[苯胺]>6时,苯胺降解效果基本保持不变,降解率在98%以上。总之,当H2O2和PMA分别为1%和0.365‰,溶液的pH为4,在1 min内对4 mg·mL−1的苯胺降解率可达98%以上。
2.4 产物分析及降解途径推测
为了确定苯胺在H2O2/PMA催化体系中的降解途径,利用GC/MS、LC/MS和IC等分析方法检测了苯胺降解产物。苯胺在H2O2/PMA体系中反应1 d后降解产物的GC/MS总离子流图和可能降解产物主要有硝基苯和苯胺聚合物(图9)。经IC检测,反应后
NO−3 根据检测到的产物和苯胺在类Fenton体系中的降解机理[26-27],可推测苯胺在H2O2/PMA催化体系中降解途径可能有以下3种(图11):一是苯胺首先被氧化成对苯酚,然后被氧化成对苯醌、马来酸、2,3-二羟基琥珀酸,部分2,3-二羟基琥珀酸可与体系中生成的氨反应生成2,3-二羟基丁二酰胺;二是苯胺被氧化成羟基苯胺,一部分羟基苯胺被氧化成硝基苯,另一部分羟基苯胺与对苯酚反应生成4-(苯氨基过氧)苯酚;三是苯胺相互之间反应生成苯胺类聚合物偶氮苯和4-硝基二苯胺,偶氮苯经氧化形成氧化偶氮苯。这些产物都可矿化成
NO−3 3. 结论
1)金属配位体类催化剂杂多酸PMA,对H2O2催化速度快、活性高且相对稳定。
2) PMA催化H2O2主要产生高活性的过氧化物[Mo(OO)2]*和[Mo(OOH)2]*;对苯胺的降解主要是非自由基反应。
3) PMA的最佳加入量为0.2 mmol·L−1,该体系在pH为3~10内,降解能力不受pH影响;为了使降解率在90%以上,H2O2中活性氧与苯胺的摩尔比不宜低于2;当H2O2和PMA分别为1%和0.365‰,溶液pH为4,在1 min内对4 mg·mL−1苯胺的降解率可达98%以上。
4)在H2O2/PMA体系中,苯胺的中间产物主要有硝基苯、苯胺聚合物、硝酸盐等。初步推测,其降解反应途径主要以N、C原子的氧化和聚合反应为主。
-
-
[1] VOGT C, ALFREIDER A, LORBEERB H, et al. Bioremediation of chlorobenzene-contaminated ground water in an in situ reactor mediated by hydrogen peroxide[J]. Journal of Contaminant Hydrology, 2004, 68(1/2): 121-141. [2] 张文兵, 肖贤明, 傅家谟, 等. 过氧化氢高级氧化技术去除水中有机污染物[J]. 中国给水排水, 2002, 18(3): 89-92. doi: 10.3321/j.issn:1000-4602.2002.03.027 [3] GHANBARI F, WANG Q L, HASSANI A, et al. Electrochemical activation of peroxides for treatment of contaminated water with landfill leachate: Efficacy, toxicity and biodegradability evaluation[J]. Chemosphere 2021, 279: 130610. [4] 吕来, 胡春. 多相芬顿催化水处理技术与原理[J]. 化学进展, 2017, 29(9): 981-999. doi: 10.7536/PC170552 [5] 杨迦, 李璇, 马小燕, 等. 新型过氧化氢加合物的活化及降解苯胺研究[J]. 应用化工, 2020, 49(7): 1746-1750. [6] FAKHRAIAN H, VALIZADEH F. Activation of hydrogen peroxide via bicarbonate, sulfate, phosphate andurea in the oxidation of methyl phenyl sulfide[J]. Journal of Molecular Catalysis A: Chemical. 2010, 331(1): 69-72. [7] WAGNER G W, YANG Y C. Rapid nucleophilic/oxidative decontamination of chemical warfare agents[J]. Industrial and Engineering Chemistry Research, 2002, 41(8): 1925-1928. doi: 10.1021/ie010732f [8] TAI C, JIANG G. Dechlorination and destruction of 2, 4, 6-trichlorophenol and pentachlorophenol using hydrogen peroxide as the oxidant catalyzed by molybdate ions under basic condition[J]. Chemosphere, 2005, 59: 321-326. doi: 10.1016/j.chemosphere.2004.10.024 [9] DONG L L, WANG W M. Catalytic activities of dissolved and sch-immobilized Mo in H2O2 decomposition: Implications for phenol oxidation under acidic conditions[J]. Applied Catalysis B:Environmental, 2016, 185: 371-377. doi: 10.1016/j.apcatb.2015.12.010 [10] HAN Z B, HAN X, ZHAO X M. Iron phthalocyanine supported on amidoximated PAN fiber as effective catalyst for controllable hydrogen peroxide activation in oxidizing organic dyes[J]. Journal of Hazardous Materials, 2016, 320: 27-35. doi: 10.1016/j.jhazmat.2016.08.004 [11] 彭建彪, 张耀宗, 张亚, 等. 一种席夫碱铜配合物催化过氧化氢氧化降解三氯生[J]. 环境化学, 2019, 38(5): 978-984. [12] KUZNETSOVA N I, KIRILLOVA N V, KUZNETSOVA L I, et al. Hydrogen peroxide and oxygen–hydrogen oxidation of aromatic compounds in catalytic systems containing heteropoly compounds[J]. Journal of Hazardous Materials, 2007, 146(3): 569-576. doi: 10.1016/j.jhazmat.2007.04.058 [13] TAHA Z A, HIJAZI A K. Structural and photophysical properties of lanthanide complexes with N'-(2-methoxybenzylidene)-2-pyridinecarbohydrazide schiff base ligand: Catalyzed oxidation of anilines with hydrogen peroxide[J]. Journal of Molecular Structure, 2021, 1238: 130451. doi: 10.1016/j.molstruc.2021.130451 [14] DONG J, LV H J, SUN X G, et al. A versatile self-detoxifying material based on immobilized polyoxoniobate for decontamination of chemical warfare agent simulants[J]. Chemistry(Weinheimander, Bergstrasse, Germany), 2018, 24(72): 19208-19215. [15] 张华, 张子鹏, 张澜澜, 等. H2O2强化光催化处理苯胺化工废水的应用试验[J]. 化工进展, 2020, 39(12): 5299-5308. [16] 赵三平. 典型活化H2O2消毒体系的活性氧及其对化学毒剂的消毒机制研究[D]. 北京: 防化研究院, 2015. [17] KHAN F, YAQOOB M, ASGHAR M, et al. Surfactant enhanced flow injection chemiluminescence method for vitamin D3 determination in pharmaceutical formulations[J]. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy, 2018, 208: 150-156. [18] 何耀宇, 江治, 上官文峰, 等. 活性氧物种及其检测方法的研究进展[J/OL]. 过程工程学报: 1-16[2021-10-13]. http://kns.cnki.net/kcms/detail/11.4541.TQ.20210222.1104.002.html. [19] 孙家倩. 自然水体生物膜体系中活性氧的生成及其对典型有机污染物的降解[D]. 长春: 吉林大学, 2016. [20] YU, W C, ZHAO, L X. Chemiluminescence detection of reactive oxygen species generation and potential environmental applications[J]. TrAC:Trends in Analytical Chemistry, 2021, 136: 116197. doi: 10.1016/j.trac.2021.116197 [21] 戴慧旺, 陈建新, 苗笑增, 等. 醇类对UV-Fenton体系羟基自由基淬灭效率的影响[J]. 中国环境科学, 2018, 38(1): 202-209. doi: 10.3969/j.issn.1000-6923.2018.01.024 [22] 郭芬草, 李鹏翔, 廉红蕾. 基于杂多酸的高效氧化脱硫催化剂的合成及应用[J]. 现代化工, 2018, 38(3): 62-66. [23] KATARZYNA B, JERZY H, EWA M. Acid-base and oxidation catalysis on heteropolysalts with surface acid layers[J]. Faraday Discussions of the Chemical Society, 1989, 87(1): 173-187. [24] 郑寿荣, 戚海华, 颜其洁, 傅献彩. 12-钼磷酸与γ酸Al2O3载体的相互作用[J]. 物理化学学报, 1994(6): 521-525. doi: 10.3866/PKU.WHXB19940608 [25] 辛勤, 熊光, 高兴涛, 等. Mo/Al2O3催化剂中钼配位结构的原位红外和拉曼光谱表征[J]. 光散射学报, 1998, 10(3/4): 132-135. [26] 秦月娇, 耿烁, 焦纬洲, 等. 用超重力技术强化O3/Fe(Ⅱ)工艺深度氧化降解苯胺废水[J]. 含能材料, 2018, 26(5): 448-454. doi: 10.11943/j.issn.1006-9941.2018.05.013 [27] LIU Y C, ZHANG G M, FANG S Y, et al. Degradation of aniline by heterogeneous fenton's reaction using a Ni-Fe oxalate complex catalyst[J]. Journal of Environmental Management, 2016, 182(1): 367-373. -






 下载:
下载: