-
磷是自然界中重要的化学元素,广泛应用于人类的生产生活中。然而,过量的磷排放会引起水体富营养化,导致全球30%~50%水资源水质恶化[1]。另一方面,磷作为不可再生资源,其全球储量估计在未来50~100 a内耗尽[2],全球粮食供应将面临巨大挑战[3]。目前,用于去除或回收污水中磷的方法包括生物法、化学沉淀法、离子交换法、吸附法等[3],其中吸附法因其去除率高、操作简单、可回收利用、无二次污染等优点成为研究热点[5],尤其是天然矿物、农业废物、工业废物等廉价材料的吸附研究[6-8]。
给水厂污泥(DWTR)是饮用水处理过程中不可避免的副产品。根据《城市建设统计年鉴》中的估算值,2019年我国给水厂污泥产量可达到320×104 t,预计到2030年将突破400×104 t,这不仅会增加环境负担,而且会增加处理成本[9]。由于DWTR中含有无定形态的铁铝等元素,有较大的比表面积和丰富的孔隙结构,对水中阴离子尤其是
PO3−4-P 具有选择性吸附,其吸附机理是DWTR表面羟基与PO3−4-P 发生配体交换形成内球络合物[10]。但大多数研究中DWTR对PO3−4-P 的吸附量为3.5~23.0 mg·g−1,吸附性能有限[11]。因此,研究人员通过酸活化[12]、热活化[12]、降低到纳米级粒径[13]或者金属负载等方法对DWTR进行改性。其中金属改性可丰富吸附材料表面的官能团,提高吸附剂对PO3−4-P 的吸附能力[14]。有研究[15-16]表明,镧对PO3−4-P 具有很强的亲和力,但较高的价格限制了镧的广泛应用。而铁元素资源丰富,廉价易得,但对PO3−4-P 的吸附容量较低[16]。若以给水厂污泥为原材料,将镧和铁负载到DWTR上,发挥镧铁的协同作用,则有望实现吸附剂的高效吸附和经济实用的双重目标。基于上述背景,本研究采用沉淀法制备了镧铁负载给水厂污泥复合材料(LaFe-DWTR),研究了LaFe-DWTR对PO3−4-P 的静态吸附过程,探讨了吸附剂投加量、吸附等温线、吸附动力学、pH以及共存离子的影响特征,考察了LaFe-DWTR对PO3−4-P 的吸附性能,并结合FTIR和XPS对LaFe-DWTR表征结果揭示了可能的吸附机理,以期为LaFe-DWTR对PO3−4-P 吸附的应用提供参考。 -
实验试剂:七水合氯化镧(LaCl3·7H2O)、氯化铁(FeCl3)、磷酸二氢钾(KH2PO4)、硫酸(H2SO4)、抗坏血酸(C6H8O6)、钼酸铵((NH4)2MoO4)、酒石酸锑钾(CHKOSb)、盐酸(HCl)、氢氧化钠(NaOH)等,均为分析纯。
实验仪器:UV2600型紫外分光光度计(日本岛津)、AL204型电子分析天平(瑞士梅特勒-托利多)、HZQ-F160型恒温振荡箱(哈尔滨东联电子)、Zeiss Merlin型场发射扫描电子显微镜-能谱仪(德国蔡司)、Nano ZS90型zeta电位仪(英国马尔文)、TriStar II 3020型比表面积测定仪(美国麦克)、Master sizer2000型粒径分析仪(英国马尔文)、ICP-MS7900型电感耦合等离子体质谱仪(美国安捷伦)、Frontier FTIR型傅里叶变换红外光谱仪(美国珀金埃尔默)、PHI Quantera型X射线光电子能谱仪(日本理学)。
-
LaFe-DWTR的制备。将自然风干后的给水厂污泥(DWTR)于105 ℃烘箱干燥24 h,研磨过120目筛保存(粒径≤0.125 mm)。将一定质量的LaCl3·7H2O和FeCl3溶解于250 mL去离子水中,加入5 g DWTR搅拌均匀,缓慢滴加3.0 mol·L−1 NaOH至混合液pH为11后,在500 r·min−1的条件下连续搅拌5 h,再陈化24 h;然后倾去上清液,用去离子水洗涤沉淀物至中性,于105 ℃烘箱干燥12 h,研磨后过120目筛保存备用。
静态吸附实验。配制50.00 mg·L−1的
PO3−4-P 溶液,加入2.0 g·L−1的LaFe-DWTR,使用0.1 mol·L−1的NaOH和HCl调节pH为6.0,在25 ℃、160 r·min−1的条件下振荡,反应24 h后取上清液,过0.45 μm滤膜测定PO3−4-P 质量浓度。按照静态吸附实验操作程序,在0.5~6.0 g·L−1内优化LaFe-DWTR的投加量,定期采样,分析吸附动力学过程;吸附等温实验的初始PO3−4-P 质量浓度为0~300.00 mg·L−1,分别研究pH为2.0~11.0和Cl−、NO−3 、SO2−4 、HCO−3 、SiO2−3 和HA质量浓度为50.00~250.00 mg·L−1时对PO3−4-P 吸附效果的影响。采用经典的吸附等温线和动力学模型对吸附数据进行拟合[17]。采用1.1中的实验仪器对LaFe-DWTR吸附PO3−4-P 前后的表面形貌、元素分布、表面电位、表面官能团和元素价态分布进行表征与分析。 -
DWTR和LaFe-DWTR的SEM和EDS如图1所示。DWTR呈无规则的片层絮状结构,负载镧和铁元素后,LaFe-DWTR表面更为松散粗糙,有较多小颗粒聚集,应该为镧铁复合氢氧化物颗粒[18]。一般而言,纯氢氧化镧形态为棒状。而上述现象说明铁的掺入形成了球状聚集体颗粒,此现象与镧铁氢氧化物的SEM形貌特征相似[16]。图1(d)中LaFe-DWTR的DES面扫描结果证实:Fe、La、Al和O元素分布在LaFe-DWTR表面。这说明La和Fe成功负载到DWTR上。
DWTR和LaFe-DWTR的表面元素含量变化见表1。DWTR主要由C、O、Al、Mg、Si、Fe等元素组成,这与以往研究[19]报道的DWTR成分相似。负载镧和铁之后,LaFe-DWTR中C、O、Al、Mg、Si等元素含量降低,Fe元素含量明显升高,同时出现了La元素,其质量百分数为27.79%。
DWTR和LaFe-DWTR的理化性质见表2。负载镧和铁导致DWTR的比表面积由36.17 m2·g−1增加到98.57 m2·g−1,孔体积由0.09 m3·g−1增加到0.17 m3·g−1。这可能是由于镧铁氢氧化物在DWTR表面沉淀增大了其比表面积和孔体积。有研究[16]表明,铁的掺入可使晶体结构规则的氢氧化镧转化为微晶结构,可增加材料的比表面积和活性位点,从而促进对
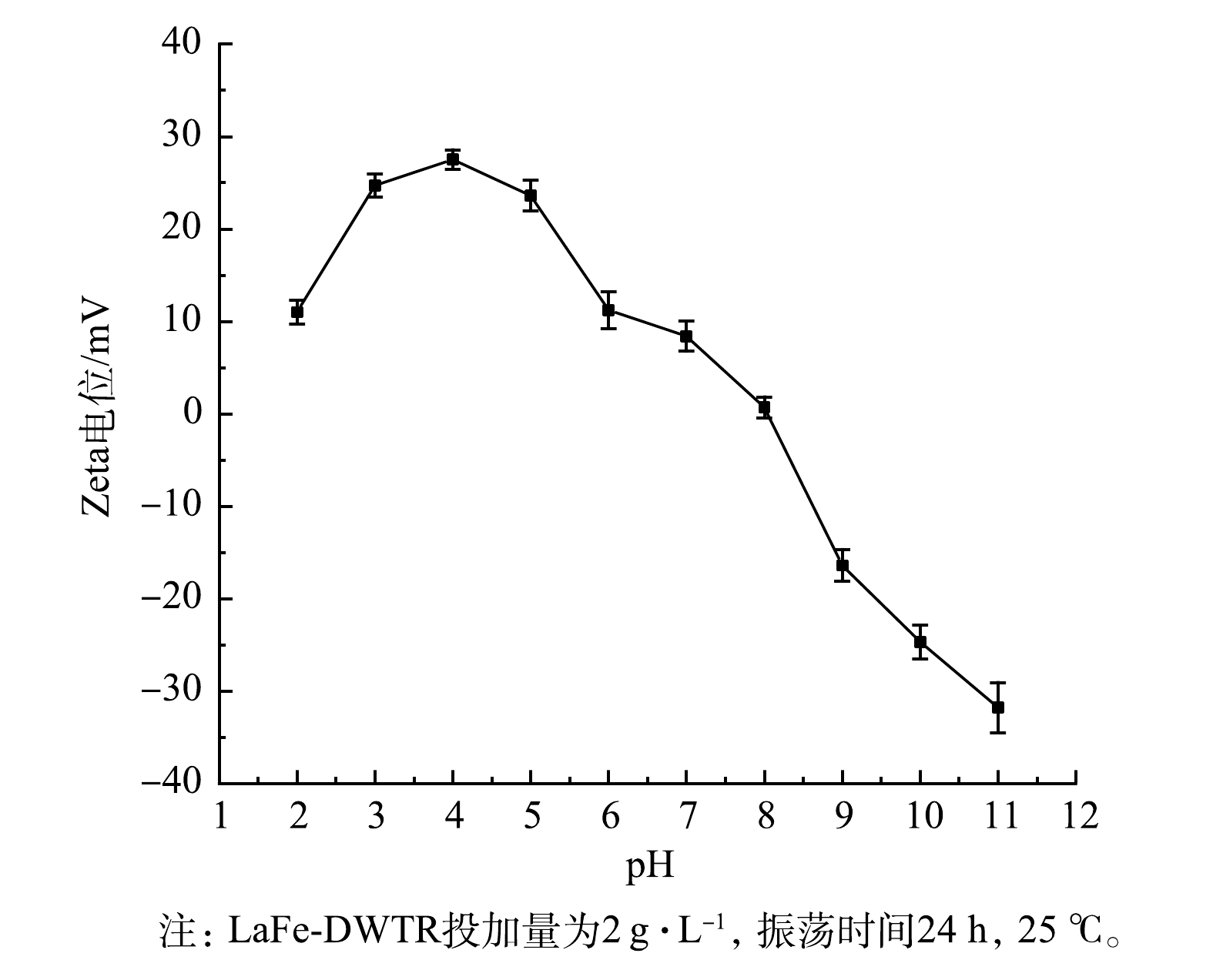
PO3−4-P 的吸附。采用ICP测得DWTR中铁的质量浓度为34.7 mg·g−1,LaFe-DWTR中镧和铁的质量浓度分别为175.1 mg·g−1和107.6 mg·g−1。这说明较高含量的镧、铁是提高PO3−4-P 吸附量的关键。LaFe-DWTR在不同pH下的Zeta电位如图2所示。显然,LaFe-DWTR的表面电荷随着pH的增加逐渐降低,等电点为8.04。这与镧铁氢氧化物在不同pH下的Zeta电位变化趋势接近[20]。当溶液pH低于8.04时,LaFe-DWTR表面羟基质子化带正电,LaFe-DWTR与
PO3−4-P 之间的静电吸引有利于去除PO3−4-P 。另一方面,当pH大于8.04时,LaFe-DWTR表面羟基脱质子化产生氧负离子而带负电,因而不利于PO3−4-P 吸附。 -
1) LaFe-DWTR投加量对吸附的影响。如图3所示,随着投加量的增加,LaFe-DWTR对
PO3−4-P 的吸附量持续下降,PO3−4-P 去除率先迅速增加后趋于平缓。当LaFe-DWTR投加量由0.5 g·L−1增加到2.0 g·L−1时,吸附量由44.77 mg·g−1下降到23.91 mg·g−1,去除率由44.76%增加到95.62%。该结果说明:随着LaFe-DWTR投加量增加,吸附位点增多,PO3−4-P 去除率保持相对稳定的增长速率。当投加量由2.0 g·L−1增加到6.0 g·L−1时,吸附量从23.91 mg·g−1持续下降到8.33 mg·g−1,但材料对PO3−4-P 的去除率增长幅度很小。这说明:LaFe-DWTR投加量较高时,虽然去除率逐渐趋于100%,但LaFe-DWTR的吸附量很低,吸附位点未能充分利用。考虑到处理效率和经济成本,选择2.0 g·L−1为LaFe-DWTR的最佳投加量。2)吸附等温线。LaFe-DWTR吸附
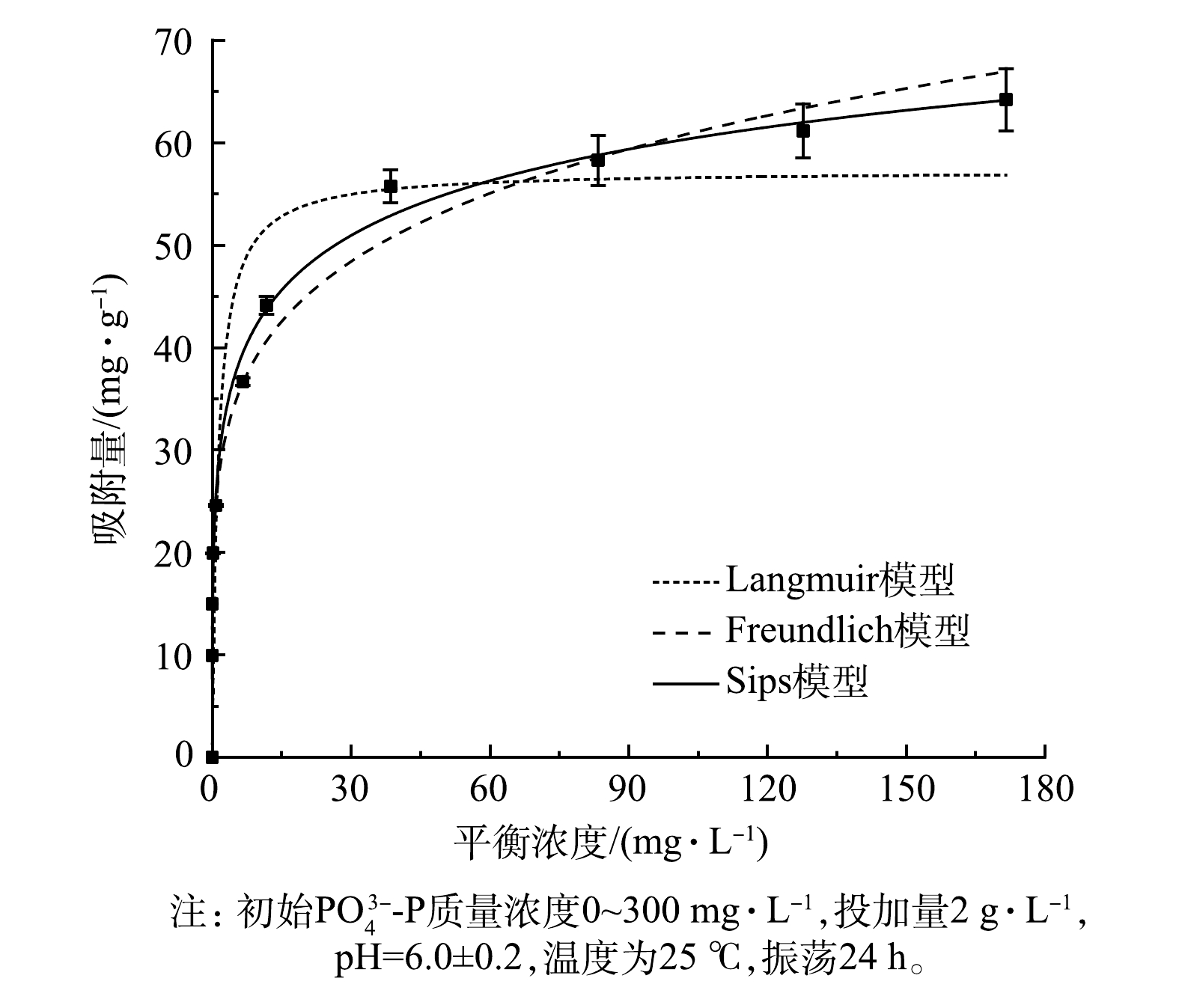
PO3−4-P 的等温线曲线如图4所示。LaFe-DWTR对PO3−4-P 的吸附量随着PO3−4-P 平衡浓度的增加而增加,并逐渐趋于平缓。采用Langmuir,Freundlich和Sips模型对LaFe-DWTR的吸附等温线进行拟合,具体参数如表3所示。可见,LaFe-DWTR的Sips模型对等温线拟合程度较好(R2=0.98)。这说明:在初始PO3−4-P 质量浓度为0~300 mg·L−1时,LaFe-DWTR对PO3−4-P 的吸附过程可用非均匀的多分子层吸附模型模拟[21]。由图4可见,在平衡质量浓度为30~180 mg·L−1时,LaFe-DWTR对PO3−4-P 的吸附量接近57.27 mg·g−1。比较不同吸附材料对PO3−4-P 的理论吸附量 (表4),发现LaFe-DWTR具有明显的优势。3)吸附动力学。LaFe-DWTR对
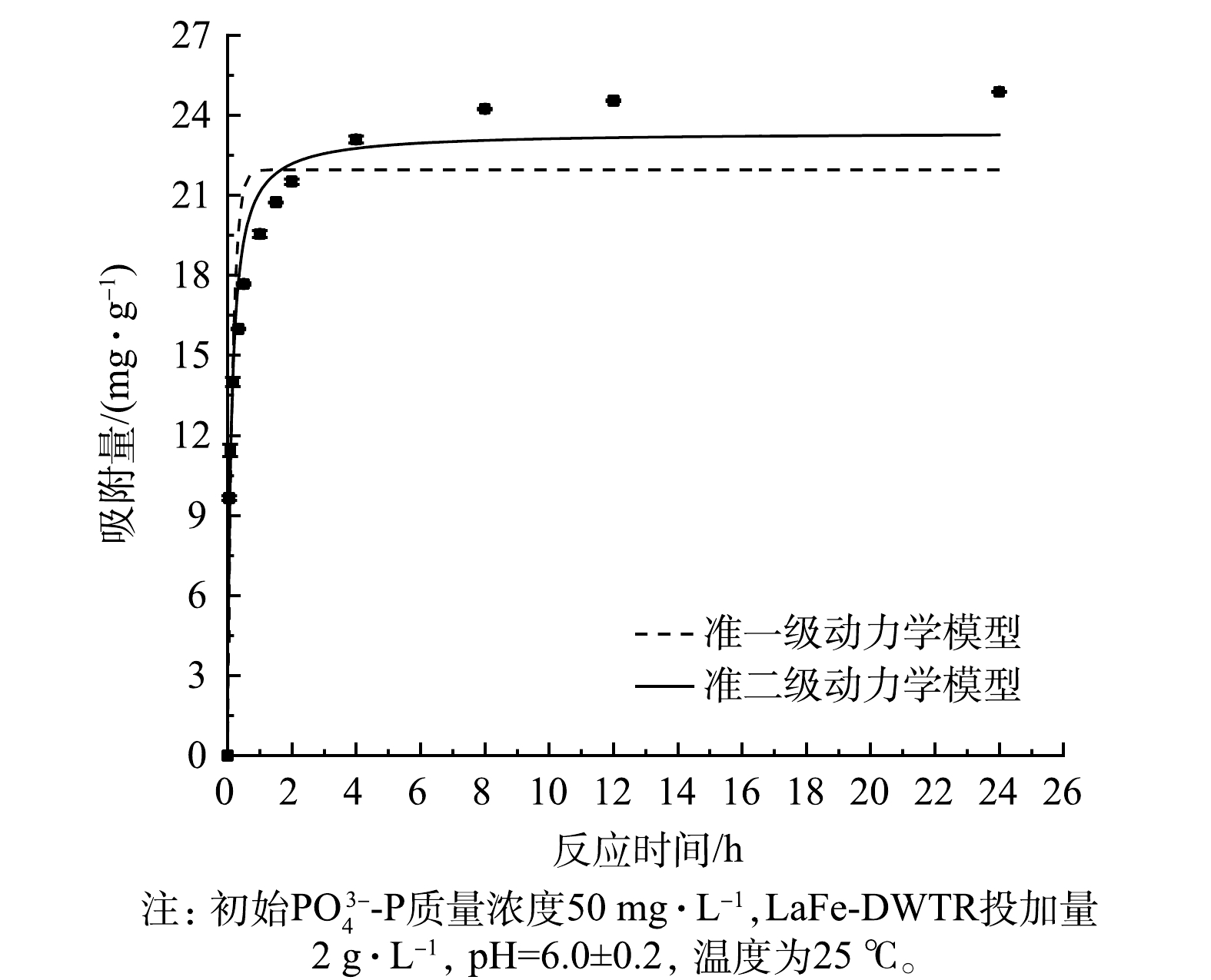
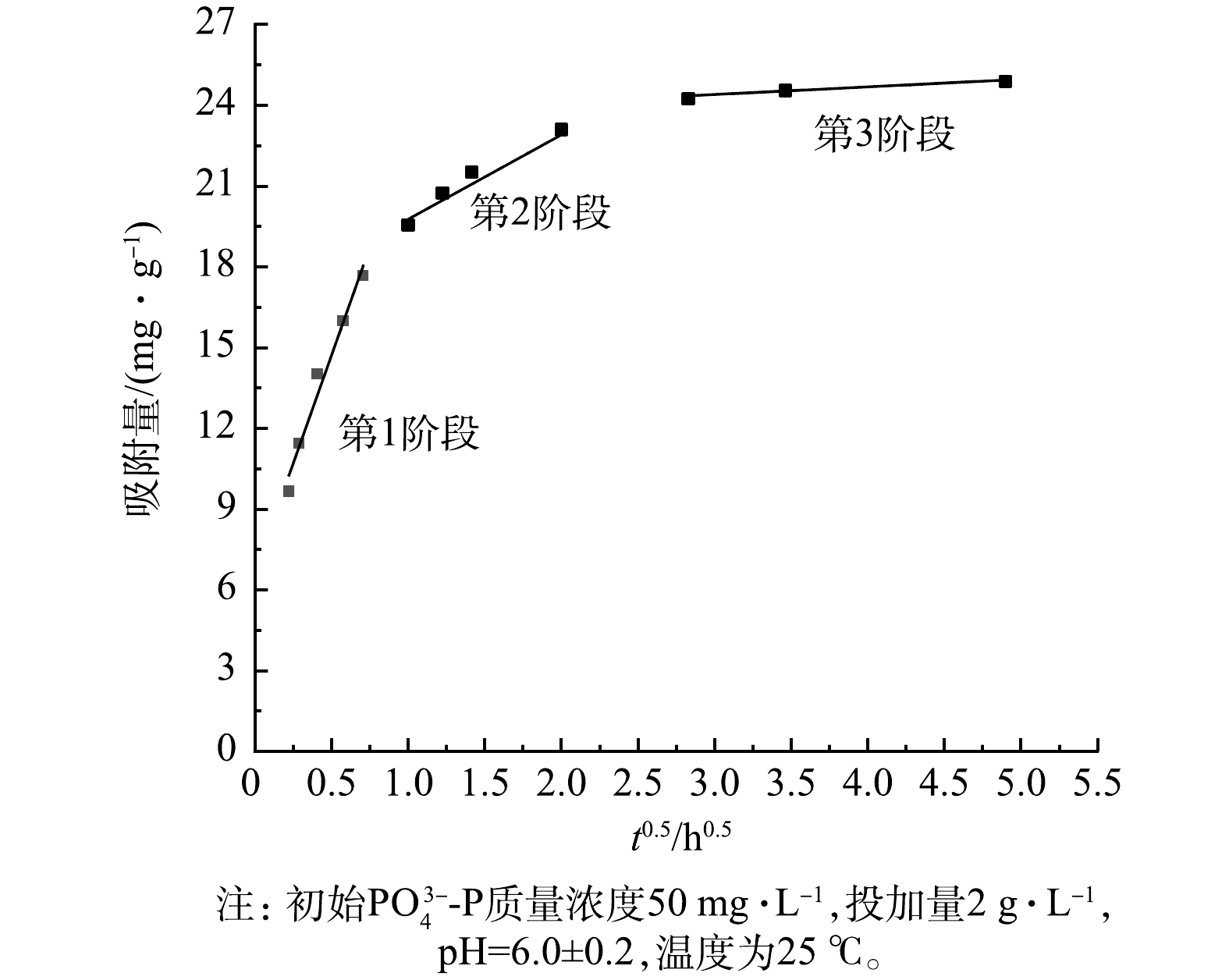
PO3−4-P 的动力学曲线如图5所示。LaFe-DWTR吸附量在最开始的2 h内迅速增加,吸附量可达到最大吸附量的86.45%,并在8 h后趋于稳定,24 h时达到最大。而文献报道La/Fe为1∶1的镧铁氢氧化物对PO3−4-P 的吸附量在6 h才达到最大吸附量的87.9%[20]。这可能是由于:LaFe-DWTR的平均孔径(6.00 nm)大于镧铁氢氧化物的平均孔径(2.00 nm)[16],有利于PO3−4-P 的表面扩散与吸附。采用准一级和准二级动力学模型进行动力学曲线拟合,相应的参数如表5所示。可见,LaFe-DWTR对PO3−4-P 的吸附过程更符合准二级动力学模型。计算得出的PO3−4-P 的平衡吸附量(23.36 mg·g−1)接近平衡吸附量的实验结果(24.88 mg·g−1),表明LaFe-DWTR吸附PO3−4-P 的决定性步骤是化学吸附[28]。进一步通过Weber-Morris模型进行动力学曲线拟合,结果分别见图6和表6。吸附过程分为3个阶段,说明颗粒内扩散参与了吸附过程;拟合直线均未经过原点,说明颗粒内扩散不是吸附过程的限制步骤[28]。第1阶段的拟合直线斜率较大,表明吸附开始阶段以表面扩散为主。吸附初期,LaFe-DWTR表面提供大量的吸附位点,且LaFe-DWTR固液界面的
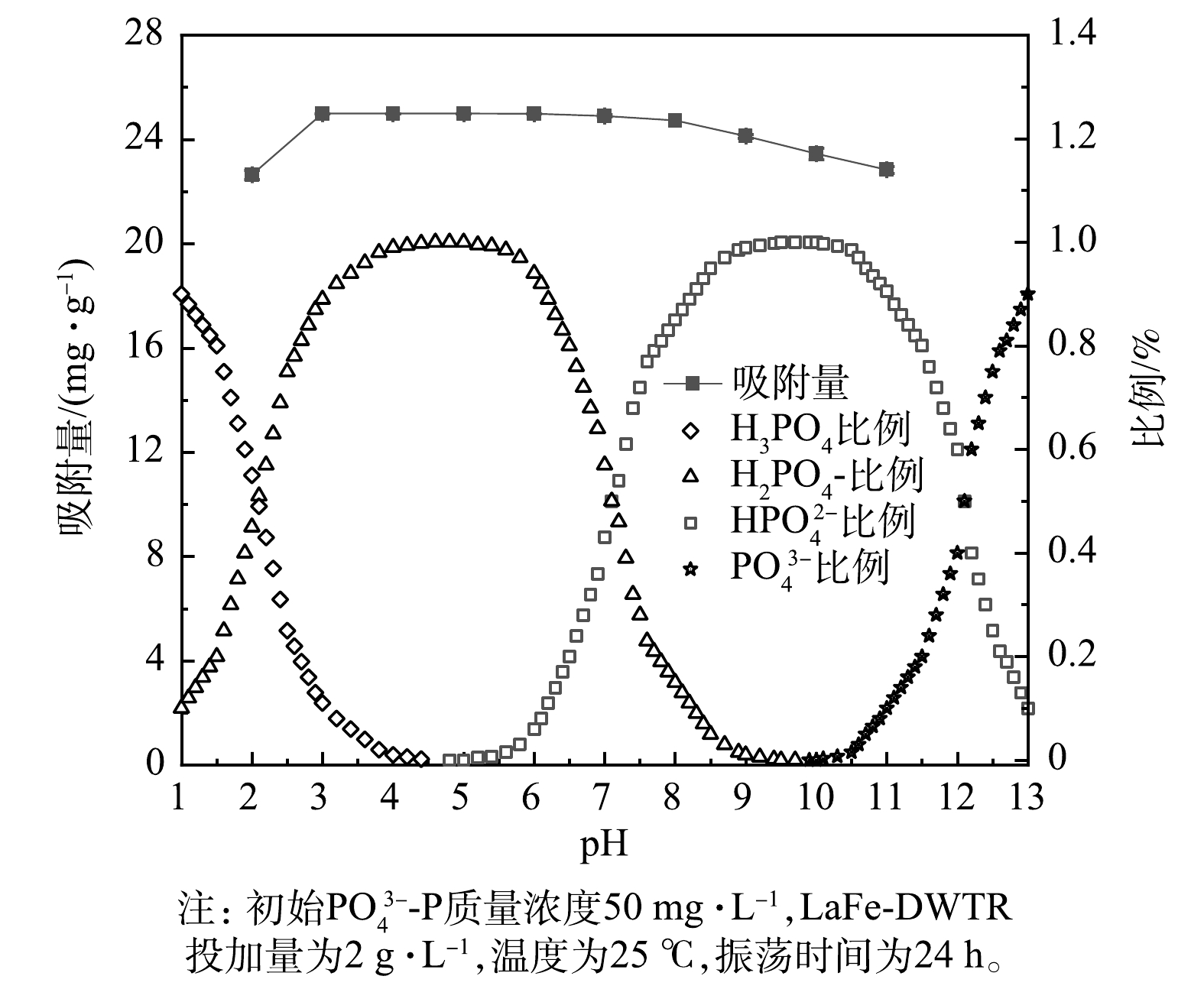
PO3−4-P 浓度梯度大,有利于PO3−4-P 从固液界面向LaFe-DWTR表面迁移,并与LaFe-DWTR表面羟基发生配体交换作用。第2阶段拟合直线的斜率较低,LaFe-DWTR表面的活性位点被占据,此时内膜扩散起主要作用,PO3−4-P 经颗粒内扩散吸附在LaFe-DWTR的中孔、微孔结构中。第3阶段拟合直线斜率进一步降低,此时溶液中PO3−4-P 浓度降低,传质速率下降,PO3−4-P 在颗粒内部扩散逐渐减弱直到吸附平衡。4)pH的影响。由图7可以看出,随着pH由2.0增加到3.0,LaFe-DWTR对
PO3−4-P 的吸附量由22.64 mg·g−1增加到最大值24.99 mg·g−1。当pH为3.0~8.0时,PO3−4-P 的吸附量基本保持稳定;随着pH升高到11.0,吸附量逐渐下降到22.83 mg·g−1。可见,酸性条件下LaFe-DWTR对PO3−4-P 吸附效果更好,在实验的pH 范围内,LaFe-DWTR对PO3−4-P 的去除率依然保持在90%以上。而有研究[20]中镧铁氢氧化物对PO3−4-P 的吸附随着pH增加逐渐降低。这说明DWTR作为镧铁的载体可以降低LaFe-DWTR对pH的依赖。PO3−4-P 的吸附量受pH变化的影响主要归因于不同pH下P的形态、LaFe-DWTR的表面电荷和表面羟基质子化。当pH为2.0时,磷的形态以H2PO−4 和H3PO4为主,由于H3PO4不显电性且难与镧铁氢氧化物结合,且镧和铁在酸性条件下易溶出[18],从而抑制LaFe-DWTR对PO3−4-P 的吸附。随着pH由2.0升至4.0,H3PO4不断减少,H2PO−4 逐渐增加,LaFe-DWTR表面金属质子化以M—OH+2 形式存在,此时静电引力作用可以强化LaFe-DWTR对H2PO−4 的吸附[29]。当pH由4.0升至8.0时,磷的形态以H2PO−4 和HPO2−4 为主,此时静电引力逐渐减弱,但LaFe-DWTR对PO3−4-P 的吸附量依然保持稳定。这说明LaFe-DWTR的表面羟基与H2PO−4 和HPO2−4 主要通过配体交换形成内球络合物[17]。随着pH由8.0升至11.0,磷的形态以HPO2−4 和PO3−4 为主。理论上HPO2−4 比单电荷的H2PO−4 更容易与LaFe-DWTR结合[1],但LaFe-DWTR表面羟基的脱质子化程度增加导致静电斥力增强,不利于LaFe-DWTR对PO3−4-P 的吸附,而且配体交换也因OH-的竞争作用而受到抑制[20],路易斯酸碱作用成为LaFe-DWTR吸附PO3−4-P 的主要机制[17]。5)共存离子的影响。共存离子对LaFe-DWTR吸附
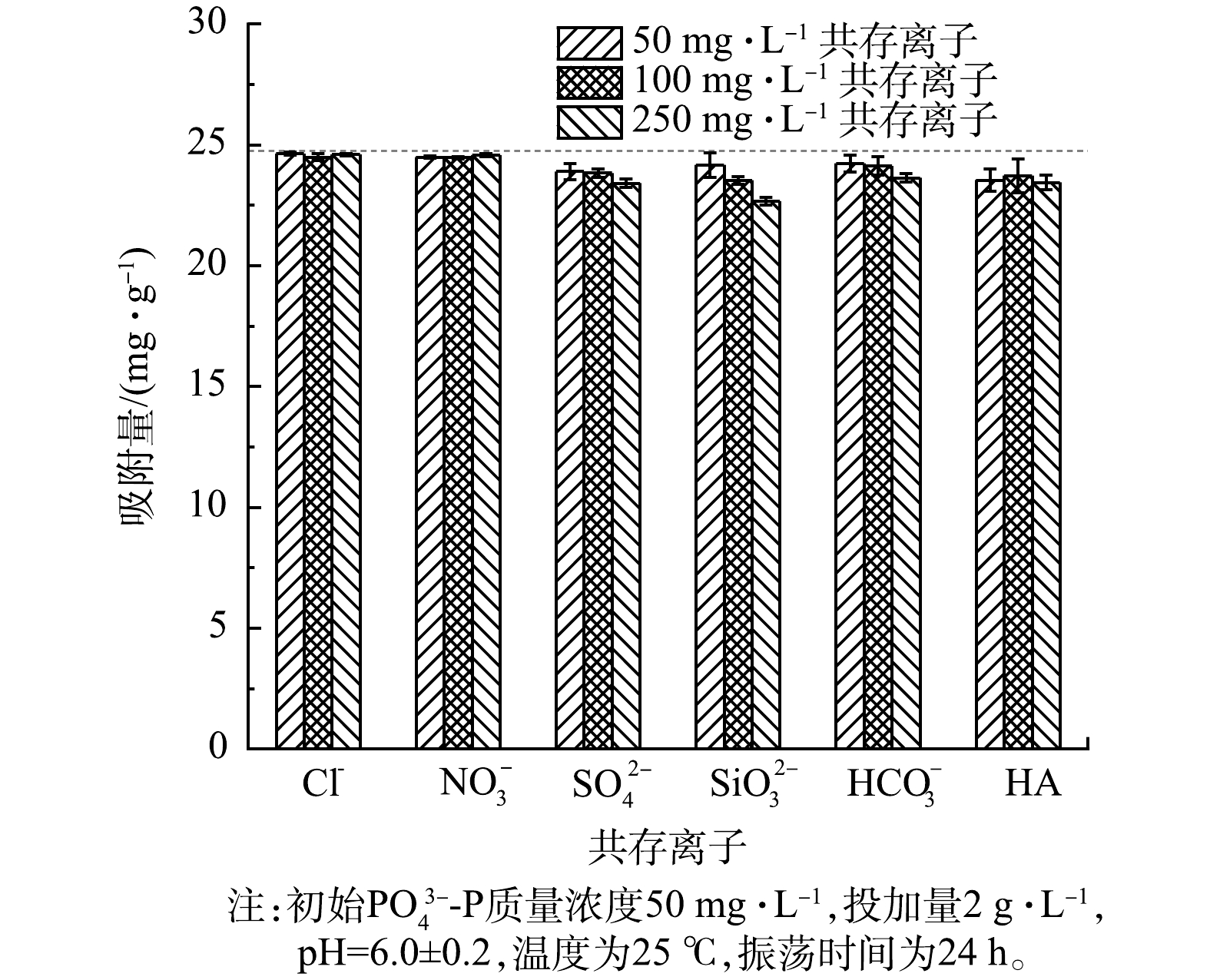
PO3−4-P 的影响如图8所示。总体来说,LaFe-DWTR对PO3−4-P 的吸附量维持在10%以内,说明LaFe-DWTR吸附PO3−4-P 具有很强的选择性。进一步分析表明,Cl-、NO−3 对LaFe-DWTR吸附PO3−4-P 的影响可以忽略。这是由于Cl-和NO−3 主要通过非特异性的静电作用在LaFe-DWTR表面形成外球络合物,而LaFe-DWTR对PO3−4-P 的吸附主要通过配体交换或路易斯酸碱作用形成内球络合物[30]。但HCO−3 、SiO2−3 、SO2−4 和HA对LaFe-DWTR吸附PO3−4-P 有轻微抑制作用,并且PO3−4-P 的吸附量随着共存离子浓度的增加逐渐降低。一般情况下,HCO−3 可通过静电作用在LaFe-DWTR表面形成外球络合物[30],但HCO−3 水解导致溶液pH上升,进而抑制LaFe-DWTR对PO3−4-P 的吸附[18]。另外,Si和P具有相似的结构和化学性质,La4(SiO4)3与LaPO4的Ksp值相近,因此,SiO2−3 可抑制LaFe-DWTR对PO3−4 的吸附[17]。而SO24 的离子半径(0.230 nm)与H2PO−4 的离子半径(0.238 nm)接近,能够竞争LaFe-DWTR表面的金属活性位点形成内球络合物[31]。HA是带有羟基、羧基等多种官能团的高分子聚芳族化合物,可与LaFe-DWTR发生络合反应[32]。 -
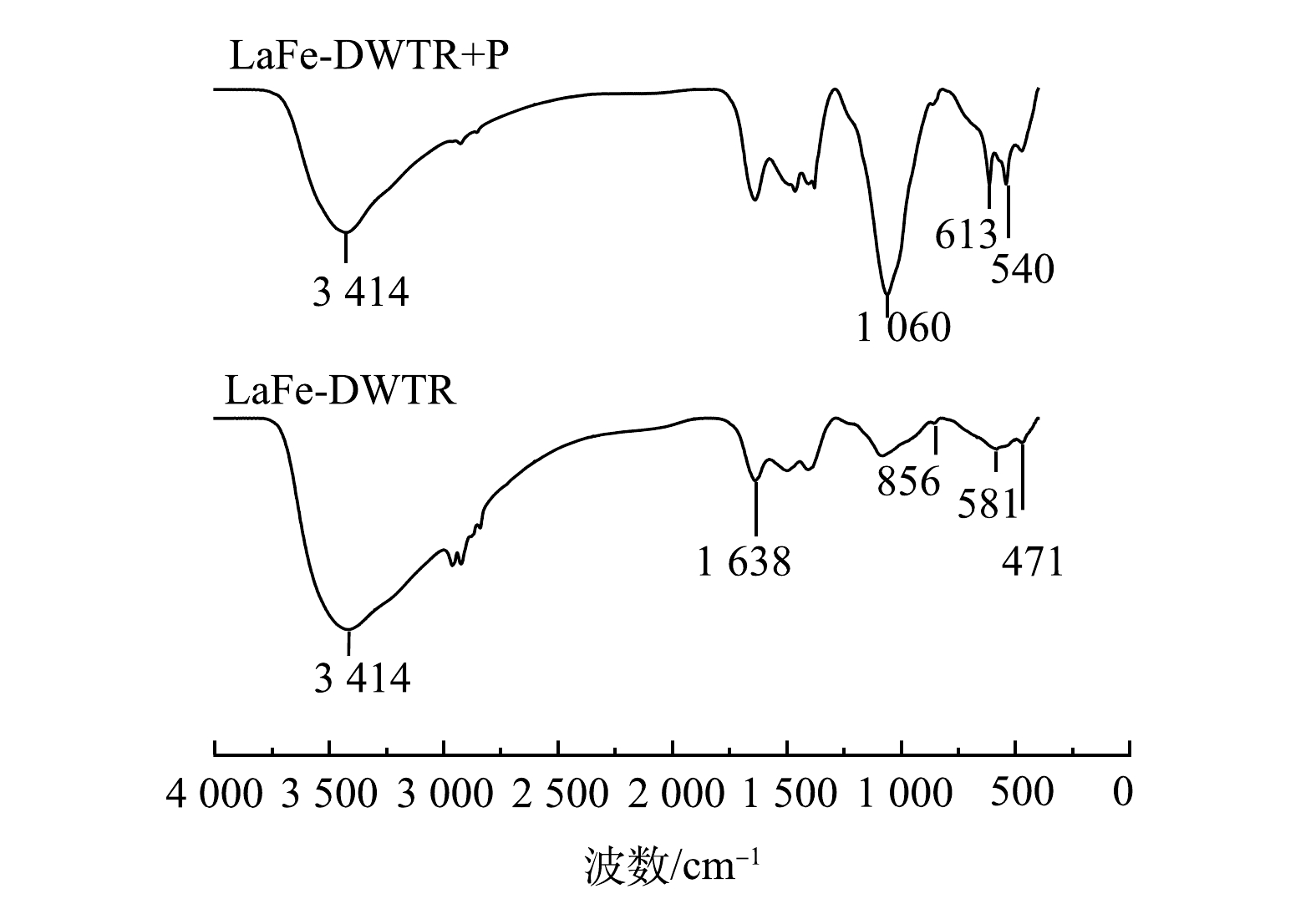
1)FTIR分析。LaFe-DWTR吸附
PO3−4-P 前后的FTIR如图9所示。吸附前的LaFe-DWTR在3 200~3 500 cm−1内出现了分子间氢键O—H的伸缩振动吸收峰,吸收峰面积比较大。这是由于镧铁负载DWTR产生大量羟基,在1 638 cm−1处的强峰是M—OH与吸收水分子之间的伸缩振动吸收峰[16]。856 cm−1处的弱峰是La—O键振动峰[17],581 cm−1和471 cm−1处的吸收峰分别与Fe—O和Al—O振动吸收峰很好地对应[6, 16],说明镧和铁元素成功负载到DWTR上。LaFe-DWTR吸附PO3−4-P 后,3 200~3 500 cm−1处的峰面积明显减小,表明表面—OH被取代。同时,在1 060、613、540 cm−1处出现了新的吸收峰,其中613 cm−1和540 cm−1处的弱峰可能是PO3−4 中O—P—O的υ4振动峰,1 060 cm−1处的强峰来源于HPO2−4 或H2PO−4 中P—O的υ3振动峰[20]。由此可知,PO3−4-P 成功吸附到LaFe-DWTR上。2)吸附前后XPS分析。LaFe-DWTR吸附
PO3−4-P 前后的XPS全谱图、O1s、P2p、La3d、Fe2p、Al2p的XPS扫描光谱如图10所示。所有结果均用C1s(284.6 eV)校准。由图10(a)可以看出,LaFe-DWTR中存在La、Fe、Al、O等元素,吸附PO3−4-P 后出现了P2p峰,证明PO3−4-P 已被LaFe-DWTR成功吸附。由图10(b)可以看出:O1s光谱可以分为3个重叠峰,532.8 cm−1处的吸收峰对应与金属结合氧化物的氧(M—O);531.42 cm−1和531.53 cm−1处的吸收峰对应与金属结合的羟基氧(M—OH);530.38 cm−1和530.55 cm−1处的吸收峰对应吸附水中的氧(H2O)[4]。LaFe-DWTR吸附PO3−4-P 前后O1s的XPS分峰拟合数据如表7所示。可见,LaFe-DWTR吸附PO3−4-P 后,M—OH键对应的峰面积由57.69%下降到45.56%,而M—O键对应的峰面积从36.77%增加到41.85%。这表明吸附PO3−4-P 的过程中形成了La—O或Fe/Al—O键,因而进一步证实了PO3−4-P 主要通过与LaFe-DWTR表面的-OH进行配体交换而被吸附[4]。此外,为探究LaFe-DWTR与
PO3−4-P 之间的相互作用,进一步分析了P2p、La3d、Al2p和Fe2p的XPS图谱。由图10(c)可以看出,LaFe-DWTR吸附PO3−4-P 后出现了P2p的特征光谱(132.95 eV),与KH2PO4的标准P2p光谱(134.0 eV)相比,降低了1.05 eV。这表明PO3−4-P 与LaFe-DWTR形成了内球络合物[4]。由图10(d)可以看出,LaFe-DWTR中La3d5/2的吸收峰位于834.85 eV和838.65 eV,La3d3/2的吸收峰位于851.75 eV和855.25 eV[1]。吸附PO3−4-P 后,La3d5/2的新峰位于835.5 eV和838.75 eV,La3d3/2的新峰位于852.15 eV和855.6 eV,结合能升高了0.1~0.65 eV。这证明PO3−4-P 与La—OH发生配体交换作用[33]。结合图10(e)、图10(f)可以看出,吸附PO3−4-P 后,铁结合能由710.7 eV增加到711.1 eV,铝结合能由73.65 eV增加到73.95 eV。这说明Fe—OH和Al—OH基团在吸附PO3−4-P 的过程中也发挥了作用[23]。 -
1)采用沉淀法成功制备出镧铁负载给水厂污泥复合材料(LaFe-DWTR),其对
PO3−4-P 的饱和吸附量为57.27 mg·g−1,等温吸附过程可用非均匀的多分子层吸附描述;吸附动力学符合准二级动力学,在前2 h的吸附量可以达到最大吸附量的86.45%。2) LaFe-DWTR在较宽的pH范围内能够保持对
PO3−4-P 的稳定吸附,在共存离子存在下对PO3−4-P 具有较好的吸附选择性。3) LaFe-DWTR对
PO3−4-P 的吸附以化学吸附为主,PO3−4-P 与LaFe-DWTR表面羟基的配体交换为主要吸附机理。
镧铁负载给水厂污泥复合材料对水中磷酸盐的吸附性能及机理
Performance and mechanism of phosphorus adsorption by lanthanum/iron-loaded drinking water treatment residues
-
摘要: 采用沉淀法制备了镧铁负载给水厂污泥(DWTR)复合材料(LaFe-DWTR),对其微观形貌和理化性质进行了表征,考察了LaFe-DWTR对水中
PO3−4-P 的吸附等温线和吸附动力学,探讨了吸附剂投加量、pH和共存离子对PO3−4-P 吸附效果的影响,并揭示了可能的吸附机理。结果表明:相比DWTR,镧和铁负载的DWTR比表面积和孔体积明显增加;当LaFe-DWTR投加量为2.0 g·L−1,PO3−4-P 初始质量浓度为50 mg·L−1时,LaFe-DWTR对PO3−4-P 的吸附等温线符合Sips模型,吸附动力学符合准二级动力学模型,说明吸附过程主要受化学吸附和颗粒内扩散控制;LaFe-DWTR在pH 2.0~11.0内对PO3−4-P 的去除率均在90%以上,共存离子对LaFe-DWTR吸附PO3−4-P 的影响较小;LaFe-DWTR吸附PO3−4-P 的主要机理是配体交换。Abstract: In this study, a precipitation method was used to prepare lanthanum/iron-loaded drinking water treatment residues (LaFe-DWTR) composite material. Its micro-morphology and physicochemical properties were characterized, and the adsorption isotherms and kinetics of LaFe-DWTR towardsPO3−4-P in water, as well as the effects of dosage, pH and coexisting ions onPO3−4-P adsorption effect, were investigated. Furthermore, the corresponding adsorption mechanism between LaFe-DWTR andPO3−4-P was identified. The results showed that lanthanum/iron loading led to a significant increase of the specific surface area and pore volume of DWTR. At LaFe-DWTR dosage of 2.0 g·L−1 and initialPO3−4-P concentration of 50 mg·L−1, the adsorption isotherm and kinetics could be well fitted by sips model and pseudo-second-order kinetic model, respectively. The adsorption process was mainly dominated by chemical adsorption and intra-particle diffusion. At pH 2.0~11.0, over 90%PO3−4-P in water could be removed by LaFe-DWTR. The coexisting ions had slight effect onPO3−4-P adsorption. Ligand exchange was the main adsorption mechanism between LaFe-DWTR andPO3−4-P .-
Key words:
- lanthanum/iron loading /
- drinking water treatment residues /
- adsorption /
- phosphorus /
- ligand exchange
-
城市污水中的有机物、氮和磷等物质是污水处理厂需要去除的主要污染物[1]。实际上,这些物质亦是能源和资源,若能实现资源化利用,则可解决污水处理厂能耗和成本较高的问题,确保其可持续性发展。因此,城市污水处理需由达标处理向能源回收、资源回收和低碳处理方向转型[2]。大量有机物、氮磷等物质在污水处理过程中进入污泥,故污泥的资源化处理亦成为研究热点[3]。利用厌氧消化技术对其中的有机物进行能源高效回收,再利用厌氧氨氧化(anaerobic ammonium oxidation, anammox)技术对污泥厌氧消化液进行低碳脱氮处理被认为是较为有效的方法[4]。
污泥厌氧消化过程会释放高浓度的磷,产生高含磷的污泥厌氧消化液。LIN等[5]成功开发了厌氧氨氧化-羟基磷酸钙(anammox-hydroxyapatite, anammox-HAP)颗粒污泥技术,实现了高负荷厌氧氨氧化脱氮同步高效磷回收[6]。污泥厌氧消化液的磷酸盐浓度与污水处理厂的除磷工艺密切相关。对于采用化学除磷方法的污水处理厂,其出水中磷酸盐质量浓度一般低于10 mg·L−1;而采用生物除磷方法的污水处理厂,则出水中磷酸盐的质量浓度相对较高[7]。anammox-HAP颗粒污泥技术可实现污泥厌氧消化液的高效脱氮和磷回收[8]。然而,污泥消化液水质差异对anammox-HAP系统磷回收效率会产生影响。MA等[9]通过批次实验研究发现,对于不同磷含量的废水,最适宜的钙投加量是不同的,磷的回收效率亦不相同。
现有研究在探索anammox-HAP系统的脱氮性能和磷回收效率时,主要集中在磷质量浓度较低时(<100 mg·L−1)的性能与表现,而实际污泥厌氧消化液中,磷的质量浓度可超过200 mg ·L−1[8]。本课题组在连续流膨胀颗粒污泥床(expanded granular sludge bed,EGSB)反应器中建立anammox-HAP系统并观察其长期运行特征,考察不同进水磷质量浓度、反应器pH、进水钙磷比(Ca/P)对反应器磷回收效率及污泥特性的影响,以期实现高效脱氮和磷回收,为anammox-HAP工艺应用于污泥厌氧消化液的低碳处理和资源回收提供参考。
1. 材料与方法
1.1 实验装置
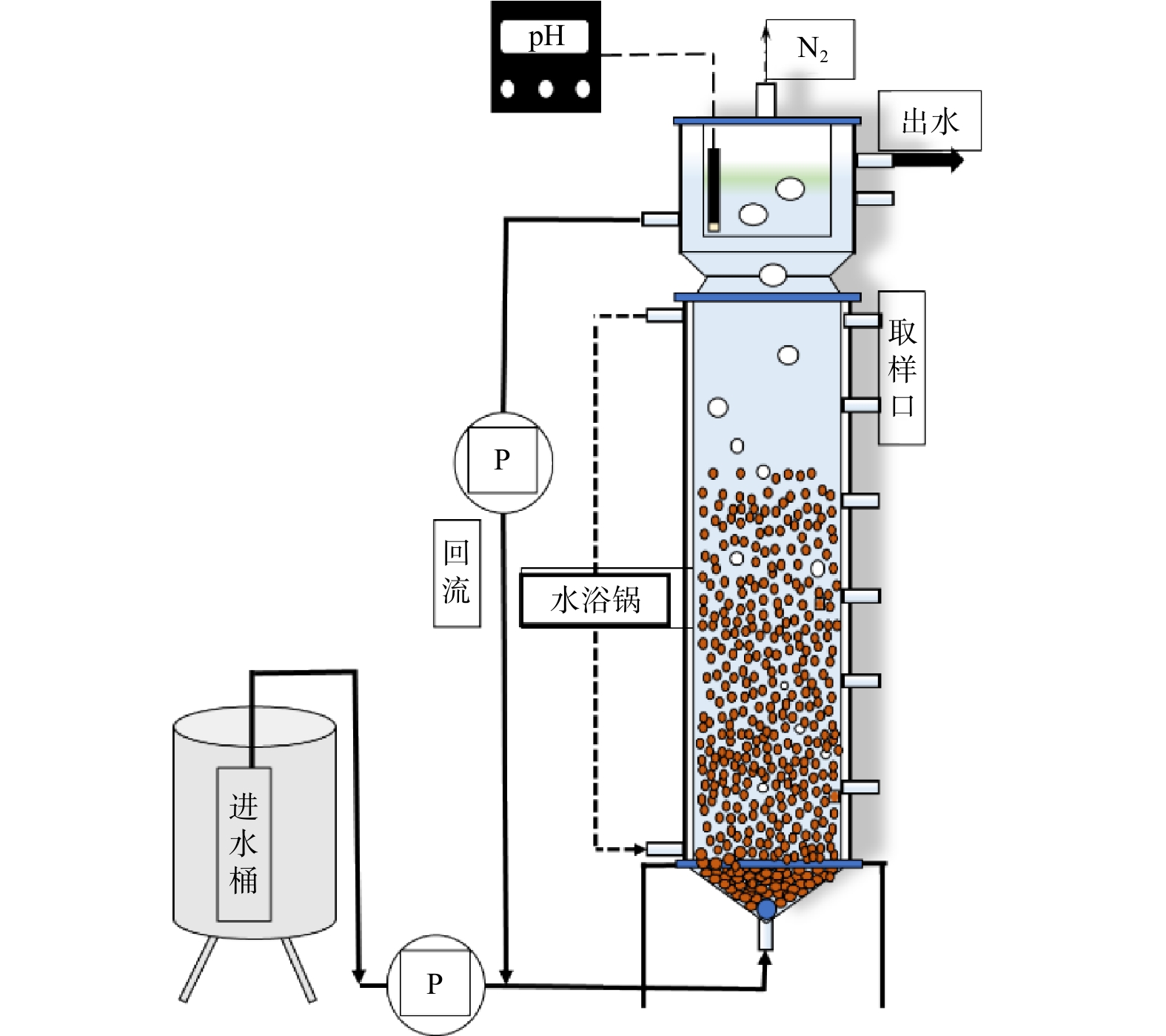
实验反应器为EGSB反应器,结构如图1所示。反应器由有机玻璃制成,有效容积为6 L。在反应器的顶端设有三相分离器,用于固液气三相的分离,从而防止反应器运行过程中絮状污泥的流失。
1.2 接种污泥与实验用水
接种污泥取自实验室长期稳定运行的anammox反应器。anammox-HAP颗粒污泥的质量浓度为51.5 g·L−1,接种体积为1 L。
反应器的进水均为人工配水。氯化铵(NH4Cl)与亚硝酸钠(NaNO2)为进水中的基质。配水中用1.25 g·L−1的KHCO3提供无机碳源和碱度,并添加质量浓度为0.1 g·L−1的MgSO4·7H2O、0.017 g·L−1的FeSO4·7H2O、0.024 g·L−1的Na2EDTA和0.4 mL·L−1等微量元素。EGSB反应器中磷质量浓度的控制通过投加不同浓度的KH2PO4来实现,Ca2+的质量浓度根据磷变化而变化。另外,为避免过高的游离氨(free ammonia, FA)或者游离亚硝酸硝酸盐(free nitrous acid, FNA)对厌氧氨氧化菌(anaerobic ammonium oxidizing bacterium, AnAOB)产生抑制作用,向反应器中添加HCl和NaOH以调节系统pH,从而保证反应器的正常运行。
1.3 水质指标和颗粒污泥特性的分析方法
每天定时取反应器出水水样进行分析。水样先经过0.45 μm滤膜过滤后,再进行水质分析。水质分析指标包括氨氮、亚硝态氮、硝态氮、正磷酸盐和pH。分析方法按照《水和废水分析监测方法》(第4版)[10]进行。
颗粒污泥的特性分析方法包括:颗粒污泥粒径分布(筛分法)、颗粒污泥沉降速度(重量沉降法)、颗粒污泥VSS和TSS含量(重量法)、颗粒污泥固相总磷(钼酸铵分光光度法)。
1.4 实验方案
通过逐步提高总氮(由50 mg·L−1升至1 000 mg·L−1)和降低HRT(由4.8 h降至3.2 h),调节反应器的氮负荷(nitrogen loading rate, NLR)(由0.3 g·(L·d)−1提升至7.5 g·(L·d)−1)。为避免因出水中基质的质量浓度过高而影响回流的稀释效果,反应器进水[
NO−2 NH+4 表1为反应器的运行条件。初始阶段设置的进水磷质量浓度为40 mg·L−1,反应器稳定运行过程中,进水磷的质量浓度逐步升至250 mg·L−1。此外,通过调节反应器内pH与Ca/P,以考察磷回收效率的变化。
表 1 反应器运行条件Table 1. Operational conditions of the reactor时间/d P/(mg·L-1) Ca/(mg·L-1) Ca/P pH 1~42 40 60 1.5 7.2~8.2 43~87 100 150 1.5 7.3~7.7 88~91 100 200 2 7.4~7.7 92~95 100 250 2.5 7.3~7.4 96~108 100 300 3 7.2~7.4 109~126 150 225 1.5 7.1~7.4 127~141 200 300 1.5 7.0~7.7 170~179 250 375 1.5 7.0~7.3 2. 结果与讨论
2.1 反应器的脱氮性能
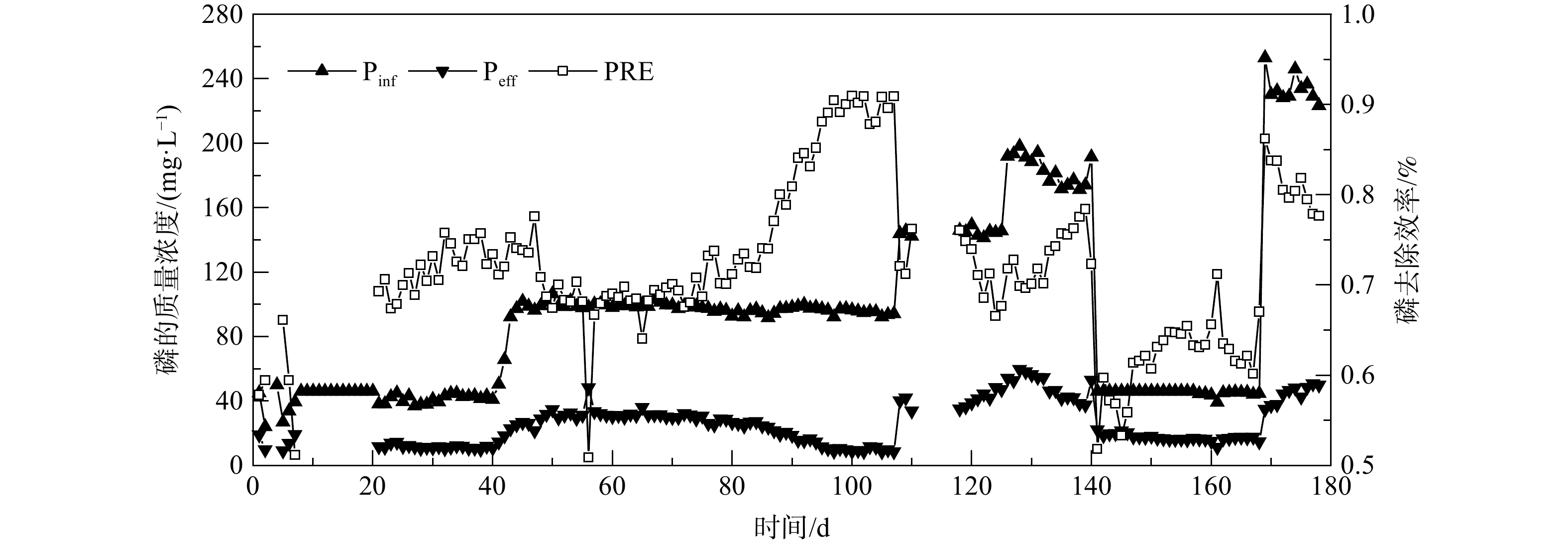
不同磷质量浓度对anammox-HAP系统的进、出水氮质量浓度及去除率的影响如图2所示。磷的质量浓度变化对anammox-HAP系统脱氮性能并没有明显影响。反应器运行前5 d,出水的氮质量浓度较高,主要是由于反应器刚启动时污泥的状态不太稳定。在第6~108天,进水磷的质量浓度提升至150 mg·L−1,反应器稳定运行,出水氨氮和亚硝态氮均小于5 mg·L−1。在第109天,反应器回流管出现破裂导致反应器直接进入高浓度基质状态,此时AnAOB受FA和FNA的抑制,且回流泵一直处于工作状态,较多空气被带入反应器中,从而使得AnAOB被进一步抑制。为恢复系统正常运行,降低了进水总氮。7 d后,反应器恢复正常运行。在第118~133天,磷的质量浓度提升至200 mg·L−1,反应器仍然保持稳定运行,出水氨氮和亚硝态氮均小于5 mg·L−1。从第134 天开始,反应器出水氮的质量浓度逐渐升高。其原因有2个:1)磷浓度的提升导致更多HAP生成,消耗更多碱[11],反应器内pH出于较低水平,导致FNA抑制AnAOB,反应系统失稳;2)从反应器长期运行条件来看,由于回流使得颗粒污泥的多次被取出导致反应器内无机组分含量占比较大,此时反应器内微生物含量无法使反应器维持之前的运行负荷。在第161天后,总氮最终稳定在800 mg·L−1。当磷的质量浓度提升至250 mg·L−1后,向进水桶中添加NaOH调节合适的pH,以维持反应器稳定运行。
反应器进水的磷质量浓度为40~250 mg·L−1。在整个运行过程中,发生过一次由于回流泵的蠕动管未及时更换,导致回流管破裂,AnAOB被抑制的意外状况。除此之外,反应器运行均很稳定,反应器总氮的平均去除率达到88.5%。反应器的氮去除负荷(nitrogen removal rate, NRR)最高达到6.8 g·(L·d)−1。因此,此反应过程对应的磷质量浓度范围对anammox-HAP系统的脱氮性能并无明显影响。然而,周正等[12]发现,在长期研究获得的结果中,磷酸盐质量浓度在70~90 mg·L−1时,SAA开始受到明显影响。不同研究得到的抑制浓度差异较大,这可能是由于在高负荷水平下培养的anammox-HAP颗粒污泥具有较高活性,抗冲击能力更强,故磷质量浓度对anammox的抑制阈值也会更高。此外,反应器的类型及操作条件也会影响AnAOB,导致抑制浓度存在差异。综上所述,污泥厌氧消化液中磷质量浓度对EGSB反应器中anammox-HAP系统的脱氮性能无明显的不利影响。
2.2 反应器的磷回收效率
2.2.1 进水磷浓度对anammox-HAP系统的磷回收效率的影响
EGSB反应器长期进出水磷质量浓度及anammox-HAP系统磷回收效率的变化如图3所示。在反应器运行的第55~73 天和第169~178天,磷的质量浓度分别为100 mg·L−1和250 mg·L−1。维持反应器中pH和Ca/P不变,磷的回收效率会随着进水磷质量浓度的升高而升高,分别为69%和80%。因此,在未改变其他影响因素的条件下,进水磷的质量浓度越高,anammox-HAP系统的磷回收效率越高。这与LIN等[13]的研究结果一致。
2.2.2 pH和Ca/P对anammox-HAP系统的磷回收效率的影响
pH是影响anammox-HAP系统磷回收效率的关键因素。在反应器运行的第133~140天,通过向基质桶里加NaOH将pH从6.7调节至8.0~8.1。此时,氮和磷的质量浓度不变,磷的平均回收效率明显从70.9%提高至75.5%,结果如图3所示。此外,在第20~40天,将氮的质量浓度从600 mg·L−1升至700 mg·L−1,磷的平均回收效率从69.3%提升至73.2%。这是由于anammox过程是个消耗H+的过程,氮质量浓度的提升导致pH升高。因此,在HAP结晶过程中,pH会对磷酸钙的沉淀起到重要作用,pH的升高促进了结晶的形成[14]。在第141~168 天,由于反应器中FNA抑制AnAOB,脱氮效率降低。同时,磷的回收效率也明显降低,最低时降至51.8%。anammox的高效脱氮特性可为HAP的形成提供较好的pH条件[15]。因此,AnAOB被FNA或FA抑制也会减弱生物诱导HAP矿化作用,进而影响磷的回收效率。
在第80 ~106天,反应器进水总氮维持在1 000 mg·L−1,进水磷的质量浓度约为100 mg·L−1,pH不变。当进水Ca/P从1.5提升至3,anammox-HAP系统磷的回收效率明显提升,从70.6%提高到89.7%。在运行过程中,反应器内极易出现白色沉淀导致管道堵塞。而对于不同的磷质量浓度,最佳Ca/P也不一样[9]。因此,在实际污泥厌氧消化液处理中,可通过控制anammox-HAP系统的最佳Ca/P,以提高污泥厌氧消化液中磷的回收效率。
2.3 高磷浓度下厌氧氨氧化-羟基磷灰石颗粒污泥特性
2.3.1 高磷浓度下形成的颗粒污泥组成
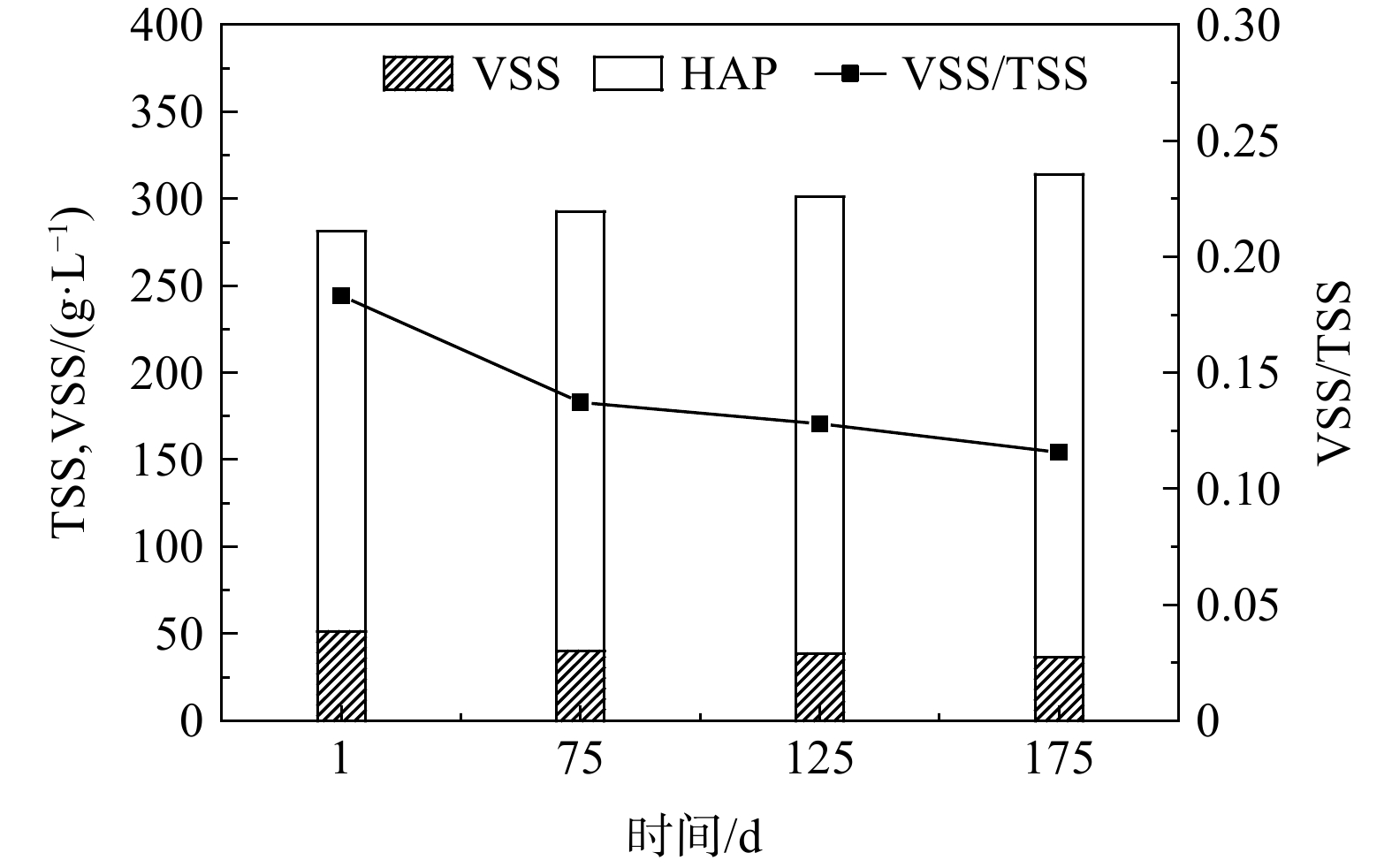
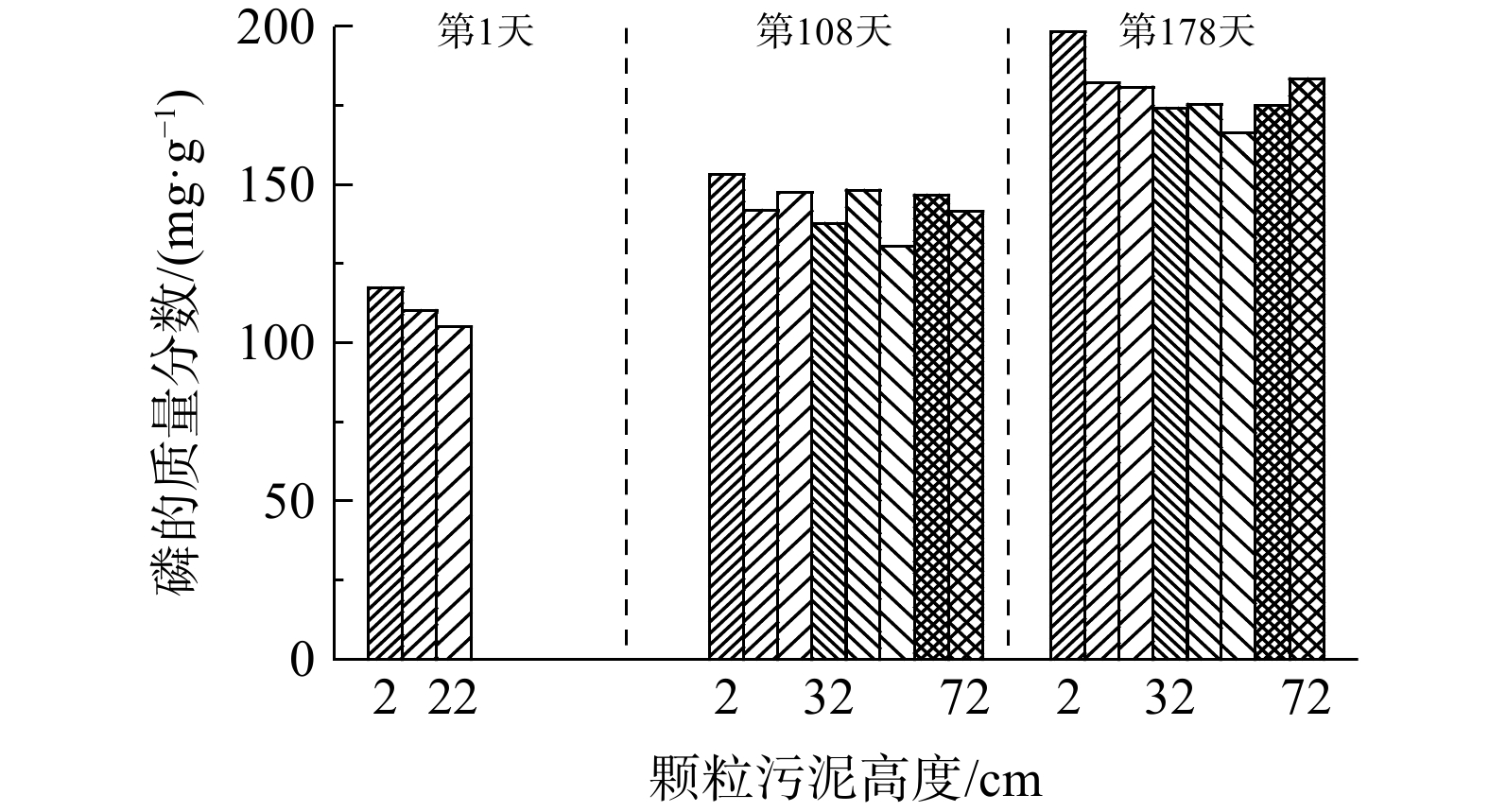
高磷浓度下形成高度矿化的颗粒污泥有助于实现系统对污泥厌氧消化液中磷的回收。不同时期EGSB反应器内VSS和HAP的分布如图4所示。反应器启动初期,接种污泥的泥层高度为12 cm,生物量质量浓度为51.5 g·L−1。运行至第103天,反应器内泥层高度为80 cm。此后,不定期的排泥使得反应器内泥层高度保持在约80 cm。随着反应器的运行,反应器内颗粒污泥的平均污泥浓度变化不大,为281.1~314.1 g·L−1。然而,污泥中平均VSS在明显减小,从51.5 g·L−1减至36.4 g·L−1;而反应器内平均HAP的含量在逐渐增大,从229.6 g·L−1增至277.8 g·L−1;VSS占TSS的比值从18%降至12%。由于EGSB反应器的升流式特性,反应器中形成的颗粒污泥无机组分含量从底部到上部逐渐减少。因此,需要不定期地从反应器底部取泥,以保证反应器中微生物量的充足,维持反应器的稳定运行。如表2和图5所示,反应器底部的颗粒污泥生物量占比较低,无机组分占比较高,且底部颗粒污泥的磷质量浓度高,因此,从反应器底部取出的高度矿化的颗粒污泥可成为有利用价值的磷资源。
表 2 不同高度EGSB反应器内颗粒污泥的组分特征(第178天)Table 2. Distribution of VSS and HAP in the EGSB reactor at different heights (178th day)反应器高度/cm TSS/(g·L-1) VSS /(g·L-1) VSS/TSS 2 350.3 38.17 0.11 12 272.34 35.35 0.13 22 253.71 32.29 0.13 32 237.96 31.74 0.13 42 259.5 32.73 0.13 52 240.91 25.76 0.11 62 220.83 31 0.14 72 209.87 28.59 0.14 2.3.2 高磷浓度形成的颗粒污泥特性
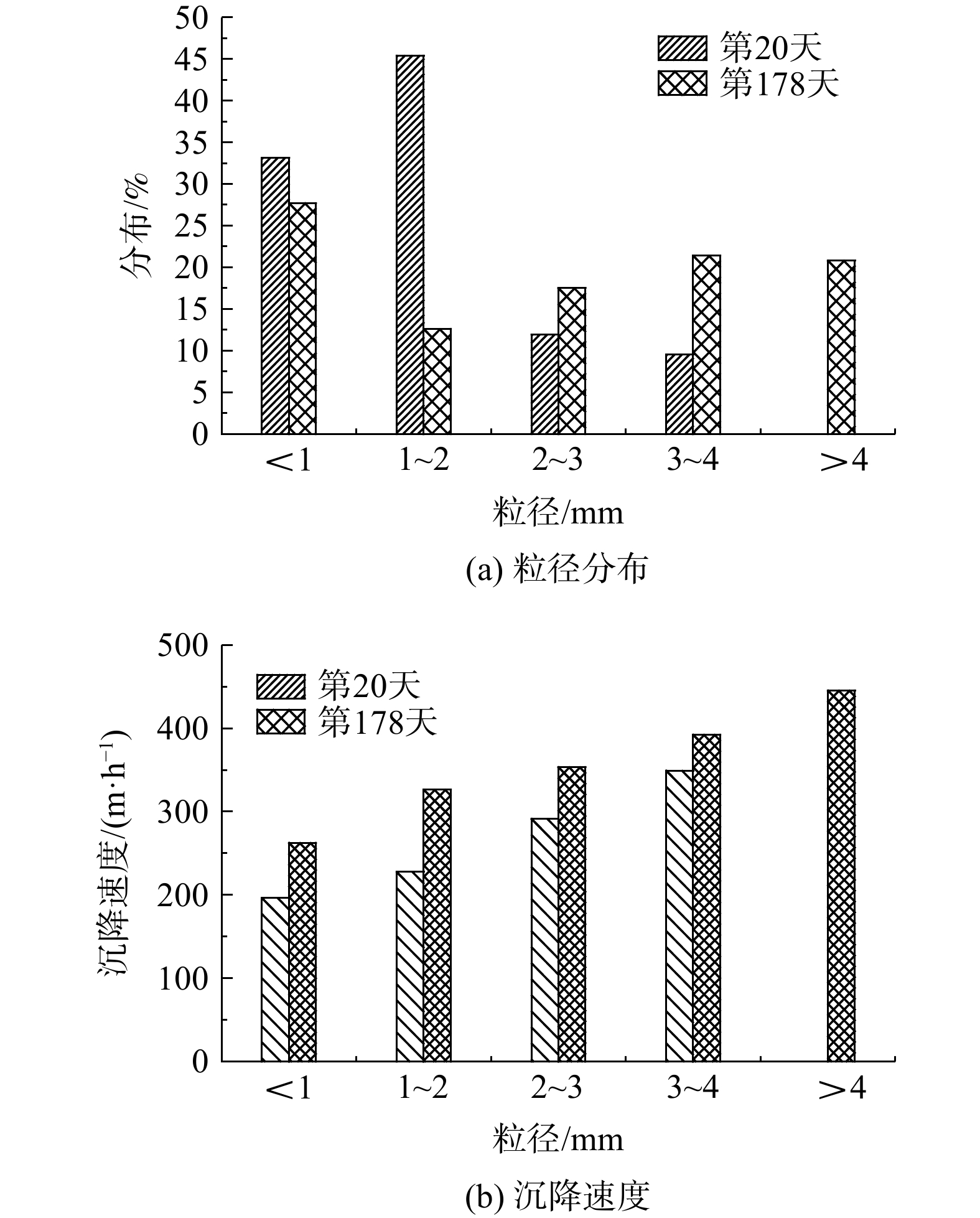
颗粒污泥的粒径分布和沉降速度分别体现了anammox-HAP颗粒污泥的生长情况和颗粒污泥的沉降性能。根据粒径大小,本研究将颗粒污泥分为5类:<1 、1~2、2~3、3~4 和>4 mm。由图6(a)可知,反应器运行至第20 天时,反应器内颗粒污泥主要以粒径<2 mm的为主;运行至第178 天时,颗粒污泥的粒径明显增大,大于2 mm的颗粒污泥的占比明显提高,占到50%以上。这也映证了反应器内的颗粒污泥会由小颗粒变成大颗粒。大粒径的颗粒污泥具有发育更为成熟的外膜内核结构[16]。然而,在本系统内磷质量浓度较高的条件下,形成的大颗粒污泥结构松散且不稳定,这可能是由于之前AnAOB活性受抑制,使得微生物新陈代谢能力下降,在不利于其凝聚的条件下形成了颗粒污泥。这也解释了在第178天反应器内小于1 mm的颗粒污泥占比仍达到27.2%。
HAP作为内核时anammox-HAP颗粒污泥具有较好的沉降性能[17]。由图(b)可知,反应器运行期间,颗粒污泥的沉降速度整体呈变大趋势。反应器内产生的高度矿化的污泥有利于污泥的沉降。在较高磷浓度下形成的颗粒污泥沉降速度为262.5~445.5 m·h−1,明显高于刚接种时anammox-HAP颗粒污泥的沉降速度。Anammox-HAP颗粒污泥的沉降速度明显高于其他研究中颗粒污泥的沉降速度[18-19],使其更易实现反应器内厌氧氨氧化菌的有效持留。然而,AnAOB的抑制会影响颗粒污泥的形成,导致反应器内存在一定的絮状污泥。反应器内的絮状污泥仍会因较大的上升流速随出水一起流出反应器。因此,在实验研究或者工程应用的过程中,应保证反应器的稳定运行,促进颗粒污泥形成较紧密的结构,以维持反应器内充足的生物量。
3. 结论
1)进水磷浓度在40~250 mg·L−1时,基于anammox-HAP工艺的EGSB反应器脱氮性能稳定,平均总氮去除率为88.5%,氮去除负荷为6.8 g·(L·d)−1。
2) Anammox-HAP系统磷回收效率与进水磷质量浓度、反应器pH及进水Ca/P密切相关。在保证反应器稳定运行的前提下,进水磷质量浓度、pH和Ca/P越高,越有利于磷的回收。磷回收效率最高可达89.7%。
3)由于EGSB反应器的升流式特性,反应器中形成的anammox-HAP颗粒污泥无机组分含量会沿反应器高度从上到下逐渐增大。通过定期从反应器底部排泥,既可实现高效优质的磷回收,又能保证anammox-HAP系统颗粒污泥的厌氧氨氧化活性,保持反应器的高效脱氮性能。
-
表 1 DWTR和LaFe-DWTR的表面元素分布比例
Table 1. Proportion of elements in DWTR and LaFe-DWTR
% 材料 C O Al Si Mg Fe La 总量 DWTR 24.34 30.42 9.04 12.12 4.17 9.47 — 89.56 LaFe-DWTR 16.12 19.28 4.24 3.95 3.55 15.03 27.79 89.96 表 2 DWTR和LaFe-DWTR的理化性质对比
Table 2. Comparison of physical properties between DWTR and LaFe-DWTR
材料 形貌 外观 比表面积/(m2·g−1) 孔径/nm 孔体积/(cm3·g−1) 粒径/μm 铁含量/(mg·g−1) 镧含量/(mg·g−1) DWTR 粉末 黄褐色 36.17 7.02 0.09 21.16 34.70 - LaFe-DWTR 粉末 黄褐色 98.57 6.00 0.17 22.70 107.60 175.10 表 3 LaFe-DWTR对
PO3−4-P Table 3. Fitting results of adsorption isotherms of LaFe-DWTR towards
PO3−4-P Langmuir Freundlich Sips qm kL RL2 kF 1/n RF2 Ks βS αS RS2 57.27 0.78 0.86 25.69 0.19 0.97 360.54 0.23 0.06 0.98 表 4 不同材料的
PO3−4-P Table 4. Comparison of adsorption capacity of different materials
原材料 改性方法 初始 PO3−4-P 理论吸附量/(mg·g−1) 参考文献 DWTR - 5.00~100.00 4.17~8.20 [22] DWTR 球形颗粒(D=6 mm) 0.31~310.00 19.70 [23] DWTR 热活化 52.00~930.00 29.66 [12] DWTR 酸活化 52.00~930.00 22.86 [12] DWTR 热酸活化 155.00~3 100.00 53.23 [24] DWTR 铁改性 10.00~150.00 24.69 [25] DWTR 镧改性 0.50~8.00 12.30 [26] 活性炭纤维 镧铁改性 10.00~60.00 29.44 [18] 膨润土 镧铁改性 2.00~40.00 14.30 [27] 蒙脱石 镧铁改性 0.49~4 032.24 17.86 [6] 膨胀石墨 镧铁改性 20.00~60.00 34.72 [28] DWTR 镧铁改性 0~300.00 57.27 本研究 表 5 LaFe-DWTR对
PO3−4-P Table 5. Fitting results of adsorption kinetics of LaFe-DWTR towards
PO3−4-P 准一级动力学模型 准二级动力学模型 qe/(mg·g−1) k1 R2 qe/(mg·g−1) k2 R2 21.96 0.30 0.88 23.36 0.40 0.92 表 6 LaFe-DWTR对
PO3−4-P Table 6. Fitting results of Weber-Morris intraparticle models of LaFe-DWTR towards
PO3−4-P 第1阶段 第2阶段 第3阶段 kp1/(mg·(g·h0.5)−1) R12 kp2/(mg·(g·h0.5)−1) R22 kp3/(mg·(g·h0.5)−1) R32 16.06 0.97 3.14 0.96 0.28 0.61 表 7 LaFe-DWTR吸附
PO3−4-P Table 7. Deconvolution of XPS O1s spectra for LaFe-DWTR before and after
PO3−4-P 材料 分峰 结合能/eV 半峰全宽/eV GL/% 峰面积 百分比/% 吸附前 H2O 532.80 1.07 80 6 912.87 5.54 M—OH 531.42 1.55 80 71 963.55 57.69 M—O 530.38 1.52 80 45 864.25 36.77 吸附后 H2O 532.80 1.30 80 21 552.21 12.59 M—OH 531.53 1.30 80 77 969.30 45.56 M—O 530.55 1.22 80 71 612.05 41.85 -
[1] LI X L, WANG Y L, LI J Y, et al. Rapid and selective harvest of low-concentration phosphate by La(OH)3 loaded magnetic cationic hydrogel from aqueous solution: Surface migration of phosphate from -N+(CH3)3 to La(OH)3[J]. Science of the Total Environment, 2021, 800(15): 149481. [2] LUO F, FENG X N, JIANG X Q, et al. Lanthanum molybdate/magnetite for selective phosphate removal from wastewater: Characterization, performance, and sorption mechanisms[J]. Environmental Science and Pollution Research, 2020, 28(4): 1-10. [3] SHAN S J, WANG W, LIU D M, et al. Remarkable phosphate removal and recovery from wastewater by magnetically recyclable La2O2CO3/γ-Fe2O3 nanocomposites[J]. Journal of Hazardous Materials, 2020, 397(5): 122597. [4] SHI W M, FU Y W, WEI J, et al. Enhanced phosphate removal by zeolite loaded with Mg-Al-La ternary (hydr)oxides from aqueous solutions: Performance and mechanism[J]. Chemical Engineering Journal, 2019, 357: 33-44. doi: 10.1016/j.cej.2018.08.003 [5] XIE J, WANG Z, LU S Y, et al. Removal and recovery of phosphate from water by lanthanum hydroxide materials[J]. Chemical Engineering Journal, 2014, 254: 163-170. doi: 10.1016/j.cej.2014.05.113 [6] CASTRO L F, BRANDAO V, BERTOLINO L C, et al. Phosphate adsorption by montmorillonites modified with lanthanum/iron and a laboratory test using water from the Jacarepaguá Lagoon (RJ, Brazil)[J]. Journal of the Brazilian Chemical Society, 2019, 30(3): 641-657. [7] QIU H, NI W X, ZHANG H H, et al. Fabrication and evaluation of a regenerable HFO-doped agricultural waste for enhanced adsorption affinity towards phosphate[J]. Science of the Total Environment, 2020, 703(PT.2): 135493.1-135493.11. [8] RAZALI M, ZHAO Y Q, BRUEN M. Effectiveness of a drinking-water treatment sludge in removing different phosphorus species from aqueous solution[J]. Separation and Purification Technology, 2007, 55(3): 300-306. doi: 10.1016/j.seppur.2006.12.004 [9] 崔競文, 郑晓英, 邱丽佳, 等. 城市给水厂污泥对污水中磷的动态吸附[J]. 环境工程学报, 2020, 14(4): 917-924. doi: 10.12030/j.cjee.201906110 [10] TAHMAZI T A, BABATUNDEA A O. Mechanistic study of P retention by dewatered waterworks sludges[J]. Environmental Technology & Innovation, 2016, 6: 38-48. [11] EVERAERT M, BERGMANS J, BROOS K, et al. Granulation and calcination of alum sludge for the development of a phosphorus adsorbent: From lab scale to pilot scale[J]. Journal of Environmental Management, 2020, 279: 111525. [12] 高思佳, 王昌辉, 裴元生. 热活化和酸活化给水处理厂废弃铁铝泥的吸磷效果[J]. 环境科学学报, 2012, 32(3): 606-611. [13] ELKHATIB E A, MAHDY A M, SALAMA K A. Green synthesis of nanoparticles by milling residues of water treatment[J]. Environmental Chemistry Letters, 2015, 13(3): 333-339. doi: 10.1007/s10311-015-0506-6 [14] 蒋亚辉, 张增强, 李荣华, 等. 铁锰氧化物改性铝污泥对Pb2+和Cu2+的吸附性能[J]. 西北农林科技大学学报(自然科学版), 2019, 47(4): 97-106. [15] SONG Q X, HUANG S Z, LI X, et al. Synthesis of magnetite/lanthanum hydroxide composite and magnetite/aluminum hydroxide composite for removal of phosphate[J]. Science of the Total Environment, 2020, 723: 137838. doi: 10.1016/j.scitotenv.2020.137838 [16] YU J, XIANG C, ZHANG G, et al. Activation of lattice oxygen in LaFe(Oxy)hydroxides for efficient phosphorus removal[J]. Environmental Science & Technology, 2019, 53(15): 9073-9080. [17] DONG S X, WANG Y L, ZHAO Y W, et al. La3+/La(OH)3 loaded magnetic cationic hydrogel composites for phosphate removal: Effect of lanthanum species and mechanistic study[J]. Water Research, 2017, 126(1): 433-441. [18] LIU J Y, ZHOU Q, CHEN J H, et al. Phosphate adsorption on hydroxyl-iron-lanthanum doped activated carbon fiber[J]. Chemical Engineering Journal, 2013, 215-216(2): 859-867. [19] ZHAO Y Q, NZIHOU A, REN B, et al. Waterworks sludge: An underrated material for beneficialreuse in water and environmental engineering[J]. Waste and Biomass Valorization, 2021, 12(8): 4239-4251. doi: 10.1007/s12649-020-01232-w [20] DUAN H J, ZHANG L, WANG Y L, et al. Phosphate removal from aqueous solution by Fe-La binary (hydr)oxides: Characterizations and mechanisms[J]. Environmental Science and Pollution Research, 2021. [21] CHEN Y N, XU R, LIU Y H, et al. La(OH)3-modified magnetic CoFe2O4 nanocomposites: A novel adsorbent with highly efficient activity and reusability for phosphate removal[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2020, 599(12): 124870. [22] BAI L L, WANG C H, HE L S, et al. Influence of the inherent properties of drinking water treatment residuals on their phosphorus adsorption capacities[J]. Journal of Environmental Sciences, 2014, 26: 2397-2405. doi: 10.1016/j.jes.2014.04.002 [23] LI X Q, CUI J, PEI Y S. Granulation of drinking water treatment residuals as applicable media for phosphorus removal[J]. Journal of Environmental Management, 2018, 213: 36-46. [24] WANG C H, GAO S J, WANG T X, et al. Effectiveness of sequential thermal and acid activation on phosphorus removal by ferric and alum water treatment residuals[J]. Chemical Engineering Journal, 2011, 172(2-3): 885-891. doi: 10.1016/j.cej.2011.06.078 [25] 马啸宙. 铁优化给水污泥降解水中磷行为特性及机理探讨[D]. 兰州: 兰州交通大学, 2016. [26] WANG C H, HAO Z, WEI Z, et al. A simple method to improve the adsorption properties of drinking water treatment residue by lanthanum modification[J]. Chemosphere, 2019, 221: 750-757. doi: 10.1016/j.chemosphere.2019.01.099 [27] LIN J W, ZHAO Y Y, ZHAN Y H, et al. Control of internal phosphorus release from sediments using magnetic lanthanum/iron-modified bentonite as active capping material[J]. Environmental Pollution, 2020, 264: 114809. doi: 10.1016/j.envpol.2020.114809 [28] ZHANG L, JIN S W, WANG Y, et al. Phosphate adsorption from aqueous solution by lanthanum-iron hydroxide loaded with expanded graphite[J]. Environmental Technology, 2018, 39(8): 997-1006. doi: 10.1080/09593330.2017.1317843 [29] ZHOU Y Q, WANG Y L, DONG S X, et al. Phosphate removal by a La(OH)3 loaded magnetic MAPTAC-based cationic hydrogel: Enhanced surface charge density and Donnan membrane effect[J]. Journal of Environmental Sciences, 2022, 113: 26-39. doi: 10.1016/j.jes.2021.05.041 [30] WU B, WAN J, ZHANG Y Y, et al. Selective phosphate removal from water and wastewater using sorption: Process fundamentals and removal mechanisms[J]. Environmental Science & Technology, 2020, 54(1). [31] LI R H, WANG J J, ZHOU B Y, et al. Enhancing phosphate adsorption by Mg/Al layered double hydroxide functionalized biochar with different Mg/Al ratios[J]. Science of the Total Environment, 2016, 559: 121-129. doi: 10.1016/j.scitotenv.2016.03.151 [32] BROWN P A, GILL S A, ALLEN S J. Metal removal from wastewater using peat[J]. Water Research, 2000, 34(16): 3907-3916. doi: 10.1016/S0043-1354(00)00152-4 [33] WU B, FANG L P, FORYNER J D, et al. Highly efficient and selective phosphate removal from wastewater by magnetically recoverable La(OH)3/Fe3O4 nanocomposites[J]. Water Research, 2017, 126(1): 179-188. -




















 下载:
下载: