-
禽粪污染是我国农村面临的主要污染之一[1]。据统计,我国每年家禽存栏量约为60×108 只,以粪排泄系数0.125 kg·d−1计,每年禽类粪污产量高达2.7×108 t。由于禽类粪便综合利用率低,其大量流入环境对生态环境具有极大威胁[2]。目前,全国约25个省份的耕地均面临着粪便磷(P)污染风险,其中3省市因粪便P超标,农地污染风险指数达到最高等级[3-4]。就总磷(TP)而言,禽类粪尿平均达5.37~6.20 kg·t−1,远高于牲畜类(0.52~3.41 kg·t−1)[2]。因降水、灌溉的冲刷淋洗作用,粪尿P大量流失,进而带来土壤面源污染、地下水污染及水体富营养化等一系列环境问题[5-6]。
近年来,热解处理技术在粪便[7]、污泥[8]、作物秸秆[9]等固废资源化利用方面备受关注。一方面,随着热解温度的提高,生物炭中TP含量不断增加[10],植物营养得到富集;另一方面,在热解过程中,高温使得生物炭P的水溶性降低,P的稳定性明显增加[11]。高温热解会导致植源生物炭中P由不稳定态向稳定态转变,形成更稳定的含P矿物,如纤磷钙铝石(CaAl3(OH)5(PO4)2)和银星石(Al3(OH)3(PO4)2·5H2O)[12]。在污泥生物炭中,相比低温,更高温度促使更多缓释P的形成[13]。在鸡粪生物炭中,随着热解温度的升高,P的形态也由植酸(C6H18O24P6)依次向磷镁石(Mg3(PO4)2)、方解石转化,水溶态P不断降低[7]。总之,热解温度会显著影响P形态[14],但鲜见有关借用Hedley分级方法探究生物炭中P的生物有效性及其形态动态变化的报道[12]。
畜禽粪便制备生物炭后再进行农业利用能有效降低土壤中TP的淋失[6, 15],淋失量除受生物炭来源、生物炭表面性质[16]等本身的性质影响外,还受生物炭添加量[17]、降水[18]、淋溶强度[19]等因素影响。本研究以不同热解温度制备畜禽粪便生物炭,并将生物炭中P按Hedley连续提取法进行分级;同时,探讨5次降水对施加生物炭的淋溶柱中P损失的影响,以期为生物炭应用于农田后地下径流中P污染风险控制提供参考。
-
1)鸡粪生物炭的制备。供试鸡粪于2020年6月采自江苏丹阳某蛋鸡养殖场。将剔除鸡毛、小石块等杂物后的鲜鸡粪于105 ℃烘干2 h,经研钵磨碎过2 mm筛,混匀后标记为CM。将干燥的鸡粪紧实装填于具盖坩埚中,分别于300、400、500、600和700 ℃限氧热解2 h(程控箱式电炉,型号SXL-1016,上海精宏实验设备有限公司),冷却后即为鸡粪生物炭,依次按热解温度编号为BC300、BC400、BC500、BC600、BC700。
2)供试土壤样品采集与处理。供试土壤于2020年7月采自江苏丹阳某有20 a种植史的农家菜地(东经119.673128°,北纬32.0213531°),采集深度为0~20 cm。土壤样品采集后,剔除作物根系等非土壤组分,自然风干后经磨细过2 mm筛,充分混匀后用塑料密封袋密封、分装并储存于4 ℃专用冰柜中备用。风干后土样pH 4.78、电导率121.5 μs·cm−1、含水率13.48%。
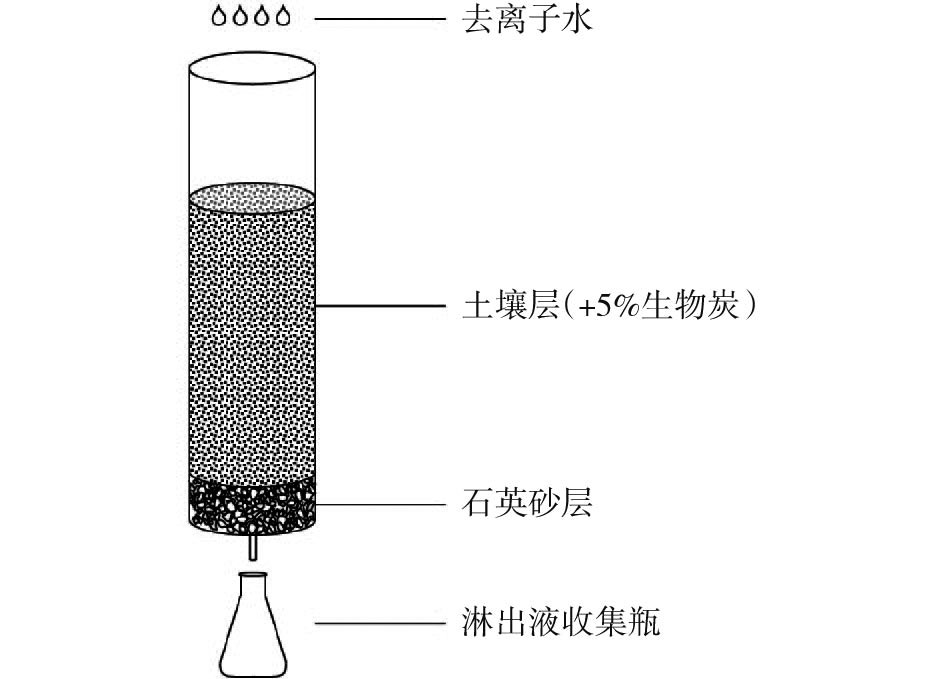
3)淋溶装置为圆柱形淋溶柱(Φ 8 mm×500 mm),底部预铺5 cm厚石英砂(见图1)。
-
1)用改进后的Hedley分级法测定生物炭中各P形态的质量分数[12]。依次采用去离子水(H2O)、碳酸氢钠(NaHCO3)、氢氧化钠(NaOH)、盐酸(HCl)溶液浸提生物炭,并采用HClO4-H2SO4完全消解残渣,测定上清液及消解液中P浓度。生物炭pH、电导率分别按国家标准GB/T 12496.7-1999和LY/T 1616-2004测定[20-21]。生物炭中无机磷(Pi)和TP质量分数分别经硫酸(H2SO4)浸提和HClO4-H2SO4 消解预处理后经钼锑抗比色法测定[22];有机磷质量分数为TP和Pi质量分数之差。
2)土柱淋溶实验。向土样中添加5%的生物炭或鸡粪进行土柱淋溶实验。模拟降雨共进行5次,每次模拟降雨强度(暴雨)为70 mm·h−1,持续30 min,收集淋出液。淋出液Pi、TP浓度分别采用钼锑抗比色法、过硫酸钾氧化-钼锑抗比色法测定[23]。
-
淋失率计算公式见式(1)。
式中:Li为第i次淋出液中P(指TP或Pi)的淋失率;Ci为第i次淋出液中P的质量浓度,mg·L−1;Vi为第i次淋出液体积, mL;m为添加生物炭或鸡粪中P的质量, mg。
-
不同温度热解的生物质炭理化性质见表1。由表1可知,相比CM,热解提高了生物炭的TP、Pi质量分数(均以干重计)和pH,降低了其电导率;且随着热解温度增加,TP质量分数和pH不断增加(TP的BC700处理除外),生物炭得率不断降低,Pi质量分数和电导率呈现波动性变化。随着热解温度的提高,生物炭中TP质量分数增加的现象,普遍存在于畜禽粪便[10, 24]、植物秸秆[25]等热解过程中。平均每升高100 ℃,生物炭TP质量分数便增加2~3 g·kg−1[26]。这归因于:随着温度提高,生物炭的得率降低导致的P浓缩作用[27]。畜禽粪便中,有机碳质量分数约为TP的19倍[28],有机碳会因热解产生H2O、CO、CO2和CH4等主要气体而大量损失[29],导致生物炭得率降低。例如,在700 ℃下热解的生物炭中,挥发性有机物减少了80%[30]。值得注意的是,尽管Pi是TP中最主要的P形态,但本研究发现,生物炭中Pi质量分数随热解温度变化而波动,表明其变动可能受P形态的影响,因而需要进一步细化研究。
生物炭pH的变化规律与生物炭来源(如植物、动物粪便等)和热解时长无关[31-32],而与生物炭中主要碱性物质(如矿物、有机官能团等)的赋存形态随热解温度的变化有关。一方面,随热解温度的升高,生物炭中含氧有机官能团(如羧基)因分解挥发而降低,甚至消失,从而导致了生物炭碱性的增加[11, 31];另一方面,生物炭中碳酸盐质量分数随着热解温度的升高而增加,对碱性物质的贡献也不断增加[33]。据统计,鸡粪生物炭和农作物的pH(9.4和9.5)比林木(8.2)、草本(8.7)、污泥(8.7)等其他来源的生物炭更高[28],可应用于改良酸性土壤[34-36]。综合以上结果可知,相比于鸡粪原料,鸡粪生物炭具有高P和偏碱性的特点,对酸性土壤在酸土改良与P肥供给方面可能更具优势。
-
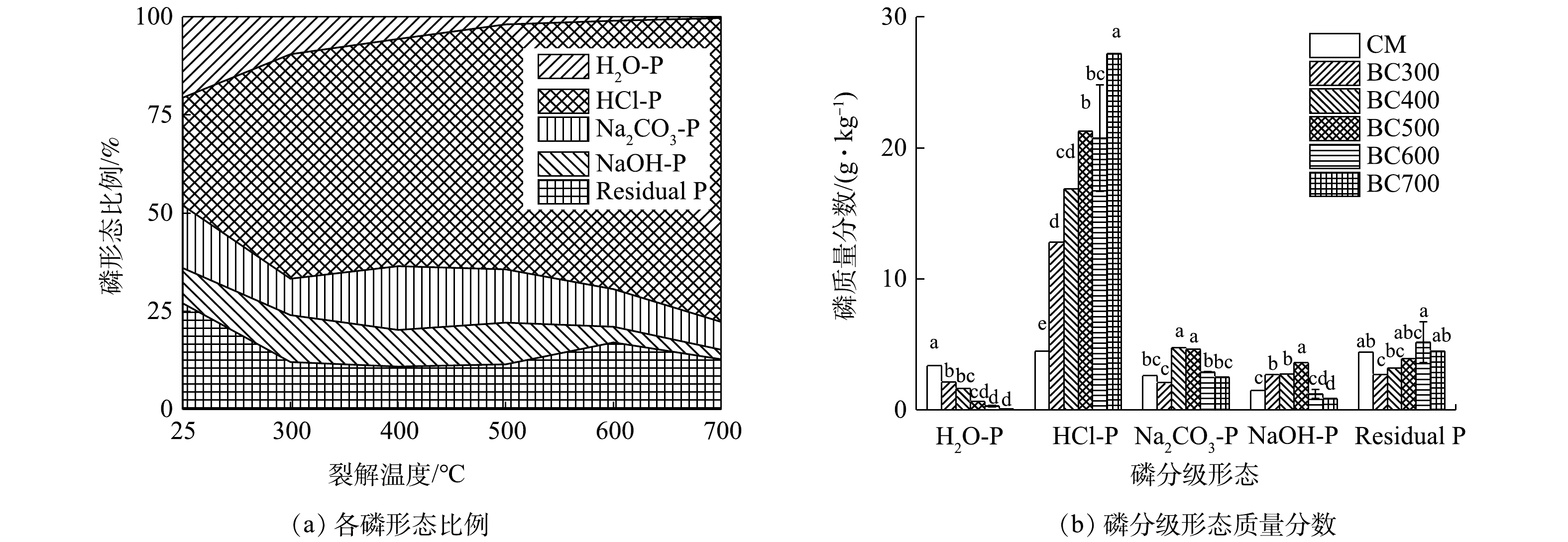
鸡粪生物炭各P形态比例随热解温度的变化见图2(a)。由图2(a)可知,随着热解温度的升高,鸡粪生物碳中H2O-P的占比不断减少;而生物炭中HCl-P占比逐渐增加并成为最主要的P形态;随热解温度的升高,NaHCO3-P和NaOH-P占比之和呈现先增加后降低的趋势,峰值出现时的热解温度在400 ~500 ℃;生物炭中Residual-P比例随温度升高的变化很小。
Hedley分级法是国际上认可度较高的P分级方法之一[37]。本实验借鉴Hedley分级法,将生物炭P形态区分为H2O-P、NaHCO3-P、NaOH-P、HCl-P和Residual-P。H2O-P是最易随水迁移的P形态,是评价粪肥P淋失风险的指标之一[38]。生物炭H2O-P比例随着热解温度升高而减少的规律在粪肥的热解过程中很常见[39]。因此,相比粪肥直接施用,热解处理能降低生物质炭中水溶性P浓度和比例,可降低P的淋溶风险。NaHCO3-P和NaOH-P分别是不稳定和中度稳定的P素形态,是可被植物生长利用的形态[40]。鸡粪生物炭NaHCO3-P和NaOH-P占比之和随热解温度的升高呈现先增后减的趋势,在使用作物秸秆制备生物炭时,也具有类似的趋势[12]。JIANG等[7]指出,较低温度热解适用于农田土壤修复,高温热解更适合于P的资源回收。因此,在鸡粪生物炭作为P肥施用资源化时,应当选择较低的热解温度以保留更多的植物可用态P。
鸡粪生物炭各P形态质量分数随热解温度的变化见图2(b)。由图2(b)可知,鸡粪生物炭中HCl-P是占绝对优势(占TP比例超50%)的稳定P形态。随着热解温度的升高,缓释磷HCl-P是生物炭中P转化的最主要去向。在低温(300 ℃)热解条件下,不稳定的H2O-P是HCl-P增加的主要贡献者;而在高温(600 oC以上)条件下,中度稳定的NaOH-P和NaHCO3-P是主要贡献者。与本研究结果一致的是,更高的热解温度确实会有使生物炭P由不稳定形态向稳定形态转化的趋势[7, 13]。XU等[12]对农作物秸秆来源的生物炭分析的结果表明,随着热解温度的升高,P形态由H2O-P转化先为弱稳定性的NaHCO3-P或NaOH-P,然后再转化为稳定态的HCl-P和Residual-P;经与秸秆来源的生物炭比较,可推断鸡粪生物炭P的形态组成的温度可控性更好,Residual-P更少,在控制农业污染方面可能更具有潜力。
-
降水引起的不同生物炭处理P淋失率见表2、表3和表4。相比CM处理,添加鸡粪生物炭均降低了土壤TP(表2)、Pi(表3)和Po (表4)的淋失率,依次降低了56.62%~ 67.74%、45.18%~64.15%、82.32%~92.82%。这说明,经热解处理后的鸡粪生物炭对土壤中P的迁移具有抑制作用[41]。LI等[15]发现,添加生物炭确实能显著降低土壤TP溶出量,这与本研究结果一致。其可能的原因是:1)动物粪便热解转化生物炭的过程促使了低溶解性磷矿石[(Ca,Mg)3(PO4)2]的形成,增加了生物炭本身P的稳定性[6],不同于粪肥的快速解吸P释放过程,生物炭中磷矿石的P释放过程是稳定而缓慢的[6];2)热解过程能增加鸡粪生物炭比表面积,其表面又存在大量的胶体和纳米MgO晶体,能将土壤间隙水中的P通过非均质吸附而固定[41];3)土壤中的铁铝元素也会影响磷酸盐化合物的移动性[42]。但土壤本身性质与生物炭对P迁移的贡献大小需进一步研究。与本研究类似,NOVAK等[43]发现,增加淋溶次数会导致鸡粪和植物源生物炭处理的土壤中TP和Pi的淋失率均不断增加。即使粪便来源比植物来源的生物炭通常含P量更高、释放更少[44],但如果是在田间施用时,应当充分考虑多次高强度降水可能会造成的淋失问题。
此外,表3显示,添加生物炭后,鸡粪生物炭的Pi累计淋失率,随着热解温度(300~700 ℃)的升高,呈现先增加后降低的趋势,BC500处理中Pi淋失率最大,BC300处理中Pi淋失率最小。不仅土壤性质如pH、阴阳离子等均会影响P素的释放[44],而且生物炭本身吸附容量的差异也可能是影响P固持与释放的重要因素[45]。另外,本实验尚未考虑作物特征及表面径流对P素淋失的影响。综上所述,依据TP和Pi淋失情况,并考虑制备生物炭过程中的能源损耗,300 ℃是较为理想的热解温度。
-
1)鸡粪经热解制备生物炭后,TP质量分数提高了31.8%~99.6%;随着热解温度的升高,生物炭中TP质量分数亦相应增加。
2)随着热解温度的升高,鸡粪生物炭P分级形态的变化规律是:HCl-P是生物炭中P素转化的最主要去向;低温(300 ℃)热解条件下,水溶性的H2O-P是HCl-P增加的主要贡献者;而高温(600 ℃以上)条件下,中度稳定的NaOH-P和NaHCO3-P是主要贡献者。
3)相比CM处理,所有添加鸡粪生物炭处理(BC300~BC700)均降低了土壤TP、Pi和Po的总淋失率,依次降低了56.62%~67.74%、45.18%~ 64.15%、82.32%~92.82%。随着热解温度(300~700 ℃)的升高,TP和Pi的总淋失率呈现先增加后降低的趋势,500 ℃下制备的生物炭总淋失率最大。从防止P损失和节约能耗角度综合考虑,300 ℃是最佳热解温度。
4)随着降水次数的增加,添加鸡粪生物质炭的土壤中TP和Pi的淋失率亦不断增加。
热解温度对鸡粪生物炭磷形态及磷淋失的影响
Effects of pyrolysis temperature on phosphorus speciation and phosphorus leaching loss of chicken manure biochar
-
摘要: 针对粪肥施用时的磷(P)污染风险,采用高温热解技术制备生物炭进行P固定,以降低其淋失风险。通过P分级法研究了生物炭中P形态随热解温度的变化规律,并通过土柱淋溶实验研究了5次模拟降水下鸡粪或生物炭中的P淋失率。结果表明,鸡粪生物炭中P的固定规律是:随热解温度升高,稳定态HCl提取态磷(HCl-P)不断增加,成为生物炭中P稳定化的最主要去向。低温(300 ℃)热解条件下,不稳定的H2O-P是HCl-P增加的主要贡献者;而高温(600 ℃以上)条件下,中度稳定的NaOH-P和NaHCO3-P是主要贡献者。随着降水次数的增加,鸡粪和生物炭处理的土壤中总磷(TP)和无机磷(Pi)的淋失率均不断增加。相比于鸡粪,所有生物炭处理经5次降水后的TP、Pi、有机磷(Po)的总淋失率依次降低了56.62%~67.74%、45.18%~64.15%、82.32%~92.82%。综合能耗考虑,300 ℃是制备鸡粪生物炭的理想温度并可防止P的淋失。本研究结果可为粪肥农用过程中土壤P污染控制提供参考。Abstract: For the phosphorus (P) pollution risk of manure application, manure-derived biochar was prepared by pyrolysis technology for stabilizing P and reducing its leaching risk. This paper studied P form variation of the biochar at different pyrolysis temperature by the P grading method, and P leaching from soil column with chicken manure or biochar addition under five simulated rainfalls. The results showed that with the increasing pyrolysis temperature, the HCl-P kept increasing and became the main destination of P stabilization in chicken manure biochar. The soluble H2O-P was the main contributor to the increase of HCl-P at low temperature (300 ℃), while the moderately stable NaOH-P and NaHCO3-P were the main contributors at high temperature (above 600 ℃). With the increasing rainfall times, the leaching loss of TP and Pi in all treatments increased continuously. As compared with chicken manure, the total leaching rates of TP, Pi and Po in biochar treatments decreased by 56.62%~67.74%, 45.18%~64.15% and 82.32%~92.82%, respectively. Considering energy consumption, 300 ℃ is the ideal temperature for preparing chicken manure biochar to prevent phosphorus leaching. This research provides reference for the control of soil P pollution in manure fertilization.
-
Key words:
- Chicken manure /
- Pyrolysis temperature /
- Biochar /
- Hedley extraction /
- Phosphorus loss /
- Leaching /
- Upland soil
-
石油类污染物的意外泄漏事故频繁发生,导致一定数量的非水相液体 (NAPL) 通过包气带进入地下造成污染[1]。在包气带内挥发性有机物 (VOCs) 会通过挥发作用进入土壤气体,VOCs气体在迁移过程中发生生物降解,源区轻非水相液体 (LNAPL) 由生物降解作用导致的衰减占LNAPL总质量损失的90%~99% [2-3]。因此,挥发性石油烃在包气带中的气相自然衰减和生物降解动力学规律的研究对VOCs蒸气入侵风险评估和石油场地监测自然衰减应用都具有重要意义[4-5],气相生物降解速率是蒸气入侵建模和定量风险评估的关键输入参数[6-7]。
当VOCs在污染源挥发成为气态在包气带扩散迁移过程中,吸附、生物降解等机制会导致显著的质量衰减,这被称为气相自然衰减[8-9]。在某汽油污染场地,从地下水源挥发的总碳氢化合物质量的68%在毛细管层被生物降解,石油烃蒸气潜水面上1 m内包气带内被降解殆尽[10]。HÖHENER等[11]通过微宇宙实验、柱实验及现场研究测定了包气带中13种VOCs的气相生物降解规律。VOCs气相自然衰减受到土壤类型、温度、含水率、营养水平等多种因素影响。土壤类型,特别是土壤孔隙度、含水量、土壤渗透性、有效扩散性和有机碳吸附能力是影响VOCs气相迁移归趋的重要因素[12]。YAO等[13]报道,土壤质地对VOCs浓度衰减的影响,其中土壤粒径的对底板下土壤气衰减因子的影响平均约为0.4个数量级。BEKELE等[14]研究了三氯乙烯 (TCE) 在5种不同的土壤中的气相吸附,粘土质量分数增加1倍会导致TCE蒸气吸附量增加11倍。但是,目前关于包气带VOCs气相自然衰减的研究仍然很不充分,对于不同种类石油烃蒸气在不同土壤中的吸附与生物降解规律以及我国不同区域土壤的气相自然衰减潜力尚不清楚。
本研究采用微宇宙实验,选取4种正构烷烃 (正戊烷、正己烷、正庚烷、正辛烷) 、4种环烷烃 (环戊烷、环己烷、环庚烷、环辛烷) 及4种苯系物 (苯、甲苯、乙苯、对二甲苯) ,对其在黑土、黄土、红土及石英砂等4种土壤中的气相自然衰减规律和生物降解速率进行了系统研究。
1. 材料与方法
1.1 实验材料
实验试剂采用色谱纯的正戊烷、正己烷、正庚烷、正辛烷、环戊烷、环己烷、环庚烷、环辛烷、苯、甲苯、乙苯、对二甲苯。本研究所用的黄土、黑土、红土和石英砂分别取自河北省、黑龙江省、云南省和江西省,土壤经自然风干后过2 mm标准方孔筛备用,其基本理化性质如表1所示。
表 1 实验土壤的基本理化性质Table 1. Basic physical-chemical characteristics of experimental soils土壤类型 pH 孔隙度 含水率 有效扩散系数 (20 ℃)/ (正戊烷,m2·d−1) 密度/ (g·cm−1) 有机质质量分数/% 土壤质地 机械组成/% 砂粒 粉粒 黏粒 黄土 7.8 0.5 0.02 0.28 1.3 0.66 壤土 49.6 39.6 10.7 黑土 6.1 0.8 0.09 0.80 0.6 36.70 壤质砂土 74.6 19.6 5.8 红土 5.7 0.6 0.02 0.36 1.0 0.33 粘土 11.2 5.4 83.4 石英砂 7.6 0.4 0.01 0.19 1.5 0.32 砂土 97.4 1.8 0.9 1.2 实验方法
微宇宙实验在50 mL的玻璃旋盖小瓶中进行,分别取20 g土壤及20 μL混合污染物于瓶中,使用特氟龙微型阀瓶盖密封。为了研究非生物作用对气相自然衰减的贡献,同时做灭菌对照组,使用120 ℃高压蒸汽灭菌30 min。每隔一段时间进行气体取样,采用250 μL气密性微量取样针取100 μL气体,用气相色谱仪测定污染物蒸气的质量浓度 (g·m−3) 。
1.3 分析方法
污染物气体质量浓度采用安捷伦7890B 气相色谱仪,检测器为火焰离子化检测器(FID),温度250 ℃,HP-5毛细管柱( 30 m×0. 32 mm×0. 25 μm),进样口温度设置为200 ℃,分流比10∶1。测试正构烷烃时,柱箱升温程序为初始温度55 ℃保持时间2.5 min,升温至140 ℃,保持时间0.2 min,升温速率为30 ℃·min−1。测试环烷烃时,柱箱温度为50 ℃保持时间2 min,升温至75 ℃,保持时间0.2 min,升温速率为10 ℃·min−1。测试苯系物时色谱柱箱恒温120 ℃。
自然衰减通常用一级动力学模型描述。气态烃的表观一级衰减速率是通过质量浓度数据明显下降阶段的ln (Ct/C0) 与时间 (t) 线性回归来确定,其中C0是污染蒸气的初始质量浓度,Ct是t时刻污染蒸气质量浓度[15]。非灭菌土壤中的表观一级衰减速率是生物降解和非生物自然衰减速率的总和,而灭菌土壤中的污染物质量浓度下降仅由非生物机制引起,因此标记为“非生物衰减速率”。对于同一种气态烃,非灭菌土壤中的“表观一级衰减速率”减去灭菌土壤中的“非生物衰减速率”是生物降解的真正贡献,标记为“生物降解速率”[16]。
2. 结果与讨论
2.1 正构烷烃在4种土壤中的气相自然衰减
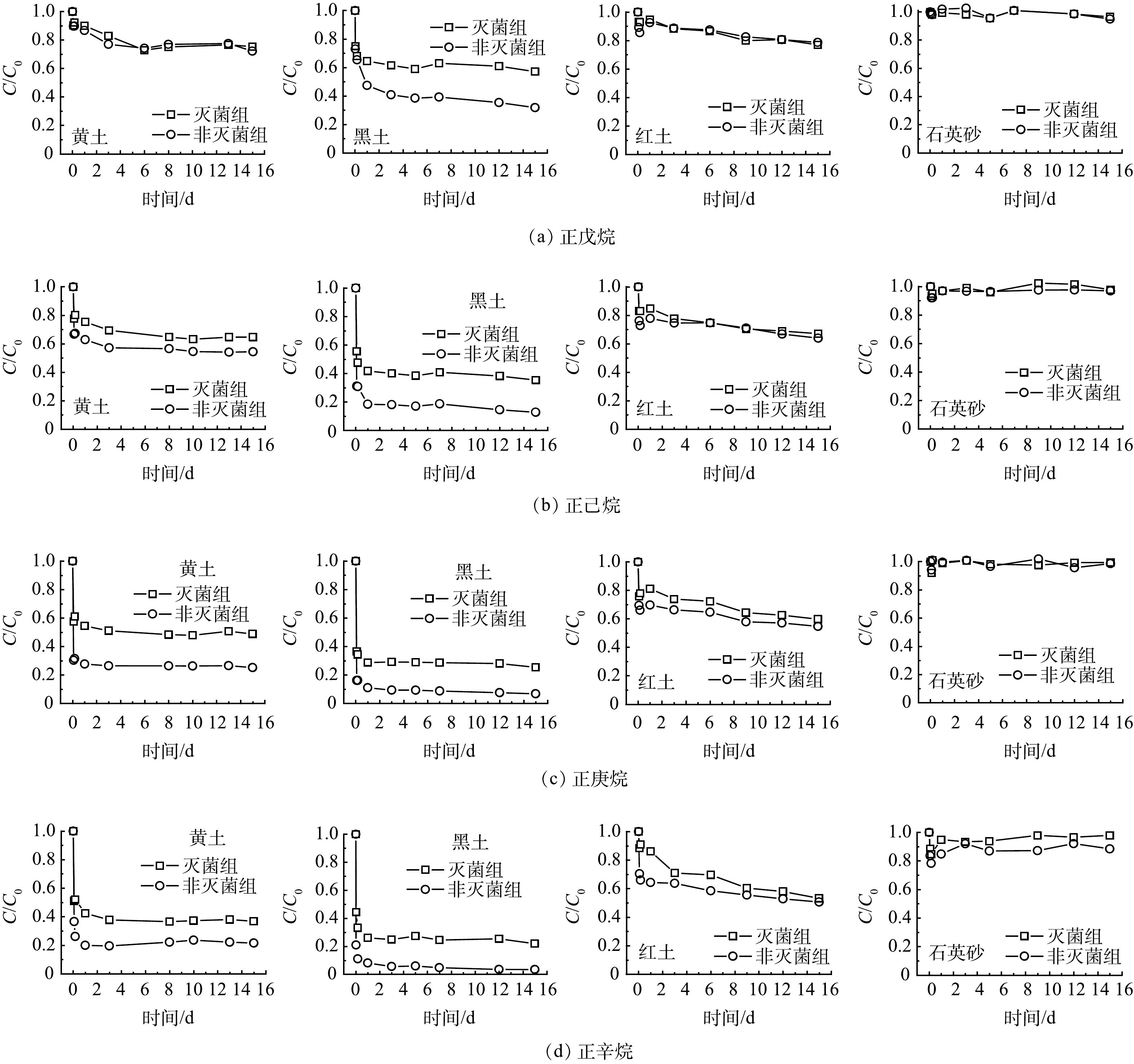
4种正构烷烃 (正戊烷、正己烷、正庚烷、正辛烷) 在灭菌组和非灭菌组的衰减去除率均表现为黑土>黄土>红土>石英砂 (表2) 。4种正构烷烃的生物降解速率表现为黑土>黄土>红土,石英砂未发生明显的生物降解,因此无法拟合石英砂的降解速率 (图1、表3) 。灭菌组中气态烃的自然衰减机制主要是吸附,而土壤有机质质量分数是4种土壤气相吸附能力差异大的主要原因。4种土壤的有机质的质量分数顺序:黑土 (36.70%) >黄土 (0.66%) >红土 (0.33%) >石英砂 (0.32%) 。这与灭菌组中的气态烃衰减去除率一致。其他研究[14,17]也发现,土壤有机质质量分数是土壤对气态VOCs吸附的主要因素,高有机质质量分数会增加土壤对VOCs的吸附。BEKELE等[14]报道,土壤有机质质量分数增加1倍导致总三氯乙烯蒸气吸附量增加7倍。UGWOHA和ANDRESEN [17]发现,土壤有机质质量分数从0增加至5%后气态烷烃的吸附质量增加了2倍,土壤有机质量分数的增加会增强汽油烃蒸气的吸附速度和吸附量。气态VOCs需要首先被土壤吸附固定,然后才能被土壤微生物代谢降解[18],较高的有机质质量分数会提高土壤吸附固定VOCs的能力,从而会提高其生物降解能力。因此,土壤有机质质量分数是4种土壤气相吸附能力和生物降解能力差异大的主要原因。除有机质质量分数外,土壤的生物降解能力还与土壤土著微生物数量密切相关,经测试发现,本研究所用的黑土 (5.2×106 cfu·g−1) 和黄土 (2.1×106 cfu·g−1) 中的微生物数量远大于红土 (1.2×105 cfu·g−1) 和石英砂 (2.0×103 cfu·g−1) 。综上所述,较高有机质质量分数和微生物数量使得黑土对于气态烃具有较强的自然衰减能力。
表 2 石油烃在不同土壤中自然衰减去除率Table 2. The remove rates of petroleum hydrocarbons in different soils% 化合物 黄土 黑土 红土 石英砂 灭菌组 非灭菌组 生物降解的贡献* 灭菌组 非灭菌组 生物降解的贡献* 灭菌组 非灭菌组 生物降解的贡献* 灭菌组 非灭菌组 生物降解的贡献* 正戊烷 24.61 27.82 3.21 42.91 68.18 25.27 21.33 23.06 1.73 3.56 5.08 1.52 正己烷 35.35 45.64 10.29 64.67 87.24 22.57 32.89 36.05 3.16 2.18 3.03 0.86 正庚烷 51.17 74.77 23.61 74.62 93.20 18.58 40.25 45.29 5.04 0.61 1.39 0.78 正辛烷 63.14 78.43 15.28 78.12 96.55 18.44 49.37 46.77 2.60 5.63 7.87 2.24 环戊烷 13.30 33.68 20.38 20.90 43.04 22.14 5.29 6.29 1.00 5.58 9.62 4.05 环己烷 12.96 28.24 15.28 46.68 70.96 24.28 1.75 7.09 5.34 4.29 9.91 5.62 环庚烷 8.23 45.91 37.68 61.22 84.85 23.63 9.88 12.89 3.01 12.67 14.29 1.62 环辛烷 57.60 66.28 8.67 71.90 85.35 13.45 9.14 17.37 8.23 12.56 21.14 8.58 苯 69.62 81.55 11.93 77.66 92.32 14.66 64.88 75.69 10.81 27.15 27.51 0.36 甲苯 72.54 80.57 8.03 82.64 91.98 9.34 67.44 75.63 8.19 26.43 27.00 0.57 乙苯 72.31 79.12 6.81 80.98 85.64 4.66 53.64 56.86 3.23 19.38 19.88 0.50 对二甲苯 75.80 82.81 7.01 77.57 83.36 5.80 51.45 55.65 4.20 19.46 20.00 0.54 注:“*”表示生物降解贡献的去除率为非灭菌组与灭菌组去除率之差。 表 3 石油烃在不同土壤中的一级衰减速率常数Table 3. The first order attenuation rate constants of petroleum hydrocarbons in different soilsd−1 化合物 黄土 黑土 红土 石英砂 灭菌组 非灭菌组 生物降解 灭菌组 非灭菌组 生物降解 灭菌组 非灭菌组 生物降解 灭菌组 非灭菌组 生物降解 正戊烷 0.03 0.04 0.01 0.03 0.06 0.03 0.02 0.02 — — — — 正己烷 0.03 0.06 0.03 0.05 0.18 0.13 0.016 0.02 0.004 — — — 正庚烷 0.05 0.18 0.13 0.26 0.54 0.28 0.02 0.05 0.03 — — — 正辛烷 0.06 0.15 0.09 0.02 0.12 0.10 0.03 0.05 0.02 — — — 环戊烷 0.01 0.02 0.01 0.04 0.07 0.03 0.01 0.01 — — — — 环己烷 0.01 0.03 0.02 0.20 0.26 0.06 0.01 0.01 — — — — 环庚烷 0.02 0.05 0.03 0.28 0.32 0.04 0.01 0.01 — — — — 环辛烷 0.07 0.09 0.02 0.33 0.39 0.06 0.01 0.01 — — — — 苯 25.68 27.84 2.16 28.24 235.48 7.24 24.24 25.78 1.54 — — — 甲苯 30.72 38.96 8.24 29.36 39.12 9.76 25.68 28.44 2.76 — — — 乙苯 15.6 17.08 1.48 324.98 30.82 5.84 11.76 12.72 0.96 — — — 对二甲苯 14.4 15.58 1.18 23.76 27.66 3.90 11.04 11.94 0.90 — — — 2.2 环烷烃在4种土壤中的气相自然衰减
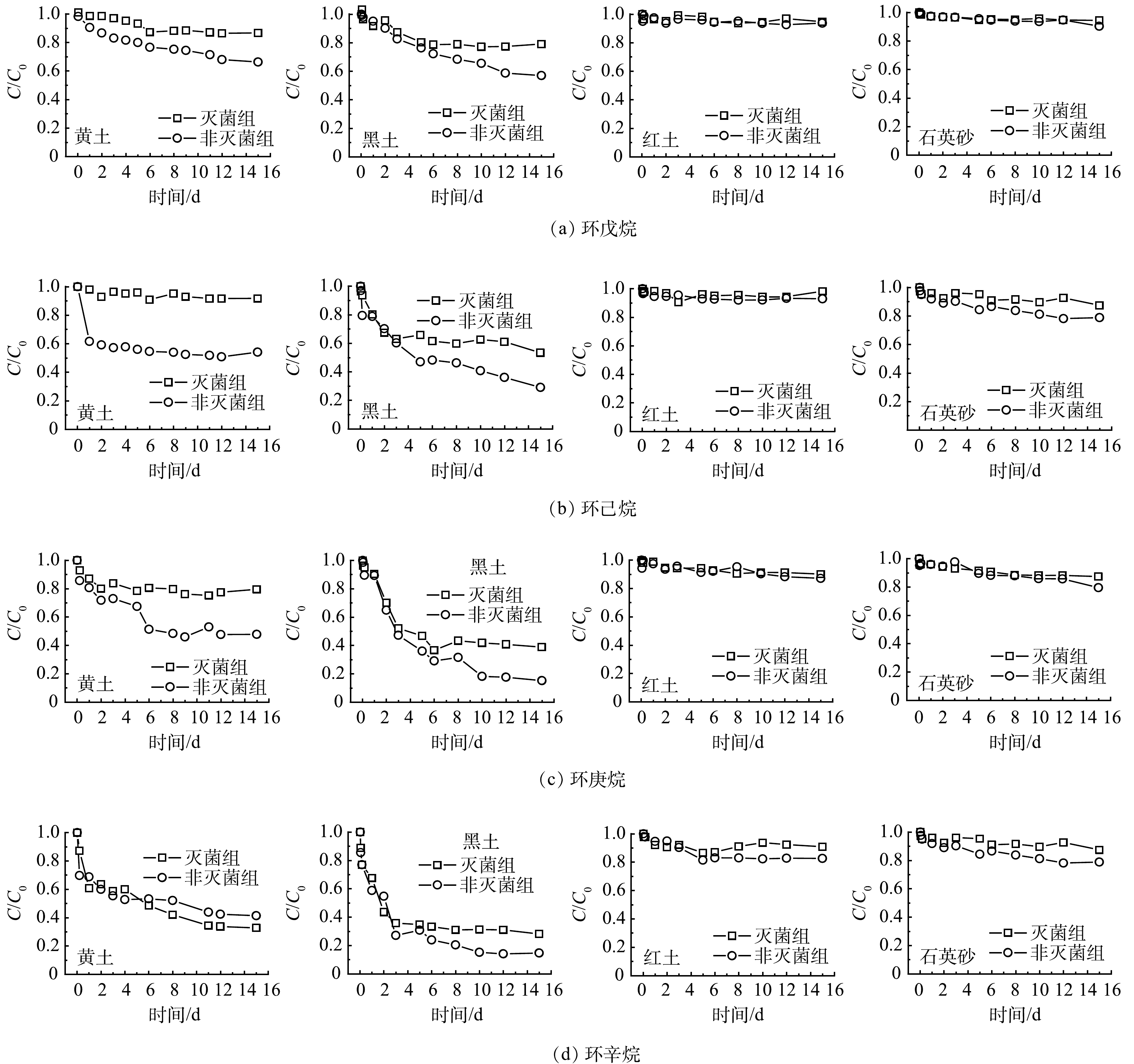
4种环烷烃 (环戊烷、环己烷、环庚烷、环辛烷) 在不同土壤中的衰减规律与正构烷烃相似,在灭菌组和非灭菌组的衰减去除率整体上符合黑土>黄土>红土>石英砂的规律 (表2、图2) 。环烷烃在黑土、黄土和红土中的生物降解速率均很小 (<0.06 d−1) ,而石英砂中几乎不存在生物降解。这说明环烷烃蒸气的生物降解性极低 (表3) 。HöHENER等[11]也发现,气相环烷烃的自然衰减速率很低,实验和场地等不同方式获得的气相一级衰减速率常数均低于0.31 d−1。这可能由于环烷烃的溶解度较低,导致土壤气体和水之间的界面传质速率较低[19]。而且短链烷烃 (<C9) 对许多微生物都有毒性,中间链长的正构烷烃 (C10~C24) 降解速度最快,短链烷烃通过其溶剂作用来抑制微生物活性,它们在作为溶剂存在时会破坏脂质膜[20-21]。大量有机地球化学研究证实环烷烃的生物降解性低于正构烷烃[22-23],且生物降解随着环数的增加而降低[24]。环烷烃通过氧化酶的作用降解为环醇,进一步脱氢为酮,环烷烃代谢的主要产物是环酮和环烷烃-羧酸[20,24]。
2.3 苯系物在4种土壤中的气相自然衰减
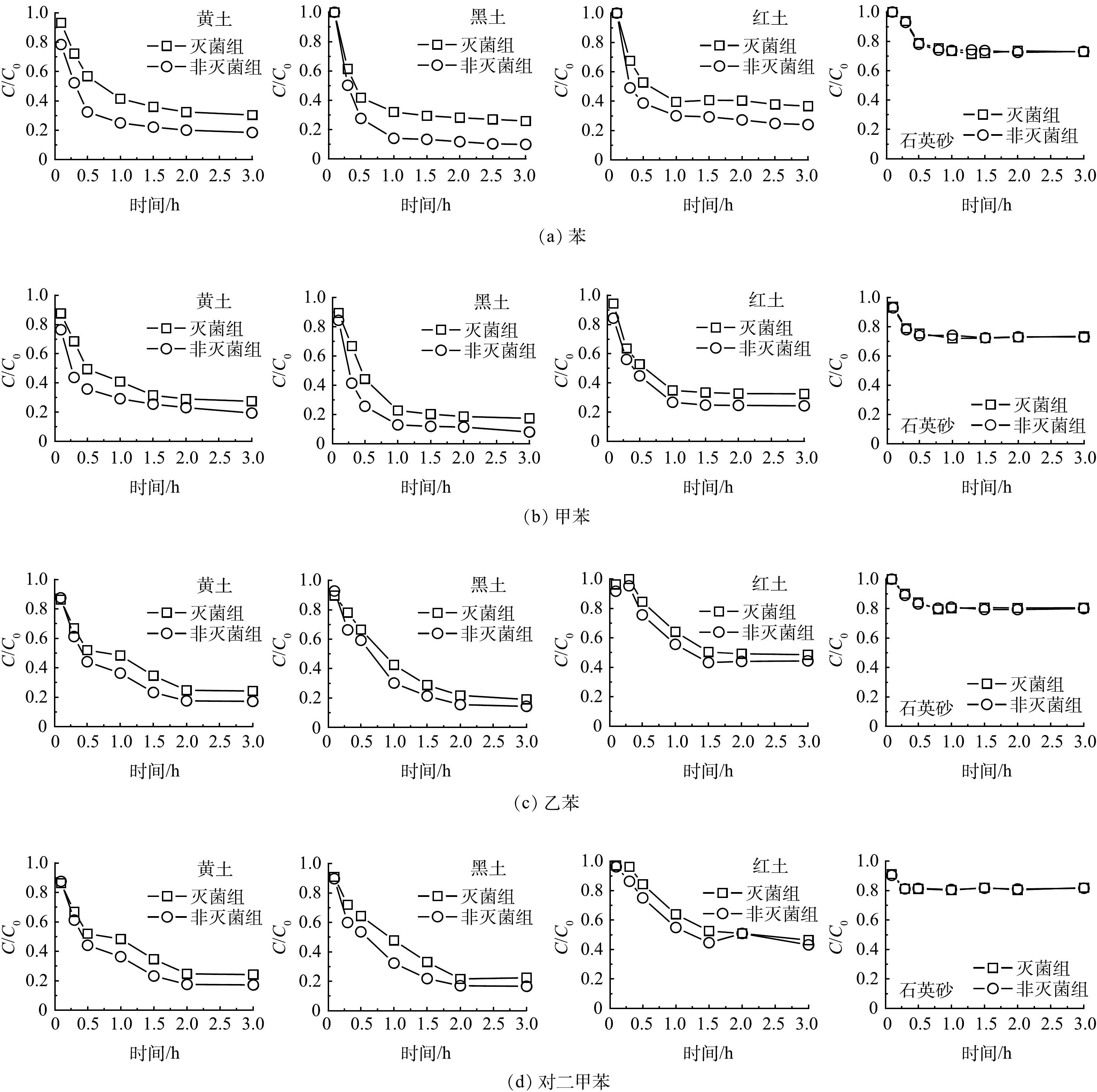
4种苯系物 (苯、甲苯、乙苯、对二甲苯) 在4种土壤在灭菌组和非灭菌组中的自然衰减去除率均表现为黑土>黄土>红土>石英砂 (表2、图3) 。4种苯系物的生物降解速率均符合黑土 (3.90~9.76 d−1) >黄土 (1.18~8.24 d−1) >红土 (0.90~2.76 d−1) 的规律,而石英砂几乎不存在生物降解 (表3) 。因为黑土中的高有机质质量分数会促进苯系物蒸气的吸附,进而促进生物降解。UGWOHA和ANDRESEN[17]发现土壤有机质的质量分数增加5%导致E20乙醇汽油中苯的吸附量增加76%。在不同的土壤中苯系物的一级生物降解速率均为甲苯>苯>乙苯>对二甲苯。苯系物的生物降解速率依赖于分子化学结构,甲苯通常认为是苯系物中最容易被生物降解的。因为环上存在取代基提供了攻击侧链或氧化芳香环的替代途径[25]。苯氧化的第一步是由双加氧酶催化的羟基化,苯环上取代基的存在允许两种可能的机制:攻击侧链或氧化芳环,所有这些途径汇聚形成邻苯二酚中间体。苯主要中间产物是邻苯二酚,甲苯和乙苯在单独的途径上降解,产生各自的主要中间体3甲基邻苯二酚和3-乙基邻苯二酚,二甲苯均代谢为单甲基化儿茶酚[25]。BTEX化合物之间存在复杂的底物相互作用以及其生物降解过程中的竞争性抑制效应[26];有研究报道[27],在混合物中苯和甲苯根据竞争性抑制动力学被去除,而对二甲苯在苯和甲苯的存在下通过共代谢过程部分去除,甲苯、苯或乙苯的存在对二甲苯的降解速率有负面影响。尽管芳环上没有官能团可能使苯难以被生物转化,但苯在水中的溶解度 (1 791.00 mg·L−1) 在4种苯系物中最高(甲苯、乙苯及对二甲苯溶解度分别为535.00、161.00、156.00 mg·L−1),也促进了苯的生物降解[25]。
2.4 不同种类石油烃的气相自然衰减潜力对比
苯系物的自然衰减去除率和生物降解速率远高于正构烷烃和环烷烃,环烷烃最难被生物降解。4种苯系物中一级生物降解速率均为甲苯>苯>乙苯>对二甲苯,甲苯最容易被生物降解。苯、甲苯、乙苯、对二甲苯生物降解速率0.90~9.76 d−1,正戊烷、正己烷、正庚烷、正辛烷生物降解速率小于0.28 d−1,环戊烷、环己烷、环庚烷、环辛烷生物降解速率小于0.06 d−1。苯系物的表观一级衰减速率和生物降解速率都远高于正构烷烃和环烷烃,可能因为苯系物的溶解度远高于正构烷烃和环烷烃[22]。PASTERIS等[21]也报道过,柱实验数据拟合的甲苯的一级生物降解速率常数为3.2 d−1,而短链烷烃如戊烷和己烷、环烷烃和的生物降解速率较慢,估计为0.1~1.2 d−1。脂肪族烃缺乏官能团且水溶性极低,微生物对脂肪烃都表现出较低的化学反应性和生物利用度,烷烃的微生物降解的敏感性:正构烷烃>异构烷烃>环烷烃[20]。
3. 结论
1) 正构烷烃、环烷烃和苯系物蒸气在4种土壤中的自然衰减,整体自然衰减去除率黑土>黄土>红土>石英砂,黑土生物降解速率高于黄土,红土和石英砂的生物降解能力很低。
2) 苯系物的气相自然衰减速率和生物降解速率远高于正构烷烃和环烷烃。包气带中的气相生物降解是石油污染场地一种重要但被忽视的自然衰减机制,该过程对于挥发性石油烃蒸气入侵暴露以及污染物自然衰减均具有重要的影响。
3) 气相自然衰减和气相生物降解动力学数据可以为蒸气入侵定量风险评估和石油污染场地自然衰减速率定量评估模型提供关键输入参数。
-
表 1 鸡粪生物质炭得率、pH、电导率及P组分
Table 1. Properties of chicken manure biochar: yield, pH, electric conductivity and P speciation
处理组 生物炭得率/% pH 电导率/(μs·cm−1) TP质量分数/(g·kg−1) Pi质量分数/(g·kg−1) Po质量分数/(g·kg−1) CM − 8.1±0.1f 4 568.0±1 368.2a 22.59±2.30d 15.26±1.53d 7.33±2.04a BC300 73.8±2.9a 9.5±0.0e 1 269.3±131.2c 29.78±2.53cd 20.02±0.68c 9.75±2.62a BC400 58.6±1.9b 10.0±0.0d 1 488.0±24.1b 36.09±2.47bc 32.30±2.57ab 3.79±0.28a BC500 56.9±0.7b 10.4±0.1c 1 266.7±2.5c 37.27±3.00bc 31.36±1.33b 5.91±2.03a BC600 52.2±0.6c 10.5±0.0b 1 345.7±3.2bc 45.09±6.98a 35.24±2.09a 9.85±8.84a BC700 50.6±1.0c 10.9±0.1a 1 032.0±17.8d 42.56±4.84ab 33.11±2.57ab 9.44±4.68a 注:表中TP、Pi和Po分别代表总磷、无机磷和有机磷;表中数据以平均值±标准偏差表示;表中同列标有不同小写字母表示各处理间差异显著(P<0.05)。 表 2 不同处理土柱TP淋失率
Table 2. Total phosphorus loss rate in soil columns with different treatments
‰ 处理组 1次降水后淋失率 2次降水后淋失率 3次降水后淋失率 4次降水后淋失率 5次降水后淋失率 累计淋失率 BC300 1.59±0.17b 2.18±0.34b 2.76±0.32b 3.74±0.36c 4.67±0.27c 14.94±0.96b BC400 1.95±0.22b 2.04±0.32b 3.01±0.75b 4.00±0.95c 5.97±1.97bc 16.97±3.41b BC500 1.56±0.18b 2.19±0.34b 3.10±0.73b 6.02±0.23b 7.23±0.74b 20.09±1.42b BC600 1.20±0.02b 1.83±0.21b 2.60±0.53b 4.70±0.53bc 4.98±0.19c 15.31±0.82b BC700 1.01±0.25b 1.52±0.07b 2.75±0.52b 4.80±0.11bc 5.03±0.32c 15.12±0.44b CM 7.74±2.69a 9.29±2.14a 8.92±1.40a 9.94±1.31a 10.43±1.35a 46.32±7.49a 注:同一列数据后字母不同表示处理间差异达到显著水平(P<0.05)。 表 3 不同处理土柱Pi淋失率
Table 3. Inorganic phosphorus loss rate in soil columns with different treatments
‰ 处理组 1次降水后淋失率 2次降水后淋失率 3次降水后淋失率 4次降水后淋失率 5次降水后淋失率 累计淋失率 BC300 1.32±0.19b 1.71±0.33b 2.61±0.38b 3.54±0.53d 4.18±0.54c 13.36±1.24c BC400 1.58±0.29b 1.86±0.37b 2.94±0.53b 4.19±1.11cd 5.97±1.41b 16.54±3.61c BC500 1.49±0.18b 2.09±0.19b 2.97±0.83b 5.76±0.36b 8.11±0.30a 20.43±1.34b BC600 1.06±0.05b 1.46±0.11b 2.53±0.33b 4.55±0.61cd 5.72±0.07b 15.33±0.66c BC700 1.00±0.17b 1.23±0.18b 3.05±0.21b 4.80±0.45bc 5.01±0.18b 15.10±0.48c CM 6.11±1.96a 7.42±1.26a 7.38±0.66a 7.94±0.28a 8.42±0.75a 37.27±3.41a 注:同一列数据后字母不同表示处理间差异达到显著水平(P<0.05)。 表 4 不同处理土柱Po淋失率
Table 4. Organic phosphorus loss rate in soil columns with different treatments
‰ 处理组 1次降水后淋失率 2次降水后淋失率 3次降水后淋失率 4次降水后淋失率 5次降水后淋失率 累计淋失率 BC300 0.26±0.04b 0.46±0.39b 0.15±0.06b 0.24±0.22b 0.49±0.35b 1.60±0.82b BC400 0.37±0.28b 0.36±0.36b 0.11±0.18b 0±0b 0.42±0.37b 1.26±0.64b BC500 0.12±0.11b 0.14±0.12b 0.13±0.12b 0.26±0.18b 0±0b 0.65±0.29b BC600 0.14±0.05b 0.37±0.13b 0.10±0.17b 0.14±0.09b 0±0b 0.76±0.25b BC700 0.04±0.04b 0.29±0.11b 0.06±0.10b 0.18±0.17b 0.11±0.19b 0.67±0.09b CM 1.62±1.57a 1.87±1.11a 1.54±0.79a 2.00±1.35a 2.02±0.64a 9.05±4.69a 注:同一列数据后字母不同表示处理间差异达到显著水平(P<0.05)。 -
[1] 王方浩, 马文奇, 窦争霞, 等. 中国畜禽粪便产生量估算及环境效应[J]. 中国环境科学, 2006, 26(5): 614-617. doi: 10.3321/j.issn:1000-6923.2006.05.024 [2] 吴浩玮, 孙小淇, 梁博文, 等. 我国畜禽粪便污染现状及处理与资源化利用分析[J]. 农业环境科学学报, 2020, 39(6): 1168-1176. doi: 10.11654/jaes.2020-0218 [3] 金磊, 王立志. 畜禽粪便磷排放减少的措施研究进展[J]. 饲料工业, 2020, 41(9): 58-63. [4] 耿维, 胡林, 崔建宇, 等. 中国区域畜禽粪便能源潜力及总量控制研究[J]. 农业工程学报, 2013, 29(1): 171-179. [5] GAGNON B, DEMERS I, ZIADI N, et al. Forms of phosphorus in composts and in compost-amended soils following incubation[J]. Canadian Journal of Soil Science, 2012, 92: 711-721. doi: 10.4141/cjss2012-032 [6] LIANG Y, CAO X D, ZHAO L, et al. Phosphorus release from dairy manure, the manure-derived biochar, and their amended soil: effects of phosphorus nature and soil property[J]. Journal of Environmental Quality, 2014, 43: 1504-1509. doi: 10.2134/jeq2014.01.0021 [7] JIANG Y B, REN C, GUO H Y, et al. Speciation transformation of phosphorus in poultry litter during pyrolysis: insights from X-ray diffraction, fourier transform infrared, and solid-state NMR spectroscopy[J]. Environmental Science and Technology, 2019, 53: 13841-13849. doi: 10.1021/acs.est.9b03261 [8] 李智伟, 王兴栋, 林景江, 等. 污泥生物炭制备过程中氮磷钾及重金属的迁移行为[J]. 环境工程学报, 2016, 10(3): 1392-1399. [9] DAI L C, LI H, TAN F R, et al. Biochar: a potential route for recycling of phosphorus in agricultural residues[J]. Global Change Biology Bioenergy, 2016, 8: 852-858. doi: 10.1111/gcbb.12365 [10] 王煌平, 张青, 章赞德, 等. 不同热解温度限氧制备的畜禽粪便生物炭养分特征[J]. 农业工程学报, 2018, 34(20): 233-239. doi: 10.11975/j.issn.1002-6819.2018.20.030 [11] 王立华, 林琦. 热解温度对畜禽粪便制备的生物质炭性质的影响[J]. 浙江大学学报(理学版), 2014, 41(2): 185-190. [12] XU G, ZHANG Y, SHAO H B, et al. Pyrolysis temperature affects phosphorus transformation in biochar: chemical fractionation and (31)P NMR analysis[J]. Science of the Total Environment, 2016, 569-570: 65-72. doi: 10.1016/j.scitotenv.2016.06.081 [13] QIAN T T, JIANG H. Migration of phosphorus in sewage sludge during different thermal treatment processes[J]. ACS Sustainable Chemistry and Engineering, 2014, 2: 1411-1419. doi: 10.1021/sc400476j [14] GHANIM B M, WITOLD K, LEAHY J J. Speciation of nutrients in hydrochar produced from hydrothermal carbonization of poultry litter under different treatment conditions[J]. ACS Sustainable Chemistry and Engineering, 2018, 6: 11265-11272. doi: 10.1021/acssuschemeng.7b04768 [15] LI Z G, GU C M, ZHANG R H, et al. The benefic effect induced by biochar on soil erosion and nutrient loss of slopping land under natural rainfall conditions in central China[J]. Agricultural Water Management, 2017, 185: 145-150. doi: 10.1016/j.agwat.2017.02.018 [16] 刘玉学, 吕豪豪, 石岩, 等. 生物质炭对土壤养分淋溶的影响及潜在机理研究进展[J]. 应用生态学报, 2015, 26(1): 304-310. [17] HOSSEINI S H, LIANG X Q, NIYUNGEKO C, et al. Effect of sheep manure-derived biochar on colloidal phosphorus release in soils from various land uses[J]. Environmental Science and Pollution Research, 2019, 26: 36367-36379. doi: 10.1007/s11356-019-06762-y [18] LU Y Y, SILVEIRA M L, O'CONNOR G A, et al. Biochar impacts on nutrient dynamics in a subtropical grassland soil: 1. Nitrogen and phosphorus leaching[J]. Journal of Environmental Quality, 2020, 49: 1408-1420. doi: 10.1002/jeq2.20139 [19] 王忠江, 张正, 刘卓, 等. 生物炭配施沼液对淋溶状态下土壤养分的影响[J]. 农业机械学报, 2018, 49(11): 260-267. doi: 10.6041/j.issn.1000-1298.2018.11.030 [20] 中华人民共和国国家质量技术监督局, 中国国家标准化管理委员会. 木质活性炭试验方法pH值的测定: GB/T 12496.7-1999[S]. 北京: 中国标准出版社, 1999 [21] 中华人民共和国国家林业局, 中国国家标准化管理委员会. 活性炭水萃取电导率测定方法: LY/T 1616-2004[S]. 北京: 中国标准出版社, 2004 [22] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 168-169 [23] 中华人民共和国国家环境保护局, 中国国家标准化管理委员会. 水质 总磷的测定 钼酸铵分光光度法: GB/T 11893-1989[S]. 北京: 中国标准出版社, 1989 [24] ZUO L Q, LIN R P, SHI Q, et al. Evaluation of the bioavailability of heavy metals and phosphorus in biochar derived from manure and manure digestate[J]. Water, Air, and Soil Pollution, 2020, 231: 553. doi: 10.1007/s11270-020-04924-0 [25] UCHIMIYA M, HIRADATE S. Pyrolysis temperature-dependent changes in dissolved phosphorus speciation of plant and manure biochars[J]. Journal of Agricultural and Food Chemistry, 2014, 62: 1802-1809. doi: 10.1021/jf4053385 [26] LIANG X Q, JIN Y, HE M M, et al. Phosphorus speciation and release kinetics of swine manure biochar under various pyrolysis temperatures[J]. Environmental Science and Pollution Research, 2018, 25: 25780-25788. doi: 10.1007/s11356-017-0640-8 [27] HOSSAIN M Z, BAHAR M M, SARKAR B, et al. Biochar and its importance on nutrient dynamics in soil and plant[J]. Biochar, 2020, 2: 379-420. doi: 10.1007/s42773-020-00065-z [28] 邱良祝, 朱脩玥, 马彪, 等. 生物质炭热解炭化条件及其性质的文献分析[J]. 植物营养与肥料学报, 2017, 23(6): 1622-1630. doi: 10.11674/zwyf.17031 [29] 尚斌, 董红敏, 朱志平, 等. 畜禽粪便热解气体的红外光谱分析[J]. 农业工程学报, 2010, 26(4): 259-263. doi: 10.3969/j.issn.1002-6819.2010.04.044 [30] WEBER K, QUICKER P. Properties of biochar[J]. Fuel, 2018, 217: 240-261. doi: 10.1016/j.fuel.2017.12.054 [31] 单瑞峰, 宋俊瑶, 邓若男, 等. 不同类型生物炭理化特性及其对土壤持水性的影响[J]. 水土保持通报, 2017, 37(5): 63-68. [32] 周强, 黄代宽, 余浪, 等. 热解温度和时间对生物炭pH的影响[J]. 地球环境学报, 2015, 6(3): 195-200. doi: 10.7515/JEE201503008 [33] YUAN J H, XU R K, ZHANG H. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 2011, 102: 3488-3497. doi: 10.1016/j.biortech.2010.11.018 [34] 袁金华, 徐仁扣. 生物质炭对酸性土壤改良作用的研究进展[J]. 土壤, 2012, 44(4): 541-547. doi: 10.3969/j.issn.0253-9829.2012.04.003 [35] GONDE K, MIERZWA-HERSZTEK M, KOPEĆ M, et al. Influence of biochar application on reduced acidification of sandy soil, increased cation exchange capacity, and the content of available forms of K, Mg, and P[J]. Polish Journal of Environmental Studies, 2019, 28(1): 103-111. [36] CH'NG H Y, AHMED O H, MAJID N M A. Improving phosphorus availability, nutrient uptake and dry matter production of Zea Mays L. on a tropical acid soil using poultry manure biochar and pineapple leaves compost[J]. Experimental Agriculture, 2016, 52(3): 447-465. doi: 10.1017/S0014479715000204 [37] 孙桂芳, 金继运, 石元亮. 土壤磷素形态及其生物有效性研究进展[J]. 中国土壤与肥料, 2011, 2: 1-9. doi: 10.3969/j.issn.1673-6257.2011.01.001 [38] SHARPLEY A, MOYER B. Phosphorus forms in manure and compost and their release during simulated rainfall[J]. Journal of Environmental Quality, 2000, 29: 1462-1469. [39] CANTRELL K B, HUNT P G, UCHIMIYA M, et al. Impact of pyrolysis temperature and manure source on physicochemical characteristics of biochar[J]. Bioresource Technology, 2012, 107: 419-428. doi: 10.1016/j.biortech.2011.11.084 [40] NEGASSA W, LEINWEBER P. How does the Hedley sequential phosphorus fractionation reflect impacts of land use and management on soil phosphorus: a review[J]. Journal of Plant Nutrition and Soil Science, 2009, 172: 305-325. doi: 10.1002/jpln.200800223 [41] YANG L, WU Y, WANG Y, et al. Effects of biochar addition on the abundance, speciation, availability, and leaching loss of soil phosphorus[J]. Science of the Total Environment, 2021, 758: 143657. doi: 10.1016/j.scitotenv.2020.143657 [42] JOSEPH S D, CAMPS-ARBESTAIN M, LIN Y, et al. An investigation into the reactions of biochar in soil[J]. Australian Journal of Soil Research, 2010, 48(6/7): 501-515. [43] NOVAK J M, JOHNSON M G, SPOKAS K A. Concentration and release of phosphorus and potassium from lignocellulosic- and manure-based biochars for fertilizer reuse[J]. Frontiers in Sustainable Food Systems, 2018, 2: 54. doi: 10.3389/fsufs.2018.00054 [44] SUN K, QIU M Y, HAN L F, et al. Speciation of phosphorus in plant- and manure-derived biochars and its dissolution under various aqueous conditions[J]. Science of the Total Environment, 2018, 634: 1300-1307. doi: 10.1016/j.scitotenv.2018.04.099 [45] MIN X, WU J, GANG Y, et al. Biochar addition to soil highly increases P retention and decreases the risk of phosphate contamination of waters[J]. Environmental Chemistry Letters, 2019, 17: 533-541. doi: 10.1007/s10311-018-0802-z -





 DownLoad:
DownLoad: