-
剩余污泥是污水生物处理的主要副产物,其产生量约为所处理COD总量的0.4~0.5倍,即降解1 kg COD可合成0.4~0.5 kg剩余污泥,产量巨大。根据2017年数据,我国城市剩余污泥产量已达2.95×107 t[1]。剩余污泥成分复杂[2],如未妥善处理处置将严重影响生态环境。传统剩余污泥处理处置方法(如焚烧、填埋等末端治理方法)不仅耗资巨大(占污水处理厂运行费用的25%~60%)[3],还面临一系列政策、环境和技术问题。因此,解决污泥问题的关键不仅应优化并发展剩余污泥处理处置技术(末端处理),还应结合污泥原位减量工艺(过程处理)对其进行综合整治。
污泥原位减量工艺是在保证出水达标前提下,促进微生物降解有机物产能用于热逸散,而非增殖的一种污水处理技术[4]。国内外学者对此进行了广泛的尝试,并取得了一系列有意义的成果。如:基于能量解耦联理论的OSA系列工艺[5-6];基于内源衰减及程序化死亡机理的低F/M(基质/微生物)及长SRT(污泥龄)系列工艺[7-8];基于溶胞-隐性增长原理的污泥化学/物理/生物原位破解系列工艺等[9-10]。这类工艺的作用机制、内部驱动力各异,但其处理方式均是通过内嵌物化法、机械法和生物法等影响微生物新陈代谢过程,进而降低剩余污泥表观产率。已有学者[11-12]详细报道了物化法、机械法和生物法及基于这3种方法的工程/技术工艺,但并未系统归纳污泥原位减量技术的运行机理及内部驱动机制。本文以微生物新陈代谢途径为主线,分析了减量技术对微生物生长过程、衰减过程及水解过程的干涉及影响,探讨了污泥原位减量技术的驱动原理,归纳了减量技术的不足及其对污水处理的影响,展望了污泥原位减量技术的应用前景,以期为科学构建并改良低污泥产率污水生物处理技术提供参考。
全文HTML
-
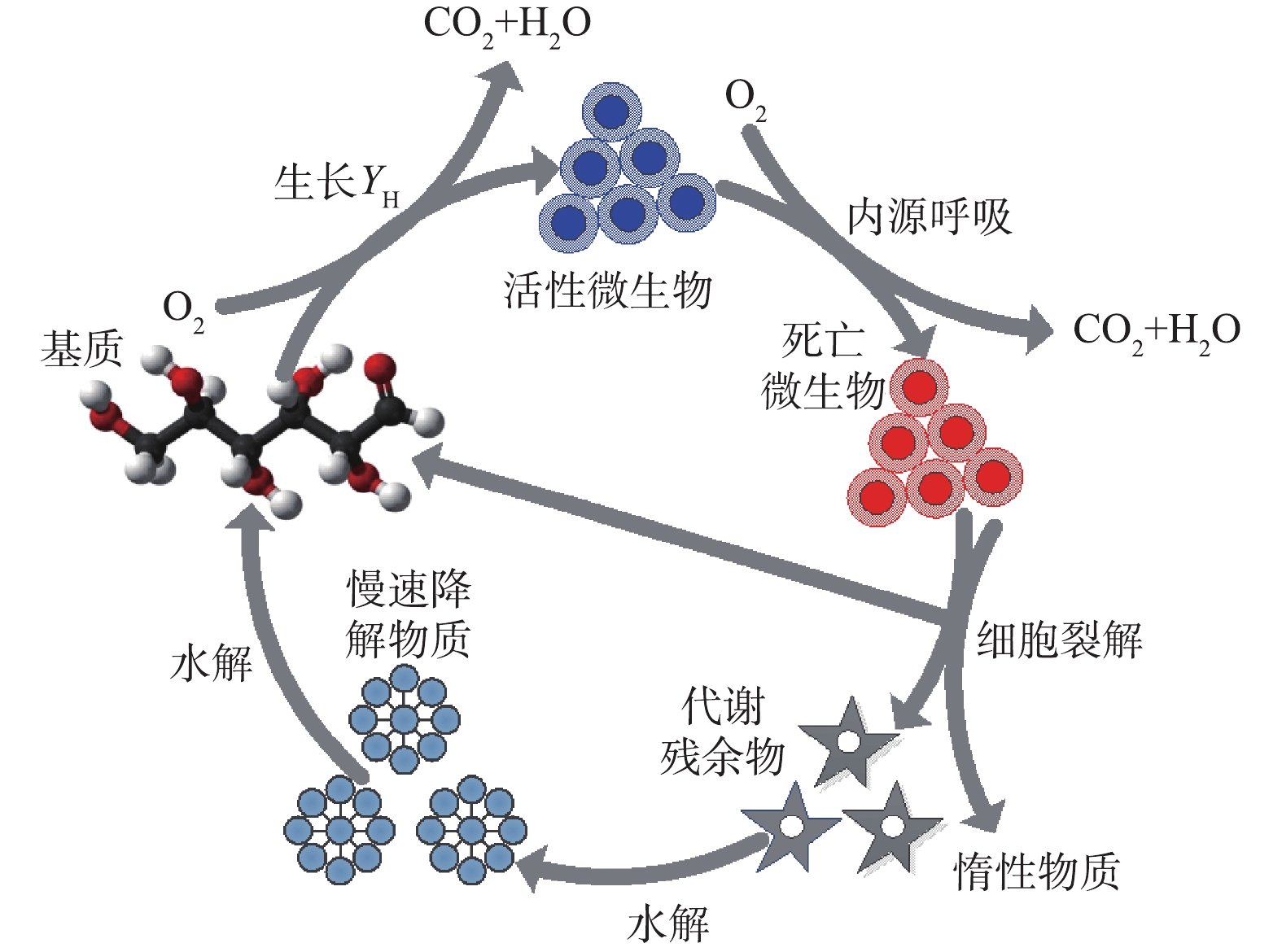
剩余污泥是包含好氧异养菌、兼性异养菌、厌氧异养菌、好氧自养菌、兼性自养菌及厌氧自养菌等的生物絮凝体。细菌在胞外酶作用下以环境中的底物为基质,通过完整或不完整的三羧酸,循环转移电子至末端电子受体(氧气、氧化物及部分有机物等,所获能量多寡与电子供体与受体间的电位差直接相关),并获取能量;所获能量耦联生物增殖,增殖效率与能量利用率相关;当基质不足时,部分细胞会在群感效应控制下,进入程序化死亡,释放胞内物质,并被其他细胞利用而重复上述过程[4],污泥增殖代谢过程见图1,此过程的计算可用式(1)表达。表1反映了微生物新陈代谢3个过程(微生物的增殖、微生物的死亡、污泥水解)及污泥减量技术的干涉方法和驱动机制。
式中:F为污泥表观生长率;R为污泥生长率(真实产率);Q为维持能消耗率;D为细胞死亡率;H为水解率;G为隐性生长率。
因此,促进有机物向呼吸产物转化、减少代谢过程的生物产量包括3种途径:须促进分解代谢并降低合成代谢,从而限制生物质的合成;须增加生物维持能需求,减少生物生长耗能;须诱导细胞裂解及隐性生长,降低污泥表观产量。
-
生长意味着生物聚集体(污泥)总量的提高。即细菌以底物为基质,通过异化作用获取能量,并用于自身增殖。微生物增殖与异化作用中的电子平衡、ATP平衡及能量平衡等直接相关,最终电子受体的电位差、电子传递与磷酸化反应的耦联效率及能量释放方式等均会对微生物生长带来显著影响。
-
微生物通过完整或不完整的三羧酸循环转移电子至末端电子受体(氧气、氧化物及部分有机物)并获取能量,所获能量多寡与电子供体与受体间的电势差直接相关。基于电势差异,最终电子受体可划分为O2类、
NO−x 类及有机物3类,其对应产能方式为有氧呼吸、缺氧呼吸及发酵3种类型,各类型消耗单位电子供体产能及微生物产率差异明显。有氧呼吸一般以O2为最终电子受体,对电子供体利用率极高[13]。以葡萄糖为例,1 mol葡萄糖被O2完全氧化,可获得6 mol CO2和12 mol H2O,并产生 38 mol ATP,约1 161 kJ能量。国际水协会(International Water Association,IWA)给出的有氧异养菌产率系数为0.67(ASM1)[14]。
缺氧呼吸是氧限制或缺乏状态下的一种代谢类型,最终电子受体为
NO−3 、NO−2 、SO−4 及S2O−等无机物,或延胡索酸等有机物[15],其氧化还原电势各异,但均较O2弱,理论产能低于有氧呼吸。以葡萄糖为例,1 mol葡萄糖被NO−3 完全氧化可获得26 mol ATP,约794 kJ能量。IWA并未给出缺氧异养菌产率系数,但有较多研究者对此进行了系统研究。ORHON等[16]结合已有研究[17-19]的观点,通过生物能量原理估算了缺氧与有氧产率的比值。在底物分别为市政废水、蛋白质、乳酸盐和碳水化合物时,其比值分别为0.79、0.80、0.80和0.85。KUBA等[20]发现,聚磷菌(phosphorus accumulating organisms, PAO)在缺氧与有氧环境下的产率之比为0.74,这与ORHON等[16]的理论值相当接近。SPERANDIO等[21]基于二氧化碳释放速率,量化了微生物的有氧和缺氧产量,发现以醋酸盐为底物时,有氧产率为0.54 g·g−1 (以1 g COD产生的MLVSS计),缺氧产率为0.45 g·g−1。综上分析,相同条件下,缺氧呼吸微生物产率系数约等于有氧的0.7~0.8倍。发酵是缺乏电子受体的一种代谢类型,基本形式为乙醇发酵与乳酸发酵[22],不经三羧酸循环,故其产能较低[23]。以葡萄糖为例,1 mol葡萄糖通过乙醇发酵,可获得2 mol C2H6O和2 mol CO2,并产生2 mol ATP,约61 kJ能量。厌氧污泥产率系数一般为0.03~0.18 [24],远小于有氧污泥产率系数。IWA给出的厌氧异养菌产率系数为0.02~0.03(ASM1)[25]。
微生物增殖能耗源于分解代谢,代谢产能的降低势必导致微生物产率的下降。因此,相同条件下,缺氧或发酵呼吸产能明显低于有氧呼吸,微生物产率亦然。
-
在微生物的新陈代谢过程中,电子传递与磷酸化反应相耦联,即氧化电子供体过程伴随着ADP转化为ATP的磷酸化过程。MITCELL[26]认为,这一过程包括一系列电子载体传递链:电子随呼吸链下传并经电子传递链泵出质子,质子穿过线粒体内膜,形成跨线粒体内膜的H+梯度,H+经质子通道导回基质并将其化学能转移到ATP中,其中电子传递与ATP形成的关键因素为H+的跨膜梯度,但电子传递与磷酸化反应的耦联状态并不稳定,主要受H+的跨膜梯度影响。加入解耦联剂,改变初始底物浓度/初始微生物浓度比(S0/X0)并改变微生物营养/饥饿时序均会弱化H+的跨膜梯度,影响微生物能量耦联效应,产生解耦联现象。
解耦联剂可强化线粒体内膜对氢离子的通透性,促进H+的细胞膜扩散,消除膜两侧质子梯度,减少ATP合成量[27]。投加解耦联剂后,微生物正常氧化反应仍可顺利进行,但磷酸化与电子传递耦联关系减弱,能量生成减少,微生物同化作用降低。解耦联剂可分为质子型解耦联和离子通道型解耦联。离子通道型解耦联剂多为通道型蛋白[28],如缬氨霉素及短杆菌肽A等[29];质子型解耦联剂分子结构多属于亲脂类的弱酸[30-31],如2,4-二硝基苯酚 (dNP)、对硝基苯酚(pNP)、2,4-二氯苯酚(dCP)、3,3,4,5-四氯水杨酰苯胺(TCS)、2,4,5-三氯苯酚(TCP)、羰基氰化物对氯苯腙(FCCP)、四羟甲基硫酸(THPS)、甲酚、氨基酚等,被较多应用的是2,4,5-三氯苯酚(TCP)[32-34]。
初始底物浓度/初始微生物浓度比(S0/X0, COD/ MLSS)过高会导致微生物分解代谢与合成代谢速率脱节,能量过剩溢出,继而出现解耦联现象[35-36]。无效溢出能量Eu是S0/X0的系数,随S0/X0的增大而增大,其模型[37]见式(2)。
式中:Eu,max是最大能量逸出系数;K是产率相关饱和常数。由式(2)可以看出,随着S0/X0的增加,Eu亦随之增加;当S0/X0远大于K值时,Eu达到最大值[37]。主要原因包括4种:1)微生物快速积累能量而导致粒子(如质子、钾离子)在细胞膜两侧的传递削弱了跨膜电势,提高了氧化磷酸化解耦联发生的可能性;2)减少了生物体内部分新陈代谢途径(如甲基乙二酸途径),导致了糖酵解缺失[38];3)使维持能(细胞利用外部基质或体内肝糖、PHA所需的能量)增加[39-40];4)ATP酶在高浓度ATP状态下对ATP分解造成了无效质子循环,即生物能量产生速率可能高于微生物消耗速率[41]。但解耦联对S0/X0的要求为8~10,远高于污水的正常范围(0.01~0.13)[42],不适用于实际污水处理。
好氧-沉降-厌氧(oxic-settling-anaerobic, OSA)工艺是基于传统CASS工艺的改进型污泥原位减量技术[41]。CHUDOBA等[43-44]认为,OSA工艺污泥减量主要基于能量解耦联作用,即当微生物处于好氧营养环境时,其消耗底物,产生ATP;处于厌氧饥饿环境时,消耗ATP,这种ATP循环变化导致了分解代谢和合成代谢之间的解耦联。但CHEN等[45]认为,厌氧饥饿环境下污泥的高效衰减可能是OSA工艺污泥减量的主要原因,OSA工艺剩余污泥减少主要源于厌氧环境下污泥的水解或裂解[46]。除此之外,还有研究者[47]将OSA减量机理归咎为慢速生长菌种主导、EPS水解释放等。无论内部驱动如何,OSA减量工艺是一项实用、高效而绿色的工艺[48-49]。但OSA减量工艺的弊端在于,缺乏对剩余污泥最小化的内部驱动机制的认识,各类研究成果均可对某项驱动原理进行支撑,但更可能的是各种减量机制的同步发生,这就影响了理论对实际工艺的指导,限制了OSA工艺的推广利用。
-
维持能是微生物维持自身物质循环、离子梯度、蛋白质及核酸合成和物质转运等生化反应所需耗能[50],是微生物生命维持的固有需求,也是第一需求。维持能并不一定等同于内源呼吸产生的能量,内源呼吸是活性污泥的固有复杂反应。郝晓地等[51]将内源呼吸分为2个层次:1)胞外层次,包括高等生物对污泥的捕食行为及污泥微生物的隐性生长;2)胞内层次,即微生物保持其完整与活性的能量消耗(维持能)。PIRT[52-53]将维持能定义为产细胞外耗能,即非增殖消耗。因此,维持能消耗越多,细胞增殖能耗越少。而事实上,维持能消耗占比非常高,可达细胞产能的50%以上,故维持能在降低污泥产量方面具有重要作用[54]。
污泥龄对维持能的消耗占比有重要影响。污泥龄越长,污泥浓度越高,有机负荷率(OLR)越低,污泥维持能消耗越多,污泥表观产率越低。WUNDERLICH等[55]发现,污泥龄由3.7 d延长至8.7 d后,污泥表观产率由0.38减少到0.28。TECK等[56]发现,污泥龄由10 d延长至300 d后,系统F/M值由1.07降至0.185,污泥浓度由3.1 g L−1升至18.0 g L−1,污泥表观产率由0.24降至 0.024。LAERA等[57]通过研究无排泥MBR工艺发现,经180 d运行后,系统内污泥浓度增至16~18 g L−1,OLR(以COD计)低于0.1 g ·(g·d)−1(以VSS计),呼吸速率维持在2~3 mg·(g·h)−1(以VSS计),系统进入稳定期,并继续稳定运行150 d,实现污泥零排放。污泥龄是活性污泥法中最具操作性的参数,对于稳态系统,其与污泥表观增长率成反比,Yobs和污泥龄之间的关系[58]可用式(3)描述。
式中:Ymax为污泥真实产率;Kd为污泥衰减速率(负值);θc为污泥龄。
可以看出,随着污泥龄的延长,污泥表观产率会逐步降低。但长泥龄会导致污泥浓度升高,进而引起基质的传质、反应及污泥的沉降等问题。
维持能作为一种生命活动需求,正常条件下较为稳定,但会受无机盐影响。如氯化钠会显著改变酵母维持能、生长速率及产量等。这种改变的原因在于:在较高NaCl浓度下,胞外Na+可能通过被动运输或促进扩散进入生物体(不耗能),而微生物的保护机制会通过主动外迁,平衡胞内过量的Na+,从而消耗了更多能量[59],同时,这种机制还受胞内外盐度差及微生物耐受性的影响。WATSON[59]发现,在酿酒酵母(Saccharomyces cerevisiae)培养液中投加1 mol NaCl可以提高生物维持能,降低生物产率;STRACHAN等[60]发现,投加NaCl可以增加微生物的维持能需求,有效减少生物质的产量。但长期处于高盐条件,微生物耐盐性提高,活性污泥会逐步适应高盐环境,维持能消耗将回归常态[61]。
-
虽然部分重金属具有促进微生物生长的作用[62-63],但大部分重金属的存在可抑制或停止微生物的生长[64-67]。重金属对微生物的影响取决于其类型、形态、浓度和微生物种类[64-67]。此外,部分环境条件,如其他金属[62,68]、非金属离子[69]和有机物质[67]的存在以及pH的变化都会影响重金属毒性[62,70]。重金属对微生物的作用包括急性毒性反应和长期慢性毒性反应。重金属能结合生物膜引起不可逆的损害[42,71],或直接与DNA反应,影响微生物细胞的遗传物质[72]。重金属对微生物生长和底物降解产生影响的主要原因在于,在重金属胁迫下,微生物需要消耗更多维持能,以修复由重金属毒性导致的细胞损伤[73]。此外,细胞还必须使用替代酶途径来适应新的环境条件或平衡整个细胞膜的渗透需求,因此,随着重金属浓度的增加,用于微生物增殖的能耗会逐步降低。STASINAKIS等[74]发现,基质中Cr4+浓度≥10 mg·L−1时,污泥微生物会被明显抑制,并导致最大增长速率与产率的明显下降。CABRERO等[75]发现,随着基质中Cu2+浓度从1 mg·L−1增加至20 mg·L−1,污泥微生物最大生长速率和污泥产率分别从0.039 g·(L·h)−1和0.378 g·g−1下降至0.014 g·(L·h)−1和0.378 g·g−1。随着基质中Zn2+浓度从1 mg·L−1变化至20 mg·L−1,污泥微生物最大生长速率和污泥产率分别从0.047 g·(L·h)−1和0.378 g·g−1下降至0.032 g·(L·h)−1和0.333 g·g−1。李冰等[76]发现,随着基质中重金属离子含量的增加,污泥真实产率迅速降低,在Ni2+、Cr4+浓度为15 mg·L−1时,YH降低为0. 289和0. 218,相当于正常状态的75%和56%,并认为基质重金属浓度与微生物受抑制的程度成正比。重金属不但可以降低污泥的真实产量,且可以干扰微生物活性,增加污泥衰减速率,显著降低污泥表观产率。实际上,除处理部分工矿企业的富重金属废水外,重金属污泥减量很少被提及应用。这主要是因为重金属本身就是一种有毒有害污染物,对人体健康危害极大;同时抗重金属微生物属于基因导向型[77-78],长期处理富含重金属污水的微生物易被驯化,最终减量效果会降低甚至消失[79]。
2.1. 电子受体
2.2. 解耦联
2.3. 维持能
2.4. 重金属
-
微生物衰减是生物聚集体(污泥)总量的减少或生物体活性、功能的损失[80]。基于群体角度,微生物衰减是在极端环境下,如饥饿、有毒物质、渗透压、极端pH、负荷冲击等因素导致的污泥活性下降、功能丧失及生物体总量减少。而基于个体角度,微生物衰减是细菌发生应激适应而导致的微生物各项功能分化及衰退、休眠、死亡或程序化死亡(programmed cell death, PCD)。该过程主要包括程序性基因表达、蛋白质合成和水解、核糖体降解以及细胞体积显著减小等,其会因细菌种类不同而极具差异[81]。
IWA活性污泥模型(ASMX)分别从2条途径描述了污泥衰减:生长-衰减途径和死亡-再生途径。这2条途径分别从整体角度描述了污泥活性下降和个体角度描述了细菌死亡-水解-再生,均能较好地模拟活性污泥的衰减。但从污泥减量方面看,污泥衰减仅包含污泥死亡部分,而不包含污泥活性降低及休眠部分。
污泥衰减的主要原因是极端环境下细菌的应激反应。污泥减量工艺可以通过人为构造极端环境,干扰微生物的正常生殖,影响微生物衰减率。
-
在污水生物处理过程中,微生物生命周期通常由营养期(底物丰富阶段)和饥饿期(底物匮乏阶段)组成[82]。在营养期,微生物利用外源底物实现细胞生长、细胞维持和胞内外聚合物的合成;而转至饥饿期时,微生物为满足维持能需求,不断分解胞内外聚合物,此过程为微生物的生长抑制或负增长过程。虽然底物匮乏可引起微生物的生长抑制,但不一定会诱发微生物死亡。微生物死亡的主要原因是外源物质匮乏导致其生存环境恶劣,进而诱发群体效应,促使部分微生物程序性细胞死亡,并以此来维持种群的生存,为种群延续创造条件[83]。COHEN等[84]发现,大肠杆菌的胸腺嘧啶营养缺陷突变株在胸腺嘧啶饥饿时死亡,称为胸腺嘧啶缺乏死亡(thymine less death, TLD),这是首次观察到的由于营养匮乏而导致的细菌程序性死亡现象。饥饿可以诱发微生物的死亡,并提高污水生物处理过程的污泥衰减率。
-
噬菌体感染是调节污水生物处理系统微生物死亡的重要因素。噬菌体是污水生物处理系统中一类常见微生物[85],其在污水中的浓度约为4.2×107~3.0×109个·mL−1[86]。一般认为,污水生物处理过程中微生物死亡主要是由饥饿及噬菌体感染引起的细胞程序化死亡[83]。细菌被感染后,其凋亡相关基因可被病毒激活或被病毒基因表达控制,进而影响细胞凋亡的启动或抑制,而反过来通过程序化细胞死亡亦可抑制噬菌体的进一步传播[87-88]。
-
温度越高,微生物衰减速率越高。任杰等[89]研究表明,在4、20和30 ℃条件下,硝化菌衰减速率随温度的升高而增大,衰减指数由0.03提高至0.20。同时,微生物衰减速率对温度的敏感性亦不相同。SIEGRIST等[90]未发现缺氧环境温度降低(20~12 ℃)对活性污泥中硝化细菌的衰减有明显影响;而SLAZER [91]的研究表明,缺氧环境活性污泥中硝化细菌的衰减指数随温度的变化而下降,从0.2(30 ℃)下降至0.06(20 ℃);TOM等[92]也有类似的发现,在30~50 ℃条件下,活性污泥的衰减指数变化不明显,而待温度增高至60 ℃后,活性污泥的衰减指数忽然升高约25%。温度不仅可以影响污泥衰减速率,同时对微生物的维持能也有较大作用。根据TIJHUIS等[93]提出的基于热力学的细菌维持能量计算方法,温度对维持能量有较大的影响,PAOs维持能随温度的升高而增加[94]。这说明随着温度的升高,维持能亦增加,微生物可能更易进入饥饿状态,进而诱导微生物的程序化死亡,导致微生物衰减加快。
-
辐射可损害微生物新陈代谢过程,破坏DNA双螺旋结构,断裂氢键,同时干扰蛋白,诱导蛋白变性,最终影响微生物的生命过程,导致其死亡。辐射技术应用于污泥领域是近年来才出现的新热点。该技术可以提高污泥衰减效率,灭活污泥中的病原体,氧化有机污染物,增强难溶性物质的可溶性并对酶活造成一定影响[95]。KIM等[96]采用γ-射线辐照活性污泥,发现经一段时间的辐射后,活性污泥絮体被打破,蛋白质及碳水化合物等从絮体中释放出来,从而提高了酶与底物的有效接触率,蛋白质及碳水化合物等的释放率。CHU等[97]发现,经γ-射线辐照后,污泥出现液化现象,并有蛋白质、多糖和胞外酶等的释放,其作用与超声波类似,但活性测试后发现,蛋白酶、超氧化物歧化酶和过氧化氢在辐射过程出现了轻微失活。
辐射包括阳光辐射、β-射线辐射和微波辐射,这几种辐射均能对微生物的衰减造成一定影响,通过调整辐射剂量能够降低污泥表观产率。
-
微生物衰减易受极端环境影响,因此,通过投加化学基质改变微生物生存环境既可以明显提高微生物衰减率(如投加强氧化剂如O3及Cl2、进行热处理和高压分解、施加超声破碎等),又可以通过暴力手段强行破坏微生物细胞壁、细胞膜,使其构成成分受损而导致新陈代谢障碍,进而干扰膜内脂蛋白和脂多糖,改变细胞通透性,导致细胞溶解、死亡。此外,通过极端环境还可以液化污泥中不容易水解的大分子物质[3,35, 97-100],可大幅提高回流污泥的可生化性。
-
不同微生物对环境压力的抗性不同,其存活时间亦各异。通常,存活时间顺序为真菌抗性>细菌抗性>病毒抗性;而从细菌来说,存活时间顺序为革兰氏阳性菌抗性>革兰氏阴性菌抗性。从单一物种来说,不同株的微生物抗性亦不尽相同。活性污泥中的5类主要微生物包括硝化细菌(包括氨氮氧化细菌AOB和亚硝酸氮氧化细菌NOB)、聚磷菌(PAOs)、聚糖原菌(GAOs)以及常规异养菌(OHOs)[78]。聚磷菌(PAOs)和聚糖原菌(GAOs)具有胞内PHA,能在饥饿状态下分解并提供能量,维持细胞正常生存,其衰减速率较低,7 d 平均衰减速率为 0.11 d−1,且呈线性衰减[101];硝化细菌(AOB和NOB)不具有饥饿阶段可提供能量的胞内聚合物,其衰减速率均较高。但BOLLMANN等[102]指出,AOB的核糖体在饥饿环境中能够维持有机体征的一般功能,并具有独特的生理机制来应付营养物质短缺的饥饿期,使细胞长期处于一种预备的状态,不进行细胞分化等行为,因此,AOB的好氧衰减速率(0.144±0.008) d−1要明显低于 NOB的好氧衰减速率(0.306±0.026) d−1。
3.1. 饥饿环境下微生物的衰减及死亡
3.2. 噬菌体感染导致微生物死亡
3.3. 温度升高加剧微生物衰减
3.4. 辐射导致的微生物衰减及死亡
3.5. 极端环境影响微生物衰减
3.6. 微生物抗性在微生物衰减过程中的作用
-
活性污泥主要由活性微生物、活性微生物表面胞外聚合物(EPS)、吸附在EPS上的微生物氧化残余物及吸附在活性污泥表面尚未降解或难以降解的有机物和无机物等4部分组成,其有机物含量为60%~70%[103]。基于物质与能量平衡分析,当活性微生物以其自身为底物进行新陈代谢时,部分有机物随着微生物的生长循环以二氧化碳的形式进入到大气,总碳含量降低,污泥产量减少,这种微生物靠自身为底物的生长方式称为隐性生长。
隐性生长包含2个阶段:第1阶段为污泥絮体的分解,即在胞外水解酶的作用下,释放胞内物质(主要为蛋白质、脂肪和碳水化合物等),溶解挥发性悬浮固体(VSS);第2阶段为活性微生物进行生长及增殖。其中污泥絮体分解属于速率限制阶段,其很大程度上取决于水解酶活性。水解酶主要是混合菌群产生的包括蛋白酶、淀粉酶、脂肪酶等在内的复合酶,是污泥絮体解聚、氧化和水解过程的首要作用者,也是大分子有机质降解及转化的第1步。通过酶活作用,污泥中难溶性大分子有机物会先后被分解为小分子物质及生物易降解成分,如蛋白质可以被转化为多肽、二肽、氨基酸等,淀粉可以被水解为葡萄糖等。但酶主要位于细胞膜表面及EPS内,而EPS对酶的包埋作用降低了酶与底物的接触程度,因此,自然状态下污泥水解效率较低。已有学者[103]对强化污泥水解的预处理技术进行了广泛研究。
EPS对酶的包埋导致污泥自身水解效率不足,因此,可通过2种方式强化污泥水解:1)打破污泥絮体,释放胞外酶,强化污泥水解;2)直接溶解污泥絮体及细胞,释放胞内物质等,其主要通过物理、化学或生物方法将絮体或细胞破坏,使内容物流出。物理方法主要包括超声波、辐射、热处理、微波等方法;化学方法主要包括臭氧法、氯气法和酸碱法等;生物方法主要通过投加能分泌胞外酶的细菌或者生物酶制剂实现。
-
通过干涉污泥中微生物新陈代谢过程,实现污泥原位减量的理论主要有4种:解耦联代谢(抑制污泥生长)、维持代谢(抑制污泥生长,强化污泥衰减)、溶胞-隐性生长(污泥衰减及水解)和生物捕食。这些工艺的效率及效果各异,但均会对污水处理过程造成一定的影响(表2)。投加解耦联剂抑制污泥生长,无需改变工艺系统,是实现污泥减量最为方便的形式,但仍存在较多问题,最典型的是污染物去除率下降和工艺稳定性降低。通过高S0/X0比值和OSA工艺实现非化学辅助性解耦联是污泥减量工艺中较为安全的形式,但高S0/X0比值导致生物处理工艺的适用条件苛刻,且出水尚需后续处理,同时高S0有机废水也面临其他工艺的竞争,如厌氧处理;OSA工艺及其变种工艺在国内外已有了广泛研究,但其减量机制众说纷纭,尚无定论,难以基于现有理论指导实际工程。通过改变工艺电子受体(如好氧呼吸变为缺氧或厌氧),影响微生物正常三羧酸循环,降低污泥产率也是一种安全节能的污泥原位减量形式,但缺氧工艺对进水中溶解性硝酸盐、硫酸盐等电子受体的浓度有所要求,而厌氧工艺出水有机物浓度较高,还需进行后续处理,应用限制较多。通过延长SRT,提高污泥内源呼吸总量,可有效降低污泥产率,同时较长的SRT能提高污泥微生物浓度及种类,延长食物链长度,可进一步提高污染物的去除率,但会引发较多问题,如污泥膨胀、除磷效果差等。通过各种物理(微波、热等)、化学(臭氧、ClO2、NaOH、O3、Fenton等)或生物(溶菌酶)方式破解污泥,进而提高污泥溶胞-隐性生长速率是较为常见的污泥原位减量工艺,其减量率高,启动速度快,应用方便,但须专设单元提供污泥破解空间,同时污泥(C5H7O2NP0.1)破解后,营养盐类会溶出,提高了工艺污染去除负荷,对工艺污染物去除效果有一定影响。
-
采取加入解耦联剂或改变工艺参数的方式,减少微生物真实产率,是目前实现污泥原位减量的有效途径。但化学解耦联剂成本高昂且难以降解,若应用不当会影响污水生物处理工艺的出水水质;投加解耦联剂会导致部分微生物死亡,影响微生物活性,并释放出胞内物质,影响出水COD、氮及磷的浓度;同时,投加解耦联剂会影响活性污泥工艺内的原有种群分布,进而影响污泥特性,导致脱水及沉降性能发生变化。高S0/X0污泥减量技术对S0/X0的要求过高(8~10),正常污水处理厂难以满足,不适于实际污水处理;缺氧污泥产量低,仅相当于有氧污泥产率的70%~80%,但局限性较大,很难构造适宜的环境,难以应用于实际污水处理。厌氧污泥产率极低,仅相当于有氧污泥产率的10%,但厌氧工艺难以处理低浓度有机污水,还有诸多局限性。重金属可以降低污泥的真实产量,但重金属本身就是一种严重的污染物,对人体健康危害极大,同时抗重金属微生物属于基因导向型,长期处理富重金属污水的微生物易被驯化,减量效果最终会降低甚至消失。
-
维持代谢在降低污泥产量方面具有重要作用。投加氯化钠能够加强微生物代谢效率,显著降低污泥表观产率,但其成本高,同时易被驯化,不适宜推广应用。污泥龄是活性污泥法中最具操作性的参数,通过提高污泥龄降低污泥表观增长率是一种行之有效的快捷原位减量方法。但提高污泥龄会导致污泥浓度升高,进而引起基质的传质问题、反应问题、污泥沉降问题及能耗提高问题等。
-
通过物理或化学方法破解回流污泥可以促进污泥衰亡并提高污泥水解程度,进而强化隐性生长型污泥减量,但同样会影响活性污泥对污染物的去除效果,并导致污泥沉降性能下降及运行成本提升。
物理方式处理回流污泥的方法主要有超声波、热处理、微波等。其主要缺点包括:死亡细胞胞内物质溢出,导致N、P去除率下降;同时需要增设回流污泥处理装置,增加基建费用和能耗。
化学方式处理回流污泥的方法主要包括臭氧氧化法、氯气溶胞法和酸碱溶胞法等。臭氧氧化法能达到污泥的零排放,但易造成污泥中P和重金属元素的富集[114];同时,溶胞剂多为非选择性氧化剂,它将活性污泥氧化的同时还将其他还原性物质氧化,降低了活性污泥的处理效率;而氯气或氯代物等强氧化剂还会在处理过程中产生危害性副产物,影响微生物代谢,污染出水[115];酸和碱可以有效抑制细胞活性,但其投加又可能给设备安全带来隐患。总的来说,化学溶胞可能会导致高危副产物产生,并弱化系统的脱氮除磷能力,影响污泥特性,给设备造成安全隐患。
生物处理污泥的方法主要是通过投加胞外酶分泌细菌或生物酶制剂,但长期投加外源菌种或生物制剂可能会改变系统的原始菌群,并造成系统对投加药(菌)剂的依赖。可见,虽然污泥原位减量技术可以有效缓解剩余污泥问题,但同时也会给污水生物处理带来一定的影响。张自杰等[116]认为,大多数污泥减量技术均在污染物去除方面存在一定缺陷,最为突出的弊端之一在于除磷方面的不足。表3总结了活性污泥在生长过程、衰亡过程及水解过程中的原位减量方法及优劣评价,这些方法的共同点是促进总有机碳的代谢,通过呼吸作用强化矿化作用。但这些方法各有利弊:解耦联技术高效、成本低廉,但易诱发新的环境问题;OSA工艺存在成本较高,污泥失稳的现象;高S0/X0等工艺的限制性因素太多,很难成为主流的减量技术;重金属污泥减量只适宜于某些出水富含重金属的工矿企业,同时还要注意污泥的适应性问题及后处理问题,否则会对环境造成巨大的危害;高污泥浓度MBR技术目前已成功地应用于实践中,其出水水质好,剩余污泥少,但膜污染压力大;低F/M又很可能会引起污泥膨胀、成本增加等问题;厌(缺)氧代谢是一种同时降低曝气成本及生物产量的处理工艺,但存在代谢效率低、温度要求高、稳定性差等问题。污泥微生物的可控衰亡是降低污泥产率的有效方法,但研究较少,一般来说,衰亡的主要原因是衰老、饥饿及病毒。污泥水解是污泥隐性生长的速率控制阶段,通过物理、化学或生物手段可有效加快这一进程,但此类方法成本高,存在氮磷溶出及形成新型污染的隐患,且在某些时候会出现污泥被驯化等问题。
5.1. 减量工艺
5.2. 干涉污泥生长过程-减量工艺的不足
5.3. 干涉污泥维持代谢-减量工艺的不足
5.4. 干涉污泥溶胞-隐性生长-减量工艺的不足
-
1)综上所述,通过影响微生物新陈代谢的3个过程,污泥原位减量技术降低了污泥表观产率及污泥产量,是当前环保形势下解决污泥问题的另一有效途径。但不可否认的是,污泥原位减量技术会给污水生物处理带来一定的影响。因此,污泥原位减量工艺应综合考虑环境影响、处理效果和成本效益等因素并对其进行综合分析。污泥原位减量工艺对环境的影响,主要为气味散发和N、P等的二次释放,同时也要考虑加入化学解耦联剂或其他药品可能导致的环境危害;处理效果主要是指因污泥减量工艺导致污水处理工艺出水水质恶化等,这同样会对生态环境造成一定的危害;成本效益分析主要是对剩余污泥减量造成的成本提高、降低剩余污泥处理处置量带来的经济效益进行分析。剩余污泥原位减量工艺的可行性应在不造成环境影响、不降低现有污水工艺污染物去除率的基础上,由降低剩余污泥量削减的处置成本所抵消的额外污泥减量造成的成本提高所决定,因此,其最佳方案是将工艺具体到每一个独立过程,并应用适宜的方法或参数加以控制。
2)在活性污泥的主体-微生物新陈代谢的3个阶段中,生长阶段受影响较大,控制及干涉方法较多。虽然各控制方式的适应范围有限,但其可作为污泥原位减量的一个突破点,应深入研究干涉污泥生长过程的减量工艺,如OSA及其拓展工艺的微生物代谢途径,物质转化规律,以量化各机制对减量工艺的贡献率,明晰其减量内部驱动和关键节点,更好地指导实际工程。同时,目前对污泥的死亡-尤其是程序化死亡的研究还较少,但通过有限病毒、群体感应或有限饥饿适度控制微生物的程序化死亡,在降低污泥产量的同时不影响整体功能性,应是今后的一个研究重点。污泥水解(强化)-隐性生长是当前污泥原位减量技术中最具有工程意义的研究,其对减量率有极强的可控性,但同时也存在基建成本高、运行成本高、长期运行污染物去除效果下降等弊端。
3)污泥减量工艺的选择还应考虑后续污泥处置处理工艺。自2011年《城镇污水处理厂污泥处理处置技术指南》颁布后,污泥处置方式发生明显变化,土地利用、焚烧、填埋等不再是污泥处置的主要方案。农业利用、厌氧消化、燃烧、共燃烧、湿式氧化、热解及气化等成为污泥处置领域的新热点,因此,污泥减量工艺的选择应能较好地映射后续污泥处理处置工艺。如污泥中含有大量有机物及氮、磷等营养盐,通过厌氧消化产甲烷可以将一部分有机物能量以甲烷的形式进行再利用,而氮、磷等营养盐可以通过鸟粪石的形式回收,这就要求减量工艺应尽量减少对产甲烷菌有影响的化学药品的使用量,并提高生物除磷效果,更好地配合后续污泥处理处置工艺。污泥土地利用对污泥的质量要求较高,应尽量避免具有生物富集性的元素通过食物链进入人体。
4)现存污泥原位减量技术种类繁多,特点各异,性能、成本及环境生态效果也有所不同,但其技术选择取决于它们的优缺点。从可持续发展角度来看,现有污泥原位减量技术尚有较多不足,如何能在保证当前污水处理效果的基础上,尽量多地降低剩余污泥产量,并彻底明晰污泥原位减量工艺中内部驱动机制,依然是污泥减量工艺须进行长期探讨并进行研究的重要问题。





 下载:
下载: