-
随着各类化学物质的大量生产和使用,内分泌干扰物、全氟化合物和抗生素等新近发现或引起关注的新污染物在环境中的检出频率不断增加[1 − 3]. 由于这些物质具备抗降解性、生物积累能力以及潜在的神经毒性、生殖毒性等,即便在较低浓度下亦可能对生态系统及人类健康造成不利影响[4]. 为此,党中央、国务院高度重视其治理工作,正在建立新污染物环境调查监测体系和管理信息系统,进行化学物质调查,掌握其在环境中的赋存情况[5,6]. 目前全球在新污染物的定性定量检测方面面临着巨大的挑战,主要体现在以下几个方面:(1)标准化问题:针对新污染物的检测标准和方法尚未完全建立,限制了相关检测技术的普及与应用[7,8];(2)复杂的物化性质:新污染物在使用和环境中展现出多样化和变化的物理化学特性,增加了检测难度[9];(3)检测技术的开发:为了实现对环境中新污染物的精准识别与量化,亟需建立全面且高效的检测和分析方法. 在此过程中,考虑到环境基质的复杂性,提高前处理效率变得至关重要[10]. 因此迫切需要开发损失少、适用性广且高效的方法,以实现新污染物的超灵敏测定.
新污染物通常存在于复杂的基质中,易与多种环境成分相互作用,直接使用分析仪器对其进行检测可能会出现干扰结果[11]. 此外,相较于重金属和挥发性有机化合物,新污染物结构复杂、来源广泛且浓度低,传统方法难以直接实现其准确定量,主要受限于分析仪器的灵敏度. 因此,在对新污染物进行仪器分析前,样品前处理技术显得尤为重要.
样品前处理技术是提高检测可靠性的关键步骤,能够有效地去除样品基质并浓缩目标组分,以提高分析方法的灵敏度. 目前,对新污染物的前处理技术主要以液相萃取(LLE)和固相萃取(SPE)为基础. LLE利用两种不相混溶的液体之间的分配系数差异实现不同物质的分离和富集,但需要消耗大量有机溶剂,对环境产生一定的负面影响[12]. 相对而言,SPE通过固体吸附剂完成选择性吸附后,仅需较少的有机溶剂即可完成洗脱,不仅减少了基质干扰,还提高了分析方法的灵敏度[13]. 然而SPE的萃取过程繁琐且样品需求量大,也限制了其发展.
固相微萃取(SPME)是基于SPE原理的微型化且环境友好的绿色化样品前处理技术,已广泛应用于食品、环境和生物分析,能够一步完成采样、样品净化、分离和富集等步骤,对气体、液体和固体等复杂介质中的目标分析物进行高效、快速萃取[14]. 自20世纪90年代由Janusz Pawliszyn课题组首次提出以来[15],SPME不断发展,不仅引入不同类型的多孔材料作为萃取涂层,还衍生出多种萃取装置,成功与液相色谱-质谱(HPLC-MS)、气相色谱-质谱(GC-MS)、拉曼光谱等分析仪器相结合,在处理复杂样品并萃取新污染物方面具有潜在的应用优势.
本文综述了近年来SPME技术在涂层材料和萃取装置方面的进步,并介绍了SPME技术在新污染物萃取领域的进展,期望为SPME技术推动新污染物的高灵敏准确检测提供思路.
-
SPME技术的工作原理是将涂有适量固相涂层的萃取相暴露于样品基质中,分析物通过界面层扩散到萃取相,直至趋近萃取平衡. 这一过程主要依赖于氢键、π–π堆积、静电作用力等特定的物理化学相互作用,从而实现有效富集. 随后再在一定条件下(改变温度、溶剂)将目标组分解吸并进入仪器进行定性和定量分析.
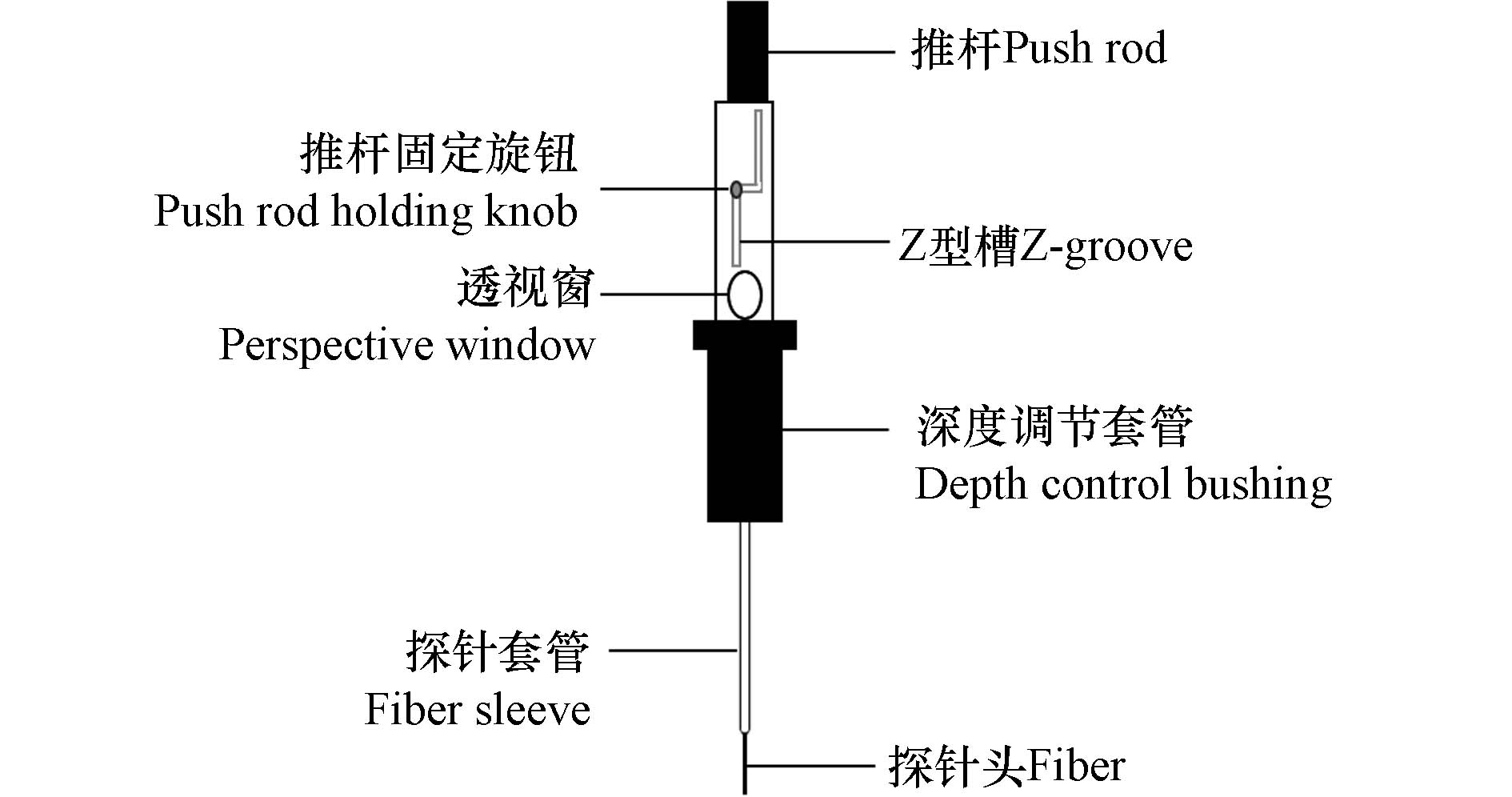
固相微萃取探针是最早出现的SPME装置,其基本装置结构类似于气相色谱的微量进样器,如图1所示. 使用石英丝或不锈钢丝作为载体,涂覆一定厚度的涂层材料,并将其固定于不锈钢套管上,作为探针的萃取头. 外层套管对涂层起保护作用,能有效避免涂层的污染和损坏. 通过调节推杆,可实现探针在套管内的伸缩,完成对目标分析物的萃取[16]. 基于SPME的操作简便、少溶剂甚至无溶剂、可实现自动化等优点,SPME于1993年开始商业化,市场上可直接购买多种吸附材料以及涂层厚度不同的商业化萃取探针,满足多个领域的应用需求.
理想的SPME涂层材料不仅需要具有大比表面积、高稳定性、丰富吸附位点,而且还要考虑涂覆过程的简便性以及重现性. 常见的市售SPME涂层主要包括二乙烯基苯(DVB)、聚二甲基硅氧烷(PDMS)、聚丙烯酸酯(PA)、碳分子筛(CAR)及其复合材料,它们对目标物具有大的吸附容量和良好的选择性. 但商用探针普遍存在价格昂贵、涂层易磨损、使用寿命短等问题[17]. 此外,值得注意的是,全氟或多氟烷基物质、四环素、酚类内分泌干扰物等新污染物具有极性特征[18 − 20]. 但目前主流的商用涂层主要对非极性或弱极性污染物的萃取效果较为理想,对极性物质的萃取效率较低,这限制了其在新污染物检测中的实用性. 因此,SPME技术亟需创新与发展,以提升其对物化性质多样化的新污染物的萃取效果.
对于直接萃取过程,相平衡时的萃取效率可以根据公式(1)[21]得到:
在这个方程中,平衡萃取量(
n )与萃取相的体积(Ve )、样品相和萃取相之间的分配系数(Kes )、分析物的初始浓度(Cs )以及样品体积(Vs )之间存在比例关系. 其中,Kes 是一个热力学参数,主要与吸附涂层的物理化学特性有关,而Ve 则取决于萃取相与目标分析物之间的接触体积. 针对痕量新污染物的高效萃取,目前的研究主要集中在开发新的涂层材料以提高Kes 或改进萃取装置以增加SPME装置中的Ve ,进而提升整体萃取效率. -
在SPME中,涂层材料的选择对萃取效率以及处理复杂样品基质的能力至关重要. 针对上述商品化探针涂层的不足,研发寿命更长、成本更低、稳定性更强的涂层材料,是一个重要发展方向. 目前,已有多种实验室自制的多孔涂层材料被应用于SPME,以满足对新兴且复杂的有机污染物的富集需求,包括金属有机框架、共价有机框架、分子印迹聚合物、碳材料和离子液体等.
-
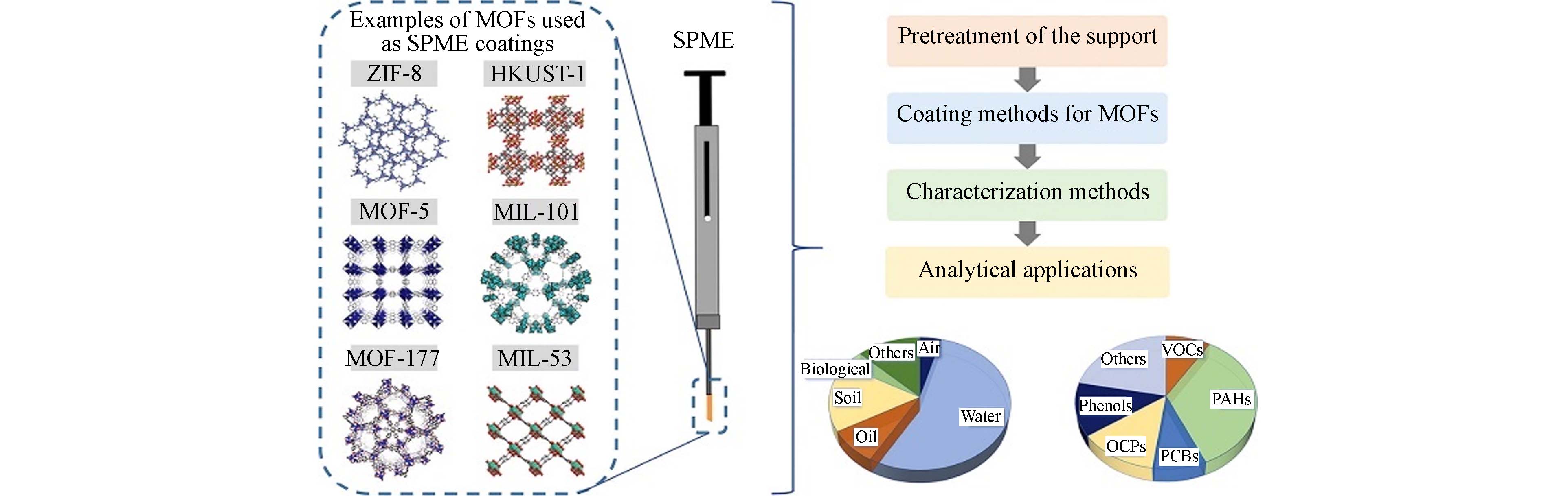
金属有机框架(MOFs)是一类晶体多孔材料,主要由金属离子或金属簇作为连接点,结合含氧或含氮的有机配体通过配位键构成[22],在吸附方面表现出色[23]. 常用作SPME涂层材料的MOFs一般可以根据其组成单元分为以下几类:沸石-咪唑框架材料(ZIF)、莱瓦希尔有机框架材料(MIL)、网状金属有机框架材料(IRMOFs)和HKUST-1[24]. 它们各具优缺点,例如ZIF拥有出色的化学稳定性,但其通道结构复杂,可能会影响传质效率和吸附能力[25];MIL则能够针对不同分析物调节孔隙结构,但合成条件较为苛刻[26];IRMOFs系列比表面积大且孔道结构规则,但对水分敏感,在潮湿的环境中易发生坍塌,为保持其结构需要引入额外的保护层[27];HKUST-1因其配位的不饱和金属位点在吸附领域前景广阔,但其亲水特性通常允许水分子与金属位点结合,降低了其用作吸附剂的潜力[28]. 因此在应用于SPME时,需综合考虑其选择性、稳定性、合成复杂度、成本等,以满足特定的应用需求. 图2展示了部分MOFs作为SPME的涂层材料用于有机氯农药、多氯联苯、酚类化合物等新污染物的高效富集[29].
通过对MOFs进行改性,可调控其孔径结构,增加表面活性位点,进而改变MOFs的萃取选择性、增强富集能力. Gong等[30]制备的氨基功能化ZIF-8,能够与全氟烷基物质(PFAS)的酸基形成六元环结构,从而增强静电作用力和氢键作用力. 该涂层的萃取效果显著优于ZIF-8和商用涂层,其富集因子为8.5—34.9,是PDMS探针的2.94倍至13.77倍. Mondal等[31]通过用氨基修饰制备出MIL-101(Cr)-NH2探针用于测定活鱼背外肌中的抗生素. 该材料不仅具有优异的孔径分布和高比表面积,而且表面的氨基能够通过共价键连接抗生素的官能团,显著提升萃取效果,超过了商用探针的萃取性能.
MOFs的合成通常需要高温和苛刻的pH条件. 针对该问题,Lan等[32]在常温和中性pH值下,通过更可控、更简单的电化学聚合方法研制出E-MOF-5涂层材料,赋予其多孔结构、高比面积和丰富的功能化表面. 与商用PDMS探针相比,E-MOF-5涂层对4种外源性雌激素具有更高的富集选择性.
-
共价有机框架(COFs)是由C、H、O、N等轻元素构成,并通过稳定的共价键连接形成二维或三维的网络结构[33]. 其可控的官能团和稳定的孔隙结构使COFs成为了新污染物富集和吸附的理想材料[34].
具有苯基、氨基及其他官能团的COFs能够提供多种吸附机制,例如π-π叠加、静电作用、氢键、疏水作用,使其在SPEM涂层方面展现出广泛的应用前景[35]. Ji等[36]通过微波促进2,3,5,6-四氟-4-腈与2,3,6,7,10,11-六羟基三苯乙烯的亲核取代反应,成功合成二噁英连接的COF涂层,表现出大表面积(2034 m2·g−1)、有序的多孔结构和良好的疏水性,对PFAS展现出色的亲和力. Guo等[37]报道了以1,3,5-三-(4-甲酰苯基)苯和联苯胺为单体构建的COF探针TFPB-BD对环境水体中多氯联苯的有效富集. 该涂层材料提供了比商用针PDMS、PDMS/DVB更大的富集因子,范围在
4471 —7488 之间.最重要的是,COFs易于根据新污染物的特征定向构造,设计含有功能基团的构建单体,为新污染物的吸附提供丰富的作用位点. 以PFAS为新污染物的典型代表,其具有较高的电负性、疏水性以及氟化特性,常规的涂层材料对其吸附效果均不太理想[38]. 为此,Huang等[39]利用方酰胺的内在优势,将氢键给体、氢键受体和亲氟链段整合到COF框架中,构建了一种新型二维COF,实现PFAS的广谱富集. 该材料成功对饮用水中的6种不同PFAS进行快速吸附,吸附量在338—375 mg·g−1范围内. 同样考虑到强氟-氟相互作用,Song等[40]通过自下而上的自组装策略和席夫碱反应,制备出富氟原子的COF涂层,成功富集了水样中的14种痕量PFAS,富集因子高达66—160. 这些研究结果表明,定向设计的COFs涂层在复杂环境中目标有机污染物的选择性富集方面具有巨大潜力.
由于大多数COFs的价格较高,这限制了它们作为吸附材料在新污染物检测中的实际应用. 因此,采用廉价试剂合成新型COFs将为其带来广阔的发展空间. Li等[41]以2,4,6-三-(4-甲酰基苯氧基)-1,3,5-三嗪和1,3-双(4-氨基苯基)尿素为结构单元,通过醛-胺缩合反应合成了一种廉价且富含氮的新型亚胺COF. 制备得到的SPME探针在蔬菜和水果(长叶莴苣、卷心菜、大白菜、苹果、梨和桃)中对有机氯农药具有高亲和力,与商品化PDMS涂层相比具有更优越的萃取性能.
-
分子印迹聚合物(MIPs)是一类特殊的高分子材料,通过以特定目标分子为模板,结合功能单体和交联剂进行聚合,从而形成具有特定识别能力的结构,能够高选择性地识别和捕获目标分析物(图3)[42]. 将具有优异选择性的MIPs与SPME进行组合已成功用于新污染物的富集,并取得了显著成效[43].
MIPs对特定目标物的高吸附性,具体表现在其具备与底物分子形状相匹配的空腔以及特定的官能团,可以对尺寸、形状和官能团相似的目标分子进行捕获. 叶等[44]分别以阿普唑仑、咪达唑仑和艾司唑仑为模板分子,在不锈钢丝上涂覆特定的分子印迹聚合物涂层,旨在检测肉牛血液和尿液中的苯二氮类药物. 结果显示,所制备的MIPs探针对特定目标物吸附量分别为140.6、130.8、112.4 ng,对目标物的选择性和识别性均优于商用针PA.
但在实际检测中,常规的MIP-SPME通常仅能对特定物质进行选择性吸附,难以实现复杂基质中多种物质的同时萃取. 针对该问题,采用多根MIPs探针同时萃取以提高多种新污染物的吸附容量是一种可行的策略. Zhou等[45]以17β-雌二醇为模板在不锈钢丝上原位聚合MIPs涂层,随后将三支探针绑定到自制手柄上,用于牛奶和酸奶中5种雌激素的萃取. 与商用针PA相比,MIPs的三支探针的萃取量显著提高了145倍,富集因子为99.60—133.16,能够在复杂基质中选择性富集痕量雌激素. 此外,分子印迹探针阵列不仅可以使用同种MIPs涂层构建萃取平台,还可以通过不同类型的MIP涂层开发组合萃取平台. Xu等[46]制备了三模板MIPs(以邻苯二甲酸二甲酯、邻苯二甲酸二苯酯和邻苯二甲酸丁苄酯为模板分子)固相微萃取探针用于探究环境水中的邻苯二甲酸盐. 相较于传统探针,三模板探针的可重复使用次数最多可达100次,能够同时对五种分析物展现出高选择性吸附能力,富集因子范围为26.80—76.35.
-
碳材料,如碳纳米管、石墨烯、碳纤维等,因其卓越的物理和化学性质而引起了广泛关注. 这些材料不仅环境友好、廉价易得,而且在强度和稳定性方面表现优异,是一类在SPME领域中极具潜力的涂层材料.
但传统碳材料存在固定的骨架结构、较低的比表面积及强疏水性等局限,常导致其萃取性能无法满足SPME的应用需求. 因此有必要对碳材料进行功能化改性,以增加活性位点、增大比表面积、调节孔隙结构,满足超痕量新污染物的富集需求[47,48]. Khataei等[49]选择热稳定性和化学稳定性好的氧化石墨烯作为前驱体,利用SNW-1表面的胺基还原氧化石墨烯得到rGO/SNW-1@PES材料,在富含N的同时,还保留了石墨烯的六边形共轭环,对饮用水中痕量的邻苯二甲酸酯表现出高亲和力. Zang等[50]在多壁碳纳米管中掺杂了氮化硼从而增强了材料的极性,将其制作为SPME探针涂层,成功从水果和蔬菜中萃取了11种有机氯农药. Li等[51]修饰纤维素制备了新型的疏松多孔石墨相氮化碳/多孔碳复合材料,用于水和果汁中有机氯农药的萃取. 通过纤维素纳米晶体表面的羟基对石墨化氮化碳进行改性,解决了该材料的团聚问题,同时部分微孔通道得以扩展为介孔通道,提高了污染物的传质速率和活性位点的利用率,萃取效率比PA高出5—30倍.
-
离子液体(ILs)是在室温或低于100 ℃条件下由有机部分和有机/无机部分离子组成的呈液态物质. 基于阳离子和阴离子的多样化组合,ILs的物理化学性质具备极大的可调性,为极性不同的新污染物萃取提供了合适的选择[52].
由于直接涂覆在纤维上可能会造成ILs的流失,Cui等[53]将[C8MIM][PF6]直接沉积到具有多孔结构和高表面积的蚀刻不锈钢丝表面,实现了IL涂层的原位制备,并用于萃取河水中的4种雌激素. 蚀刻能够在不锈钢丝上形成粗糙表面,有助于沉积更多的IL,进而显著提高了对雌激素的萃取效率,其富集因子为
1382 至4779 ,是商用PA探针的6.5—16.8倍. Du等[54]使用电化学方法制备出含IL和功能化石墨烯的共掺杂复合材料,该材料作为SPME探针涂层能够迅速吸附香水中的苯甲酸盐. 在最佳条件下,其富集因子为140—460;经过140次重复萃取后,涂层的萃取效率仍能够维持不变.聚离子液体是通过聚合反应将离子液体单体转化而成的高分子材料. 在有效保留离子液体特性的同时,还展现了聚合物的独特特征,已成为一类新的SPME萃取涂层. Nascimento等[55]使用具有更高极性和更强氢键作用的羟基和羧基对聚离子液体进行功能化,增加了对高极性分析物(如2-甲基咪唑和4-甲基咪唑)的亲和力,并提供了丰富的活性位点.
总的来说,针对复杂多变的新污染物,研究人员研发了多种功能性材料,并根据不同材料的独特优势将其组合成复合材料,以期提高萃取效率和富集因子. 这些涂层材料被制备为SPME探针后,能够更加精确地识别并富集不同基质中的新污染物,进而显著提高了检测方法的灵敏度,在新污染物检测中扮演越来越重要的角色,其具体细节可见表1.
-
由上述的表1可以发现,SPME探针对部分新污染物的富集因子较低,这可能归因于SPME探针的涂层较薄,导致有限的吸附容量和萃取效果. 尽管增加涂层厚度(一般在7—100 μm范围内)可在一定程度上提高萃取容量,但这不仅会延长平衡时间,而且涂层极易从载体上脱落. 为此,目前除了SPME探针,还发展了针内、管内、注射器内、薄膜、搅拌棒等多种萃取装置,在提高吸附性和萃取效率的同时,还有望推动多功能、一体化的前处理平台建设,实现对新污染物的高通量、高灵敏分析.
-
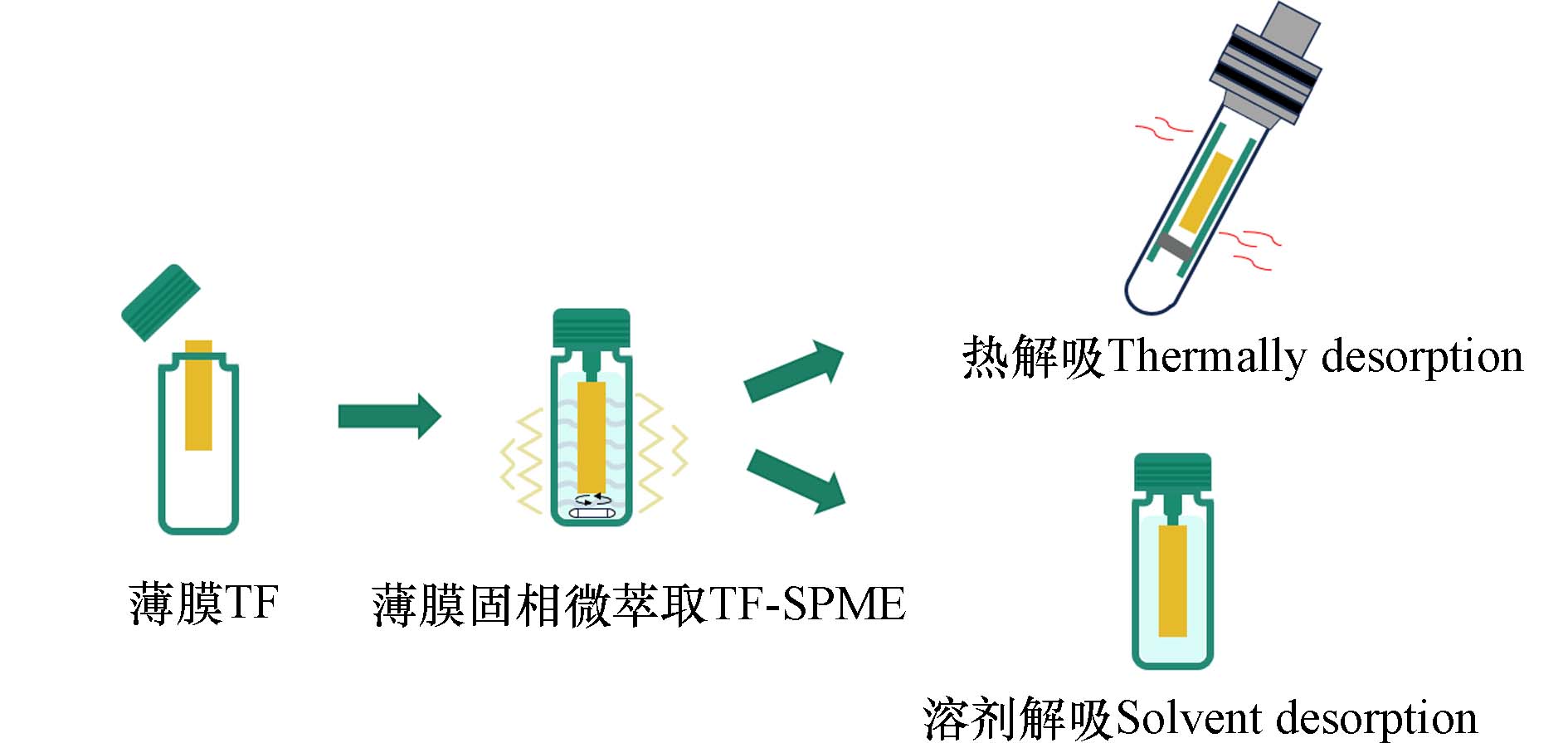
在SPME探针的基础上,薄膜固相微萃取(TF-SPME)通过增大
Ve 和表面积与体积之比,实现了更高的灵敏度和萃取效率,同时显著减少了萃取时间[84]. 理论上,TF-SPME的萃取量是SPME探针的20—100倍,已被反复验证为一种适合于现场、环境及食品领域的新型萃取技术[85].根据解吸方式,通常可以将TF-SPME分为热解吸TF-SPME和溶剂解吸TF-SPME(图4). 热解吸TF-SPME能有效避免分析物损失,具有良好的回收率. Chen等[86]将在载有二乙烯基苯颗粒的铜网作为固相微萃取薄膜,结合GC-MS对水中的3种违禁药物(甲基苯丙胺、氯胺酮和甲喹酮)进行分离检测. 所自制的薄膜在萃取效率上显著优于商用PDMS膜. 通过简化的一步萃取-热脱附流程,该方法的检出限达到了1.1 ng·L−1. 此外,水样分析结果与传统的SPE-GC-MS相比,未表现出显著差异.
在溶剂解吸TF-SPME中,被吸附的分析物被甲醇和乙腈等有机溶剂溶解,然后将脱附溶剂注入到分析仪器中进行后续检测,该脱附策略对难以通过高温完全脱附的化合物尤为有效. Rickert等[87]将亲水亲脂性颗粒装载于碳纤维基质的薄膜上,采用溶剂(95∶5 MeOH/H2O)进行解吸脱附,并结合UHPLC-MS/MS对真实水样中的农药进行了筛查,定量限在0.5 ng·mL−1以下. 同时,他们采用一种新的磁性叶片喷雾装置对结果进行了验证,表明所构建的TF-SPME-UHPLC-MS/MS检测方法具有很好的可信度,并有效降低了检出限. Sereshti等[88]采用静电纺丝技术,在细菌纤维素薄膜上涂覆由β-环糊精和海藻酸盐掺杂的聚乙烯醇,增加了活性位点,显著提高了对城市废水中抗生素的富集效率,富集因子的范围为19.4至37.5. 薄膜在100 μL的甲醇中脱附后,含有目标分析物的脱附液被注入HPLC-UV进行分析,对抗生素的检出限可达到0.02 μg·L−1.
作为一种常用的样品前处理方法,TF-SPME具有萃取时间短和高通量富集的优势. 但TF-SPME需要配备专门的部件和材料,增加了使用成本. 例如,热脱附仪通常超过10万人民币,导致热解吸的使用频率相对较低. 而溶剂解吸虽然应用广泛,但其需要消耗较大量的有机溶剂,不符合绿色化学的理念. 因此,TF-SPME技术未来将侧重于开发新型脱附部件和分析联用模式,进而扩大其应用范围.
-
管内固相微萃取(IT-SPME)结合了SPME的优点和管状结构的便利性,不同于传统的SPME探针将分析物萃取到探针的外表面,IT-SPME采用毛细管将分析物萃取至其内表面,有效减少了萃取涂层的损害或污染,并有利于后续的脱附[89]. 在水样分析的应用中,IT-SPME技术仅需数毫升的样品,便能达到与其他预处理方法(如LLE或超临界萃取)相当的灵敏度,而后者通常需要几十或几百毫升的原始水样.
最早选用中空毛细管作为萃取管,随后发展出多种类型的萃取管,包括内壁涂覆型、颗粒填充型、纤维填充型以及棒状整体柱型等(图5)[90]. Zhang等[91]利用埃洛石纳米管(HNTs)的丰富羟基和阳离子交换位点,将HNTs掺入到有机聚合物整体柱,显著提高了其对极性阳离子农药吸附能力. 经HPLC-MS/MS分析,马来酰肼、阿米特罗和灭蝇胺的检出限分别为1.9、2.1、0.1 µg·kg−1.
此外,IT-SPME还可以实现在线萃取,结合HPLC-DAD或LC-MS进行自动化分析,显著提高样品处理效率. Sun等[92]建立了3种基于在线IT-SPME的方法用于水样中有机污染物(多环芳烃、雌激素、双酚)的灵敏检测. 通过在碳纤维上原位生长TiO2纳米棒阵列,成功获得纤维填充型萃取管,大幅提升了碳纤维对有机污染物的萃取效率,富集因子高达
6784 ,所建立的IT-SPME-HPLC方法检出限低至0.001 µg·L−1. Pang等[93]开发了一种涂覆三维COF/整体式复合吸附剂的管内萃取装置,通过与HPLC-MS/MS联用实现对水样中的四环素的在线分析. 在理想的萃取条件下,该方法可以检测低至0.48—1.76 pg水平的四环素,灵敏度是已报道方法的24—98倍.IT-SPME技术克服了传统SPME在吸附能力低和易损性等方面的缺陷,展现了高水平的自动化及其与分析仪器的在线耦合能力,显著减少了人为误差,提高了准确性、精密度和灵敏度,特别适用于萃取含有新型污染物的液体样品. 然而部分IT-SPME的萃取效率仍需提升,未来可考虑将磁性杂化材料固定在毛细管中,并通过施加磁场来进一步提高萃取效率[94].
-
分散固相微萃取(DSPME)通过将吸附剂直接分散于样品溶液中,进而增大吸附剂与溶液之间的接触表面,显著提高了萃取效率. Cheng等[95]以氧化石墨烯分子印迹聚合物为分散吸附剂,用于环境水样中邻苯二甲酸酯的选择性富集. 在优化条件下,制备的吸附剂在水溶液中表现出比传统球形分子印迹聚合物更高的容量与亲和力,其富集因子超过了100.
相对来说,分散吸附剂从样品溶液中分离是比较困难的,而磁性颗粒无需额外的离心或过滤操作,借助外部磁力即可轻松实现吸附剂与溶液的分离,被认为是分散固相微萃取的一种优良载体材料. Hu等[96]开发了一种Fe3O4@SiO2@ZnO复合材料作为磁性固相微萃取吸附剂. 由于Zn(II)离子对四环素具有极强的亲和力,同时具备二价锌和磁性二氧化硅特性的纳米材料可以有效地萃取牛奶中的四环素,萃取效率约为87.6%. Viñas等[97]以油酸为表面活性剂对氧铁酸钴纳米颗粒进行改性,提高了材料的化学稳定性和抗氧化性,并降低基质效应,使其能够有效萃取果汁中的烷基酚. 该磁性颗粒不仅可以重复使用,还极大简化了样品预处理过程,富集因子在25—120范围内.
作为一种简单、快速、廉价的技术,DSPME消除了吸附剂在探针载体上应用的限制,展现出高萃取效率、高富集因子和低样品溶液消耗等特点,成功应用于新污染物检测领域. 相较于常规的SPME,DSPME在自动化发展和动植物体内分析方面仍面临一定的局限性[98],亟需克服这些挑战,以进一步提高其应用的广泛性和实用性.
-
除了上述常用的装置,近年来还开发了一系列独特的新型装置来改善SPME的局限,从而引入了具有更大可利用表面积、更高吸附能力、制造更简单的萃取装置,丰富了现有的萃取手段,为新污染物调查提供有力的支持.
由于全氟烷基膦酸(PFPA)的富集难度大,Huang等[99]根据PFPA独特的化学性质和分子结构合成了以丙烯酸十二氟庚基酯和4-乙烯基苄基三甲基氯化铵为混合功能单体的吸附剂,并将其用于由四根无支撑体的整体纤维组成的纤维束固相微萃取(MMF-SPME)装置,通过亲氟和阴离子交换等相互作用,实现了痕量PFPA的高效富集. 经HPLC-MS/MS检测,PFPA在水和蔬菜样品中的检出限分别在0.11—0.86 ng·L−1和2.2—55 ng·kg−1的范围内.
考虑到电场的高效驱动以及其与材料结构中分子之间的特殊相互作用,Chen等[100]将SPME与电场相结合,提出电增强固相微萃取(EE-SPME)技术,利用外部电场提高了萃取效率. 在此技术中,EE-SPME的富集因子达到了
1329 ,而不与电场结合的SPME富集因子为1055. 结合GC/MS-MS,涂覆具有高导电性的卟啉基共价有机骨架的探针在2.5 V电压下成功用于饮料、工业废水、湖水和牡蛎样品中痕量邻苯二甲酸酯的富集,检出限为0.002 ng·L−1.注射器微萃取(MEPS)是指将吸附剂装入注射器中,通过按压和拉动注射器柱塞即可实现萃取[101]. MEPS可以直接连接分析设备,提高回收率,有效防止目标分析物的损失. da Silva等[102]以Si@GO@βCD为吸附剂,制备了一种新型的MEPS装置,具有出色的耐久性、自动化、同步且连续富集等特点. 将其与LC-UV联用,实现了雌激素的在线自动测定,检测时间不超过17 min,方法检出限低至10 µg·L−1.
从最初的探针到如今的多样化、自动化萃取装置,萃取过程已经得到了显著简化,萃取性能也得到了有效提升. 这些装置各有利弊,选择最合适的萃取装置仍需考虑诸多因素. 例如,器件的物理性能、装置的性价比、分析物的物化性质等. 此外,考虑到不同场合的需求,快速、高效的自动化萃取装置在实验室和现场监测中也愈发受到关注. 因此,在选择萃取装置时,我们不仅要深入了解各种技术的优势与局限,还需结合实际应用场景,以达到最佳的萃取效果和检测灵敏度.
-
与其他萃取技术相比,SPME作为一种环境友好型的样品前处理技术,具有操作简便、萃取高效、低溶剂消耗等特性,更符合绿色分析化学的需求,为处于复杂基质中的新污染物检测提供了高效环保的新途径. 目前,随着新型萃取涂层和装置的不断研发,SPME已与多种分析技术相结合,应用于新污染物调查分析及风险评价工作中,有效地提高了新污染物的富集能力,帮助掌握新污染物在环境中的赋存情况. 考虑到当前部分新污染物具有较强的亲水性,并存在于复杂基质中,SPME对其富集能力仍有待提升,以持续拓展SPEM的应用范围:
1)研究吸附材料在处理新污染物时的选择性以及在复杂基质样品中的适用性,并明确其机理,以实现SPME对不同物理化学性质新污染物的广谱、高灵敏度分析.
2)重视新型SPME装置的开发,实现全自动化,同时研究在线联用技术,进一步提升样品预处理的工作效率,减少实验误差,提高新污染物整体分析的通量.
3)开发出适用于新污染物及其转化产物的现场、在线和原位检测的SPME装置,并与便携式仪器结合使用,获得比实验室分析更具有实际意义的新污染物定性定量信息.
4)目前大多数涂层材料和萃取装置是实验室自主研发并应用,将SPME纳入关于新污染物检测的国家标准,将促进技术的标准化和规范化,确保分析结果的准确性和可比性.
综上所述,随着科技的进步和检测需求的变化,SPME技术将持续发展,提供更高效、更可靠的技术保障. 未来的研究方向可能会集中于使用SPME进行靶向和非靶向(副产物)分析,以研究环境中的降解过程及其副产物,并确定环境中新污染物的物理化学参数(分布系数、恒定速率),为制定有效的新污染物环境管理和控制策略提供科学依据.
固相微萃取在新污染物检测中的研究进展
Research progress of solid phase microextraction in the detection of emerging contaminants
-
摘要: 基于新污染物的痕量存在、广泛分布、多样化物化性质,传统方法难以实现其高效检测,样品前处理技术成为有新污染物检测中不可或缺的一部分. 固相微萃取技术日趋成熟,是一种集采样、萃取、富集于一体的样品前处理技术,凭借高效、溶剂少、易于自动化等优点在新污染物检测中具有广阔的发展前景. 固相微萃取的萃取效果主要与涂层材料和萃取装置密切相关,本文系统总结了多孔材料作为吸附剂在固相微萃取中的应用,并介绍了四种具有代表性的萃取装置,为进一步推动固相微萃取的发展及其在新污染物检测领域的应用提供参考.Abstract: Given the low environmental concentrations, widespread sources, and diverse physicochemical properties of emerging contaminants, their effective detection may not be realized by traditional method. Sample pretreatment techniques have thus become an indispensable part for the determination of emerging contaminants. Solid phase microextraction (SPME), integrating sampling, extraction, and enrichment into one step, has been matured and recognized as a green sample pretreatment technique. Due to its high efficiency, reduced solvent usage, and easy automation, SPME is greatly promising for enriching emerging contaminants. The extraction efficiency of SPME is closely related to the coating materials and designed extraction devices. This work systematically reviews the application of porous materials as efficient adsorbents in SPME, and introduces four representative extraction configurations. Through this review, we aim to provide a reference for further development and application of SPME for emerging contaminants.
-
镉(Cd)是水产品中常见的重金属污染物,可以在水环境以及水生动物之间进行迁移转化,并沿着食物链在生物体内蓄积[1 − 2]. 前人研究发现,某些甲壳类水生动物对镉具有明显的蓄积特异性. 其中,三疣梭子蟹(Portunus trituberculatus)的镉蓄积问题尤为突出,引起了人们广泛关注.
三疣梭子蟹是一种生活在水深10—30 m砂质泥或砂质海底的杂食性螃蟹,广泛分布于太平洋的西海岸,北起日本的北海道,南至东南亚的越南、泰国等地[3]. 三疣梭子蟹肉质鲜美,风味独特,是一种深受中国人喜爱的具有较高营养和经济价值的海产品. 《2023中国渔业统计年鉴》[4]指出,2022年,我国海捕梭子蟹的产量就达到45.82万吨,占海捕蟹的70.75%. 然而,膳食摄入是人类暴露镉的主要途径[5],食物中的镉进入人体后会对肝脏、肾脏、骨骼、大脑等部位造成损伤,引起人体慢性中毒,进而产生生殖系统损伤、死亡率升高、预期寿命减少等负面影响[6]. 因此,三疣梭子蟹的食用安全风险问题同样受到广泛关注.
此外,相关的毒理学研究指出,不同形态的镉可能具有不同的生物学毒性[7]. 因此,在进行三疣梭子蟹的食用健康风险评价时,需考虑不同镉形态的毒性影响. 三疣梭子蟹中镉的赋存形态可以分为无机镉形态和有机镉形态[8]. 无机离子态镉可以通过不同的途径对生物体的某一器官和组织产生多方面的危害,如与体内的生物分子,包括酶和核酸等生物大分子相互作用[9]. 有机镉的具体形态目前尚未明确,并且关于有机镉的毒性机理研究也少有报道. 林建云等[10]实验指出有机结合态镉对水产动物的毒理效应和代谢作用与离子态镉(Cd2+)存在着明显的差异. 目前,国内外主要以总镉含量来评价三疣梭子蟹中镉的污染水平及食用健康风险,鲜少有针对镉形态的深入研究. 这使得三疣梭子蟹中镉的安全性评价缺乏不同镉形态的可靠数据与科学依据.
迄今为止,大部分研究主要围绕三疣梭子蟹中的镉蓄积水平、地区差异等问题进行,也有部分科学家开展了三疣梭子蟹中镉的蓄积机制及赋存形态问题的初步研究,但尚未有关于此问题的清晰明确的定论. 基于此,围绕三疣梭子蟹对镉的特异性蓄积问题,本文对三疣梭子蟹中镉的蓄积含量、分布特征及污染现状进行了综述,同时对三疣梭子蟹不同可食用组织中镉的赋存形态和健康风险评估的研究进展进行了总结分析,期望能为后续开展有关三疣梭子蟹中镉蓄积机制及赋存形态的研究提供科学参考与基础指导.
1. 三疣梭子蟹中镉的来源、污染现状及国内外限量标准(Cadmium in Portunus trituberculatus: sources, pollution situation ,domestic and international limit standards)
1.1 三疣梭子蟹中镉来源的研究进展
据报道[11 − 12],水生动物中的重金属来源主要分为两种,一种是表皮细胞或鳃等从周围水环境中直接吸收重金属,然后积累在外皮硬组织中;另一种来源则是含有重金属的颗粒状物质(饵料和沉积物颗粒)被水生动物摄食,通过食物链传递,积累在内脏软组织中. 对于甲壳类水生动物,研究人员认为重金属主要通过4个途径进入其体内. 第一,在甲壳类进行鳃呼吸时,重金属通过呼吸作用进入动物体内. 第二,某些甲壳类饵料中的金属离子通过摄食途径进入动物体内;第三,部分甲壳类动物的体表可通过与水体的渗透交换作用富集重金属;第四,水生动植物中富集的重金属通过食物链进入甲壳类体内[13].
三疣梭子蟹作为典型的甲壳类动物,目前关于其体内的镉来源的研究较少,并且对于三疣梭子蟹各可食组织中蓄积的镉具体来源也未见明确报道. 根据其他蟹类的相关研究[14 − 18],可以推测三疣梭子蟹中镉可能来源于两种途径:①环境途径,三疣梭子蟹的蟹壳和蟹腮与含镉介质(如水体、沉积物)直接接触,通过自由/被动扩散或Ca2+通道截留环境介质中的镉. ②摄食途径,三疣梭子蟹通过食物链从饵料或浮游动植物中富集镉. 作为研究三疣梭子蟹镉蓄积机制的重要组成部分,镉来源的研究还需要结合相关毒理学和生物学方法开展深入实验,以查明镉的不同来源对三疣梭子蟹体内蓄积机制的影响,同时有利于后续开展镉在三疣梭子蟹体内迁移、转运和归趋的相关研究.
1.2 三疣梭子蟹中镉的污染现状
三疣梭子蟹体内可检测出多种金属元素,镉是其中重要的有毒污染物. 尤炬炬等[19]对浙江沿海68个梭子蟹样品进行了铅、镉、总汞和无机砷的检测,发现镉含量远远高于其他重金属. 吴烨飞等[20]检测了梭子蟹中铅、镉、总汞和无机砷,只有镉存在污染问题. 可见,三疣梭子蟹中存在着明显的镉污染状况.
根据《食品安全国家标准 食品中污染物限量(GB2762—2012/GB2762—2017)》,甲壳类水产品中的镉含量不应超过0.5 mg·kg−1. 但在2012—2022年有关水产品重金属检测的报道中,全国各地市售的三疣梭子蟹普遍存在着镉超标问题(表1). 如高志杰等[21]采集了宁波市售的具有代表性的海产品进行重金属检测,发现其中镉含量最高的是梭子蟹6.808 mg·kg−1,超标率达74.5%,存在严重的镉污染现象. 樊伟等[22]研究了2007—2014年绍兴地区7类992份水产品的重金属污染情况,发现梭子蟹的镉污染最为严重,超标率为38.38%. 庞雨樵等[23]对新疆地区市售的6类水产品进行抽检,发现超标样品均为梭子蟹,最大镉浓度为2.1 mg·kg−1. 然而,即使三疣梭子蟹中镉超标问题严重,仍不能仅凭限量判定镉对三疣梭子蟹食用者的毒性大小和风险高低,还需要结合更科学的方法去研究和评价三疣梭子蟹中镉对人类的危害.
表 1 相关文献报道的三疣梭子蟹中镉含量水平及超标率Table 1. The cadmium concentrations and exceedance rates in Portunus trituberculatus reported in relevant literature采样地点Sampling region 采样年份Sampling year 报道年份Year of reporting 平均含量/(mg·kg−1)Average content 超标率/%Exceedance rate 参考文献Reference 宁波Ningbo 2012 2014 6. 808 74.5 [21] 绍兴Shaoxing 2007—2014 2016 0.90±1.35 38.38 [22] 廊坊Langfang — 2016 1.06 73.1 [24] 青岛Qingdao — 2017 2.79 100 [8] 渤海Bohai Sea 2014 2018 1.60 — [25] 温州Wenzhou 2013-2017 2020 1.99 88.4 [26] 山东Shandong — 2020 2.26 — [27] 舟山Zhoushan 2016 2021 1.44 75.6 [28] 莱州Laizhou — 2021 0.36 18.6 [29] 上海Shanghai 2021 2022 2.635 ±1.784 — [30] 注:“—”代表引用文献中未提供该信息. Note:‘—’represents in formation is not provided in the cited references. 1.3 国内外对三疣梭子蟹的限量
三疣梭子蟹对镉具有显著的蓄积特异性[31],其体内的镉含量往往远高于其他甲壳类水产品[32 − 33]. 可能是因为口虾姑[34]和三疣梭子蟹等海水蟹[35]具有不同于其他甲壳类水产品对镉的强蓄积特异性,在我国新实行的国标GB2762—2022《食品安全国家标准 食品中污染物限量》中,就将海蟹和虾蛄中的镉限量指标单独设立,把镉的限量值由原来的0.5 mg·kg−1调整为3 mg·kg−1. 除此之外,对限量值的改动,还可能是因为镉在不同生物体内的不同的赋存形态具有不同的生物利用率和生物学毒性. 依据我国相关检测标准,对水产品进行检测得到的镉总量是以毒性最高的无机离子态镉为限量值的评价标准. 但已有研究指出,三疣梭子蟹和虾蛄中的镉大部分以毒性较低的有机形态存在[8]. 因此,仅以0.5 mg·kg−1作为镉的限量标准,可能会高估三疣梭子蟹等海蟹和虾蛄中镉的毒性. 在港澳台地区,三疣梭子蟹中镉的限量标准有所不同. 澳门规定了去除内脏后的甲壳类镉的最高限量为2 mg·kg−1. 香港则是明确要求去除蟹壳和鳃后的整体(包括性腺、肝及其他消化器官)中镉的限量为2 mg·kg−1. 台湾地区仅规定甲壳类可食用组织限量值不超过0.5 mg·kg−1.
对于三疣梭子蟹中镉的限量值,国际上并没有统一的限量标准. 查阅相关法案文件(表2),可以发现不同国家相关的镉限量值有所不同,最低可至0.5 mg·kg−1,最高可至5.0 mg·kg−1,相差可至10倍. 不同国家的甲壳类水产品中镉含量限定对象的范围也有所不同. 比如,韩国、欧盟等国家会针对甲壳类不同组织进行限量值的规定. 对于各国镉限量差异问题,原因在于各国在划定限量值时没有统一的科学参考依据. 因此,有必要完善甲壳类中镉限量的判断指标. 不仅要根据甲壳类自身特征与生长环境进行评估,还要继续研究不同镉形态的毒理学效应,根据甲壳类中无机镉与总镉的占比情况,更细致地划分限量对象与限量值,更好地保障公众的食品安全.
表 2 部分组织或国家有关三疣梭子蟹中镉的限量值比较Table 2. The comparison of limit values for cadmium in Portunus trituberculatus in some organizations or countries组织或国家Organizations or countries 执行对象Implementation aims 限量值/(mg·kg−1)Limited value 执行标准/法规Implementing standards/regulations 中国China 甲壳类(海蟹、虾蛄除外)Crustaceans(except sea crabs and mantis shrimps) 0.5 GB2762—2022[36] 海蟹、虾蛄Sea crabs and mantis shrimps 3.0 中国澳门Macau, China 甲壳类(去除内脏)Crustaceans(Removal of internal organs) 2.0 第23/2018号行政法规食品中重金属污染物最高限量[37]Administrative Regulation No. 23/2018Maximum limits for heavy metal contaminants in food[37] 中国香港Hong Kong, China 蟹(去除壳和鳃后的整体)Crab (whole after shell and gills removed) 2.0 2018年食物搀杂(金属杂质含量)(修订)规例[38]Food adulteration (Metallic Contamination) (Amendment) Regulation 2018[38] 中国台湾Taiwan, China 甲壳类可食用组织Edible tissues of crustaceans 0.5 食品中污染物质及毒素卫生标准[39]Hygienic Standards for Contaminants and Toxins in Food [39]. 欧盟European Union 蟹类附肢的肌肉Muscles of crab appendages 0.5 European commission (EU) 2023/915 Regulation on the maximum levels of certain contaminants in food[40] 俄罗斯Russia 甲壳类Crustaceans 2.0 Customs Union TR CU 021/2011[41] 韩国South Korea 甲壳类Crustaceans 1.0 Food Code 2021[42] 带内脏的梭子蟹Swimming crab with entrails 5.0 美国American 甲壳类Crustaceans 3.0 Food and Drug Administration[43] 土耳其Turkey 甲壳类(蟹类的棕肉除外)Crustaceans(excluding brown meat of crabs) 0.5 Food Code 2011[44] 孟加拉Bangladesh 甲壳类Crustaceans 0.5 Bangladesh Bulletin 2014[41] 目前,我国对于食品中污染物的限量仍以总的可食用部分计算,并没有针对甲壳类特定组织的浓度限制. 在进行水产品质量安全检测时,若仅将各个可食组织混合检测,并不能全面准确地评价重金属对甲壳类动物的污染程度,也无法准确评估不同可食组织的重金属潜在健康风险. 因此,对甲壳类的不同食用组织进行分类限量,将有助于科学评价水产品质量.
2. 三疣梭子蟹的可食用组织中总镉的分布特征(Distribution characteristics of total cadmium in edible tissues of Portunus trituberculatus)
环境中的镉可以通过各种途径进入三疣梭子蟹体内,并以不同的速率在各种器官中积累[45]. 前人研究发现,镉在三疣梭子蟹体内不同组织的蓄积量存在差异[46]. 本文总结了三疣梭子蟹不同可食组织中总镉含量的研究现状,以了解镉在各可食组织中的分布特征,期待为后续镉蓄积相关研究提供参考.
2.1 肝胰腺
作为三疣梭子蟹体内重要的消化代谢器官,肝胰腺兼具肝脏和胰腺的功能,能够直接参与金属的摄取、存储和排泄[47]. 同时,肝胰腺作为镉的靶标器官,还会从生物体内的其他组织积累镉[48]. 此外,肝胰腺中存在的金属硫蛋白(metallothionein,MT)还被认为与三疣梭子蟹对重金属的解毒机制有关[49]. 有报道指出,三疣梭子蟹肝胰腺对镉的响应较敏感,能够在感应到镉的胁迫后迅速提高MT的表达[50],产生的MT结合游离的镉,形成低毒状态的金属硫蛋白-镉(cadmium-metallothionein,Cd-MT),从而降低血淋巴中的镉浓度,保证其他维持生命的器官和组织功能不受影响[51 − 53]. 因此,有学者认为三疣梭子蟹的肝胰腺可能是镉的主要蓄积组织[54].
由于肝胰腺与性腺位置相连,难以剥离,研究人员常检测的是肝胰腺和性腺的混合组织(棕肉),而不是单独检测肝胰腺组织. 因此,当前单独针对三疣梭子蟹肝胰腺组织进行镉检测的报道较少. 在仅有的报道中,有学者指出三疣梭子蟹的肝胰腺中镉含量显著高于其他可食组织[33]. 如牛红鑫等[55]对上海市售的梭子蟹中镉的残留量进行了调查,发现梭子蟹各部位中镉的含量为肝胰腺(18.44±10.50) mg·kg−1>性腺(0.49±0.37) mg·kg−1>肌肉(0.22±0.15) mg·kg−1. 然而,仅少量文献不足以说明肝胰腺对镉的蓄积特异性,往后还需要更多的研究支撑.
目前,关于肝胰腺中镉的来源、迁移与归趋的机理问题尚未有科学解释,也未有更深入的分子生物学上的研究. 并且,除了金属硫蛋白之外,肝胰腺是否存在其他蓄积镉的途径也未有明确定论. 综上可知,有关三疣梭子蟹肝胰腺的镉蓄积问题还需要不断探索.
2.2 性腺
三疣梭子蟹的性腺是消费者极为喜爱食用的组织,尤其是发育成熟的性腺[27]. 然而,专门检测三疣梭子蟹性腺中镉含量的报道非常少,绝大多数检测的是性腺与肝胰腺混合物(棕肉)中镉的含量水平. 因为三疣梭子蟹的性腺与肝胰腺位置极为相近,以往有观点认为性腺也可能是三疣梭子蟹中重要的镉蓄积组织. 有学者认为肝胰腺与性腺分布相近,两者在重金属富集分布上具有高度的相似性[33]. 此外,对于肝胰腺中某些脂类及蛋白质会在蟹类性成熟时期通过血淋巴转运至生殖腺,有学者推测某些脂溶性的镉形态可能会随之转移至性腺中[56]. 但棕肉中的镉含量并不能说明镉在性腺中蓄积的情况. 因为棕肉中的成分会因性腺发育时期的不同而产生差异. 例如,有的文献[24]检测的棕肉样品中性腺尚未发育,此时棕肉的成分几乎全是肝胰腺. 另有文献[30]对性成熟的梭子蟹样品中的棕肉进行检测,此时棕肉成分中除了肝胰腺以外,性腺也占有不小的比例. 因此,不能仅依靠棕肉的镉含量水平去单独判断肝胰腺或性腺对镉的蓄积能力.
目前,有极少量报道[32]单独检测了性腺中的镉含量,指出肝胰腺中的镉含量要高于性腺. 但是如此少量的报道,并不足以说明镉在三疣梭子蟹性腺中的蓄积情况,仍需要后续对性腺进行单独检测和研究. 性腺是三疣梭子蟹繁殖的重要器官,探究性腺中镉的蓄积情况,对研究镉对三疣梭子蟹可能存在的生殖毒性[57],以及对消费者食用三疣梭子蟹的安全风险评估研究有着重要意义. 值得注意的是,目前对于三疣梭子蟹性腺不同发育时期的镉含量检测未见报道. 性腺不同发育时期中镉含量的变化规律也是研究三疣梭子蟹中镉蓄积机制的重要部分. 因此,对于三疣梭子蟹性腺中镉的蓄积问题后续需要针对性腺不同发育时期进行更为详细和深入的实验与研究.
2.3 肌肉
在绝大多数报道中,三疣梭子蟹的肌肉(包括胸肌、腿肌、钳肌)较其他可食组织的镉含量水平最低. 如Mei等[28]对东海舟山渔场捕捞的三疣梭子蟹进行了检测,发现内脏组织的Cd水平大约是肌肉组织的9.5倍. 有研究指出,蟹类肌肉组织中的重金属含量与多种复杂因素有关,包括环境参数、种间的生理变异、以及重金属的理化性质、生物活性和累积特性等[58]. 蟹类肌肉中的镉主要来源于血淋巴的输送[59]. 研究指出,环境中的镉进入三疣梭子蟹体内后,会先经过肝胰腺的解毒,若是肝胰腺中重金属过度积累,会加快镉向肌肉组织迁移的速度[49]. 研究指出,镉与生物体中内源性物质亲和力的差异导致其在组织器官蓄积的异质性[60]. 因此,可能是肌肉对重金属的低亲和力导致了镉在肌肉中的蓄积量远低于其他组织[61].
图1展示了部分文献报道的三疣梭子蟹各个可食用组织中镉含量的堆积百分比. 可见,在多数报道中,三疣梭子蟹的可食组织被分为棕肉和白肉(肌肉)组织进行检测,且棕肉中镉含量占比显著高于白肉;对于肝胰腺和性腺分开检测的报道较少,仅有的报道显示肝胰腺中镉含量占比远高于性腺和肌肉组织. 综合而言,关于镉在三疣梭子蟹各可食组织中的分布特征,目前较为明确的是肌肉组织的镉含量水平明显低于其他可食组织,尤其是低于棕肉组织和肝胰腺组织;对于肝胰腺组织,较多学者猜测其为三疣梭子蟹的镉主要蓄积组织,但对其单独进行镉含量检测的报道较少,需要后续进行更多的实验和研究;对于性腺组织,有观点认为性腺也可能是三疣梭子蟹中重要的镉蓄积组织,但相关报道太少并不足以支撑此观点,因此后续仍需要学者们对性腺展开相关研究,尤其要针对性腺不同发育时期进行研究.
3. 镉在三疣梭子蟹可食组织中的赋存形态研究进展(The progress of chemical speciation of cadmium in the edible tissues of Portunustri tuberculatus)
重金属在环境中的迁移转化规律及其对生物的毒理学效应,并非取决于重金属的总浓度,而是由其赋存形态的性质决定[60]. 镉在三疣梭子蟹体内的赋存形态可分类为两种,一种是镉与有机物结合形成的有机镉形态,第二种则是镉以游离的无机离子态形式存在[65]. 多数毒理学研究指出,镉的毒性与其存在形态有关,无机游离态镉的毒性较高,有机结合态镉毒性较低[66]. 目前,镉在生物体内具体的赋存形态尚未清晰,针对具有镉蓄积特异性的三疣梭子蟹开展不同镉形态的分析,不仅有助于揭示三疣梭子蟹中镉的蓄积机制,同时也能为不同形态镉在其他生物体内的研究提供探索思路与数据支持.
3.1 不同镉形态的提取方法的研究进展
研究镉的形态,首先需要将不同形态的镉从生物体内提取和分离出来. 因此,选择适当的提取剂是准确测定镉形态的前提条件. 并且提取形态所用的提取剂应能将生物体内不同形态的镉完整而充分地提取且不破坏其原有形态结构. 水生生物中镉形态的研究起步较晚,关于土壤[67 − 69]、陆生植物[70 − 74]、藻类[75 − 76]中的镉形态提取分离模式和方法研究较多,且大多数提取方法是利用连续化学浸提法,即利用不同的提取剂进行分级提取后测定提取剂中的镉. 至于这些提取剂是否会在连续提取的过程中影响和破坏镉的具体化学形态,鲜有报道.
目前,有学者对水生生物中镉形态的提取开展了相关的研究. 先是有学者尝试用碱性酶缓冲液对海豚肝脏进行提取,发现提取到的可溶态镉只占镉总量的45%左右,且这部分镉全部都与蛋白质(非金属硫蛋白)相结合[77]. 除此之外,还有学者尝试用柠檬酸和琥珀酸两种有机酸溶剂提取牡蛎匀浆液中的镉,提取率可达到90.2%—91.8%,但未研究此种提取法是否会对镉形态产生影响[78]. 针对不同的浸提方法,李敏[65]分析了渔用饲料的镉形态,发现有机溶剂环己烷和乙醇无法浸提出饲料中的有机态镉,同时发现较低浓度的盐酸就能使有机态镉发生解离. 也有研究人员对比了不同提取剂的逐级提取效果,田姣姣等[79]对比了Tris-HCl缓冲溶液、HCl(pH值3.5)和碱性蛋白酶3种不同的提取剂对三疣梭子蟹可食用组织中镉形态逐级提取的效果,结果表明Tris-HCl具备较好的提取效果,对肝胰腺、性腺等组织的镉提取率高达90%,但对肌肉组织中的提取率仅为60%,仍有37%的非游离态镉存在,而经碱性蛋白酶处理后可有效溶出.
综上所述,镉形态的提取常用到酸性溶液、有机溶剂以及碱性蛋白酶缓冲液,但这些提取溶液的使用都有可能会引起有机镉形态的破坏,从而影响形态检测的结果. 目前,有研究人员开始使用与生物体生理条件相似的中性Tris-HCI缓冲溶液,以最大程度保证镉的形态在提取过程中不发生变化. 对于镉形态的研究,提取剂的选择固然重要,但目前大部分的镉形态研究仍停留在依赖不同的提取剂将镉形态进行分类后检测其中无机镉含量,未能实现直接检测镉的具体化学形态. 因此,往后对于提取方法的研究应当针对镉的具体化学形态,这对于镉具体化学形态的研究也具有重要意义.
3.2 三疣梭子蟹中无机镉形态的研究现状
国内有关水产品中无机镉的分析研究起步较晚,且所用方法大多为高效液相色谱在线联用电感耦合等离子体质谱法(high performance liquid chromatography-inductively coupled plasma mass spectrometer,HPLC-ICP-MS). 章红等[80]最早建立了水产品中无机镉的测定方法. 他们使用石墨炉原子吸收法(graphite furnace atomic absorption spectrometry, GFAAS),利用盐酸作为浸提液,测定了7种水产品中无机镉的含量. 但此方法并未分析使用盐酸浸提对样品中无机镉离子的提取效果,也没有考虑到是否存在有机镉形态被盐酸破坏转化为无机镉. 随后,赵艳芳等[81]利用Tris-HCl缓冲溶液作为浸提液,借助CG5A阳离子保护柱和CS5A阳离子分析柱对样品中Cd2+分离,建立了HPLC-ICP-MS法测定海水贝中离子态镉的含量. 自此之后,大部分有关于水产品中无机镉离子的检测方法都在此研究基础上做出优化. 如姜芳等[82]同样采用HPLC-ICP-MS法测定了海水贝中无机镉离子含量,通过进一步优化前处理过程及流动相浓度,完善了海水贝中无机镉离子的定性和定量分析方法.
国内有关三疣梭子蟹中无机镉离子的形态研究少之又少. 仅田姣姣[83]和冯瑞雪等[84]对三疣梭子蟹不同组织中的无机镉进行了探究. 在赵艳芳[81]的研究基础上,田姣姣[83]探讨了流动相浓度、pH、流速对HPLC-ICP-MS检测Cd2+的影响规律,建立了三疣梭子蟹各部位离子态镉检测的前处理方法,并且测得的三疣梭子蟹中只有蟹膏部位含有离子态镉,约占蟹膏部位总镉的9.4%. 这说明三疣梭子蟹不同部位镉的赋存形态存在差异. 而在此基础上,冯瑞雪等[84]进一步优化了HPLC-ICP-MS检测离子态镉的方法,探究了经过蒸煮和模拟消化后三疣梭子蟹各部位镉的变化. 发现经过蒸煮加工及模拟消化后,肌肉中Cd2+含量上升,蟹膏、蟹黄中Cd2+含量下降. 他们认为在蒸煮过程中,可能因汁液流失、浓缩效应或在不同部位间存在的迁移转化使样本中Cd2+含量发生变化. 综合来看,针对三疣梭子蟹体内无机镉形态的研究尚处于起步阶段,仍需要后续不断优化和完善提取、检测、定量方法,以便深入地探索三疣梭子蟹体内镉赋存形态的分布特征及蓄积机制,同时也为后续更加科学合理地评估三疣梭子蟹的食用安全风险提供研究数据.
3.3 三疣梭子蟹中有机镉形态的研究现状
研究发现,三疣梭子蟹体内毒性较高的无机镉离子含量占总镉的比例较小,间接地表明了低毒性的有机镉形态在总镉中的占比较大[85]. 目前,分析生物体中有机镉形态最常用的方法是体积排阻色谱(size exclusion chromatography,SEC)与高效液相色谱(HPLC)串联电感耦合等离子体质谱(ICP-MS)联用技术[73, 76, 86 − 87]. 然而,有机镉形态的检测存在着标准物质缺乏的问题,难以对生物体内的有机镉形态进行定性. 为此,有学者尝试将无机镉的标准溶液与其他溶液进行络合,根据镉络合物的保留时间来初步判断镉可能在生物体内存在的形态[73].
在前人的研究基础上,赵艳芳等[8]运用了SEC-HPLC-ICP-MS首次对三疣梭子蟹中的有机镉形态进行分析. 发现三疣梭子蟹肝胰腺组织中的镉主要以金属硫蛋白-镉(metallothionein-Cadmium,MT-Cd)和半胱氨酸-镉(cysteine-Cadmium,Cys-Cd)两种形态存在. 并且,根据总镉量的不同,肝胰腺中有机镉的主要存在形态也有所不同. 而对于肌肉组织,镉主要以Cys-Cd形态存在. 此后,田姣姣等[79]进一步对三疣梭子蟹体内镉赋存形态开展了研究. 他们利用Tris-HCl缓冲液进行提取,结合超滤结合透析的方式,对提取液中不同分子质量镉复合物进行分离测定. 结果显示,分子质量>10 kDa的镉复合物占比最高,可能是MT以外的其它蛋白或多糖、脂类等与镉形成大分子复合物. 这说明三疣梭子蟹在MT所介导的途径之外,可能存在其它的蓄积代谢机制;同时<500 Da的镉组分约占4%—25%,可能是存在离子态镉、氨基酸-镉等小分子镉组分.
目前,三疣梭子蟹体内有机镉形态尚未完全明确,并且有机镉的标准物质缺乏,定性与定量存在困难. 后续需要进一步确定三疣梭子蟹体内有机镉的具体形态,同时确定不同结合态的有机镉的毒性效应和转化机制,对于三疣梭子蟹中无机镉与有机镉的占比问题也值得进行更深入的探索与验证.
无论有机镉还是无机镉,国内外针对三疣梭子蟹中镉的赋存形态分析的研究非常少. 并且,研究镉形态的检测手段、测定方法并不完善,仪器设备的发展水平和镉形态的提取与分离都限制了镉形态分析. 此外,由于缺少镉形态的标准品,无法明确三疣梭子蟹等水产品中镉存在的不同形态及其相关毒理效应[31]. 因此,后续需要对镉形态的定性和定量分析开展进一步的研究,以便更科学地评估不同形态镉的毒性效应,并将研究结论应用于完善相关限量标准.
4. 三疣梭子蟹中镉的人类健康风险评估(Human health risk assessment of cadmium in Portunus trituberculatus)
镉作为一种高危有毒的环境污染物,仅关注其在三疣梭子蟹中的蓄积量不足以评估其对生物体健康的危害风险. 因此,对三疣梭子蟹中的镉进行健康风险评估可以将三疣梭子蟹中镉的膳食摄入量与机体负荷有机联系起来,同时监测镉对人体健康的潜在影响. 人体健康风险评估不单取决于食品中重金属的摄入量,还需要借助各种指标和参数[88]. 目标危害系数(Target hazard quotient, THQ)和靶标癌症风险(Target cancer risk, TCR)是人类健康风险评估最常关注的指标. THQ可以评估通过水产品途径的接触单一重金属的非致癌健康风险[89]. TCR是一种衡量个体在食用水产品期间长期暴露于潜在致癌物而患癌症风险的指标[90]. 除此之外,生物可及性(Bioaccessibility)也常用于评估食品中有毒物质的危害性. 它是指在胃肠消化过程中,营养素或污染物从食物基质中释放溶出并可以被人体吸收的百分比[91]. 考虑到一定比例的重金属不具有生物可及性[92],将生物可及性因素纳入风险计算有助于更全面地进行评估.
目前,有关三疣梭子蟹中镉的人类健康风险评估的研究大多着眼于两个方面. 一方面,研究主要针对不同食用人群进行健康风险评估[93 − 94],年龄、性别和体重是重要的影响因素. 据报道,对于同性别不同年龄段人群,三疣梭子蟹中引起的健康风险趋势表现为年龄越小,健康风险越大;对于同年龄段不同性别人群,三疣梭子蟹中镉引起的健康风险趋势表现为女性大于男性. 有学者认为,因为计算THQ时体重作为分母,低龄人群和女性群体较轻的体重导致了THQ结果较大,因此,低龄儿童和女性群体食用三疣梭子蟹的风险相对较大,并且在食用三疣梭子蟹时需要避免食用过量. 另一方面,针对三疣梭子蟹不同可食组织进行健康风险评估. 对于肌肉组织,有研究指出[49],无论镉暴露浓度的高低(1—50 μg·L−1),肌肉中的THQ值均小于限值1,这说明食用三疣梭子蟹肌肉组织造成的健康风险属于低关注级别. 然而,对于肝胰腺或棕肉组织,常常显示较高的食用风险[27, 30]. 如Yang等[95]分别评估了食用三疣梭子蟹的白肉和棕肉样品的人类健康风险,发现棕肉的非致癌风险(THQ)是白肉的16倍,致癌风险(TCR)是白肉的100倍. 即使经过烹饪后棕肉中镉的含量下降,但THQ仍接近风险限值. Zhao等[27]利用镉的生物可及性浓度计算了三疣梭子蟹组织允许每周消耗量,并由此评估了山东沿海地区三疣梭子蟹的食用安全性,指出在山东的成年人每周食用0.13 kg棕色肉和1.56 kg白肉,对机体不会产生明显的危害,并且不建议食用棕肉,更推荐食用白肉. 此外,有研究指出[95],煮熟后的三疣梭子蟹中的镉浓度有所下降,建议消费者最好只食用熟蟹黄或熟蟹肉,避免食用烹饪螃蟹的汁水或油,以减少镉对人体健康的危害. 综上,对于三疣梭子蟹不同的可食组织,消费者最好少食用或不食用肝胰腺或棕肉,更推荐食用安全性更高的肌肉组织.
关于三疣梭子蟹的人类健康风险评估,后续研究除了可以针对如孕妇、幼童等易受镉污染影响的敏感人群进行研究,还可以针对三疣梭子蟹食用频次和数量较高的沿海居民进行健康风险观察. 另外,野生捕捞和规模养殖的三疣梭子蟹中镉的健康风险尚未见报道. 总而言之,食用三疣梭子蟹作为一种可预见的、可判断的人类膳食摄入镉的途径,研究三疣梭子蟹中镉的人类健康风险有助于相关限量的制定以及对食用量和膳食人群做出推荐.
5. 结论与展望(Conclusion and prospect)
针对三疣梭子蟹中镉的特异性蓄积问题,相关研究大多着眼于三疣梭子蟹不同组织中总镉的含量水平,而有关镉在三疣梭子蟹中的蓄积机制及赋存形态问题的研究仍处于探索阶段. 虽然已经有研究初步检测了三疣梭子蟹不同组织中的镉形态,但受限于镉形态的提取、分离、定性和定量方法的不完善,后续仍需要建立相应的技术方法,以便更好地研究三疣梭子蟹中不同形态镉的具体类型以及各组织中不同形态镉的占比问题,为深入研究三疣梭子蟹中镉的蓄积机制和赋存形态提供技术基础,同时为食用三疣梭子蟹的镉安全性问题提供新的风险评价思路.
基于三疣梭子蟹中镉的蓄积机制及赋存形态尚未明晰的现状,今后可从以下几方面着手进行更深入的研究:①镉在三疣梭子蟹不同组织中的迁移、转化、蓄积以及释放的全过程未有研究,可以开展相关的检测实验,寻找镉在三疣梭子蟹中的变化规律,进而探索镉在三疣梭子蟹体内的蓄积机制,还可为后续标准限量的修订提供科学参考依据. ②为更深入探索镉在三疣梭子蟹中的蓄积机制,也为更加全面评估不同毒性的镉形态对人类健康的影响,三疣梭子蟹各组织中赋存的镉形态研究必不可少. 镉形态标准物缺乏、分离分析方法不完善、仪器设备不够精密等问题,有待后续的学者们持续研究和解决. 建立科学的方法,才能够更清晰地了解三疣梭子蟹中镉的赋存形态及分布规律,最终摸索出三疣梭子蟹对镉的蓄积机制. ③研究三疣梭子蟹中镉的特异性蓄积问题,终是为了能更加准确地评估人们食用三疣梭子蟹的膳食风险. 虽然前人已经进行了相关研究,但考虑到人群和时空的差异,不能仅依靠过往的评估结果进行食用三疣梭子蟹的安全性判断,需要持续对食用三疣梭子蟹进行镉的安全性评估. 在进行评估时,孕妇、幼童等易受镉污染影响的敏感人群以及食用三疣梭子蟹频次和数量较高的沿海居民都是重点研究对象. 此外,还可以进行不同养殖方式、不同食用组织、不同镉赋存形态等方面的健康风险评估,全面分析三疣梭子蟹中镉的膳食风险,保障人们在食用三疣梭子蟹时不受重金属镉的威胁.
-
表 1 不同涂层材料的SPME探针在新污染物分析中的应用
Table 1. Application of SPME fibers with different coating materials in the analysis of new pollutants
涂层材料Coating materials 分析物Analytes 样品Samples 分析仪器Analytical instruments 检出限Detection limit 富集因子Enrichment factors 参考文献References DVB/CAR/PDMS 多氟烷基物质 饮用水、矿泉水、河水 GC-APPI-HRMS 0.02—15 ng·L−1 — [56] COF-NH2 多氟烷基物质 金鱼 UHPLC-MS/MS 0.001—0.25 ng·g−1 — [57] ISP 多氟烷基物质 自来水、河水和废水 MS 0.1—13 ng·L−1 48—491 [58] NH2-ZIF-8 全氟烷基物质 河水、海水、污水 HPLC-MS/MS 0.15—0.75 ng·L−1 8.5—34.9 [30] TH-COF 全氟烷基物质 饮用水、地下水、河水 UPLC-MS/MS 2.0—4.5 pg·L−1 — [36] COF-F-1 全氟烷基物质 环境水 NanoESI-MS 0.02—0.8 ng·L−1 105— 4538 [59] COF-NH-CO-F9 全氟烷基物质 自来水、河水、湖水、池塘水、废水和农田用水 UHPLC-MS/MS 0.0035 —0.18 ng·L−166—160 [40] NH2-UiO-66(Zr)-hp 全氟烷基物质 自来水、池水、河水 HPLC 0.035—0.616 ng·L−1 6.5—48 [60] DVB/CAR/PDMS 邻苯二甲酸盐 瓶装水 GC-MS/MS 0.3—2.6 ng·mL−1 — [61] 分子印迹聚合物 邻苯二甲酸盐 河水 HPLC 0.003 μg·L−1 26.80—76.35 [46] Ppy/MnO2-fGr/[AVIm]NTf2 苯甲酸盐 香水 GC-FID 2.84—6.42 ng·L−1 140—460 [54] PDBA-MXene 邻苯二甲酸酯 果酱 GC-FID 0.10—6.0 ng·g−1 — [62] MWCNT-HMs 邻苯二甲酸酯 茶饮料 GC-MS/MS 0.11—2.6 ng·L−1 118— 2137 [63] FPBA-TAPT COF 邻苯二甲酸酯 自来水和瓶装水 GC-MS 0.018—0.106 μg·L−1 1444 —3116 [64] CC-TPC 邻苯二甲酸酯 矿泉水瓶、塑料快餐容器、食品包装袋和食品保鲜膜 GC-MS 0.027—0.10 ng·g−1 978— 2210 [65] DVB/CAR/PDMS 微/纳米塑料 海水、土壤 GC-MS 0.014 μg·L−1 — [66] 氮掺杂多孔碳N-SPCs 微/纳米塑料 瓶装水 GC-MS 0.0041 —0.0054 μg·L−1— [67] MIL-on-UiO 多氯联苯 湖水、橙汁 GC-FID 0. 2—2 pg· mL−1 3530 —7420 [68] 共价有机骨架TFPB-BD 多氯联苯 水产品 GC-MS/MS 0.07—0.35 ng·L−1 4471 —7488 [37] 3DPGF 多氯联苯 自来水和河水 GC-MS 0.03—0.2 ng·L−1 824— 5716 [69] CF-COF 多氯联苯 地表水 GC-MS 0.0015 —0.0088 ng·L−1699— 4281 [70] Co3O4/NiCo2O4 多氯联苯 绿茶、蜂蜜和瓶装饮用水 GC-FID 0.03—1.5 pg·mL−1 6884 —9765 [71] 新型亚胺 COF 有机氯农药 蔬菜和水果 GC-ECD 0.03—0.3 ng·g−1 — [41] Tp-Azo-COF 有机氯农药 牛奶、绿茶、自来水和井水 GC-MS 0.002—0.08 ng·L−1 1061 —3693 [72] g-C3N4@PC 有机氯农药 水和果汁 GC-MS 0.0141 —0.0942 ng·L−1— [51] NU- 1000 有机氯农药 池水和河水 GC-MS 0.011—0.058 ng·L−1 972— 2255 [73] 碳气凝胶 四环素 牛奶和鸡蛋 HPLC 0.52—1.05 μg·L−1 — [74] MIL-101 四环素 牛奶和鸡蛋 HPLC-UV-vis 0.13—1.16 μg·L−1 62.5—335 [75] 离子液-碳气凝胶 四环素 鸡蛋和废水 HPLC 0.36—0.71 μg·L−1 — [76] MOF-199 抗生素 尿液 HPLC-UV 0.14—0.62 μg·L−1 32—55 [77] 分子印迹聚合物 抗生素 饮用水 ESI-MS 0.003—0.05 ng·g−1 244— 1604 [78] SCWT 抗生素 自来水、河水 ESI-MS 1.8—4.5 ng·L−1 146—548 [79] E-MOF-5 雌激素 牛奶 HPLC 0.17—0.56 ng·mL−1 — [32] HCP-TCRA 雌激素 牛奶 HPLC-MS 0.3—10 ng·mL−1 63.7—78.3 [80] TpBD-COF 四溴双酚A 自来水、河水,海水 AMS 0.92ng·L−1 185 [81] PDMS/DVB 四溴双酚A和六溴环十二烷 自来水 LC-MS/MS 0.01—0.04 ng·mL−1 28—96 [82] MON-NH2 酚类内分泌干扰物 婴儿奶嘴 GC-MS/MS 0.005 μg·L−1 — [83] 分子印迹聚合物 酚类内分泌干扰物 牛奶和酸奶 HPLC-DAD 0.33 μg·L−1 99.60—133.16 [45] 离子液体 酚类内分泌干扰物 河水 HPLC-UV 0.01—0.04 ng·mL−1 1382 —4779 [53] “—”代表该参考文献没有提供富集因子. -
[1] 吴颖娟, 王龙, 李志梅, 等. 新污染物以及其在水环境中的检测技术综述[J]. 广东化工, 2024, 51(16): 128-131,147. doi: 10.3969/j.issn.1007-1865.2024.016.041 WU Y J, WANG L, LI Z M, et al. Review of New Pollutants and Detection of New Pollutants in Water[J]. Guangdong Chemical Industry, 2024, 51(16): 128-131,147 (in Chinese). doi: 10.3969/j.issn.1007-1865.2024.016.041
[2] 李上, 李雁宾. 水环境优控污染物筛选研究进展[J]. 环境化学, 2024, 43(6): 1966-1979. doi: 10.7524/j.issn.0254-6108.2023120604 LI S, LI Y B. Research progress on screening priority pollutants in aquatic environments[J]. Environmental Chemistry[J]. Environmental Chemistry, 2024, 43(6): 1966-1979 (in Chinese). doi: 10.7524/j.issn.0254-6108.2023120604
[3] 生态环境部. 《新污染物生态环境监测标准体系表(2024年版)》[S]. 北京: 中国标准出版社, 2024. Ministry of Ecology and Environment. Table of New Pollutant Ecological Environment Monitoring Standard System (2024 edition) [S]. Beijing: Standards Press of China, 2024 (in Chinese).
[4] 刘悦, 王惠琴, 张雨苗, 等. 表面增强拉曼光谱技术在水环境污染物检测中的研究进展[J]. 环境化学, 2025, 44(3): 217-228. doi: 10.7524/j.issn.0254-6108.2014.02.020 LIU Y, WANG H Q, ZHANG Y M, et al. Research progress of surface-enhanced Raman spectroscopy in the detection of water environmental pollutants[J]. Environmental Chemistry, 2025, 44(3): 217-228 (in Chinese). doi: 10.7524/j.issn.0254-6108.2014.02.020
[5] 高歌, 张文晴, 魏歆倪, 等. 新型优先管控污染物筛选研究进展[J]. 中国环境科学, 2024, 44(11): 6472-6483. GAO G, ZHANG W Q, WEI X N, et al. Research Progress on Screening of Emerging Priority Controlled Contaminants[J]. China Environmental Science,2024, 44(11): 6472-6483 (in Chinese).
[6] 中共中央国务院. 《新污染物治理行动方案》[EB/OL]. (2022-05-04) [2024-10-20] General Office of the State Council. Action programme on emerging contaminants [EB/OL]. (2022-05-04) [2024-10-20]
[7] 钱慧敏, 刘艳娜, 姚林林, 等. 非靶标技术在新污染物识别中的应用[J]. 环境化学, 2024, 43(2): 363-376. doi: 10.7524/j.issn.0254-6108.2023021603 QIAN H M, LIU Y N, YAO L L, et al. Recent advances in nontarget discovery of emerging pollutants in the environment[J]. Environmental Chemistry, 2024, 43(2): 363-376 (in Chinese). doi: 10.7524/j.issn.0254-6108.2023021603
[8] 王燕飞, 蒋京呈, 林军. 新污染物的调查监测需求分析[J]. 生态毒理学报, 2023, 18(2): 23-32. doi: 10.7524/AJE.1673-5897.20221108003 WANG Y F, JIANG J C, LIN J. Analysis on investigation and monitoring requirements of new pollutants[J]. Asian Journal of Ecotoxicology, 2023, 18(2): 23-32 (in Chinese). doi: 10.7524/AJE.1673-5897.20221108003
[9] 张桂成, 孙军. 渤海环境污染现状及研究进展[J]. 环境化学, 2023, 42(3): 918-930. doi: 10.7524/j.issn.0254-6108.2022101805 ZHANG G C, SUN J. State of environmental pollution in the Bohai Sea, China: A review[J]. Environmental Chemistry, 2023, 42(3): 918-930 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022101805
[10] 何晓杰, 李菊英. 环境中微/纳塑料的定量追踪与检测技术研究进展[J]. 分析测试学报, 2024, 43(8): 1135-1143. doi: 10.12452/j.fxcsxb.24053094 HE X J, LI J Y. Recent advances in quantitative tracking and detection technologies for micro/nano plastics in the environment[J]. Journal of Instrumental Analysis, 2024, 43(8): 1135-1143 (in Chinese). doi: 10.12452/j.fxcsxb.24053094
[11] 赵淑莉, 陈少坤, 于秀豪, 等. 美丽中国建设过程中重点关注的新污染物监测研究[J]. 中国环境科学, 2024, 44(8): 4576-4587. doi: 10.3969/j.issn.1000-6923.2024.08.042 ZHAO S L, CHEN S K, YU X H, et al. Study on monitoring widespread concerned emerging contaminants under the construction of the Beautiful China[J]. China Environmental Science, 2024, 44(8): 4576-4587 (in Chinese). doi: 10.3969/j.issn.1000-6923.2024.08.042
[12] 张秦铭, 和莹, 王蕾, 等. 液相微萃取技术在环境水体新污染物检测中的研究进展[J]. 中国环境科学, 2024, 44(12): 6949-6961. ZHANG Q M, HE Y, WANG L, et al. Research Progress of Liquid Phase Microextraction in Analysis of New Pollutants in Environmental Water[J]. China Environmental Science, 2024,44(12): 6949-6961 (in Chinese ).
[13] LI C Y, LV S W, YANG L, et al. Facile preparation of uniform-sized covalent organic framework nanoflowers as versatile sample-pretreatment platforms for sensitive and specific determination of hazardous substances[J]. Journal of Hazardous Materials, 2022, 438: 129566. doi: 10.1016/j.jhazmat.2022.129566 [14] ZHENG J, KUANG Y X, ZHOU S X, et al. Latest improvements and expanding applications of solid-phase microextraction[J]. Analytical Chemistry, 2023, 95(1): 218-237. doi: 10.1021/acs.analchem.2c03246 [15] ARTHUR CL, PAWLISZYN J. Solid-Phase microextraction with thermal-desorption using fused-silica optical fibers[J]. Analytical Chemistry, 1990, 10,62(19): 2145-2148. [16] LORD H, PAWLISZYN J. Evolution of solid-phase microextraction technology[J]. Journal of Chromatography A, 2000, 885(1/2): 153-193. [17] PIRI-MOGHADAM H, ALAM M N, PAWLISZYN J. Review of geometries and coating materials in solid phase microextraction: Opportunities, limitations, and future perspectives[J]. Analytica Chimica Acta, 2017, 984: 42-65. doi: 10.1016/j.aca.2017.05.035 [18] HASEGAWA T. Physicochemical nature of perfluoroalkyl compounds induced by fluorine[J]. The Chemical Record, 2017, 17(10): 903-917. doi: 10.1002/tcr.201700018 [19] XU B L, LIU F, Brookes P C, et al. Microplastics play a minor role in tetracycline sorption in the presence of dissolved organic matter[J]. Environmental Pollution, 2018, 240: 87-94. doi: 10.1016/j.envpol.2018.04.113 [20] LI A J, WANG F B, TAO L, et al. Rapid and simultaneous determination of multiple endocrine-disrupting chemicals and their metabolites in human serum and urine samples[J]. Talanta, 2022, 248: 123639. doi: 10.1016/j.talanta.2022.123639 [21] OUYANG G F, PAWLISZYN J. A critical review in calibration methods for solid-phase microextraction[J]. Analytica Chimica Acta, 2008, 627(2): 184-197. doi: 10.1016/j.aca.2008.08.015 [22] EVANS J D, GARAI B, REINSCH H, et al. Metal–organic frameworks in Germany: From synthesis to function[J]. Coordination Chemistry Reviews, 2019, 380: 378-418. doi: 10.1016/j.ccr.2018.10.002 [23] ZHENG J, CHEN L Y, KUANG Y X, et al. Universal strategy for metal-organic framework growth: From cascading-functional films to MOF-on-MOFs[J]. Small, 2024, 20(34): e2307976. doi: 10.1002/smll.202307976 [24] 徐寅祺, 顾政, 陶海升. MOFs表面修饰的电化学传感器在酚类污染物检测中的应用综述[J]. 环境化学, 2022, 41(9): 3094-3105. doi: 10.7524/j.issn.0254-6108.2021051602 XU Y Q, GU Z, TAO H S. Review of sensors based on MOFs-modified on the surface of bare electrodes for the detection of phenolic pollutants[J]. Environmental Chemistry, 2022, 41(9): 3094-3105 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021051602
[25] WANG X M, WANG F B, JI H, et al. ZIF-67 derived hollow nanomaterials as solid phase microextraction coatings for rapid capture of polycyclic aromatic hydrocarbons from water samples[J]. Environmental Science: Nano, 2021, 8(3): 675-686. doi: 10.1039/D0EN01176B [26] WANG D Y, YAO H C, YE J S, et al. Metal-organic frameworks (MOFs): Classification, synthesis, modification, and biomedical applications[J]. Small, 2024: e2404350. [27] HAYAT A, RAUF S, AL ALWAN B, et al. Recent advance in MOFs and MOF-based composites: Synthesis, properties, and applications[J]. Materials Today Energy, 2024, 41: 101542. doi: 10.1016/j.mtener.2024.101542 [28] KAMALABADI M, MADRAKIAN T, AFKHAMI A, et al. Crystal violet-modified HKUST-1 framework with improved hydrostability as an efficient adsorbent for direct solid-phase microextraction[J]. Microchimica Acta, 2021, 188(9): 305. doi: 10.1007/s00604-021-04966-z [29] ROCÍO-BAUTISTA P, PACHECO-FERNÁNDEZ I, PASÁN J, et al. Are metal-organic frameworks able to provide a new generation of solid-phase microextraction coatings?- A review[J]. Analytica Chimica Acta, 2016, 939: 26-41. doi: 10.1016/j.aca.2016.07.047 [30] GONG X Y, XU L Y, KOU X X, et al. Amino-functionalized metal–organic frameworks for efficient solid-phase microextraction of perfluoroalkyl acids in environmental water[J]. Microchemical Journal, 2022, 179: 107661. doi: 10.1016/j.microc.2022.107661 [31] MONDAL S, XU J Q, CHEN G S, et al. Solid-phase microextraction of antibiotics from fish muscle by using MIL-101(Cr)NH2-polyacrylonitrile fiber and their identification by liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2019, 1047: 62-70. doi: 10.1016/j.aca.2018.09.060 [32] LAN H Z, PAN D D, SUN Y Y, et al. Thin metal organic frameworks coatings by cathodic electrodeposition for solid-phase microextraction and analysis of trace exogenous estrogens in milk[J]. Analytica Chimica Acta, 2016, 937: 53-60. doi: 10.1016/j.aca.2016.07.041 [33] LI N, DU J J, WU D, et al. Recent advances in facile synthesis and applications of covalent organic framework materials as superior adsorbents in sample pretreatment[J]. TrAC Trends in Analytical Chemistry, 2018, 108: 154-166. doi: 10.1016/j.trac.2018.08.025 [34] ZHOU S X, KUANG Y X, SHI Y R, et al. Modulated covalent organic frameworks with higher specific surface area for the ultrasensitive detection of polybrominated biphenyls[J]. Chemical Engineering Journal, 2023, 453: 139743. doi: 10.1016/j.cej.2022.139743 [35] FENG J J, FENG J Q, JI X P, et al. Recent advances of covalent organic frameworks for solid-phase microextraction[J]. TrAC Trends in Analytical Chemistry, 2021, 137: 116208. doi: 10.1016/j.trac.2021.116208 [36] JI W H, GUO Y S, XIE H M, et al. Rapid microwave synthesis of dioxin-linked covalent organic framework for efficient micro-extraction of perfluorinated alkyl substances from water[J]. Journal of Hazardous Materials, 2020, 397: 122793. doi: 10.1016/j.jhazmat.2020.122793 [37] GUO J X, QIAN H L, ZHAO X, et al. In situ room-temperature fabrication of a covalent organic framework and its bonded fiber for solid-phase microextraction of polychlorinated biphenyls in aquatic products[J]. Journal of Materials Chemistry A, 2019, 7(21): 13249-13255. doi: 10.1039/C9TA02974E [38] 刘煦, 杨田, 雷秋霞, 等. 全氟和多氟烷基化合物去除进展[J]. 环境化学, 2024, 43(8): 2517-2538. LIU X, YANG T, LEI Q X, et al. Advances in removal of per- and polyfluoroalkyl substances[J]. Environmental Chemistry, 2024, 43(8): 2517-2538 (in Chinese).
[39] HUANG J L, SHI Y R, HUANG G, et al. Facile synthesis of a fluorinated-squaramide covalent organic framework for the highly efficient and broad-spectrum removal of per- and polyfluoroalkyl pollutants[J]. Angewandte Chemie (International Ed), 2022, 61(31): e202206749. doi: 10.1002/anie.202206749 [40] SONG C C, ZHENG J, ZHANG Q D, et al. Multifunctionalized covalent organic frameworks for broad-spectrum extraction and ultrasensitive analysis of per- and polyfluoroalkyl substances[J]. Analytical Chemistry, 2023, 95(19): 7770-7778. doi: 10.1021/acs.analchem.3c01137 [41] LI J, WANG Z, LI J Q, et al. Novel N-riched covalent organic framework for solid-phase microextraction of organochlorine pesticides in vegetable and fruit samples[J]. Food Chemistry, 2022, 388: 133007. doi: 10.1016/j.foodchem.2022.133007 [42] SHAHHOSEINI F, AZIZI A, BOTTARO C S. A critical evaluation of molecularly imprinted polymer (MIP) coatings in solid phase microextraction devices[J]. TrAC Trends in Analytical Chemistry, 2022, 156: 116695. doi: 10.1016/j.trac.2022.116695 [43] BELBRUNO J J. Molecularly imprinted polymers[J]. Chemical Reviews, 2019, 119(1): 94-119. doi: 10.1021/acs.chemrev.8b00171 [44] 叶洪, 赖浩宇, 高博, 等. 分子印迹固相微萃取-超高效液相色谱串联质谱法检测肉牛体内三种苯二氮类药物[J]. 农产品加工, 2024(11): 70-76. YE H, LAI H Y, GAO B, et al. Determination of three benzodiazepines in beef cattles by molecularly imprinted polymers-solid phase micro extraction: Ultra performance liquid chromatography-tandem mass spectrometry[J]. Farm Products Processing, 2024(11): 70-76 (in Chinese).
[45] ZHOU Q Q, DUAN Y L, XU Z G, et al. A molecularly imprinted fiber array solid-phase microextraction strategy for simultaneous detection of multiple estrogens[J]. Journal of Materials Chemistry. B, 2023, 11(22): 4991-4999. doi: 10.1039/D3TB00555K [46] XU S F, ZHANG X L, XU Z G, et al. Exposure and risk assessment of phthalates in environmental water using a three-template molecularly imprinted fiber array strategy[J]. Journal of Hazardous Materials, 2024, 461: 132491. doi: 10.1016/j.jhazmat.2023.132491 [47] ZHENG J, CHEN L Y, XIE X T, et al. Polydopamine modified ordered mesoporous carbon for synergistic enhancement of enrichment efficiency and mass transfer towards phenols[J]. Analytica Chimica Acta, 2020, 1095: 109-117. doi: 10.1016/j.aca.2019.10.036 [48] KUANG Y X, XIE X T, ZHOU S X, et al. Customized oxygen-rich biochar with ultrahigh microporosity for ideal solid phase microextraction of substituted benzenes[J]. Science of the Total Environment, 2023, 870: 161840. doi: 10.1016/j.scitotenv.2023.161840 [49] KHATAEI M M, YAMINI Y, GHAEMMAGHAMI M. Reduced graphene-decorated covalent organic framework as a novel coating for solid-phase microextraction of phthalate esters coupled to gas chromatography-mass spectrometry[J]. Microchimica Acta, 2020, 187(4): 256. doi: 10.1007/s00604-020-4224-9 [50] ZANG X H, CHANG Q Y, PANG Y C, et al. Solid-phase microextraction of eleven organochlorine pesticides from fruit and vegetable samples by a coated fiber with boron nitride modified multiwalled carbon nanotubes[J]. Food Chemistry, 2021, 359: 129984. doi: 10.1016/j.foodchem.2021.129984 [51] LI H M, DONG P L, LONG A Y, et al. Cellulose nanocrystals induced loose and porous graphite phase carbon nitride/porous carbon composites for capturing and determining of organochlorine pesticides from water and fruit juice by solid-phase microextraction[J]. Polymers, 2023, 15(9): 2218. doi: 10.3390/polym15092218 [52] PATINHA D J S, SILVESTRE A J D, MARRUCHO I M. Poly(ionic liquids) in solid phase microextraction: Recent advances and perspectives[J]. Progress in Polymer Science, 2019, 98: 101148. doi: 10.1016/j.progpolymsci.2019.101148 [53] CUI M Y, QIU J X, LI Z H, et al. An etched stainless steel wire/ionic liquid-solid phase microextraction technique for the determination of alkylphenols in river water[J]. Talanta, 2015, 132: 564-571. doi: 10.1016/j.talanta.2014.09.012 [54] DU J, ZHAO F Q, ZENG B Z. Preparation of functionalized graphene and ionic liquid Co-doped polypyrrole solid phase microextraction coating for the detection of benzoates preservatives[J]. Talanta, 2021, 228: 122231. doi: 10.1016/j.talanta.2021.122231 [55] NASCIMENTO L E S, THAPA B, DA SILVA OLIVEIRA W, et al. Multivariate optimization for extraction of 2-methylimidazole and 4-methylimidazole from açaí-based food products using polymeric ionic liquid-based sorbent coatings in solid-phase microextraction coupled to gas chromatography–mass spectrometry[J]. Food Chemistry, 2024, 444: 138593. doi: 10.1016/j.foodchem.2024.138593 [56] AYALA-CABRERA J F, CONTRERAS-LLIN A, MOYANO E, et al. A novel methodology for the determination of neutral perfluoroalkyl and polyfluoroalkyl substances in water by gas chromatography-atmospheric pressure photoionisation-high resolution mass spectrometry[J]. Analytica Chimica Acta, 2020, 1100: 97-106. doi: 10.1016/j.aca.2019.12.004 [57] SONG X, WANG R Y, WANG X, et al. An amine-functionalized olefin-linked covalent organic framework used for the solid-phase microextraction of legacy and emerging per- and polyfluoroalkyl substances in fish[J]. Journal of Hazardous Materials, 2022, 423: 127226. doi: 10.1016/j.jhazmat.2021.127226 [58] ZHONG C F, DENG J W, YANG Y Y, et al. Rapid and sensitive determination of legacy and emerging per- and poly-fluoroalkyl substances with solid-phase microextraction probe coupled with mass spectrometry[J]. Talanta, 2024, 276: 126233. doi: 10.1016/j.talanta.2024.126233 [59] HOU Y J, DENG J W, HE K L, et al. Covalent organic frameworks-based solid-phase microextraction probe for rapid and ultrasensitive analysis of trace per- and polyfluoroalkyl substances using mass spectrometry[J]. Analytical Chemistry, 2020, 92(15): 10213-10217. doi: 10.1021/acs.analchem.0c01829 [60] OUYANG S, LIU G F, PENG S, et al. Superficially capped amino metal-organic framework for efficient solid-phase microextraction of perfluorinated alkyl substances[J]. Journal of Chromatography A, 2022, 1669: 462959. doi: 10.1016/j.chroma.2022.462959 [61] ALSHEHRI M M, ALI OULADSMANE M, ALI AOUAK T, et al. Determination of phthalates in bottled waters using solid-phase microextraction and gas chromatography tandem mass spectrometry[J]. Chemosphere, 2022, 304: 135214. doi: 10.1016/j.chemosphere.2022.135214 [62] LIU S, LI Y H, ZANG X H, et al. Phenylenediboronic acid-intercalated MXene-based adsorbent for solid-phase microextraction of phthalate esters in jams[J]. Microchemical Journal, 2024, 200: 110446. doi: 10.1016/j.microc.2024.110446 [63] SONG X L, LIU Y Q, HE F Y, et al. Facile fabrication of carbon nanotube hollow microspheres as a fiber coating for ultrasensitive solid-phase microextraction of phthalic acid esters in tea beverages[J]. Analytical Methods, 2024, 16(3): 420-426. doi: 10.1039/D3AY01943H [64] 张莹, 赵金凤, 费哲奇, 等. 共价有机框架衍生多孔碳固相微萃取纤维结合气相色谱法测定水样中的邻苯二甲酸酯[J]. 高等学校化学学报, 2024, 45(8): 34-43. doi: 10.7503/cjcu20240137 ZHANG Y, ZHAO J F, FEI Z Q, et al. Determination of phthalates in water by covalent organic framework derived porous carbon solid phase microextraction fiber combined with gas chromatography[J]. Chemical Journal of Chinese Universities, 2024, 45(8): 34-43 (in Chinese). doi: 10.7503/cjcu20240137
[65] WANG Z, ZHANG X Y, YANG Q, et al. Covalent triazine-based frameworks for efficient solid-phase microextraction of phthalic acid esters from food-contacted plastics[J]. Journal of Chromatography A, 2022, 1681: 463474. doi: 10.1016/j.chroma.2022.463474 [66] XU S R, LI H M, XIAO L, et al. Quantitative determination of poly(methyl methacrylate) micro/nanoplastics by cooling-assisted solid-phase microextraction coupled to gas chromatography-mass spectrometry: Theoretical and experimental insights[J]. Analytical Chemistry, 2024, 96(5): 2227-2235. doi: 10.1021/acs.analchem.3c05316 [67] XU S R, LI H M, XIAO L, et al. Monitoring Poly(methyl methacrylate) and Polyvinyl Dichloride Micro/Nanoplastics in Water by Direct Solid-Phase Microextraction Coupled to Gas Chromatography-Mass Spectrometry[J]. Analytical Chemistry, 2024, 96(26): 10772-10779. doi: 10.1021/acs.analchem.4c01900 [68] MU M Y, ZHU S P, GAO Y M, et al. Efficient enrichment and sensitive detection of polychlorinated biphenyls using nanoflower MIL-on-UiO as solid-phase microextraction fiber coating[J]. Food Chemistry, 2024, 459: 140276. doi: 10.1016/j.foodchem.2024.140276 [69] YU J Y, JIANG X, LU Z H, et al. In situ self-assembly of three-dimensional porous graphene film on zinc fiber for solid-phase microextraction of polychlorinated biphenyls[J]. Analytical and Bioanalytical Chemistry, 2022, 414(18): 5585-5594. doi: 10.1007/s00216-022-04003-9 [70] SU L S, ZHANG N, TANG J P, et al. In-situ fabrication of a chlorine-functionalized covalent organic framework coating for solid-phase microextraction of polychlorinated biphenyls in surface water[J]. Analytica Chimica Acta, 2021, 1186: 339120. doi: 10.1016/j.aca.2021.339120 [71] ZHU S P, LOU X J, ZHU J W, et al. Ultra-stable Co3O4/NiCo2O4 double-shelled hollow nanocages as headspace solid-phase microextraction coating for enhanced capture of polychlorinated biphenyls[J]. Chemical Engineering Journal, 2024, 488: 150876. doi: 10.1016/j.cej.2024.150876 [72] XIN J H, XU G J, ZHOU Y R, et al. Ketoenamine covalent organic framework coating for efficient solid-phase microextraction of trace organochlorine pesticides[J]. Journal of Agricultural and Food Chemistry, 2021, 69(28): 8008-8016. doi: 10.1021/acs.jafc.1c02895 [73] GONG X Y, XU L Y, HUANG S M, et al. Application of the NU-1000 coated SPME fiber on analysis of trace organochlorine pesticides in water[J]. Analytica Chimica Acta, 2022, 1218: 339982. doi: 10.1016/j.aca.2022.339982 [74] DONG Z M, CHENG L, SUN T, et al. Carbon aerogel as a solid-phase microextraction fiber coating for the extraction and detection of trace tetracycline residues in food by coupling with high-performance liquid chromatography[J]. Analytical Methods, 2021, 13(3): 381-389. doi: 10.1039/D0AY02140G [75] DONG Z M, GUO Y Q, QIN L M, et al. Organic aerogels embedded in triple-shelled hollow MIL-101 as fiber coating for optimizing the solid-phase microextraction performances of tetracyclines in egg and milk samples[J]. Microchemical Journal, 2024, 199: 110005. doi: 10.1016/j.microc.2024.110005 [76] DONG Z M, CHENG L, SUN T, et al. Carboxylation modified meso-porous carbon aerogel templated by ionic liquid for solid-phase microextraction of trace tetracyclines residues using HPLC with UV detection[J]. Microchimica Acta, 2021, 188(2): 43. doi: 10.1007/s00604-021-04707-2 [77] NIAZIPOUR S, RAOOF J B, GHANI M. Template-directed synthesis of three-dimensional metal organic framework 199-derived highly porous copper nano-foam fiber for solid-phase microextraction of some antibiotics prior to their quantification by High performance liquid chromatography[J]. Journal of Chromatography A, 2021, 1660: 462677. doi: 10.1016/j.chroma.2021.462677 [78] LIU Y H, YANG Q X, CHEN X T, et al. Sensitive analysis of trace macrolide antibiotics in complex food samples by ambient mass spectrometry with molecularly imprinted polymer-coated wooden tips[J]. Talanta, 2019, 204: 238-247. doi: 10.1016/j.talanta.2019.05.102 [79] DENG J W, YU T T, YAO Y, et al. Surface-coated wooden-tip electrospray ionization mass spectrometry for determination of trace fluoroquinolone and macrolide antibiotics in water[J]. Analytica Chimica Acta, 2017, 954: 52-59. doi: 10.1016/j.aca.2016.12.008 [80] LIAO T, JIA J, TONG K, et al. Determination of synthetic estrogens in milk by a novel hyper-crosslinked polymer SPME coupled with HPLC-MS[J]. Microchemical Journal, 2022, 181: 107700. doi: 10.1016/j.microc.2022.107700 [81] GAO W, TIAN Y, LIU H, et al. Ultrasensitive determination of tetrabromobisphenol A by covalent organic framework based solid phase microextraction coupled with constant flow desorption ionization mass spectrometry[J]. Analytical Chemistry, 2019, 91(1): 772-775. doi: 10.1021/acs.analchem.8b04884 [82] YU Y J, ZHU X H, ZHU J Y, et al. Rapid and simultaneous analysis of tetrabromobisphenol A and hexabromocyclododecane in water by direct immersion solid phase microextraction: Uniform design to explore factors[J]. Ecotoxicology and Environmental Safety, 2019, 176: 364-369. doi: 10.1016/j.ecoenv.2019.03.104 [83] LI S H, BIAN L L, YANG C X, et al. Migration study of phenolic endocrine disruptors from pacifiers to saliva simulant by solid phase microextraction with amino-functionalized microporous organic network coated fiber[J]. Journal of Hazardous Materials, 2022, 438: 129505. doi: 10.1016/j.jhazmat.2022.129505 [84] OLCER Y A, TASCON M, EROGLU A E, et al. Thin film microextraction: Towards faster and more sensitive microextraction[J]. TrAC Trends in Analytical Chemistry, 2019, 113: 93-101. doi: 10.1016/j.trac.2019.01.022 [85] SEIDI S, TAJIK M, BAHARFAR M, et al. Micro solid-phase extraction (pipette tip and spin column) and thin film solid-phase microextraction: Miniaturized concepts for chromatographic analysis[J]. TrAC Trends in Analytical Chemistry, 2019, 118: 810-827. doi: 10.1016/j.trac.2019.06.036 [86] CHEN X L, LIU S Q, JIANG R F, et al. Rapid detection and speciation of illicit drugs via a thin-film microextraction approach for wastewater-based epidemiology study[J]. Science of the Total Environment, 2022, 842: 156888. doi: 10.1016/j.scitotenv.2022.156888 [87] RICKERT D A, SINGH V, THIRUKUMARAN M, et al. Comprehensive analysis of multiresidue pesticides from process water obtained from wastewater treatment facilities using solid-phase microextraction[J]. Environmental Science & Technology, 2020, 54(24): 15789-15799. [88] SERESHTI H, MOUSAVI RAD N. Bacterial cellulose-supported dual-layered nanofibrous adsorbent for thin-film micro-solid-phase extraction of antibiotics in municipal wastewaters[J]. Talanta, 2024, 276: 126198. doi: 10.1016/j.talanta.2024.126198 [89] KATAOKA H. In-tube solid-phase microextraction: Current trends and future perspectives[J]. Journal of Chromatography A, 2021, 1636: 461787. doi: 10.1016/j.chroma.2020.461787 [90] COSTA QUEIROZ M E, DONIZETI DE SOUZA I, MARCHIONI C. Current advances and applications of in-tube solid-phase microextraction[J]. TrAC Trends in Analytical Chemistry, 2019, 111: 261-278. doi: 10.1016/j.trac.2018.12.018 [91] ZHANG J H, CHEN Y H, NI M L, et al. A novel halloysite nanotubes-based hybrid monolith for in-tube solid-phase microextraction of polar cationic pesticides[J]. Food Chemistry, 2024, 458: 140205. doi: 10.1016/j.foodchem.2024.140205 [92] SUN M X, FENG J J, FENG J Q, et al. Biochar nanosphere- and covalent organic framework nanosphere-functionalized titanium dioxide nanorod arrays on carbon fibers for solid-phase microextraction of organic pollutants[J]. Chemical Engineering Journal, 2022, 433: 133645. doi: 10.1016/j.cej.2021.133645 [93] PANG J L, CHEN H Z, GUO H G, et al. High-sensitive determination of tetracycline antibiotics adsorbed on microplastics in mariculture water using pre-COF/monolith composite-based in-tube solid phase microextraction on-line coupled to HPLC-MS/MS[J]. Journal of Hazardous Materials, 2024, 469: 133768. doi: 10.1016/j.jhazmat.2024.133768 [94] MEI M, HUANG X J, LUO Q, et al. Magnetism-enhanced monolith-based in-tube solid phase microextraction[J]. Analytical Chemistry, 2016, 88(3): 1900-1907. doi: 10.1021/acs.analchem.5b04328 [95] CHENG L D, PAN S H, DING C Y, et al. Dispersive solid-phase microextraction with graphene oxide based molecularly imprinted polymers for determining bis(2-ethylhexyl) phthalate in environmental water[J]. Journal of Chromatography A, 2017, 1511: 85-91. doi: 10.1016/j.chroma.2017.07.012 [96] HU Y X, SU L Y, WANG S, et al. A ratiometric electrochemiluminescent tetracycline assay based on the combined use of carbon nanodots, Ru(bpy)32+, and magnetic solid phase microextraction. Microchimica Acta, 2019, 186(8): 512. [97] VIñAS P, PASTOR-BELDA M, TORRES A, et al. Use of oleic-acid functionalized nanoparticles for the magnetic solid-phase microextraction of alkylphenols in fruit juices using liquid chromatography-tandem mass spectrometry[J]. Talanta, 2016, 151: 217-223. doi: 10.1016/j.talanta.2016.01.039 [98] GHORBANI M, AGHAMOHAMMADHASSAN M, CHAMSAZ M, et al. Dispersive solid phase microextraction[J]. TrAC Trends in Analytical Chemistry, 2019, 118: 793-809. doi: 10.1016/j.trac.2019.07.012 [99] HUANG Y M, LU M, CHEN L, et al. Development of solid-phase microextraction with multiple interactions-based monolithic fibers for the sensitive determination of perfluoroalkyl phosphonic acids in water and vegetable samples[J]. Talanta, 2020, 206: 120198. doi: 10.1016/j.talanta.2019.120198 [100] CHEN H, WANG J, ZHANG W M, et al. In situ rapid electrochemical fabrication of porphyrin-based covalent organic frameworks: Novel fibers for electro-enhanced solid-phase microextraction[J]. ACS Applied Materials & Interfaces, 2023, 15(9): 12453-12461. [101] POURSHAMSI T, AMRI F, ABNIKI M. A comprehensive review on application of the syringe in liquid- and solid-phase microextraction methods[J]. Journal of the Iranian Chemical Society, 2021, 18(2): 245-264. doi: 10.1007/s13738-020-02025-7 [102] DA SILVA L F, VARGAS MEDINA D A, LANçAS F M. Automated needle-sleeve based online hyphenation of solid-phase microextraction and liquid chromatography[J]. Talanta, 2021, 221: 121608. doi: 10.1016/j.talanta.2020.121608 期刊类型引用(2)
1. 马煜萱,包峻松,洪坤钰,金军,陈坦,刘颖,杨婷,张冰. 春灌期阅海水体的氮磷分布特征及富营养化趋势. 科学技术与工程. 2025(02): 850-861 .  百度学术
百度学术
2. 孙方圆,周昌林,谈云志,刘杨,杨杰. 耐水低磷氟溶出相变磷石膏砌块的制备及应用. 高分子材料科学与工程. 2024(10): 46-56 .  百度学术
百度学术
其他类型引用(1)
-






 DownLoad:
DownLoad: