-
2022年全球塑料总量达4亿吨,同比增长约600万吨,其中90.6%为化石基塑料,仅有不到9%被机械、化学等回收利用,大量垃圾被最终填埋或因管理不善等各种原因排放到环境中[1]. 自20世纪70年代,首次在水生环境中发现塑料垃圾以来[2],已陆续在世界各地的空气[3]、海洋[4]、土壤[5]和地表水[6],甚至在北极与深海[1,7]等人类活动稀少的偏远地区都检测到NPs的存在. 在风化的长期影响与紫外线辐射(UV)以及其他环境因素[8]的作用下,环境中的塑料垃圾可降解成小于5 mm的微塑料(MPs)和100 nm纳米塑料(NPs)[9]. 并通过吸入、摄入,特别是食物链的方式进入人体,在人类粪便中检测到的NPs也为其提供了进一步的证据[10]. MPs、NPs可通过诱导氧化压力或内质网压力等进入不同生物体内,影响生殖系统、消化系统、神经系统等不同身体系统,造成胃肠道毒性、肝脏毒性、生殖毒性、神经毒性和关节毒性等多方面毒性[11]. 由于NPs尺寸较小,比表面积较大,且细胞亲和性高于MPs,更易穿过生物屏障进入血液、细胞、组织和器官,对生物造成更严重的危害[12].
近年来,已有研究关注NPs在胃肠道当中的毒性. 在细胞水平上,Li等研究发现,暴露于聚苯乙烯纳米塑料会改变肠道微生物群的组成,从而诱发菌群失调,引发肠道炎症反应[13];Mahler等[14]研究则集中探讨了口服聚苯乙烯纳米粒子对肠上皮细胞体外模型和鸡肠环体内模型中的铁吸收和铁运输的影响,发现暴露于高剂量纳米颗粒的肠道细胞显示出铁转运增加,而急性暴露于羧化颗粒(直径50 nm)的鸡比未暴露或长期暴露的鸡具有更低的铁吸收率. 在分子水平上,研究主要关注纳米粒子的毒性机制,包括氧化应激、脂质代谢失调、能量代谢异常、以及由此引发的炎症反应和细胞凋亡[15],Hu等[16]发现,摄入聚苯乙烯微塑料会增加炎症和氧化应激相关基因的表达,从而诱导哺乳动物细胞炎症和氧化应激增加. 塑料毒性效应与纳米粒子的粒径、比表面积和形态等物理化学特性密切相关. 当食物基质参与其中,不同分子与胶体物质会与NPs表面相互作用[17],产生生物电晕,对NPs的结构、电荷、聚集状态与生物毒性等产生潜在影响[18]. Ersöz等[19]研究发现,在消化模拟后,牛奶的存在会改变TiO2 NPs的细胞毒性,对细胞的生存能力造成不利影响,同时,裸露的以及与食物基质相互作用的NPs在经过消化后所获得的不同电晕结构,可能对其肠道吸收和慢性毒性产生巨大影响;Zhang等[20]则发现标准食物模型的存在下,NPs的毒性进一步降低. 因此,确定NPs与消化道食物基质的相互作用与作用机制,对了解NPs的口服毒性,评估人体的健康安全风险具有重要意义.
然而,当前对于NPs与人体健康的研究聚焦于颗粒在消化系统中的最终形态,大多关注纳米颗粒与消化液在接触时间终点的物化性质变化,忽略了食物基质与纳米颗粒的相互作用及其口胃肠消化过程的影响[18]. 本实验以应用范围较广的聚苯乙烯纳米塑料为研究对象,建立人体胃肠道(GIT)三级体外模拟消化系统,探究在蛋白质、碳水化合物和油等多种食物基质作用下,NPs在胃肠道的命运与稳定性.
-
聚苯乙烯纳米塑料购自纽邦生物科技有限公司,酪蛋白酸钠、玉米油、淀粉、果胶、蔗糖、胆盐购自上海麦克林生化科技股份有限公司,α-淀粉酶、胃蛋白酶、胆汁盐、胰液购自Sigma-Aldrich,NaCl来自阿拉丁试剂(上海)有限公司.
-
根据制造商给定的相关参数,新鲜的聚苯乙烯纳米塑料悬浮液的质量浓度为10.06%. 取0.099 mL该悬浮液于容量瓶中,并用超纯水定容至100 mL,摇匀后制成实验所需的100 mg·L−1聚苯乙烯纳米塑料悬浮液[21]. 将制备好的溶液转入棕瓶,于4 ℃冰箱内避光储存,在使用前利用NaOH或HCl调整至合适pH.
-
配制浓度为5 mmol·L−1的磷酸盐缓冲液,调pH为7.0[22].
-
标准食物模型(SFM)依据中国居民膳食指南[23](即2.89%蛋白质,1.44%糖类,1.32%膳食纤维,13.8%淀粉,3.21%脂肪,0.37%矿物)制成,如表1所示.
将酪蛋白酸钠(1%,W/W)在室温下溶解于磷酸盐缓冲溶液(10 mmol·L−1,pH 7)中,连续搅拌2 h,至完全溶解,随后对溶解的酪蛋白酸钠盐溶液进行过滤,去除剩余未溶解的粉末微粒. 将玉米油(3.21%,W/W)加入该酪蛋白酸钠溶液中,连续摇晃10 min后,在高剪切搅拌机
16000 r·min−1转速下搅拌2 min. 产生的粗乳剂再通过高压均质器,在8.27×104 kPa上通过3次,形成细乳剂(蛋白浓度为2.89%,W/W,脂肪浓度为3.21%,W/W). 最后将果胶(1.32%,W/W)、淀粉(13.8%,W/W)、蔗糖(1.44%,W/W)和氯化钠(0.37%,W/W)等其他食品成分依次加入到乳液相中,充分搅拌,确保每一成分完全溶解,达到规定浓度. 通过喷雾干燥法将其从流体形式转化为粉末状,液体形式放入台式喷雾干燥机(进样速率0.45 L·h−1,入口温度170 ℃,喷雾器喷嘴0.7 mm),喷雾干燥后在4 ℃下储存,以蒸馏水进行重组[20]. -
酪蛋白酸钠、淀粉和玉米油组成的标准化食品基质分别代表日常摄入的蛋白质、碳水化合物和油的来源,依次制备其他食物模型[24].
将酪蛋白酸钠在室温条件下溶解于磷酸盐缓冲溶液(10 mmol·L−1,pH 7)中,配制其浓度为2.89% W/W,并利用磁力搅拌器连续搅拌,以确保粉末完全分散. 将淀粉加入磷酸盐缓冲溶液(10 mmol·L−1,pH 7)中,利用磁力搅拌器连续搅拌,最终配制淀粉浓度为13.8% W/W. 以同样的方法,配制玉米油浓度为3.21% W/W.
-
为研究不同消化阶段和不同食物基质对NPs大小和分布变化的影响,建立一个包括口腔、胃和小肠3个阶段的GIT模拟器模拟体内的消化过程. 体外消化方案改编自先前的研究[25],将先前配好的100 mg·L−1 NPs加入到食品模型中进行重悬,37 ℃,100 r·min−1的水浴磁力搅拌中孵育. 在唾液步骤中,取上述制备的悬浮液20 g加入20 g含23.6 mg·L−1α-淀粉酶,2 g·L−1氯化钠的模拟唾液,以1 mol·L−1 HCl调节pH至6.8,持续孵育10 min. 取出20 g唾液消化后的样品进行分析. 在胃消化步骤中,以1 mol·L−1 HCl调节pH至2.5,加入20 mL 2 g·L−1的氯化钠溶液,并加入胃蛋白酶,使消化体系中胃蛋白浓度达到1.6 mg·mL−1. 100 r·min−1孵育2 h后,取出10 g胃期消化的样品. 随后加入1 mol·L−1 NaOH调节pH至7.0,再孵育2 h. 每一步消化后,收集样品并用于表征NPs. 在烧瓶中加入1.5 mL含0.25 mol·L−1 CaCl2·2H2O和3.75 mol·L−1 NaCl的模拟肠液,然后加入3.5 mL(0.05 g·mL−1)的胆汁盐溶液. 将系统调整到pH 7.0. 然后,将加入2.5 mL胰酶溶液(0.036 g·mL−1)加入烧杯中,在37 ℃下,100 r·min−1的转速下孵育2 h.
-
利用Zetasizer Nano ZS90,采用时间动态光散射法(DLS),使用波长为633 nm的4.0 mW氦氖激光器,测定溶液背景下NPs的水动力学直径(Dh)与粒径分布. 需注意,在测量前应用磷酸缓冲溶液对样品进行适当稀释,以避免多重散射效应[26].
根据相分析光散射法(PALS),使用Zetasizer Nano ZS90仪器测量不同溶液化学条件下聚苯乙烯纳米颗粒的电泳迁移率(electrophoretic mobility,EPM). 对于每个溶液条件,对样品连续测定10次取平均值,并重复3次以确保数据质量,然后利用公式(1)换算为zeta(ζ)电位:
式中,ζ为表面电位(mV);η为黏度(Pa·s−1);UE为电泳迁移率(cm2·V−1·s−1);ε为介电常数;f(Ka)为Henry函数.
-
在将NPs悬浮液加入标准化食品基质中并模拟其通过GIT之前,检测其在纯水中的物理化学性质(表2). 可测得NPs的平均粒径为54.47 nm. 随着pH从2.5升高到6.8和7,NPs的ζ电位从−17.47 mV增强至−25.52 mV和−29.19 mV,这可能是由于更多的氢氧根离子吸附到NPs的表面所致[26]. 表明在纯水环境中,随着pH的升高,NPs的胶体稳定性逐渐增强[27].
-
对不同食物基质下,NPs在口、胃、肠的3个阶段消化样品进行了检测,并设置空白消化液、加入食物基质后的消化液等实验组别进行对照,表现出不同食物基质下NPs粒径分布的不同变化趋势. 由于塑料的粒径超出仪器的检测范围,在淀粉和油类处理下,未显示出胃期的粒径分布曲线. 整体上,与空白消化液(图1(a))、加入食物基质后的消化液(图1(b)-(f))相比,加入纳米塑料后,粒径分布曲线大多从单峰态转变为多峰态,且表现出整体向粒径较小方向移动的趋势,有别于空白消化液、加入食物基质后的消化液等实验组别. 这表明实验测定的为纳米塑料,且可能受到食物、蛋白酶等颗粒的干扰,加入纳米塑料后,塑料会与食物、消化液组分发生相互作用,并结合形成新的团聚体.
与空腹食物模型(FFM)相比(图1(b)),加入了SFM、protein、starch、oil不同食物基质后,未消化的NPs粒径分布呈现多峰态,平均粒径增加,体系较为分散. 在标准食物模型(图1(c))下,相较于未消化阶段,在口、胃、肠三级消化阶段中的粒径分布都较为集中,均为单峰态,这表明标准食物模型的聚集状态相对稳定[23],可能与标准食物模型内食物基质丰富均匀,分阶段消化的特性有关. 在蛋白食物基质(图1(d))下,口腔与肠期都与消化前阶段都表现出相似的粒径分布形态,这可能归因于蛋白质在NPs表面形成生物电晕的干扰[28]. 而在胃期,由于胃蛋白酶对蛋白的消化作用,弱酸集团的质子化增强了其静电排斥力与空间电阻,使其进一步稳定下来[29]. 在淀粉处理(图1(e))下,口腔阶段和未处理阶段表现出几乎一致的粒径分布曲线,这可以用:淀粉完全溶解在唾液中,并且与NPs之间不会发生静电相互作用来解释[30]. 最后,在油处理(图1(f))下,呈现出在肠期较为宽敞的粒径分布曲线,这也有油在肠期阶段被分解为脂肪酸的特性有关[31].
-
如图2所示,加入纳米塑料后的Dh区别于空白消化液(图2(a))、加入食物基质后的消化液等实验组别,进一步证实所测定的颗粒为纳米塑料颗粒,且会与食物、消化液等发生相互作用.
未消化阶段,空腹食物模型(图2(b))下的Dh与初始平均粒径(54.47 nm)相差不大,标准食物模型(图2(c))、蛋白质(图2(d))、淀粉(图2(e))、油(图2(f))等食物基质作用下则显著增大,分别增大至666.1、405.17、89.03、618.22 nm. 这可能是由于食物基质会被吸附于NPs表面,增大其团聚体的粒径,并根据各食物基质的不同性质表现出不同的大小(标准食物模型>油>蛋白>淀粉>空腹食物模型). 与未消化的NPs-食物基质模型相比,经口、胃、肠各消化处理后Dh显著增大,进一步佐证了体内消化过程对NPs凝聚动力学的重要作用.
在口腔阶段,除蛋白质下降以外,其他食物基质下的Dh都表现出一定程度的增加. Zhou等[28]之前的研究也观察到类似的现象,这可能是由于蛋白质与NPs的表面快速结合形成了蛋白质电晕,并通过提供空间位阻和静电斥力分散NPs. 一些关于银纳米塑料的研究也表明,口腔阶段食物基质对NPs的粒径几乎没有影响[32],与本次实验结果相一致. 这表明在此阶段,消化酶、pH变化等因素对液体的化学性质影响可能发挥了更大的作用[18].
在胃期,与口腔阶段相比,所有处理下的Dh都增加,这可能是由于pH下降,黏蛋白的羧酸基团被质子化,大大降低了NPs的胶体稳定性,影响NPs与酶的相互作用,最终促进酶对NPs的吸附并增强它们的凝聚[32]. 此外,高离子强度的介质也可能是另一个原因[33]. 在此阶段,蛋白质(图2(d))的变化(Dh从口期的377.73 nm增加至
4942.67 nm)还可归因于被胃蛋白酶消化为氨基酸、肽和氢氧根离子,降低了NPs之间的静电排斥和空间电阻,增强了其的团聚[34]. 对于油的处理,据报道,静电排斥的减少可能是由于液滴电荷的减少和低pH下离子强度的增加[32],这一点可从图3胃期表面ζ电位接近于0的实验数据中得到进一步的证实.在肠期,NPs的Dh相较于胃期都呈现出明显的减少,而油类基质(图2(f))表现最为显著. 这可能是由于pH升高,胰酶的加入则会分解在胃期中形成的团聚体. 而在油类食物基质的处理下,NPs表面的玉米油被脂肪酶(如胰蛋白酶)完全或部分消化为脂肪酸,并与胆盐混合形成混合胶束,以影响NPs的凝聚[31]. DeLoid等[29]也观察到了类似的现象,即由于表面三酰甘油的消化,部分Fe2O3纳米粒子在小肠阶段的粒径减小.
从整体来看,相较于初始状态,淀粉(图2(e))对NPs的流体动力学直径增幅最大,从口期至胃期, Dh由229.7 nm增加至
30036.67 nm,相较于其他食物基质,肠期阶段粒径也最大,Dh为1096.33 nm,对NPs的凝聚与胶体稳定性的影响最显著. 这可能是由于淀粉中的亲水大分子的添加量较大,能更有效地影响胶体的稳定性. 这表明食用淀粉类物质可能意味着增强其生物毒性与人体健康风险. -
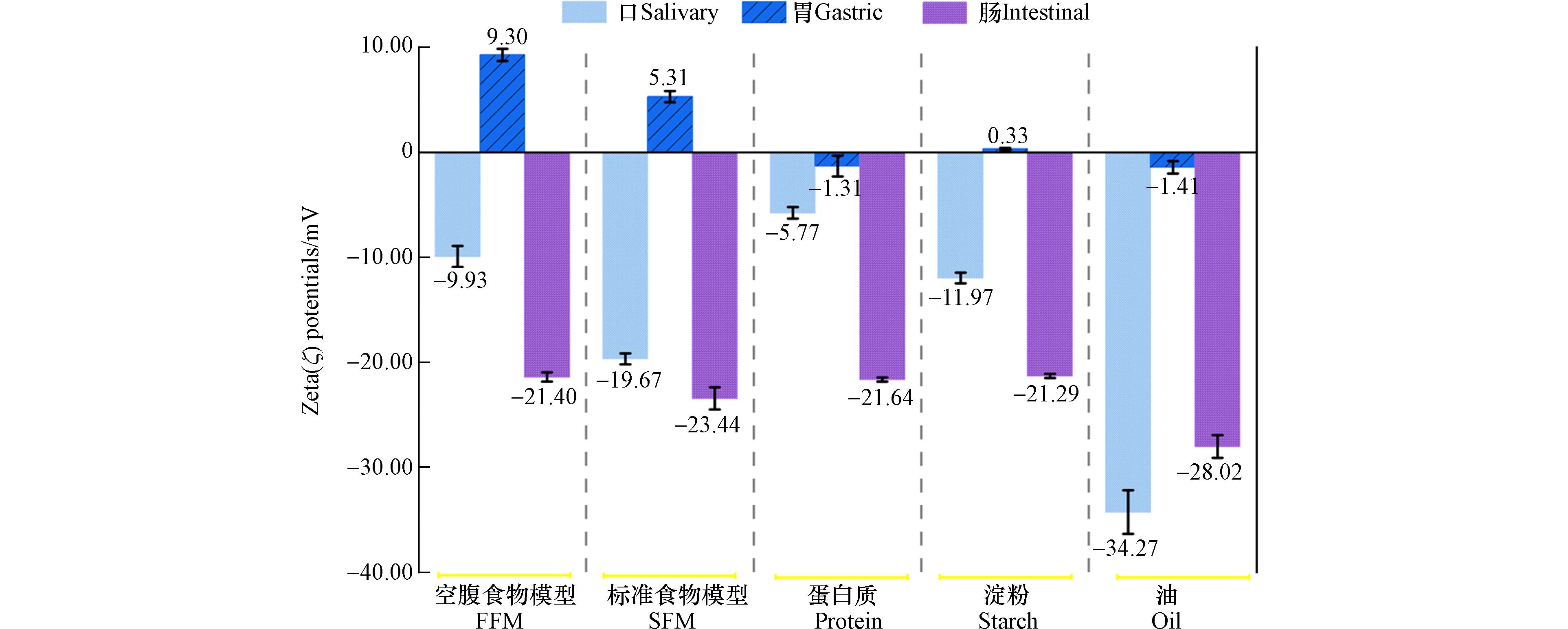
如图3所示,测量了NPs在不同食物模型下,口胃肠三级消化阶段的ζ电位的变化,这与生物分子和NPs表面的结合密切相关.
口腔阶段,NPs-食物模型均带有负电荷,范围从−5.77 mV到−34.27 mV,这表明其可能都具有较强的胶体稳定性. 而到达胃期,所有的NPs表现出几乎完全的电荷消除,ζ电位接近于0,甚至在FFM、food matrix、starch参与下,NPs呈现出电荷反转并带有轻微正电荷,这可能是由于胃蛋白酶通过吸附形成蛋白冠,对颗粒表面电荷进行了屏蔽作用[24]. 也有一些研究表明,可能是与低pH值(~1.5)下弱酸基团的质子化[29]以及低于黏蛋白的等电点(pI 3—5)等有关[25]. 肠期阶段,NPs又重新表现为负电荷,且范围在−21.29 mV到−28.02 mV. 在之前的一些研究中就有强调消化酶、胆汁盐与NPs的结合[32],而这次实验中得出了较为一致的结果,在食物基质的参与之下,食物以及消化后形成的肽聚糖或脂肪酸可与NPs相结合,并在他们的周围形成电晕,进一步稳定NPs悬浮液,这一点可从肠期阶段ζ电位的上升中可见得. 吸附的胆汁表面带有的负电荷[35]与具有表面活性剂的性质[36]都可使得NPs更为分散.
而不同食物基质的作用下,胶体的稳定性则表现为口腔阶段:油(−34.27 mV)>标准食物模型(−19.67 mV)>淀粉(−11.97 mV)>空腹食物模型(−9.93 mV)>蛋白(−5.77 mV),胃期:空腹食物模型((9.30 ± 0.58)mV)>标准食物模型(5.31 mV)>油(−1.41 mV)>蛋白质(−1.31 mV)>淀粉(0.33 mV),肠期:油(−28.02 mV)>标准食物模型(−23.44 mV)>蛋白(−21.64 mV)>空腹食物模型(−21.4 mV)>淀粉(−21.29 mV). 其中,淀粉在胃期的极不稳定性表明,淀粉能更有效地通过增加平均粒径,降低ζ电位来降低胶体的稳定性. 对比于淀粉与蛋白相似的不稳定性,油类食物基质在三级消化道中表现出较强的稳定性,特别是从胃期到肠期的转变(ζ电位由−1.41 mV转变为−28.02 mV),这可归因于在肠期中脂肪酶的存在. 肠液中含有的胰液中含有脂肪酶,可进一步催化脂肪的水解,因此油类基质可在肠期被转化为脂肪酸,从而稳定NPs使其ζ电位的绝对值增加[32]. 同样的,在口腔阶段,淀粉相较于蛋白质更稳定的原因也可能归因于口腔阶段淀粉酶的作用. 而在先前一些研究当中,发现的油和淀粉在凝聚作用中更相似,而牛奶起更稳定的作用,这一点的差异也用NPs的类型以及消化液制备的方式不同进行解释. 而从消化的整体过程来看,则表现出标准食物模型比空腹食物模型更强的稳定性的效果.
-
以往研究往往忽略食物基质与消化过程的影响,本实验通过建立GIT模拟体外消化三级模型,探究标准食物基质、蛋白质、碳水化合物、油等日常摄入的食物基质对人体内NPs粒径变化与胶体稳定性的影响. 实验结果表明,食物基质的参与会影响人体内NPs的粒径与表面电位的变化,与未消化阶段的54.47 nm相比,蛋白、淀粉、油类等食物基质加入后,Dh增至405.17、89.03、618.22 nm. 总体呈现口、胃期粒径增大、稳定性降低,肠期粒径减小、稳定性增大,并表现为各食物基质下不同消化阶段的不同特性. 淀粉通过增大粒径,降低ζ电位来达到较好的胶体稳定的效果,在胃、肠期的粒径最大,分别为
30036.67 、1096.33 nm,ζ电位分别为0.326、−21.29 nm. 蛋白则主要通过吸附于NPs表面形成蛋白冠与在胃期被胃蛋白酶消化,进一步降低NPs之间的静电排斥和空间电阻,增强其的团聚,胃期粒径从377.73 nm增加至4942.67 nm. 油由于易被肠期的胰酶分解为脂肪酸,并与胆盐混合形成混合胶束,在肠期表现出最稳定的性质,ζ电位为−28.017 nm. 以上结果显示,NPs由于受到各消化酶对各食物基质的分解、pH的变化、介质电解质等的影响,在模拟体外消化道中与不同的食物基质发生复杂的相互作用,从而改变其胃肠道行为与胶体稳定性. 前人研究大多关注接触时间终点的物化性质变化,即使有食物基质的考量也往往局限于单种物质的研究. 基于此,本研究选择了代表中国居民膳食摄入的标准食物模型与蛋白质、淀粉、油类等多种食物基质,并结合体外消化模型,尽可能真实地模拟纳米塑料在人体胃肠道的行为与胶体稳定性,为进一步评估人类在日常饮食中所面临的纳米塑料危机与健康安全风险提供了依据,也同时为纳米营养品的运输与功能发挥提供了新的思路与研究路径,推动纳米塑料健康影响评估研究的发展.
不同食物基质对纳米塑料的胃肠道行为与胶体稳定性的影响
Effects of different food matrices on gastrointestinal fate and colloidal stability of nanoplastics
-
摘要: 随着塑料产量的持续增加和回收率的低下,大量塑料进入环境,并通过机械磨损、光照和生物降解等途径分解为小于100 nm的纳米塑料(NPs). 它们通过口服摄入、呼吸吸入和皮肤接触等途径进入人体,造成生殖、神经和关节等多方面的毒性,严重威胁人体健康. 目前,NPs的研究主要集中在水环境和胃液中的迁移转化,且大多数忽视了食物基质的作用. 为进一步阐明NPs在人体内的作用机制并评估其安全风险,本研究拟建立人体胃肠道(GIT)体外消化模型,使用时间动态光散射法(DLS)探讨NPs在不同食物基质下的胃肠道行为和胶体稳定性. 结果表明,食物基质会吸附在NPs表面,增大其初始粒径. 在加入蛋白、淀粉、油类等食物基质后,NPs的水动力学直径(Dh)从54.47 nm增加到405.17、89.03、618.22 nm. 该变化受到消化过程中的pH、溶液电解质和消化酶的影响. 在胃期阶段,zeta(ζ)电位接近0;而在肠期阶段,ζ电位表现为负电荷,范围从−21.29 mV到−28.02 mV. 总体而言,NPs在胃期阶段表现为粒径增大和胶体不稳定,而在肠期阶段则表现为粒径减小和胶体稳定. 食物基质在这一过程中发挥了重要作用. 蛋白质会被蛋白酶降解,在NPs表面形成蛋白冠,这使其在口腔阶段表现出独特的粒径增加,并在胃期呈现出更强的胶体不稳定性(ζ电位为−1.308 mV. 淀粉作为中性分子,不影响体系中的静电相互作用,但能够通过增加粒径和降低ζ电位来更有效地降低胶体稳定性. 从口腔到胃期,Dh由229.7 nm增加至
30036.67 nm. 油类物质在胰酶作用下被消化为脂肪酸,并吸附在NPs表面,与胆盐形成胶束,在肠期表现出更强的胶体稳定性,ζ电位为−28.017 mV,高于其它食物基质模型. 本研究结果可为NPs在食物基质与消化道作用下的胃肠道行为提供新思路,对人体健康风险的评估具有重要意义.Abstract: With the continuous increase in plastic production and the low recycling rates, a significant amount of plastic enters the environment and is decomposed into nanoplastics (NPs) smaller than 100 nm through processes including mechanical abrasion, light irradiation, and biodegradation. They enter the human body via various pathways, such as oral ingestion, inhalation, and dermal contact, to cause reproductive, neurological, and joint toxicity, posing a serious threat to human health. Currently, research on NPs mainly focuses on their migration and transformation in aqueous environments and gastric fluids, while most studies overlook the role of food matrices. To further elucidate the interaction mechanisms of NPs in the human body and assess their safety risks, this study aims to establish an in vitro gastrointestinal tract (GIT) digestion model and use time-resolved dynamic light scattering (DLS) to investigate the gastrointestinal behavior and colloidal stability of NPs under different food matrices. The results showed that food matrices adsorbed onto the surface of NPs, increasing their initial particle size. After adding food matrices such as protein, starch, and oil, the hydrodynamic diameter (Dh) of NPs increased from 54.47 nm to 405.17, 89.03 and 618.22 nm. This change was affected by the pH, solution electrolytes, and digestive enzymes during the digestion process. In the gastric phase, the zeta (ζ) potential was close to 0; while in the intestinal phase, the ζ potential exhibited negative charges, ranging from −21.29 mV to −28.02 mV. Overall, NPs exhibited increased particle size and colloidal instability in the gastric phase, while showing reduced particle size and colloidal stability in the intestinal phase. Food matrices played an important role in this process. Proteins were degraded by proteases, forming protein corona on the surface of NPs, leading to unique increases in particle size in the oral phase and stronger colloidal instability in the gastric phase (ζ potential of −1.308 mV). Starch, as a neutral molecule, did not affect the electrostatic interactions in the system but more effectively reduced colloidal stability by increasing particle size and decreasing ζ potential. From the oral to the gastric phase, Dh increased from 229.7 nm to30036.67 nm. Oily substances were digested by pancreatic enzymes into fatty acids, adsorbed onto the surface of NPs, and mixed with bile salts to form micelles. This resulted in stronger colloidal stability in the intestinal phase, with a ζ potential of −28.017 mV, higher than that of other food matrix models. The results of this study provide new insights into the gastrointestinal behavior of NPs under the influence of food matrices and the digestive tract, which is of great significance for the assessment of human health risks. -
2022年全球塑料总量达4亿吨,同比增长约600万吨,其中90.6%为化石基塑料,仅有不到9%被机械、化学等回收利用,大量垃圾被最终填埋或因管理不善等各种原因排放到环境中[1]. 自20世纪70年代,首次在水生环境中发现塑料垃圾以来[2],已陆续在世界各地的空气[3]、海洋[4]、土壤[5]和地表水[6],甚至在北极与深海[1,7]等人类活动稀少的偏远地区都检测到NPs的存在. 在风化的长期影响与紫外线辐射(UV)以及其他环境因素[8]的作用下,环境中的塑料垃圾可降解成小于5 mm的微塑料(MPs)和100 nm纳米塑料(NPs)[9]. 并通过吸入、摄入,特别是食物链的方式进入人体,在人类粪便中检测到的NPs也为其提供了进一步的证据[10]. MPs、NPs可通过诱导氧化压力或内质网压力等进入不同生物体内,影响生殖系统、消化系统、神经系统等不同身体系统,造成胃肠道毒性、肝脏毒性、生殖毒性、神经毒性和关节毒性等多方面毒性[11]. 由于NPs尺寸较小,比表面积较大,且细胞亲和性高于MPs,更易穿过生物屏障进入血液、细胞、组织和器官,对生物造成更严重的危害[12].
近年来,已有研究关注NPs在胃肠道当中的毒性. 在细胞水平上,Li等研究发现,暴露于聚苯乙烯纳米塑料会改变肠道微生物群的组成,从而诱发菌群失调,引发肠道炎症反应[13];Mahler等[14]研究则集中探讨了口服聚苯乙烯纳米粒子对肠上皮细胞体外模型和鸡肠环体内模型中的铁吸收和铁运输的影响,发现暴露于高剂量纳米颗粒的肠道细胞显示出铁转运增加,而急性暴露于羧化颗粒(直径50 nm)的鸡比未暴露或长期暴露的鸡具有更低的铁吸收率. 在分子水平上,研究主要关注纳米粒子的毒性机制,包括氧化应激、脂质代谢失调、能量代谢异常、以及由此引发的炎症反应和细胞凋亡[15],Hu等[16]发现,摄入聚苯乙烯微塑料会增加炎症和氧化应激相关基因的表达,从而诱导哺乳动物细胞炎症和氧化应激增加. 塑料毒性效应与纳米粒子的粒径、比表面积和形态等物理化学特性密切相关. 当食物基质参与其中,不同分子与胶体物质会与NPs表面相互作用[17],产生生物电晕,对NPs的结构、电荷、聚集状态与生物毒性等产生潜在影响[18]. Ersöz等[19]研究发现,在消化模拟后,牛奶的存在会改变TiO2 NPs的细胞毒性,对细胞的生存能力造成不利影响,同时,裸露的以及与食物基质相互作用的NPs在经过消化后所获得的不同电晕结构,可能对其肠道吸收和慢性毒性产生巨大影响;Zhang等[20]则发现标准食物模型的存在下,NPs的毒性进一步降低. 因此,确定NPs与消化道食物基质的相互作用与作用机制,对了解NPs的口服毒性,评估人体的健康安全风险具有重要意义.
然而,当前对于NPs与人体健康的研究聚焦于颗粒在消化系统中的最终形态,大多关注纳米颗粒与消化液在接触时间终点的物化性质变化,忽略了食物基质与纳米颗粒的相互作用及其口胃肠消化过程的影响[18]. 本实验以应用范围较广的聚苯乙烯纳米塑料为研究对象,建立人体胃肠道(GIT)三级体外模拟消化系统,探究在蛋白质、碳水化合物和油等多种食物基质作用下,NPs在胃肠道的命运与稳定性.
1. 材料与方法(Materials and methods)
1.1 化学药品与试剂
聚苯乙烯纳米塑料购自纽邦生物科技有限公司,酪蛋白酸钠、玉米油、淀粉、果胶、蔗糖、胆盐购自上海麦克林生化科技股份有限公司,α-淀粉酶、胃蛋白酶、胆汁盐、胰液购自Sigma-Aldrich,NaCl来自阿拉丁试剂(上海)有限公司.
1.2 制备NPs悬浮液
根据制造商给定的相关参数,新鲜的聚苯乙烯纳米塑料悬浮液的质量浓度为10.06%. 取0.099 mL该悬浮液于容量瓶中,并用超纯水定容至100 mL,摇匀后制成实验所需的100 mg·L−1聚苯乙烯纳米塑料悬浮液[21]. 将制备好的溶液转入棕瓶,于4 ℃冰箱内避光储存,在使用前利用NaOH或HCl调整至合适pH.
1.3 空腹食物模型(FFM)的配制
配制浓度为5 mmol·L−1的磷酸盐缓冲液,调pH为7.0[22].
1.4 标准食物模型(SFM)的配制
标准食物模型(SFM)依据中国居民膳食指南[23](即2.89%蛋白质,1.44%糖类,1.32%膳食纤维,13.8%淀粉,3.21%脂肪,0.37%矿物)制成,如表1所示.
组成成分Composition 含量浓度/%Concentration 蛋白质(酪蛋白酸钠) 2.89 糖类(蔗糖) 1.44 膳食纤维(果胶) 1.32 淀粉(玉米淀粉) 13.8 脂肪(玉米油) 3.21 矿物(氯化钠) 0.37 将酪蛋白酸钠(1%,W/W)在室温下溶解于磷酸盐缓冲溶液(10 mmol·L−1,pH 7)中,连续搅拌2 h,至完全溶解,随后对溶解的酪蛋白酸钠盐溶液进行过滤,去除剩余未溶解的粉末微粒. 将玉米油(3.21%,W/W)加入该酪蛋白酸钠溶液中,连续摇晃10 min后,在高剪切搅拌机
16000 r·min−1转速下搅拌2 min. 产生的粗乳剂再通过高压均质器,在8.27×104 kPa上通过3次,形成细乳剂(蛋白浓度为2.89%,W/W,脂肪浓度为3.21%,W/W). 最后将果胶(1.32%,W/W)、淀粉(13.8%,W/W)、蔗糖(1.44%,W/W)和氯化钠(0.37%,W/W)等其他食品成分依次加入到乳液相中,充分搅拌,确保每一成分完全溶解,达到规定浓度. 通过喷雾干燥法将其从流体形式转化为粉末状,液体形式放入台式喷雾干燥机(进样速率0.45 L·h−1,入口温度170 ℃,喷雾器喷嘴0.7 mm),喷雾干燥后在4 ℃下储存,以蒸馏水进行重组[20].1.5 其他食物模型的配制
酪蛋白酸钠、淀粉和玉米油组成的标准化食品基质分别代表日常摄入的蛋白质、碳水化合物和油的来源,依次制备其他食物模型[24].
将酪蛋白酸钠在室温条件下溶解于磷酸盐缓冲溶液(10 mmol·L−1,pH 7)中,配制其浓度为2.89% W/W,并利用磁力搅拌器连续搅拌,以确保粉末完全分散. 将淀粉加入磷酸盐缓冲溶液(10 mmol·L−1,pH 7)中,利用磁力搅拌器连续搅拌,最终配制淀粉浓度为13.8% W/W. 以同样的方法,配制玉米油浓度为3.21% W/W.
1.6 体外模拟消化实验
为研究不同消化阶段和不同食物基质对NPs大小和分布变化的影响,建立一个包括口腔、胃和小肠3个阶段的GIT模拟器模拟体内的消化过程. 体外消化方案改编自先前的研究[25],将先前配好的100 mg·L−1 NPs加入到食品模型中进行重悬,37 ℃,100 r·min−1的水浴磁力搅拌中孵育. 在唾液步骤中,取上述制备的悬浮液20 g加入20 g含23.6 mg·L−1α-淀粉酶,2 g·L−1氯化钠的模拟唾液,以1 mol·L−1 HCl调节pH至6.8,持续孵育10 min. 取出20 g唾液消化后的样品进行分析. 在胃消化步骤中,以1 mol·L−1 HCl调节pH至2.5,加入20 mL 2 g·L−1的氯化钠溶液,并加入胃蛋白酶,使消化体系中胃蛋白浓度达到1.6 mg·mL−1. 100 r·min−1孵育2 h后,取出10 g胃期消化的样品. 随后加入1 mol·L−1 NaOH调节pH至7.0,再孵育2 h. 每一步消化后,收集样品并用于表征NPs. 在烧瓶中加入1.5 mL含0.25 mol·L−1 CaCl2·2H2O和3.75 mol·L−1 NaCl的模拟肠液,然后加入3.5 mL(0.05 g·mL−1)的胆汁盐溶液. 将系统调整到pH 7.0. 然后,将加入2.5 mL胰酶溶液(0.036 g·mL−1)加入烧杯中,在37 ℃下,100 r·min−1的转速下孵育2 h.
1.7 表征方法
利用Zetasizer Nano ZS90,采用时间动态光散射法(DLS),使用波长为633 nm的4.0 mW氦氖激光器,测定溶液背景下NPs的水动力学直径(Dh)与粒径分布. 需注意,在测量前应用磷酸缓冲溶液对样品进行适当稀释,以避免多重散射效应[26].
根据相分析光散射法(PALS),使用Zetasizer Nano ZS90仪器测量不同溶液化学条件下聚苯乙烯纳米颗粒的电泳迁移率(electrophoretic mobility,EPM). 对于每个溶液条件,对样品连续测定10次取平均值,并重复3次以确保数据质量,然后利用公式(1)换算为zeta(ζ)电位:
stringUtils.convertMath(!{formula.content}) (1) 式中,ζ为表面电位(mV);η为黏度(Pa·s−1);UE为电泳迁移率(cm2·V−1·s−1);ε为介电常数;f(Ka)为Henry函数.
2. 结果与讨论(Results and discussion)
2.1 NPs渗入食物基质前的性质
在将NPs悬浮液加入标准化食品基质中并模拟其通过GIT之前,检测其在纯水中的物理化学性质(表2). 可测得NPs的平均粒径为54.47 nm. 随着pH从2.5升高到6.8和7,NPs的ζ电位从−17.47 mV增强至−25.52 mV和−29.19 mV,这可能是由于更多的氢氧根离子吸附到NPs的表面所致[26]. 表明在纯水环境中,随着pH的升高,NPs的胶体稳定性逐渐增强[27].
表 2 NPs的初始性质Table 2. Initial properties of nanoplastics平均粒径/nmAverage particle size 表面电位/mVSurface potential pH 2.5 pH 6.8 pH 7 54.47 −17.47 −25.52 −29.19 2.2 不同食物基质下NPs粒径分布的变化
对不同食物基质下,NPs在口、胃、肠的3个阶段消化样品进行了检测,并设置空白消化液、加入食物基质后的消化液等实验组别进行对照,表现出不同食物基质下NPs粒径分布的不同变化趋势. 由于塑料的粒径超出仪器的检测范围,在淀粉和油类处理下,未显示出胃期的粒径分布曲线. 整体上,与空白消化液(图1(a))、加入食物基质后的消化液(图1(b)-(f))相比,加入纳米塑料后,粒径分布曲线大多从单峰态转变为多峰态,且表现出整体向粒径较小方向移动的趋势,有别于空白消化液、加入食物基质后的消化液等实验组别. 这表明实验测定的为纳米塑料,且可能受到食物、蛋白酶等颗粒的干扰,加入纳米塑料后,塑料会与食物、消化液组分发生相互作用,并结合形成新的团聚体.
 图 1 100 mg·L−1 PSNPs 在体外消化过程中与不同食物基质作用下的尺寸分布Figure 1. Size distributions of 100 mg·L−1 PSNPs during each phase in vitro digestion with the different food matrices(a)空白消化液;(b)空腹食物模型(FFM);(c)标准食物模型(SFM);(d)蛋白质(protein);(e)淀粉(starch);(f)油(oil)(a) blank digestion fluid; (b) FFM; (c) SFM; (d) protein; (e) starch; (f) oil
图 1 100 mg·L−1 PSNPs 在体外消化过程中与不同食物基质作用下的尺寸分布Figure 1. Size distributions of 100 mg·L−1 PSNPs during each phase in vitro digestion with the different food matrices(a)空白消化液;(b)空腹食物模型(FFM);(c)标准食物模型(SFM);(d)蛋白质(protein);(e)淀粉(starch);(f)油(oil)(a) blank digestion fluid; (b) FFM; (c) SFM; (d) protein; (e) starch; (f) oil与空腹食物模型(FFM)相比(图1(b)),加入了SFM、protein、starch、oil不同食物基质后,未消化的NPs粒径分布呈现多峰态,平均粒径增加,体系较为分散. 在标准食物模型(图1(c))下,相较于未消化阶段,在口、胃、肠三级消化阶段中的粒径分布都较为集中,均为单峰态,这表明标准食物模型的聚集状态相对稳定[23],可能与标准食物模型内食物基质丰富均匀,分阶段消化的特性有关. 在蛋白食物基质(图1(d))下,口腔与肠期都与消化前阶段都表现出相似的粒径分布形态,这可能归因于蛋白质在NPs表面形成生物电晕的干扰[28]. 而在胃期,由于胃蛋白酶对蛋白的消化作用,弱酸集团的质子化增强了其静电排斥力与空间电阻,使其进一步稳定下来[29]. 在淀粉处理(图1(e))下,口腔阶段和未处理阶段表现出几乎一致的粒径分布曲线,这可以用:淀粉完全溶解在唾液中,并且与NPs之间不会发生静电相互作用来解释[30]. 最后,在油处理(图1(f))下,呈现出在肠期较为宽敞的粒径分布曲线,这也有油在肠期阶段被分解为脂肪酸的特性有关[31].
2.3 不同食物基质下NPs流体动力学直径的变化
如图2所示,加入纳米塑料后的Dh区别于空白消化液(图2(a))、加入食物基质后的消化液等实验组别,进一步证实所测定的颗粒为纳米塑料颗粒,且会与食物、消化液等发生相互作用.
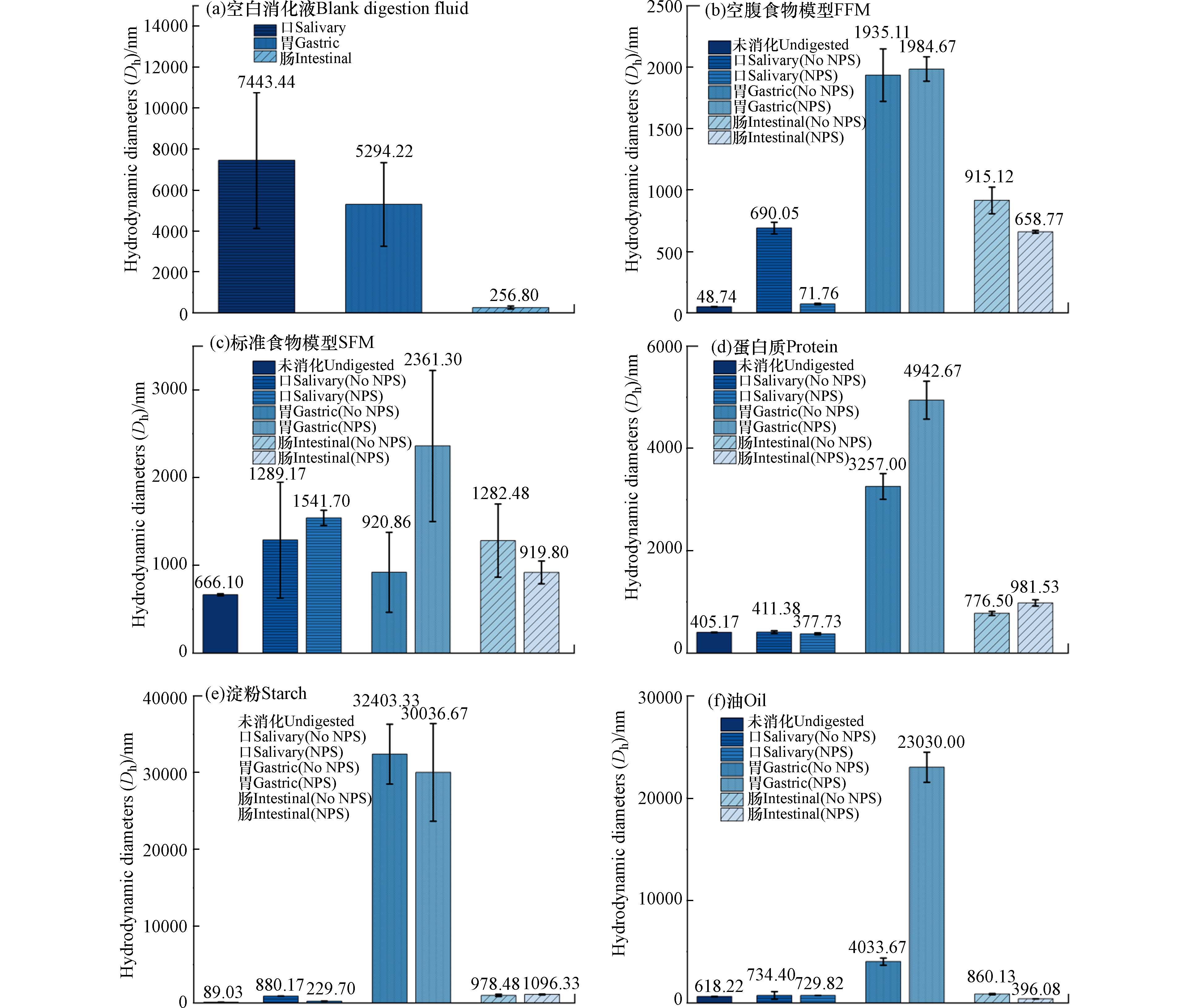 图 2 100 mg·L−1NPs在不同食物基质体外消化各阶段的流体动力学直径(Dh)Figure 2. Hydrodynamic diameters (Dh) of 100 mg·L−1PSNPs during each phase of in vitro digestion with different food matrices(a)空白消化液;(b)空腹食物模型(FFM);(c)标准食物模型(SFM);(d)蛋白质(protein);(e)淀粉(starch);(f)油(oil)(a) blank digestion fluid; (b) FFM; (c) SFM; (d) protein; (e) starch; (f) oil
图 2 100 mg·L−1NPs在不同食物基质体外消化各阶段的流体动力学直径(Dh)Figure 2. Hydrodynamic diameters (Dh) of 100 mg·L−1PSNPs during each phase of in vitro digestion with different food matrices(a)空白消化液;(b)空腹食物模型(FFM);(c)标准食物模型(SFM);(d)蛋白质(protein);(e)淀粉(starch);(f)油(oil)(a) blank digestion fluid; (b) FFM; (c) SFM; (d) protein; (e) starch; (f) oil未消化阶段,空腹食物模型(图2(b))下的Dh与初始平均粒径(54.47 nm)相差不大,标准食物模型(图2(c))、蛋白质(图2(d))、淀粉(图2(e))、油(图2(f))等食物基质作用下则显著增大,分别增大至666.1、405.17、89.03、618.22 nm. 这可能是由于食物基质会被吸附于NPs表面,增大其团聚体的粒径,并根据各食物基质的不同性质表现出不同的大小(标准食物模型>油>蛋白>淀粉>空腹食物模型). 与未消化的NPs-食物基质模型相比,经口、胃、肠各消化处理后Dh显著增大,进一步佐证了体内消化过程对NPs凝聚动力学的重要作用.
在口腔阶段,除蛋白质下降以外,其他食物基质下的Dh都表现出一定程度的增加. Zhou等[28]之前的研究也观察到类似的现象,这可能是由于蛋白质与NPs的表面快速结合形成了蛋白质电晕,并通过提供空间位阻和静电斥力分散NPs. 一些关于银纳米塑料的研究也表明,口腔阶段食物基质对NPs的粒径几乎没有影响[32],与本次实验结果相一致. 这表明在此阶段,消化酶、pH变化等因素对液体的化学性质影响可能发挥了更大的作用[18].
在胃期,与口腔阶段相比,所有处理下的Dh都增加,这可能是由于pH下降,黏蛋白的羧酸基团被质子化,大大降低了NPs的胶体稳定性,影响NPs与酶的相互作用,最终促进酶对NPs的吸附并增强它们的凝聚[32]. 此外,高离子强度的介质也可能是另一个原因[33]. 在此阶段,蛋白质(图2(d))的变化(Dh从口期的377.73 nm增加至
4942.67 nm)还可归因于被胃蛋白酶消化为氨基酸、肽和氢氧根离子,降低了NPs之间的静电排斥和空间电阻,增强了其的团聚[34]. 对于油的处理,据报道,静电排斥的减少可能是由于液滴电荷的减少和低pH下离子强度的增加[32],这一点可从图3胃期表面ζ电位接近于0的实验数据中得到进一步的证实.在肠期,NPs的Dh相较于胃期都呈现出明显的减少,而油类基质(图2(f))表现最为显著. 这可能是由于pH升高,胰酶的加入则会分解在胃期中形成的团聚体. 而在油类食物基质的处理下,NPs表面的玉米油被脂肪酶(如胰蛋白酶)完全或部分消化为脂肪酸,并与胆盐混合形成混合胶束,以影响NPs的凝聚[31]. DeLoid等[29]也观察到了类似的现象,即由于表面三酰甘油的消化,部分Fe2O3纳米粒子在小肠阶段的粒径减小.
从整体来看,相较于初始状态,淀粉(图2(e))对NPs的流体动力学直径增幅最大,从口期至胃期, Dh由229.7 nm增加至
30036.67 nm,相较于其他食物基质,肠期阶段粒径也最大,Dh为1096.33 nm,对NPs的凝聚与胶体稳定性的影响最显著. 这可能是由于淀粉中的亲水大分子的添加量较大,能更有效地影响胶体的稳定性. 这表明食用淀粉类物质可能意味着增强其生物毒性与人体健康风险.2.4 不同食物基质下NPs表面电位的变化
如图3所示,测量了NPs在不同食物模型下,口胃肠三级消化阶段的ζ电位的变化,这与生物分子和NPs表面的结合密切相关.
口腔阶段,NPs-食物模型均带有负电荷,范围从−5.77 mV到−34.27 mV,这表明其可能都具有较强的胶体稳定性. 而到达胃期,所有的NPs表现出几乎完全的电荷消除,ζ电位接近于0,甚至在FFM、food matrix、starch参与下,NPs呈现出电荷反转并带有轻微正电荷,这可能是由于胃蛋白酶通过吸附形成蛋白冠,对颗粒表面电荷进行了屏蔽作用[24]. 也有一些研究表明,可能是与低pH值(~1.5)下弱酸基团的质子化[29]以及低于黏蛋白的等电点(pI 3—5)等有关[25]. 肠期阶段,NPs又重新表现为负电荷,且范围在−21.29 mV到−28.02 mV. 在之前的一些研究中就有强调消化酶、胆汁盐与NPs的结合[32],而这次实验中得出了较为一致的结果,在食物基质的参与之下,食物以及消化后形成的肽聚糖或脂肪酸可与NPs相结合,并在他们的周围形成电晕,进一步稳定NPs悬浮液,这一点可从肠期阶段ζ电位的上升中可见得. 吸附的胆汁表面带有的负电荷[35]与具有表面活性剂的性质[36]都可使得NPs更为分散.
而不同食物基质的作用下,胶体的稳定性则表现为口腔阶段:油(−34.27 mV)>标准食物模型(−19.67 mV)>淀粉(−11.97 mV)>空腹食物模型(−9.93 mV)>蛋白(−5.77 mV),胃期:空腹食物模型((9.30 ± 0.58)mV)>标准食物模型(5.31 mV)>油(−1.41 mV)>蛋白质(−1.31 mV)>淀粉(0.33 mV),肠期:油(−28.02 mV)>标准食物模型(−23.44 mV)>蛋白(−21.64 mV)>空腹食物模型(−21.4 mV)>淀粉(−21.29 mV). 其中,淀粉在胃期的极不稳定性表明,淀粉能更有效地通过增加平均粒径,降低ζ电位来降低胶体的稳定性. 对比于淀粉与蛋白相似的不稳定性,油类食物基质在三级消化道中表现出较强的稳定性,特别是从胃期到肠期的转变(ζ电位由−1.41 mV转变为−28.02 mV),这可归因于在肠期中脂肪酶的存在. 肠液中含有的胰液中含有脂肪酶,可进一步催化脂肪的水解,因此油类基质可在肠期被转化为脂肪酸,从而稳定NPs使其ζ电位的绝对值增加[32]. 同样的,在口腔阶段,淀粉相较于蛋白质更稳定的原因也可能归因于口腔阶段淀粉酶的作用. 而在先前一些研究当中,发现的油和淀粉在凝聚作用中更相似,而牛奶起更稳定的作用,这一点的差异也用NPs的类型以及消化液制备的方式不同进行解释. 而从消化的整体过程来看,则表现出标准食物模型比空腹食物模型更强的稳定性的效果.
3. 结论(Conclusion)
以往研究往往忽略食物基质与消化过程的影响,本实验通过建立GIT模拟体外消化三级模型,探究标准食物基质、蛋白质、碳水化合物、油等日常摄入的食物基质对人体内NPs粒径变化与胶体稳定性的影响. 实验结果表明,食物基质的参与会影响人体内NPs的粒径与表面电位的变化,与未消化阶段的54.47 nm相比,蛋白、淀粉、油类等食物基质加入后,Dh增至405.17、89.03、618.22 nm. 总体呈现口、胃期粒径增大、稳定性降低,肠期粒径减小、稳定性增大,并表现为各食物基质下不同消化阶段的不同特性. 淀粉通过增大粒径,降低ζ电位来达到较好的胶体稳定的效果,在胃、肠期的粒径最大,分别为
30036.67 、1096.33 nm,ζ电位分别为0.326、−21.29 nm. 蛋白则主要通过吸附于NPs表面形成蛋白冠与在胃期被胃蛋白酶消化,进一步降低NPs之间的静电排斥和空间电阻,增强其的团聚,胃期粒径从377.73 nm增加至4942.67 nm. 油由于易被肠期的胰酶分解为脂肪酸,并与胆盐混合形成混合胶束,在肠期表现出最稳定的性质,ζ电位为−28.017 nm. 以上结果显示,NPs由于受到各消化酶对各食物基质的分解、pH的变化、介质电解质等的影响,在模拟体外消化道中与不同的食物基质发生复杂的相互作用,从而改变其胃肠道行为与胶体稳定性. 前人研究大多关注接触时间终点的物化性质变化,即使有食物基质的考量也往往局限于单种物质的研究. 基于此,本研究选择了代表中国居民膳食摄入的标准食物模型与蛋白质、淀粉、油类等多种食物基质,并结合体外消化模型,尽可能真实地模拟纳米塑料在人体胃肠道的行为与胶体稳定性,为进一步评估人类在日常饮食中所面临的纳米塑料危机与健康安全风险提供了依据,也同时为纳米营养品的运输与功能发挥提供了新的思路与研究路径,推动纳米塑料健康影响评估研究的发展. -
组成成分Composition 含量浓度/%Concentration 蛋白质(酪蛋白酸钠) 2.89 糖类(蔗糖) 1.44 膳食纤维(果胶) 1.32 淀粉(玉米淀粉) 13.8 脂肪(玉米油) 3.21 矿物(氯化钠) 0.37 表 2 NPs的初始性质
Table 2. Initial properties of nanoplastics
平均粒径/nmAverage particle size 表面电位/mVSurface potential pH 2.5 pH 6.8 pH 7 54.47 −17.47 −25.52 −29.19 -
[1] ALIMI O S, FARNER BUDARZ J, HERNANDEZ L M, et al. Microplastics and nanoplastics in aquatic environments: Aggregation, deposition, and enhanced contaminant transport[J]. Environmental Science & Technology, 2018, 52(4): 1704-1724. [2] CARPENTER E J, JR SMITH K L. Plastics on the Sargasso sea surface[J]. Science, 1972, 175(4027): 1240-1241. doi: 10.1126/science.175.4027.1240 [3] PANKO J M, CHU J, KREIDER M L, et al. Measurement of airborne concentrations of tire and road wear particles in urban and rural areas of France, Japan, and the United States[J]. Atmospheric Environment, 2013, 72: 192-199. doi: 10.1016/j.atmosenv.2013.01.040 [4] Da COSTA J P, SANTOS P S M, DUARTE A C, et al. (Nano)plastics in the environment–Sources, fates and effects[J]. Science of the Total Environment, 2016, 566: 15-26. [5] NIZZETTO L, BUSSI G, FUTTER M N, et al. A theoretical assessment of microplastic transport in river catchments and their retention by soils and river sediments[J]. Environmental Science. Processes & Impacts, 2016, 18(8): 1050-1059. [6] DRIS R, GASPERI J, ROCHER V, et al. Microplastic contamination in an urban area: A case study in greater Paris[J]. Environmental Chemistry, 2015, 12(5): 592. doi: 10.1071/EN14167 [7] CHAE Y, AN Y J. Effects of micro- and nanoplastics on aquatic ecosystems: Current research trends and perspectives[J]. Marine Pollution Bulletin, 2017, 124(2): 624-632. doi: 10.1016/j.marpolbul.2017.01.070 [8] LIU Z Q, LI Y M, PÉREZ E, et al. Polystyrene nanoplastic induces oxidative stress, immune defense, and glycometabolism change in Daphnia pulex: Application of transcriptome profiling in risk assessment of nanoplastics[J]. Journal of Hazardous Materials, 2021, 402: 123778. doi: 10.1016/j.jhazmat.2020.123778 [9] TER HALLE A, LADIRAT L, GENDRE X, et al. Understanding the fragmentation pattern of marine plastic debris[J]. Environmental Science & Technology, 2016, 50(11): 5668-5675. [10] SCHWABL P, KÖPPEL S, KÖNIGSHOFER P, et al. Detection of various microplastics in human stool: A prospective case series[J]. Annals of Internal Medicine, 2019, 171(7): 453-457. doi: 10.7326/M19-0618 [11] CHANG X R, XUE Y Y, LI J Y, et al. Potential health impact of environmental micro- and nanoplastics pollution[J]. Journal of Applied Toxicology, 2020, 40(1): 4-15. doi: 10.1002/jat.3915 [12] YANG S L, LI M Z, KONG R Y C, et al. Reproductive toxicity of micro- and nanoplastics[J]. Environment International, 2023, 177: 108002. doi: 10.1016/j.envint.2023.108002 [13] CHAMAS A, MOON H, ZHENG J J, et al. Degradation rates of plastics in the environment[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(9): 3494-3511. [14] MAHLER G J, ESCH M B, TAKO E, et al. Oral exposure to polystyrene nanoparticles affects iron absorption[J]. Nature Nanotechnology, 2012, 7(4): 264-271. doi: 10.1038/nnano.2012.3 [15] XU X, FENG Y D, HAN C J, et al. Autophagic response of intestinal epithelial cells exposed to polystyrene nanoplastics[J]. Environmental Toxicology, 2023, 38(1): 205-215. doi: 10.1002/tox.23678 [16] HU Q L, WANG H, HE C, et al. Polystyrene nanoparticles trigger the activation of p38 MAPK and apoptosis via inducing oxidative stress in zebrafish and macrophage cells[J]. Environmental Pollution, 2021, 269: 116075. doi: 10.1016/j.envpol.2020.116075 [17] McCLEMENTS D J, DeLOID G, PYRGIOTAKIS G, et al. The role of the food matrix and gastrointestinal tract in the assessment of biological properties of ingested engineered nanomaterials (iENMs): State of the science and knowledge gaps[J]. NanoImpact, 2016, 3: 47-57. [18] YIN C Y, ZHAO W L, LIU R, et al. TiO2 particles in seafood and surimi products: Attention should be paid to their exposure and uptake through foods[J]. Chemosphere, 2017, 188: 541-547. doi: 10.1016/j.chemosphere.2017.08.168 [19] ERSÖZ N, ÇANGA E M, YILDIRIM-ELIKOGLU S, et al. Effect of real food matrix on the behavior and toxicity of TiO2 nanoparticles[J]. J Nanopart Res, 2022, 10: 211. [20] ZHANG Z P, ZHANG R J, XIAO H, et al. Development of a standardized food model for studying the impact of food matrix effects on the gastrointestinal fate and toxicity of ingested nanomaterials[J]. NanoImpact, 2019, 13: 13-25. doi: 10.1016/j.impact.2018.11.002 [21] DeLOID G M, CAO X Q, COREAS R, et al. Incineration-generated polyethylene micro-nanoplastics increase triglyceride lipolysis and absorption in an in vitro small intestinal epithelium model[J]. Environmental Science & Technology, 2022, 56(17): 12288-12297. [22] COREAS R, CAO X Q, DeLOID G M, et al. Lipid and protein Corona of food-grade TiO2 nanoparticles in simulated gastrointestinal digestion[J]. NanoImpact, 2020, 20: 100272. doi: 10.1016/j.impact.2020.100272 [23] LI Y, JIANG K, CAO H, et al. Establishment of a standardized dietary model for nanoparticles oral exposure studies[J]. Food Science & Nutrition, 2021, 9(3): 1441-1451. [24] LALOUX L, KASTRATI D, CAMBIER S, et al. The food matrix and the gastrointestinal fluids alter the features of silver nanoparticles[J]. Small, 2020, 16(21): 1907687. doi: 10.1002/smll.201907687 [25] LI Y, McCLEMENTS D J. Influence of non-ionic surfactant on electrostatic complexation of protein-coated oil droplets and ionic biopolymers (alginate and chitosan)[J]. Food Hydrocolloids, 2013, 33(2): 368-375. doi: 10.1016/j.foodhyd.2013.04.016 [26] LIU Y J, HU Y B, YANG C, et al. Aggregation kinetics of UV irradiated nanoplastics in aquatic environments[J]. Water Research, 2019, 163: 114870. doi: 10.1016/j.watres.2019.114870 [27] LU S H, ZHU K R, SONG W C, et al. Impact of water chemistry on surface charge and aggregation of polystyrene microspheres suspensions[J]. Science of the Total Environment, 2018, 630: 951-959. doi: 10.1016/j.scitotenv.2018.02.296 [28] ZHOU P F, GUO M F, CUI X Y. Effect of food on orally-ingested titanium dioxide and zinc oxide nanoparticle behaviors in simulated digestive tract[J]. Chemosphere, 2021, 268: 128843. doi: 10.1016/j.chemosphere.2020.128843 [29] DeLOID G M, WANG Y L, KAPRONEZAI K, et al. An integrated methodology for assessing the impact of food matrix and gastrointestinal effects on the biokinetics and cellular toxicity of ingested engineered nanomaterials[J]. Particle and Fibre Toxicology, 2017, 14(1): 40. doi: 10.1186/s12989-017-0221-5 [30] GO M R, BAE S H, KIM H J, et al. Interactions between food additive silica nanoparticles and food matrices[J]. Frontiers in Microbiology, 2017, 8: 1013. doi: 10.3389/fmicb.2017.01013 [31] ZHANG Y Y, PIGNATELLO J J, TAO S, et al. Bioaccessibility of PAHs in fuel soot assessed by an in vitro digestive model with absorptive sink: Effect of food ingestion[J]. Environmental Science & Technology, 2015, 49(24): 14641-14648. [32] KÄSTNER C, LICHTENSTEIN D, LAMPEN A, et al. Monitoring the fate of small silver nanoparticles during artificial digestion[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2017, 526: 76-81. [33] WALCZAK A P, FOKKINK R, PETERS R, et al. Behaviour of silver nanoparticles and silver ions in an in vitro human gastrointestinal digestion model[J]. Nanotoxicology, 2013, 7(7): 1198-1210. doi: 10.3109/17435390.2012.726382 [34] CAO X Q, HAN Y H, LI F, et al. Impact of protein-nanoparticle interactions on gastrointestinal fate of ingested nanoparticles: Not just simple protein Corona effects[J]. NanoImpact, 2019, 13: 37-43. doi: 10.1016/j.impact.2018.12.002 [35] van AKEN G A. Relating food emulsion structure and composition to the way it is processed in the gastrointestinal tract and physiological responses: What are the opportunities?[J]. Food Biophysics, 2010, 5(4): 258-283. doi: 10.1007/s11483-010-9160-5 [36] DEGEN L P, PHILLIPS S F. Variability of gastrointestinal transit in healthy women and men[J]. Gut, 1996, 39(2): 299-305. doi: 10.1136/gut.39.2.299 -






 DownLoad:
DownLoad: