-
双酚类物质(bisphenol compounds, BPs)是一类通过桥碳或其他化学结构将两个酚环连接在一起的化合物. 1891年被首次合成的双酚A(bisphenol A, BPA),由于其合成的聚合物材料具有良好的强度、硬度、热稳定性和耐酸耐油性能,已被广泛用于食品包装和饮料容器制造等[1 − 2]. BPA在环境中普遍存在[3 − 6],由于其具有内分泌干扰效应,近年来在消费品领域已被限制使用[2].
对BPA的限制使用促进了其替代品的研发和应用,如双酚S(bisphenol S, BPS)和双酚AF(bisphenol AF, BPAF)等. BPS是BPA分子结构中的丙烷基被砜基(O = S = O)取代而得到的衍生物,而BPAF是BPA分子中桥碳上的甲基被氟化而得到的一类含氟化合物,由于二者特有的化学结构,BPS和BPAF的化学性质比BPA稳定[7 − 8],具有更高的机械性能、光热稳定性和抗氧化性能,因此在聚合物的生产中得到了广泛应用[7,9].
随着日用消费品使用量的增加,BPS和BPAF在多种环境介质中均有检出,如天然水体、农田土壤、沉积物、室内灰尘等[7,10 − 12]. BPS和BPAF也具有和BPA类似的内分泌干扰物毒性[8,13],且由于BPS结构中含有基团O = S = O [14],以及BPAF结构中含有CF3基团,二者的结构更复杂[7 − 8],在环境中难以被生物转化[15],特别是在水体中的生物利用率较低[16 − 17].
有机污染物进入环境后的转化方式主要有非生物转化(光解、水解及氧化还原等)和生物转化[18]. 其中,生物转化被认为是控制有机污染物持续释放到环境中的重要途径[19],目前国内外学者针对转化BPS功能菌的筛选,以及BPS和BPAF在微生物中的转化途径已展开研究,这对于难降解双酚类物质生物转化机理的阐明和污染环境的修复具有重要意义. 本文基于对国内外文献的调研,综述了环境中BPS和BPAF的来源和分布,总结了已报道的BPS和BPAF微生物转化途径,并针对现有研究中的不足提出展望,为BPS和BPAF微生物转化的机制阐明和污染环境修复提供科学依据.
-
BPS(4,4'-二羟基二苯砜),化学式为(HOC6H4)2SO2,分子量为250.27 g·mol−1(表1),性状为白色针状结晶,易溶于脂肪烃,溶于醇和醚,微溶于芳香烃,其lgKow值为1.65,20 ℃时在水中的溶解度为
1774 mg·L−1[10],比BPA具有较高的水溶性. BPAF(4,4 '-[2,2,2-三氟-1-(三氟甲基)乙酰]双酚),化学式为C15H10F6O2,分子量为336.23 g·mol−1,性状为白色粉末或晶体,溶于醇和醚,微溶于水. 由于BPS和BPAF化学结构和理化性质的特殊性,二者的环境行为也区别于BPA. -
BPS和BPAF已作为BPA“安全的替代品”被广泛应用到生产生活中. BPS是生产环氧树脂和聚碳酸酯塑料的重要中间体[23],根据欧洲化学品管理局的报告,BPS在欧洲经济区的年制造和进口量可高达
1000 —10000 吨[21]. BPAF主要用作氟橡胶、电子和光学纤维中的交联剂[24],并被作为高性能单体用于生产复合材料和聚合物. 虽然目前中国国内BPAF的总年产量尚不明确,但有报道表明仅浙江嘉兴的一家BPAF制造厂在2009年的产量就超过100吨[25],而美国早在1986—2002年期间BPAF的年产量就已经从1万磅迅速升至50万磅[26]. 同时,BPS和BPAF作为一种新型增塑剂,很容易随着塑料颗粒在环境中迁移,Xue等发现从微塑料颗粒中的释放可能是污水处理厂中BPS的来源之一[27].BPS还是热敏纸中的显色剂,据欧盟委员会报告30%的热敏纸使用后会进入废纸回收流,被循环使用作为厨房用纸、食品包装纸等食品接触纸制品[21]. Russo等从意大利收集的50个不同来源热敏纸中,其中的31个样本有BPS的检出,平均浓度为419.7 μg·g−1[28];从中国、韩国、日本和美国收集的103份热敏纸样品中BPS的平均浓度为
7440 μg·g−1[29],因此热敏纸也是环境中BPS的一个重要来源. 此外,BPS和BPAF还可以通过油漆涂料、光盘、医疗电子设备等挥发释放到室内粉尘中[30],继而随空气流动、污水排放和固体废弃物的浸出等途径迁移至土壤、水体和沉积物中形成环境污染[31],或随食物链在生物体中积累[21]. -
随着含有BPS和BPAF的产品在人类日常生活中的普遍使用,目前在天然水体、沉积物、污水污泥、室内灰尘等多种环境介质中均能检测到BPS和BPAF(表2). 对BPS和BPAF在不同环境介质中浓度和分布的调查,有助于污染溯源及风险预测,且对于降解微生物的筛选具有参考价值.
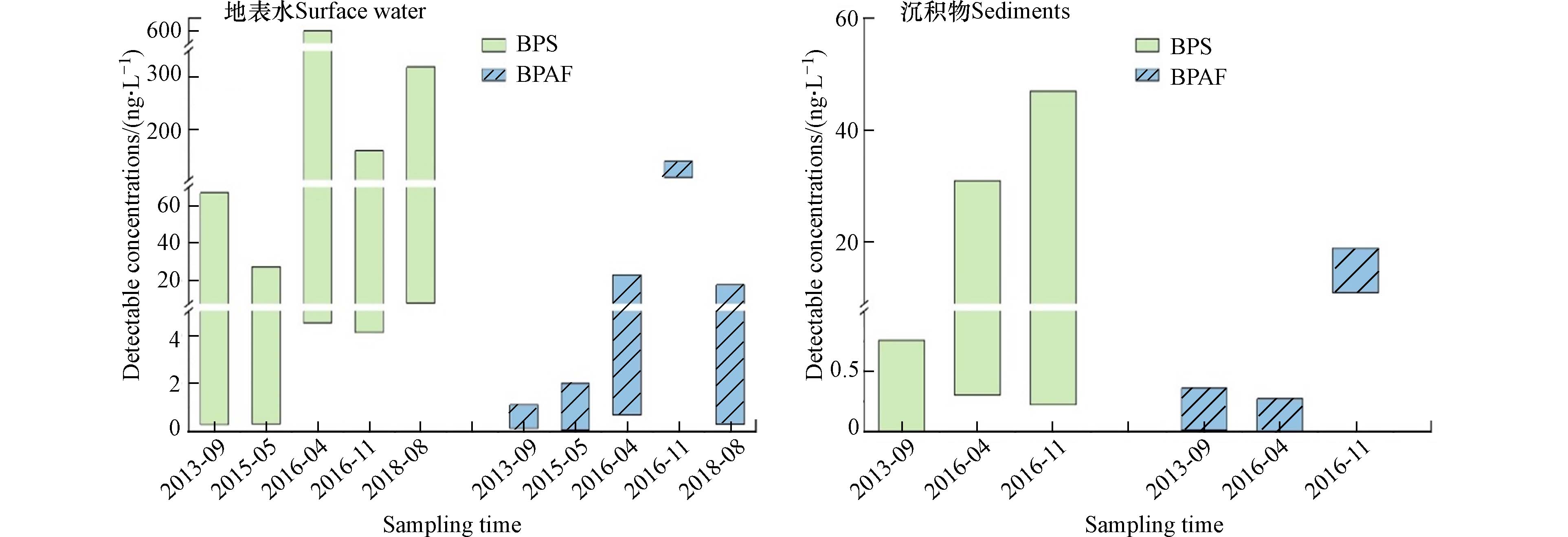
地表水和沉积物中常能检测到BPS和BPAF,目前已有研究关注了BPS和BPAF以及其他BPA替代品的环境浓度,如Song等2012年调查了中国浙江嘉兴一个制造工厂周围环境中BPAF的分布和浓度,结果表明在河水(ND—
15300 ng·Lg−1)、沉积物(0.520—200 ng·g−1干重)、土壤(ND—31 ng·g−1干重)、室内粉尘(7.82—739 ng·g−1干重)和井水(ND—300 ng·L−1)中均检测到BPAF[26]. Yamazaki等检测了中国、日本、韩国和印度的多条河流表层水中包括BPA和BPS在内的多种双酚类物质的含量,发现印度河流中BPS的检出浓度相对较高[34]. 2016年Jin等调查了中国太湖、浑河和辽河沉积物中多种双酚类物质的含量,发现其中BPA(检出率100%)、BPAF(检出率100%)和BPS(检出率57%)的检出频次最高[10]. 太湖沉积物中BPS和BPAF的检出浓度为ND—0.76 ng·g−1和0.01—0.36 ng·g−1,高于浑河流域(ND—0.42 ng·g−1干重和ND—0.012 ng·g−1干重)[10]. 2017年Liu等研究发现BPA(3.6—2.7×102 ng·g−1干重)是太湖沉积物中最主要的双酚类物质,BPAF和BPS的检出量分别在11—19 ng·L−1和0.22—47 ng·L−1[12]. 对比2013—2018年的太湖表层水体和沉积物中双酚化合物的检出浓度,可以发现在短短的几年中,BPS和BPAF在太湖水体和沉积物中的浓度虽然有所波动,但整体呈现逐年上升趋势(图1)[10 − 12,53].除地表水和沉积物之外,2014年Song等调查了中国30个城市共52个污水处理厂污泥样本中13种双酚类物质的分布情况,结果发现其中BPS(平均值3.02 ng·g−1,中值4.34 ng·g−1)对检出双酚类物质总量的平均贡献率为15.7%,同时在污泥样品中检测到BPAF(平均值0.85 ng·g−1,中值0.42 ng·g−1)[47]. 2015年Lee等调查了韩国40个代表性污水处理厂污泥中的多种双酚类物质浓度,结果显示来源于造纸和纺织工业污水处理厂的污泥中双酚类物质的浓度最高,检出率最高的是BPA(检出率97.5%),其次是双酚F(bisphenol F, BPF)(检出率75%)和BPS(检出率70%)[48]. Xue等测定了美国74个废水处理厂收集的76种污泥样品中8种双酚类物质的分布情况,发现BPS的检出率(84%)仅次于最高的BPA(100%),BPF和BPAF的检出率紧随其后(68%和46%)[27]. 2017年Sun等在中国厦门污水处理厂的进出水中均检测到BPS和BPAF,BPS进出水平均浓度分别为55.7 ng·L−1和0.901 ng·L−1;BPAF的进出水平均浓度分别为3.02 ng·L−1和1.16 ng·L−1[43]. 因此,城市污水处理厂中污水和污泥的排放也是双酚类物质释放到环境中的重要途径之一.
此外,研究显示室内粉尘中也多有BPS和BPAF的检出. 2012年Liao等检测了美国、中国、日本和韩国的156个家庭、办公室、实验室和宿舍的室内粉尘样本中双酚类物质的含量,发现韩国的粉尘样品中双酚类物质的总浓度最高(1.29—111 μg·g−1),其次是日本(1.08—24.7 μg·g−1)、美国(0.30—33.4 μg·g−1)和中国(0.026—13.5 μg·g−1);在所有被检出的双酚类物质中,BPA和BPS占总浓度的98%以上[30],被认为是室内粉尘中的主要污染物;同时BPAF在韩国灰尘样本中的检出率较高(76%)[30]. 2015年Wang等测定了包括中国在内的12个国家的388个室内粉尘样品中8种双酚类物质的含量,结果发现粉尘样品中广泛存在BPA、BPS和BPAF[51],这与Liao等的研究结果一致.
大量研究表明,双酚类物质广泛存在于各种环境介质中,其中BPS的检出频率和检出浓度仅次于BPA,BPAF也在多种环境介质中被广泛检出,且BPS和BPAF在自然环境中很难被转化[7 − 8],因此BPS和BPAF的释放对环境安全和人类健康所带来的威胁相较于其它双酚类物质更大.
-
BPS和BPAF通过多种途径进入环境之后,可以在环境中积累并进入人体,引发一系列内分泌干扰效应[7,9],潜在的人体健康风险使得该类物质在环境中的去除已经引起了广泛的关注. 研究证实,物理、化学和生物法都可以有效去除环境中的BPS或BPAF,其中物理和化学技术主要包括吸附、高级氧化和光催化等,例如石墨烯基复合材料已被证实是双酚类似物的优良吸附剂[54 − 55],Li等发现还原氧化石墨烯(rGO)具有较好的BPS吸附能力,吸附容量可以达到261.74 mg·g-1[56]. 除此之外,目前包括石墨烯、碳纳米管、石墨和生物炭在内的碳基吸附剂都已被应用于去除水中的BPS[7]. Wang等采用热活化的过硫酸盐降解BPS,可使初始浓度为6.25 mg·L−1的BPS在150 min内被完全氧化[57]. 有研究者证实添加紫外光照射的光-Fenton催化反应,可以在20 min内使10 mg·L−1的BPS完全转化生成苯酚和硫酸盐[58],Liu等研究表明光催化产生的羟基自由基可以氧化BPAF[59]. Yang等发现BPS和BPAF在高铁酸盐存在的条件下可被转化且产物无毒[60]. Jia等研究表明,在模拟阳光照射的条件下,TiO2纳米管阵列可以显著促进过氧单硫酸盐(PMS)对BPAF和BPS的降解[61]. 然而,现有的物理化学方法存在易引发二次污染、操作工艺复杂、治理成本高、运行费用高等缺点,因此人们开始更多地关注生物技术在去除BPS和BPAF方面的应用潜力.
-
现有研究表明,BPS和BPAF在水体中不易被转化,会不断积累并随水流持续向其他环境中排放. Danzl等研究不同双酚类物质在海水中的生物转化,结果发现经过30 d的培养,BPA和BPF的转化效率分别为83%和92%,但未观察到BPS的转化[16]. Ike等采集河流水样进行了双酚类物质在有氧和无氧条件下的生物降解实验,结果表明有氧条件下BPS不能被生物转化,但是在无氧条件下77 d内BPS的去除率可以达到60%左右[62]. Zhou等发现BPA等8种双酚类物质在太湖水中的半衰期为12 d至7 d,但并未观察到BPS和BPAF的生物转化[53]. Frankowski等利用河水和取自城市和农村污水处理厂活性污泥中的微生物菌群去除BPA及其5种替代品,结果发现28 d内只有BPA和BPF去除率达到100%,其余双酚类物质的去除率均低于50%[63].
然而,一些研究证实土壤和沉积物中存在具有高效转化BPS能力的微生物. 如在太湖底泥中BPS可被转化,且53 d后矿化量达到26%[53]. Wang等从河流沉积物中分离出高效转化BPS的联合菌群,使用BPS作为唯一碳源,该菌群10 d内对初始浓度为50 mg·L−1的BPS去除率高达99%[64]. Cao等发现在水稻土中培养28 d后,初始浓度为2 mg·kg−1的BPS的矿化量可达53.6%[65]. Choi等研究了BPS和BPAF在森林土壤和有机农田土壤中好氧生物的降解转化效率,两种土壤中BPS的半衰期分别为0.59 d和0.69 d,BPAF半衰期分别为24.5 d和32.6 d[15].
城市污水处理厂同样具备去除BPS和BPAF的能力. 现有研究中城市污水处理厂中BPS的平均去除率为81.2%,且微生物降解可能在其中发挥了重要作用[66]. Sun等探究了中国厦门7个污水处理厂的废水和活性污泥中5种双酚类化合物的去除情况,发现7 d内厌氧过程对BPS的平均去除率高达98.9%,但BPAF和双酚E(bisphenol E)BPE去除效率较低[43]. 然而,Choi等研究发现在产甲烷条件的厌氧污泥中,14 d内未观察到BPS和BPAF的降解[67]. Xue等研究了美国纽约两个污水处理厂中BPS的去除情况,结果发现其中BPS的去除率仅为6.4%和24%[27]. Qian等探究了中国深圳4个污水处理厂中10种双酚类化合物的去除情况,其中膜生物反应器(MBR)对BPS的去除率最高,达到99%;生物充气过滤器中BPS的去除率为62.9%;而4个污水处理厂中BPAF的去除率仅为4.4%—38.9%,这种差异主要可以归因于不同污泥中的功能菌群结构的不同[44].
-
BPS虽是BPA的替代品,但由于其化学结构中含有砜基(O = S = O),其生物转化途径和BPA有较大差异[14],生物转化难度也比BPA更大. 目前关于BPS的微生物转化途径及代谢产物的研究十分有限,表3中列出了目前已分离的具有转化BPS功能的纯培养菌株及其转化效率和转化途径. 其中大部分菌株属于鞘氨醇单胞菌科(Sphingomonadaceae),包括鞘氨醇单胞菌属(Sphingomonas)和鞘酯菌属(Sphingobium),其他菌属如土生单胞菌属(Terrimonas)、假单胞菌属(Pseudomonas)中也有转化BPS的功能菌存在.
Sakai等从海水中分离出的菌株Sphingomonas sp. BP-7,可以通过BPA中甲基碳原子或α-季碳的羟基化,引发BPA的氧化碳骨架重排途径,并脱水断键生成对羟基苯乙酮与对羟基苯甲酸,40 d内对100 mg·L−1 BPA的降解率超过95%[68],但由于BPS的两个酚环是通过硫原子桥连,因此BPS不会通过氧化骨架重排途径被生物转化,菌株BP-7对BPS几乎不转化,其转化效率只有2.8%[69].
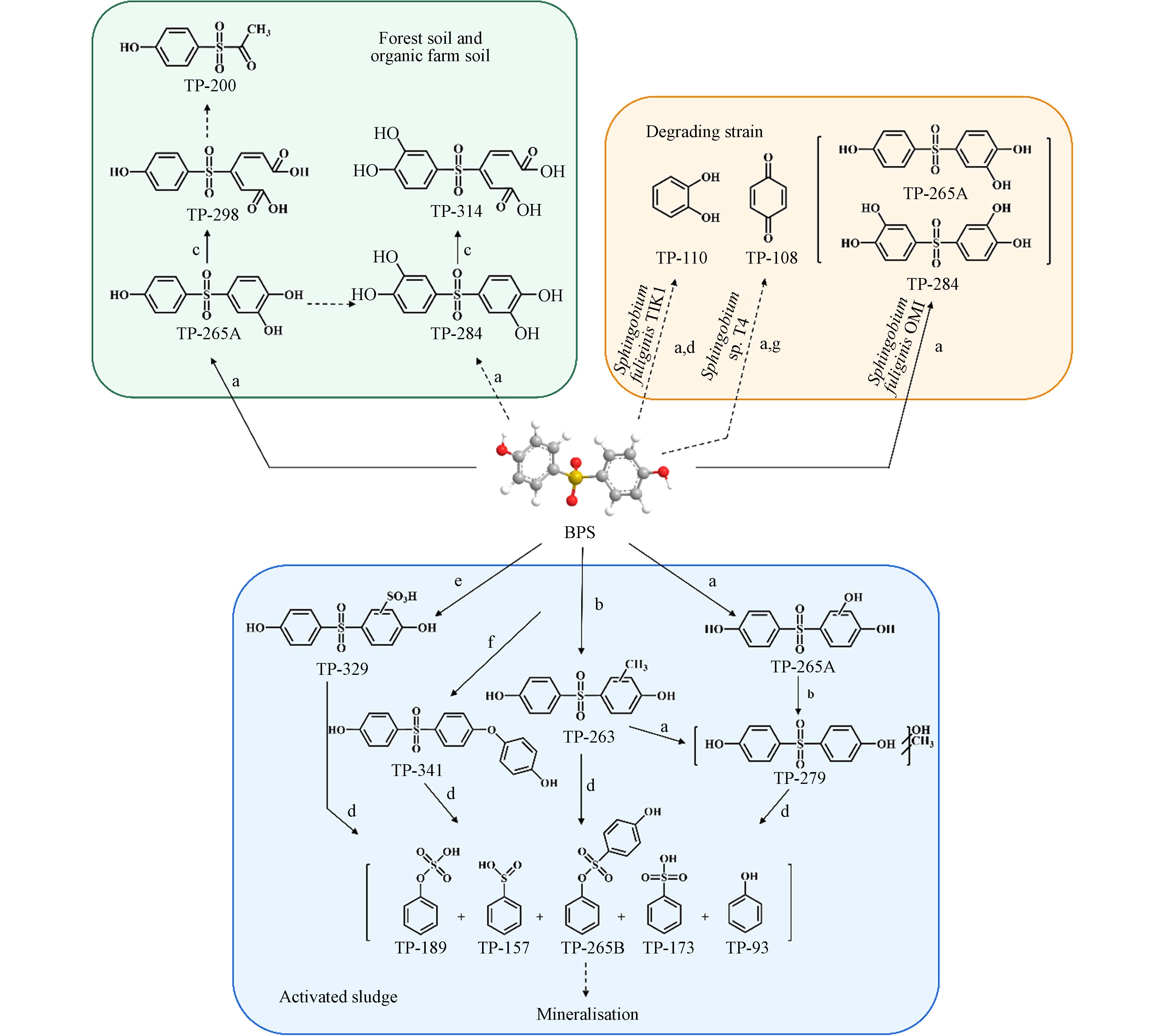
从巨型浮萍(Spirodelapolyrrhiza)根际筛选出的菌株Sphingobium fuliginis OMI可完全降解BPS,并生成代谢产物——羟基-BPS和2,2’-二羟基-BPS[68];从芦苇(Phragmites australis)根际沉积物中分离的菌株Sphingobium fuliginis TIK1和Sphingobium sp. IT4在培养24 h后可将0.5 mmol·L−1的BPS完全降解[69,71]. 其中菌株OMI[68]和菌株TIK1[69]是通过酚环羟基化和间位裂解途径降解BPS,菌株IT4[71]是通过原位羟基取代的途径降解BPS,其主要降解产物为对苯醌(图2). Choi等探究了BPA、BPS和BPAF在森林土壤和有机农田土壤中的生物降解机制,并阐明BPS主要是通过酚环羟基化和邻位裂解途径发生降解(图2)[15].
Wang等从黄浦江沉积物中分离出两株具有BPS转化能力的菌株Terrimonas pekingensis WDS和Pseudomonas sp. HDS,在培养10 d后两株菌(OD600 ≤ 0.1)对10 mg·L−1的BPS的转化效率分别为8.0%和15.6%;同时还驯化出具有转化BPS能力的富集菌液DS,该富集液在10 d内对50 mg·L−1的BPS的转化效率高达99%[57]. 由此可见与纯培养菌株相比,菌群对BPS的转化具有更大潜力. 大量的研究结果都表明菌群在有机污染物转化方面所表现出的效率显著优于单菌,这主要是由于与单一物种相比,菌群包含更多的代谢途径,具备更高广泛的碳氢化合物代谢范围[74].
近期的研究指出,活性污泥中的微生物也具有降解BPS的能力. Zhao的研究发现,分离自活性污泥的菌株Sphingomonas sp. TTNP3[72]在pH为7培养温度30 ℃条件下,可在36 h内去除40 mg·L−1的BPS[73]. Kovačič等通过研究BPS在活性污泥生物废水处理过程中的生物降解动力学发现BPS易降解且不会在生物固体或废水中积累,初始浓度为0.1 mg·L−1的BPS降解半衰期小于4.3 d,降解效率随着BPS初始浓度的增加而降低[75]. 通过鉴定BPS转化过程中的代谢产物提出了BPS新的生物转化途径,包括羟基化、甲基化、硫化、BPS部分偶联和C—S键断裂(图2)[75]. 但是对于此活性污泥生物废水处理体系中BPS降解菌的物种及其作用机制还需进一步探究.
-
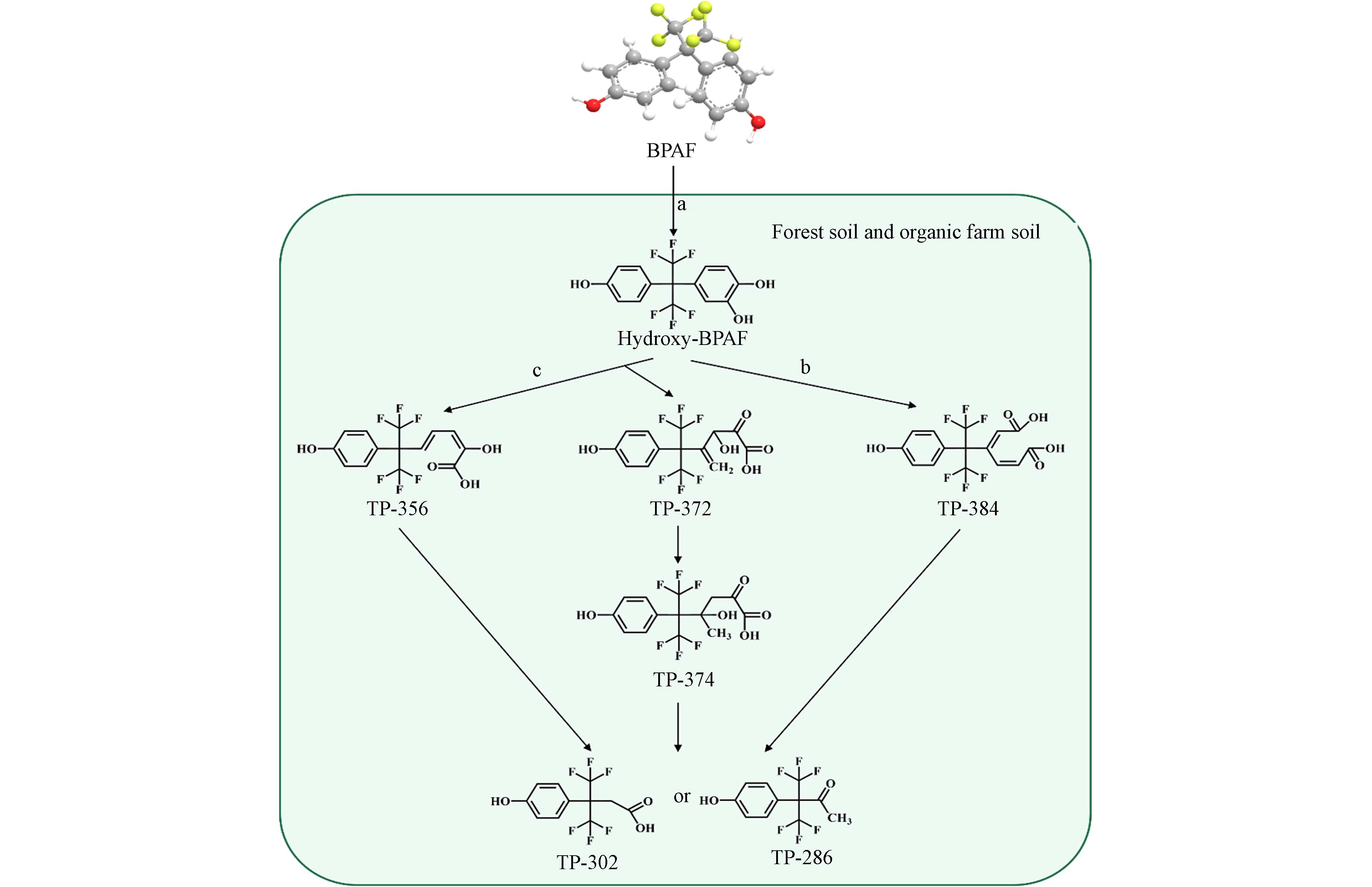
由于BPAF具有含氟化合物的特殊性质,其生物转化难度比BPA要大得多. 目前关于BPAF生物转化途径和产物的研究极其有限. Choi等探究了BPAF在森林土壤和有机农田土壤中的生物转化途径,推测出BPAF通过酚环羟基化和间位裂解或邻位裂解途径生成8种转化产物(图3)[15].
以上研究表明,在BPA、BPS和BPAF的转化过程中均检测到酚环羟基化-间位裂解反应产物,表明酚环羟基化-间位裂解途径对双酚类物质的降解具有普适性,不受连接两个酚环的化学结构和基团影响.
-
由于BPS的生物利用度较低,一些研究尝试改良方法以提高BPS的生物降解效率. Huang等研究发现在活性污泥生物反应器中50 mg·L−1BPS的完全去除需要8 d,但在向反应体系中加入50 mg·L−1的腐殖酸之后,该反应器的去除效率有所提高,完全转化的时间缩短至6 d[76];Zhou等也发现BPAF在太湖水体中不降解,但在添加腐殖酸的条件下其半衰期为71 d[53],这是由于腐殖酸具有类似表面活性剂的胶束微观结构,可能会提高微生物对BPS和BPAF的生物可利用度[77];同时,腐殖酸作为有机质含量复杂的碳源,可以通过共代谢加速这类物质的去除. 此外,Wirasnita等发现添加活性炭的人工湿地可以在8周内去除98%的BPS[78],去除效率显著高于普通人工湿地,这主要是因为活性炭可以吸附BPS,使其被附着在活性炭内部的菌群高效利用[78].
Beck等发现白腐真菌(Trametes versicolor)分泌的漆酶对于BPA有良好的生物降解特性,但是无法降解BPS[79]. Zdarta等将该漆酶固定在海绵蛋白支架上,25 h内可对初始浓度2 mg·L−1的BPS实现47%的生物转化[14]. 同时固定化漆酶表现出良好的可重复利用性和存储稳定性,在存储50 d后仍可保持其80%以上的初始活性,漆酶的固定化提高了其对BPS的催化降解作用. 类似的,Solé 等发现将微藻固定在海藻酸盐上可在10 d内去除高达80%初始浓度为10 mg·L−1的BPAF[80]. 由此可见,固定化微生物技术可以有效提高难降解双酚类化合物的生物降解效率,很可能成为双酚类化合物污染环境修复的重要手段,其具体应用与实践还有待进一步探究.
此外,一些通过外加条件驱动的BPS转化机制近年来也被报道. Hou等结合稳定同位素辅助代谢组学(SIAM)和稳定同位素探针(13C-DNA -SIP)技术探究了电化学活性生物膜(EABs)对BPS的转化机制[81]. 该研究检测到6个通过水解、氧化、烷基化或酚环裂解反应生成的13C完全标记的转化产物[81]. 与生物转化途径不同,水解和氧化分别是BPS的生物电化学转化过程的初始和关键途径,这是由电活性微生物和BPS同化物协同完成的[81].
-
双酚类物质对环境安全和人体健康构成的威胁已经引发了广泛的关注,微生物的转化被认为是控制双酚类物质释放到环境中的有效途径之一. 然而,目前的相关研究主要集中在BPA降解菌的筛选及其降解机制的探究,而对于生物难利用的BPA替代物BPS和BPAF的研究,不论是具有转化能力的微生物资源的开发,或是相关的微生物转化途径及代谢产物的分析都十分有限,因此后续关于BPS和BPAF生物转化研究的方向和重点可以从以下角度出发(图4).
-
目前,对于土壤、沉积物以及污水处理厂活性污泥等对BPS和BPAF有良好转化效果体系的研究,仅停留在转化能力和效率的评估,未深入探究其生物转化机制以及菌群中不同微生物在转化过程中的贡献. 现有的研究局限于极少数的纯培养菌株对BPS转化机制,而BPS降解过程中微生物群落之间协同作用机制尚不明确,BPAF降解过程中生物转化机制的研究亦尚未开展. 今后的研究可以利用稳定性同位素核酸探针(DNA-SIP)等技术甄别菌群中直接参与污染物转化的关键物种,并结合分子生态网络构建等生物信息学技术,进一步揭示BPS和BPAF转化过程中微生物的互作机制.
-
目前尚缺乏BPS,特别是BPAF降解菌的种质资源,仅有极少数具有BPS降解能力的纯培养菌株,如鞘脂菌属菌株Sphingobium fuliginis OMI、Sphingobium fuliginis TIK1、Sphingobium sp. IT4和鞘氨醇单胞菌属菌株Sphingomonas sp. TTNP3等[68 − 69],未见BPS降解菌群和BPAF降解菌株或菌群的报道,这些种质资源对于BPS和BPAF生物去除的研究至关重要. 菌群构建在原油[74]、抗生素[82]、有机染料[83]、废水[84]、纤维素[85]和海洋有机污染物[86]的微生物降解中已有应用,而在双酚类物质生物转化中的应用尚未开展. 由于参与污染物转化的功能菌采用传统培养技术很难被分离筛选,未来研究中可以应用新型微生物筛分技术,如基于拉曼光谱的单细胞分选技术(Raman-SIP)等解决传统纯培养的局限性,该技术是一种强大的功能生物细胞探查方法,可以在单细胞水平上实现对降解微生物的原位识别和分离,进而可以用于构建具有BPS和BPAF高效降解能力的菌群,为双酚类物质污染环境的修复提供种质资源.
-
目前关于BPS和BPAF的代谢途径的研究十分有限. 虽然已经对少数纯菌或环境介质中的BPS和BPAF转化途径进行了探究,但是已鉴定出的转化产物的种类极其有限,且各途径是由哪些微生物介导,以及在整个菌群的作用下BPS和BPAF的完整转化路径尚不清楚. 尚未深入探究不同环境体系中可能存在的不同降解途径,及不同微生物在BPS和BPAF降解过程中的贡献,同时,对BPS和BPAF降解产生的下游产物引发的环境效应及其进一步转化机制的研究也存在空白. 因此今后的研究可以考虑将化学定量方法(如HPLC-QTOF-MS法)、标记技术(如DNA-SIP技术)和组学技术(如高通量测序技术)相结合,通过同位素示踪溯源结合组学数据分析以获得准确的降解产物和降解途径,这将为BPS和BPAF生物转化机理的全面阐明提供科学依据.
-
目前的研究主要是通过高浓度BPS长期驯化获得BPS降解菌群,并通过传统分离纯化技术获得纯培养菌株. 然而,微生物群落结构在长期驯化的过程中向着BPS降解菌优势化的方向演化,与真实环境中的原位微生物群落存在差异;同时BPS的环境浓度普遍低于驯化过程中BPS的投加量,因此使用高浓度污染物长期驯化的方法仅局限于纯菌转化BPS机制的研究,无法反映真实环境中的降解过程. 对于BPAF降解菌株的纯化分离以及原位环境下BPAF降解机制的研究更是尚未开展. 因此今后的研究更应关注真实环境条件下BPS和BPAF的降解机制,以期为污染源追踪和污染物在降解菌的种内、种间转化机制分析提供依据. 这有助于人们深入理解真实环境中BPS和BPAF的迁移转化过程,并对污水和土壤等实际环境中BPS和BPAF的去除具有指导意义.
-
降解菌在有机废水处理的应用中对复杂环境介质耐受差、难以定殖,且无法重复利用,污水处理厂等体系无法完全满足降解菌的最适生长条件. 而关于BPS降解菌最适生长条件的研究十分有限,且环境因素对降解效率的影响尚不明确,因此无法最大化发挥体系中降解菌的降解潜能. 今后的研究可以考虑优化pH、温度、底物投加量和外加碳、氮源等培养条件以提高微生物对BPS和BPAF的转化效率. 研究表明固定化微生物具有耐冲击负荷高、菌体不易流失、可以重复使用和产物易分离等优点,今后的研究也可以考虑利用微生物固定化手段,通过将功能菌群固定于载体上以克服悬浮系功能菌的缺陷,同时提高降解菌的降解效率.
-
双酚类物质是一类通过桥碳或其他化学结构将两个酚环连接在一起的化合物,具有相同的结构通式,由于其化学结构存在差异,在环境中具有转化潜力的微生物物种不甚相同,微生物转化途径也可能有所不同. 除BPS和BPAF之外,还有10余种BPA的替代物,它们的生物转化机制是否存在差异同样值得关注,这有助于系统性阐明双酚类物质的生物转化途径,以及修复双酚类化合物引起的环境污染.
双酚S和双酚AF的环境分布及微生物转化的研究进展
Research progress on environmental distribution and microbial transformation of bisphenol S and bisphenol AF
-
摘要: 双酚S(bisphenol S,BPS)和双酚AF(bisphenol AF,BPAF)是两种使用量最大的双酚A(bisphenol A,BPA)替代品,应用于高分子材料和日常消费品领域,近年来在环境中被广泛检出. 相较于其他双酚类物质,BPS和BPAF因其化学结构特性而难以被生物利用,对生态环境和人体健康构成威胁. 然而,目前已有少量研究表明在土壤、沉积物和活性污泥中BPS和BPAF可被有效转化. 本文在阐述环境中BPS和BPAF的来源和分布的基础上,回顾了已报道的具有转化BPS和BPAF功能的微生物,总结其转化产物和途径,并提出BPS和BPAF转化机制研究中存在的不足以及对未来研究方向的展望,以期为双酚类化合物污染环境的修复提供科学依据.Abstract: Bisphenol S (BPS) and bisphenol AF (BPAF) have emerged as the primary alternatives to bisphenol A (BPA), finding extensive applications in polymer materials and the manufacturing of daily consumer products. Their widespread presence in the environment has raised concerns in recent years. Notably, the unique chemical structures of BPS and BPAF make them resistant to biotransformation compared to other bisphenol compounds, thereby posing a significant threat to both ecological systems and human health. This paper highlights recent research indicating the potential for effective transformation of BPS and BPAF in soil, sediment, and activated sludge. Based on demonstration of the sources and distribution of BPS and BPAF in the environment, we reviewed microorganisms reported to possess the ability to transform these compounds, and summarized products and pathways associated with this transformation. Additionally, challenges and opportunities were proposed for further exploration into the biotransformation mechanisms of BPS and BPAF. In summary, this review serves as a scientific foundation for developing strategies to remediate environments contaminated with bisphenol compounds.
-
双酚类物质(bisphenol compounds, BPs)是一类通过桥碳或其他化学结构将两个酚环连接在一起的化合物. 1891年被首次合成的双酚A(bisphenol A, BPA),由于其合成的聚合物材料具有良好的强度、硬度、热稳定性和耐酸耐油性能,已被广泛用于食品包装和饮料容器制造等[1 − 2]. BPA在环境中普遍存在[3 − 6],由于其具有内分泌干扰效应,近年来在消费品领域已被限制使用[2].
对BPA的限制使用促进了其替代品的研发和应用,如双酚S(bisphenol S, BPS)和双酚AF(bisphenol AF, BPAF)等. BPS是BPA分子结构中的丙烷基被砜基(O = S = O)取代而得到的衍生物,而BPAF是BPA分子中桥碳上的甲基被氟化而得到的一类含氟化合物,由于二者特有的化学结构,BPS和BPAF的化学性质比BPA稳定[7 − 8],具有更高的机械性能、光热稳定性和抗氧化性能,因此在聚合物的生产中得到了广泛应用[7,9].
随着日用消费品使用量的增加,BPS和BPAF在多种环境介质中均有检出,如天然水体、农田土壤、沉积物、室内灰尘等[7,10 − 12]. BPS和BPAF也具有和BPA类似的内分泌干扰物毒性[8,13],且由于BPS结构中含有基团O = S = O [14],以及BPAF结构中含有CF3基团,二者的结构更复杂[7 − 8],在环境中难以被生物转化[15],特别是在水体中的生物利用率较低[16 − 17].
有机污染物进入环境后的转化方式主要有非生物转化(光解、水解及氧化还原等)和生物转化[18]. 其中,生物转化被认为是控制有机污染物持续释放到环境中的重要途径[19],目前国内外学者针对转化BPS功能菌的筛选,以及BPS和BPAF在微生物中的转化途径已展开研究,这对于难降解双酚类物质生物转化机理的阐明和污染环境的修复具有重要意义. 本文基于对国内外文献的调研,综述了环境中BPS和BPAF的来源和分布,总结了已报道的BPS和BPAF微生物转化途径,并针对现有研究中的不足提出展望,为BPS和BPAF微生物转化的机制阐明和污染环境修复提供科学依据.
1. 环境中BPS和BPAF的来源和分布(Environmental sources and distribution of BPS and BPAF)
1.1 理化性质
BPS(4,4'-二羟基二苯砜),化学式为(HOC6H4)2SO2,分子量为250.27 g·mol−1(表1),性状为白色针状结晶,易溶于脂肪烃,溶于醇和醚,微溶于芳香烃,其lgKow值为1.65,20 ℃时在水中的溶解度为
1774 mg·L−1[10],比BPA具有较高的水溶性. BPAF(4,4 '-[2,2,2-三氟-1-(三氟甲基)乙酰]双酚),化学式为C15H10F6O2,分子量为336.23 g·mol−1,性状为白色粉末或晶体,溶于醇和醚,微溶于水. 由于BPS和BPAF化学结构和理化性质的特殊性,二者的环境行为也区别于BPA.性质Properties 双酚SBPS 双酚AFBPAF 化学名 4,4'-二羟基二苯砜 2,2-二(4-羟基苯基)六氟丙烷 CAS 080-09-1 1478 -61-1分子式 C12H10SO4 C15H10F6O2 化学结构式 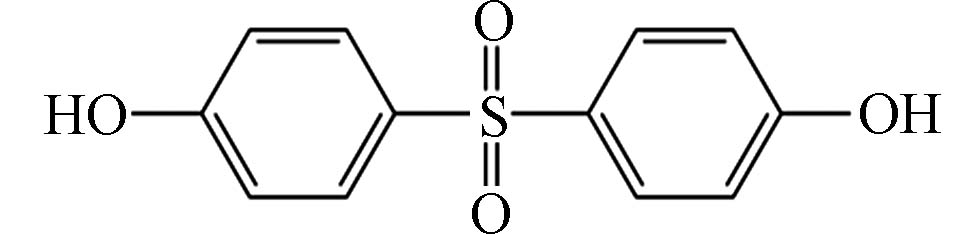
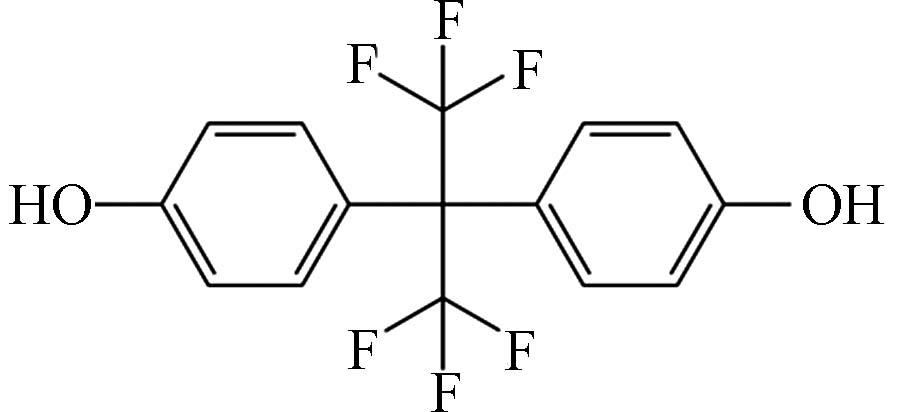
分子量(M) 250.27 g·mol−1 336.23 g·mol−1 熔点(m.p.) 245—250 ℃ 159—164 ℃ 沸点(b.p.) 505.3 °C (0.1 MPa) 316.7 °C (0.1 MPa) 密度(ρ) 1.37 g·cm−3 1.37 g·cm−3 水溶性(Sw) 1774 mg·L−1 (20 ℃)0.84 mg·L−1 (20 ℃) 解离常数(pKa1, pKa2) 7.42, 8.03 9.13, 9.74 辛醇/水系数(lgKow) 1.65 4.64 1.2 主要来源
BPS和BPAF已作为BPA“安全的替代品”被广泛应用到生产生活中. BPS是生产环氧树脂和聚碳酸酯塑料的重要中间体[23],根据欧洲化学品管理局的报告,BPS在欧洲经济区的年制造和进口量可高达
1000 —10000 吨[21]. BPAF主要用作氟橡胶、电子和光学纤维中的交联剂[24],并被作为高性能单体用于生产复合材料和聚合物. 虽然目前中国国内BPAF的总年产量尚不明确,但有报道表明仅浙江嘉兴的一家BPAF制造厂在2009年的产量就超过100吨[25],而美国早在1986—2002年期间BPAF的年产量就已经从1万磅迅速升至50万磅[26]. 同时,BPS和BPAF作为一种新型增塑剂,很容易随着塑料颗粒在环境中迁移,Xue等发现从微塑料颗粒中的释放可能是污水处理厂中BPS的来源之一[27].BPS还是热敏纸中的显色剂,据欧盟委员会报告30%的热敏纸使用后会进入废纸回收流,被循环使用作为厨房用纸、食品包装纸等食品接触纸制品[21]. Russo等从意大利收集的50个不同来源热敏纸中,其中的31个样本有BPS的检出,平均浓度为419.7 μg·g−1[28];从中国、韩国、日本和美国收集的103份热敏纸样品中BPS的平均浓度为
7440 μg·g−1[29],因此热敏纸也是环境中BPS的一个重要来源. 此外,BPS和BPAF还可以通过油漆涂料、光盘、医疗电子设备等挥发释放到室内粉尘中[30],继而随空气流动、污水排放和固体废弃物的浸出等途径迁移至土壤、水体和沉积物中形成环境污染[31],或随食物链在生物体中积累[21].1.3 环境分布与浓度
随着含有BPS和BPAF的产品在人类日常生活中的普遍使用,目前在天然水体、沉积物、污水污泥、室内灰尘等多种环境介质中均能检测到BPS和BPAF(表2). 对BPS和BPAF在不同环境介质中浓度和分布的调查,有助于污染溯源及风险预测,且对于降解微生物的筛选具有参考价值.
表 2 BPS和BPAF在不同环境介质(海水、地表水和地下水、土壤、沉积物、废水、污泥、生活用水和饮用水、室内粉尘和日用消费品)中的浓度Table 2. Concentration of BPS and BPAF in various environmental media (including seawater, surface water& groundwater, soil, sediments, wastewater, sewage sludge, domestic water & drinking water, indoor dust and consumer goods)介质类型Medium 检出位点Detection site 物质检出浓度Concentrations 参考文献Reference BPS BPAF 海水/(ng·L−1) 美国旧金山湾 1—120 NDa [32] 罗马尼亚 ND—11.3 NAb [33] 地表水和地下水/(ng·L−1) 中国珠江 ( 2014.03 )ND—135 ND [34] 中国珠江( 2017.12 )1.6—59.8 0.40—3.59 [35] 中国扬子江 0.18—14.9 NA [36] 中国西江 ND ND [34] 中国骆马湖 ND—94 12—84 [37] 中国辽河 0.22—52 0.50—9.6 [10,38] 中国浑河 0.61—46 0.61—11 [10] 中国太湖( 2013.09 )0.28—67 0.13—1.1 [10] 中国太湖( 2015.05 )0.32—27.3 0.06—2 [11] 中国太湖( 2016.04 )4.5— 1600 0.7—23 [37] 地表水和地下水/(ng·L−1) 中国太湖( 2016.11 )4.1—160 110—140 [12] 中国太湖( 2018.08 )8—319 0.3—17.7 [39] 中国江西、浙江 NA ND— 15300 [25] 中国张家港 ND—74.04 ND—0.63 [40] 日本江户川 2.7—4.7 NA [34] 日本荒川 1.6—7.6 NA [34] 日本多摩川 1.5—8.7 NA [34] 日本东京湾 ND—15 NA [34] 韩国汉江 ND—42 NA [34] 印度库姆河 15— 3640 NA [34] 印度白金汉运河 58— 2100 NA [34] 捷克 0—27 0—205 [41] 中国江西、浙江(井水) NA ND—300 [25] 土壤/(ng·g−1干重) 中国江西、浙江 NA ND—331 [25] 中国浙江 0.03—8.35 NA [42] 中国张家港 ND—151.53 ND—21.63 [40] 沉积物/(ng·g−1干重) 中国骆马湖 ND—0.25 0.68 [37] 中国辽河 ND—1.1 ND [10,38] 中国浑河 ND—0.42 ND—0.012 [10] 中国太湖( 2013.09 )ND—0.76 0.01—0.36 [10] 中国太湖( 2016.04 )0.3—31 ND—0.27 [37] 中国太湖( 2016.11 )0.22—47 11—19 [12] 中国江西、浙江 NA 0.520—200 [25] 中国张家港 ND—43.9 ND—40.68 [40] 美国 ND—4.65 ND [29] 日本 ND—4.46 ND [29] 韩国 ND—1970 ND—423 [29] 罗马尼亚 ND—2.7 NA [33] 废水/(ng·L−1) 中国厦门(入水) 55.7 0.901 [43] 中国厦门(出水) 3.02 1.16 [43] 中国深圳(入水) 53.3—177.3 55.2—140.5 [44] 中国深圳(出水) 48.4—90.5 53.7—128.8 [44] 美国纽约(入水) 27.6—31.2 NA [27] 美国纽约(出水) 23.6—27.3 NA [27] 印度多个城市(入水) 14.7 1.1 [45] 印度多个城市(出水) 2.4 ND [45] 斯洛文尼亚 40.6 8.2 [46] 污泥/(ng·g−1干重) 中国深圳 75.6—160.6 92.1—158.0 [44] 中国30个城市 0.17—110 0.42—45.1 [47] 美国纽约 ND— 1480 ND—72.2 [27] 韩国40个污水处理厂 ND—523 ND—3.59 [48] 污泥/(ng·g−1干重) 印度多个城市 22.5 ND [45] 挪威 7.1— 2100 NA [41] 生活用水和饮用水/(ng·L−1) 法国 3.9—55.0 ND—3.0 [49] 意大利 0.24—51.45 1.02— 1544.68 [50] 室内灰尘/(ng·g−1干重) 中国江西、浙江 NA 7.82—739 [25] 中国北京、济南、广州、上海、齐齐哈尔和乌鲁木齐(2010) 0.00083 —12.6ND [30] 日本熊本、长崎、福冈、埼玉和佐贺(2012) 0.25—2.55 ND—0.011 [30] 韩国安山和安阳(2012) 0.09—26.6 ND—0.091 [30] 美国奥尔巴尼(2006)、美国纽约(2010) 0.0056 —25.5ND [30] 中国多个城市(2012—2014) ND—2 0.8—54 [51] 日本多个城市(2012—2014) 8.8— 1800 0.88—14 [51] 韩国多个城市 ND—32 ND—5.6 [51] 美国多个城市 ND—2 0.23—25 [51] 哥伦比亚多个城市 ND—35 0.07—34 [51] 希腊多个城市 ND— 21000 ND—47 [51] 印度多个城市 ND—150 ND—6.5 [51] 科威特多个城市 ND—200 0.38—13 [51] 巴基斯坦多个城市 ND—66 ND—2.9 [51] 罗马尼亚多个城市 6.2— 4900 ND—5.2 [51] 沙特阿拉伯多个城市 ND— 1100 ND—6.7 [51] 越南多个城市 ND—260 ND—2.9 [51] 日用消费品/(μg·cm−2) 美国热敏纸 ND—193 NA [52] 美国贴画(带背胶) ND—17.3 NA [52] 美国保鲜膜 ND—0.96 NA [52] 美国百洁布 ND—0.23 NA [52] 美国塑料托盘 ND—0.15 NA [52] aND, 未检出. ND, not detected. bNA, 没有数据. NA, no data available. 地表水和沉积物中常能检测到BPS和BPAF,目前已有研究关注了BPS和BPAF以及其他BPA替代品的环境浓度,如Song等2012年调查了中国浙江嘉兴一个制造工厂周围环境中BPAF的分布和浓度,结果表明在河水(ND—
15300 ng·Lg−1)、沉积物(0.520—200 ng·g−1干重)、土壤(ND—31 ng·g−1干重)、室内粉尘(7.82—739 ng·g−1干重)和井水(ND—300 ng·L−1)中均检测到BPAF[26]. Yamazaki等检测了中国、日本、韩国和印度的多条河流表层水中包括BPA和BPS在内的多种双酚类物质的含量,发现印度河流中BPS的检出浓度相对较高[34]. 2016年Jin等调查了中国太湖、浑河和辽河沉积物中多种双酚类物质的含量,发现其中BPA(检出率100%)、BPAF(检出率100%)和BPS(检出率57%)的检出频次最高[10]. 太湖沉积物中BPS和BPAF的检出浓度为ND—0.76 ng·g−1和0.01—0.36 ng·g−1,高于浑河流域(ND—0.42 ng·g−1干重和ND—0.012 ng·g−1干重)[10]. 2017年Liu等研究发现BPA(3.6—2.7×102 ng·g−1干重)是太湖沉积物中最主要的双酚类物质,BPAF和BPS的检出量分别在11—19 ng·L−1和0.22—47 ng·L−1[12]. 对比2013—2018年的太湖表层水体和沉积物中双酚化合物的检出浓度,可以发现在短短的几年中,BPS和BPAF在太湖水体和沉积物中的浓度虽然有所波动,但整体呈现逐年上升趋势(图1)[10 − 12,53].除地表水和沉积物之外,2014年Song等调查了中国30个城市共52个污水处理厂污泥样本中13种双酚类物质的分布情况,结果发现其中BPS(平均值3.02 ng·g−1,中值4.34 ng·g−1)对检出双酚类物质总量的平均贡献率为15.7%,同时在污泥样品中检测到BPAF(平均值0.85 ng·g−1,中值0.42 ng·g−1)[47]. 2015年Lee等调查了韩国40个代表性污水处理厂污泥中的多种双酚类物质浓度,结果显示来源于造纸和纺织工业污水处理厂的污泥中双酚类物质的浓度最高,检出率最高的是BPA(检出率97.5%),其次是双酚F(bisphenol F, BPF)(检出率75%)和BPS(检出率70%)[48]. Xue等测定了美国74个废水处理厂收集的76种污泥样品中8种双酚类物质的分布情况,发现BPS的检出率(84%)仅次于最高的BPA(100%),BPF和BPAF的检出率紧随其后(68%和46%)[27]. 2017年Sun等在中国厦门污水处理厂的进出水中均检测到BPS和BPAF,BPS进出水平均浓度分别为55.7 ng·L−1和0.901 ng·L−1;BPAF的进出水平均浓度分别为3.02 ng·L−1和1.16 ng·L−1[43]. 因此,城市污水处理厂中污水和污泥的排放也是双酚类物质释放到环境中的重要途径之一.
此外,研究显示室内粉尘中也多有BPS和BPAF的检出. 2012年Liao等检测了美国、中国、日本和韩国的156个家庭、办公室、实验室和宿舍的室内粉尘样本中双酚类物质的含量,发现韩国的粉尘样品中双酚类物质的总浓度最高(1.29—111 μg·g−1),其次是日本(1.08—24.7 μg·g−1)、美国(0.30—33.4 μg·g−1)和中国(0.026—13.5 μg·g−1);在所有被检出的双酚类物质中,BPA和BPS占总浓度的98%以上[30],被认为是室内粉尘中的主要污染物;同时BPAF在韩国灰尘样本中的检出率较高(76%)[30]. 2015年Wang等测定了包括中国在内的12个国家的388个室内粉尘样品中8种双酚类物质的含量,结果发现粉尘样品中广泛存在BPA、BPS和BPAF[51],这与Liao等的研究结果一致.
大量研究表明,双酚类物质广泛存在于各种环境介质中,其中BPS的检出频率和检出浓度仅次于BPA,BPAF也在多种环境介质中被广泛检出,且BPS和BPAF在自然环境中很难被转化[7 − 8],因此BPS和BPAF的释放对环境安全和人类健康所带来的威胁相较于其它双酚类物质更大.
2. BPS和BPAF的微生物转化(Microbial transformation of BPS and BPAF
BPS和BPAF通过多种途径进入环境之后,可以在环境中积累并进入人体,引发一系列内分泌干扰效应[7,9],潜在的人体健康风险使得该类物质在环境中的去除已经引起了广泛的关注. 研究证实,物理、化学和生物法都可以有效去除环境中的BPS或BPAF,其中物理和化学技术主要包括吸附、高级氧化和光催化等,例如石墨烯基复合材料已被证实是双酚类似物的优良吸附剂[54 − 55],Li等发现还原氧化石墨烯(rGO)具有较好的BPS吸附能力,吸附容量可以达到261.74 mg·g-1[56]. 除此之外,目前包括石墨烯、碳纳米管、石墨和生物炭在内的碳基吸附剂都已被应用于去除水中的BPS[7]. Wang等采用热活化的过硫酸盐降解BPS,可使初始浓度为6.25 mg·L−1的BPS在150 min内被完全氧化[57]. 有研究者证实添加紫外光照射的光-Fenton催化反应,可以在20 min内使10 mg·L−1的BPS完全转化生成苯酚和硫酸盐[58],Liu等研究表明光催化产生的羟基自由基可以氧化BPAF[59]. Yang等发现BPS和BPAF在高铁酸盐存在的条件下可被转化且产物无毒[60]. Jia等研究表明,在模拟阳光照射的条件下,TiO2纳米管阵列可以显著促进过氧单硫酸盐(PMS)对BPAF和BPS的降解[61]. 然而,现有的物理化学方法存在易引发二次污染、操作工艺复杂、治理成本高、运行费用高等缺点,因此人们开始更多地关注生物技术在去除BPS和BPAF方面的应用潜力.
2.1 BPS和BPAF的微生物转化效率
现有研究表明,BPS和BPAF在水体中不易被转化,会不断积累并随水流持续向其他环境中排放. Danzl等研究不同双酚类物质在海水中的生物转化,结果发现经过30 d的培养,BPA和BPF的转化效率分别为83%和92%,但未观察到BPS的转化[16]. Ike等采集河流水样进行了双酚类物质在有氧和无氧条件下的生物降解实验,结果表明有氧条件下BPS不能被生物转化,但是在无氧条件下77 d内BPS的去除率可以达到60%左右[62]. Zhou等发现BPA等8种双酚类物质在太湖水中的半衰期为12 d至7 d,但并未观察到BPS和BPAF的生物转化[53]. Frankowski等利用河水和取自城市和农村污水处理厂活性污泥中的微生物菌群去除BPA及其5种替代品,结果发现28 d内只有BPA和BPF去除率达到100%,其余双酚类物质的去除率均低于50%[63].
然而,一些研究证实土壤和沉积物中存在具有高效转化BPS能力的微生物. 如在太湖底泥中BPS可被转化,且53 d后矿化量达到26%[53]. Wang等从河流沉积物中分离出高效转化BPS的联合菌群,使用BPS作为唯一碳源,该菌群10 d内对初始浓度为50 mg·L−1的BPS去除率高达99%[64]. Cao等发现在水稻土中培养28 d后,初始浓度为2 mg·kg−1的BPS的矿化量可达53.6%[65]. Choi等研究了BPS和BPAF在森林土壤和有机农田土壤中好氧生物的降解转化效率,两种土壤中BPS的半衰期分别为0.59 d和0.69 d,BPAF半衰期分别为24.5 d和32.6 d[15].
城市污水处理厂同样具备去除BPS和BPAF的能力. 现有研究中城市污水处理厂中BPS的平均去除率为81.2%,且微生物降解可能在其中发挥了重要作用[66]. Sun等探究了中国厦门7个污水处理厂的废水和活性污泥中5种双酚类化合物的去除情况,发现7 d内厌氧过程对BPS的平均去除率高达98.9%,但BPAF和双酚E(bisphenol E)BPE去除效率较低[43]. 然而,Choi等研究发现在产甲烷条件的厌氧污泥中,14 d内未观察到BPS和BPAF的降解[67]. Xue等研究了美国纽约两个污水处理厂中BPS的去除情况,结果发现其中BPS的去除率仅为6.4%和24%[27]. Qian等探究了中国深圳4个污水处理厂中10种双酚类化合物的去除情况,其中膜生物反应器(MBR)对BPS的去除率最高,达到99%;生物充气过滤器中BPS的去除率为62.9%;而4个污水处理厂中BPAF的去除率仅为4.4%—38.9%,这种差异主要可以归因于不同污泥中的功能菌群结构的不同[44].
2.2 BPS和BPAF的微生物转化
2.2.1 BPS的微生物转化途径
BPS虽是BPA的替代品,但由于其化学结构中含有砜基(O = S = O),其生物转化途径和BPA有较大差异[14],生物转化难度也比BPA更大. 目前关于BPS的微生物转化途径及代谢产物的研究十分有限,表3中列出了目前已分离的具有转化BPS功能的纯培养菌株及其转化效率和转化途径. 其中大部分菌株属于鞘氨醇单胞菌科(Sphingomonadaceae),包括鞘氨醇单胞菌属(Sphingomonas)和鞘酯菌属(Sphingobium),其他菌属如土生单胞菌属(Terrimonas)、假单胞菌属(Pseudomonas)中也有转化BPS的功能菌存在.
表 3 双酚S降解菌株及其降解效率和转化途径Table 3. BPS degrading strains and their degradation efficiency and transformation pathwaysBPS降解菌株BPS degrading strain 菌株来源Source of the strain 环境条件Environmentalconditions 初始浓度Initialconcentration 去除效率/%Removal rate 转化途径Transformationpathway 参考文献References Sphingobium fuliginis OMI 巨型浮萍(Spirodela polyrrhiza)根际 pH 6.5 28 ℃ 24 h 1.0 mmol·L−1(250 mg·L−1) 100.0 酚环羟基化间位裂解 [68] Sphingobium fuliginis TIK1 芦苇(Phragmitesaustralis)根系沉积物 pH 7.2 28 ℃ 24 h 0.5 mmol·L−1(125 mg·L−1) 100.0 酚环羟基化间位裂解 [17,69 − 70] Sphingobium sp. IT4 芦苇(Phragmites australis)根沉积物系 pH 7.2 28 ℃ 24 h 0.5 mmol·L−1(125 mg·L−1) 100.0 本位羟基取代 [69,71] Sphingomonas sp. strain TTNP3 活性污泥 pH 7.0 30 ℃ 36 h 40 mg·L−1 100.0 —a [72 − 73] Sphingomonas sp. strain BP-7 海水 pH 7.3 27 ℃ 28 d 100 mg·L−1 2.8 — [17] Terrimonas pekingensis sp. WDS 河流沉积物 pH 7.0 30 ℃ 10 d 10 mg·L−1 8.0 — [64] Pseudomonas sp. HDS 河流沉积物 pH 7.0 30 ℃ 10 d 10 mg·L−1 15.6 — [64] a—, 没有数据. —, no data available. Sakai等从海水中分离出的菌株Sphingomonas sp. BP-7,可以通过BPA中甲基碳原子或α-季碳的羟基化,引发BPA的氧化碳骨架重排途径,并脱水断键生成对羟基苯乙酮与对羟基苯甲酸,40 d内对100 mg·L−1 BPA的降解率超过95%[68],但由于BPS的两个酚环是通过硫原子桥连,因此BPS不会通过氧化骨架重排途径被生物转化,菌株BP-7对BPS几乎不转化,其转化效率只有2.8%[69].
从巨型浮萍(Spirodelapolyrrhiza)根际筛选出的菌株Sphingobium fuliginis OMI可完全降解BPS,并生成代谢产物——羟基-BPS和2,2’-二羟基-BPS[68];从芦苇(Phragmites australis)根际沉积物中分离的菌株Sphingobium fuliginis TIK1和Sphingobium sp. IT4在培养24 h后可将0.5 mmol·L−1的BPS完全降解[69,71]. 其中菌株OMI[68]和菌株TIK1[69]是通过酚环羟基化和间位裂解途径降解BPS,菌株IT4[71]是通过原位羟基取代的途径降解BPS,其主要降解产物为对苯醌(图2). Choi等探究了BPA、BPS和BPAF在森林土壤和有机农田土壤中的生物降解机制,并阐明BPS主要是通过酚环羟基化和邻位裂解途径发生降解(图2)[15].
Wang等从黄浦江沉积物中分离出两株具有BPS转化能力的菌株Terrimonas pekingensis WDS和Pseudomonas sp. HDS,在培养10 d后两株菌(OD600 ≤ 0.1)对10 mg·L−1的BPS的转化效率分别为8.0%和15.6%;同时还驯化出具有转化BPS能力的富集菌液DS,该富集液在10 d内对50 mg·L−1的BPS的转化效率高达99%[57]. 由此可见与纯培养菌株相比,菌群对BPS的转化具有更大潜力. 大量的研究结果都表明菌群在有机污染物转化方面所表现出的效率显著优于单菌,这主要是由于与单一物种相比,菌群包含更多的代谢途径,具备更高广泛的碳氢化合物代谢范围[74].
近期的研究指出,活性污泥中的微生物也具有降解BPS的能力. Zhao的研究发现,分离自活性污泥的菌株Sphingomonas sp. TTNP3[72]在pH为7培养温度30 ℃条件下,可在36 h内去除40 mg·L−1的BPS[73]. Kovačič等通过研究BPS在活性污泥生物废水处理过程中的生物降解动力学发现BPS易降解且不会在生物固体或废水中积累,初始浓度为0.1 mg·L−1的BPS降解半衰期小于4.3 d,降解效率随着BPS初始浓度的增加而降低[75]. 通过鉴定BPS转化过程中的代谢产物提出了BPS新的生物转化途径,包括羟基化、甲基化、硫化、BPS部分偶联和C—S键断裂(图2)[75]. 但是对于此活性污泥生物废水处理体系中BPS降解菌的物种及其作用机制还需进一步探究.
2.2.2 BPAF的微生物转化途径
由于BPAF具有含氟化合物的特殊性质,其生物转化难度比BPA要大得多. 目前关于BPAF生物转化途径和产物的研究极其有限. Choi等探究了BPAF在森林土壤和有机农田土壤中的生物转化途径,推测出BPAF通过酚环羟基化和间位裂解或邻位裂解途径生成8种转化产物(图3)[15].
以上研究表明,在BPA、BPS和BPAF的转化过程中均检测到酚环羟基化-间位裂解反应产物,表明酚环羟基化-间位裂解途径对双酚类物质的降解具有普适性,不受连接两个酚环的化学结构和基团影响.
2.2.3 其他手段协同微生物转化BPS和BPAF
由于BPS的生物利用度较低,一些研究尝试改良方法以提高BPS的生物降解效率. Huang等研究发现在活性污泥生物反应器中50 mg·L−1BPS的完全去除需要8 d,但在向反应体系中加入50 mg·L−1的腐殖酸之后,该反应器的去除效率有所提高,完全转化的时间缩短至6 d[76];Zhou等也发现BPAF在太湖水体中不降解,但在添加腐殖酸的条件下其半衰期为71 d[53],这是由于腐殖酸具有类似表面活性剂的胶束微观结构,可能会提高微生物对BPS和BPAF的生物可利用度[77];同时,腐殖酸作为有机质含量复杂的碳源,可以通过共代谢加速这类物质的去除. 此外,Wirasnita等发现添加活性炭的人工湿地可以在8周内去除98%的BPS[78],去除效率显著高于普通人工湿地,这主要是因为活性炭可以吸附BPS,使其被附着在活性炭内部的菌群高效利用[78].
Beck等发现白腐真菌(Trametes versicolor)分泌的漆酶对于BPA有良好的生物降解特性,但是无法降解BPS[79]. Zdarta等将该漆酶固定在海绵蛋白支架上,25 h内可对初始浓度2 mg·L−1的BPS实现47%的生物转化[14]. 同时固定化漆酶表现出良好的可重复利用性和存储稳定性,在存储50 d后仍可保持其80%以上的初始活性,漆酶的固定化提高了其对BPS的催化降解作用. 类似的,Solé 等发现将微藻固定在海藻酸盐上可在10 d内去除高达80%初始浓度为10 mg·L−1的BPAF[80]. 由此可见,固定化微生物技术可以有效提高难降解双酚类化合物的生物降解效率,很可能成为双酚类化合物污染环境修复的重要手段,其具体应用与实践还有待进一步探究.
此外,一些通过外加条件驱动的BPS转化机制近年来也被报道. Hou等结合稳定同位素辅助代谢组学(SIAM)和稳定同位素探针(13C-DNA -SIP)技术探究了电化学活性生物膜(EABs)对BPS的转化机制[81]. 该研究检测到6个通过水解、氧化、烷基化或酚环裂解反应生成的13C完全标记的转化产物[81]. 与生物转化途径不同,水解和氧化分别是BPS的生物电化学转化过程的初始和关键途径,这是由电活性微生物和BPS同化物协同完成的[81].
3. 总结与展望(Conclusions and outlooks)
双酚类物质对环境安全和人体健康构成的威胁已经引发了广泛的关注,微生物的转化被认为是控制双酚类物质释放到环境中的有效途径之一. 然而,目前的相关研究主要集中在BPA降解菌的筛选及其降解机制的探究,而对于生物难利用的BPA替代物BPS和BPAF的研究,不论是具有转化能力的微生物资源的开发,或是相关的微生物转化途径及代谢产物的分析都十分有限,因此后续关于BPS和BPAF生物转化研究的方向和重点可以从以下角度出发(图4).
3.1 BPS和BPAF降解过程中微生物互作机制的研究
目前,对于土壤、沉积物以及污水处理厂活性污泥等对BPS和BPAF有良好转化效果体系的研究,仅停留在转化能力和效率的评估,未深入探究其生物转化机制以及菌群中不同微生物在转化过程中的贡献. 现有的研究局限于极少数的纯培养菌株对BPS转化机制,而BPS降解过程中微生物群落之间协同作用机制尚不明确,BPAF降解过程中生物转化机制的研究亦尚未开展. 今后的研究可以利用稳定性同位素核酸探针(DNA-SIP)等技术甄别菌群中直接参与污染物转化的关键物种,并结合分子生态网络构建等生物信息学技术,进一步揭示BPS和BPAF转化过程中微生物的互作机制.
3.2 BPS和BPAF降解功能菌群的构建
目前尚缺乏BPS,特别是BPAF降解菌的种质资源,仅有极少数具有BPS降解能力的纯培养菌株,如鞘脂菌属菌株Sphingobium fuliginis OMI、Sphingobium fuliginis TIK1、Sphingobium sp. IT4和鞘氨醇单胞菌属菌株Sphingomonas sp. TTNP3等[68 − 69],未见BPS降解菌群和BPAF降解菌株或菌群的报道,这些种质资源对于BPS和BPAF生物去除的研究至关重要. 菌群构建在原油[74]、抗生素[82]、有机染料[83]、废水[84]、纤维素[85]和海洋有机污染物[86]的微生物降解中已有应用,而在双酚类物质生物转化中的应用尚未开展. 由于参与污染物转化的功能菌采用传统培养技术很难被分离筛选,未来研究中可以应用新型微生物筛分技术,如基于拉曼光谱的单细胞分选技术(Raman-SIP)等解决传统纯培养的局限性,该技术是一种强大的功能生物细胞探查方法,可以在单细胞水平上实现对降解微生物的原位识别和分离,进而可以用于构建具有BPS和BPAF高效降解能力的菌群,为双酚类物质污染环境的修复提供种质资源.
3.3 BPS和BPAF转化产物的鉴定和转化途径的分析
目前关于BPS和BPAF的代谢途径的研究十分有限. 虽然已经对少数纯菌或环境介质中的BPS和BPAF转化途径进行了探究,但是已鉴定出的转化产物的种类极其有限,且各途径是由哪些微生物介导,以及在整个菌群的作用下BPS和BPAF的完整转化路径尚不清楚. 尚未深入探究不同环境体系中可能存在的不同降解途径,及不同微生物在BPS和BPAF降解过程中的贡献,同时,对BPS和BPAF降解产生的下游产物引发的环境效应及其进一步转化机制的研究也存在空白. 因此今后的研究可以考虑将化学定量方法(如HPLC-QTOF-MS法)、标记技术(如DNA-SIP技术)和组学技术(如高通量测序技术)相结合,通过同位素示踪溯源结合组学数据分析以获得准确的降解产物和降解途径,这将为BPS和BPAF生物转化机理的全面阐明提供科学依据.
3.4 原位环境下BPS和BPAF转化机制的探究
目前的研究主要是通过高浓度BPS长期驯化获得BPS降解菌群,并通过传统分离纯化技术获得纯培养菌株. 然而,微生物群落结构在长期驯化的过程中向着BPS降解菌优势化的方向演化,与真实环境中的原位微生物群落存在差异;同时BPS的环境浓度普遍低于驯化过程中BPS的投加量,因此使用高浓度污染物长期驯化的方法仅局限于纯菌转化BPS机制的研究,无法反映真实环境中的降解过程. 对于BPAF降解菌株的纯化分离以及原位环境下BPAF降解机制的研究更是尚未开展. 因此今后的研究更应关注真实环境条件下BPS和BPAF的降解机制,以期为污染源追踪和污染物在降解菌的种内、种间转化机制分析提供依据. 这有助于人们深入理解真实环境中BPS和BPAF的迁移转化过程,并对污水和土壤等实际环境中BPS和BPAF的去除具有指导意义.
3.5 微生物转化BPS和BPAF条件的优化
降解菌在有机废水处理的应用中对复杂环境介质耐受差、难以定殖,且无法重复利用,污水处理厂等体系无法完全满足降解菌的最适生长条件. 而关于BPS降解菌最适生长条件的研究十分有限,且环境因素对降解效率的影响尚不明确,因此无法最大化发挥体系中降解菌的降解潜能. 今后的研究可以考虑优化pH、温度、底物投加量和外加碳、氮源等培养条件以提高微生物对BPS和BPAF的转化效率. 研究表明固定化微生物具有耐冲击负荷高、菌体不易流失、可以重复使用和产物易分离等优点,今后的研究也可以考虑利用微生物固定化手段,通过将功能菌群固定于载体上以克服悬浮系功能菌的缺陷,同时提高降解菌的降解效率.
3.6 BPA其他代替物微生物转化机制的关注
双酚类物质是一类通过桥碳或其他化学结构将两个酚环连接在一起的化合物,具有相同的结构通式,由于其化学结构存在差异,在环境中具有转化潜力的微生物物种不甚相同,微生物转化途径也可能有所不同. 除BPS和BPAF之外,还有10余种BPA的替代物,它们的生物转化机制是否存在差异同样值得关注,这有助于系统性阐明双酚类物质的生物转化途径,以及修复双酚类化合物引起的环境污染.
-
性质Properties 双酚SBPS 双酚AFBPAF 化学名 4,4'-二羟基二苯砜 2,2-二(4-羟基苯基)六氟丙烷 CAS 080-09-1 1478 -61-1分子式 C12H10SO4 C15H10F6O2 化学结构式 分子量(M) 250.27 g·mol−1 336.23 g·mol−1 熔点(m.p.) 245—250 ℃ 159—164 ℃ 沸点(b.p.) 505.3 °C (0.1 MPa) 316.7 °C (0.1 MPa) 密度(ρ) 1.37 g·cm−3 1.37 g·cm−3 水溶性(Sw) 1774 mg·L−1 (20 ℃)0.84 mg·L−1 (20 ℃) 解离常数(pKa1, pKa2) 7.42, 8.03 9.13, 9.74 辛醇/水系数(lgKow) 1.65 4.64 表 2 BPS和BPAF在不同环境介质(海水、地表水和地下水、土壤、沉积物、废水、污泥、生活用水和饮用水、室内粉尘和日用消费品)中的浓度
Table 2. Concentration of BPS and BPAF in various environmental media (including seawater, surface water& groundwater, soil, sediments, wastewater, sewage sludge, domestic water & drinking water, indoor dust and consumer goods)
介质类型Medium 检出位点Detection site 物质检出浓度Concentrations 参考文献Reference BPS BPAF 海水/(ng·L−1) 美国旧金山湾 1—120 NDa [32] 罗马尼亚 ND—11.3 NAb [33] 地表水和地下水/(ng·L−1) 中国珠江 ( 2014.03 )ND—135 ND [34] 中国珠江( 2017.12 )1.6—59.8 0.40—3.59 [35] 中国扬子江 0.18—14.9 NA [36] 中国西江 ND ND [34] 中国骆马湖 ND—94 12—84 [37] 中国辽河 0.22—52 0.50—9.6 [10,38] 中国浑河 0.61—46 0.61—11 [10] 中国太湖( 2013.09 )0.28—67 0.13—1.1 [10] 中国太湖( 2015.05 )0.32—27.3 0.06—2 [11] 中国太湖( 2016.04 )4.5— 1600 0.7—23 [37] 地表水和地下水/(ng·L−1) 中国太湖( 2016.11 )4.1—160 110—140 [12] 中国太湖( 2018.08 )8—319 0.3—17.7 [39] 中国江西、浙江 NA ND— 15300 [25] 中国张家港 ND—74.04 ND—0.63 [40] 日本江户川 2.7—4.7 NA [34] 日本荒川 1.6—7.6 NA [34] 日本多摩川 1.5—8.7 NA [34] 日本东京湾 ND—15 NA [34] 韩国汉江 ND—42 NA [34] 印度库姆河 15— 3640 NA [34] 印度白金汉运河 58— 2100 NA [34] 捷克 0—27 0—205 [41] 中国江西、浙江(井水) NA ND—300 [25] 土壤/(ng·g−1干重) 中国江西、浙江 NA ND—331 [25] 中国浙江 0.03—8.35 NA [42] 中国张家港 ND—151.53 ND—21.63 [40] 沉积物/(ng·g−1干重) 中国骆马湖 ND—0.25 0.68 [37] 中国辽河 ND—1.1 ND [10,38] 中国浑河 ND—0.42 ND—0.012 [10] 中国太湖( 2013.09 )ND—0.76 0.01—0.36 [10] 中国太湖( 2016.04 )0.3—31 ND—0.27 [37] 中国太湖( 2016.11 )0.22—47 11—19 [12] 中国江西、浙江 NA 0.520—200 [25] 中国张家港 ND—43.9 ND—40.68 [40] 美国 ND—4.65 ND [29] 日本 ND—4.46 ND [29] 韩国 ND—1970 ND—423 [29] 罗马尼亚 ND—2.7 NA [33] 废水/(ng·L−1) 中国厦门(入水) 55.7 0.901 [43] 中国厦门(出水) 3.02 1.16 [43] 中国深圳(入水) 53.3—177.3 55.2—140.5 [44] 中国深圳(出水) 48.4—90.5 53.7—128.8 [44] 美国纽约(入水) 27.6—31.2 NA [27] 美国纽约(出水) 23.6—27.3 NA [27] 印度多个城市(入水) 14.7 1.1 [45] 印度多个城市(出水) 2.4 ND [45] 斯洛文尼亚 40.6 8.2 [46] 污泥/(ng·g−1干重) 中国深圳 75.6—160.6 92.1—158.0 [44] 中国30个城市 0.17—110 0.42—45.1 [47] 美国纽约 ND— 1480 ND—72.2 [27] 韩国40个污水处理厂 ND—523 ND—3.59 [48] 污泥/(ng·g−1干重) 印度多个城市 22.5 ND [45] 挪威 7.1— 2100 NA [41] 生活用水和饮用水/(ng·L−1) 法国 3.9—55.0 ND—3.0 [49] 意大利 0.24—51.45 1.02— 1544.68 [50] 室内灰尘/(ng·g−1干重) 中国江西、浙江 NA 7.82—739 [25] 中国北京、济南、广州、上海、齐齐哈尔和乌鲁木齐(2010) 0.00083 —12.6ND [30] 日本熊本、长崎、福冈、埼玉和佐贺(2012) 0.25—2.55 ND—0.011 [30] 韩国安山和安阳(2012) 0.09—26.6 ND—0.091 [30] 美国奥尔巴尼(2006)、美国纽约(2010) 0.0056 —25.5ND [30] 中国多个城市(2012—2014) ND—2 0.8—54 [51] 日本多个城市(2012—2014) 8.8— 1800 0.88—14 [51] 韩国多个城市 ND—32 ND—5.6 [51] 美国多个城市 ND—2 0.23—25 [51] 哥伦比亚多个城市 ND—35 0.07—34 [51] 希腊多个城市 ND— 21000 ND—47 [51] 印度多个城市 ND—150 ND—6.5 [51] 科威特多个城市 ND—200 0.38—13 [51] 巴基斯坦多个城市 ND—66 ND—2.9 [51] 罗马尼亚多个城市 6.2— 4900 ND—5.2 [51] 沙特阿拉伯多个城市 ND— 1100 ND—6.7 [51] 越南多个城市 ND—260 ND—2.9 [51] 日用消费品/(μg·cm−2) 美国热敏纸 ND—193 NA [52] 美国贴画(带背胶) ND—17.3 NA [52] 美国保鲜膜 ND—0.96 NA [52] 美国百洁布 ND—0.23 NA [52] 美国塑料托盘 ND—0.15 NA [52] aND, 未检出. ND, not detected. bNA, 没有数据. NA, no data available. 表 3 双酚S降解菌株及其降解效率和转化途径
Table 3. BPS degrading strains and their degradation efficiency and transformation pathways
BPS降解菌株BPS degrading strain 菌株来源Source of the strain 环境条件Environmentalconditions 初始浓度Initialconcentration 去除效率/%Removal rate 转化途径Transformationpathway 参考文献References Sphingobium fuliginis OMI 巨型浮萍(Spirodela polyrrhiza)根际 pH 6.5 28 ℃ 24 h 1.0 mmol·L−1(250 mg·L−1) 100.0 酚环羟基化间位裂解 [68] Sphingobium fuliginis TIK1 芦苇(Phragmitesaustralis)根系沉积物 pH 7.2 28 ℃ 24 h 0.5 mmol·L−1(125 mg·L−1) 100.0 酚环羟基化间位裂解 [17,69 − 70] Sphingobium sp. IT4 芦苇(Phragmites australis)根沉积物系 pH 7.2 28 ℃ 24 h 0.5 mmol·L−1(125 mg·L−1) 100.0 本位羟基取代 [69,71] Sphingomonas sp. strain TTNP3 活性污泥 pH 7.0 30 ℃ 36 h 40 mg·L−1 100.0 —a [72 − 73] Sphingomonas sp. strain BP-7 海水 pH 7.3 27 ℃ 28 d 100 mg·L−1 2.8 — [17] Terrimonas pekingensis sp. WDS 河流沉积物 pH 7.0 30 ℃ 10 d 10 mg·L−1 8.0 — [64] Pseudomonas sp. HDS 河流沉积物 pH 7.0 30 ℃ 10 d 10 mg·L−1 15.6 — [64] a—, 没有数据. —, no data available. -
[1] VANDENBERG L N, HAUSER R, MARCUS M, et al. Human exposure to bisphenol A (BPA)[J]. Reproductive Toxicology, 2007, 24(2): 139-177. doi: 10.1016/j.reprotox.2007.07.010 [2] MA Y, LIU H H, WU J X, et al. The adverse health effects of bisphenol A and related toxicity mechanisms[J]. Environmental Research, 2019, 176: 108575. doi: 10.1016/j.envres.2019.108575 [3] GEENS T, AERTS D, BERTHOT C, et al. A review of dietary and non-dietary exposure to bisphenol-A[J]. Food and Chemical Toxicology, 2012, 50(10): 3725-3740. doi: 10.1016/j.fct.2012.07.059 [4] PINNEY S E, MESAROS C A, SNYDER N W, et al. Second trimester amniotic fluid bisphenol A concentration is associated with decreased birth weight in term infants[J]. Reproductive Toxicology, 2017, 67: 1-9. doi: 10.1016/j.reprotox.2016.11.007 [5] MARTÍN J, SANTOS J L, APARICIO I, et al. Analytical method for biomonitoring of endocrine-disrupting compounds (bisphenol A, parabens, perfluoroalkyl compounds and a brominated flame retardant) in human hair by liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2016, 945: 95-101. doi: 10.1016/j.aca.2016.10.004 [6] MENDONCA K, HAUSER R, CALAFAT A M, et al. Bisphenol A concentrations in maternal breast milk and infant urine[J]. International Archives of Occupational and Environmental Health, 2014, 87(1): 13-20. doi: 10.1007/s00420-012-0834-9 [7] FANG Z, GAO Y R, WU X L, et al. A critical review on remediation of bisphenol S (BPS) contaminated water: Efficacy and mechanisms[J]. Critical Reviews in Environmental Science and Technology, 2020, 50(5): 476-522. doi: 10.1080/10643389.2019.1629802 [8] NIU L J, ZHANG S Q, WANG S Q, et al. Overlooked environmental risks deriving from aqueous transformation of bisphenol alternatives: Integration of chemical and toxicological insights[J]. Journal of Hazardous Materials, 2022, 427: 128208. doi: 10.1016/j.jhazmat.2021.128208 [9] MATSUSHIMA A, LIU X H, OKADA H, et al. Bisphenol AF is a full agonist for the estrogen receptor ERalpha but a highly specific antagonist for ERbeta[J]. Environmental Health Perspectives, 2010, 118(9): 1267-1272. doi: 10.1289/ehp.0901819 [10] JIN H B, ZHU L Y. Occurrence and partitioning of bisphenol analogues in water and sediment from Liaohe River Basin and Taihu Lake, China[J]. Water Research, 2016, 103: 343-351. doi: 10.1016/j.watres.2016.07.059 [11] ZHOU L J, ZHANG B B, ZHAO Y G, et al. Occurrence, spatiotemporal distribution, and ecological risks of steroids in a large shallow Chinese Lake, Lake Taihu[J]. Science of the Total Environment, 2016, 557/558: 68-79. doi: 10.1016/j.scitotenv.2016.03.059 [12] LIU Y H, ZHANG S H, SONG N H, et al. Occurrence, distribution and sources of bisphenol analogues in a shallow Chinese freshwater lake (Taihu Lake): Implications for ecological and human health risk[J]. Science of the Total Environment, 2017, 599/600: 1090-1098. doi: 10.1016/j.scitotenv.2017.05.069 [13] ROCHESTER J R, BOLDEN A L. Bisphenol S and F: A systematic review and comparison of the hormonal activity of bisphenol A substitutes[J]. Environmental Health Perspectives, 2015, 123(7): 643-650. doi: 10.1289/ehp.1408989 [14] ZDARTA J, ANTECKA K, FRANKOWSKI R, et al. The effect of operational parameters on the biodegradation of bisphenols by Trametes versicolor laccase immobilized on Hippospongia communis spongin scaffolds[J]. Science of the Total Environment, 2018, 615: 784-795. doi: 10.1016/j.scitotenv.2017.09.213 [15] CHOI Y J, LEE L S. Aerobic soil biodegradation of bisphenol (BPA) alternatives bisphenol S and bisphenol AF compared to BPA[J]. Environmental Science & Technology, 2017, 51(23): 13698-13704. [16] DANZL E, SEI K, SODA S, et al. Biodegradation of bisphenol A, bisphenol F and bisphenol S in seawater[J]. International Journal of Environmental Research and Public Health, 2009, 6(4): 1472-1484. doi: 10.3390/ijerph6041472 [17] SAKAI K, YAMANAKA H, MORIYOSHI K, et al. Biodegradation of bisphenol A and related compounds by Sphingomonas sp. strain BP-7 isolated from seawater[J]. Bioscience, Biotechnology, and Biochemistry, 2007, 71(1): 51-57. doi: 10.1271/bbb.60351 [18] 蔡蕊, 王文姬, 许航, 等. 四溴双酚A在土壤中的降解转化及残留研究进展[J]. 环境化学, 2021, 40(1): 102-110. doi: 10.7524/j.issn.0254-6108.2020021001 CAI R, WANG W J, XU H, et al. Degradation, transformation, and residue formation of tetrabromobisphenol A (TBBPA) in soil: A review[J]. Environmental Chemistry, 2021, 40(1): 102-110 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020021001
[19] de MORAIS FARIAS J, KREPSKY N. Bacterial degradation of bisphenol analogues: An overview[J]. Environmental Science and Pollution Research International, 2022, 29(51): 76543-76564. doi: 10.1007/s11356-022-23035-3 [20] CHEN D, KANNAN K, TAN H L, et al. Bisphenol analogues other than BPA: Environmental occurrence, human exposure, and toxicity-a review[J]. Environmental Science & Technology, 2016, 50(11): 5438-5453. [21] WU L H, ZHANG X M, WANG F, et al. Occurrence of bisphenol S in the environment and implications for human exposure: A short review[J]. Science of the Total Environment, 2018, 615: 87-98. doi: 10.1016/j.scitotenv.2017.09.194 [22] CHOI Y J, LEE L S. Partitioning behavior of bisphenol alternatives BPS and BPAF compared to BPA[J]. Environmental Science & Technology, 2017, 51(7): 3725-3732. [23] LIAO C Y, KANNAN K. A survey of alkylphenols, bisphenols, and triclosan in personal care products from China and the United States[J]. Archives of Environmental Contamination and Toxicology, 2014, 67(1): 50-59. doi: 10.1007/s00244-014-0016-8 [24] KONNO Y, SUZUKI H, KUDO H, et al. Synthesis and properties of fluorine-containing poly(ether)s with pendant hydroxyl groups by the polyaddition of bis(oxetane)s and bisphenol AF[J]. Polymer Journal, 2004, 36(2): 114-122. doi: 10.1295/polymj.36.114 [25] 张超. 青春期双酚AF暴露对初中生抑郁症状和小鼠神经行为的影响及机制研究[D]. 合肥: 安徽医科大学, 2022. ZHANG C. Effects and mechanisms of adolescent bisphenol AF exposure on depressive symptoms in junior high school students and neurobehavior in mice[D]. Hefei: Anhui Medical University, 2022 (in Chinese).
[26] SONG S J, RUAN T, WANG T, et al. Distribution and preliminary exposure assessment of bisphenol AF (BPAF) in various environmental matrices around a manufacturing plant in China[J]. Environmental Science & Technology, 2012, 46(24): 13136-13143. [27] XUE J C, KANNAN K. Mass flows and removal of eight bisphenol analogs, bisphenol A diglycidyl ether and its derivatives in two wastewater treatment plants in New York State, USA[J]. Science of the Total Environment, 2019, 648: 442-449. doi: 10.1016/j.scitotenv.2018.08.047 [28] RUSSO G, BARBATO F, GRUMETTO L. Monitoring of bisphenol A and bisphenol S in thermal paper receipts from the Italian market and estimated transdermal human intake: A pilot study[J]. Science of the Total Environment, 2017, 599/600: 68-75. doi: 10.1016/j.scitotenv.2017.04.192 [29] LIAO C Y, LIU F, MOON H B, et al. Bisphenol analogues in sediments from industrialized areas in the United States, Japan, and Korea: Spatial and temporal distributions[J]. Environmental Science & Technology, 2012, 46(21): 11558-11565. [30] LIAO C Y, LIU F, GUO Y, et al. Occurrence of eight bisphenol analogues in indoor dust from the United States and several Asian countries: Implications for human exposure[J]. Environmental Science & Technology, 2012, 46(16): 9138-9145. [31] YU X H, XUE J C, YAO H, et al. Occurrence and estrogenic potency of eight bisphenol analogs in sewage sludge from the U. S. EPA targeted national sewage sludge survey[J]. Journal of Hazardous Materials, 2015, 299: 733-739. doi: 10.1016/j.jhazmat.2015.07.012 [32] SHIMABUKU I, CHEN D, WU Y, et al. Occurrence and risk assessment of organophosphate esters and bisphenols in San Francisco Bay, California, USA[J]. Science of the Total Environment, 2022, 813: 152287. doi: 10.1016/j.scitotenv.2021.152287 [33] CHIRIAC F L, PIRVU F, PAUN I. Investigation of endocrine disruptor pollutants and their metabolites along the Romanian Black Sea Coast: Occurrence, distribution and risk assessment[J]. Environmental Toxicology and Pharmacology, 2021, 86: 103673. doi: 10.1016/j.etap.2021.103673 [34] YAMAZAKI E, YAMASHITA N, TANIYASU S, et al. Bisphenol A and other bisphenol analogues including BPS and BPF in surface water samples from Japan, China, Korea and India[J]. Ecotoxicology and Environmental Safety, 2015, 122: 565-572. doi: 10.1016/j.ecoenv.2015.09.029 [35] ZHAO X, QIU W H, ZHENG Y, et al. Occurrence, distribution, bioaccumulation, and ecological risk of bisphenol analogues, parabens and their metabolites in the Pearl River Estuary, South China[J]. Ecotoxicology and Environmental Safety, 2019, 180: 43-52. doi: 10.1016/j.ecoenv.2019.04.083 [36] WAN Y J, XIA W, YANG S Y, et al. Spatial distribution of bisphenol S in surface water and human serum from Yangtze River watershed, China: Implications for exposure through drinking water[J]. Chemosphere, 2018, 199: 595-602. doi: 10.1016/j.chemosphere.2018.02.040 [37] YAN Z Y, LIU Y H, YAN K, et al. Bisphenol analogues in surface water and sediment from the shallow Chinese freshwater lakes: Occurrence, distribution, source apportionment, and ecological and human health risk[J]. Chemosphere, 2017, 184: 318-328. doi: 10.1016/j.chemosphere.2017.06.010 [38] WANG L, YING G G, ZHAO J L, et al. Assessing estrogenic activity in surface water and sediment of the Liao River system in northeast China using combined chemical and biological tools[J]. Environmental Pollution, 2011, 159(1): 148-156. doi: 10.1016/j.envpol.2010.09.017 [39] SI W, CAI Y F, LIU J C, et al. Investigating the role of colloids on the distribution of bisphenol analogues in surface water from an ecological demonstration area, China[J]. Science of the Total Environment, 2019, 673: 699-707. doi: 10.1016/j.scitotenv.2019.04.142 [40] YANG X D, ZHOU Q H, WANG Q W, et al. Congener-specific uptake and accumulation of bisphenols in edible plants: Binding to prediction of bioaccumulation by attention mechanism multi-layer perceptron machine learning model[J]. Environmental Pollution, 2023, 337: 122552. doi: 10.1016/j.envpol.2023.122552 [41] ŠAUER P, ŠVECOVÁ H, GRABICOVÁ K, et al. Bisphenols emerging in Norwegian and Czech aquatic environments show transthyretin binding potency and other less-studied endocrine-disrupting activities[J]. The Science of the Total Environment, 2021, 751: 141801. doi: 10.1016/j.scitotenv.2020.141801 [42] WEI D L, YUAN K J, AI F X, et al. Occurrence, spatial distributions, and temporal trends of bisphenol analogues in an E-waste dismantling area: Implications for risk assessment[J]. Science of the Total Environment, 2023, 867: 161498. doi: 10.1016/j.scitotenv.2023.161498 [43] SUN Q, WANG Y W, LI Y, et al. Fate and mass balance of bisphenol analogues in wastewater treatment plants in Xiamen City, China[J]. Environmental Pollution, 2017, 225: 542-549. doi: 10.1016/j.envpol.2017.03.018 [44] QIAN Y G, JIA X F, DING T D, et al. Occurrence and removal of bisphenol analogues in wastewater treatment plants and activated sludge bioreactor[J]. Science of the Total Environment, 2021, 758: 143606. doi: 10.1016/j.scitotenv.2020.143606 [45] KARTHIKRAJ R, KANNAN K. Mass loading and removal of benzotriazoles, benzothiazoles, benzophenones, and bisphenols in Indian sewage treatment plants[J]. Chemosphere, 2017, 181: 216-223. doi: 10.1016/j.chemosphere.2017.04.075 [46] ČESEN M, LENARČIČ K, MISLEJ V, et al. The occurrence and source identification of bisphenol compounds in wastewaters[J]. Science of the Total Environment, 2018, 616/617: 744-752. doi: 10.1016/j.scitotenv.2017.10.252 [47] SONG S J, SONG M Y, ZENG L Z, et al. Occurrence and profiles of bisphenol analogues in municipal sewage sludge in China[J]. Environmental Pollution, 2014, 186: 14-19. doi: 10.1016/j.envpol.2013.11.023 [48] LEE S, LIAO C Y, SONG G J, et al. Emission of bisphenol analogues including bisphenol A and bisphenol F from wastewater treatment plants in Korea[J]. Chemosphere, 2015, 119: 1000-1006. doi: 10.1016/j.chemosphere.2014.09.011 [49] ALBOUY M, DECEUNINCK Y, MIGEOT V, et al. Characterization of pregnant women exposure to halogenated parabens and bisphenols through water consumption[J]. Journal of Hazardous Materials, 2023, 448: 130945. doi: 10.1016/j.jhazmat.2023.130945 [50] RUSSO G, LANERI S, Di LORENZO R, et al. Monitoring of pollutants content in bottled and tap drinking water in Italy[J]. Molecules, 2022, 27(13): 3990. doi: 10.3390/molecules27133990 [51] WANG W, ABUALNAJA K O, ASIMAKOPOULOS A G, et al. A comparative assessment of human exposure to tetrabromobisphenol A and eight bisphenols including bisphenol A via indoor dust ingestion in twelve countries[J]. Environment International, 2015, 83: 183-191. doi: 10.1016/j.envint.2015.06.015 [52] XU Z Y, TIAN L, LIU L, et al. Food thermal labels are a source of dietary exposure to bisphenol S and other color developers[J]. Environmental Science & Technology, 2023, 57(12): 4984-4991. [53] ZHOU N, LIU Y H, CAO S Q, et al. Biodegradation of bisphenol compounds in the surface water of Taihu Lake and the effect of humic acids[J]. Science of the Total Environment, 2020, 723: 138164. doi: 10.1016/j.scitotenv.2020.138164 [54] FANG Z, HU Y Y, WU X S, et al. A novel magnesium ascorbyl phosphate graphene-based monolith and its superior adsorption capability for bisphenol A[J]. Chemical Engineering Journal, 2018, 334: 948-956. doi: 10.1016/j.cej.2017.10.067 [55] FANG Z, HU Y Y, ZHANG W W, et al. Shell-free three-dimensional graphene-based monoliths for the aqueous adsorption of organic pollutants[J]. Chemical Engineering Journal, 2017, 316: 24-32. doi: 10.1016/j.cej.2017.01.072 [56] LI L Y, XU D H, PEI Z G. Kinetics and thermodynamics studies for bisphenol S adsorption on reduced graphene oxide[J]. RSC Advances, 2016, 6(65): 60145-60151. doi: 10.1039/C6RA10607B [57] WANG Q, LU X H, CAO Y, et al. Degradation of Bisphenol S by heat activated persulfate: Kinetics study, transformation pathways and influences of co-existing chemicals[J]. Chemical Engineering Journal, 2017, 328: 236-245. doi: 10.1016/j.cej.2017.07.041 [58] FRANKOWSKI R, PŁATKIEWICZ J, STANISZ E, et al. Biodegradation and photo-Fenton degradation of bisphenol A, bisphenol S and fluconazole in water[J]. Environmental Pollution, 2021, 289: 117947. doi: 10.1016/j.envpol.2021.117947 [59] LIU Y X, ZHANG X, WU F. Photodegradation of bisphenol AF in montmorillonite dispersions: Kinetics and mechanism study[J]. Applied Clay Science, 2010, 49(3): 182-186. doi: 10.1016/j.clay.2010.05.002 [60] YANG T, WANG L, LIU Y L, et al. Comparative study on ferrate oxidation of BPS and BPAF: Kinetics, reaction mechanism, and the improvement on their biodegradability[J]. Water Research, 2019, 148: 115-125. doi: 10.1016/j.watres.2018.10.018 [61] JIA J L, LIU D M, WANG Q, et al. Comparative study on bisphenols oxidation via TiO2 photocatalytic activation of peroxymonosulfate: Effectiveness, mechanism and pathways[J]. Journal of Hazardous Materials, 2022, 424: 127434. doi: 10.1016/j.jhazmat.2021.127434 [62] IKE M, CHEN M Y, DANZL E, et al. Biodegradation of a variety of bisphenols under aerobic and anaerobic conditions[J]. Water Science and Technology: a Journal of the International Association on Water Pollution Research, 2006, 53(6): 153-159. doi: 10.2166/wst.2006.189 [63] FRANKOWSKI R, ZGOŁA-GRZEŚKOWIAK A, SMUŁEK W, et al. Removal of bisphenol A and its potential substitutes by biodegradation[J]. Applied Biochemistry and Biotechnology, 2020, 191(3): 1100-1110. doi: 10.1007/s12010-020-03247-4 [64] WANG X W, CHEN J Q, JI R, et al. Degradation of bisphenol S by a bacterial consortium enriched from river sediments[J]. Bulletin of Environmental Contamination and Toxicology, 2019, 103(4): 630-635. doi: 10.1007/s00128-019-02699-7 [65] CAO S Q, WANG S F, ZHAO Y Y, et al. Fate of bisphenol S (BPS) and characterization of non-extractable residues in soil: Insights into persistence of BPS[J]. Environment International, 2020, 143: 105908. doi: 10.1016/j.envint.2020.105908 [66] WANG H, LIU Z H, ZHANG J, et al. Insights into removal mechanisms of bisphenol A and its analogues in municipal wastewater treatment plants[J]. The Science of the Total Environment, 2019, 692: 107-116. doi: 10.1016/j.scitotenv.2019.07.134 [67] CHOI Y J, NIES L F, LEE L S. Persistence of three bisphenols and other trace organics of concern in anaerobic sludge under methanogenic conditions[J]. Environmental Technology, 2021, 42(9): 1373-1382. doi: 10.1080/09593330.2019.1668966 [68] OGATA Y, GODA S, TOYAMA T, et al. The 4-tert-butylphenol-utilizing bacterium Sphingobium fuliginis OMI can degrade bisphenols via phenolic ring hydroxylation and meta-cleavage pathway[J]. Environmental Science & Technology, 2013, 47(2): 1017-1023. [69] TOYAMA T, OJIMA T, TANAKA Y, et al. Sustainable biodegradation of phenolic endocrine-disrupting chemicals by Phragmites australis-rhizosphere bacteria association[J]. Water Science and Technology: a Journal of the International Association on Water Pollution Research, 2013, 68(3): 522-529. doi: 10.2166/wst.2013.234 [70] TOYAMA T, MOMOTANI N, OGATA Y, et al. Isolation and characterization of 4-tert-butylphenol-utilizing Sphingobium fuliginis strains from Phragmites australis rhizosphere sediment[J]. Applied and Environmental Microbiology, 2010, 76(20): 6733-6740. doi: 10.1128/AEM.00258-10 [71] TOYAMA T, MURASHITA M, KOBAYASHI K, et al. Acceleration of nonylphenol and 4-tert-octylphenol degradation in sediment by Phragmites australis and associated rhizosphere bacteria[J]. Environmental Science & Technology, 2011, 45(15): 6524-6530. [72] TANGHE T, DHOOGE W, VERSTRAETE W. Isolation of a bacterial strain able to degrade branched nonylphenol[J]. Applied and Environmental Microbiology, 1999, 65(2): 746-751. doi: 10.1128/AEM.65.2.746-751.1999 [73] 赵晓晴. 椰壳生物炭固定化TTNP3对水环境中双酚类化合物的去除[D]. 南京: 南京大学, 2018. ZHAO X Q. The removal of bisphenol compounds in water environment by coconut shell biochar immobilized TTNP3[D]. Nanjing: Nanjing University, 2018 (in Chinese).
[74] SANTISI S, CAPPELLO S, CATALFAMO M, et al. Biodegradation of crude oil by individual bacterial strains and a mixed bacterial consortium[J]. Brazilian Journal of Microbiology, 2015, 46(2): 377-387. doi: 10.1590/S1517-838246120131276 [75] KOVAČIČ A, GYS C, GULIN M R, et al. Kinetics and biotransformation products of bisphenol F and S during aerobic degradation with activated sludge[J]. Journal of Hazardous Materials, 2021, 404: 124079. doi: 10.1016/j.jhazmat.2020.124079 [76] HUANG W C, JIA X F, LI J Y, et al. Dynamics of microbial community in the bioreactor for bisphenol S removal[J]. Science of the Total Environment, 2019, 662: 15-21. doi: 10.1016/j.scitotenv.2019.01.173 [77] LIM B R, DO S H, HONG S H. The impact of humic acid on the removal of bisphenol A by adsorption and ozonation[J]. Desalination and Water Treatment, 2015, 54(4/5): 1226-1232. [78] WIRASNITA R, MORI K, TOYAMA T. Effect of activated carbon on removal of four phenolic endocrine-disrupting compounds, bisphenol A, bisphenol F, bisphenol S, and 4-tert-butylphenol in constructed wetlands[J]. Chemosphere, 2018, 210: 717-725. doi: 10.1016/j.chemosphere.2018.07.060 [79] BECK S, BERRY E, DUKE S, et al. Characterization of Trametes versicolor laccase-catalyzed degradation of estrogenic pollutants: Substrate limitation and product identification[J]. International Biodeterioration & Biodegradation, 2018, 127: 146-159. [80] SOLÉ A, MATAMOROS V. Removal of endocrine disrupting compounds from wastewater by microalgae co-immobilized in alginate beads[J]. Chemosphere, 2016, 164: 516-523. doi: 10.1016/j.chemosphere.2016.08.047 [81] HOU R, GAN L, GUAN F Y, et al. Bioelectrochemically enhanced degradation of bisphenol S: Mechanistic insights from stable isotope-assisted investigations[J]. iScience, 2021, 24(1): 102014. doi: 10.1016/j.isci.2020.102014 [82] WU X L, GU Y C, WU X Y, et al. Construction of a tetracycline degrading bacterial consortium and its application evaluation in laboratory-scale soil remediation[J]. Microorganisms, 2020, 8(2): 292. doi: 10.3390/microorganisms8020292 [83] OOI J, LEE L Y, HIEW B Y Z, et al. Assessment of fish scales waste as a low cost and eco-friendly adsorbent for removal of an azo dye: Equilibrium, kinetic and thermodynamic studies[J]. Bioresource Technology, 2017, 245: 656-664. doi: 10.1016/j.biortech.2017.08.153 [84] DVOŘÁK P, NIKEL P I, DAMBORSKÝ J, et al. Bioremediation 3.0: Engineering pollutant-removing bacteria in the times of systemic biology[J]. Biotechnology Advances, 2017, 35(7): 845-866. doi: 10.1016/j.biotechadv.2017.08.001 [85] MNIF I, SAHNOUN R, ELLOUZ-CHAABOUNI S, et al. Application of bacterial biosurfactants for enhanced removal and biodegradation of diesel oil in soil using a newly isolated consortium[J]. Process Safety and Environmental Protection, 2017, 109: 72-81. doi: 10.1016/j.psep.2017.02.002 [86] SUBASHCHANDRABOSE S R, RAMAKRISHNAN B, MEGHARAJ M, et al. Consortia of cyanobacteria/microalgae and bacteria: Biotechnological potential[J]. Biotechnology Advances, 2011, 29(6): 896-907. doi: 10.1016/j.biotechadv.2011.07.009 -





 DownLoad:
DownLoad: