-
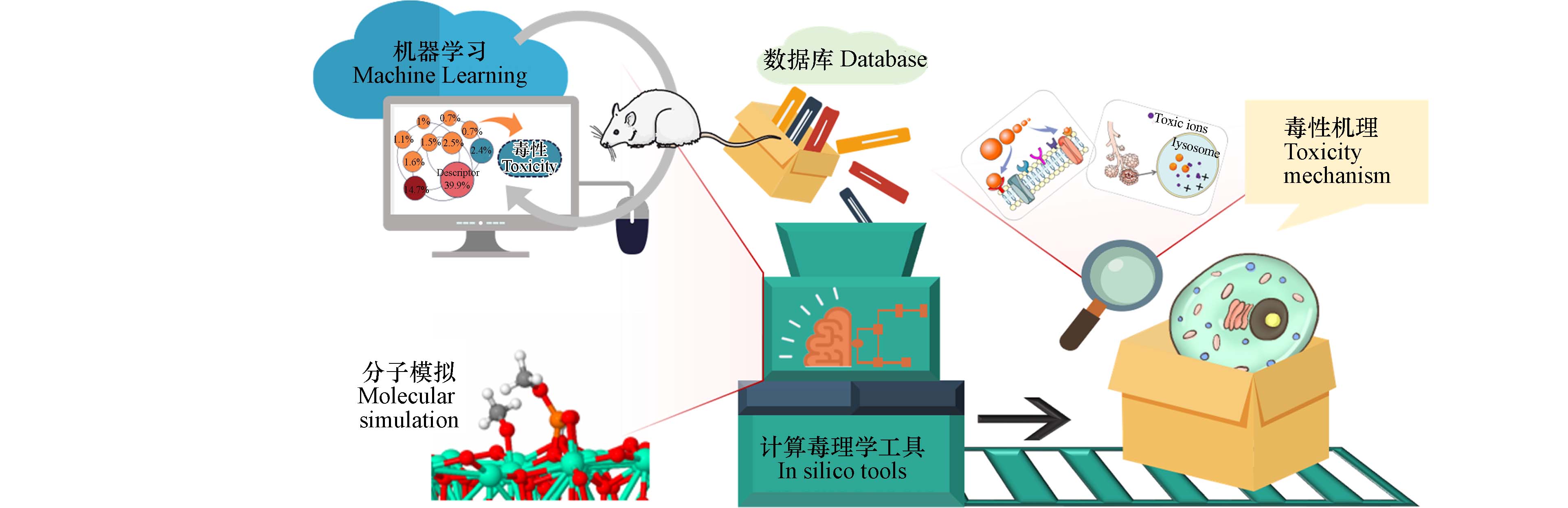
《中共中央关于制定国民经济和社会发展第十四个五年规划和二〇三五年远景目标的建议》对“重视新污染物治理”提出了新的要求. 新污染物是指未被纳入常规环境监测,但有可能进入环境,并导致已知或潜在的负面生态或健康效应,可能成为未来法规管理对象的化学物质. 为深入打好污染防治攻坚战,推动生态环境高水平保护,助力新污染物治理,需要全面筛查纳米材料等新污染物的生物效应和毒性作用,甄别具有健康危害的优先控制污染物. 近年来,由于纳米科技等新兴技术领域的高速发展,纳米材料等新污染物正在大量、飞速地产生[1]. 工业活动、农业和医疗服务中一系列纳米材料的使用导致其随后出现在土壤、地表和地下水资源中,对生态系统和人类健康造成了潜在的、尚不明确的不良后果[2]. 例如,全球每年产生的纳米废物数量已达150万吨[3],其潜在公共健康风险引起了广泛关注[1, 4 − 6]. 由于纳米材料在物理化学性质、量子力学性质、生物转化以及毒理学影响方面都表现出高度复杂的机制[7],其风险评估面临比常规污染物更严峻的挑战.
传统的毒性评估方法主要依赖于动物水平的体内(in vivo)测试,然而动物实验通常伴随着效率低下、成本高昂以及伦理困境等局限性. 因此工程纳米材料等新化学品被合成和使用的速度(每年500—
1000 种)远高于传统化学品毒性评估实验的进行速度(每种2—3年),且多数实验的结果是描述性的,难以揭示毒性的深层次机理. 由于动物毒性实验的种种限制,全球范围内的科研和政策影响机构都在致力于发展动物测试的替代策略,例如,美国环境保护署(EPA)已宣布将于2035年停止开展或资助任何在哺乳动物身上进行的实验研究. 为了满足日益增长的风险评价需求,实现毒性的高通量、低成本筛查,同时最大化利用有利生物效应和最小化不利生物效应(实现新物质的安全设计),计算毒理学(In silico)工具应运而生并广受推广. 然而,由于缺乏标准化,监管机构尚未接受将计算毒理学工具作为风险评估的独立解决方案,而是将其作为传统实验的补充工具[7 − 8].计算毒理学指的是使用计算工具支持毒理学研究和化学品安全评估的综合策略. 计算毒理学工具通过大数据分析、人工智能和机器学习、预测建模、和分子模拟等手段,建立不依赖于动物试验的毒性评估新方法(图1). 对PubMed的年度出版物数量进行了分析可以发现,机器学习等人工智能方法在毒性预测领域的研究数量从2000年到2020年迅速增加,在2014年到2020年间增长了近5倍[9]. 《21世纪毒性测试:愿景与策略》发表以来,全球范围内计算毒理学工具蓬勃发展. 例如, EPA于2005年成立了从事计算毒理学研究的“国家计算毒理学中心”[10]. 在REACH法规的指引下,经济合作与发展组织(OECD)和欧盟联合研究中心等国际组织机构逐渐形成了一系列计算毒理学方法的导则(图2)、数据库和工具平台. 专门针对纳米材料的数据库和预测平台工具也正在涌现. 例如,截止2023年9月,纳米技术产品数据库(https://product.statnano.com)已经收录了分布在全球64个国家,来自
3124 家公司的一万多种商用纳米材料. 印度贾达普大学(Jadavpur University)针对纳米材料建立了预测软件NanoProfiler (http://teqip.jdvu.ac.in/QSAR_Tools/DTCLab/),实现了使用文献中已经报道的计算毒理学模型来预测纳米材料的性质和毒性. 我国计算毒理学研究也正在迅速发展. 针对纳米材料,大连理工大学建立了专门性的预测软件,对纳米金属氧化物的炎症效应和免疫毒性进行虚拟筛查[11 − 12].基于人工智能的毒性预测工具将是纳米材料等新污染物毒性筛查和监管的未来方向[9,13]. 在纳米计算毒理学工具发展的关键时刻,需要对其进行综合性、标准化的梳理和应用,以便形成新污染物风险评估的计算毒理学解决方案和传统动物实验的有力替代策略. 本综述全面回顾了近10年来针对纳米材料的计算毒理学研究,介绍了用于研究纳米毒性筛查和纳米毒性机理探索的机器学习预测模型和分子模拟等计算毒理学工具. 讨论的毒性终点包括纳米生物界面作用、肺毒性、肾毒性、生殖发育毒性和神经毒性等,并总结了影响各类毒性的关键参数,以期促进我国计算毒理学领域研究工作在新污染物治理方面的快速推进.
-
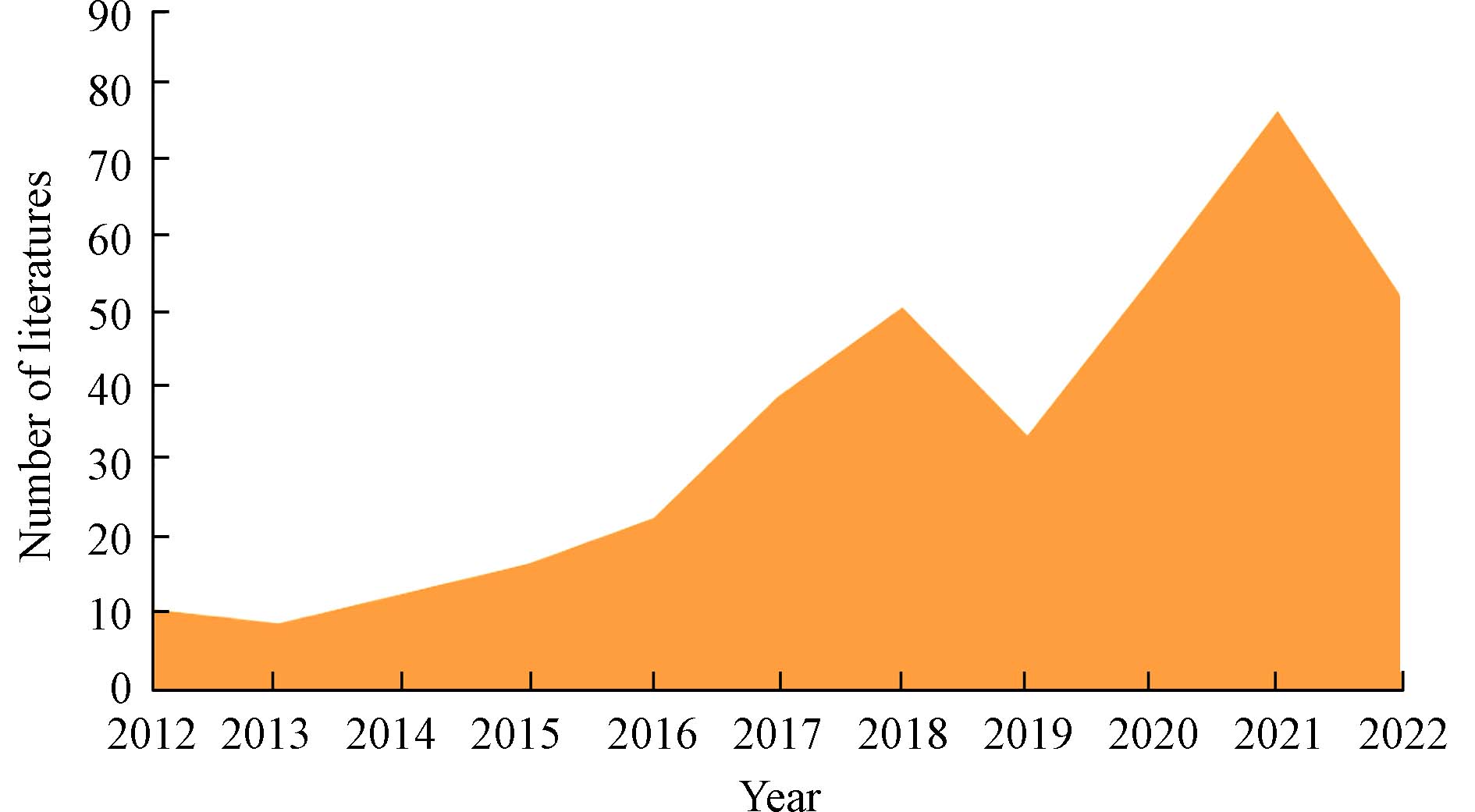
本研究运用VOSviewer 1.6.16可视化软件对纳米计算毒理学领域文献研究脉络进行分析与展示. 由荷兰雷登大学科学技术中心开发的VOSviewer软件是一款基于网络数据创建可视化文献计量知识图谱的软件,可用于文献关键词、主题词、作者等信息的共现分析. 在Web of science以“nanoparticle* AND toxic* AND in silico”为检索式,检索时间从2012年1月1日至2023年1月1日,经筛选后所得近10年相关文献381篇. 图3为2012—2023年每年发文量的趋势图,2012年纳米计算毒理学研究相关文献的收录只有10篇左右,科研界对纳米计算毒理学工具的探索还处在萌芽状态;2012—2016年期间发文总量呈缓慢增长的状态,纳米计算毒理学的研究处于初步发展阶段;2016—2023年间相关文章的发表量大幅上升,表明使用计算毒理学工具研究纳米毒性取得了重大突破. 但2018—2019期间增长趋势短期呈现下降状态,说明近5年内关于纳米计算毒理学的研究理论已经相对成熟. 然而在2020年《中共中央关于制定国民经济和社会发展第十四个五年规划和二〇三五年远景目标的建议》发布以来,为了助力新污染物治理,全面筛查纳米材料等新污染物的生物效应和毒性作用成为研究热点,其热度在近3年内又一次大幅增高. 为甄别具有健康危害的优先控制纳米材料,可以预见纳米计算毒理学领域在未来仍有巨大的发展潜力.
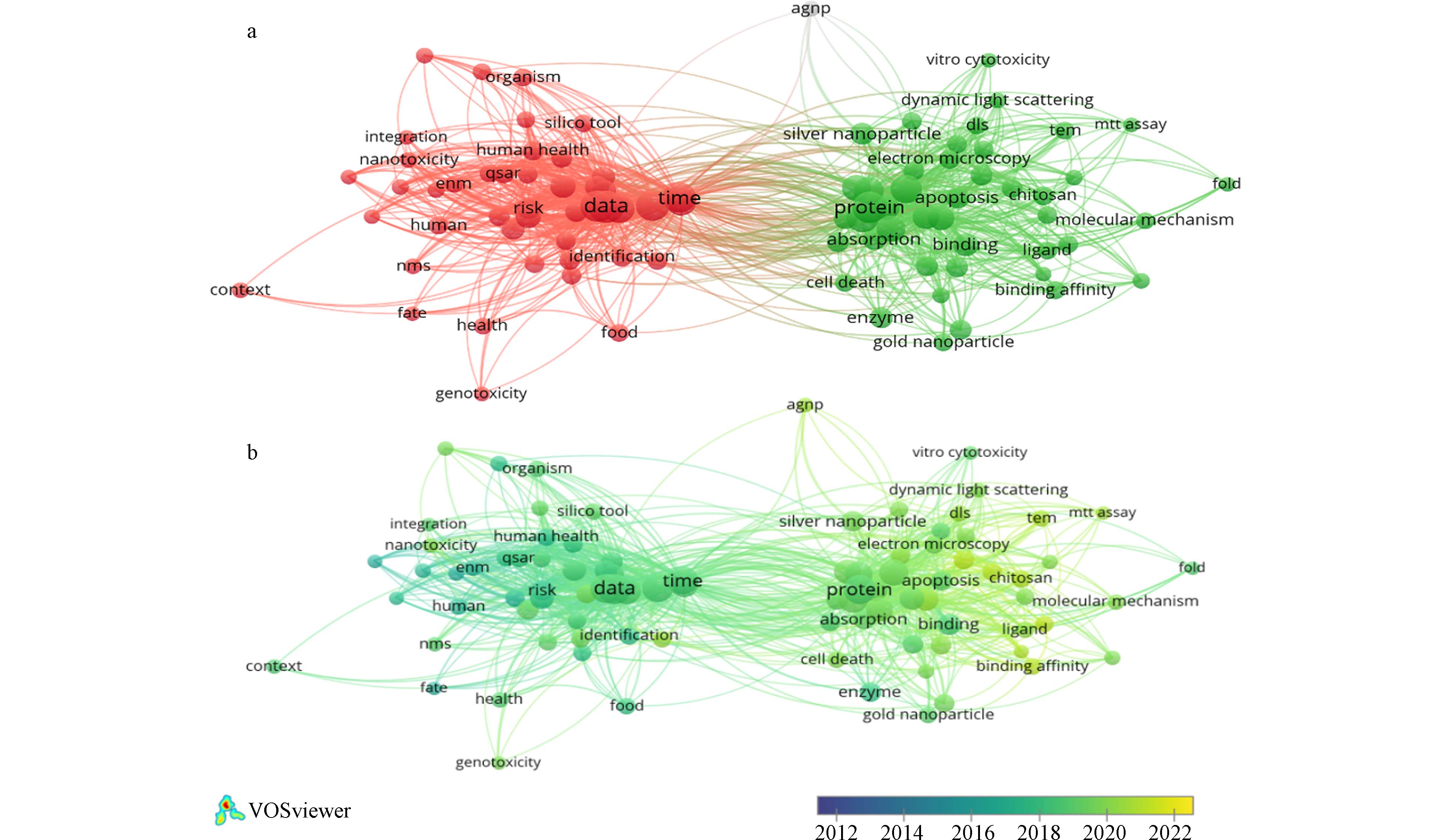
将整理后的数据导入VOSviewer 1.6.16软件,并提取关键词. 根据提取到的关键词字段信息对关键词的频次进行统计和降序排列,得到高频关键词(以10作为高频词阈值)共91个. 出现频次排在前20位的关键词及其出现次数依次列入表1中.
对91个高频关键词进行共现聚类可视化分析. 如图4a所示,每个圆形节点代表1个关键词,连线代表两个关键词间存在共现关系. 连线的粗细与两个关键词间的关联强度呈正比,连线的长短分别与两个关键词间的关联强度呈反比. 节点的大小取决于关键词出现的频次,节点的颜色(红色和绿色)以及其所在位置代表其所属的聚类. 同时对高频关键词进行关键词共现时间线分析(图4b). 关键词共现时间线图谱中,不同颜色代表着不同的关键词出现年份,节点颜色为蓝代表关键词出现得时间较早,节点颜色为黄表示关键词新兴程度较高. 可以看出在纳米计算毒理学领域的高频关键词出现时间都较为临近,新兴度很高.
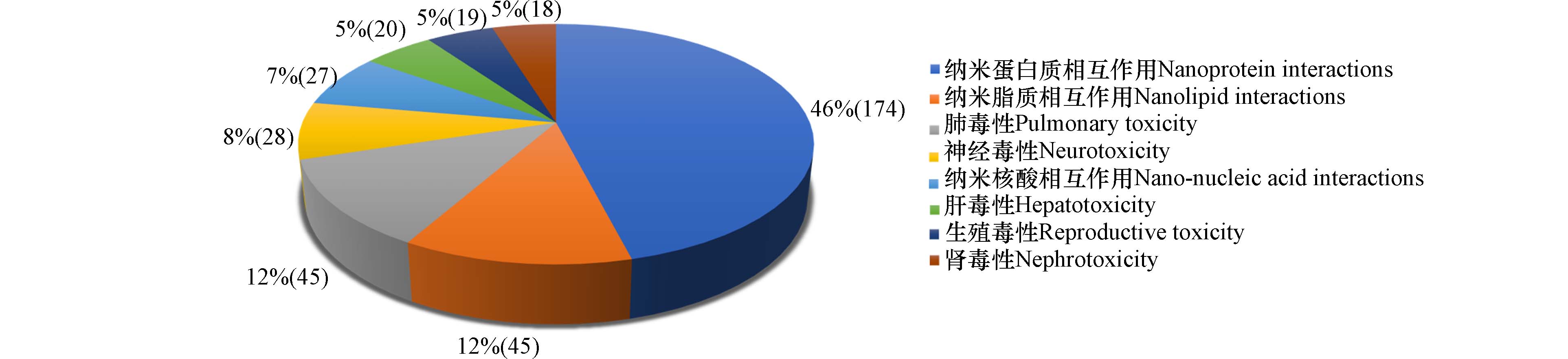
为了了解纳米计算毒理学研究关注的毒性终点,在Web of science分别以“nanoparticle* AND toxic* AND in silico AND protein”,“nanoparticle* AND toxic* AND in silico AND lipid”, “nanoparticle* AND toxic* AND in silico AND nucleic acid”, “nanoparticle* AND toxic* AND in silico AND (lung OR pulmonary)”,“nanoparticle* AND toxic* AND in silico AND (liver OR hepato*)”,“nanoparticle* AND toxic* AND in silico AND (renal OR kidney)”,“nanoparticle* AND toxic* AND in silico AND neuro*”,“nanoparticle* AND toxic* AND in silico AND reproductive”为检索式,搜索该领域以纳米蛋白质相互作用、纳米脂质相互作用、纳米核酸相互作用、纳米肺毒性、纳米肝毒性、纳米肾毒性、纳米生殖毒性和纳米神经毒性为终点的计算毒理学研究. 检索时间从2012年1月1日至2023年1月1日. 从图5中可以看出,针对纳米毒性的计算模拟研究最常见的终点为纳米蛋白质相互作用、纳米脂质相互作用、纳米肺毒性,分别涵盖174、46和45篇出版物. 其次为神经毒性、纳米核酸相互作用、肝毒性,分别涵盖29、27和20篇出版物. 关注生殖毒性和肾毒性的纳米计算毒理学研究相对较少,分别涵盖19和18篇出版物. 以下将根据不同的毒性终点,对各领域的代表性纳米计算毒理学研究展开综述.
-
纳米材料可以通过意外暴露(呼吸、皮肤接触、食物链积累)以及有目的方式(医疗和诊断)进入人体或其它生物系统[14]. 研究证据表明,进入生物体的纳米材料首先会与生物系统中的生物大分子(蛋白质、核酸和脂质等)发生相互作用[15]. 这些相互作用错综复杂地影响着纳米-生物界面的形成,并进一步决定了其溶解、聚集、细胞摄取以及蛋白冠形成等过程,进而影响其毒性[16]. 因此,纳米毒性筛查首先需要深入了解其与生物分子之间的相互作用. 得益于分子建模理论和计算机技术的快速发展,理论建模和基于机器学习的预测模型逐渐成为阐明和预测复杂生物界面的一种经济可靠的方法. 分子动力学(molecular dynamics, MD)模拟已经被成功用于揭示纳米材料是如何与生物分子(蛋白质、膜和核酸)在原子/分子水平上的相互作用,以及由此产生的对生物功能的影响. 机器学习模型也被用于高通量预测各类纳米-生物界面作用和揭示纳米生物界面效应的影响因素. 这些研究结果不仅对于纳米毒性筛查非常重要,而且对于评估纳米药物的潜在治疗效果也非常重要. 本节以纳米材料为代表,综述了基于MD的计算毒理学工具在研究纳米-生物界面上的进展.
-
因为蛋白质数量巨大,且每种蛋白质都具有特定的生物学功能,因此纳米-蛋白界面是最重要的界面[16]. 纳米材料和蛋白质之间的界面作用影响着其在体内的生物效应,这些效应可能是有益的,可用于纳米医学;也可能是有害的,导致纳米毒性. 例如,β-淀粉样蛋白和α-突触核蛋白肽分别是阿尔茨海默和帕金森的病理标志. Yang等[17]首次使用MD模拟表明,石墨烯可以抑制β-淀粉样蛋白的聚集,用于以上疾病的治疗. 金属富勒烯醇Gd@C82(OH)22被认为是治疗胰腺癌和乳腺癌的潜在抗肿瘤纳米药物[18]. 但是,Gd@C82(OH)22同时会抑制基质金属蛋白酶的表达,降低其活性. 为了破译Gd@C82(OH)22对基质金属蛋白酶的特异性抑制,Kang等[18]使用MD模拟揭示了Gd@C82(OH)22特异性结合基质金属蛋白酶并抑制其活性是受非特异性静电、疏水和特异性氢键的驱动,而非以往研究以为的锌催化位点. Gu等[19]和Li等[20]提出石墨烯表面出现的缺陷可以增强其诱导蛋白质变性的能力. 蛋白质的碱性残基与石墨烯缺陷位点上的带电羧基之间具有强静电相互作用,从而使蛋白质能紧密地固定在石墨烯缺陷边缘. 同时,蛋白质的其他部分通过强烈的π-π堆积和疏水相互作用附着在石墨烯表面,这一过程加速了蛋白质的解折叠.
随着实验数据的不断扩充,采用机器学习算法可以建立纳米-生物分子相互作用的预测模型,揭示影响纳米材料与生物分子之间相互作用的关键因素. Ban等[21]挖掘和分析了56篇文献中652条各种纳米材料上吸附的蛋白冠数据,建立了一个具有高度异构性的数据库,并通过随机森林(Random forest, RF)模型发现了决定蛋白冠形成的最重要因素是纳米颗粒表面是否经过修饰. Findlay等[22]采用集成机器学习算法对银纳米材料蛋白冠吸附进行了预测,揭示了影响蛋白冠形成的关键因素是蛋白质的理化性质和银纳米颗粒的表面电荷. 尽管机器学习模型可用于预测纳米-蛋白相互作用,但由于缺乏合适的纳米描述符和适用的纳米结构诠释方法,这种预测仍受到一定阻碍. 受人脸识别技术的启发,Yan等[23]通过对纳米结构图像的卷积神经网络分析,对纳米-蛋白相互作用进行了预测. 该模型直接从纳米颗粒图像中学习纳米结构特征,无需进行纳米描述符的计算. 构建的卷积神经网络模型可成功地用于预测147种纳米颗粒(包括123种金纳米颗粒、12种铂纳米颗粒和12种钯纳米颗粒)的物理化学性质(如分配系数logP和zeta电势)以及生物活性(如细胞摄取情况和蛋白质吸附情况). 这种方法实现了高效的端到端深度学习模式,可用于纳米材料安全设计.
-
核酸(DNA和RNA)作为细胞中的主要的遗传信息携带分子,在指导蛋白质的合成方面具有重要功能. 某些尺寸下或具有特定表面涂层的纳米材可以穿过细胞膜,直接与核酸发生作用,对细胞造成有害影响[24]. 另一方面,某些纳米材料通过吸附核酸可以作为纳米载体使用[25]. 因此,通过计算模拟对纳米-核酸相互作用进行研究,对于了解纳米材料基因毒性的基本分子机制以及纳米材料在DNA技术中的应用具有双重意义. Gu等通过模拟双链的氧核糖核酸(dsDNA)与二维氮化碳纳米材料(C2N)的结合,发现dsDNA与C2N单层结合的方式是使dsDNA的轴线与C2N单层呈垂直方向. 这是因为位于dsDNA末端位置的两个界面核苷酸碱基诱导了与C2N表面的部分π-π堆积相互作用,从而稳定了垂直结合模式[26]. Gu等还提出,界面上的水分子调节了dsDNA和不同Pd晶体表面(Pd(100)和Pd(111))之间的界面相互作用[19]. dsDNA在Pd(111)表面显示出平坦的构象,而在Pd(100)表面显示直立的构象,表明dsDNA与Pd(111)的结合亲和力比与Pd(100)强. 这些模拟和预测通过凝胶电泳实验得到了验证.
-
纳米材料与细胞膜之间的特殊相互作用已经为纳米医学(例如,用于抗菌治疗、靶向药物递送和生物成像)以及纳米毒性研究提供了重要切入点[27]. 已有研究基于MD模拟探究了纳米材料与细胞膜界面之间的相互作用以及纳米材料对细胞膜结构和功能的影响. Tu等[28]通过MD模拟研究了石墨烯纳米片的潜在抗菌活性,发现纳米片可以从大肠杆菌膜中提取大量的磷脂分子. 这主要是由于石墨烯纳米片对脂质的强烈分散作用使细菌的生存能力显著降低. 随后又有研究表明,蛋白质的吸附能够通过减少石墨烯纳米材料对细胞膜的物理破坏来减轻其细胞毒性[29]. 对于其他二维纳米材料(如BN[30 − 31]、C2N[32 − 33]和黑磷[34]等)进行的一系列MD模拟和实验研究也共同表明它们对脂质膜可能具有破坏作用. 针对富勒烯[35 − 36]、碳纳米管[37]、金纳米颗粒[38]和二氧化硅[39]等纳米材料的MD模拟表明,疏水性[28]、表面电荷[40]、形状和大小[38, 41]是影响纳米材料膜通透性/相容性的关键因素,这可能对降低纳米材料的毒性,并增强其医学应用具有指导意义.
-
纳米材料由于尺寸微小,很容易悬浮在空气中被人类吸入,因此肺部是纳米材料进入人体的主要途径之一[42]. 虽然很多纳米材料等新污染物对人类的潜在健康影响尚不确定[1],但有研究表明,暴露于富含纳米材料的颗粒物会增加肺部感染的易感性,引发肺炎、肺纤维化等疾病[43 − 44]. 纳米材料沉积产生的肺部炎症效应等不良反应还可能会驱动次级器官的毒性效应,如对血管壁和大脑产生有害影响[44 − 45]. 研究者观察到,暴露于富含金属氧化物纳米颗粒的烟雾中使焊工群体中肺炎的发病风险显著增加[46]. 焊接作业产生的颗粒物多达80%为亚微米级颗粒[47],这些纳米颗粒很容易悬浮在空气中,造成职业暴露. 研究发现,在肺部疾病患者的肺泡巨噬细胞和肺纤维化区域中,沉积着由铁、锰和氧化铬组成的纳米颗粒(直径分布为20—25 nm)[46]. 在体外[48]和体内[43]实验中,也证明了呼吸暴露于纳米材料会通过炎性激活和Toll样受体(TLR)激活诱导强烈的免疫反应,导致炎症细胞因子(IL-1β)大量释放. 从安全评估的角度出发,已有研究开发了用于预测纳米材料肺部毒性的机器学习模型(表2).
-
大多数已发表的模型都针对一个传统的毒理学终点:肺部细胞死亡. 例如,Oh Eunkeu等基于17个量子点建立了预测量子点诱导上皮细胞和成纤维细胞的毒性预测模型,利用表面性质、量子点直径、测试类型和暴露时间等描述符预测量子点材料的毒性[49]. Trinh等基于20种不同类型的多壁碳纳米管(MWCNT),开发了针对纳米材料的定量结构-效应关系(QSAR)模型,以预测MWCNT对人类肺细胞的细胞毒性[50]. 该模型表明,MWCNT的以下特性可以用于预测其对人肺细胞具有毒性:直径(12−74 nm);长度(0.19−20.25 μm);表面积(11.3−380.0 m2·g−1);暴露剂量(0−200 mg·kg−1). Labouta 等基于24种无机纳米材料和9种有机纳米材料,对肺癌人类肺泡基底上皮细胞(A549 cells) 和小鼠单核巨噬细胞(RAW 264.7)的致死率进行了建模预测. 模型表明,这两种细胞的毒性主要与纳米颗粒的化学组成相关,其次是纳米颗粒浓度、纳米颗粒尺寸和细胞类型[51]. 通过结合体外实验和计算方法,Cao等通过考虑纳米颗粒尺寸和zeta电位对毒性的影响,建立了用于预测纳米金属氧化物对A549细胞的半数致死浓度(LC50). 模型揭示了纳米金属氧化物在A549细胞中的毒性机制与活性氧释放有关[52].
近年来,纳米材料的毒性作用被发现不仅表现为杀死细胞,因此也有研究开始致力于开发用于预测纳米材料与肺部免疫系统等相互作用的机器学习模型. 例如,通过构建涵盖包括30余种纳米金属氧化物的综合毒性数据库,已有研究搭建了预测纳米材料诱导免疫毒性[12]和肺部炎症效应[11]的机器学习模型. 结合机器学习分析、密度泛函理论(DFT)计算和实验等手段,识别和证明了纳米材料诱导肺部免疫毒性和炎症的关键事件以及毒性机理:电负性、ζ-电位和阳离子电荷被发现是影响金属氧化物诱导炎症效应的关键参数,而金属离子在溶酶体内的溶解性被首次发现和证明可以用来预测免疫毒性.
-
目前,绝大多数已建立的模型只能预测体外(In vitro)终点,针对个体水平上肺部毒性的预测模型较少. 原因之一是数据量的限制:在机器人技术的帮助下,高通量筛选(HTS)技术的进展加速了体外毒性数据的大量生成. 原因之二是数据的质量的限制:使用自动化测试方法产生的数据具有很高的同质性. 因此与动物数据相比,这些数据更适合开发毒性预测模型,动物数据可能会在同一实验产生多个差异大的测试结果. 原因之三是机理解释的限制:由于完整生物体的复杂性,仅根据个体水平的顶端毒性和描述符,很难科学地解释模型的预测结果. 对比而言,分子和细胞水平的毒性预测结果与化学结构描述符之间的相关性可以相对容易地解释.
针对体内肺部毒性的计算毒理学模型尚处在萌芽状态. 已有研究借助Meta-Analysis构建了非功能化碳纳米管的体内肺部毒性预测模型. 预测终点涵盖肺支气管肺泡灌洗液中的毒性指标:中性粒细胞和巨噬细胞计数,以及乳酸脱氢酶和总蛋白浓度. 结果发现,金属的杂质对碳纳米管的肺毒性具有显著影响(钴杂质能增加毒性,而其他杂质有混合影响),碳纳米管长度与大多数肺毒性指标呈负相关,碳纳米管直径和聚集体大小与细胞损伤指标呈负相关,但与免疫毒性指标有正相关. 也有研究通过文献挖掘收集了57种纳米材料在大鼠/小鼠体内的免疫反应和纳米颗粒肺器官负荷毒性数据,提出了一种基于RF特征重要度的特征交互网络分析框架. 该研究基于暴露剂量、恢复时间等描述符对纳米颗粒的肺免疫应答和肺器官负荷进行了准确预测.
-
肝脏与肾脏是人体的主要解毒器官,参与许多外源和内源性物质的分解代谢和排泄. 对大鼠的研究表明,ZnO[61]、SiO2[62 − 63]等纳米材料会通过诱发氧化应激等效应,使大鼠肾脏线粒体和细胞膜受损,导致肾毒性. 针对肾毒性,Wang等收集了34种金纳米颗粒,使用疏水性等描述符和k-近邻(kNN)算法,开发了人胚胎肾细胞293(HEK293 cells)细胞摄取情况的预测模型[62]. Manganelli等通过使用quasi-SMILES描述符建立了暴露于20 nm和50 nm SiO2纳米颗粒的HEK293细胞毒性预测模型[64]. Yuan等使用多重偏最小二乘(PLS)回归和RF回归开发了计算毒理学模型以预测暴露于纳米TiO2的人肾皮质近曲小管上皮细胞(HK-2)的细胞毒性. 研究表明,RF模型在评估肾毒性方面具有更高的稳定性和精确度[65].
-
来自动物实验、人类临床观察和流行病学研究的结果表明,纳米材料具有生殖和发育毒性,威胁公共健康[1,4]. 例如,研究证明尺寸微小的工程纳米材料可以通过血睾屏障,并积聚在生殖器官中,影响精子产生[66]. 暴露于TiO2等工程纳米材料被证明会损害男性生殖系统[67]以及对怀孕、胎儿发育和后代健康构成危害[68 − 69]. Ban等针对工程纳米材料构建了机器学习模型以预测其与生殖系统之间的相互作用[70]. 该研究从文献中挖掘了18种纳米材料在动物实验中的生殖毒性数据和10个生殖毒性影响因素(例如纳米颗粒性质和实验条件等),进行荟萃分析并建立了基于RF的分类模型. 模型从高度异质性数据中识别了决定纳米生殖毒性的关键因素:纳米材料的化学组成和暴露方式. 含有锌和铁元素的纳米材料倾向于在大鼠体内积累,但其诱导的生殖毒性显著低于含有贵金属的纳米材料. 与其他暴露途径相比,腹腔注射会诱导更显著的生殖毒性. Robinson等建立了预测纳米金属氧化物材料对斑马鱼胚胎毒性的机器学习模型. 结果表明,纳米金属氧化物的金属元素鲍林电负性对斑马鱼胚胎毒性具有显著影响[71].
-
工程纳米材料可以从鼻腔中的嗅上皮细胞沿着嗅神经元进入嗅球,从而直接到达大脑,进入中枢神经系统并影响神经元功能[72]. 例如,单壁纳米颗粒(SWNT)、富勒烯、镉硒量子点、炭黑和染料掺杂的SiO2等5种纳米颗粒被发现会引起的大鼠PC-12神经元样细胞系毒性[72]. 为了筛查纳米材料对神经系统造成的不良影响,计算毒理学工具已经被用于评估其体内和体外神经毒性. Marvin等建立了贝叶斯网络(BN)模型,基于工程纳米材料的不同物理化学性质、生物效应和(体外或体内)暴露方法等参数评估其神经毒性、炎症等多种毒理学终点,通过使用p-chem特征和有关研究类型的信息研究纤维化和细胞毒性[73]. 但目前针对纳米神经毒性的预测模型数量较少,未来需要发展针对纳米神经毒性的综合数据库,促进计算毒理学工具在神经毒性领域的发展和应用.
-
本文回顾了近10年来用于研究纳米材料的计算毒理学工具的最新进展. 这些工具作为动物实验的替代方法,可以高效、低成本地对大批量纳米材料进行毒性筛查,有助于解决传统毒理学的伦理、经济和时间限制. 通过机理分析,这些工具揭示了纳米材料诱导细胞和生物体水平毒性的关键影响因素,同时也促进了研究者对毒性机理的理解和新的毒性机理的发现. 然而,计算毒理学工具的发展过程中仍面临以下问题有待解决.
(1)揭示或预测体内毒性的计算毒理学工具欠缺. 化学物质风险评估随着毒性测试模式的转变和新法规的引入而不断发展,使用哺乳动物的体内毒性实验广受批判并已经开始被禁止使用. 体内实验通常比体外实验提供更全面、更与人类相关的毒性数据,但是由于动物实验成本高昂,当需要评估大量新材料时,有限的时间和资源显然不足以支撑对每种物质进行传统的动物实验. 高通量体外测试方法在初步毒性筛选时具有巨大潜力. 但体外测试系统一般仅限于一种或几种不同的细胞类型,因此不能代表整个生物体的毒性效应. 且体外测试通常使用癌症细胞系,这些细胞系产生的反应与动物体内毒性很可能不同甚至完全相反. 因此,计算毒理学研究的最终的目标必将是开发能够基于体外实验数据预测体内效应的外推工具. 然而,目前能使用体外数据预测体内毒性的工具很少. 这是由于针对纳米材料等新污染物毒性的体内数据还很稀少,少数可用于计算毒理学分析的体内数据往往在不同的实验条件下产生,具有高度复杂性和异质性,这使得对其毒性行为进行概括具有极大挑战性. 未来需要制定严格的标准来规范和收集已发表的新兴污染物的体内毒性数据,构建标准化的综合毒性数据库. 在这一基础上,有可能填补体外到体内毒性的外推工具这一基本空白的领域,为动物毒性测试提供优先顺序,从而减少不必要的动物实验.
(2)数据库的毒性数据类别严重不平衡. 由于生物测试本身的特点,来自毒性数据库的数据通常具有严重不平衡的问题,少量具有毒性的化学物质与大量非毒性化学物质形成悬殊对比. 在计算毒理学模型训练和验证阶段通常都会遇到一个问题:无毒(阴性)的样本数量远远高于有毒(阳性)的样本数量[74]. 数据集中的这种不平衡是毒理学大数据分析及建模中一个极为普遍的问题,它对算法性能有负面影响. 为了有效利用现有数据库,从不平衡数据集中训练高效稳健的计算毒理学模型,需要应用一些方法进行类别平衡. 例如,通过应用合成少数类过采样技术(Synthetic minority oversampling technique, SMOTE)来增加少数类的数据点. 该技术是一种监督实例算法,它基于kNN原理对少数类样本进行过采样[75].
(3)纳米材料与其他污染物共同暴露问题有待研究. 大多纳米材料具有高反应性,即使是那些传统被认为惰性的材料(例如TiO2、Au、Ag纳米颗粒),环境变化也可以显著改变其物理化学性质,从而改变其生物效应[76]. 为了更好地评估纳米材料在环境中的毒性影响,未来需要了解其释放到环境中后的特性变化规律. 因此未来的计算毒理学研究需要侧重于环境中更可能被发现的新污染物类型(如纳米复合材料),并考虑到其在环境中的化学和生物转化. 此外,以纳米颗粒为代表的一类新污染物与蛋白质、生物膜、细胞、DNA和细胞器相互作用,形成一系列依赖于动态生物-物理-化学相互作用的纳米生物界面. 这些相互作用导致环境冠(蛋白冠、脂质冠)的形成,另一方面,生物分子可能在纳米材料表面诱导自由能释放、表面重组和溶解行为. 这些过程可能对生物相容性或毒性具有显著影响,还有待于进一步研究.
(4)计算毒理学工具的机理解释尚不完备. 由于高通量测试方法的加持,公开的数据量和数据复杂性均在增加,这使计算毒理学研究能够使用更先进的机器学习算法(如深度神经网络),也能够捕捉复杂的、微弱的非线性关系. 然而,这些类型的模型通常具有“黑箱”性质. 所以对模型进行机理解释对于说明机器学习模型预测结果是否符合科学的基本原则至关重要. 尽管近年来各种算法的可解释性不断增强,但在计算毒理学领域,模型的机理解释仍然普遍被忽视. 大多数研究致力于应用机器学习等人工智能方法来对毒性终点进行预测,但少有研究借助人工智能方法来确定或发现毒性机理[9].
(5)已开发的毒性预测模型的应用存在困难. 目前大多数研究都集中在使用毒性数据开发新的模型,而不是将已有模型应用于毒理学领域的应用(例如新污染物的毒性筛查)[9]. 原因可能是在许多建模研究中,毒性预测模型都是基于专有算法和技术,并且开发模型的源代码被公开的情况并不多. 在化学品管理领域,人们具有不同的学术背景,即使源代码是开放的,对于算法和程序专业知识的缺失使得使用模型预测毒性变得困难,也难以将其综合利用于化学物质的监管. 在未来的研究中,建立一个开放访问的数据和模型共享社区非常重要. 在没有隐私或法律保密要求时,应在模型发表时提供完整的数据集和分析源代码,作为发表的必要条件.
计算毒理学工具解码纳米毒性评估和毒性机理
In silico tools in computational toxicology decode risk assessment and mechanism interpretation of nanomaterials
-
摘要: “十四五”时期对“重视新污染物治理”提出了新的要求. 工程纳米材料等新污染物的毒性筛查对于保护环境和人类健康至关重要. 由于动物实验方法面临周期长、成本高、效率低下、伦理问题等局限性,传统毒理学实验的进行速度远远落后于新纳米材料的出现速度. 为了高通量、低成本地评估纳米材料潜在的健康风险,发展动物实验的替代方法十分必要. 计算毒理学工具作为最有望替代动物实验的智能策略之一,仍处于积极发展和应用的早期阶段. 本文使用VOSviewer软件对近十年来代表性的纳米计算毒理学研究进行了分析,综述了用于筛查和评估纳米材料毒性、解释其毒性机理的各种计算毒理学工具,包括机器学习模型和分子模拟等. 本文讨论的终点包括纳米材料与各类生物界面的作用、肺毒性、肾毒性、生殖发育毒性和神经毒性等,并总结了影响各类毒性的关键参数,提出了该领域发展中存在的问题与展望,有望为纳米材料的计算毒理学研究和应用提供参考.Abstract: During the 14th Five Year Plan period from 2021 to 2025, new requirements were put forward for "attaching importance to the treatment of emerging contaminants". Risk assessment of engineered nanomaterials and other emerging contaminants is of great importance for protecting human health and the environment. Traditional hazard assessment relies mostly on in vivo testing that poses technical challenges, e.g., regarding the validity of extrapolation to humans, ethical dilemmas, but also comes with high resource demands in cost and time. Non-testing approaches in hazard assessment is necessary, considering cost and time efficiency to assess potential risks. Computational toxicology tools are alternative methods in compliance with the 3R (Replacement, Reduction, and Refinement) principles for reducing the use of animals in research. The advances in in silico tools for toxicity assessment are essential for increasing throughput, reducing the burden of animal testing, providing details of the toxicity mechanisms, and generating novel hypotheses for risk assessment in nano-toxicity. Computational toxicology tools comprise an active and diverse collection of ongoing efforts, although it is still in their early steps toward a scientific accord, subsequent guidelines, and regulation adoption. During the critical juncture, this paper reviews diverse in silico tools including machine learning models and molecular simulations for predicting biomacromolecule interactions and the adverse effects of nanomaterials during the last decade. Computational toxicology for analyzing and simulating various toxicity endpoints such as pulmonary toxicity, nephrotoxicity, reproductive toxicity, neurotoxicity, etc. are discussed, the characteristics affecting toxicity are deeply understood. The in silico approaches used as alternatives to animal models are helping to address the ethical, economic, and time constraints of in vivo tests, while also advancing understanding of toxicity mechanisms. In the future, specialized comprehensive databases of engineered nanomaterials and other emerging contaminants need to be built for substituting sparse literature data; prediction models based on artificial intelligence that decode relationships between in vitro and in vivo toxicity should be developed; co-exposure of nanomaterials and chemicals should be considered in toxicity predicting and risk assessments; the formation and structure of protein/lipid corona still need to be explored.
-

-
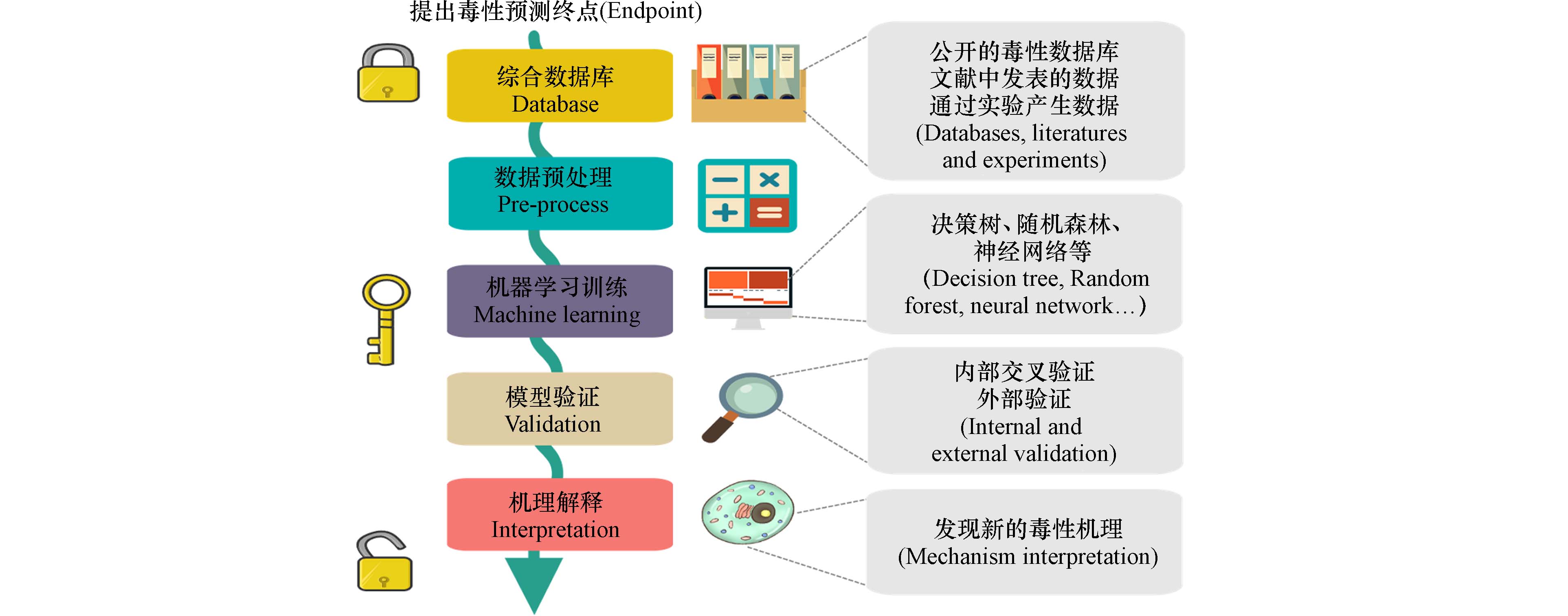
图 2 计算毒理学预测模型构建的总体路线. 路线图分为5个主要部分:数据库的构建、数据预处理、模型的构建、模型的验证和机理解释
Figure 2. A summarized general roadmap for implementing a prediction model in the field of computational toxicology. The roadmap could be divided into five main parts: database formation, data pre-processing, model implementation, model validation, and mechanism interpretation
表 1 出现频次排在前20位的关键词及其出现次数
Table 1. The occurrence frequency of the 20 highest frequency terms
关键词Keywords 中文含义Meaning 出现次数Frequency data 数据 74 in silico study/in silico model 计算研究/计算模型 74 risk/risk assessment 风险/风险评估 60 protein 蛋白质 68 nanomaterial 纳米材料 67 prediction 预测 62 delivery 传递 57 environment 环境 53 synthesis 合成 52 modeling 建模 50 time 时间 49 cell line 细胞系 48 cancer 癌症 43 efficacy 效率 41 stability 稳定性 37 molecular docking 分子对接 34 binding 结合 33 safety 安全性 30 physicochemical property 物理化学性质 29 silver nanoparticle 银纳米颗粒 27 表 2 预测纳米材料肺部毒性的机器学习模型
Table 2. Machine learning (ML) models for predicting the toxicity of nanomaterials
物质Materials 受试生物/细胞Test organism/cell 关键描述符Key descriptors 毒性终点Endpoints 参考文献References 17种量子点 肺上皮细胞成纤维细胞 壳、配体、表面修饰、直径、测试类型和暴露时间 LC50 [49] TiO2和ZnO纳米颗粒 大鼠肺上皮细胞和肺泡巨噬细胞 尺寸等物理化学性质 细胞膜损伤 [53] 42种TiO2和ZnO纳米颗粒 大鼠肺上皮细胞和肺泡巨噬细胞 尺寸和暴露浓度 细胞膜损伤 [54] 21种MeONPs 肺癌人类肺泡基底上皮细胞(A549 cells) 活性氧释放 LC50 [52] 18种MeONPs 人永生化表皮细胞(HaCaT cells) ΔH、氧元素百分比 EC50 [55] 17种MeONPs 人永生化表皮细胞(HaCaT cells) SMILES lg(1/EC50) [56] 21种MeONPs 肺癌人类肺泡基底上皮细胞(A549 cells) 颗粒尺寸和zeta电势 LC50 [57] 34种金纳米颗粒 肺癌人类肺泡基底上皮细胞(A549 cells) 疏水性 细胞摄取量 [58] 20种MWCNTs 人肺部细胞 (BEAS-2B, 16HBE14o-, WI-38, HBE) 直径、长度、表面积和剂量 CV [50] 24种无机纳米材料和9种有机纳米材料 肺癌人类肺泡基底上皮细胞(A549 cells)、小鼠单核巨噬细胞(RAW 264.7) 化学组成、暴露浓度、尺寸、细胞类型 CV [51] 30种MeONPs 类肺部巨噬细胞(THP-1 cells) 金属离子在溶酶体模拟液中的释放率、尺寸、zeta电势和阳离子电荷 CV [12] 30种MeONPs 类肺部巨噬细胞(THP-1 cells) 金属元素电负性、zeta电势和阳离子电荷 炎症效应 [11] 57种纳米材料 大鼠/小鼠 暴露剂量、恢复时间等 免疫反应和纳米颗粒肺器官负荷 [59] 17种CNT 大鼠/小鼠 金属杂质、尺寸、表面积、聚集情况等 炎症效应等肺部毒性指标 [60] * MeONPs: metal oxide nanoparticles, 纳米金属氧化物; MWCNTs: multiwalled carbon nanotubes, 多壁碳纳米管; CNT: carbon nanotube, 未功能化碳纳米管; CV: cell viability, 细胞存活率(%); EC50: concentration for 50% of maximal effect, 50%效应浓度; LC50: median lethal concentration, 半数致死量; ΔH: enthalpy of formation of a gaseous cation, 气态阳离子的形成焓. -
[1] LI X H, HUANG Y, CHEN J W. Advances in in silico toxicity assessment of nanomaterials and emerging contaminants[M]//Advances in Toxicology and Risk Assessment of Nanomaterials and Emerging Contaminants. Singapore: Springer Singapore, 2022: 325-347. [2] GOMES A R, JUSTINO C, ROCHA-SANTOS T, et al. Review of the ecotoxicological effects of emerging contaminants to soil biota[J]. Journal of Environmental Science and Health. Part A, Toxic/Hazardous Substances & Environmental Engineering, 2017, 52(10): 992-1007. [3] YOUNIS S A, EL-FAWAL E M, SERP P. Nano-wastes and the environment: Potential challenges and opportunities of nano-waste management paradigm for greener nanotechnologies[M]// Handbook of Environmental Materials Management. Cham: Springer, 2018: 1-72. [4] DIAMANTI-KANDARAKIS E, BOURGUIGNON J P, GIUDICE L C, et al. Endocrine-disrupting chemicals: An endocrine society scientific statement[J]. Endocrine Reviews, 2009, 30(4): 293-342. doi: 10.1210/er.2009-0002 [5] FLINT S, MARKLE T, THOMPSON S, et al. Bisphenol A exposure, effects, and policy: A wildlife perspective[J]. Journal of Environmental Management, 2012, 104: 19-34. [6] LYCHE J L, GUTLEB A C, BERGMAN A, et al. Reproductive and developmental toxicity of phthalates[J]. Journal of Toxicology and Environmental Health. Part B, Critical Reviews, 2009, 12(4): 225-249. doi: 10.1080/10937400903094091 [7] FURXHI I, MURPHY F, MULLINS M, et al. Practices and trends of machine learning application in nanotoxicology[J]. Nanomaterials, 2020, 10(1): 116. doi: 10.3390/nano10010116 [8] VILLAVERDE J J, SEVILLA-MORÁN B, LÓPEZ-GOTI C, et al. Considerations of nano-QSAR/QSPR models for nanopesticide risk assessment within the European legislative framework[J]. Science of the Total Environment, 2018, 634: 1530-1539. doi: 10.1016/j.scitotenv.2018.04.033 [9] 张家晨, 张良, 庄树林. 分子起始事件在计算毒理学中的研究展望[J]. 环境化学, 2021, 40(9): 2629-2632. doi: 10.1002/etc.5146 ZHANG J C, ZHANG L, ZHUANG S L. Perspective of molecular initiating events in computational toxicology[J]. Environmental Chemistry, 2021, 40(9): 2629-2632 (in Chinese). doi: 10.1002/etc.5146
[10] JEONG J, CHOI J. Artificial intelligence-based toxicity prediction of environmental chemicals: Future directions for chemical management applications[J]. Environmental Science & Technology, 2022, 56(12): 7532-7543. [11] COLLINS F S, GRAY G M, BUCHER J R. Toxicology. Transforming environmental health protection[J]. Science, 2008, 319(5865): 906-907. doi: 10.1126/science.1154619 [12] HUANG Y, LI X H, XU S J, et al. Quantitative structure-activity relationship models for predicting inflammatory potential of metal oxide nanoparticles[J]. Environmental Health Perspectives, 2020, 128(6): 67010. doi: 10.1289/EHP6508 [13] HUANG Y, LI X H, CAO J Y, et al. Use of dissociation degree in lysosomes to predict metal oxide nanoparticle toxicity in immune cells: Machine learning boosts nano-safety assessment[J]. Environment International, 2022, 164: 107258. doi: 10.1016/j.envint.2022.107258 [14] CAI X M, LIU X, JIANG J, et al. Molecular mechanisms, characterization methods, and utilities of nanoparticle biotransformation in nanosafety assessments[J]. Small, 2020, 16(36): e1907663. doi: 10.1002/smll.201907663 [15] MU Q X, JIANG G B, CHEN L X, et al. Chemical basis of interactions between engineered nanoparticles and biological systems[J]. Chemical Reviews, 2014, 114(15): 7740-7781. doi: 10.1021/cr400295a [16] WANG Y L, CAI R, CHEN C Y. The nano-bio interactions of nanomedicines: Understanding the biochemical driving forces and redox reactions[J]. Accounts of Chemical Research, 2019, 52(6): 1507-1518. doi: 10.1021/acs.accounts.9b00126 [17] YANG Z X, GE C C, LIU J J, et al. Destruction of amyloid fibrils by graphene through penetration and extraction of peptides[J]. Nanoscale, 2015, 7(44): 18725-18737. doi: 10.1039/C5NR01172H [18] KANG S G, ZHOU G Q, YANG P, et al. Molecular mechanism of pancreatic tumor metastasis inhibition by Gd@C82(OH)22 and its implication for de novo design of nanomedicine[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(38): 15431-15436. [19] GU Z L, ZHAO L, GE C C, et al. Facet-regulated adhesion of double-stranded DNA on palladium surfaces[J]. Nanoscale, 2019, 11(4): 1827-1836. doi: 10.1039/C8NR06203J [20] LI B Y, BELL D R, GU Z L, et al. Protein WW domain denaturation on defective graphene reveals the significance of nanomaterial defects in nanotoxicity[J]. Carbon, 2019, 146: 257-264. doi: 10.1016/j.carbon.2019.01.107 [21] BAN Z, YUAN P, YU F B, et al. Machine learning predicts the functional composition of the protein corona and the cellular recognition of nanoparticles[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(19): 10492-10499. [22] FINDLAY M R, FREITAS D N, MOBED-MIREMADI M, et al. Machine learning provides predictive analysis into silver nanoparticle protein corona formation from physicochemical properties[J]. Environmental Science. Nano, 2018, 5(1): 64-71. doi: 10.1039/C7EN00466D [23] YAN X L, ZHANG J, RUSSO D P, et al. Prediction of nano–bio interactions through convolutional neural network analysis of nanostructure images[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(51): 19096-19104. [24] SINGH N, MANSHIAN B, JENKINS G J S, et al. NanoGenotoxicology: The DNA damaging potential of engineered nanomaterials[J]. Biomaterials, 2009, 30(23/24): 3891-3914. [25] DEMIRER G S, ZHANG H, MATOS J L, et al. High aspect ratio nanomaterials enable delivery of functional genetic material without DNA integration in mature plants[J]. Nature Nanotechnology, 2019, 14(5): 456-464. doi: 10.1038/s41565-019-0382-5 [26] GU Z L, ZHAO L, LIU S T, et al. Orientational binding of DNA guided by the C2N template[J]. ACS Nano, 2017, 11(3): 3198-3206. doi: 10.1021/acsnano.7b00236 [27] ZHANG X, MA G H, WEI W. Simulation of nanoparticles interacting with a cell membrane: Probing the structural basis and potential biomedical application[J]. NPG Asia Materials, 2021, 13: 52. doi: 10.1038/s41427-021-00320-0 [28] TU Y S, LV M, XIU P, et al. Destructive extraction of phospholipids from Escherichia coli membranes by graphene nanosheets[J]. Nature Nanotechnology, 2013, 8(8): 594-601. doi: 10.1038/nnano.2013.125 [29] CHONG Y, GE C C, YANG Z X, et al. Reduced cytotoxicity of graphene nanosheets mediated by blood-protein coating[J]. ACS Nano, 2015, 9(6): 5713-5724. doi: 10.1021/nn5066606 [30] LI Z, ZHANG Y H, CHAN C, et al. Temperature-dependent lipid extraction from membranes by boron nitride nanosheets[J]. ACS Nano, 2018, 12(3): 2764-2772. doi: 10.1021/acsnano.7b09095 [31] XIE X J, HOU Z Y, DUAN G X, et al. Boron nitride nanosheets elicit significant hemolytic activity via destruction of red blood cell membranes[J]. Colloids and Surfaces B:Biointerfaces, 2021, 203: 111765. doi: 10.1016/j.colsurfb.2021.111765 [32] LIU L, ZHANG S T, ZHAO L, et al. Superior compatibility of C2N with human red blood cell membranes and the underlying mechanism[J]. Small, 2018, 14(52): e1803509. doi: 10.1002/smll.201803509 [33] ZHANG S T, LIU L, DUAN G X, et al. Cytotoxicity of C2N originating from oxidative stress instead of membrane stress[J]. ACS Applied Materials & Interfaces, 2019, 11(38): 34575-34585. [34] MA X Y, ZHU X H, HUANG C X, et al. Molecular mechanisms underlying the role of the puckered surface in the biocompatibility of black phosphorus[J]. Nanoscale, 2021, 13(6): 3790-3799. doi: 10.1039/D0NR08480H [35] QIAO R, ROBERTS A P, MOUNT A S, et al. Translocation of C60 and its derivatives across a lipid bilayer[J]. Nano Letters, 2007, 7(3): 614-619. doi: 10.1021/nl062515f [36] SRIDHAR A, SRIKANTH B, KUMAR A, et al. Coarse-grain molecular dynamics study of fullerene transport across a cell membrane[J]. The Journal of Chemical Physics, 2015, 143(2): 024907. doi: 10.1063/1.4926668 [37] SHEN C, ZOU G J, GUO W L, et al. Lipid coating and end functionalization govern the formation and stability of transmembrane carbon nanotube porins[J]. Carbon, 2020, 164: 391-397. doi: 10.1016/j.carbon.2020.04.011 [38] GUPTA R, RAI B. Effect of size and surface charge of gold nanoparticles on their skin permeability: A molecular dynamics study[J]. Scientific Reports, 2017, 7: 45292. doi: 10.1038/srep45292 [39] DELLE PIANE M, POTTHOFF S, BRINKER C J, et al. Molecular dynamics simulations of the silica–cell membrane interaction: Insights on biomineralization and nanotoxicity[J]. The Journal of Physical Chemistry C, 2018, 122(37): 21330-21343. doi: 10.1021/acs.jpcc.8b04537 [40] TANG X F, ZHANG S T, ZHOU H, et al. The role of electrostatic potential polarization in the translocation of graphene quantum dots across membranes[J]. Nanoscale, 2020, 12(4): 2732-2739. doi: 10.1039/C9NR09258G [41] GUPTA R, BADHE Y, MITRAGOTRI S, et al. Permeation of nanoparticles across the intestinal lipid membrane: Dependence on shape and surface chemistry studied through molecular simulations[J]. Nanoscale, 2020, 12(11): 6318-6333. doi: 10.1039/C9NR09947F [42] AHAMED M, AKHTAR M J, ALHADLAQ H A, et al. Assessment of the lung toxicity of copper oxide nanoparticles: Current status[J]. Nanomedicine, 2015, 10(15): 2365-2377. doi: 10.2217/nnm.15.72 [43] CHO W S, DUFFIN R, POLAND C A, et al. Metal oxide nanoparticles induce unique inflammatory footprints in the lung: Important implications for nanoparticle testing[J]. Environmental Health Perspectives, 2010, 118(12): 1699-1706. doi: 10.1289/ehp.1002201 [44] LI J J, MURALIKRISHNAN S, NG C T, et al. Nanoparticle-induced pulmonary toxicity[J]. Experimental Biology and Medicine, 2010, 235(9): 1025-1033. doi: 10.1258/ebm.2010.010021 [45] MILLS N L, DONALDSON K, HADOKE P W, et al. Adverse cardiovascular effects of air pollution[J]. Nature Clinical Practice Cardiovascular Medicine, 2009, 6(1): 36-44. doi: 10.1038/ncpcardio1399 [46] ANDUJAR P, SIMON-DECKERS A, GALATEAU-SALLÉ F, et al. Role of metal oxide nanoparticles in histopathological changes observed in the lung of welders[J]. Particle and Fibre Toxicology, 2014, 11: 23. doi: 10.1186/1743-8977-11-23 [47] DASCH J, D'ARCY J. Physical and chemical characterization of airborne particles from welding operations in automotive plants[J]. Journal of Occupational and Environmental Hygiene, 2008, 5(7): 444-454. doi: 10.1080/15459620802122720 [48] LI R B, JI Z X, CHANG C H, et al. Surface interactions with compartmentalized cellular phosphates explain rare earth oxide nanoparticle hazard and provide opportunities for safer design[J]. ACS Nano, 2014, 8(2): 1771-1783. doi: 10.1021/nn406166n [49] OH E, LIU R, NEL A, et al. Meta-analysis of cellular toxicity for cadmium-containing quantum dots[J]. Nature Nanotechnology, 2016, 11(5): 479-486. doi: 10.1038/nnano.2015.338 [50] TRINH T X, CHOI J S, JEON H, et al. Quasi-SMILES-based nano-quantitative structure-activity relationship model to predict the cytotoxicity of multiwalled carbon nanotubes to human lung cells[J]. Chemical Research in Toxicology, 2018, 31(3): 183-190. doi: 10.1021/acs.chemrestox.7b00303 [51] LABOUTA H I, ASGARIAN N, RINKER K, et al. Meta-analysis of nanoparticle cytotoxicity via data-mining the literature[J]. ACS Nano, 2019, 13(2): 1583-1594. [52] CAO J K, PAN Y, JIANG Y T, et al. Computer-aided nanotoxicology: Risk assessment of metal oxide nanoparticles via nano-QSAR[J]. Green Chemistry, 2020, 22(11): 3512-3521. doi: 10.1039/D0GC00933D [53] SAYES C, IVANOV I. Comparative study of predictive computational models for nanoparticle-induced cytotoxicity[J]. Risk Analysis:an Official Publication of the Society for Risk Analysis, 2010, 30(11): 1723-1734. doi: 10.1111/j.1539-6924.2010.01438.x [54] PAPA E, DOUCET J P, DOUCET-PANAYE A. Linear and non-linear modelling of the cytotoxicity of TiO2 and ZnO nanoparticles by empirical descriptors[J]. SAR and QSAR in Environmental Research, 2015, 26(7/8/9): 647-665. [55] BASANT N, GUPTA S. Multi-target QSTR modeling for simultaneous prediction of multiple toxicity endpoints of nano-metal oxides[J]. Nanotoxicology, 2017, 11(3): 339-350. doi: 10.1080/17435390.2017.1302612 [56] TOROPOVA A P, TOROPOV A A. Nano-QSAR in cell biology: Model of cell viability as a mathematical function of available eclectic data[J]. Journal of Theoretical Biology, 2017, 416: 113-118. doi: 10.1016/j.jtbi.2017.01.012 [57] LUAN F, KLEANDROVA V V, GONZÁLEZ-DÍAZ H, et al. Computer-aided nanotoxicology: Assessing cytotoxicity of nanoparticles under diverse experimental conditions by using a novel QSTR-perturbation approach[J]. Nanoscale, 2014, 6(18): 10623-10630. doi: 10.1039/C4NR01285B [58] WANG W Y, SEDYKH A, SUN H N, et al. Predicting nano-bio interactions by integrating nanoparticle libraries and quantitative nanostructure activity relationship modeling[J]. ACS Nano, 2017, 11(12): 12641-12649. doi: 10.1021/acsnano.7b07093 [59] YU F B, WEI C H, DENG P, et al. Deep exploration of random forest model boosts the interpretability of machine learning studies of complicated immune responses and lung burden of nanoparticles[J]. Science Advances, 2021, 7(22): eabf4130. doi: 10.1126/sciadv.abf4130 [60] GERNAND J M, CASMAN E A. A meta-analysis of carbon nanotube pulmonary toxicity studies: How physical dimensions and impurities affect the toxicity of carbon nanotubes[J]. Risk Analysis:an Official Publication of the Society for Risk Analysis, 2014, 34(3): 583-597. doi: 10.1111/risa.12109 [61] YAN G Y, HUANG Y N, BU Q, et al. Zinc oxide nanoparticles cause nephrotoxicity and kidney metabolism alterations in rats[J]. Journal of Environmental Science and Health. Part A, Toxic/Hazardous Substances & Environmental Engineering, 2012, 47(4): 577-588. [62] WANG F, GAO F, LAN M B, et al. Oxidative stress contributes to silica nanoparticle-induced cytotoxicity in human embryonic kidney cells[J]. Toxicology in Vitro, 2009, 23(5): 808-815. doi: 10.1016/j.tiv.2009.04.009 [63] SUN F L, WANG X Y, ZHANG P Z, et al. Reproductive toxicity investigation of silica nanoparticles in male pubertal mice[J]. Environmental Science and Pollution Research, 2022, 29(24): 36640-36654. doi: 10.1007/s11356-021-18215-6 [64] MANGANELLI S, LEONE C, TOROPOV A A, et al. QSAR model for predicting cell viability of human embryonic kidney cells exposed to SiO2 nanoparticles[J]. Chemosphere, 2016, 144: 995-1001. doi: 10.1016/j.chemosphere.2015.09.086 [65] YUAN B, WANG P, SANG L, et al. QNAR modeling of cytotoxicity of mixing nano-TiO2 and heavy metals. Ecotoxicology and Environmental Safety. 2021, 15(208): 111634. [66] LAN Z, YANG W X. Nanoparticles and spermatogenesis: How do nanoparticles affect spermatogenesis and penetrate the blood-testis barrier[J]. Nanomedicine, 2012, 7(4): 579-596. doi: 10.2217/nnm.12.20 [67] SANTONASTASO M, MOTTOLA F, COLACURCI N, et al. In vitro genotoxic effects of titanium dioxide nanoparticles (n-TiO2) in human sperm cells[J]. Molecular Reproduction and Development, 2019, 86(10): 1369-1377. doi: 10.1002/mrd.23134 [68] KUNOVAC A, HATHAWAY Q A, PINTI M V, et al. ROS promote epigenetic remodeling and cardiac dysfunction in offspring following maternal engineered nanomaterial (ENM) exposure[J]. Particle and Fibre Toxicology, 2019, 16(1): 24. doi: 10.1186/s12989-019-0310-8 [69] DUGERSHAW B B, AENGENHEISTER L, HANSEN S S K, et al. Recent insights on indirect mechanisms in developmental toxicity of nanomaterials[J]. Particle and Fibre Toxicology, 2020, 17(1): 31. doi: 10.1186/s12989-020-00359-x [70] BAN Z, ZHOU Q X, SUN A Q, et al. Screening priority factors determining and predicting the reproductive toxicity of various nanoparticles[J]. Environmental Science & Technology, 2018, 52(17): 9666-9676. [71] ROBINSON R L M, SARIMVEIS H, DOGANIS P, et al. Identifying diverse metal oxide nanomaterials with lethal effects on embryonic zebrafish using machine learning[J]. Beilstein Journal of Nanotechnology, 2021, 12: 1297-1325. doi: 10.3762/bjnano.12.97 [72] LARNER S F, WANG J, GOODMAN J, et al. In vitro neurotoxicity resulting from exposure of cultured neural cells to several types of nanoparticles[J]. Journal of Cell Death, 2017, 10: 1179670717694523. [73] MARVIN H J P, BOUZEMBRAK Y, JANSSEN E M, et al. Application of Bayesian networks for hazard ranking of nanomaterials to support human health risk assessment. Nanotoxicology, 2017, 11: 123-133. [74] BASEI G, HRISTOZOV D, LAMON L, et al. Making use of available and emerging data to predict the hazards of engineered nanomaterials by means of in silico tools: A critical review[J]. NanoImpact, 2019, 13: 76-99. doi: 10.1016/j.impact.2019.01.003 [75] CHAWLA N V, BOWYER K W, HALL L O, et al. SMOTE: Synthetic minority over-sampling technique[J]. Journal of Artificial Intelligence Research, 2002, 16: 321-357. doi: 10.1613/jair.953 [76] 韩晓丰, 王亮, 宁清, 等. 抗生素和纳米银对大肠杆菌的联合毒性和抗性突变诱导效应[J]. 环境化学, 2023, 42(1): 1-10. doi: 10.1002/etc.5366 HAN X F, WANG L, NING Q, et al. Joint toxicity and resistance mutation-inducing effect of antibiotics and AgNPs on Escherichia coli[J]. Environmental Chemistry, 2023, 42(1): 1-10 (in Chinese). doi: 10.1002/etc.5366
-




 下载:
下载: