-
湖泊是水生生态系统的重要组成部分,也是重要的生物多样性储存库[1]. 研究发现,湖泊在调节河川径流,繁衍水生生物和改善区域生态环境等方面发挥着重要作用[2 − 4]. 事实上,湖泊的许多生态功能都是由水生生物(包括植物和鱼类)、沉积物及其微生物协助完成的. 微生物影响水中有机质分解和养分循环,促进植物生长[5]. 水体和沉积物中的微生物群落对污水中的氮磷硫的去除有着直接影响[6]. 同时,微生物对水体污染物响应敏感,在水体质量和污染检测中常作为指示指标[7 − 8]. 随着湖泊富营养化和水体污染问题的日益严重,污染物对水体和沉积物微生物群落影响及其生态功能危害受到学者的广泛关注[9 − 11].
砷是环境中广泛存在的天然有毒类金属元素. 进入工业时代以来,由于金属冶炼、化石燃烧等工业活动,以及农业中使用含砷农药,大量含砷化合物排放到环境中,最终造成湖泊水体中砷污染问题[12]. 进入水体中的砷不断累积,并引起水体和沉积物微生物群落结构和生态功能的紊乱,从而威胁湖泊水体健康[13 − 14]. 同时,砷由水体进入动植物体内,通过食物链富集传递进入人体,对人类健康构成危害[15]. 目前,湖泊等水体砷污染问题已经得到了全球范围内的大量报道[16 − 17]. 鱼类是湖泊系统中的重要生物资源,鱼类活动能够影响湖泊生物群落结构、营养物质的构成等[18 − 19]. 然而,关于鱼类扰动对湖泊水体和沉积物中微生物的影响却极少报道. 因此,认识砷污染和鱼类活动对湖泊水体和沉积物微生物的影响,对全面理解湖泊生态系统中砷的毒性效应和生态风险具有重要意义.
鉴于此,本研究通过室内模拟湖泊生态系统,通过高通量测序技术探究鱼类活动和砷污染下湖泊水体和沉积物细菌群落的响应机制. 这将有助于提升人们对湖泊水体和沉积物细菌群落的认识,也有助于了解鱼类活动和污染物共同作用下对水生生态系统的潜在影响.
-
将采自当地湖泊的沉积物带回实验室,置于阴凉通风处风干后,捡出砾石、落叶和垃圾等杂物,研磨后过2 mm筛,备用. 供试鱼类为湖泊常见的麦穗鱼(Pseudorasbora parva),购自本地养殖场,实验所用鱼饲料购自本地水族市场. 实验前,选择相似长度和体重的鱼若干条,将其放入实验室采集的去离子水中进行两周的本地驯化. 本次实验选用十二水砷酸钠(Na3AsO4·12H2O)作为砷污染源,其他试剂若无特殊说明,均为分析级纯度,购自国药控股化学试剂有限公司.
-
本研究共设置4个处理组,分别为仅有沉积物的对照组(C),添加了鱼的处理组(C-F),添加了砷的处理组(As),添加了鱼和砷的复合处理组(As-F). 具体为,实验所用水体为城市自来水,静置1—2 d后,备用. 添加10 L水样到聚乙烯塑料收纳盒中(长×宽×高,40 cm × 30 cm × 30 cm),在底层均匀铺满5 cm厚度的沉积物,取适量的含砷试剂充分溶于水中,然后将溶液倒入贴有标签As和As-F的实验组中,用玻璃棒缓慢搅动,使其均匀分布在水体中,放在实验室避光处老化14 d. 在C-F和As-F的实验组中各加入10条长度体重相似的鱼. 每个处理组设3个重复,最后共有12个实验培养盒. 培养条件设置为:14 h光照,10 h黑暗,温度控制在(24 ± 2)℃,每3—5 d对鱼进行1次定点喂食. 实验期间,定期向收纳盒中加入超纯水,保证水量为10 L.
-
试验28 d后,采集水体、沉积物和鱼组织样品. 使用无菌手套将鱼从水体中捞出,放入装有无水乙醇的离心管中杀死封存,在无菌超纯水漂洗5次,从而去除鱼体表层微生物对实验结果的影响。在无菌操作台上用无菌镊子和无菌剪刀对鱼进行解剖,提取组织物. 所有水样用0.22 μm滤膜进行过滤,滤膜剪碎后使用土壤试剂盒FastDNA®Spin Kit(MP Biomedical, California, USA),依照其提供的操作流程提取水体微生物DNA. 称取沉积物0.5 g左右,使用与水体相同的土壤试剂盒提取沉积物微生物DNA. 鱼组织使用组织试剂盒DNeasy Blood and Tissue Kit(QIAGEN, 中国)提取其微生物DNA. 随后紫外分光光度计ND-1000(Nano-Drop,美国)测样品DNA浓度,最后将DNA样品储存于-20 ℃冰箱,备用.
-
本研究使用Illumina Hiseq 2500 平台高通量测序技术进行分析,扩增细菌16S rRNA基因的V4区(上下游引物分别为515F: 5′-GTGCCAGCMGCCGCGGTAA-3′,806R: 5′-GGACTACHVGGGTWTCTAAT-3′),下游引物加上barcode用来区别不同样品. PCR扩增反应体系及其加热循环条件参照文献[20]. PCR产物经纯化回收、浓度测定并混库,送测序公司(诺禾,中国)进行测序. 测序原始序列使用Quantitative Insights Into Microbial Ecology (QIIME)进行分析[21]. 首先去除所有barcode、低质量及模糊序列,得到高质量目标区域序列,在97%的相似度水平上完成操作分类单元(Operational Taxonomic Units, OTU)[22]. 细菌Alpha多样性通过OUT、Chao1指数和 Shannon多样性指数表示每个样品内在多样性. Beta多样性采用基于Bray−Curtis距离的主坐标轴法分析. 测序数据已上传到美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)(SRP111095).
-
水体和沉积物pH值采用pH仪(Fisher Scientific,美国)进行测定. 沉积物总氮(TN)和总碳(TC)使用C/N分析仪(Vario MAX C/N,德国)燃烧法完成. 水样过滤后准确量取9 mL于微波消解管中,加入1 mL硝酸后充分混合,使用微波消解仪(CEM Microwave,英国)进行消解,沉积物和鱼中重金属则使用硝酸-氢氟酸体系在微波消解仪内进行. 消解完成后溶液定容并过滤,待上机测定. 所有样品中As含量由电感耦合等离子体质谱(ICP-MS,美国)测定. 每批消解样品设置3个空白对照,及两个技术平行,样品间平行重复的偏差控制在10%以内. 同时,使用标准物质大虾GBW10050和黄棕壤GBW07403进行校准验证,样品回收率均在91.7%—108.1%之间,符合要求.
-
数据基本分析(均值,标准差,标准误等)采用Excel 2010 (Microsoft,美国). 样品间显著性分析采用SPSS V 20.0完成(IBM,美国),其中单因素方差分析(one-way analysis of variance,one-way ANOVA)比较数据在0.05水平上的显著性,显著性检验的方法使用Tukey HSD检验. 其他数据绘图均由Origin Pro 8.5 (OriginLab,美国) 完成. 微生物数据分析主要基于R(version 3.4.3)绘制,如R中工具包vegan 2.3-1进行主坐标分析,Adonis test算法显示样品间细菌群落的差异.
-
本次实验沉积物,水体与鱼组织的理化性质如表1所示. 本实验的沉积物pH均值在7.84左右,呈弱碱性,且在各个处理组之间不存在显著差异(P > 0.05). 对照处理组的水体pH(9.19)显著低于C-F处理组内水体pH(10.1;P < 0.05). 同时,As处理组内水体pH为9.31,也显著低于As-F处理组内水体pH(10.2;P < 0.05). 此外,砷的加入使沉积物、水体和鱼组织内的砷含量显著升高,如As-F处理组内鱼体内砷含量(0.34 mg·kg−1)是C-F处理组鱼体内砷含量(0.19 mg·kg−1)的1.8倍(P < 0.05). 同时加砷后,水体砷浓度(2.22 μg·kg−1)显著提升到30.3 μg·kg−1(P < 0.05),其浓度也高于我国包装饮用水砷限量(10 μg·kg−1,GB 2762—2022).
本实验中砷的添加显著增加了水体、沉积物及鱼组织内砷的含量,在陆地或水体生态系统已有大量相关报道,且与本研究结果一致[23 − 25]. 进入水体的砷,通过自然沉降、生物化学吸附等反应,形态发生转化,并不断蓄积在水体底部即沉积物中,鱼等生物体则通过接触、取食等途径,不断富集砷等污染物. 特别是本研究周期仅28 d,鱼组织内富集砷的浓度提高了近一倍. 值得注意的是,虽然少量的砷污染对鱼群体无直接毒害作用,但对其微生物影响不容忽视. 同时,鱼是水体生态系统中食物链的重要组成部分,可通过食用等途径,对人体产生潜在危害,因此仍值得长期关注.
-
通过对沉积物、水体和鱼等样品进行高通量测序,一共获得950276条高质量序列. 样本序列数值范围从45232条到67135条不等,每个样品的平均序列数为58638. 此外,根据序列97%的相似度进行判定后,共得到17437个OTUs,其中沉积物、水体和鱼细菌群落之间大约有11.9%的共享OTUs. 同时,发现沉积物、水体和鱼组织样品的细菌群落之间基于Bray-Curtis距离算法的主坐标分析显示,沉积物、水体和鱼等3种类型细菌群落沿着第一坐标轴和第二坐标轴彼此之间互相分离(Adonis test,P = 0.001;图1a),且第一和第二轴分别能够解释30.8%和19.8%的变异量. 另外,通过计算样品细菌的Shannon多样性可知,沉积物细菌多样性显著高于水体和鱼细菌多样性(P < 0.001;图1b),而水体和鱼样品之间的Shannon多样性指数差异不大(P = 0.2).
沉积物、水体、鱼三者之间的细菌群落显著不同,这与三者自身组成及周围所处环境不同有关. 鱼从周围水体或沉积物环境中取食,其肠道特殊生境会对微生物进行筛选同化,使得鱼体内细菌多样性低于周围环境,类似的现象在陆地生态系统蚯蚓肠道也有发现[26 − 27]. 本研究模拟水体为城市自来水,城市管道水体经过混凝工艺、杀菌等处理,水体微生物多样性较低,且水体生物量较少,进一步抑制了水体细菌的生长. 而沉积物来源湖泊,富含有机质,且生物多样性较高. 这可能是沉积物细菌多样性高于水体的主要原因,类似的结果也出现在自然水体报道中[28 − 29].
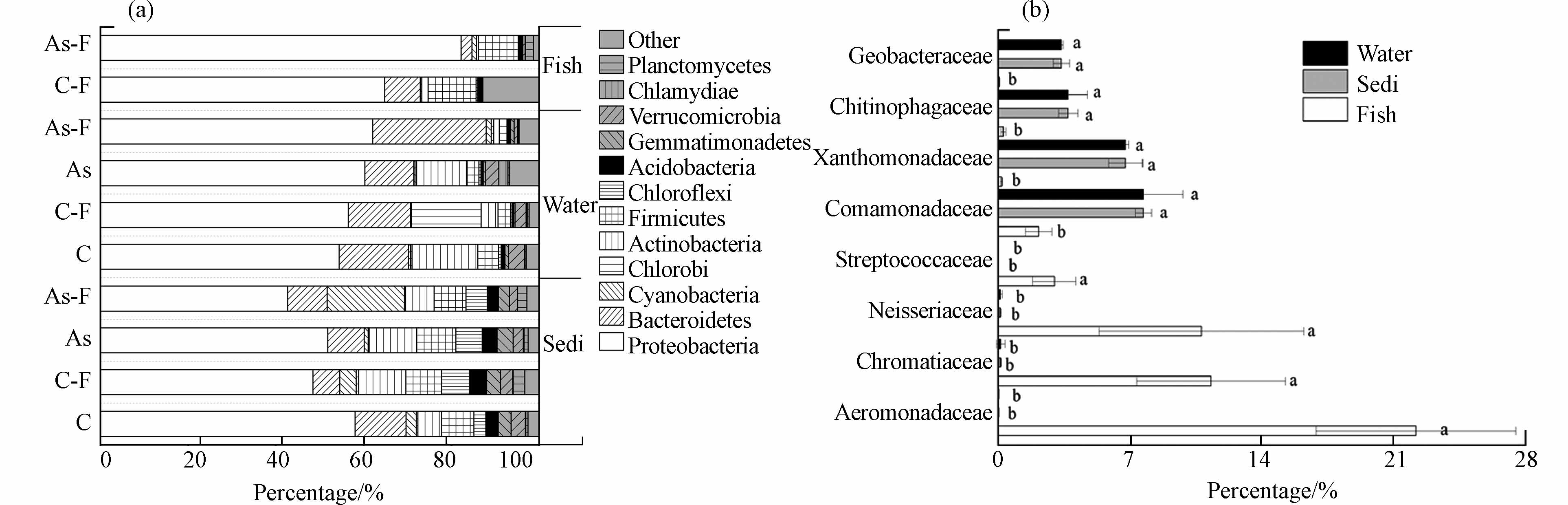
从细菌群落的组成来看,沉积物和水体的细菌群落在门水平(phylum)上相似,优势菌群均为变形菌门(Proteobacteria,占比分别为50.2%和58.3%)、拟杆菌门(Bacteroidetes,分别为8.75%和16.7%)和放线菌门(Actinobacteria,分别为8.37%和7.90%). 鱼中的优势菌群主要是变形菌门(Proteobacteria,73.1%)、厚壁菌门(Firmicutes,9.94%)和拟杆菌门 (Bacteroidetes, 5.26%;图2a). 其中,沉积物和水体放线菌门的相对丰度接近,全部显著高于鱼组织内该菌丰度(0.93%;ANOVA,P < 0.01). 厚壁菌门的相对丰度在沉积物(7.90%)和鱼(9.94%)中差异不大,其丰度分别是水体中该菌丰度的2.6倍和3.3倍 (P < 0.01). 另外,在科(family)水平上沉积物、水体和鱼组织中存在一些显著性差异的细菌群落(图2b). 鱼中丰度最高的是气单胞菌科(Aeromonadaceae,22.2%),且鱼类丰度均显著高于沉积物和水体中该细菌丰度(分别为0.03%和0.04%;P < 0.01). 此类细菌属革兰氏阴性菌,生长在厌氧环境,气单胞菌可以分泌蛋白酶、淀粉酶、纤维素酶,有助于鱼对营养物质的消化吸收[30 − 31]. 鱼中着色菌科(Chromatiaceae,11.3%)丰度也显著高于沉积物和水体中对应细菌丰度(分别为0.12%和0.13%;P < 0.01). 丛毛单胞菌科(Comamonadaceae)在沉积物和水体内的丰度最高,均为7.70%,丰度是鱼内细菌丰度的3.6倍(P < 0.01).
沉积物、水体和鱼细菌群落之间大约有11.9%的共享OTUs,这说明三者生境之间存在一定联系. 在湖泊生态系统中,水体和沉积物可通过直接接触或经进食进入鱼体内,鱼肠道独特生境对其进入细菌进行一系列选择适应过程,最终附着在鱼的排泄物中,细菌再次进入水体和沉积物中,从而形成一个微生境物质循环系统[32 − 33]. 总的来说, 沉积物、水体、鱼三者间存在一定差异,但它们通过物质和细菌转化建立起密切关系,共同维持湖泊生态系统的生物多样性.
-
砷和鱼活动可以影响水体和沉积物中细菌群落的多样性,如鱼活动能显著增加沉积物细菌群落的物种丰富度指数(Observed OUT;P < 0.05;图3a),同样也增加了沉积物细菌群落的Chao1指数(图3b). 但在砷和鱼交互活动的作用下,沉积物细菌群落多样性无显著变化(P > 0.05;图3a、3b). 另一方面,鱼或砷单独作用下对水体细菌多样性影响不大,而鱼和砷交互作用可显著降低其群落多样性(P < 0.05;图3a、3b). 此外,通过对水体和沉积物中细菌群落结构的PCoA分析,发现As处理和对照下水体细菌群落聚在一起,差异不大. 而鱼活动的介入使得水体细菌沿第一坐标轴显著分离(Adonis test,P = 0.001;图3c),该坐标轴解释了53.1%的变量. 同样的,砷的加入未能显著改变沉积物细菌群落结构,而鱼活动使得沉积物中细菌群落沿PCo1轴显著分离(P = 0.003;图3d),此坐标轴解释了32.9%的变异量.
沉积物中细菌多样性的增高可能与鱼类活动有关,如鱼类觅食活动会引起表层沉积物的再悬浮与营养盐类释放,从而提高沉积物整体养分生产力[34]. 同时鱼类排泄、游弋活动加速水体与表层沉积物之间的物质交换,改变水体和沉积物的理化性质,从而影响细菌群落结构与组成. 这也与国内外水库中鱼类活动的结果类似[35 − 36]. 而砷和鱼联合作用显著降低水体细菌多样性,砷作为有毒类金属元素,对水体细菌直接产生选择压力,降低细菌代谢等活动[37]. 同时鱼类活动直接取食水体细菌,降低其营养成分,这些可能是水体生物多样性降低的主要因素.
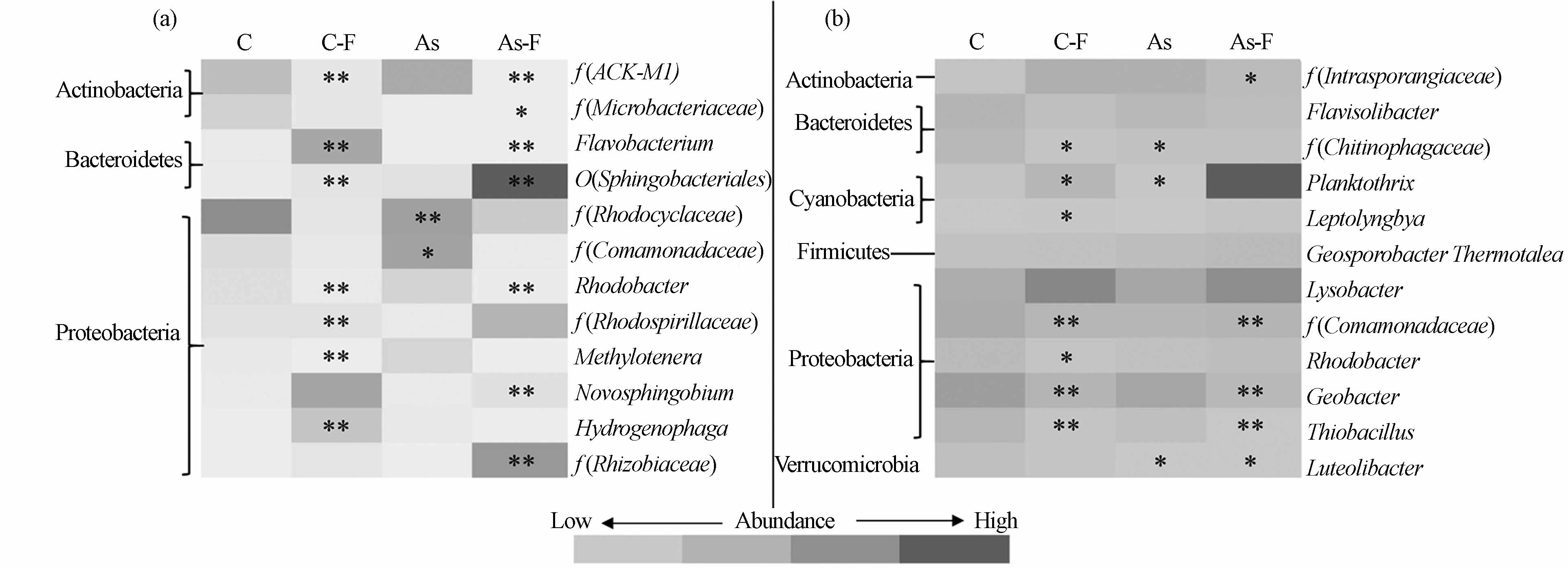
砷的添加和鱼的活动均能引起水体和沉积物中细菌组成的变化(图4). 与对照相比,鱼活动使水体中黄杆菌属(Flavobacterium)和噬氢菌属(hydrogenophaga)的丰度显著增加(P < 0.05;图4a).
砷和鱼的共同作用下,水体中黄杆菌属和红杆菌属(Rhodobacter)的丰度分别显著降低到0.16%和0.54%(P < 0.05). 在沉积物细菌群落组成中,砷和鱼活动对黄色土源菌(Flavisolibacter)和溶杆菌属(Lysobacter)影响较小,其丰度均无明显变化(P > 0.05;图4b). 鱼活动使得沉积物中浮丝藻属(Planktothrix)的丰度显著增高到2.08%,但砷的加入则显著降低该菌的丰度(0.41%,P < 0.05). 砷和鱼活动的共同介入使得地杆菌属(Geobacter)和硫杆菌属(Thiobacillus)的丰度较对照显著增加(P < 0.05).
鱼类活动对水体和沉积物中细菌群落差异性和组成的影响大于砷含量变化所产生的影响. 可能的因素如下,首先低浓度砷污染对周围环境细菌的抑制作用不明显,有报道称低浓度砷甚至能促进土壤微生物多样性的增高[38]. 已有研究报道,浓度高达74 mg·kg−1污染的砷对水环境下土壤细菌多样性影响不大,且作用显著低于pH[39]. 这些研究表明,低浓度砷对水体及沉积物细菌群落施加选择性压力较小,即对其细菌多样性影响有限. 其次,鱼类在活动过程中通过进食、排泄等活动影响周围环境,这在上文中已得到证实. 当然本研究所选收纳盒较小,鱼类活动范围有限,可能存在进一步夸大鱼类活动影响力的结果,需要在后续研究进一步验证.
-
(1)模拟湖泊生态系统中,沉积物、水体、鱼组织细菌群落存在显著差异,且沉积物细菌多样性显著高于水体和鱼组织. 沉积物和水体优势菌群为变形菌门、拟杆菌门和放线菌门.
(2)砷和鱼活动显著改变水体和沉积物细菌群落组成,同时可显著降低沉积物细菌多样性,这可为开展基于生物和化学联合扰动下湖泊水生态系统响应工作提供科学参考.
鱼和砷对湖泊水体和沉积物细菌群落的影响
Effects of fish and arsenic on bacterial communities in lake water and sediment
-
摘要: 湖泊是水体生物多样性的一个重要存储库,湖泊砷污染问题在全球范围内被广泛关注,然而鱼扰动和砷污染的联合作用对水体和沉积物微生物影响研究却很少报道. 鉴于此,本研究通过室内模拟湖泊生态系统,并采用高通量测序技术以探究鱼类活动和砷污染下湖泊水体和沉积物细菌群落的响应机制. 研究结果表明,沉积物细菌多样性显著高于水体和鱼组织中细菌多样性. 鱼和砷均能引起水体和沉积物细菌群落的改变,鱼和砷的共同作用可使沉积物细菌多样性显著降低,同时可导致水体中黄杆菌属(Flavobacterium)和红杆菌属(Rhodobacter)的含量显著降低. 这些结果有利于深入了解湖泊水体和沉积物细菌群落,为开展污染物和生物扰动联合作用下的生态风险研究提供科学依据.Abstract: Lake ecosystems are thought as an important reservoir of aquatic biodiversity, lake arsenic contamination is a growing concern for global safety and health. However, the combined effect of arsenic and fish disturbance on microbial communities in water and sediments are rarely reported. Herein, a microcosm experiment was used to explore the alteration of bacterial communities of lake water and sediment under fish activity and/or arsenic using Illumina sequencing analysis. The results showed that bacterial diversity in sediments was significantly higher than that in water and fish. Both fish and arsenic could cause changes in bacterial communities in water and sediments. In addition, co-exposure to arsenic and fish decreased significantly the bacterial diversity in sediments, also reduce observably the relative abundance of Flavobacterium and Rhodobacter in water. Our findings broaden the current scientific knowledge of the microbial communities in lake and sediment ecosystems, and provide scientific basis for ecological risk study under the combined effects of pollutants and biological disturbance.
-
Key words:
- lake /
- sediment /
- fish disturbance /
- arsenic pollution /
- bacterial diversity.
-
湖泊是水生生态系统的重要组成部分,也是重要的生物多样性储存库[1]. 研究发现,湖泊在调节河川径流,繁衍水生生物和改善区域生态环境等方面发挥着重要作用[2 − 4]. 事实上,湖泊的许多生态功能都是由水生生物(包括植物和鱼类)、沉积物及其微生物协助完成的. 微生物影响水中有机质分解和养分循环,促进植物生长[5]. 水体和沉积物中的微生物群落对污水中的氮磷硫的去除有着直接影响[6]. 同时,微生物对水体污染物响应敏感,在水体质量和污染检测中常作为指示指标[7 − 8]. 随着湖泊富营养化和水体污染问题的日益严重,污染物对水体和沉积物微生物群落影响及其生态功能危害受到学者的广泛关注[9 − 11].
砷是环境中广泛存在的天然有毒类金属元素. 进入工业时代以来,由于金属冶炼、化石燃烧等工业活动,以及农业中使用含砷农药,大量含砷化合物排放到环境中,最终造成湖泊水体中砷污染问题[12]. 进入水体中的砷不断累积,并引起水体和沉积物微生物群落结构和生态功能的紊乱,从而威胁湖泊水体健康[13 − 14]. 同时,砷由水体进入动植物体内,通过食物链富集传递进入人体,对人类健康构成危害[15]. 目前,湖泊等水体砷污染问题已经得到了全球范围内的大量报道[16 − 17]. 鱼类是湖泊系统中的重要生物资源,鱼类活动能够影响湖泊生物群落结构、营养物质的构成等[18 − 19]. 然而,关于鱼类扰动对湖泊水体和沉积物中微生物的影响却极少报道. 因此,认识砷污染和鱼类活动对湖泊水体和沉积物微生物的影响,对全面理解湖泊生态系统中砷的毒性效应和生态风险具有重要意义.
鉴于此,本研究通过室内模拟湖泊生态系统,通过高通量测序技术探究鱼类活动和砷污染下湖泊水体和沉积物细菌群落的响应机制. 这将有助于提升人们对湖泊水体和沉积物细菌群落的认识,也有助于了解鱼类活动和污染物共同作用下对水生生态系统的潜在影响.
1. 材料与方法(Materials and methods)
1.1 试验材料
将采自当地湖泊的沉积物带回实验室,置于阴凉通风处风干后,捡出砾石、落叶和垃圾等杂物,研磨后过2 mm筛,备用. 供试鱼类为湖泊常见的麦穗鱼(Pseudorasbora parva),购自本地养殖场,实验所用鱼饲料购自本地水族市场. 实验前,选择相似长度和体重的鱼若干条,将其放入实验室采集的去离子水中进行两周的本地驯化. 本次实验选用十二水砷酸钠(Na3AsO4·12H2O)作为砷污染源,其他试剂若无特殊说明,均为分析级纯度,购自国药控股化学试剂有限公司.
1.2 实验设计
本研究共设置4个处理组,分别为仅有沉积物的对照组(C),添加了鱼的处理组(C-F),添加了砷的处理组(As),添加了鱼和砷的复合处理组(As-F). 具体为,实验所用水体为城市自来水,静置1—2 d后,备用. 添加10 L水样到聚乙烯塑料收纳盒中(长×宽×高,40 cm × 30 cm × 30 cm),在底层均匀铺满5 cm厚度的沉积物,取适量的含砷试剂充分溶于水中,然后将溶液倒入贴有标签As和As-F的实验组中,用玻璃棒缓慢搅动,使其均匀分布在水体中,放在实验室避光处老化14 d. 在C-F和As-F的实验组中各加入10条长度体重相似的鱼. 每个处理组设3个重复,最后共有12个实验培养盒. 培养条件设置为:14 h光照,10 h黑暗,温度控制在(24 ± 2)℃,每3—5 d对鱼进行1次定点喂食. 实验期间,定期向收纳盒中加入超纯水,保证水量为10 L.
1.3 实验分析方法
1.3.1 样品提取
试验28 d后,采集水体、沉积物和鱼组织样品. 使用无菌手套将鱼从水体中捞出,放入装有无水乙醇的离心管中杀死封存,在无菌超纯水漂洗5次,从而去除鱼体表层微生物对实验结果的影响。在无菌操作台上用无菌镊子和无菌剪刀对鱼进行解剖,提取组织物. 所有水样用0.22 μm滤膜进行过滤,滤膜剪碎后使用土壤试剂盒FastDNA®Spin Kit(MP Biomedical, California, USA),依照其提供的操作流程提取水体微生物DNA. 称取沉积物0.5 g左右,使用与水体相同的土壤试剂盒提取沉积物微生物DNA. 鱼组织使用组织试剂盒DNeasy Blood and Tissue Kit(QIAGEN, 中国)提取其微生物DNA. 随后紫外分光光度计ND-1000(Nano-Drop,美国)测样品DNA浓度,最后将DNA样品储存于-20 ℃冰箱,备用.
1.3.2 细菌16S rRNA基因扩增和生物信息分析
本研究使用Illumina Hiseq 2500 平台高通量测序技术进行分析,扩增细菌16S rRNA基因的V4区(上下游引物分别为515F: 5′-GTGCCAGCMGCCGCGGTAA-3′,806R: 5′-GGACTACHVGGGTWTCTAAT-3′),下游引物加上barcode用来区别不同样品. PCR扩增反应体系及其加热循环条件参照文献[20]. PCR产物经纯化回收、浓度测定并混库,送测序公司(诺禾,中国)进行测序. 测序原始序列使用Quantitative Insights Into Microbial Ecology (QIIME)进行分析[21]. 首先去除所有barcode、低质量及模糊序列,得到高质量目标区域序列,在97%的相似度水平上完成操作分类单元(Operational Taxonomic Units, OTU)[22]. 细菌Alpha多样性通过OUT、Chao1指数和 Shannon多样性指数表示每个样品内在多样性. Beta多样性采用基于Bray−Curtis距离的主坐标轴法分析. 测序数据已上传到美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)(SRP111095).
1.3.3 样品理化分析
水体和沉积物pH值采用pH仪(Fisher Scientific,美国)进行测定. 沉积物总氮(TN)和总碳(TC)使用C/N分析仪(Vario MAX C/N,德国)燃烧法完成. 水样过滤后准确量取9 mL于微波消解管中,加入1 mL硝酸后充分混合,使用微波消解仪(CEM Microwave,英国)进行消解,沉积物和鱼中重金属则使用硝酸-氢氟酸体系在微波消解仪内进行. 消解完成后溶液定容并过滤,待上机测定. 所有样品中As含量由电感耦合等离子体质谱(ICP-MS,美国)测定. 每批消解样品设置3个空白对照,及两个技术平行,样品间平行重复的偏差控制在10%以内. 同时,使用标准物质大虾GBW10050和黄棕壤GBW07403进行校准验证,样品回收率均在91.7%—108.1%之间,符合要求.
1.4 数据处理
数据基本分析(均值,标准差,标准误等)采用Excel 2010 (Microsoft,美国). 样品间显著性分析采用SPSS V 20.0完成(IBM,美国),其中单因素方差分析(one-way analysis of variance,one-way ANOVA)比较数据在0.05水平上的显著性,显著性检验的方法使用Tukey HSD检验. 其他数据绘图均由Origin Pro 8.5 (OriginLab,美国) 完成. 微生物数据分析主要基于R(version 3.4.3)绘制,如R中工具包vegan 2.3-1进行主坐标分析,Adonis test算法显示样品间细菌群落的差异.
2. 结果与讨论 (Results and Discussion)
2.1 砷在沉积物、水体和鱼组织内的浓度分布特征
本次实验沉积物,水体与鱼组织的理化性质如表1所示. 本实验的沉积物pH均值在7.84左右,呈弱碱性,且在各个处理组之间不存在显著差异(P > 0.05). 对照处理组的水体pH(9.19)显著低于C-F处理组内水体pH(10.1;P < 0.05). 同时,As处理组内水体pH为9.31,也显著低于As-F处理组内水体pH(10.2;P < 0.05). 此外,砷的加入使沉积物、水体和鱼组织内的砷含量显著升高,如As-F处理组内鱼体内砷含量(0.34 mg·kg−1)是C-F处理组鱼体内砷含量(0.19 mg·kg−1)的1.8倍(P < 0.05). 同时加砷后,水体砷浓度(2.22 μg·kg−1)显著提升到30.3 μg·kg−1(P < 0.05),其浓度也高于我国包装饮用水砷限量(10 μg·kg−1,GB 2762—2022).
表 1 本实验体系的基本理化性质Table 1. The basic physicochemical properties in this experimental system体系Systems 指标Index C C-F As As-F 沉积物 pHN/%C/%As/ (mg·kg−1) 7.85 ± 0.0 a 7.87 ± 0.0 a 7.78 ± 0.0 a 7.86 ± 0.0 a 0.12 ± 0.1 a 0.13 ± 0.0 a 0.13 ± 0.01 a 0.13 ± 0.0 a 1.58 ± 0.0 a 1.56 ± 0.0 a 1.59 ± 0.0 a 1.60 ± 0.1 a 12.5 ± 0.2 b 12.6 ± 0.1 b 18.0 ± 0.2 a 17.5 ± 0.5 a 水体 pHAs/(μg·kg−1) 9.19 ± 0.0 b 10.1 ± 0.0 a 9.31 ± 0.1 b 10.2 ± 0.1 a 2.16 ± 0.1 b 2.27 ± 0.1 b 31.1 ± 1.2 a 29.6 ± 0.5 a 鱼 As/(mg·kg−1) — 0.19 ± 0.02 b — 0.34 ± 0.02 a 注:C表示空白对照组;C-F表示添加鱼的无污染组;As表示添加砷的无鱼处理组;As-F表示添加砷和鱼的处理组. 所有数据均以“均值 ± 标准差”表示,不同字母(ab)表示数据在四个处理间在0.05水平上存在显著差异. “—”表示无数据. Note: C represents the control treatment; C-F represents the control group with fish added; As represents the fish-free treatment with arsenic added; As-F represents the treatment with arsenic and fish added. All data are presented as “mean ± standard deviation”, and different letters (ab) indicate significant differences at the 0.05 level among the four treatments. “—” indicates no data. 本实验中砷的添加显著增加了水体、沉积物及鱼组织内砷的含量,在陆地或水体生态系统已有大量相关报道,且与本研究结果一致[23 − 25]. 进入水体的砷,通过自然沉降、生物化学吸附等反应,形态发生转化,并不断蓄积在水体底部即沉积物中,鱼等生物体则通过接触、取食等途径,不断富集砷等污染物. 特别是本研究周期仅28 d,鱼组织内富集砷的浓度提高了近一倍. 值得注意的是,虽然少量的砷污染对鱼群体无直接毒害作用,但对其微生物影响不容忽视. 同时,鱼是水体生态系统中食物链的重要组成部分,可通过食用等途径,对人体产生潜在危害,因此仍值得长期关注.
2.2 沉积物、水体和鱼细菌群落间的差异比较
通过对沉积物、水体和鱼等样品进行高通量测序,一共获得950276条高质量序列. 样本序列数值范围从45232条到67135条不等,每个样品的平均序列数为58638. 此外,根据序列97%的相似度进行判定后,共得到17437个OTUs,其中沉积物、水体和鱼细菌群落之间大约有11.9%的共享OTUs. 同时,发现沉积物、水体和鱼组织样品的细菌群落之间基于Bray-Curtis距离算法的主坐标分析显示,沉积物、水体和鱼等3种类型细菌群落沿着第一坐标轴和第二坐标轴彼此之间互相分离(Adonis test,P = 0.001;图1a),且第一和第二轴分别能够解释30.8%和19.8%的变异量. 另外,通过计算样品细菌的Shannon多样性可知,沉积物细菌多样性显著高于水体和鱼细菌多样性(P < 0.001;图1b),而水体和鱼样品之间的Shannon多样性指数差异不大(P = 0.2).
沉积物、水体、鱼三者之间的细菌群落显著不同,这与三者自身组成及周围所处环境不同有关. 鱼从周围水体或沉积物环境中取食,其肠道特殊生境会对微生物进行筛选同化,使得鱼体内细菌多样性低于周围环境,类似的现象在陆地生态系统蚯蚓肠道也有发现[26 − 27]. 本研究模拟水体为城市自来水,城市管道水体经过混凝工艺、杀菌等处理,水体微生物多样性较低,且水体生物量较少,进一步抑制了水体细菌的生长. 而沉积物来源湖泊,富含有机质,且生物多样性较高. 这可能是沉积物细菌多样性高于水体的主要原因,类似的结果也出现在自然水体报道中[28 − 29].
从细菌群落的组成来看,沉积物和水体的细菌群落在门水平(phylum)上相似,优势菌群均为变形菌门(Proteobacteria,占比分别为50.2%和58.3%)、拟杆菌门(Bacteroidetes,分别为8.75%和16.7%)和放线菌门(Actinobacteria,分别为8.37%和7.90%). 鱼中的优势菌群主要是变形菌门(Proteobacteria,73.1%)、厚壁菌门(Firmicutes,9.94%)和拟杆菌门 (Bacteroidetes, 5.26%;图2a). 其中,沉积物和水体放线菌门的相对丰度接近,全部显著高于鱼组织内该菌丰度(0.93%;ANOVA,P < 0.01). 厚壁菌门的相对丰度在沉积物(7.90%)和鱼(9.94%)中差异不大,其丰度分别是水体中该菌丰度的2.6倍和3.3倍 (P < 0.01). 另外,在科(family)水平上沉积物、水体和鱼组织中存在一些显著性差异的细菌群落(图2b). 鱼中丰度最高的是气单胞菌科(Aeromonadaceae,22.2%),且鱼类丰度均显著高于沉积物和水体中该细菌丰度(分别为0.03%和0.04%;P < 0.01). 此类细菌属革兰氏阴性菌,生长在厌氧环境,气单胞菌可以分泌蛋白酶、淀粉酶、纤维素酶,有助于鱼对营养物质的消化吸收[30 − 31]. 鱼中着色菌科(Chromatiaceae,11.3%)丰度也显著高于沉积物和水体中对应细菌丰度(分别为0.12%和0.13%;P < 0.01). 丛毛单胞菌科(Comamonadaceae)在沉积物和水体内的丰度最高,均为7.70%,丰度是鱼内细菌丰度的3.6倍(P < 0.01).
沉积物、水体和鱼细菌群落之间大约有11.9%的共享OTUs,这说明三者生境之间存在一定联系. 在湖泊生态系统中,水体和沉积物可通过直接接触或经进食进入鱼体内,鱼肠道独特生境对其进入细菌进行一系列选择适应过程,最终附着在鱼的排泄物中,细菌再次进入水体和沉积物中,从而形成一个微生境物质循环系统[32 − 33]. 总的来说, 沉积物、水体、鱼三者间存在一定差异,但它们通过物质和细菌转化建立起密切关系,共同维持湖泊生态系统的生物多样性.
2.3 砷和鱼活动对水体和沉积物细菌菌群的影响
砷和鱼活动可以影响水体和沉积物中细菌群落的多样性,如鱼活动能显著增加沉积物细菌群落的物种丰富度指数(Observed OUT;P < 0.05;图3a),同样也增加了沉积物细菌群落的Chao1指数(图3b). 但在砷和鱼交互活动的作用下,沉积物细菌群落多样性无显著变化(P > 0.05;图3a、3b). 另一方面,鱼或砷单独作用下对水体细菌多样性影响不大,而鱼和砷交互作用可显著降低其群落多样性(P < 0.05;图3a、3b). 此外,通过对水体和沉积物中细菌群落结构的PCoA分析,发现As处理和对照下水体细菌群落聚在一起,差异不大. 而鱼活动的介入使得水体细菌沿第一坐标轴显著分离(Adonis test,P = 0.001;图3c),该坐标轴解释了53.1%的变量. 同样的,砷的加入未能显著改变沉积物细菌群落结构,而鱼活动使得沉积物中细菌群落沿PCo1轴显著分离(P = 0.003;图3d),此坐标轴解释了32.9%的变异量.
沉积物中细菌多样性的增高可能与鱼类活动有关,如鱼类觅食活动会引起表层沉积物的再悬浮与营养盐类释放,从而提高沉积物整体养分生产力[34]. 同时鱼类排泄、游弋活动加速水体与表层沉积物之间的物质交换,改变水体和沉积物的理化性质,从而影响细菌群落结构与组成. 这也与国内外水库中鱼类活动的结果类似[35 − 36]. 而砷和鱼联合作用显著降低水体细菌多样性,砷作为有毒类金属元素,对水体细菌直接产生选择压力,降低细菌代谢等活动[37]. 同时鱼类活动直接取食水体细菌,降低其营养成分,这些可能是水体生物多样性降低的主要因素.
砷的添加和鱼的活动均能引起水体和沉积物中细菌组成的变化(图4). 与对照相比,鱼活动使水体中黄杆菌属(Flavobacterium)和噬氢菌属(hydrogenophaga)的丰度显著增加(P < 0.05;图4a).
砷和鱼的共同作用下,水体中黄杆菌属和红杆菌属(Rhodobacter)的丰度分别显著降低到0.16%和0.54%(P < 0.05). 在沉积物细菌群落组成中,砷和鱼活动对黄色土源菌(Flavisolibacter)和溶杆菌属(Lysobacter)影响较小,其丰度均无明显变化(P > 0.05;图4b). 鱼活动使得沉积物中浮丝藻属(Planktothrix)的丰度显著增高到2.08%,但砷的加入则显著降低该菌的丰度(0.41%,P < 0.05). 砷和鱼活动的共同介入使得地杆菌属(Geobacter)和硫杆菌属(Thiobacillus)的丰度较对照显著增加(P < 0.05).
鱼类活动对水体和沉积物中细菌群落差异性和组成的影响大于砷含量变化所产生的影响. 可能的因素如下,首先低浓度砷污染对周围环境细菌的抑制作用不明显,有报道称低浓度砷甚至能促进土壤微生物多样性的增高[38]. 已有研究报道,浓度高达74 mg·kg−1污染的砷对水环境下土壤细菌多样性影响不大,且作用显著低于pH[39]. 这些研究表明,低浓度砷对水体及沉积物细菌群落施加选择性压力较小,即对其细菌多样性影响有限. 其次,鱼类在活动过程中通过进食、排泄等活动影响周围环境,这在上文中已得到证实. 当然本研究所选收纳盒较小,鱼类活动范围有限,可能存在进一步夸大鱼类活动影响力的结果,需要在后续研究进一步验证.
3. 结论(Conclusion)
(1)模拟湖泊生态系统中,沉积物、水体、鱼组织细菌群落存在显著差异,且沉积物细菌多样性显著高于水体和鱼组织. 沉积物和水体优势菌群为变形菌门、拟杆菌门和放线菌门.
(2)砷和鱼活动显著改变水体和沉积物细菌群落组成,同时可显著降低沉积物细菌多样性,这可为开展基于生物和化学联合扰动下湖泊水生态系统响应工作提供科学参考.
-
表 1 本实验体系的基本理化性质
Table 1. The basic physicochemical properties in this experimental system
体系Systems 指标Index C C-F As As-F 沉积物 pHN/%C/%As/ (mg·kg−1) 7.85 ± 0.0 a 7.87 ± 0.0 a 7.78 ± 0.0 a 7.86 ± 0.0 a 0.12 ± 0.1 a 0.13 ± 0.0 a 0.13 ± 0.01 a 0.13 ± 0.0 a 1.58 ± 0.0 a 1.56 ± 0.0 a 1.59 ± 0.0 a 1.60 ± 0.1 a 12.5 ± 0.2 b 12.6 ± 0.1 b 18.0 ± 0.2 a 17.5 ± 0.5 a 水体 pHAs/(μg·kg−1) 9.19 ± 0.0 b 10.1 ± 0.0 a 9.31 ± 0.1 b 10.2 ± 0.1 a 2.16 ± 0.1 b 2.27 ± 0.1 b 31.1 ± 1.2 a 29.6 ± 0.5 a 鱼 As/(mg·kg−1) — 0.19 ± 0.02 b — 0.34 ± 0.02 a 注:C表示空白对照组;C-F表示添加鱼的无污染组;As表示添加砷的无鱼处理组;As-F表示添加砷和鱼的处理组. 所有数据均以“均值 ± 标准差”表示,不同字母(ab)表示数据在四个处理间在0.05水平上存在显著差异. “—”表示无数据. Note: C represents the control treatment; C-F represents the control group with fish added; As represents the fish-free treatment with arsenic added; As-F represents the treatment with arsenic and fish added. All data are presented as “mean ± standard deviation”, and different letters (ab) indicate significant differences at the 0.05 level among the four treatments. “—” indicates no data. -
[1] 张锋, 李自珍, 惠苍. 中国湿地物种多样性与生境面积关系及其生态学机理的模拟研究[J]. 西北植物学报, 2004, 24(3): 392-396. ZHANG F, LI Z Z, HUI C. Species-area relationship of Chinese wetlands and its theoretical simulation[J]. Acta Botanica Boreali-Occidentalia Sinica, 2004, 24(3): 392-396 (in Chinese).
[2] FILSTRUP C T, KING K B S, MCCULLOUGH I M. Evenness effects mask richness effects on ecosystem functioning at macro-scales in lakes[J]. Ecology Letters, 2019, 22(12): 2120-2129. doi: 10.1111/ele.13407 [3] 罗桂林, 田林锋. 基于WQI法的宁夏湖泊藻类爆发过程水环境质量变化及溯源探究[J]. 环境化学, 2021, 40((7): ): 2073-2082. doi: 10.7524/j.issn.0254-6108.2020100301 LUO G L, TIAN L F. Study on water environmental quality change and source tracing of algae bloom in lakes of Ningxia based on WQI method[J]. Environmental Chemistry, 2021, 40((7): ): 2073-2082 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020100301
[4] QIN B Q, ZHANG Y L, DENG J M, et al. Polluted lake restoration to promote sustainability in the Yangtze River Basin, China[J]. National Science Review, 2022, 9(1): nwab207. doi: 10.1093/nsr/nwab207 [5] 郑焕春, 周青. 微生物在富营养化水体生物修复中的作用[J]. 中国生态农业学报, 2009, 17(1): 197-202. doi: 10.3724/SP.J.1011.2009.00197 ZHENG H C, ZHOU Q. Function of microorganism in bioremediation of eutrophic water[J]. Chinese Journal of Eco-Agriculture, 2009, 17(1): 197-202 (in Chinese). doi: 10.3724/SP.J.1011.2009.00197
[6] 于小彦, 张平究, 张经纬, 等. 城市河流沉积物微生物量分布和群落结构特征[J]. 环境科学学报, 2020, 40(2): 585-596. YU X Y, ZHANG P J, ZHANG J W, et al. Characteristics of distribution patterns of microbial biomass and community structures in the sediments from urban river[J]. Acta Scientiae Circumstantiae, 2020, 40(2): 585-596 (in Chinese).
[7] 范廷玉, 赵一凡, 王兴明, 等. 芜湖城市内河水体微生物群落结构特征及其影响因素[J]. 环境化学, 2022, 41(4): 1380-1391. doi: 10.7524/j.issn.0254-6108.2021090201 FAN T Y, ZHAO Y F, WANG X M, et al. Microbial community structure and its influencing factors in urban river water in Wuhu[J]. Environmental Chemistry, 2022, 41(4): 1380-1391 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021090201
[8] 王慧婷, 孙靖宇, 王洪敏. 水生生物在水质监测中的应用研究[J]. 环境与发展, 2018, 30(4): 185-186. WANG H T, SUN J Y, WANG H M. Application of aquatic organisms in water quality monitoring[J]. Environment and Development, 2018, 30(4): 185-186 (in Chinese).
[9] MO Y Y, PENG F, GAO X F, et al. Low shifts in salinity determined assembly processes and network stability of microeukaryotic plankton communities in a subtropical urban reservoir[J]. Microbiome, 2021, 9(1): 128. doi: 10.1186/s40168-021-01079-w [10] 覃岚倩, 白少元, 张琴, 等. 人工湿地对抗生素复合污染的净化效果及微生物群落响应[J]. 生态学杂志, 2021, 40(2): 525-533. QIN L Q, BAI S Y, ZHANG Q, et al. Purification effect of constructed wetland on antibiotic compound pollution and the microbial community response[J]. Chinese Journal of Ecology, 2021, 40(2): 525-533 (in Chinese).
[11] 吴玲, 秦红益, 朱梦圆, 等. 太湖富营养化湖区秋季水体和沉积物中硝化微生物分布特征及控制因素[J]. 湖泊科学, 2017, 29(6): 1312-1323. doi: 10.18307/2017.0603 WU L, QIN H Y, ZHU M Y, et al. Distribution characteristics and controlling factors of nitrifying microorganisms in freshwater and sediment of eutrophic zones in Lake Taihu in autumn[J]. Journal of Lake Sciences, 2017, 29(6): 1312-1323 (in Chinese). doi: 10.18307/2017.0603
[12] 吴万富, 徐艳, 史德强, 等. 我国河流湖泊砷污染现状及除砷技术研究进展[J]. 环境科学与技术, 2015, 38(S1): 190-197. WU W F, XU Y, SHI D Q, et al. The arsenic pollution status of the rivers and lakes in China and the research progress on arsenic removal techniques[J]. Environmental Science & Technology, 2015, 38(Sup 1): 190-197 (in Chinese).
[13] 武广哲. 滆湖沉积物微生物多样性及其分布特性研究[D]. 上海: 华东理工大学, 2020. WU G Z. Study on microbial diversity and distribution characteristics of sediments in the Lake Gehu[D]. Shanghai: East China University of Science and Technology, 2020 (in Chinese).
[14] 张萍, 张菊, 邓焕广, 等. 南四湖菹草对上覆水和表层沉积物中汞和砷的富集特征[J]. 环境化学, 2022, 41(11): 3589-3598. doi: 10.7524/j.issn.0254-6108.2021071402 ZHANG P, ZHANG J, DENG H G, et al. Enrichment characteristics of mercury and arsenic by Potamogeton crispus in the overlying water and surface sediment of Nansi Lake[J]. Environmental Chemistry, 2022, 41(11): 3589-3598 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021071402
[15] 宋梦萍, 杨常亮, 张璟, 等. 食物相暴露条件下尼罗罗非鱼对砷的累积与转化[J]. 环境化学, 2022, 41(6): 1897-1904. doi: 10.7524/j.issn.0254-6108.2021113002 SONG M P, YANG C L, ZHANG J, et al. Accumulation and transformation of arsenic in Oreochromis niloticus under food phase exposure[J]. Environmental Chemistry, 2022, 41(6): 1897-1904 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021113002
[16] 包稚群, 丘克强. 关于我国砷污染现状与治理砷建议[J]. 云南冶金, 2019, 48(3): 60-64. BAO Z Q, QIU K Q. The current status and treatment suggestions of arsenic pollution in China[J]. Yunnan Metallurgy, 2019, 48(3): 60-64 (in Chinese).
[17] DENG F, ZHANG D W, YANG L T, et al. Effects of antibiotics and heavy metals on denitrification in shallow eutrophic lakes[J]. Chemosphere, 2022, 291: 132948. doi: 10.1016/j.chemosphere.2021.132948 [18] DALU T, CUTHBERT R N, MOYO S, et al. Invasive carp alter trophic niches of consumers and basal resources in African Reservoirs[J]. Science of the Total Environment, 2022, 813: 152625. doi: 10.1016/j.scitotenv.2021.152625 [19] 温超男. 鱼类生物操纵对水质影响的巢湖围隔试验[D]. 合肥: 安徽农业大学, 2020. WEN C N. Mesocosm experiment on the influence of biomanipulation on water quality in Lake Chaohu[D]. Hefei: Anhui Agricultural University, 2020 (in Chinese).
[20] ZHU D, MA J, LI G, et al. Soil plastispheres as hotpots of antibiotic resistance genes and potential pathogens[J]. The ISME Journal, 2022, 16(2): 521-532. doi: 10.1038/s41396-021-01103-9 [21] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. doi: 10.1038/nmeth.f.303 [22] COLE J R, WANG Q, CARDENAS E, et al. The Ribosomal Database Project: Improved alignments and new tools for rRNA analysis[J]. Nucleic Acids Research, 2009, 37(suppl_1): D141-D145. [23] 高俊海, 马迎群, 秦延文, 等. 大伙房水库水体及沉积物砷总量及形态分布特征[J]. 环境科学学报, 2013, 33(9): 2573-2578. GAO J H, MA Y Q, QIN Y W, et al. Speciation and distribution characteristics of arsenic in overlying water, pore water and sediments of Dahuofang Reservoir[J]. Acta Scientiae Circumstantiae, 2013, 33(9): 2573-2578 (in Chinese).
[24] YANG F, XIE S W, WEI C Y, et al. Arsenic characteristics in the terrestrial environment in the vicinity of the Shimen realgar mine, China[J]. Science of the Total Environment, 2018, 626: 77-86. doi: 10.1016/j.scitotenv.2018.01.079 [25] 李欢, 张静丽, 张诗雨, 等. 四环素和砷对斑马鱼的联合毒性及机制[J]. 中国环境科学, 2021, 41(7): 3371-3380. doi: 10.3969/j.issn.1000-6923.2021.07.042 LI H, ZHANG J L, ZHANG S Y, et al. Combined toxicity and underlying mechanism of tetracycline and arsenic on zebrafish[J]. China Environmental Science, 2021, 41(7): 3371-3380 (in Chinese). doi: 10.3969/j.issn.1000-6923.2021.07.042
[26] WANG H T, LIANG Z Z, DING J, et al. Arsenic bioaccumulation in the soil fauna alters its gut microbiome and microbial arsenic biotransformation capacity[J]. Journal of Hazardous Materials, 2021, 417: 126018. doi: 10.1016/j.jhazmat.2021.126018 [27] ZHU D, DELGADO-BAQUERIZO M, SU J Q, et al. Deciphering potential roles of earthworms in mitigation of antibiotic resistance in the soils from diverse ecosystems[J]. Environmental Science & Technology, 2021, 55(11): 7445-7455. [28] HE Q, WANG S, HOU W G, et al. Temperature and microbial interactions drive the deterministic assembly processes in sediments of hot springs[J]. Science of the Total Environment, 2021, 772: 145465. doi: 10.1016/j.scitotenv.2021.145465 [29] ZHANG L Y, DELGADO-BAQUERIZO M, SHI Y, et al. Co-existing water and sediment bacteria are driven by contrasting environmental factors across glacier-fed aquatic systems[J]. Water Research, 2021, 198: 117139. doi: 10.1016/j.watres.2021.117139 [30] 冯雪. 草鱼和银鲫肠道产消化酶细菌的研究[D]. 武汉: 华中农业大学, 2008. FENG X. Study on digestive enzyme-producing bacteria in the intestinal tract of Ctenopharyngodon idellus and Carassius auratus gibelio[D]. Wuhan: Huazhong Agricultural University, 2008 (in Chinese).
[31] KIM P S, SHIN N R, LEE J B, et al. Host habitat is the major determinant of the gut microbiome of fish[J]. Microbiome, 2021, 9(1): 166. doi: 10.1186/s40168-021-01113-x [32] BALDO L, RIERA J L, SALZBURGER W, et al. Phylogeography and ecological niche shape the cichlid fish gut microbiota in central American and African Lakes[J]. Frontiers in Microbiology, 2019, 10: 2372. doi: 10.3389/fmicb.2019.02372 [33] ZHANG X Z, YOU Y, PENG F, et al. Interaction of microbiota between fish and the environment of an In-pond raceway system in a lake[J]. Microorganisms, 2022, 10(6): 1143. doi: 10.3390/microorganisms10061143 [34] JONES S E, JAGO C F. In situ assessment of modification of sediment properties by burrowing invertebrates[J]. Marine Biology, 1993, 115(1): 133-142. doi: 10.1007/BF00349395 [35] LEMMENS P, DECLERCK S A J, TUYTENS K, et al. Bottom-up effects on biomass versus top-down effects on identity: A multiple-lake fish community manipulation experiment[J]. Ecosystems, 2018, 21(1): 166-177. doi: 10.1007/s10021-017-0144-x [36] WANG L, CHEN J, SU H J, et al. Is zooplankton body size an indicator of water quality in (sub)tropical reservoirs in China?[J]. Ecosystems, 2022, 25(2): 308-319. doi: 10.1007/s10021-021-00656-2 [37] LI P, JIANG Z, WANG Y H, et al. Analysis of the functional gene structure and metabolic potential of microbial community in high arsenic groundwater[J]. Water Research, 2017, 123: 268-276. doi: 10.1016/j.watres.2017.06.053 [38] 朱永官. 农业环境中的砷及其对人体的健康风险[M]. 北京: 科学出版社, 2013. ZHU Y G. Arsenic in the agricultural environment and its potential risk to humans[M]. Beijing: Science Press, 2013(in Chinese).
[39] LI H Q, SHEN Y J, WANG W L, et al. Soil pH has a stronger effect than arsenic content on shaping plastisphere bacterial communities in soil[J]. Environmental Pollution (Barking, Essex: 1987), 2021, 287: 117339. -






 DownLoad:
DownLoad: