-
抗生素被广泛应用于医疗和畜牧业,其可随人类或动物的尿液或粪便排出,进入土壤、地表水、市政管网及污水处理设施,甚至地下水中[1]. 抗生素不仅具有一定的毒性,还会诱导微生物产生抗性基因. 因此,会造成生态环境和健康风险[2].
目前,处理抗生素废水的传统方法包括吸附法、臭氧氧化、电化学氧化以及生物法等[3]. 近年来,生物电化学系统(Bioelectrochemical systems, BES) 也被用于降解抗生素. 例如,Chen[4]等在MFC中,利用石墨烯修饰生物电极来降解土霉素,8 d后降解率达95%[5]. Liang[6]等报道,改良的BES在24 h内对氯霉素的去除率达96%. Wu[7]等报道,在基于碳棒和泡沫铜电极的BES中,可在36 h内对CAP(初始浓度为32 mg·L−1)完全去除. 然而,在BES中,难降解有机物在降解过程中产生的一些有毒且难以矿化中间体,使微生物活性降低. 为解决该问题,有研究者将BES与人工湿地[8]或光催化技术耦合起来以强化污染物的矿化. 其中,BES与光催化过程耦合,既可提高污染物的矿化效率,又可提高能源回收[9-10],因而备受关注. 本课题组前期的研究工作证实,通过构建基于生物阳极和光电阴极的生物光电化学系统(Biophotoelectro- chemical system, BPES)可促进染料、2,4-二氯苯酚以及抗生素的降解[10-13]. 然而,BPES中高效光电极材料的研发以及抗生素降解过程机理仍需进一步深入研究.
在BPES中,光电极的催化性能对体系降解污染物的影响很大,因此,设计和构筑性能优异的光催化剂至关重要. 溴氧化铋(BiOBr)是一种层状半导体,因其独特的电子结构、适中的能带位置和良好的光学特性而受关注[14]. 但是,BiOBr的禁带宽度较宽 (Eg≈2.90 eV),且其光生电子空穴对极易复合,导致光催化效率较低[15]. 研究表明,通过金属离子Cu掺杂可提高催化剂的光催化活性[16]. 因此,本文的研究目的是通过Cu离子掺杂优化BiOBr光阴极,分析其理化性质和光电化学特性,并将其与生物阳极耦合构建BPES,考察其对盐酸四环素(TC)、磺胺甲恶唑(SMX)和阿莫西林(AMX)的降解性能. 此外,考察不同操作条件对BPES降解抗生素性能的影响,推断AMX的降解路径,并解析BPES生物阳极上微生物群落结构的演变规律,为BPES处理抗生素废水提供一定的理论依据.
-
实验使用的试剂主要包括Bi(NO3)3·5H2O、Cu(NO3)2·3H2O、KBr、KH2PO4、甲醇(色谱纯)、乙腈(色谱纯)、Nafion、无水乙酸钠、TC、SMX和AMX等.
-
Cu掺杂的BiOBr通过溶剂热法制备. 首先分别将0.05、0.15 、0.25 mmol的Cu(NO3)2·3H2O溶解到80 mL的乙二醇溶液中,经充分搅拌溶解后向其中加入5 mmol的 Bi(NO3)3·5H2O 和5 mmol的KBr,剧烈搅拌1 h,随后超声分散20 min,形成均匀的悬浮液. 将得到的混合悬浮液分别转移到100 mL聚四氟乙烯内衬的反应釜中,在160 ℃下加热12 h,随后样品60 ℃下烘12 h,所得样品分别命名为5-Cu-BiOBr、15-Cu-BiOBr、25-Cu-BiOBr. BiOBr的制备同上. 光阴极材料由催化剂通过涂覆法负载在泡沫镍基底上得到. 首先将泡沫镍(5 cm×3 cm)浸没于硫酸(1 mol·L−1)和无水乙醇混合液中超声清洗30 min,再用去离子水多次冲洗,自然干燥备用;然后分别将60 mg的上述光催化剂加入到0.3 mL异丙醇和0.6 mL Nafion的混合溶液中,经超声混合后将悬浮液均匀涂在泡沫镍上,自然干燥备用.
通过扫描电子显微镜(SEM, Hitachi S-SU8020)及透射电镜(TEM)和高分辨率透射电镜(HR-TEM)(FEI Tecnai G2 F30)来观察光电极材料的微观形貌结构. 用X射线光电子能谱(XPS, ESCALAB 250XI+)分析光电极的化学成分. 采用傅里叶变换红外光谱(FT-IR, IRTracer-100)分析化学键. 利用UV-vis漫反射光谱(UV-vis DRS, UV-2600)检测其光吸收特性,并利用光致发光光谱(PL, ZLX-PL-I)分析光生载流子的分离效率. 此外,采用光电化学工作站(荷兰,Metrohm-Autolab,PGSTAT302N)三电极体系测试光阴极的光电化学性能,包括电化学阻抗谱(EIS), 线性扫描伏安曲线(LSV)和循环伏安曲线(CV)等测试,具体体系及操作参数与本课题组前期报道相同[12].
-
BPES反应器为石英玻璃单室瓶式反应器(设置2个平行反应器),有效容积为160 mL(直径为6 cm,高度为8 cm). 碳刷阳极的长度为4.0 cm,直径为2.5 cm. 以制备的BiOBr及Cu-BiOBr光电极为阴极,两电极(间距约2 cm)平行放置在BPES中,外接10 Ω电阻. 选用南宁市琅东污水处理厂的生活污水进行接种,在0.6 V外加电压下驯化挂膜. BPES的基质主要成分为(以1 L基质计):1.0 g无水乙酸钠,100 mL PBS缓冲液,2.5 mL微量元素溶液,0.2 mL维他命溶液,873.2 mL去离子水. 挂膜成功后,向上述基质中添加一定浓度(5 mg·L−1)的TC、SMX、AMX,驯化阳极微生物使之适应抗生素废水. 采用多通路电压数据采集器 (Model M2700, module M7708, Keithley Instruments,美国)采集电阻两端的电压. 采用300W的氙灯(λ >420 nm)作为可见光光源.
-
TC浓度采用紫外分光光度计测定,波长265 nm. SMX与AMX的浓度通过高效液相色谱仪(HPLC-20AD,岛津)测定,采用C18色谱柱(5 μm,4.6 mm×150 mm),SMX的流动相比例为10%甲醇/90%超纯水,流速为0.8 mL·min−1,检测波长为277 nm;AMX的流动相比例为2.5%甲醇/97.5% 5 mmol·L−1磷酸二氢钾,流速为1.0 mL·min−1,检测波长254 nm. 采用Waters Xevo G2-XS QTOF 液质联用仪(Waters ACQUITY UPLC BEH C18柱,1.7 μm)对AMX降解的中间产物进行鉴定,柱温为40 ℃,流动相比例为0.1%甲酸水/乙腈=95/5,流速为0.3 mL·min−1,进样量为2 μL.
-
从图1a-d可看出,Cu-BiOBr和BiOBr均为规整、均匀的层状纳米片组成的花瓣球体,且Cu掺杂减小了花瓣球体的直径(Cu-BiOBr 3 µm vs. BiOBr 6 µm),使材料比表面积及总孔体积均有所增加. Cu-BiOBr的TEM图中的晶格条纹间距0.282 nm、0.277 nm与0.229 nm分别对应{102}、{110}和{112}晶面,与标准卡片 (PDF#85-0862)相符合 (图1e-f),说明Cu-BiOBr的成功合成.
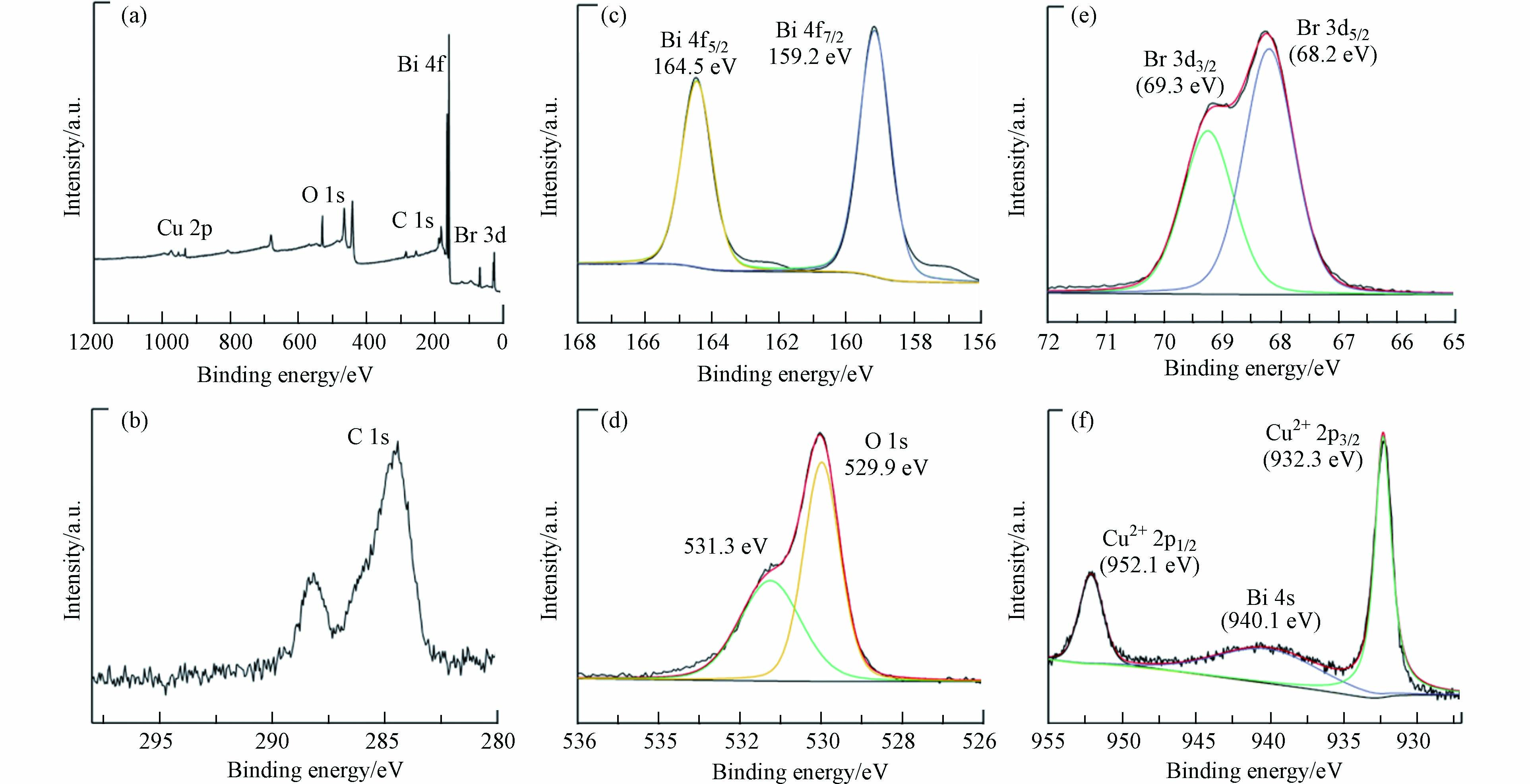
XPS全扫描光谱(图2a)可看出,15-Cu-BiOBr主要由C、Bi、O、Br和Cu组成. 结合能位于69.3 eV,68.2 eV处的峰对应着Br 3d3/2与Br 3d5/2,验证了BiOBr中Br的存在. Bi3+的结合能位于164.5 eV与159.2 eV处的峰对应着Bi 4f5/2 和Bi 4f5/2,说明Bi3+的存在. 而O 1s 的531.3 eV与529.9 eV的结合能峰值分别属于晶格氧 (O2-)与H2O的特征峰[17]. 对于Cu-BiOBr,结合能峰位于932.3 eV (Cu 2p3/2)和952.1 eV (Cu 2p1/2),表明Cu2+的存在. 结合能940.1 eV处的峰出现,可能是Bi 4s的峰,也可认为该峰与Cu 2p处的轨道峰发生重叠[18].
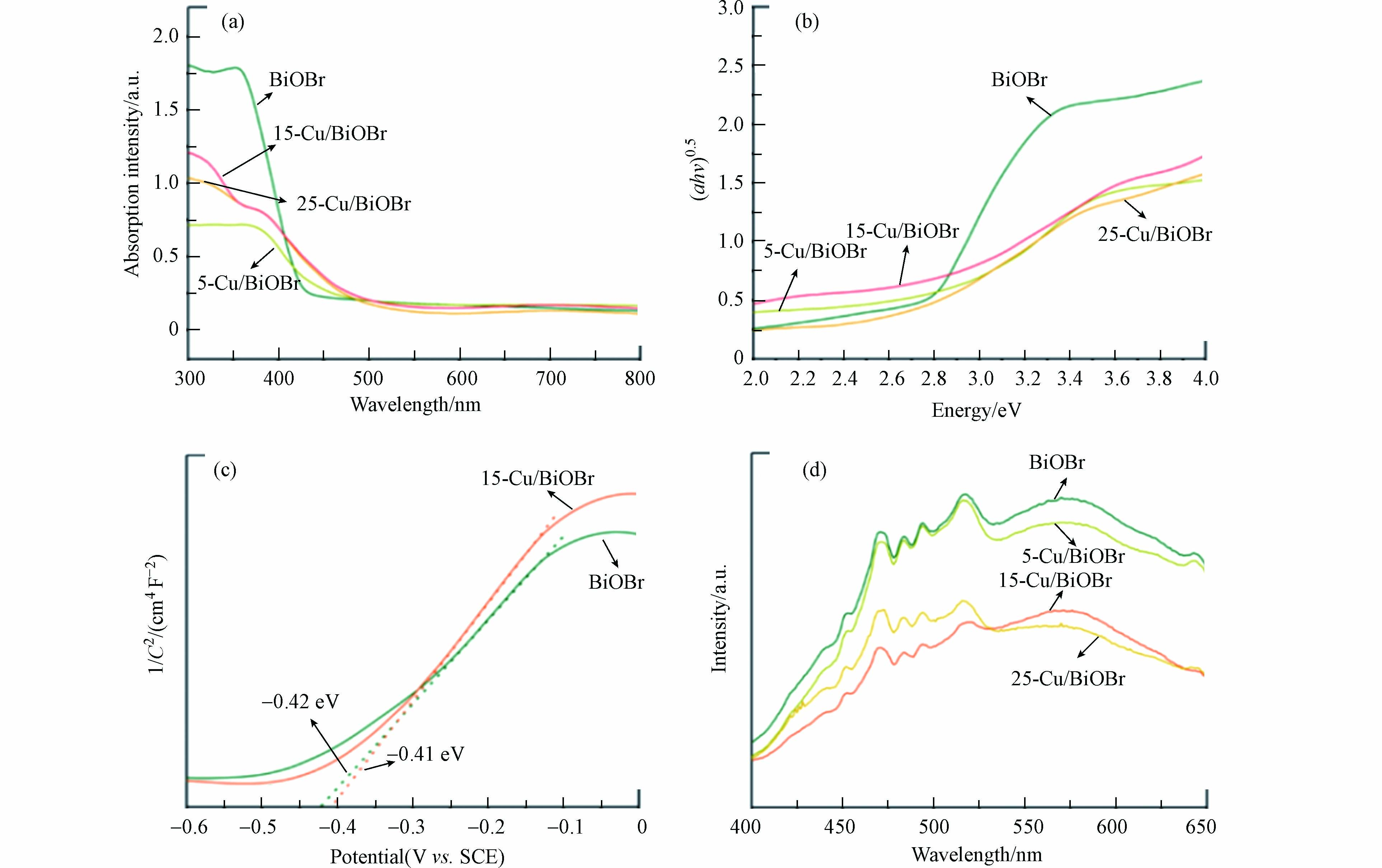
从UV-vis-DRS光谱(图3a)可看出,原始BiOBr的可见光吸收较差,其吸收边约为440 nm,而Cu-BiOBr最大吸收边有所拓宽. 从图3b可得出BiOBr和Cu-BiOBr的禁带宽度分别为2.70 eV和 2.60 eV. 由 Mott-Schottky曲线(图3c)可得BiOBr与15-Cu-BiOBr的平带势,通过计算可知BiOBr与15-Cu-BiOBr的导带位置分别为-0.18 eV和-0.17 eV,其价带位置分别在2.88 eV和2.77 eV. PL图谱(图3d)显示,所有材料在451、470、484、495、519nm处均有相同的发射峰,主要在于BiOBr具有不同的发射中心 [19]. 此外,Cu-BiOBr的发射峰强度低于BiOBr,说明Cu掺杂有助于提高BiOBr光生载流子的分离效率,且15-Cu-BiOBr的峰强度最低,说明其载流子分离效率最高.
-
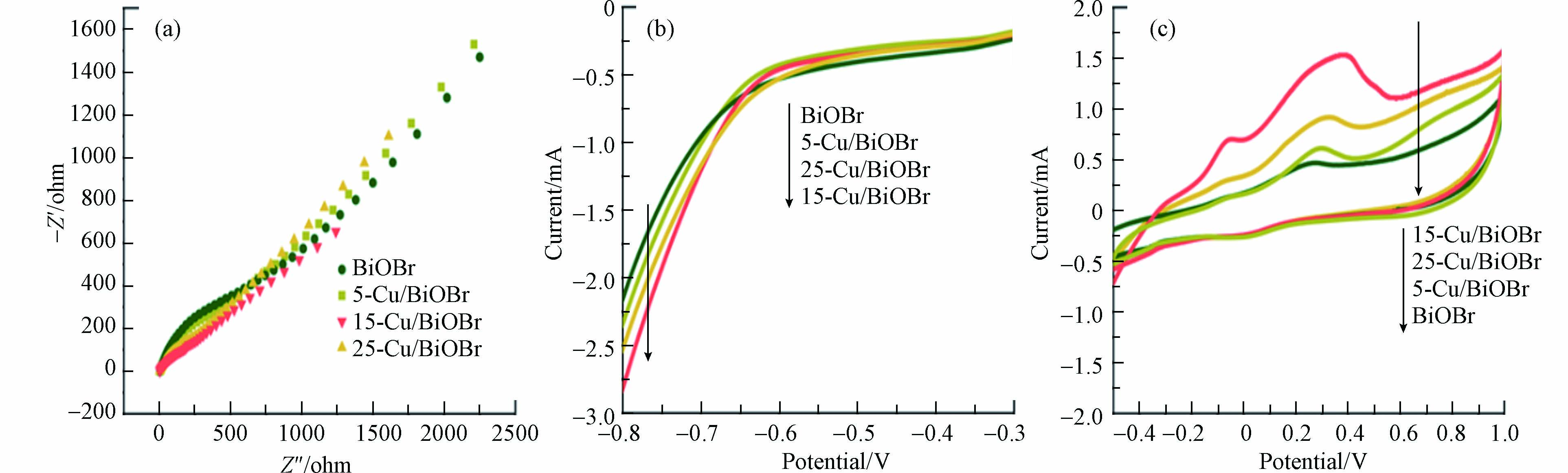
从EIS曲线拟合结果(表1)可知,Cu掺杂减少了BiOBr电荷转移电阻(R1),有利于加速电荷转移. LSV(图4b)显示,15-Cu-BiOBr的过电位最小,其末端电流最大(在-0.8 V,5-Cu-BiOBr、15-Cu-BiOBr和25-Cu-BiOBr的电流分别为2.33、2.52、2.81 mA,大于BiOBr的2.15 mA),说明15-Cu-BiOBr光阴极电化学性能最优. CV曲线(图4c)显示光电极材料在0.3-0.4 V电位附近均出现明显的氧化峰,且15-Cu-BiOBr比电容最大(由曲线面积的整体积分可得)[20]. 这些结果均表明,Cu的掺杂有助于提高BiOBr的电化学性能,使光生电子空穴对加速分离,且15-Cu-BiOBr光阴极最优.
-
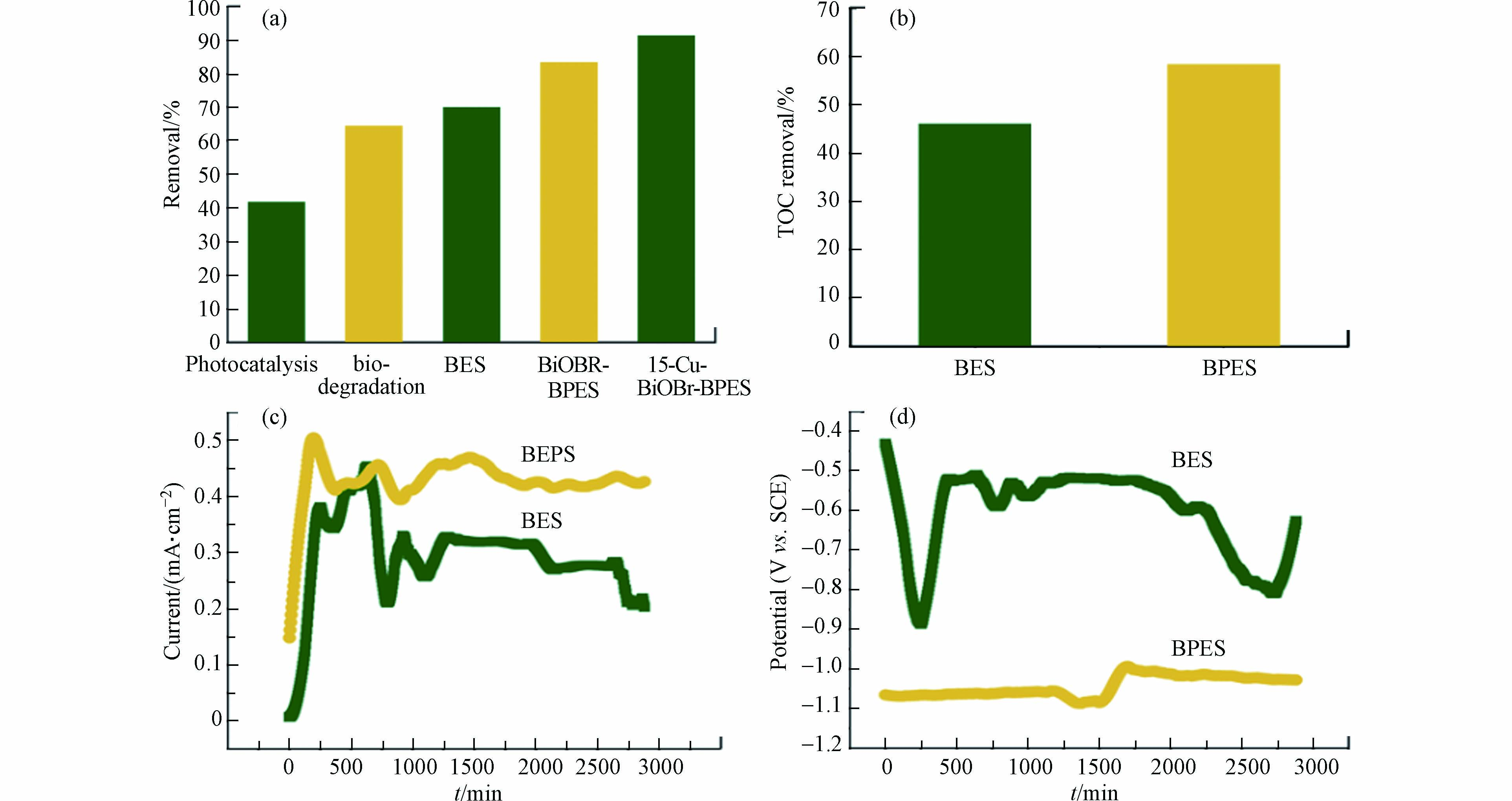
从图5a可知,经过48 h的运行,15-Cu-BiOBr 光阴极的BPES中AMX的降解率91.38%,高于BiOBr光阴极的BPES的降解率(83.52%),而光无光照的BES对AMX的去除率为70.10%. 此外,光催化降解、开路(即微生物降解过程)的去除率分别为41.81%、64.60%. 这些结果表明,在BPES中,微生物降解、光催化降解及电化学过程共同促进了AMX的分解,且微生物降解过程占主导. 由图5b可知,BPES中TOC去除率为58.43%,约为BES中TOC去除率(46.14%)的1.3倍. 这可归因于BPES中光催化产生活性基团,可作用于AMX及其中间产物,促进其降解为小分子物质,进而再被阳极微生物利用,微生物-光-电协同加速污染物的降解,这与前期研究结果一致[12]. 此外,光照还可提高BPES的电流输出(图5c),原因是光阴极表面产生的光生空穴能捕获生物阳极传递过来的电子,加速电子从阳极到阴极之间的转移,进而增加电流输出. 此外,BPES阴极电位比BES更低,与生物阳极形成更大的电势差,也有利于电子转移(图5d).
-
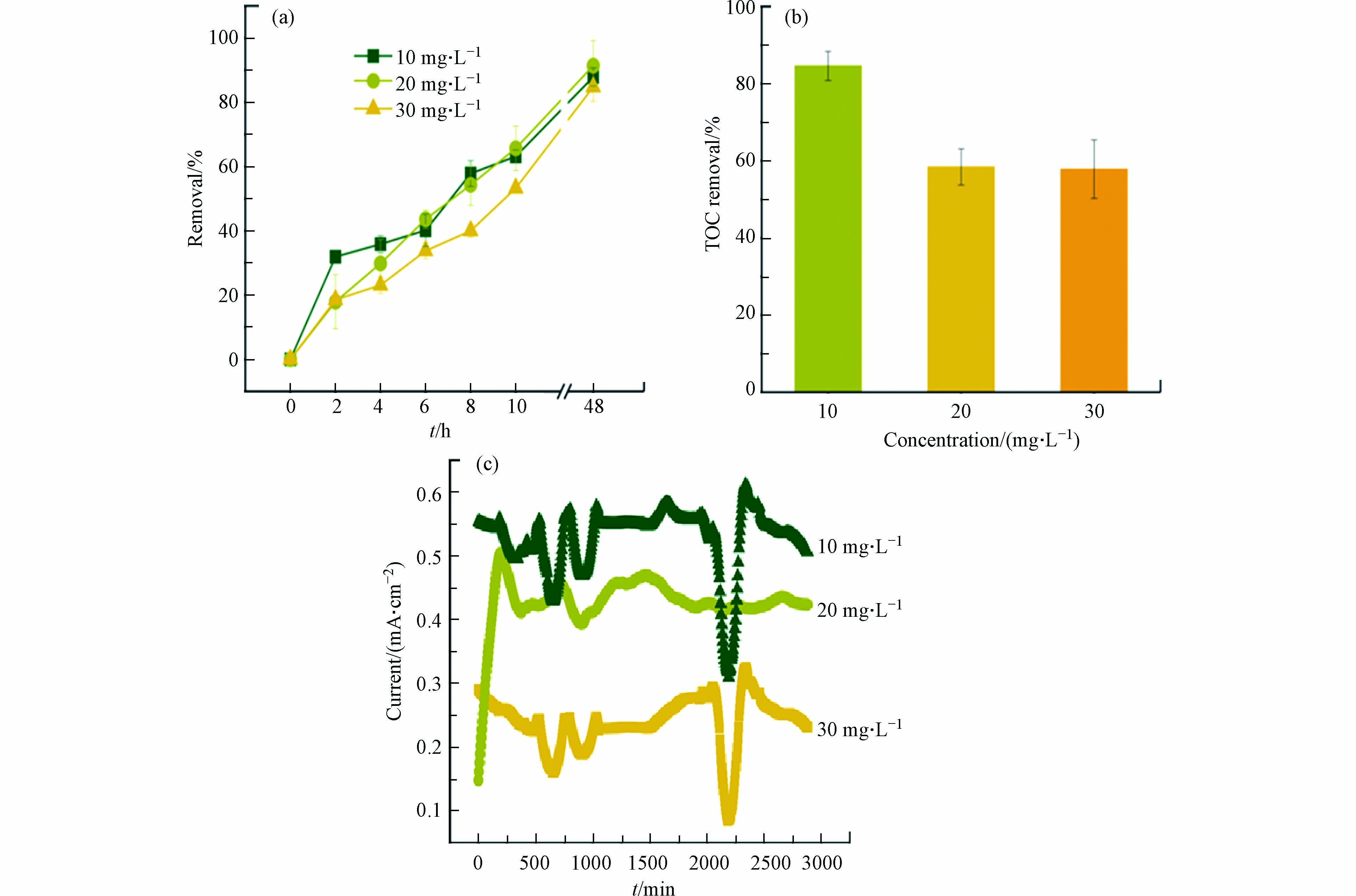
如图6a所示,在BPES中,当 AMX初始浓度从10 mg·L−1增加到20 mg·L−1时,AMX的去除无显著差异;当初始浓度增加至30 mg·L−1时,去除率下降. 然而,当初始浓度为10 mg·L−1时,TOC去除率达到84.60%,明显高于初始浓度为20 mg·L−1和30 mg·L−1的情况(图6b). BPES的电流输出则随着AMX的初始浓度的增加而降低(图6c),可能的原因是当AMX初始浓度增加时,会对阳极电活性微生物产生一定的抑制作用,从而抑制外电路的电流输出.
-
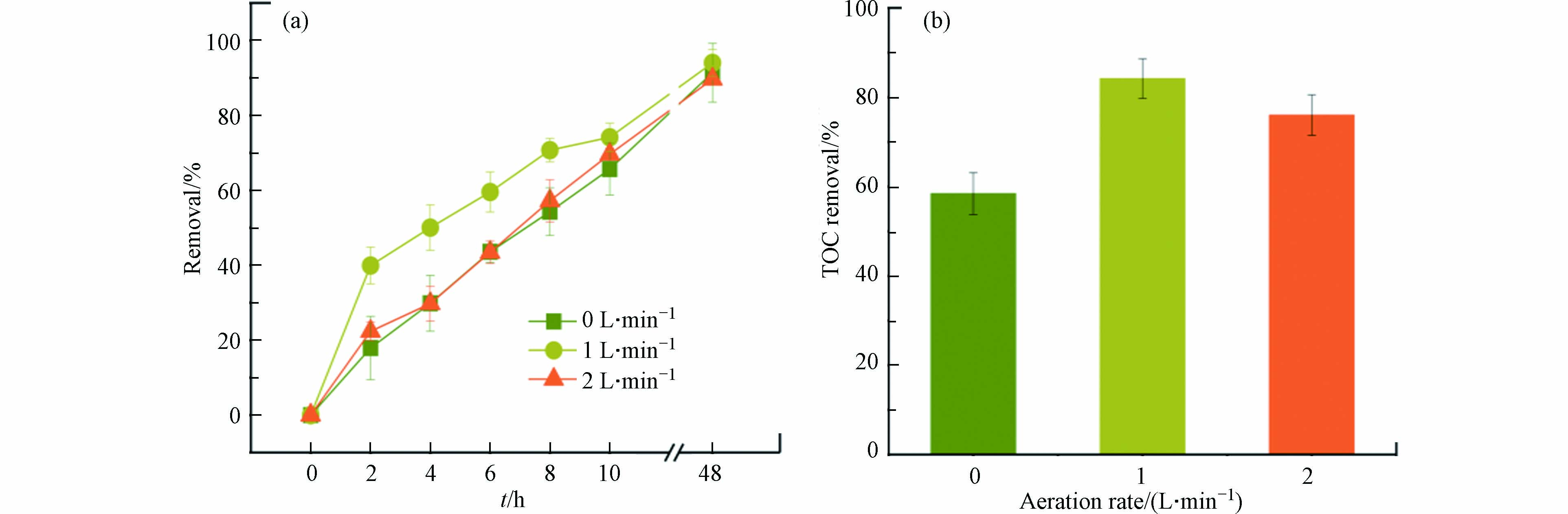
为提高BPES中光催化过程对AMX降解的贡献,对BPES进行微曝气. 当曝气速率为1 L·min−1时,前10 小时可显著加速AMX降解(74.16 %)(图7). TOC结果也验证了该结果:当曝气速率为1 L·min−1时,TOC去除率为84.17%,高于曝气速率为2 L·min−1的情况(76.01%)以及不曝气的情况(58.43%). 原因是适当曝气可增加溶解氧,有利于光阴极表面生成更多活性物种,促进AMX降解与矿化;当曝气速率较大时,则可能会对阳极微生物产生不利影响,影响AMX降解.
-
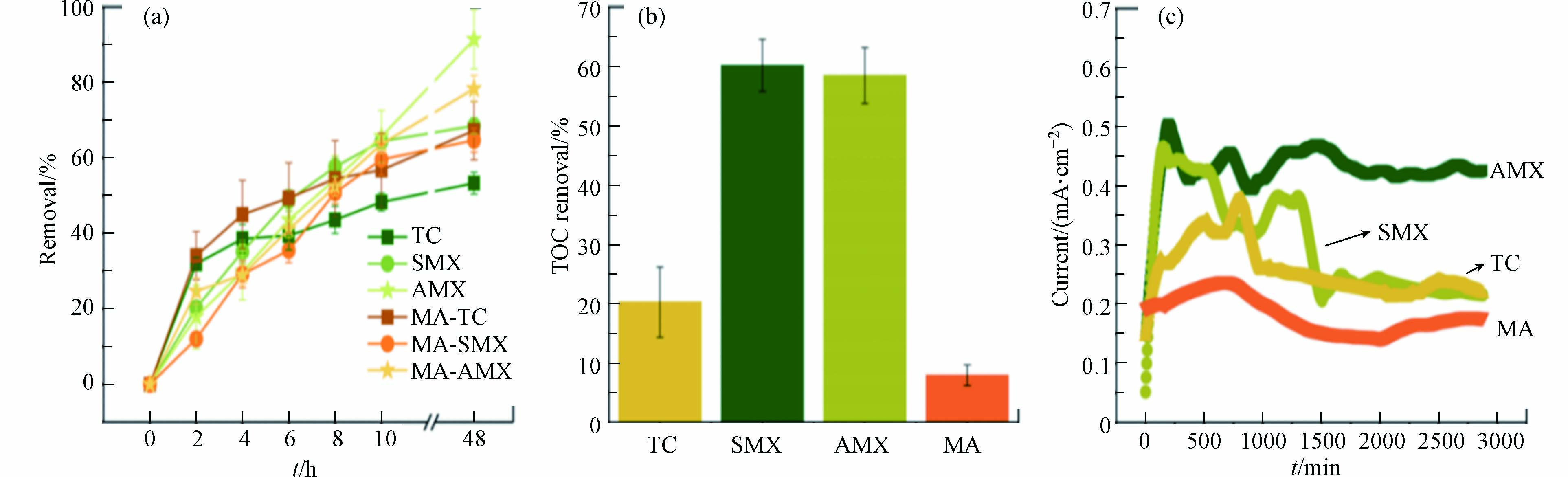
图8展示了TC,SMX与AMX在BPES中降解性能以及电能输出特性. 如图8a所示,BPES经过48 h的运行后,AMX的去除率最高,达到91.38%,SMX次之(68.49%),TC降解率最低(53.32%). 原因可能是AMX及其降解中间产物对阳极电活性菌的抑制作用较低,而TC降解的中间体则对微生物具有较大的抑制作用. 当BPES中加入混合抗生素(Mixed antibiotic,MA)(TC、SMX和AMX各10 mg·L−1),TC、SMX和AMX在10 h的降解率分别是56.81%、59.57%、63.67%,48 h后的降解率分别是67.22%、64.68%和78.33%,均低于单一降解性能. 图8b显示,SMX和AMX的TOC去除率分别为60.15%和58.43%,TC的TOC去除为20.26%,而MA的TOC去除率最低. 在混合抗生素体系中,由于BPES污染物的总浓度为30 mg·L−1,远高于单一降解的情形,且共存情况下3种抗生素降解过程相互竞争,再者,混合抗生素及其中间体也会抑制微生物的呼吸代谢,因此,共存情况下抗生素的降解效率和TOC去除率均最低. 如图8c所示,BPES电流输出性能与抗生素降解效果的趋势基本一致:处理AMX的BPES电流输出最高,处理SMX的BPES次之,再者是降解TC的BPES,电流输出最低的是处理MA的BPES. 这与抗生素及其降解中间产物对阳极电活性菌的抑制作用有密切关系.
-
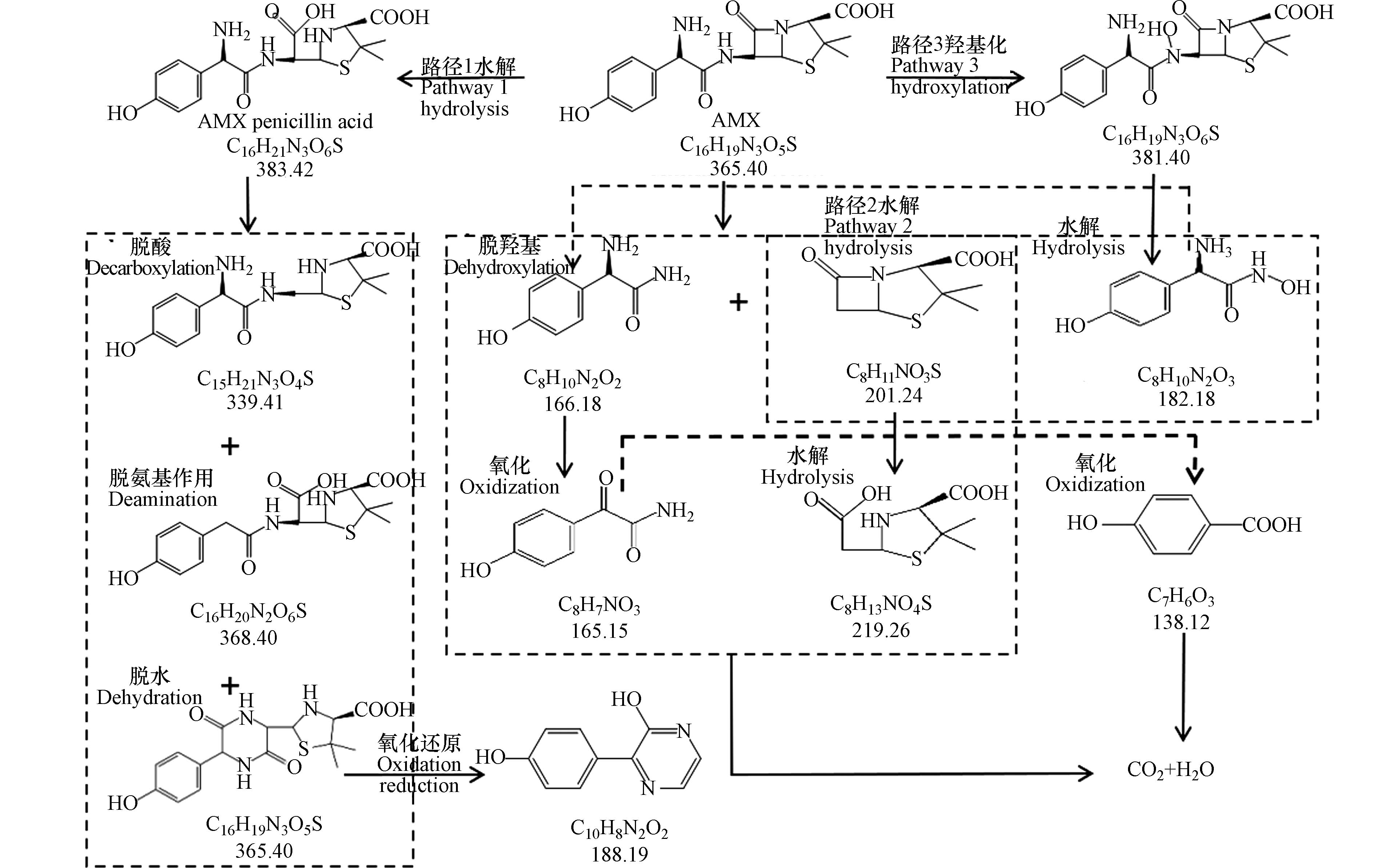
通过液质联用仪鉴定识别出来的AMX的中间产物主要为C16H19N3O5S (m/z=366.11)、C16H19N3O6S (m/z=382.12)、C16H21N3O6S (m/z=384.12)、C8H10N2O2 (m/z=166.98)、C8H11NO3S (m/z=202.22)、C8H9N2O3 (m/z=182.98)、C8H7NO3 (m/z=166.34)、C8H13NO4S (m/z=220.22)、C15H21N3O4S (m/z=340.39)、C16H20N2O6S (m/z=369.39)、C10H8N2O2 (m/z=188.95)、C7H6O3 (m/z=139.99). 由中间产物可推测,AMX主要发生了水解、氧化开环、自由基取代,以及脱氨和脱羧等反应过程,根据已知信息及相关文献报道推断,AMX在BPES中可能的降解路径主要有三条,如图9所示.
-
图10揭示了接种液、BES以及BPES生物阳极处理不同抗生素废水之后的微生物群落结构在种属水平上的演变规律. 经过BES和BPES的驯化以后,生物阳极上Geobacter的占比比接种液的显著增加,在处理AMX、SMX、TC和MA分别占细菌总数65.48%、40.6%、13.41%和12.46%. 这是因为Geobacter具有优良的细胞外电子转移能力和载体表面的附着生长能力[21]. 相比于BES,降解SMX和AMX的BPES阳极上的Geobacter的数量分别增加了12.5%和37.38%. 据报道,Geobacter广泛存在于磺胺类抗生素[22]和AMX[23]污染废水中,对抗生素的降解发挥着重要作用.
Dysgonomonas在TC样品中占比最大为26.42%,高于BES (0.86%)、SMX (0.3%)、AMX (3.01%)、MA (4.32%). Dysgonomonas属于Bacteroidetes,非运动性的兼性厌氧球菌[24],被认为是生物降解药物污染物的优势菌属,也常出现在抗生素废水中[25-27]. 此外,在TC样品的阳极生物膜中,Comamonas占细菌总数15.66%,而Acidovorax、Gordonia、Stenotrophomonas、Sphaerochaeta和Desulfovibrio等占比也较高..
在SMX和AMX的样品生物膜中,也含有少数的Comamonas、Acidovorax、Gordonia、Stenotrophomonas、Sphaerochaeta、Desulfovibrio等,均电活性细菌,为 BPES 的产电提供贡献. 在3种抗生素混合降解的BPES阳极中,Comamonas、Acidovorax、Gordonia、Stenotrophomonas、Sphaerochaeta、Desulfovibrio等细菌的数量都有所增加,说明微生物群落结构会随着共底物的类型及浓度变化进而发生改变.
-
(1) Cu的掺杂提高了BiOBr的光电化学性能;以最优的Cu-BiOBr为光阴极构建的BPES可高效降解AMX,且当曝气速率为1L·min−1时,AMX降解加速. BPES对SMX也有较好的去除效果,而对TC的降解则不太理想. AMX, TC和SMX共存情况下,其降解过程会出现相互竞争相互抑制现象,导致去除率降低.
(2) AMX在BPES中可能的降解路径主要有三条,降解主要通过水解、自由基的取代、氧化开环,以及脱氨和脱羧等反应过程.
(3) BPES生物阳极的微生物群落结构随着污染物的改变而发生演变,降解SMX和AMX的主要菌种为Geobacter,分别占比40.6%和65.48%. 另外, Dysgonomonas主要有助于降解TC,其占其细菌总数的26.42%. Comamonas则在MA中占有较大比例,表明Comamonas对不同抗生素均具有良好的耐受性.
基于Cu掺杂BiOBr光阴极的生物光电化学系统降解典型抗生素的特性及微生物群落响应
Degradation of typical antibiotics and microbial community response in a biophotoelectrochemical system with a Cu-doped BiOBr photocathode
-
摘要: 抗生素难以生物降解且会诱导产生抗性基因,对生态环境和人体健康均造成威胁,因此,抗生素废水的高效处理意义重大. 本研究制备了Cu掺杂的BiOBr光阴极,并与生物阳极耦合,构建生物光电化学系统(biophotoelectrochemical system,BPES),用于降解抗生素. 结果表明,Cu-BiOBr较BiOBr具有更优异的光电化学性能. 光照条件下的BPES在48 h内对初始浓度为20 mg·L−1的阿莫西林(AMX)的去除率达91.38%. 此外,适当曝气可提高BPES对AMX的去除. 当AMX与盐酸四环素(TC),磺胺甲恶唑(SMX)在BPES中共降解时,降解过程均受到不同程度的抑制. 根据鉴定的AMX的降解中间产物,推断了AMX的降解路径. BPES的阳极生物膜上的微生物主要以电活性细菌Geobacter为主,其对抗生素具有较高耐受性以及降解能力.
-
关键词:
- 生物光电化学系统 /
- Cu-BiOBr光阴极 /
- 抗生素 /
- 降解路径 /
- 微生物群落.
Abstract: Antibiotics are difficult to be biodegraded, and they can induce resistance genes; therefore, efficient treatment of antibiotics wastewater is of great significance. In this study, the Cu-doped BiOBr (Cu-BiOBr) photocathode was prepared and coupled with a bioanode to constructed a biophotoelectrochemical system (BPES) for antibiotics degradation. Results showed that the Cu-BiOBr exhibited superior photochemical performance as compared with the BiOBr. In the light-illuminated BPES, the removal of amoxicillin (AMX, initial concentrationof 20 mg·L−1) reached 91.38% within 48 h. In addition, providing suitable aeration in the BPES could promote AMX removal. When AMX, tetracycline hydrochloride (TC), and sulfamethoxazole (SMX) were co-existed in the BPES, degradation process of each antibiotic was inhibited to some extent. Possible degradation pathways of AMX in BPES were proposed according to the identified degradation intermediates. The dominated microorganisms on the anodic biofilm of the BPESs treating different antibiotic wastewater were electro-active bacteria--Geobacter, which showed relatively high resistance towards antibiotics and certain degradation ability. -
表 1 拟合不同光电阴极的EIS数据
Table 1. EIS data fitted by different photocathodes
光电阴极Photocathodes R0/Ω R1/Ω R2/Ω BiOBr 4.24 6.16×10−3 1.60×10−6 5-Cu-BiOBr 4.55 4.92×10−3 1.95×10−6 15-Cu-BiOBr 4.30 3.62×10−3 1.19×10−6 25-Cu-BiOBr 4.51 5.33×10−3 8.45×10−5 -
[1] LU N, WANG L Q, LV M, et al. Graphene-based nanomaterials in biosystems [J]. Nano Research, 2019, 12(2): 247-264. doi: 10.1007/s12274-018-2209-3 [2] 陶玥彤, 李茹莹. 生物电化学系统对河道沉积物中抗生素的强化去除 [J]. 环境科学学报, 2021, 41(4): 1383-1392. TAO Y T, LI R Y. Enhanced removal of antibiotics from the river sediments by bioelectrochemical systems [J]. Acta Scientiae Circumstantiae, 2021, 41(4): 1383-1392(in Chinese).
[3] 郑乐媚, 关亦玮, 文定, 等. BiOBr/GO复合纳米光催化剂的制备及可见光下降解环丙沙星废水 [J]. 环境化学, 2020, 39(8): 2137-2146. ZHENG L M, GUAN Y W, WEN D, et al. Preparation of BiOBr/GO composition nanocatalysts and application of degradation of ciprofloxacin wastewater in visible light [J]. Environmental Chemistry, 2020, 39(8): 2137-2146(in Chinese).
[4] CHEN J F, HU Y Y, HUANG W T, et al. Biodegradation of oxytetracycline and electricity generation in microbial fuel cell with in situ dual graphene modified bioelectrode [J]. Bioresource Technology, 2018, 270: 482-488. doi: 10.1016/j.biortech.2018.09.060 [5] CHEN J F, YANG Y W, LIU Y Y, et al. Bacterial community shift and antibiotics resistant genes analysis in response to biodegradation of oxytetracycline in dual graphene modified bioelectrode microbial fuel cell [J]. Bioresource Technology, 2019, 276: 236-243. doi: 10.1016/j.biortech.2019.01.006 [6] LIANG B, CHENG H Y, KONG D Y, et al. Accelerated reduction of chlorinated nitroaromatic antibiotic chloramphenicol by biocathode [J]. Environmental Science & Technology, 2013, 47(10): 5353-5361. [7] WU D, SUN F Q, ZHOU Y. Degradation of chloramphenicol with novel metal foam electrodes in bioelectrochemical systems [J]. Electrochimica Acta, 2017, 240: 136-145. doi: 10.1016/j.electacta.2017.04.059 [8] ZHANG S, YANG X L, LI H, et al. Degradation of sulfamethoxazole in bioelectrochemical system with power supplied by constructed wetland-coupled microbial fuel cells [J]. Bioresource Technology, 2017, 244: 345-352. doi: 10.1016/j.biortech.2017.07.143 [9] HOU Y P, LUO H P, LIU G L, et al. Improved hydrogen production in the microbial electrolysis cell by inhibiting methanogenesis using ultraviolet irradiation [J]. Environmental Science & Technology, 2014, 48(17): 10482-10488. [10] HOU Y P, YUAN G Y, QIN S M, et al. Photocathode optimization and microbial community in the solar-illuminated bio-photoelectrochemical system for nitrofurazone degradation [J]. Bioresource Technology, 2020, 302: 122761. doi: 10.1016/j.biortech.2020.122761 [11] HOU Y P, GAN Y Y, YU Z B, et al. Solar promoted azo dye degradation and energy production in the bio-photoelectrochemical system with a g-C3N4/BiOBr heterojunction photocathode [J]. Journal of Power Sources, 2017, 371: 26-34. doi: 10.1016/j.jpowsour.2017.10.033 [12] TU L L, HOU Y P, YUAN G Y, et al. Bio-photoelectrochemcial system constructed with BiVO4/RGO photocathode for 2, 4- dichlorophenol degradation: BiVO4/RGO optimization, degradation performance and mechanism [J]. Journal of Hazardous Materials, 2020, 389: 121917. doi: 10.1016/j.jhazmat.2019.121917 [13] QIN S M, HOU Y P, YUAN G Y, et al. Different refractory organic substances degradation and microbial community shift in the single-chamber bio-photoelectrochemical system [J]. Bioresource Technology, 2020, 307: 123176. doi: 10.1016/j.biortech.2020.123176 [14] 周奥, 曹新强, 顾彦, 等. 以生物炭为内核的BC@BiOBr催化剂的制备及可见光光催化性能 [J]. 环境化学, 2019, 38(2): 235-242. ZHOU A, CAO X Q, GU Y, et al. Preparation of BC@BiOBr catalyst with biochar as core and its visible light photocatalytic performance [J]. Environmental Chemistry, 2019, 38(2): 235-242(in Chinese).
[15] 李冬梅, 梁奕聪, 卓涌淇, 等. 铋修饰BiOBr/g-C3N4异质结光催化剂合成及其可见光催化性能研究 [J]. 环境科学学报, 2021, 41(3): 960-968. LI D M, LIANG Y C, ZHUO Y Q, et al. Synthesis of Bi-decorated BiOBr/g-C3N4 heterojunction photocatalyst and its visible light-driven photocatalytic performance [J]. Acta Scientiae Circumstantiae, 2021, 41(3): 960-968(in Chinese).
[16] 叶少琛, 徐向阳, 何光裕, 等. CuxZn1-xS/RGO复合材料的制备及其光催化降解环丙沙星性能研究[J]. 环境化学, 2020, 39(7): 1977-1984. YE S C, XU X Y, HE G Y, et al. Preparation and performance of CuxZn1-xS/RGO composite for photocatalytic degradation of CIP[J]. Environmental Chemistry, 2020, 39(7): 1977-1984(in Chinese). Environmental chemistry, 2020, 39(07): 1977-1984 (in Chinese).
[17] WANG H, YONG D Y, CHEN S C, et al. Oxygen-vacancy-mediated exciton dissociation in BiOBr for boosting charge-carrier-involved molecular oxygen activation [J]. Journal of the American Chemical Society, 2018, 140(5): 1760-1766. doi: 10.1021/jacs.7b10997 [18] HILL D M, MEYER H M 3rd, WEAVER J H, et al. Cu adatom interactions with single- and polycrystalline Bi2Ca1+xSr2-xCu2O8+y and YBa2Cu3O7-x [J]. Physical Review. B, Condensed Matter, 1988, 38(16): 11331-11336. doi: 10.1103/PhysRevB.38.11331 [19] LV X C, YAN D Y S, LAM F L Y, et al. Solvothermal synthesis of copper-doped BiOBr microflowers with enhanced adsorption and visible-light driven photocatalytic degradation of norfloxacin [J]. Chemical Engineering Journal, 2020, 401: 126012. doi: 10.1016/j.cej.2020.126012 [20] SENGOTTAIYAN C, KALAM N A, JAYAVEL R, et al. BiVO4/RGO hybrid nanostructure for high performance electrochemical supercapacitor [J]. Journal of Solid State Chemistry, 2019, 269: 409-418. doi: 10.1016/j.jssc.2018.10.011 [21] WANG L, LIU Y L, WANG C, et al. Anoxic biodegradation of triclosan and the removal of its antimicrobial effect in microbial fuel cells [J]. Journal of Hazardous Materials, 2018, 344: 669-678. doi: 10.1016/j.jhazmat.2017.10.021 [22] YAN W F, XIAO Y, YAN W D, et al. The effect of bioelectrochemical systems on antibiotics removal and antibiotic resistance genes: A review [J]. Chemical Engineering Journal, 2019, 358: 1421-1437. doi: 10.1016/j.cej.2018.10.128 [23] LV L Y, LI W G, WU C D, et al. Microbial community composition and function in a pilot-scale anaerobic-anoxic-aerobic combined process for the treatment of traditional Chinese medicine wastewater [J]. Bioresource Technology, 2017, 240: 84-93. doi: 10.1016/j.biortech.2017.01.053 [24] BRIDGES C M, GAGE D J. Development and application of aerobic, chemically defined media for Dysgonomonas [J]. Anaerobe, 2021, 67: 102302. doi: 10.1016/j.anaerobe.2020.102302 [25] 王思祺, 严伟富, 赵峰, 等. 基于微生物电化学技术的萘普生高盐废水处理 [J]. 环境化学, 2020, 39(4): 1137-1144. WANG S Q, YAN W F, ZHAO F, et al. Treatment of naproxen high-salt wastewater based on microbial electrochemical technology [J]. Environmental Chemistry, 2020, 39(4): 1137-1144(in Chinese).
[26] MORRIS J M, JIN S, CRIMI B, et al. Microbial fuel cell in enhancing anaerobic biodegradation of diesel [J]. Chemical Engineering Journal, 2009, 146(2): 161-167. doi: 10.1016/j.cej.2008.05.028 [27] ALEXANDRINO D A M, MUCHA A P, ALMEIDA C M R, et al. Biodegradation of the veterinary antibiotics enrofloxacin and ceftiofur and associated microbial community dynamics [J]. Science of the Total Environment, 2017, 581/582: 359-368. doi: 10.1016/j.scitotenv.2016.12.141 -





 下载:
下载: