-
随着经济社会的不断发展、现代化工业进程的不断加深,塑料的使用在人们日常生活中无处不在. 从食品包装,电子产品,家具到常见的一次性使用物品等. 2016年全球产生了19—2300万吨塑料垃圾,每年塑料排放量到2030年预计可达5300万吨[1]. 塑料制品经紫外辐射、物理磨损、(微)生物降解等一系列过程后可解离成颗粒状、碎片状或其它形态的塑料,其中直径小于5 mm的塑料被称之为微塑料(microplastic, MPs),纳米级尺寸的塑料为纳米微塑料(nanoplastics,NPs)[2-3].
据报道,预计到2050年,自然环境中存在的塑料垃圾将达1.20×1011亿吨,它的污染及潜在危害已成为日益关注的环境问题[4]. MPs所导致的潜在健康危害逐渐引起了全世界的广泛关注,联合国环境规划署已明确将MPs列为全球新兴环境污染物之一[5-7]. 有研究指出,土壤中的MPs可在阳光照射下,产生环境持久性自由基以及活性氧(reactive oxygen species, ROS),引起生物体的氧化应激而造成机体损伤[8]. 很多报道已揭示海洋MPs污染会对生物体的消化系统、生殖系统、神经系统等产生不良效应[9-12]. 然而MPs不仅只存在于海洋中,还广泛浮游在空气里且可随季风等影响,而在全球范围内移动[13].
近年来,有研究团队在大气环境中检测到了MPs且在人肺组织中也检测到了塑料合成纤维,这引发了人们对空气中存在的MPs与职业病关系的关注[14-15]. 关于大气中存在的MPs,2021年研究者在我国北部和东南部五个城市-北京、天津、上海、南京和杭州进行了大气MPs浓度检测,结果显示,北部城市空气中的 MPs 浓度(358±132)个·m−3高于东南部城市(230±94)个·m−3[16]. 在中国东莞市进行的调查指出该市大气环境中约存在175—313个·m−2·d−1,其平均沉积率为(36 ± 7)个·m−2·d−1[17]. 早前在巴黎进行的调查研究显示,该地区大气沉降物中的MPs浓度可达335个·m−2·d−1[18]. Dris等[19]在后期研究中指出,巴黎市区总大气沉降物的平均沉降速率为(110 ± 96) 个·m−2·d−1 ,郊区为(53 ± 38)个·m−2·d−1. 由此可见,城市中气载MPs的问题可能比城郊更严峻[19]. 最近的一项荟萃分析数据显示,成年女性每天平均接触258个MPs颗粒,其中吸入的MPs颗粒达132个[20]. 鉴于MPs不仅能从海洋传播到陆地环境中,其还能在空气中进行远距离传播[21];且空气中的MPs比海洋中的MPs体积更小,肉眼完全看不见,所以很难掌握其移动途径和扩散范围,因而对大气中存在的MPs进行研究刻不容缓.
然而,目前MPs对呼吸系统毒性影响的研究暂仅停留在MPs的肺部沉积及表观毒性效应上[22]. 本综述旨在总结归纳MPs暴露对呼吸系统的影响及其机制研究进展,并对当前研究存在的不足以及仍待解决的问题进行探讨.
-
2019年《西日本新闻》报道,福冈工业大学环境科学研究所的研究团队在福冈市内检测出了悬浮在空气中的MPs颗粒,此外在长岛大气中也检测出了同类物质[19]. 最近,欧洲研究团队在海拔1300多米的比利牛斯山脉的空气中同样也检测到了MPs[21]. 海洋和陆地中的MPs可能通过风力作用、颗粒附着、大气运输等方式转运到大气环境内,继而悬浮于空气中(图1)[23]. 因此,MPs可在水生环境、地表和大气环境间移动.
MPs根据产生途径可分为初级MPs和次级MPs. 前者通常指人类生产生活直接产生的塑料颗粒如化妆品、牙膏等含有的MPs颗粒或作为工业原料的塑料颗粒及树脂颗粒[24]. 而后者则是大型塑料垃圾经过热降解、光降解、化学降解等非生物或生物降解方式产生的塑料颗粒[25]. 目前大气中已发现的MPs部分来自于纺织衣物中的合成纤维[26]. 在纺织行业生产衣服的过程中会使用超细塑料纤维,它们通过直接或间接的方式释放到周围环境内[27-28]. 另外,在工业生产环境下,对合成材料进行切割等机械加工过程中也会产生超细颗粒. 自2019年底爆发新型冠状病毒疾病(COVID-19)以来,佩戴口罩已成为人们日常生活的常态. 据世界卫生组织相关数据显示,每月估计需8900万个医用口罩,并要求将制造量增加40%[29]. 随着全世界口罩的生产及消费的增加,环境中大量的塑料和塑料颗粒废物也可能随之增加,由此带来了新的环境挑战[30].
-
人体主要通过吸入、皮肤接触等方式暴露于气载MPs[31]. 在大气沉积物样品中发现的主要塑料成分有聚苯乙烯(polystyrene, PS)、聚乙烯(polyethylene, PE)、聚丙烯(polypropylene,PP)、聚氯乙烯(polyvinyl chloride, PVC)、聚对苯二甲酸乙二醇酯(polyethylene terephthalate, PET)、聚碳酸酯(polycarbonate, PC)以及其他未表征的塑料(图2)[23]. MPs形态各异,如碎片、纤维、颗粒等[24]. 国内学者从东莞大气尘埃中收集到的样本和其他可疑MPs的化学成分中发现:纤维状微塑料比例最高(73%),检测到的非纤维状微塑料中有PE(14%),PP(9%)和PS(4%)[17]. 国外学者对伦敦市中心MPs的采样结果显示,纤维状MPs占比17%,其中聚丙烯腈(polyacrylonitrile, PAN)丰度最高(67%),其次是PET(19%)和聚酰胺(polyamide, PA)(9%),另外5%被归类为“其他”如PP等. 在非纤维MPs中,鉴定出8种合成聚合物:PS、PP、PE、PET、聚氨基甲酸酯(polyurethane, PUR)、PVC、丙烯酸聚合物和聚合石油树脂. 其中,PS在非纤维MPs中占比最高,约19%[32]. 此外,塑料本身也是一种污染载体,疏水性的特性使其易负载有害物质. Ashton等[33]在街道灰尘微塑料样品中检测到了 Cd、Cr、Cu、Zn 等重金属元素. 海洋和陆地土壤中的MPs除了能负载重金属元素外,还可附着多氯联苯、多环芳烃等持久性有机污染物(persistent organic pollutants, POPs)[34]. 气载微塑料是否吸附POPs发挥复合暴露毒性,从而对生物体和环境产生不良影响尚缺乏相关研究.
对于MPs的定量检测方法主要采用显微镜检;定性检测主要采用傅立叶红外光谱法(FT-IR)、拉曼光谱法及 Pyr-GCMS热解析气相色谱(图2). 首先通过光谱成像显微镜检测样品得到红外成像光谱,然后将其与光谱数据库进行比对,然后通过极精细的空间分辨率快速扫描识别待检样品的表面材料成分[35]. FPA - µFTIR成像光谱显微镜作为最先进的检测仪器之一能检测到的MPs粒径为11 μm[36]. 最近,我国有研究团队基于短波长可见激光探测样品IR吸收区域的光热效应,通过mIRage O-PTIR(Optical Photothermal Infrared)显微光谱仪建立了极具突破性的新型MPs表征方法,此仪器拥有亚微米空间分辨红外光谱系统,可识别出1—10 μm的MPs和400—1000 nm的NPs [37]. 由于方法本身的限制及MPs颗粒入人肺后检测的复杂程度,使得当前技术无法完全准确测量空气中MPs的含量及入人肺的数量,所以有关大气中MPs的内暴露数据十分有限 [38]. 至今,我国和美国职业安全与健康管理局(Occupational Safety and Health Administration, OSHA)均尚未在有毒和有害空气污染物相关标准中对空气中微米及纳米级的塑料颗粒设置职业暴露阈值[39]. 未来,在MPs的检测层面上,应加强技术攻关,联合各方优势来克服对小尺寸MPs颗粒的表征难题,以更好的了解MPs在大气环境中及在人肺中的暴露情况.
-
沉积率和清除率是影响气载MPs对人体吸入毒性潜在风险的重要因素[14]. 总悬浮颗粒物(total suspended particulate,TSP)是对漂浮在空气中的固态和液态颗粒物的总称,其粒径范围约为0.1—100 μm;通常把粒径在10 μm以下的颗粒物称为可吸入颗粒物,又称PM10,它们的长期累积会增加患呼吸系统疾病的风险,如气促、咳嗽、诱发哮喘、慢性支气管炎、慢性肺炎等[40]. 此外,人体生理及肺解剖学特征也影响着可吸入颗粒物在肺部的沉积. 气溶胶指悬浮在气体中的液体或固体颗粒,在气溶胶吸入研究过程中:颗粒的大小和可吸入性是研究者需主要考虑的因素[41]. 呼吸系统与外界相通,可吸入颗粒物在肺部的沉积作用主要取决于颗粒的空气动力学直径,有研究表明:直径>5 μm的气溶胶颗粒物几乎不能被人体吸入或阻塞于上呼吸道,<5 μm的气溶胶颗粒物可进入细支气管和肺泡,而<2.5 μm的气溶胶颗粒物几乎全部进入到肺泡内(图3)[42]. 可吸入颗粒物进入呼吸系统后可通过持续纤毛运动、肺泡巨噬细胞吞噬和迁移作用、淋巴转运及打喷嚏等方式得到一定的清除[6]. 由于肺泡表面积大(约150 m2),组织屏障薄于<1 μm的特性使得纳米颗粒吸入后更易穿透毛细血管进入呼吸系统并通过血液循环和淋巴系统等其它途径遍布全身[43]. 目前,颗粒物经吸入进入呼吸系统后,随呼吸具体吸入及呼出多少及最终沉积在肺部的量还有待研究.
由于MPs具有粒径小、比表面积大、物化性质稳定、形态各异等特征,使其可在环境中难以降解而长期存在[44]. 研究发现长度为15—20 μm的纤维不能从肺部得到有效的清除,0.3—10 μm的纤维具有潜在致癌性[45]. 早前已有研究者在人肺中发现了长达250 μm,宽约50 μm的吸入性塑料纤维[46]. 2019年Vianello等[35]建立呼吸模型模拟人体在室内环境暴露于气载MPs的研究证明,从事轻度活动的普通男性在24h内约吸入272颗MPs. 2020年,Zhang等[47]通过独创的定量方法分析了从12个不同国家采集到的286个室内灰尘样本,数据分析显示人体吸入PET-MPs达360—150000 ng ·(kg·d)−1,PC-MPs达0.88—270 ng·(kg·d)−1.
此外,大气中存在的MPs很可能成为可吸入颗粒物中的一部分,它们通过吸入的方式对人类健康造成潜在威胁. 而目前,除通过经修正的生态风险评估(Risk Index, RI)模型来评估气载MPs的生态潜在风险外,尚无其他模型对其进行准确的风险评估[48]. 因此,与MPs吸入相关的健康风险是十分值得关注的重要科学问题.
式中,RI:潜在生态风险指数,T1:MPs聚合物的化学毒性系数,C1:Ci(实测MPs聚合物丰度)与C0(背景MPs聚合物丰度)之比.
MPs吸入的沉积与清除过程不仅与颗粒沉积模式、呼吸道解剖特征等因素密切相连,还与其暴露丰度、暴露持续时间以及自身化学物组成类型等有关. 然而当前, 气载MPs在人体呼吸系统内与真实沉积相关的内暴露数据尚空缺,有待加强人群研究来明确人体可吸入气载MPs的尺径范围及定量可沉积在肺部的MPs颗粒来为其风险评估提供支持.
-
人体呼吸系统包括呼吸道和肺两大部分,其主要功能是进行气体交换. 呼吸道包括鼻、咽、喉、气管和各级支气管. 其中鼻、咽、喉为上呼吸道;气管和各级支气管为下呼吸道. 肺由肺实质(支气管树和肺泡)以及肺间质(结缔组织、血管、淋巴管、淋巴结和神经)组成. 空气中的超细颗粒和非矿物纤维可穿过管腔或通过清除机制而作为吸入异物停留在肺中,这些异物通过影响正常的降解作用继而可能诱发炎症[46].
生物体吸入MPs后可引起呼吸道粘膜及肺组织产生局部生物反应. 有研究在人的肺部样品中检测到了微量塑料纤维,并猜测此纤维与肺部恶性肿瘤间存在着相关关系[49]. 在Song等[50]进行的一组病例报告中,8名工人暴露于弥漫聚丙烯酸酯混合物的工作环境5—13个月后,均因出现呼吸急促,胸腔积液,肺纤维化,异物肉芽肿和低氧血症等症状入院. 经一系列临床检查,患者肺组织中均出现炎症、纤维化和胸膜异物肉芽肿等不良症状. 通过透射电子显微镜在肺部观察到了30 nm的颗粒,同时在胸腔积液中也观察到了颗粒沉积现象[50]. 另外,Atis等[51]对生产加工塑料袋的工人和纺织工人进行健康检查发现,与对照组未暴露在工厂环境的人相比,受试工人支气管周围出现了增厚和弥漫性玻璃样变,同时受试组工人出现呼吸道症状的风险增加了3.6倍且血清中IL-8 和 TNF-α水平显著升高. 工厂环境中弥漫的PP团簇物经扫描电子显微镜检测到其直径为(6.9 ± 2.1)μm,长度为(96.7 ± 35.2)μm. 由于该物质空气动力学直径≤ 10 μm,故PP团簇物可能是工人在纺织制造过程中吸入的物质之一. 另外有研究指出:纤维状PP的直径取决于制造工艺,单丝纱线可以从153 μm分解到1—5 μm不等的超细纤维[52]. 由此可见,弥漫在空气中的MPs可对机体呼吸系统产生一定的损伤作用. 职业暴露是气载MPs成为健康风险的重要方式之一,今后应加强对塑料制厂、纺织工厂等的环境检测以及严格履行对工人的定期例行健康检查来做到早发现、早预防以减少环境暴露对人健康的负面影响.
早在2012年,Varela等[53]在体外将PS-NPs(polystyrene-Nanomicroplastic, PS-NPs)作用于腺癌人类肺泡基底上皮细胞(A549)的研究表明,NPs能被吸收,其吸收率取决于颗粒大小,40 nm PS-NPs的内化速度快于20 nm、100 nm PS-NPs. 但NPs与肺泡上皮细胞相互作用的机制及其内化后的潜在不良影响未得到很好的理解,故需进一步研究. Dong等[54]在调查MPs对肺毒性的研究发现,人正常肺上皮细胞(BEAS-2B)暴露于10 μg·cm−2和1000 μg·cm−2 浓度下(1.72 ± 0.26) μm (1.67—2.17 μm)的PS-NPs后紧密连接蛋白(zona occludens protein 1,ZO-1)表达下降、跨上皮电阻(transepithelial electrical resistance, TEER)降低,导致气道上皮通透性变差从而使得肺屏障功能受损. 因此,外来物质和毒素更容易进入间质及血液中,从而增加了患肺部炎症及慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)的风险. 此外,其它研究团队也发现PS-NPs会破坏肺泡上皮屏障而影响正常肺功能[55].
在模式生物体内,Lim等[56]发现MPs暴露对生物呼吸系统具有潜在损伤作用,他们对大鼠进行连续14 d全身动态吸入100 nm PS-MPs后观察到雄性大鼠的吸气时间明显减少;雌性大鼠呼吸频率增快,吸气时间和呼气时间均减少的肺功能不良症状. 最近,有研究团队在正常和哮喘模型小鼠鼻腔内每3 d滴注300 μg·20 μL−1 MP,连续24 d后发现两组动物均出现肺部炎性细胞浸润、支气管内肺泡巨噬细胞聚集、支气管肺泡灌洗液 (bronchoalveolar lavage fluid, BALF) 中 TNF-α 水平升高,以及正常小鼠组血浆 IgG1 产生增加;此外,MP暴露通过增加粘液产生和炎症细胞浸润以及促进巨噬细胞聚集来加重哮喘症状[57].
-
尽管近几年才日益对大气环境中存在的MPs引起关注,但其吸入毒性研究已有相关报道. 基于研究指出气载MPs致机体呼吸系统具有损伤作用,本文接下来将以具体的机制为着眼点,从氧化损伤、炎症反应、细胞周期紊乱和细胞凋亡的4个方面分别进行阐述.
-
活性氧(reactive oxygen species, ROS)是由具有活性氧功能的基团物质组成,包括超氧阴离子、羟自由基、过氧化氢及其下游产物过氧化物和羟化物等[58],ROS的急剧增多可破坏肺组织细胞,导致中性粒细胞发生炎性浸润,蛋白酶分泌增多等不良作用[59-60]. 研究者对(1.72 ± 0.26) μm (1.67—2.17 μm) 聚苯乙烯微塑料颗粒(PS-MPs)的体外肺毒性研究发现:PS-MPs通过诱导ROS的形成对BEAS-2B产生了细胞毒性和炎症效应[54]. 当BEAS-2B细胞暴露于高剂量的PS-MPs(1000 μg·cm−2)时,大量ROS的形成抵抗了细胞抗氧化酶能力而发生了氧化应激. 其机制可能与IL-8、IL-6表达水平的增高,释放相关细胞因子有关. Shi等[61]在A549细胞中进行PS-MPs与邻苯二甲酸酯联合暴露的毒性研究也发现PS-MPs可通过抵抗细胞内抗氧化酶的活性而引起氧化应激. 氧化酶和抗氧化酶的失衡导致氧化应激损伤,这可能在MPs致肺部疾病中发挥着潜在作用[59-60,62].
有研究指出在酚醛树脂(phenol-formaldehyde resin microplastic, PF)的制造、应用、加工等过程中,会将大量粒径小于10 μm的PF微塑料微粒(PF-MPs)释放到空气和其他环境介质内[63]. 据报道,研磨车间环境中的PF-MPs浓度高达153.6 mg·m−3. 考虑到在该车间工作的职业人群在PF-MPs环境中暴露的可能性大, Zhu等[64]采集了来自不同公司的5个PF-MP样本,其平均直径分别为12.13、14.61、14.20、13.52、12.61 μm并在太阳光模拟照射下对它们的氧化潜力(oxidative potential, OP)进行评估,以通过PF-MP在阳光照射下产生的环境持久性自由基(environmentally persistent free radicals , EPFRs)和ROS浓度来衡量OP与PF-MP活性成分之间的相关性及其潜在毒性影响. 此外,使用A549细胞评估了光老化对PF-MP细胞毒性的作用,以进一步了解对人类健康的潜在不利影响. 该研究指出,长期暴露在光照辐射下,1000 μg·mL−1浓度的PF-MPs可明显增加A549细胞ROS的产生并降低其细胞活力来增强细胞毒性[64]. 在PS-MPs与人肺泡腔室细胞的生物反应差异性的研究中,将25 μg·mL−1浓度下50 nm和100 nm的PS-MPs悬浮液分别染毒Ⅰ型肺泡上皮细胞、Ⅱ型肺泡上皮细胞和肺泡巨噬细胞24 h后观察到GSSG / GSH比率(氧化型谷胱甘肽与还原型谷胱甘肽的比率)上调,激活了氧化应激的发生,进而诱导了炎症,其中巨噬细胞中ROS表达水平低于Ⅰ型肺泡上皮细胞和Ⅱ型肺泡上皮细胞[65]. 除此, Kim等[66]以秀丽隐杆线虫和斑马鱼为模式生物,结合转录因子RNAi筛选、AOP Wiki(http://aopwiki.org)和CTD(comparative toxicogenomics database)分析方法进行基因-疾病相互作用分析,揭示了过氧化物酶体增殖物激活受体γ失活导致肺纤维化在微塑料对人类健康影响过程中可能发挥着重要作用. 近期,有研究通过微阵列检测,获得了正常BEAS-2B细胞和7.5 μg·cm−2、30 μg·cm−2 40 nm PS-NPs处理BEAS-2B细胞之后的差异表达基因并通过功能分析预测到PS-NPs处理组的差异表达基因在氧化还原酶活性和转录调控方面呈显著富集,这可能在呼吸系统疾病的发病过程中发挥着作用[55].
氧化应激涉及的通路主要包括:Kelch样环氧氯丙烷相关蛋白1-核因子E2 相关因子2-抗氧化反应序列元件(Keap1-Nrf2-ARE) 通路、磷脂酰肌醇-3-激酶/蛋白激酶 B(PI3K/Akt)通路、丝裂原蛋白活化激酶(MAPK)信号通路家族、酪氨酸蛋白激酶/信号转导和转录活化子 (JAK/ STAT)信号通路、Toll 样受体(TLRs)信号通路、核因子(NF)-κB 信号通路、Wnt信号通路等[67]. 它们也可能是气载微塑料通过氧化应激对机体产生不良健康影响的潜在机制,这有待研究者进行深入研究.
-
炎症在肺部疾病的发生发展过程中起着重要作用. 有关气载微塑料的体内动物研究显示,将受试大鼠暴露于不同浓度剂量的100 nm PS-MPs中发现,TGF-β和促纤维化的TNF-α蛋白水平上升[56]. 早在20年前,Brown等[68]对空气中PM 10的研究就已发现,气管滴注1 mg的64 nm、202 nm、535 nm PS-MPs于大鼠肺部后,64 nm PS-MPs相较于其它两种粒径PS-MPs,支气管肺泡灌洗液中的蛋白质浓度和乳酸脱氢酶含量水平呈显著上升趋势,肺内嗜中性粒细胞水平也显著增加,这提示着粒径越小的超细颗粒可能会引起更严重的炎症反应. 在另外一项体外细胞实验发现[54]:当BEAS-2B细胞暴露于(1.72 ± 0.26) μm (1.67—2.17 μm)粒径范围内10 μg·cm−2和1000 μg·cm−2的PS-MPs环境中24 h后,IL-6在细胞中的表达水平明显升高. BEAS-2B细胞暴露在浓度1000 μg·cm−2的PS-MP环境中24 h后,IL-8表达水平也呈增高趋势. 这与Xu等[69]利用不同尺寸、浓度的PS对A549细胞进行的毒性研究所发现的结果一致,PS-MPs诱导促炎性细胞因子:IL-8和TNF-α表达的上升. 这些改变的细胞因子值得关注,今后的研究可以此作为依据和基础,进行深入探讨.
肺泡巨噬细胞在维持肺部内环境稳定和防御外来大气污染物危害等方面发挥着重要功能,其发挥吞噬功能后可释放包括白介素在内的具有广泛生物活性的各种致炎细胞因子,进而参与组织损伤、水肿等多种炎症过程[70]. Ruenraroengsak等[65]的研究指出25 μg·mL−1浓度下50 nm PS-MPs通过激活肺泡Ⅱ型上皮细胞和肺泡巨噬细胞,释放了IL-6和IL-8,使得IL-6、IL-8水平显著上升产生炎症效应. IL-6、IL-8能激活免疫系统,参与急性免疫反应[71],并且在COPD的发生发展过程中发挥着一定的作用[72-73].
炎症反应在呼吸系统疾病中与肺损伤、肺纤维化及COPD等疾病的发生息息相关,NF-κB、MAPK、JAK/STAT、Toll样受体、NLRP3炎症小体等信号通路在炎症因子释放上起着重要作用[74]. 目前气载微塑料与炎症反应研究暂仅停留在表观效应上,尚未对潜在机制进行探讨. 在今后的研究中,可以从已观察到的效应水平作为着眼点,首先从经典的炎症机制作为起点,对气载微塑料致炎症反应进行寻因以知晓内在可能的潜在机制,来为预防气载微塑料可能造成的潜在不良影响提供针对性的干预支持.
-
细胞周期与多种生命活动的正常运行密切相关,如信号传导、基因转录、细胞凋亡、DNA修复、细胞分化等. 它可调控蛋白降解,控制细胞周期内一系列生物活动. 细胞周期紊乱可影响细胞生长、复制、分裂等. 有研究者将A549细胞暴露于100 μg·mL−1浓度下的1 μm和10 μm PS-MPs后发现:细胞活力和增殖能力均显著降低[75].
据报道称PS-MPs诱导细胞发生ROS和不平衡的氧化还原反应可导致DNA、脂质、蛋白质和细胞器的过氧化[76]. DNA过氧化可通过碱基切除修复来延缓细胞周期,从而增加cyclin D、cyclin E、Ki-67的表达[77]. 细胞周期从G1期进入到S期需要cyclin D和cyclin E的持续磷酸化得以实现[78]. 在Xu等[69]进行的细胞周期检测中发现25 μg·mL−1 25 nm、160 μg·mL−1 70 nm的PS-MPs均将细胞周期阻滞在S期,且cyclin D、cyclin E蛋白表达增加及在mRNA水平上出现了转录水平升高的现象. 除此以外,Ki-67是细胞增值的关键标志物,该研究结果发现Ki-67水平上调,在细胞周期G1、S、G2期中普遍表达而在G0期不表达,由此可见气载MP在肺部细胞暴露后可使细胞周期变长而细胞周期的改变往往和细胞恶性转化和肿瘤细胞失控性增殖关系密切,其潜在不良影响不容忽视;其中参与细胞周期运转的重要蛋白分子可能对细胞不良病变及在临床肿瘤防治过程中发挥着重要作用[79]. 此外,由于目前该方面的研究较少,且缺少微塑料与肺部恶性疾病间的临床研究数据,故需研究者进行后续探讨且思考现实意义.
-
细胞凋亡是细胞的一种基本生物学现象,受到多基因调控. 它在生物体进化、维持内环境稳定以及多个系统发育过程中都起着重要的作用. 在PS-NPs对人肺上皮细胞影响的初步研究中发现:25 μg·mL−1 25 nm、160 μg·mL−1 70 nm的PS-MPs除了诱导促炎细胞因子上调以外还可以以时间依赖性的方式促进凋亡蛋白BAX、Casepase-3、Casepase-8、Casepase-9及细胞色素c表达水平的显著上调,这提示PS-NPs可启动与TNF-a相关的凋亡路径[69]. Johnston等[80]在肝母细胞瘤C3A细胞系和肝癌HepG2细胞系的线粒体中检测到了PS-MPs, 且有研究指出NPs可以改变细胞质血小板中的钙水平[81]. 因此,PS-MPs在细胞质中可能损害线粒体的正常功能,引起线粒体表面Bax的单体化,诱导Ca2+内流和线粒体中细胞色素c外流,导致膜电位降低,ATP不足,从而激活下游的Casepase-9和Casepase-3,最终诱导线粒体发生凋亡. PS-MPs不仅可上调TNF-a和肿瘤坏死因子相关凋亡配体Death receptor 5 (Death receptor 5,DR5)的表达,而且PS-MPs对DR5下游的凋亡蛋白casepase-8、casepase-3、casepase-9均有上调作用,这提示着DR5介导的信号复合体可能参与着PS-MPs诱导细胞凋亡的过程. 另外,有研究者通过Annexin V-FITC/PI双染试剂在荧光显微镜下观察经0 μg·cm−2、7.5 μg·cm−2、15 μg·cm−2、30 μg·cm−2 40 nm PS-MPs染毒后的HPAEpiC和 BEAS-2B细胞发现:细胞凋亡的症状呈一定的剂量依赖性,随给药浓度的增加而显著增加[55].
细胞凋亡是一种特殊的细胞死亡类型,具有重要的生物学意义和复杂的分子生物学机制,凋亡过程的紊乱可能与许多疾病的发生发展有直接或间接的关系. 除了上述已发现的机制外,PS-MPs的直接免疫原性以及其诱导发生的炎症反应而破坏细胞膜的完整性进而导致细胞的进一步坏死可能也是肺部疾病发生发展的潜在机制之一,在后续研究中可对其深入研究.
-
MPs作为一种新型气载环境污染物,其来源广泛,形态各异. 现阶段研究对海洋和陆地中存在的MPs关注度较高,而对大气环境中的MPs研究甚少. 目前,对于MPs而言,尚缺乏系统的技术规范和环境评价体系. 因而迫切需要构建微塑料监测分析的标准化方法,包括MPs样品采集、分离、检测、量化技术. 由于检测技术的局限性,尚未能对小于400 nm的MPs进行准确表征. 即使通过扫描电子显微镜、mIRage O-PTIR能识别尺寸达纳米级的MPs,但检测范围仍有限. 在后续研究中,研究者应着力攻克小于400 nm MPs的检测技术.
随着越来越多的研究证实了大气中存在着MPs,人们又无时无刻不暴露于空气中,其潜在的健康风险值得大家关注. 当前已有的研究提示,MPs可通过氧化应激、诱导炎症、干扰细胞正常周期和细胞凋亡等机制,对呼吸系统造成潜在威胁,而这些研究侧重于表观效应的描述尚未对潜在的机制进行深入挖掘. 未来,研究者应在已有研究基础上,通过体内、体外和人群研究相结合的方式来对MPs潜在健康危害机理进行深入探索,以期为将来风险评估及危害防范提供科学依据.
此外,对于此领域的研究可重点关注:①通过人群研究摸清大气环境中的MPs在人体中的内暴露水平,进而评估研究气载MPs的现实意义,并为健康风险评估提供数据支持;②探讨不同粒径MPs的吸入暴露风险和健康危害效应以及着眼于生物毒性效应机制的探索;③关注MPs与其他环境污染物的复合暴露毒性效应与机制研究来增强对MPs暴露的全面认识.
气载微塑料对呼吸系统的影响及机制研究进展
Research progress on the effects and mechanisms of airborne microplastics exposure on the respiratory system
-
摘要: 近年来,号称“海中PM 2.5”的微塑料污染已成为全世界广泛关注的环境问题之一. 微塑料是一类新兴环境污染物,它的来源广泛、种类丰富、形态各异等特征使其可在水、土壤等环境介质中长期存在. 然而,有研究已检测到空气中也存在着微塑料. 大气环境中存在的微塑料不仅来源于纺织业、建筑工地、家具等,还可以来源于海洋. 存在于海洋中的微塑料可随季风运动继而悬浮于空气中,并在世界各地范围内广泛移动. 微塑料不仅本身具有一定的生物毒性,它还可携其它污染物构成复合污染. 由此可见,微塑料不仅可以通过食物链进入体内,微(纳米)塑料及其附着的有害物质还可通过吸入途径进入生物体内,从而对人类的健康构成潜在威胁. 由于该领域当前研究主要集中在海洋和陆地环境中存在的微塑料对生物体的毒性研究而对气载微塑料的研究大多仅仅停留在监测或其对生物体的表观效应上,尚缺乏气载微塑料对生物机体构成潜在健康风险的深入机制探索. 因此,本文依据大气环境中微塑料的相关研究报道,主要从大气环境中微塑料的来源与化学组成、主要类型和检测方法、气载微塑料致机体呼吸系统损伤作用、气载微塑料致呼吸系统疾病损伤机制四个方面对大气微塑料暴露对呼吸系统的影响进行综述探讨,并展望今后的研究重点和方向.Abstract: In recent years, the pollution of microplastics ("PM2.5 in the sea") has become one of the environmental issues of widespread concern all over the world. Microplastics are a kind of emerging environmental pollutants, the characteristics of the wide range of sources, rich types, and different shapes that make them long-lived in environmental media such as water and soil. However, some studies have detected the presence of microplastics in the air. The microplastics present in the atmospheric environment not only come from the textile industry, construction industry, furniture, etc., but also the microplastics existing in the ocean can float in the air with the movement of the monsoon and move widely around the world. Microplastics not only have certain biological toxicity, it can also form compound pollution by carrying other pollutants. For the reason that microplastics can not only enter the body through the food chain, but micro (nano) plastics and their attached harmful substances can also enter the organism through inhalation, thus posing the potential threats to human health. Since the current research to microplastics is mainly focused on the toxicity of microplastics existing in the marine and terrestrial environment, the majority of studies on airborne microplastics only focus on monitoring or just the effects on organisms, and there is still a lack of in-depth mechanism exploration of the potential health risks of airborne microplastics to biological organisms. Therefore, based on the relevant research reports of microplastics in the atmospheric environment, this article reviews the impact of atmospheric microplastics exposure on the respiratory system from four aspects: the source and chemical composition of microplastics in the atmospheric environment, the main types and detection methods, the damage effect of airborne microplastics on the respiratory system, and the mechanisms of airborne microplastics-induced respiratory damage, while envisaging the focus and direction for future research.
-
Key words:
- atmospheric environment /
- airborne microplastics /
- inhalation /
- injury /
- toxic effects /
- mechanism
-
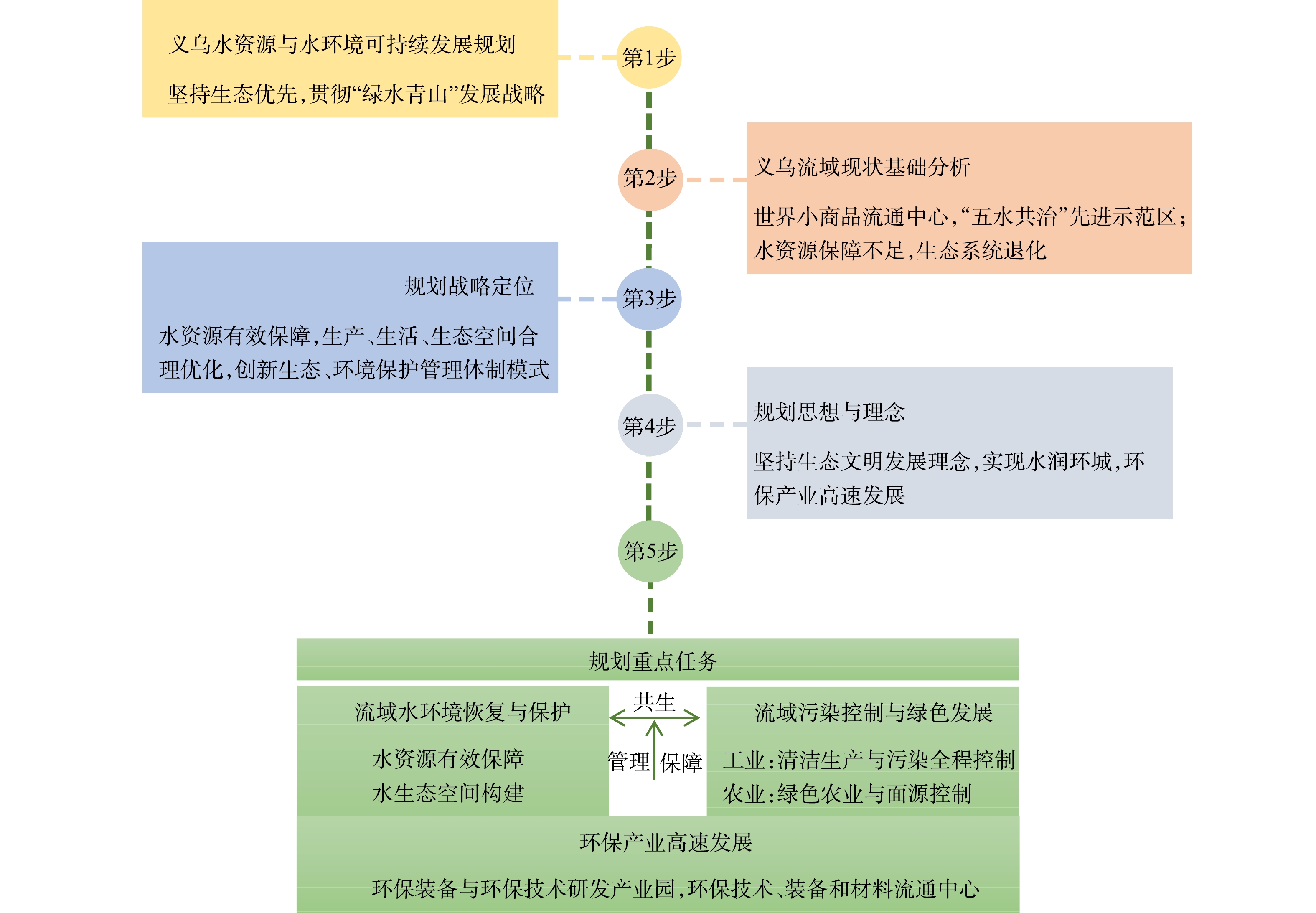
党的十八大以来,我国生态环境的改善初见成效、稳中向好,但部分区域形势仍然十分严峻[1]。义乌市是世界闻名的“小商品之都”、全球最大的小商品集散中心[2]。义乌市还是我国第一批新型城镇化综合试点地区。在经济发展的背后,产业与社会对水资源的需求逐步提高。全面提升水资源安全保障和水环境保护能力是义乌市生态环境保护工作的重心。
义乌市原本河网水系发达,水量充沛。但随着该市经济的高速发展,用水量急剧增大,水污染日趋严重。2013年11月29日,浙江省委十三届四中全会提出“五水共治”这一项重大战略政策,遵循协同理念治水,创新运用“五位一体”协同水管理模式、“河长制”与多样化的公众参与途径,实现了水环境质量的全面好转[3-4]。
本文系统总结义乌“五水共治1.0”(2013—2020年)实施以来取得的成果及工作中的难点与挑战,明确了水环境质量持续改善与水系统功能修复的核心目标,进而提出水环境与水资源可持续发展模式(“五水共治2.0”)的构建设想,提出为实现该目标应采取的举措,以及具体的工程布局,以期为义乌市“五水共治”工作的进一步推动提供参考。
1. 义乌市“五水共治”模式
1.1 “五水共治1.0”工程已取得的成果
2013年,治水工作启动时,义乌市水体的COD、总磷和氨氮浓度指标为地表IV类水标准,总氮浓度高于V类水标准,属于典型的水质型缺水城市特征。义乌市秉承“五水共治”理念,以浙中生态廊道建设为统领,以“河长制”为抓手,坚持“源头治理彻底、综合施策科学、设施运维常态、督查监管有力、水质达标全优”的目标,使得地表水水质在2014—2018年间逐步提高。总体上看,义乌市江干(支)流水质持续向好,供水能力增强,节水措施效果显著,洪涝灾害减少。截至2019年,义乌市供水总量达到2.92×108 m3·a−1,污水处理能力提高到54×104 t·d−1,全市8个县控及以上断面污染物浓度基本满足地表水Ⅲ类标准,义乌市域内饮用水水源地也基本满足城市自来水厂的供水需求。在此基础上,义乌市总结出了一系列宝贵的治水经验。例如,在规划管理上形成了“1+14+9+9”(1个总体规划,14个镇街主体责任,9个污染源头治理,9大保障机质)模式;在治水措施上,对污水处理厂进行提标改造,并实现市域污水厂的互联互通;配套建设城乡污水管网约4 000 km,基本实现义乌市污水收集全覆盖到义乌市管网连接,构建“一网九厂”;从7个污水处理厂的科学调度、“削峰填谷”到合理调蓄,实现“智慧排水”。由于出色地完成了“五水共治1.0”工作(见图1),义乌市多次荣获浙江省“五水共治”工作优秀县(市、区)大禹鼎。
1.2 义乌市“五水共治1.0”面临的挑战与难题
1)水质型饮用水短缺与水系统功能受损问题尚未解决。通过“五水共治”前期的治理,主要水体水环境质量得到较大改善,但水质与水生态系统现状仍不容乐观。首先,上游入境断面义东桥和城区退水断面塔下洲仍有3~4个月水质达不到地表水Ⅲ类标准,特别是2018年后水质出现反弹,与2017年对比,氨氮上升25.9%,总磷上升19.4%。其次,因治水工作长期忽视水生态系统的构建,现状建设用地无序扩张,导致生态空间结构和功能受损,连接度差,生态系统面积不断萎缩,多条河流断流,河岸植被覆盖率低,植被结构单一,景观破碎化严重。
2)管网污染严重、雨污分流系统尚未完善。地下管网渗漏问题、重厂轻网、污水收集效率低,是目前我国治水工作的难题[5]。2017年我国污水管网的整体外渗率达39%,城市黑臭区外渗率更是高达66%,为新加坡平均水平的6.6倍[6]。这些外渗的污水直接或间接进入地表水系统,使得“控源截污”这一水体治理核心措施不能发挥应有功效。义乌市地下管网渗漏情况尚不明确,城区97个小区中仍有42个未全面完成截污纳管与雨污分流,雨污分流不到位的住户占比约达40%。因此,如何快速高效地启动全市范围的地下管网普查工作,并制定地下管网系统修复计划是下一步的核心任务和一大难题。
3)农村水污染治理运维管理体系不够专业。在农村生活污水治理过程中,大部分地区的分散式生活污水处理设施是由村民进行维护管理的。由于管理人员对污水治理重要性的认识不足,使得一些污水处理设施运行维护管理水平较低,甚至有些设施处于“零管理”状态,影响了这些设施正常发挥污水治理作用。
4)治污工程能耗、药耗高,效益有待优化。义乌市政府在“五水共治”工程建设和运行方面已投入了大量的建设费用。前期工程已取得了较好的治理效果,但部分工程的工程效益欠佳,未做到效益最大化。由于质量控制和管理工作是工程发挥最大效益的前提,在实现能耗与药耗降低的同时必须保证质量达标。因此,“五水共治”工程后续建设应加强规范质量管理,确保治理达标的同时降低治理成本,以提高工程的效益。
5)流域监测体系以被动监测为主,尚未实现智能化。在水环境监测方面,当前水质监测采用人工采样监测方式,缺乏实时性,这可能导致发现污染滞后,加大治理难度。生态环境监测体系缺乏规范化和系统化布局,区域的环境监测体系不健全,缺乏完整的生态环境监测网络。目前,义乌市尚未建设数据库、管理平台等规范化、系统化的信息系统,尚未实现天地一体化实时监控和预警预报,管理基础较弱。
1.3 水资源与水环境可持续发展(“五水共治2.0”)模式的构建设想
义乌市“五水共治1.0”工作在排涝水、治污水、抓节水、防洪水和保供水5个方面成绩突出,解决了将黑水变为清水,基本解决了水污染问题。下一步治水工作的目标则应变为水资源管理,通过科学的分析、规划和管理,使水资源更好地支撑义乌市经济的可持续发展。
“2.0时代”,义乌市应持续践行两山理论,走可持续发展之路,坚持经济发展与生态环境两手抓,做到“知水”、“策水”、“懂水”、“控水”和“新水”。“知水”即从常规污染物控制走向风险污染物全面控制;“策水”即监测体系从被动监测转向主动预警;“懂水”即利用工程手段从全面控污转向精准控污;“控水”即工程实施效益从高能耗转向高效率;“新水”即在政府顶层设计层面将水治理转向智慧水管理。
“五水共治2.0”的总体思路分以下5个层面:1)从控污走向水生态保护,建立水生态平衡,恢复生态空间结构与功能;2)从去除常规污染物的提标改造,逐步转向风险污染物的控制;3)对管网渗漏问题进行全面排查,全力以赴补齐“雨污分流系统不完善”这一短板,最大限度挖掘雨水资源;4)通过招投标和严格的质量控制等有效手段,实现低成本和高效益产出;5)构建义乌市全网水质水量监测预警体系。“五水共治2.0”的技术路线见图2。
1.4 基于可持续发展方略的“五水共治2.0”的重点建设任务
1)以雨水为主线的多水源开发与风险防控。从水环境治理和水资源利用的长远角度来看,开展以雨水为主线的多水源开发与风险防控,在减轻义乌市排水系统和污水处理系统压力的同时,还可以实现优质饮用水的足量供应[7]。基于以上思路,对义乌市降雨在时间、空间上的水质水量进行研究,形成“三步走”雨水综合利用新模式:将义乌市境内地表雨水系统划分为人员活动少、开发强度低的可用区,人员活动密集、开发强度高的备用区,以及易产生高风险物质的风险区;在可用区内构建雨水导流与收集系统,在城市生活区融入海绵城市概念,在以岩口水库为代表的农村地区,因地制宜地制定雨水收集和利用方案,在风险区设置雨水调蓄处理设施,合理进行风险区生态系统规划;建设以地下水储备和水利枢纽再生水厂为核心的饮用水应急保障体系,扩大重大灾害条件下再生水供水来源[8-9]。
2)以污水为主线的管网收集系统实现低成本管控。义乌市水环境质量在多年治理中虽然得到大幅度的改善,但水质现状仍不容乐观,尤其在丰水期存在水质较差现象,其主要原因是雨污分流不彻底、管网漏损情况严重导致的污水收集率低。此外,污水处理厂提标改造后采用的膜技术并未从根本上解决进水中碳氮比较低导致的污染物去除效率低的问题,在丰水期情况更为严重[10]。未来,义乌市以污水治理为主线的治水工作重点有:基于地上河道两侧排口信息制定地下管网系统修复计划;在已有和新建的污水厂中引入新型污水处理工艺,以降低能耗,提高资源回收和水生态修复能力;构建“厂—河—网”一体的污水收集与低能耗污水处理模式,实现污染物的低成本管控。
3)构建以健康水生态系统为主线的塘、库、溪多类型梯级生态系统。在以湿地、河道和塘系统等为核心的水域空间,构建“沉水植物—浮水植物—水生动物”多层级水生态系统,恢复生物多样性。在以滨河缓冲净化带为核心的陆域空间,构建“复合式滨河缓冲净化带”,增强对面源污染的截流净化能力以及滨河缓冲带的生物多样性,恢复河道纳污承载力[11]。
4)搭建以智慧管控为主线的监测与预警平台。在入境和境内河流断面等处合理配置监测系统,实施常规监测与自动在线监控相统一的监测体系,并完善水环境监测和上游流域污染源监控体系[12];以提升水生态环境科学决策水平和创新水生态环境监管模式为核心,构建全景式水生态环境形势研判可视化系统;从水生态环境日常管理和污染应急处置两大方面,搭建水生态环境智慧化管理平台。
5)实现从国内生产总值(Gross Domestic Product,GDP)到生态系统生产总值(Gross Ecosystem Product,GEP)核算与考核的绿色转变。将GEP核算纳入义乌市水资源综合绩效,评估生态系统的生产总值、状况及变化。通过建立政府生态审计制度,对义乌市水资源管理进行监督,严格执行相关环境保护政策,加强生态环境管理。
2. “五水共治2.0”中的主要工程
1)水源地保护与水质提升工程。义乌市最重要饮用水水源地之一的岩口水库,其水质长期处于中度富营养化水平,易出现藻华现象,严重威胁居民饮用水安全[13]。针对此现象,须对全区进行污染风险分级划分,合理管控农耕施肥过程,对黄山溪、斯河溪2个入库溪流末端的湿地净化系统进行功能提升,恢复生态系统功能,搭建智慧化管理平台,保障及时预警与应急处置。这部分工程的主要内容见表1。
表 1 水源地保护与水质提升工程建议Table 1. Water source protection and water quality improvement project planning序号 工程名称 主要目标 1 上游农村污水管网评估 构建适合岩口区域的生活污水收集治理和资源化利用模式,完善渗滤液“收集—处置—达标排放”系统 2 农业面源多级屏障体系 建“农田排水沟—沟渠湿地—滞留回用塘/退耕还草/过滤草沟—功能湿地”多级屏障技术体系,实现区域面源污染源头消减和过程控制[14] 3 岩口水库生态治理 在岩口上游构建流域梯级生态水系格局,针对黄山溪、斯何溪、金傅宅溪和溪华溪4条主要入库溪流的关键区域进行河道生态结构优化 4 智慧化平台构建与保护区优化 把保护区划分为库区、入库支流和陆域3个部分,在入库关键节点处设置水质和水量的实时在线监测设备,优化与保障库区内水质 2)初雨控制与关键区域低影响开发工程。根据城市不同地区雨水径流水质水量特征,建议采取雨水径流污染与资源化协同的管控和利用模式,同时识别流域面源污染发生的关键源区,有序构建“源—流—汇”空间系列化防控工程。这部分工程的主要内容见表2。
表 2 初雨控制与关键区域低影响开发工程建议Table 2. Initial rainfall control and low impact development project planning in key areas序号 工程名称 主要目标 1 雨污分流与雨水资源利用评估 对已完成的雨污分流区进行效果评估,对城市不同功能及开发地块的雨水资源潜力评估,提出雨水径流污染与资源化协同的管控和利用模式 2 面源污染风险与湖周生态保护 评估影响城市面源污染的地表沉积物累积状况和综合径流产生能力,在湖周建设开发区设计相应海绵设施的类型、面积以及布局,制定分期流域水污染防治工程方案[15] 3)管网排查与污水系统优化工程。对管网漏损和雨、污管道错接漏接情况进行全面摸排,完善地下管网系统。建议从源头上对水环境健康与风险污染物进行管控,构建义乌市污水治理“水量—水质—污泥”的平衡调控与污水资源再利用体系。这部分工程的主要内容见表3。
表 3 管网排查与污水系统优化工程建议Table 3. Pipeline network investigation and sewage system optimization project planning序号 工程名称 主要目标 1 管网普查优化与数字化监控 对义乌市地下管网系统进行全面普查及优化改造,构建全市地下管网GIS系统,建立数字化管网新模式 2 风险污染物管控与城市饮用水应急保障 开展全流域风险污染物监测与评估工作,构建城市饮用水应急保障体系,建设双江水利枢纽再生水应急水厂 3 污水收集与再生处理 引入新型污水处理技术,形成“厂—河—网”一体的污水收集与低成本、灰绿结合的村镇污水基础设施建设与运管技术,重构污水处理厂水质提升与再生利用技术路径,实现城乡水系统协同优化与精准管控 4)流域典型水系生态修复工程。随着义乌市“五水共治”工作重心由污染控制逐渐转向水生态修复,基于中国科学院生态环境研究中心(义乌)长三角中心提出的以“源头控制—水系生态修复—智慧测水管水”为主体的水系生态修复思路和对策,建议启动污染源调查评估、连通水系与生态修复、智慧化平台搭建等工程,具体内容见表4。
表 4 流域典型水系生态修复工程建议Table 4. Ecological restoration project planning of typical water systems in the basin序号 工程名称 主要目标 1 污染源调查评估 对流域内典型水系分区进行污染源调查,并对点源、面源污染源污染负荷进行量化核算,对水系污染现状和降解能力现状进行评估 2 连通水系与生态修复 全力打造“百川东到海、路路皆通达”的畅通格局,构建“沉水植物—浮水植物—水生动物多层级水生态系统”水域空间、“复合式滨河缓冲净化带”陆域空间 3 智慧化平台搭建 在流域典型水系关键节点设置水质和水量的实时在线监测设备,实现水库管理相关部门对入库水体的综合管控,保障库区内水质安全 5)双江水利枢纽水资源保障与景观综合提升工程。义乌市双江水利枢纽工程以供水、防洪为主,结合改善生态环境,兼顾灌溉、航运、发电等综合利用。该枢纽工程丰水期库区氨氮和总磷浓度较高,有诱发蓝藻水华爆发的风险。依据中国科学院生态环境研究中心(义乌)长三角中心提出了外源污染控制、内源底泥污染削减、与藻华应急管控措施的双江水利枢纽水生态环境综合治理思路,建议对库区进行水质风险划分,并构建水质综合保障方案。这部分工程的主要内容见表5。
表 5 双江水利枢纽水资源保障与景观综合提升工程建议Table 5. Water resources guarantee and landscape comprehensive improvement project planning of Shuangjiang water control project序号 工程名称 主要目标 1 构建湖周生态保护圈层与库区净化系统 在湖周采用海绵城市建设手段,设计相应海绵设施的类型、面积以及布局,同时构建库区湿地—缓冲带净化系统,降低库区外源污染负荷的输入 2 淤泥疏浚及资源化利用工程 进行底泥疏挖、底泥脱水、余水处理及底泥的资源化利用等综合淤泥疏浚与利用综合方案设计 3 构建水质监测预警智慧决策平台与应急处置 针对库区内、外源污染负荷,打造环境立体监测网络,建立环境智慧决策系统和针对极端水质情况下的应急处置—多功能澄清塘+陶粒坝应急处置工程 3. 与“五水共治2.0”相适应的工程管理模式
1)建立新理念下的智慧化管理平台。浙江省政府推出的“互联网+智慧水务”管理平台,实质性地破解了“五水共治”项目的统筹管理难题[16]。义乌市按照智慧城市建设的总体部署,以水务智慧化带动水务现代化,建成由点(水源地、取用水户、入河排污口等)、线(河流、水功能区、供排水管网等)、面(行政区、水资源分区和地下水分区等)组成的网络体系;从生态环境日常管理和污染应急处置两大方面,集水质水量水处理一体化,综合雨水、污水、地下水、供水与污水处理,搭建生态环境智慧化管理平台。在岩口水库等饮用水源地设置饮用水源监测点位,并布设水质自动监测站;在东青溪、青口溪、洪溪、东溪和航慈溪等入江的河流布设例行监测点位,监测水环境质量标准中的24项常规指标;在污染较重的铜溪、东青溪、六都溪等3条河流入江口布设水污染物通量监测点位,并开展生物多样性监测,按季度监测并评价水源区和缓冲区生态质量和生物多样性状况。
2)环保产业园建设与产业经济规划。进入“十三五”以来,我国环保产业步入新的发展阶段[17]。义乌市应立足于当地产业发展状况,开展环保产业园建设与产业经济规划工作,以便对现有产业园区进行环保生态化改造。总体思路有以下3个层面:①致力于创新产业园管理机制,实现与工程中心共生共赢的经济循环关系;②着重于发展先进环保技术、装备、产品和服务;③专注于环保领域的产业集聚,打造一个创业环境优良的产业生态圈。具体来说,可在义乌市现有工厂或企业间建立“生产者—消费者—分解者”的循环途径,寻求物质闭环循环、能量多级利用和废物产生最小化;还可将环保产业园打造为国内环保产业质量管理体系认证中心、中小微环保企业孵化中心、环保产业技术联盟共享中心,重点建设“国家环保产业示范基地”、“义乌市知识产权示范园区”。
3)立创新型环境评估体系。探索建立生态文明建设目标评价考核制度,实施GDP和GEP双核算制度[18]。在此制度下有效划分各级政府、各部门在经济调节、资源环境监管和公共服务方面的主要职责,逐步完善干部政绩考核制度和评价标准体系,实行领导责任制和资源环境问责制。在标准不低于省级基础上,根据各镇街的实际情况研究制定本区域内考核办法,强化现有考核指标体系设有的四大类指标(经济发展、资源环境、人民生活、社会进步)的资源环境比重。
-
-
[1] BORRELLE S B, RINGMA J, LAW K L, et al. Predicted growth in plastic waste exceeds efforts to mitigate plastic pollution [J]. Science, 2020, 369(6510): 1515-1518. doi: 10.1126/science.aba3656 [2] REDONDO-HASSELERHARM P E, FALAHUDIN D, PEETERS E T H M, et al. Microplastic effect thresholds for freshwater benthic macroinvertebrates [J]. Environmental Science & Technology, 2018, 52(4): 2278-2286. [3] KIRAN B R, KOPPERI H, VENKATA MOHAN S. Micro/nano-plastics occurrence, identification, risk analysis and mitigation: Challenges and perspectives [J]. Re/Views in Environmental Science and Bio/Technology, 2022: 27;2735. [4] GEYER R, JAMBECK J R, LAW K L. Production, use, and fate of all plastics ever made [J]. Science Advances, 2017, 3(7): e1700782. doi: 10.1126/sciadv.1700782 [5] YANG D Q, SHI H H, LI L, et al. Microplastic pollution in table salts from China [J]. Environmental Science & Technology, 2015, 49(22): 13622-13627. [6] GALLOWAY T S, COLE M, LEWIS C. Interactions of microplastic debris throughout the marine ecosystem [J]. Nature Ecology & Evolution, 2017, 1: 116. [7] UNITED NATIONS ENVIRONMENT PROGRAMME. UNEP year book: Emerging issues in our global environment [R]. Nairobi, Kenya, 2014. [8] ZHU K C, JIA H Z, ZHAO S, et al. Formation of environmentally persistent free radicals on microplastics under light irradiation [J]. Environmental Science & Technology, 2019, 53(14): 8177-8186. [9] LU L, WAN Z Q, LUO T, et al. Polystyrene microplastics induce gut microbiota dysbiosis and hepatic lipid metabolism disorder in mice [J]. Science of the Total Environment, 2018, 631/632: 449-458. doi: 10.1016/j.scitotenv.2018.03.051 [10] LUO T, WANG C Y, PAN Z H, et al. Maternal polystyrene microplastic exposure during gestation and lactation altered metabolic homeostasis in the dams and their F1 and F2 offspring [J]. Environmental Science & Technology, 2019, 53(18): 10978-10992. [11] QIAO R X, SHENG C, LU Y F, et al. Microplastics induce intestinal inflammation, oxidative stress, and disorders of metabolome and microbiome in zebrafish [J]. Science of the Total Environment, 2019, 662: 246-253. doi: 10.1016/j.scitotenv.2019.01.245 [12] LÖNNSTEDT O M, EKLÖV P. Environmentally relevant concentrations of microplastic particles influence larval fish ecology [J]. Science, 2016, 352(6290): 1213-1216. doi: 10.1126/science.aad8828 [13] ZHANG Y L, GAO T G, KANG S C, et al. Importance of atmospheric transport for microplastics deposited in remote areas [J]. Environmental Pollution, 2019, 254: 112953. doi: 10.1016/j.envpol.2019.07.121 [14] PRATA J C. Airborne microplastics: Consequences to human health? [J]. Environmental Pollution, 2018, 234: 115-126. doi: 10.1016/j.envpol.2017.11.043 [15] AMATO-LOURENÇO L F, CARVALHO-OLIVEIRA R, JÚNIOR Jr, et al. Presence of airborne microplastics in human lung tissue [J]. Journal of Hazardous Materials, 2021, 416: 126124. doi: 10.1016/j.jhazmat.2021.126124 [16] ZHU X, HUANG W, FANG M Z, et al. Airborne microplastic concentrations in five megacities of northern and southeast China [J]. Environmental Science & Technology, 2021, 55(19): 12871-12881. [17] CAI L Q, WANG J D, PENG J P, et al. Characteristic of microplastics in the atmospheric fallout from Dongguan City, China: Preliminary research and first evidence [J]. Environmental Science and Pollution Research International, 2017, 24(32): 24928-24935. doi: 10.1007/s11356-017-0116-x [18] DRIS R, GASPERI J, ROCHER V, et al. Microplastic contamination in an urban area: A case study in Greater Paris [J]. Environmental Chemistry, 2015, 12(5): 592. doi: 10.1071/EN14167 [19] DRIS R, GASPERI J, SAAD M, et al. Synthetic fibers in atmospheric fallout: A source of microplastics in the environment? [J]. Marine Pollution Bulletin, 2016, 104(1/2): 290-293. [20] COX K D, COVERNTON G A, DAVIES H L, et al. Human consumption of microplastics [J]. Environmental Science & Technology, 2019, 53(12): 7068-7074. [21] ALLEN S, ALLEN D, PHOENIX V R, et al. Atmospheric transport and deposition of microplastics in a remote mountain catchment [J]. Nature Geoscience, 2019, 12(5): 339-344. doi: 10.1038/s41561-019-0335-5 [22] FOURNIER S B, D'ERRICO J N, ADLER D S, et al. Nanopolystyrene translocation and fetal deposition after acute lung exposure during late-stage pregnancy [J]. Particle and Fibre Toxicology, 2020, 17(1): 55. doi: 10.1186/s12989-020-00385-9 [23] EVANGELIOU N, GRYTHE H, KLIMONT Z, et al. Atmospheric transport is a major pathway of microplastics to remote regions [J]. Nature Communications, 2020, 11: 3381. doi: 10.1038/s41467-020-17201-9 [24] DERRAIK J G B. The pollution of the marine environment by plastic debris: A review [J]. Marine Pollution Bulletin, 2002, 44(9): 842-852. doi: 10.1016/S0025-326X(02)00220-5 [25] BRDLÍK P, BORŮVKA M, BĚHÁLEK L, et al. Biodegradation of poly(lactic acid) biocomposites under controlled composting conditions and freshwater biotope [J]. Polymers, 2021, 13(4): 594. doi: 10.3390/polym13040594 [26] AKHBARIZADEH R, DOBARADARAN S, AMOUEI TORKMAHALLEH M, et al. Suspended fine particulate matter (PM2.5), microplastics (MPs), and polycyclic aromatic hydrocarbons (PAHs) in air: Their possible relationships and health implications [J]. Environmental Research, 2021, 192: 110339. doi: 10.1016/j.envres.2020.110339 [27] SALVADOR CESA F, TURRA A, BARUQUE-RAMOS J. Synthetic fibers as microplastics in the marine environment: A review from textile perspective with a focus on domestic washings [J]. Science of the Total Environment, 2017, 598: 1116-1129. doi: 10.1016/j.scitotenv.2017.04.172 [28] NAPPER I E, THOMPSON R C. Release of synthetic microplastic plastic fibres from domestic washing machines: Effects of fabric type and washing conditions [J]. Marine Pollution Bulletin, 2016, 112(1/2): 39-45. [29] WHO. Advice on the use of masks in the community, during home care and in health care settings [EB]. [2020-06-29]. [30] FADARE O O, OKOFFO E D. Covid-19 face masks: A potential source of microplastic fibers in the environment [J]. The Science of the Total Environment, 2020, 737: 140279. doi: 10.1016/j.scitotenv.2020.140279 [31] ENYOH C E, VERLA A W, VERLA E N, et al. Airborne microplastics: A review study on method for analysis, occurrence, movement and risks [J]. Environmental Monitoring and Assessment, 2019, 191(11): 668. doi: 10.1007/s10661-019-7842-0 [32] WRIGHT S L, ULKE J, FONT A, et al. Atmospheric microplastic deposition in an urban environment and an evaluation of transport [J]. Environment International, 2020, 136: 105411. doi: 10.1016/j.envint.2019.105411 [33] ASHTON K, HOLMES L, TURNER A. Association of metals with plastic production pellets in the marine environment [J]. Marine Pollution Bulletin, 2010, 60(11): 2050-2055. doi: 10.1016/j.marpolbul.2010.07.014 [34] HORTON A A, WALTON A, SPURGEON D J, et al. Microplastics in freshwater and terrestrial environments: Evaluating the current understanding to identify the knowledge gaps and future research priorities [J]. Science of the Total Environment, 2017, 586: 127-141. doi: 10.1016/j.scitotenv.2017.01.190 [35] PRIMPKE S, WIRTH M, LORENZ C, et al. Reference database design for the automated analysis of microplastic samples based on Fourier transform infrared (FTIR) spectroscopy [J]. Analytical and Bioanalytical Chemistry, 2018, 410(21): 5131-5141. doi: 10.1007/s00216-018-1156-x [36] VIANELLO A, JENSEN R L, LIU L, et al. Simulating human exposure to indoor airborne microplastics using a Breathing Thermal Manikin [J]. Scientific Reports, 2019, 9: 8670. doi: 10.1038/s41598-019-45054-w [37] SU Y, HU X, TANG H, et al. Steam disinfection releases micro(nano)plastics from silicone-rubber baby teats as examined by optical photothermal infrared microspectroscopy [J]. Nature Nanotechnology, 2022, 17(1): 76-85. doi: 10.1038/s41565-021-00998-x [38] BATOOL I, QADIR A, LEVERMORE J M, et al. Dynamics of airborne microplastics, appraisal and distributional behaviour in atmosphere;a review [J]. Science of the Total Environment, 2022, 806: 150745. doi: 10.1016/j.scitotenv.2021.150745 [39] LABOR USDO: Regulations (Standards - 29 CFR). [40] ARAUJO J A, NEL A E. Particulate matter and atherosclerosis: Role of particle size, composition and oxidative stress [J]. Particle and Fibre Toxicology, 2009, 6: 24. doi: 10.1186/1743-8977-6-24 [41] WONG B A. Inhalation exposure systems: Design, methods and operation [J]. Toxicologic Pathology, 2007, 35(1): 3-14. doi: 10.1080/01926230601060017 [42] FIORDELISI A, PISCITELLI P, TRIMARCO B, et al. The mechanisms of air pollution and particulate matter in cardiovascular diseases [J]. Heart Failure Reviews, 2017, 22(3): 337-347. doi: 10.1007/s10741-017-9606-7 [43] LEHNER R, WEDER C, PETRI-FINK A, et al. Emergence of nanoplastic in the environment and possible impact on human health [J]. Environmental Science & Technology, 2019, 53(4): 1748-1765. [44] YAO Y, GLAMOCLIJA M, MURPHY A, et al. Characterization of microplastics in indoor and ambient air in northern New Jersey [J]. Environmental Research, 2022, 207: 112142. doi: 10.1016/j.envres.2021.112142 [45] WARING R H, HARRIS R M, MITCHELL S C. Plastic contamination of the food chain: A threat to human health? [J]. Maturitas, 2018, 115: 64-68. doi: 10.1016/j.maturitas.2018.06.010 [46] PAULY J L, STEGMEIER S J, ALLAART H A, et al. Inhaled cellulosic and plastic fibers found in human lung tissue [J]. Cancer Epidemiology, Biomarkers & Prevention, 1998, 7(5): 419-428. [47] ZHANG J J, WANG L, KANNAN K. Microplastics in house dust from 12 countries and associated human exposure [J]. Environment International, 2020, 134: 105314. doi: 10.1016/j.envint.2019.105314 [48] LIU K, WANG X H, FANG T, et al. Source and potential risk assessment of suspended atmospheric microplastics in Shanghai [J]. Science of the Total Environment, 2019, 675: 462-471. doi: 10.1016/j.scitotenv.2019.04.110 [49] DRIS R, GASPERI J, MIRANDE C, et al. A first overview of textile fibers, including microplastics, in indoor and outdoor environments [J]. Environmental Pollution, 2017, 221: 453-458. doi: 10.1016/j.envpol.2016.12.013 [50] SONG Y, LI X, DU X. Exposure to nanoparticles is related to pleural effusion, pulmonary fibrosis and granuloma [J]. The European Respiratory Journal, 2009, 34(3): 559-567. doi: 10.1183/09031936.00178308 [51] ATIS S, TUTLUOGLU B, LEVENT E, et al. The respiratory effects of occupational polypropylene flock exposure [J]. The European Respiratory Journal, 2005, 25(1): 110-117. doi: 10.1183/09031936.04.00138403 [52] HESTERBERG T W, MCCONNELL E E, MIILLER W C, et al. Pulmonary toxicity of inhaled polypropylene fibers in rats [J]. Fundamental and Applied Toxicology, 1992, 19(3): 358-366. doi: 10.1016/0272-0590(92)90174-G [53] VARELA J A, BEXIGA M G, ÅBERG C, et al. Quantifying size-dependent interactions between fluorescently labeled polystyrene nanoparticles and mammalian cells [J]. Journal of Nanobiotechnology, 2012, 10: 39. doi: 10.1186/1477-3155-10-39 [54] DONG C D, CHEN C W, CHEN Y C, et al. Polystyrene microplastic particles: in vitro pulmonary toxicity assessment [J]. Journal of Hazardous Materials, 2020, 385: 121575. doi: 10.1016/j.jhazmat.2019.121575 [55] YANG S, CHENG Y P, CHEN Z Z, et al. In vitro evaluation of nanoplastics using human lung epithelial cells, microarray analysis and co-culture model [J]. Ecotoxicology and Environmental Safety, 2021, 226: 112837. doi: 10.1016/j.ecoenv.2021.112837 [56] LIM D, JEONG J, SONG K S, et al. Inhalation toxicity of polystyrene micro(nano)plastics using modified OECD TG 412 [J]. Chemosphere, 2021, 262: 128330. doi: 10.1016/j.chemosphere.2020.128330 [57] LI L Z, XU Y, LI S X, et al. Molecular modeling of nanoplastic transformations in alveolar fluid and impacts on the lung surfactant film [J]. Journal of Hazardous Materials, 2022, 427: 127872. doi: 10.1016/j.jhazmat.2021.127872 [58] BERNARD K, HECKER L, LUCKHARDT T R, et al. NADPH oxidases in lung health and disease [J]. Antioxidants & Redox Signaling, 2014, 20(17): 2838-2853. [59] ZHU J, KOVACS L, HAN W H, et al. Reactive oxygen species-dependent calpain activation contributes to airway and pulmonary vascular remodeling in chronic obstructive pulmonary disease [J]. Antioxidants & Redox Signaling, 2019, 31(12): 804-818. [60] LANGEN R C J, KORN S H, WOUTERS E F M. ROS in the local and systemic pathogenesis of COPD [J]. Free Radical Biology and Medicine, 2003, 35(3): 226-235. doi: 10.1016/S0891-5849(03)00316-2 [61] SHI Q Y, TANG J C, WANG L, et al. Combined cytotoxicity of polystyrene nanoplastics and phthalate esters on human lung epithelial A549 cells and its mechanism [J]. Ecotoxicology and Environmental Safety, 2021, 213: 112041. doi: 10.1016/j.ecoenv.2021.112041 [62] ZUO L, HALLMAN A H, ROBERTS W J, et al. Superoxide release from contracting skeletal muscle in pulmonary TNF-α overexpression mice [J]. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology, 2014, 306(1): R75-R81. doi: 10.1152/ajpregu.00425.2013 [63] LITHNER D, LARSSON Å, DAVE G. Environmental and health hazard ranking and assessment of plastic polymers based on chemical composition [J]. Science of the Total Environment, 2011, 409(18): 3309-3324. doi: 10.1016/j.scitotenv.2011.04.038 [64] ZHU K C, JIA H Z, SUN Y J, et al. Enhanced cytotoxicity of photoaged phenol-formaldehyde resins microplastics: Combined effects of environmentally persistent free radicals, reactive oxygen species, and conjugated carbonyls [J]. Environment International, 2020, 145: 106137. doi: 10.1016/j.envint.2020.106137 [65] RUENRAROENGSAK P, TETLEY T D. Differential bioreactivity of neutral, cationic and anionic polystyrene nanoparticles with cells from the human alveolar compartment: Robust response of alveolar type 1 epithelial cells [J]. Particle and Fibre Toxicology, 2015, 12: 19. doi: 10.1186/s12989-015-0091-7 [66] KIM Y, JEONG J, LEE S, et al. Identification of adverse outcome pathway related to high-density polyethylene microplastics exposure: Caenorhabditis elegans transcription factor RNAi screening and zebrafish study [J]. Journal of Hazardous Materials, 2020, 388: 121725. doi: 10.1016/j.jhazmat.2019.121725 [67] YANG L, YUAN Y D. Oxidative damage mechanism of PM2.5 and its relationship with respiratory diseases [J]. Clinical Focus, 2016, 31(4): 433-438. [68] BROWN D M, WILSON M R, MACNEE W, et al. Size-dependent proinflammatory effects of ultrafine polystyrene particles: A role for surface area and oxidative stress in the enhanced activity of ultrafines [J]. Toxicology and Applied Pharmacology, 2001, 175(3): 191-199. doi: 10.1006/taap.2001.9240 [69] XU M K, HALIMU G, ZHANG Q R, et al. Internalization and toxicity: A preliminary study of effects of nanoplastic particles on human lung epithelial cell [J]. Science of the Total Environment, 2019, 694: 133794. doi: 10.1016/j.scitotenv.2019.133794 [70] LI R, QIU X H, XU F F, et al. Macrophage-mediated effects of airborne fine particulate matter (PM 2.5) on hepatocyte insulin resistance in vitro [J]. ACS Omega, 2016, 1(5): 736-743. doi: 10.1021/acsomega.6b00135 [71] AGHASAFARI P, GEORGE U, PIDAPARTI R. A review of inflammatory mechanism in airway diseases [J]. Inflammation Research, 2019, 68(1): 59-74. doi: 10.1007/s00011-018-1191-2 [72] BARNES P J. The cytokine network in chronic obstructive pulmonary disease [J]. American Journal of Respiratory Cell and Molecular Biology, 2009, 41(6): 631-638. doi: 10.1165/rcmb.2009-0220TR [73] ZENG Y Y, HU W P, ZUO Y H, et al. Altered serum levels of type I collagen turnover indicators accompanied by IL-6 and IL-8 release in stable COPD [J]. International Journal of Chronic Obstructive Pulmonary Disease, 2019, 14: 163-168. doi: 10.2147/COPD.S188139 [74] CHEN X W, LIU J B, WANG Y L, et al. Inflammatory signal pathway induced by PM2.5: A review of recent studies [J]. Journal of Environment and Health, 2019, 36(10): 857-860. [75] GOODMAN K E, HARE J T, KHAMIS Z I, et al. Exposure of human lung cells to polystyrene microplastics significantly retards cell proliferation and triggers morphological changes [J]. Chemical Research in Toxicology, 2021, 34(4): 1069-1081. doi: 10.1021/acs.chemrestox.0c00486 [76] ZHANG Y, TEKOBO S, TU Y, et al. Permission to enter cell by shape: Nanodisk vs nanosphere [J]. ACS Applied Materials & Interfaces, 2012, 4(8): 4099-4105. [77] STROH A, ZIMMER C, GUTZEIT C, et al. Iron oxide particles for molecular magnetic resonance imaging cause transient oxidative stress in rat macrophages [J]. Free Radical Biology and Medicine, 2004, 36(8): 976-984. doi: 10.1016/j.freeradbiomed.2004.01.016 [78] BESSON A, DOWDY S F, ROBERTS J M. CDK inhibitors: Cell cycle regulators and beyond [J]. Developmental Cell, 2008, 14(2): 159-169. doi: 10.1016/j.devcel.2008.01.013 [79] PANAGIOTOU E, GOMATOU G, TRONTZAS I P, et al. Cyclin-dependent kinase (CDK) inhibitors in solid tumors: A review of clinical trials [J]. Clinical & Translational Oncology, 2022, 24(2): 161-192. [80] JOHNSTON H J, SEMMLER-BEHNKE M, BROWN D M, et al. Evaluating the uptake and intracellular fate of polystyrene nanoparticles by primary and hepatocyte cell lines in vitro [J]. Toxicology and Applied Pharmacology, 2010, 242(1): 66-78. doi: 10.1016/j.taap.2009.09.015 [81] BUCCI-SABATTINI V, CASSINELLI C, COELHO P G, et al. Effect of titanium implant surface nanoroughness and calcium phosphate low impregnation on bone cell activity in vitro [J]. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology, 2010, 109(2): 217-224. doi: 10.1016/j.tripleo.2009.09.007 期刊类型引用(3)
1. 李佳熙,姬向荣,刘芙瑶,傅宇辰,裴阳阳,云妙英. 微塑料暴露引起“肠道菌群-肠-脑轴”毒性及作用机制研究进展. 环境化学. 2025(02): 419-431 .  本站查看
本站查看
2. 朱康,李文言. 微塑料对呼吸系统影响的研究进展. 中国医师杂志. 2025(01): 158-160 .  百度学术
百度学术
3. 冯亚慧,李灼,李文静. 塑料颗粒对人体健康影响的研究进展. 南京医科大学学报(自然科学版). 2024(09): 1310-1317 .  百度学术
百度学术
其他类型引用(0)
-







 下载:
下载: