-
全氟和多氟类化合物(per-and polyfluoroalkyl substances, PFAS)是一类分子结构中烷基上的氢原子全部(全氟)或部分(多氟)被氟原子取代的脂肪族化合物[1],具有独特的理化性质。自20世纪50年代以来,PFAS被制造并广泛应用于许多军事、工业、民用领域[2]。全氟烷基酸(perfluoroalkyl acids, PFAAs),如全氟烷基羧酸(perfluoroalkyl carboxylic acids, PFCAs)和全氟烷基磺酸(perfluoroalkane sulfonic acids, PFSAs),是应用和研究最为广泛的一类PFAS,其中又以全氟辛基羧酸(perfluorooctanoic acid, PFOA)和全氟辛基磺酸(perfluorooctane sulfonic acid, PFOS)为典型。越来越多的研究表明了PFOA和PFOS具有持久性、生物累积性、毒性和长距离迁移的特性,因此这两种物质均已列入《关于持久性有机污染物斯德哥尔摩公约》的管制范围[3-4]。许多国家和国际组织已停止生产PFOA和PFOS,并不断寻求更安全、更环保的替代品[5-8]。六氟环氧丙烷二聚体(hexafluoropropylene oxide dimer acid, HFPO-DA,其铵盐的商品名为GenX),最初作为PFOA替代品而开发,但目前由于其可能对生态和人体健康产生严重影响而正在接受审查,如荷兰通过了将HFPO-DA,其盐和酰卤作为高度关注物质的提案,并得到了欧盟的支持。含8个碳和10个碳的氯代多氟烷基醚磺酸盐(potassium 9-chlorohexadecafluoro-3-oxanonane-1-sulfonate, 9Cl-PF3ONS和potassium 11-chloroeicosafluoro-3-oxaundecane-1-sulfonate, 11Cl-PF3OUdS,又称 6∶2 Cl-PFESA和8∶2 Cl-PFESA),是PFOS替代商品F53-B的主要和次要组分,用以替代PFOS作为铬雾抑制剂,其潜在的生态和人体健康影响也受到越来越多的关注。
环境固体介质对PFAS有较强的吸附性[9],使得土壤/大气颗粒物/沉积物/污泥等成为PFAS在环境中重要的汇,并可能成为其它环境介质中该类污染物的潜在来源。极限萃取(Exhaustive extraction)是环境样品中有机污染物分析的常用技术,即利用极性有机试剂一次或多次萃取样品中的目标化合物,萃取过程中通常会存在大量的基质干扰物质与目标化合物共萃取的现象。为了减少基质干扰,需要对萃取液进行净化。在土壤/大气颗粒物/沉积物/污泥等环境固体样品PFAS的萃取过程中,净化萃取液的常用手段是固相萃取(Solid phase extraction, SPE),即利用固体吸附剂将萃取液中的目标化合物吸附使其与干扰化合物分离,然后再用洗脱液洗脱,达到分离和富集目标化合物的目的。然而,繁琐的超声、振荡、离心、转移、浓缩、复溶、净化、干燥等过程非常耗时,使得基于SPE的极限萃取法样品制备所用时间占到整个污染物分析过程所用时间的75%以上[10],这往往构成分析技术的瓶颈[11]。繁琐的萃取、净化过程同时增大了目标污染物损失的可能性,使得方法的回收率不稳定。由于步骤繁琐,消耗了较多的有机试剂、超纯水、离心管、固相萃取柱、高纯氮气等,成本较高。为了提高萃取效率,快速分析环境中PFAS的赋存水平,进而探讨其风险和管控措施,亟需完善固体环境介质中PFAS的萃取方法,发展样品制备效率和成本效益较高的处理技术。
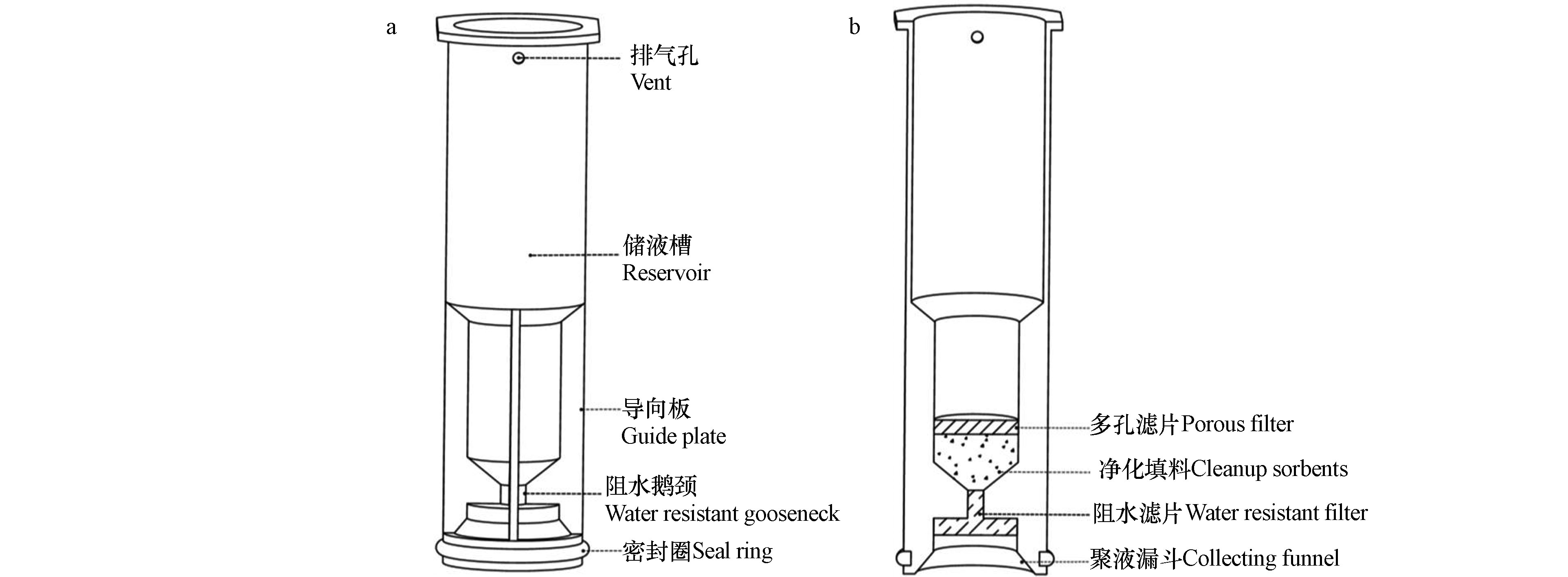
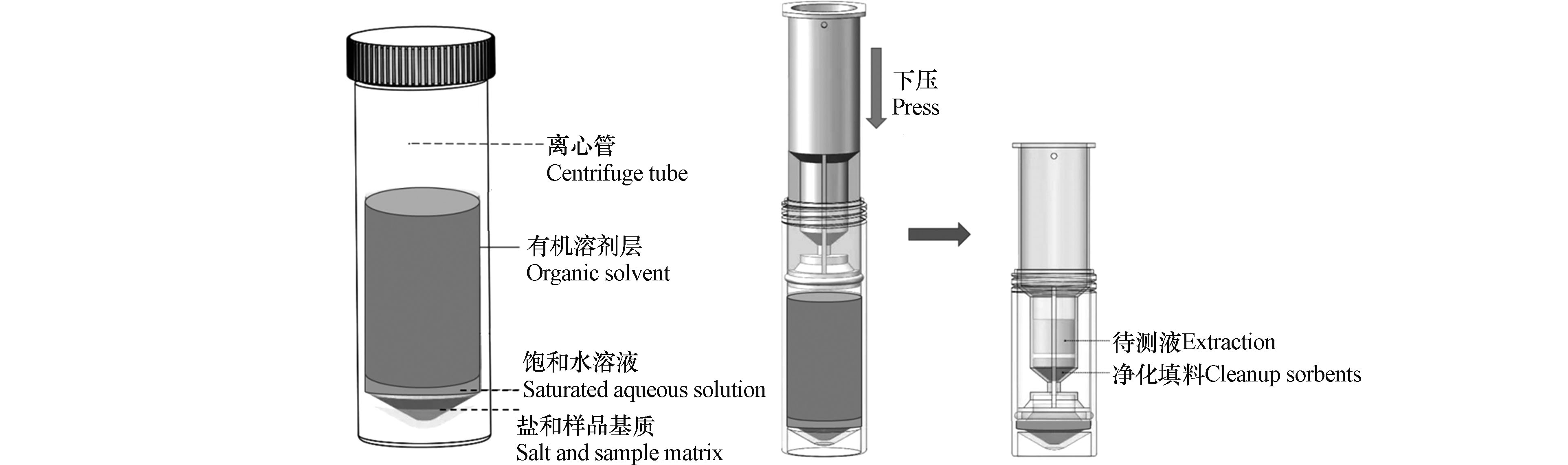
QuEChERS技术是由美国农业部在本世纪初提出的一种提取和净化农作物中农残的样品前处理方法[12],该技术利用乙腈提取目标化合物,之后采用硫酸镁等盐析分层,再加入吸附剂进行分散固相萃取,达到净化样品的目的。该技术具有快速(Quick)、简单(Easy)、便宜(Cheap)、有效(Effective)、可靠(Rugged)和安全(Safe)的特点,但存在稀释倍数大,重复性较差等问题[13]。SinCHERS技术是在SPE、QuEChERS等技术基础上开发出的一种新型快速样品制备技术,具有一步(Single–step)、经济(Cheap)、有效(Effective)、可靠(Rugged)、安全(Safe)的特点。基于SinCHERS技术的样品制备流程如图1所示。首先在碱性条件下利用有机试剂充分浸提固体样品中的目标化合物,之后向体系中加入酸调节体系pH值,振荡、离心,使得目标化合物在该体系内分配平衡,使得有机萃取液与其他组分之间分层良好。将SinCHERS前处理净化小柱(简称SinCHERS柱)置入离心管,缓慢下压,有机萃取液通过净化填料净化,并进入储液槽,取出槽内液体,浓缩、过滤后完成样品制备。相较于传统的固相萃取净化技术,SinCHERS技术节省了样品制备时间,减少了溶剂和各类器皿的使用量,并可以减少样品转移过程中目标化合物的损失,通常具有更好的稳定性和回收率。目前,SinCHERS技术已经成功应用于植物性样品中农药残留的测定[13-17]、动物性样品中兽药残留的测定以及纺织品中偶氮染料的测定[18]。
本文主要研究内容为SinCHERS技术在土壤/大气颗粒物/沉积物/污泥等固体样品PFAS检测中的应用,包括SinCHERS柱净化填料的优选和样品萃取净化流程的确定等,其目的在于提高土壤/大气颗粒物/沉积物/污泥等固体样品PFAS的萃取效率,缩短萃取时间,降低萃取成本,从而提高这些化合物的检测效率。
-
土壤/大气颗粒物/沉积物/污泥等固体样品;标准样品,含目标化合物PFAC-MXB (含全氟丁酸(perfluorobutanoic acid, PFBA)、全氟戊酸(perfluoropentanoic acid, PFPeA)、全氟己酸(perfluorohexanoic acid, PFHxA)、全氟庚酸(perfluoroheptanoic acid, PFHpA)、PFOA、全氟壬酸(perfluorononanoic acid, PFNA)、全氟癸酸(perfluorodecanoic acid, PFDA)、全氟十一酸(perfluoroundecanoic acid, PFUnDA)、全氟十二酸(perfluorododecanoic acid, PFDoDA)、全氟十三酸(perfluorotridecanoic acid, PFTrDA)、全氟十四酸(perfluorotetradecanoic acid, PFTeDA)、全氟十六酸(perfluorohexadecanoic acid, PFHxDA)、全氟十八酸(perfluorooctadecanoic acid, PFODA)、全氟丁烷磺酸(perfluorobutane sulfonic acid, PFBS)、全氟己烷磺酸(perfluorohexane sulfonic acid, PFHxS)、PFOS、全氟癸烷磺酸(perfluorodecane sulfonic acid, PFDS)), HFPO-DA, 9Cl-PF3ONS, 11Cl-PF3OUdS, 以及内标物质MPFAC-MXA (含MPFBA, MPFHxA, MPFOA, MPFNA, MPFDA, MPFUnDA, MPFDoDA, MPFHxS, MPFOS), M3HFPO-DA (Wellington 实验室, 加拿大);甲醇、乙腈(HPLC级,Fisher,美国);氢氧化钠(AR,麦克林,上海);盐酸(AR);乙酸铵(纯度≥98%, Sigma,美国);0.2 µm GHP针式滤器(PALL,美国);高纯氮(海科,北京);Milli-Q 超纯水(Millipore,美国);SinCHERS柱(Anybond,天津);ACQUITY BEH C18色谱柱(1.7 µm, 2.1 mm×100 mm, Waters, 美国)。
SinCHERS柱是天津安邦键合(Anybond)科技有限公司开发出的产品[19],其结构如图2所示。其中净化填料能够起到吸附有机萃取液内溶解的杂质,净化萃取液的目的,是SinCHERS柱的核心结构。填料内容需要根据目标污染物和样品所含杂质情况进行选择和配比。SinCHERS柱柱体采用医疗级聚丙烯材质,密封圈采用医疗级高级纯硅胶材质,可有效避免柱体应用带来的背景污染。
-
Agilent 1290高效液相色谱/6460三重四极杆质谱系统(HPLC-MS/MS, Agilent,美国);电动辅助工具(Anybond,天津);分析天平;超声波清洗器;振荡器;离心机;氮吹仪。
-
土壤/大气颗粒物/沉积物/污泥等环境固体样品中PFAS萃取净化步骤如下:称取1—2 g干燥研磨后固体样品至50 mL离心管中,加入2—10 ng同位素标记的化合物,用于内标法定量。然后加入1 mL 0.5 mol·L−1氢氧化钠溶液和4 mL乙腈溶液,涡旋混匀后水浴条件下超声30 min。再加入16 mL乙腈,振荡30 min,使样品中的待测组分充分转移至有机萃取液中。之后加入250 μL 2 mol·L−1盐酸调节pH值,涡旋混匀,然后使用离心机5000r·min−1离心5 min。将SinCHERS柱置入离心管,缓慢下压,使上清液净化后进入储液槽,下压至SinCHERS柱体无法下行,净化过程完成。将净化液转移至另一离心管中,氮吹浓缩至近干,用甲醇或初始流动相比例的混合溶液定容至0.5—1 mL,将定容后的溶液过0.2 µm GHP针式滤器,上机分析检测。
色谱条件:流动相A组分为10 mmol·L−1乙酸铵水溶液,B组分为乙腈,采用梯度洗脱:0 min A组分80%,14 min A组分10%,16 min A组分10%,20 min A组分80%;流速0.3 mL·min−1;柱温为40 ℃;进样量为5 µL。
质谱条件:离子化模式为电喷雾离子化(ESI)负离子模式;数据采集模式为多反应检测扫描模式(Multi reaction monitoring, MRM);离子源温度350 ℃;载气流量9 L·min−1;雾化器压力40 psi;毛细管电压3500 V;ΔEMV电压400 V。所分析20种PFAS及10种内标物的质谱相关参数如表1所示。
-
将标准物质用甲醇配制混合标准溶液,标准化合物的质量浓度依次为0.01、0.05、0.1、0.5、1、5、10、50、100 ng·mL−1,内标物质的质量浓度均为5 ng·mL−1。以标准化合物浓度为横坐标,以标准化合物和内标的相对浓度为纵坐标,得到标准曲线。
PFAS的方法检出限(Method detection limit, MDL)可基于加标样品的检测结果,根据美国环保署提供的方法计算[20]:
其中,
MDL 为基于加标样品的方法检出限,t(n−1,1−α=0.99) 表示置信水平为99%时的单尾t值,SS 为重复加标样品分析结果的样本标准偏差。不添加土壤样品,用本方法全流程进行定量分析,得到该方法的程序空白,能够反应SinCHERS柱体、所使用试剂、器皿、管路等的背景污染情况。
取青海省海南藏族自治州共和县廿地乡草场土壤,将其烘干、均质化、研磨至100目后作为土壤基质,添加10 ng各目标化合物,按照本文“1.3”部分所述步骤进行PFAS的分析检测,扣除本底值后计算加标回收率。由于所分析样品的理化性质受到样品种类、采样时间、采样地点等多种因素的影响,不同样品间可能存在回收率的差异,将本文所描述方法应用于实际样品时,需进行预实验,并在必要时做出适度调整。
-
本研究采用Waters ACQUITY BEH C18色谱柱(1.7 µm, 2.1 mm×100 mm)进行目标化合物的分离。对比了流动相A组分中不同浓度乙酸铵含量和不同流速对20种目标化合物的分离效果的影响。基于以2 mmol·L−1与10 mmol·L−1乙酸铵水溶液作为流动相A相时得到的色谱图,发现乙酸铵含量主要影响目标化合物的保留时间和响应强度,当乙酸铵含量为10 mmol·L−1时,物质间的分离效果更好,峰形对称性更好,而乙酸铵含量为2 mmol·L−1时,各物质的响应强度更高。基于流动相速度分别为0.25、0.3 mL·min−1时得到的色谱图,发现流速主要影响目标化合物的保留时间和峰形,较高流速时目标化合物的出峰时间更早,整体比低流速时出峰时间提前约0.5 min。较高流速时,峰形更好,表现在峰宽较窄,峰形较尖,峰高较高,因此改善了相邻物质的分离度,如PFTrDA和11Cl-PF3OUdS之间,PFUnDA和9Cl-PF3ONS之间的分离度。综合考虑不同条件下的分离效果,优选10 mmol·L−1乙酸铵水溶液作为流动相A相,优选0.3 mL·min−1为流动相流速,使目标化合物达到一个更好的分离检测效果。
许多研究已经对产品PFAC-MXB中17种PFAAs,以及产品MPFAC-MXA中9种同位素内标化合物的质谱条件进行了优化[21-22],本研究重点优化了HFPO-DA及其同位素内标M3HFPO-DA,9Cl-PF3ONS,以及11Cl-PF3OUdS的质谱参数。负离子模式下,首先通过全扫确定目标化合物的母离子,之后进行离子扫描优化裂解电压,再进行子离子扫描找到子离子并优化碰撞能,最后在多反应监测模式下选择响应更高的子离子作为定量子离子。优化后的参数见表1。
-
为有效净化有机萃取液中所含的杂质,使用无水硫酸镁、石墨化碳黑(Graphitized carbon black, GCB)、离子交换材料的混合物作为SinCHERS柱中的净化填料,三类填料的作用分别为:吸收萃取液中可能含有的微量水分、去除色素等杂质、去除其他干扰性离子化合物。为考察具有不同层间距的GCB和不同离子交换材料对SinCHERS柱净化效果的影响,在两个污染水平下(基质样品中额外添加目标化合物10 ng、50 ng)对比了使用不同层间距的GCB和不同离子交换填料时PFAS的回收率,每种处理设置了6个重复。
层间距不同,GCB的净化能力也不同。为了选择合适的层间距,将层间距分别为10、20、30 nm的GCB与无水硫酸镁和离子交换材料HLB混合后作为SinCHERS柱内的净化填料,在两种污染水平下对比了各PFAS的回收率(图3a, b)。结果表明,当加标水平为10 ng时,若使用层间距为10 nm或30 nm的GCB,PFODA的回收率下降到57%以下。在50 ng的加标水平下,所有20种PFAS的回收率均在可接受范围内(70%—130%)[23-24],但层间距为30 nm时,SinCHERS柱去除色素的能力降低,净化后基质的颜色更深。根据回收率和净化效果对比,优选层间距为20 nm的GCB作为净化填料。GCB能吸附非极性/弱极性化合物,层间距越小,净化效果越好。但过小的层间距条件下不可逆吸附更容易发生,特别是对大分子物质。这可能是使用层间距为10 nm的GCB 时PFODA回收率较低的原因。相反,层间距为30 nm的GCB,其净化色素和其他干扰物质的能力也会降低。
为了选择合适的离子交换材料,对比了HLB、SAX、WCX 3种离子交换填料,分别将其与层间距为20 nm的GCB、无水硫酸镁混合后作为SinCHERS柱内的净化填料,在两种污染水平下对比PFAS的回收率(图3c, d)。结果表明,当使用HLB时,20种PFAS在两种加标水平下的平均回收率分别为71.0%—110.6%和74.0%—127%。而使用SAX和WCX时,无论在什么加标水平下,PFODA的回收率都下降到63%以下。在10 ng的加标水平下,使用HLB时,有12种PFAS的回收率更稳定,即回收率的标准方差低于另外两种填料。当使用SAX和WCX时,分别有4种PFAS的回收率的标准方差低于另外两种填料。HLB作为一种弱阴离子交换材料,在乙腈溶液中能吸收比PFAS酸性更强的阴离子化合物,降低了负离子模式下杂质阴离子对质谱的干扰。SAX作为一种强阴离子交换材料,对PFAS的吸附能力比HLB强。这可能是使用SAX时,PFODA回收率较低的原因。而阳离子交换材料WCX对干扰性阴离子化合物没有净化作用。
综合考虑不同填料组合条件下目标化合物的回收率范围和稳定性,优选层间距为200 Å的GCB、HLB与无水硫酸镁组合作为SinCHERS柱中的净化填料,使目标化合物同时具有较好的回收率和检测稳定性。
-
用甲醇配制不同浓度梯度的标准物质混合标准溶液,拟合得到标准曲线的R2值均在0.99以上,线性范围在0.01—100 ng·mL−1,对应环境固体样品的可检测范围为0.005—50 ng·g−1 dw。
浓度为100 ng·mL−1的20种目标化合物的MRM色谱图如图4所示。可以发现,在优化的条件下,HPLC-MS/MS可以实现20种PFAS的分离。
基于该方法得到20种目标化合物的方法检出限见表2。PFAS的检出限范围0.46—2.31 ng·g-1 dw。当不添加土壤样品时,得到该方法程序空白,各目标化合物含量均低于检出限。
基于该方法得到20种PFAS的方法回收率如表3所示。其中,PFODA和PFBS的方法回收率为71.0%和78.4%,其余PFAS的回收率范围为84.1%—110.6%。该方法PFOA、PFODA、PFDS的回收率的标准偏差最小,为3.1%、3%、2.7%。其余PFAS的标准偏差在3.8%—13.4%之间。
-
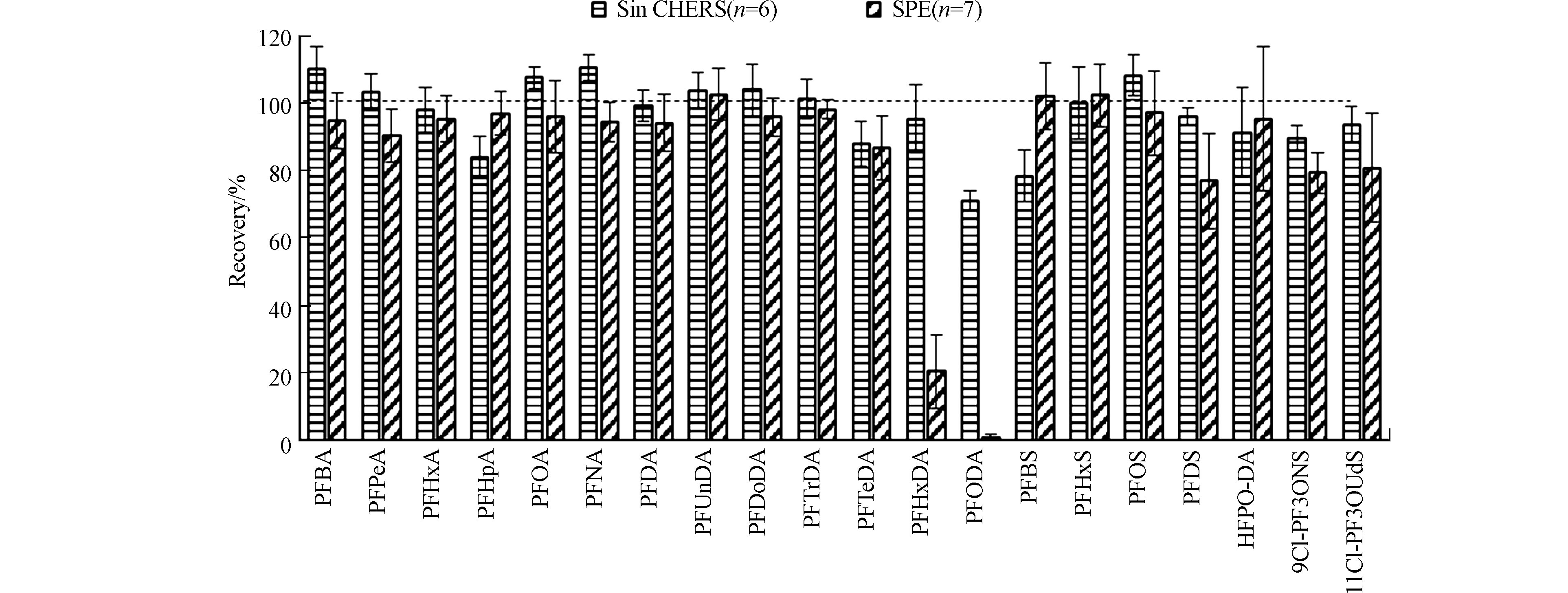
再次利用青海省土壤基质样品(本文“1.4”部分),同时应用本方法和SPE样品前处理过程[22, 25-28]对样品进行处理。当在基质样品中额外添加10 ng目标化合物时,两种技术在回收率上的差异如图5所示,对于大部分PFAS,即碳链长度为4—14的全氟羧酸化合物,碳链长度为6和8的全氟磺酸化合物,HFPO-DA,以及11Cl-PF3OUdS,两种技术的回收率均在80%—120%之间。对于碳链长度为16和18的全氟羧酸化合物,即PFHxDA和PFODA,传统SPE技术的回收率仅为20%和1%,而SinCHERS技术的回收率为95%和71%,增大了可检测污染物的种类。对于PFDS和9Cl-PF3ONS,传统SPE技术的回收率为77%和79%,SinCHERS技术的回收率为96%和90%,回收效率显著提高。对于全氟丁烷磺酸来说,SinCHERS技术的回收率78%低于SPE技术102%,但仍可用于环境样品中该物质的检测定量[29]。
对于大部分PFAS,即碳链长度为4—11,14,16的全氟羧酸化合物,碳链长度为4、8、10的全氟磺酸化合物,HFPO-DA,9Cl-PF3ONS,以及11Cl-PF3OUdS,SinCHERS技术回收率的方差低于传统的SPE技术,说明对于大部分PFAS,该方法具有更好的稳定性。同时,SinCHERS技术在步骤上更为简洁,可节约大量的试剂耗材,且具有更高的时效性。
-
为验证本方法对PFAS提取效果的稳定性和适用性,2020年7月,采集了黄河流域河套灌区大棚和露天条件下共67个农田土壤样品,应用本方法进行了PFAS样品加标回收率和实际样品浓度的测定,分析结果如表4所示。其中,PFODA的方法回收率为71.9%,其余PFAS的回收率范围为87.0%—110.5%。PFPeA、PFOA、PFODA的标准偏差最小,为2.9%、2.4%、2.1%,其余PFAS的标准偏差在3.5%—12.1%之间。67份土壤样品中,20种PFAS的总浓度
∑ PFAS范围为1.71—14.0 ng·g−1 dw,平均含量为3.81 ng·g−1 dw。PFBA、PFPeA的组分贡献率最高,平均达到∑ PFAS的46.5%和29.0%。本文所述方法具有较好的稳定性和适用性。通过对比大棚和露天条件下的污染特征可以发现,多数样点的
∑ PFAS含量表现为大棚高于露天,但差异不显著。对比最主要组分PFBA,发现大棚内含量显著高于棚外(P=0.028)。经分析发现,土壤PFBA含量与土壤总有机碳、总氮含量显著正相关,而大棚内土壤总有机碳、总氮含量显著高于棚外。作为改善大棚内土壤条件的常用方法之一,有机肥的施用能够显著提高土壤总有机碳、总氮含量。此外,有研究表明,有机肥的施用可能是农田系统PFAS污染的来源之一[30]。因此,有机肥的施用可能是影响或决定PFAS的赋存的重要原因。 -
该方法建立了基于SinCHERS-HPLC-MS/MS技术的环境固体样品中20种PFAS的萃取、净化和检测方法。优选出了无水硫酸镁、层间距为20 nm的GCB、HLB离子交换材料的组合作为SinCHERS柱内的净化填料,并优化了HPLC-MS/MS条件以分离并定量检测20种目标化合物。目标化合物的方法回收率在71.0%—110.6%之间。相较于SPE样品前处理流程,该方法大大缩短了样品中污染物萃取净化的时间,降低了经济成本,优化了某些长链PFAS的萃取效率。
SinCHERS-HPLC-MS/MS法检测环境固体样品中20种全氟和多氟类化合物
Analysis of 20 per- and polyfluoroalkyl substances in environmental solid samples by SinCHERS-high performance liquid chromatography-electrospray ionization-mass spectrometry
-
摘要: 建立了SinCHERS-高效液相色谱串联质谱(HPLC-MS/MS)技术的土壤样品中20种全氟和多氟类化合物(Per- and polyfluoroalkyl substances, PFAS)的萃取、净化和检测方法。采用无水硫酸镁、层间距为20 nm的石墨化碳黑、HLB离子交换材料的组合作为SinCHERS前处理净化小柱的净化填料,使用HPLC-MS/MS检测,内标法定量。目标化合物的方法检出限在0.48—2.31 ng·g−1 dw(干重)之间,方法回收率在71.0%—110.6%之间,标准偏差在2.7%—13.4%之间。相较于固相萃取(SPE)样品前处理流程,SinCHERS净化方法大大缩短了样品中污染物萃取净化的时间,降低了经济成本,优化了某些长链PFAS的萃取效率,且具有相对较高的稳定性。提高了在16 min内同时检测20种PFAS的检测效率,为环境中PFAS评估提供更为方便的检测方法以得到有效的基础数据。
-
关键词:
- SinCHERS /
- 高效液相色谱串联质谱 /
- 全氟和多氟类化合物
Abstract: A method for the extraction, purification, and determination of 20 per- and polyfluoroalkyl substances (PFAS) in environmental solid samples by SinCHERS-high liquid chromatography-electrospray ionization-mass spectrometry (HPLC-MS/MS) was established. The combination of anhydrous magnesium sulfate, graphitized carbon black with interlayer spacing of 20 nm, and HLB ion exchange material was used as the cleanup sorbents in SinCHERS cartridge. 20 PFAS were determined by HPLC-MS/MS using internal standard method. The method detection limit of the target compounds were 0.48—2.31 ng·g−1 dw, the recoveries were 71.0%—110.6%, and the standard deviations were 2.7%—13.4%. Compared with SPE sample pretreatment, this method is more time saving, more economical, and more stable. It also improves the recoveries of some long-chain PFAS. It provides a more convenient detection method for PFAS evaluation in the environment to obtain effective basic data. -
全氟和多氟类化合物(per-and polyfluoroalkyl substances, PFAS)是一类分子结构中烷基上的氢原子全部(全氟)或部分(多氟)被氟原子取代的脂肪族化合物[1],具有独特的理化性质。自20世纪50年代以来,PFAS被制造并广泛应用于许多军事、工业、民用领域[2]。全氟烷基酸(perfluoroalkyl acids, PFAAs),如全氟烷基羧酸(perfluoroalkyl carboxylic acids, PFCAs)和全氟烷基磺酸(perfluoroalkane sulfonic acids, PFSAs),是应用和研究最为广泛的一类PFAS,其中又以全氟辛基羧酸(perfluorooctanoic acid, PFOA)和全氟辛基磺酸(perfluorooctane sulfonic acid, PFOS)为典型。越来越多的研究表明了PFOA和PFOS具有持久性、生物累积性、毒性和长距离迁移的特性,因此这两种物质均已列入《关于持久性有机污染物斯德哥尔摩公约》的管制范围[3-4]。许多国家和国际组织已停止生产PFOA和PFOS,并不断寻求更安全、更环保的替代品[5-8]。六氟环氧丙烷二聚体(hexafluoropropylene oxide dimer acid, HFPO-DA,其铵盐的商品名为GenX),最初作为PFOA替代品而开发,但目前由于其可能对生态和人体健康产生严重影响而正在接受审查,如荷兰通过了将HFPO-DA,其盐和酰卤作为高度关注物质的提案,并得到了欧盟的支持。含8个碳和10个碳的氯代多氟烷基醚磺酸盐(potassium 9-chlorohexadecafluoro-3-oxanonane-1-sulfonate, 9Cl-PF3ONS和potassium 11-chloroeicosafluoro-3-oxaundecane-1-sulfonate, 11Cl-PF3OUdS,又称 6∶2 Cl-PFESA和8∶2 Cl-PFESA),是PFOS替代商品F53-B的主要和次要组分,用以替代PFOS作为铬雾抑制剂,其潜在的生态和人体健康影响也受到越来越多的关注。
环境固体介质对PFAS有较强的吸附性[9],使得土壤/大气颗粒物/沉积物/污泥等成为PFAS在环境中重要的汇,并可能成为其它环境介质中该类污染物的潜在来源。极限萃取(Exhaustive extraction)是环境样品中有机污染物分析的常用技术,即利用极性有机试剂一次或多次萃取样品中的目标化合物,萃取过程中通常会存在大量的基质干扰物质与目标化合物共萃取的现象。为了减少基质干扰,需要对萃取液进行净化。在土壤/大气颗粒物/沉积物/污泥等环境固体样品PFAS的萃取过程中,净化萃取液的常用手段是固相萃取(Solid phase extraction, SPE),即利用固体吸附剂将萃取液中的目标化合物吸附使其与干扰化合物分离,然后再用洗脱液洗脱,达到分离和富集目标化合物的目的。然而,繁琐的超声、振荡、离心、转移、浓缩、复溶、净化、干燥等过程非常耗时,使得基于SPE的极限萃取法样品制备所用时间占到整个污染物分析过程所用时间的75%以上[10],这往往构成分析技术的瓶颈[11]。繁琐的萃取、净化过程同时增大了目标污染物损失的可能性,使得方法的回收率不稳定。由于步骤繁琐,消耗了较多的有机试剂、超纯水、离心管、固相萃取柱、高纯氮气等,成本较高。为了提高萃取效率,快速分析环境中PFAS的赋存水平,进而探讨其风险和管控措施,亟需完善固体环境介质中PFAS的萃取方法,发展样品制备效率和成本效益较高的处理技术。
QuEChERS技术是由美国农业部在本世纪初提出的一种提取和净化农作物中农残的样品前处理方法[12],该技术利用乙腈提取目标化合物,之后采用硫酸镁等盐析分层,再加入吸附剂进行分散固相萃取,达到净化样品的目的。该技术具有快速(Quick)、简单(Easy)、便宜(Cheap)、有效(Effective)、可靠(Rugged)和安全(Safe)的特点,但存在稀释倍数大,重复性较差等问题[13]。SinCHERS技术是在SPE、QuEChERS等技术基础上开发出的一种新型快速样品制备技术,具有一步(Single–step)、经济(Cheap)、有效(Effective)、可靠(Rugged)、安全(Safe)的特点。基于SinCHERS技术的样品制备流程如图1所示。首先在碱性条件下利用有机试剂充分浸提固体样品中的目标化合物,之后向体系中加入酸调节体系pH值,振荡、离心,使得目标化合物在该体系内分配平衡,使得有机萃取液与其他组分之间分层良好。将SinCHERS前处理净化小柱(简称SinCHERS柱)置入离心管,缓慢下压,有机萃取液通过净化填料净化,并进入储液槽,取出槽内液体,浓缩、过滤后完成样品制备。相较于传统的固相萃取净化技术,SinCHERS技术节省了样品制备时间,减少了溶剂和各类器皿的使用量,并可以减少样品转移过程中目标化合物的损失,通常具有更好的稳定性和回收率。目前,SinCHERS技术已经成功应用于植物性样品中农药残留的测定[13-17]、动物性样品中兽药残留的测定以及纺织品中偶氮染料的测定[18]。
本文主要研究内容为SinCHERS技术在土壤/大气颗粒物/沉积物/污泥等固体样品PFAS检测中的应用,包括SinCHERS柱净化填料的优选和样品萃取净化流程的确定等,其目的在于提高土壤/大气颗粒物/沉积物/污泥等固体样品PFAS的萃取效率,缩短萃取时间,降低萃取成本,从而提高这些化合物的检测效率。
1. 材料与方法(Materials and methods)
1.1 试剂耗材
土壤/大气颗粒物/沉积物/污泥等固体样品;标准样品,含目标化合物PFAC-MXB (含全氟丁酸(perfluorobutanoic acid, PFBA)、全氟戊酸(perfluoropentanoic acid, PFPeA)、全氟己酸(perfluorohexanoic acid, PFHxA)、全氟庚酸(perfluoroheptanoic acid, PFHpA)、PFOA、全氟壬酸(perfluorononanoic acid, PFNA)、全氟癸酸(perfluorodecanoic acid, PFDA)、全氟十一酸(perfluoroundecanoic acid, PFUnDA)、全氟十二酸(perfluorododecanoic acid, PFDoDA)、全氟十三酸(perfluorotridecanoic acid, PFTrDA)、全氟十四酸(perfluorotetradecanoic acid, PFTeDA)、全氟十六酸(perfluorohexadecanoic acid, PFHxDA)、全氟十八酸(perfluorooctadecanoic acid, PFODA)、全氟丁烷磺酸(perfluorobutane sulfonic acid, PFBS)、全氟己烷磺酸(perfluorohexane sulfonic acid, PFHxS)、PFOS、全氟癸烷磺酸(perfluorodecane sulfonic acid, PFDS)), HFPO-DA, 9Cl-PF3ONS, 11Cl-PF3OUdS, 以及内标物质MPFAC-MXA (含MPFBA, MPFHxA, MPFOA, MPFNA, MPFDA, MPFUnDA, MPFDoDA, MPFHxS, MPFOS), M3HFPO-DA (Wellington 实验室, 加拿大);甲醇、乙腈(HPLC级,Fisher,美国);氢氧化钠(AR,麦克林,上海);盐酸(AR);乙酸铵(纯度≥98%, Sigma,美国);0.2 µm GHP针式滤器(PALL,美国);高纯氮(海科,北京);Milli-Q 超纯水(Millipore,美国);SinCHERS柱(Anybond,天津);ACQUITY BEH C18色谱柱(1.7 µm, 2.1 mm×100 mm, Waters, 美国)。
SinCHERS柱是天津安邦键合(Anybond)科技有限公司开发出的产品[19],其结构如图2所示。其中净化填料能够起到吸附有机萃取液内溶解的杂质,净化萃取液的目的,是SinCHERS柱的核心结构。填料内容需要根据目标污染物和样品所含杂质情况进行选择和配比。SinCHERS柱柱体采用医疗级聚丙烯材质,密封圈采用医疗级高级纯硅胶材质,可有效避免柱体应用带来的背景污染。
1.2 仪器设备
Agilent 1290高效液相色谱/6460三重四极杆质谱系统(HPLC-MS/MS, Agilent,美国);电动辅助工具(Anybond,天津);分析天平;超声波清洗器;振荡器;离心机;氮吹仪。
1.3 样品制备与检测
土壤/大气颗粒物/沉积物/污泥等环境固体样品中PFAS萃取净化步骤如下:称取1—2 g干燥研磨后固体样品至50 mL离心管中,加入2—10 ng同位素标记的化合物,用于内标法定量。然后加入1 mL 0.5 mol·L−1氢氧化钠溶液和4 mL乙腈溶液,涡旋混匀后水浴条件下超声30 min。再加入16 mL乙腈,振荡30 min,使样品中的待测组分充分转移至有机萃取液中。之后加入250 μL 2 mol·L−1盐酸调节pH值,涡旋混匀,然后使用离心机5000r·min−1离心5 min。将SinCHERS柱置入离心管,缓慢下压,使上清液净化后进入储液槽,下压至SinCHERS柱体无法下行,净化过程完成。将净化液转移至另一离心管中,氮吹浓缩至近干,用甲醇或初始流动相比例的混合溶液定容至0.5—1 mL,将定容后的溶液过0.2 µm GHP针式滤器,上机分析检测。
色谱条件:流动相A组分为10 mmol·L−1乙酸铵水溶液,B组分为乙腈,采用梯度洗脱:0 min A组分80%,14 min A组分10%,16 min A组分10%,20 min A组分80%;流速0.3 mL·min−1;柱温为40 ℃;进样量为5 µL。
质谱条件:离子化模式为电喷雾离子化(ESI)负离子模式;数据采集模式为多反应检测扫描模式(Multi reaction monitoring, MRM);离子源温度350 ℃;载气流量9 L·min−1;雾化器压力40 psi;毛细管电压3500 V;ΔEMV电压400 V。所分析20种PFAS及10种内标物的质谱相关参数如表1所示。
表 1 20种PFAS目标化合物及10种内标物的质谱相关参数Table 1. MS conditions for 20 PFASs and 10 Internal standards目标化合物Compound 母离子(m/z)→子离子(m/z)Precursor ion (m/z)→Production (m/z) 裂解电压/VFragmentor 碰撞能量/eVCollision energy 内标Internal standard 目标化合物 PFBA 213.0 → 169.1 57 1 MPFBA PFPeA 263.0 → 218.9 68 2 MPFBA PFHxA 313.0 → 269.0 68 3 MPFHxA PFHpA 363.0 → 318.9 68 4 MPFOA PFOA 413.0 → 368.9 82 4 MPFOA PFNA 463.0 → 419.0 82 3 MPFNA PFDA 513.0 → 468.9 86 3 MPFDA PFUnDA 563.0 → 519.0 90 5 MPFUnDA 目标化合物 PFDoDA 613.0 → 569.0 90 5 MPFDoDA PFTrDA 662.9 → 619.0 80 5 MPFDoDA PFTeDA 713.1 → 669.0 100 7 MPFDoDA PFHxDA 813.0 → 769.0 100 9 MPFDoDA PFODA 913.0 → 869.0 118 10 MPFDA PFBS 299.0 → 80.0 135 32 MPFHxS PFHxS 399.0 → 80.0 150 40 MPFHxS PFOS 498.9 → 80.0 154 47 MPFOS PFDS 599.0 → 79.9 160 65 MPFOS HFPO-DA 329.0 → 169.0 49 5 M3HFPO-DA 9Cl-PF3ONS 530.8 → 350.9 120 22 MPFOS 11Cl-PF3OUdS 630.7 → 450.9 123 25 MPFOS 内标 MPFBA 217.0 → 172.0 57 1 MPFHxA 315.0 → 270.0 68 3 MPFOA 417.0 → 372.0 82 4 MPFNA 468.0 → 423.0 82 3 MPFDA 515.0 → 470.0 86 3 MPFUnDA 565.0 → 520.0 90 5 MPFDoDA 615.0 → 570.0 90 5 MPFHxS 403.0 → 103.0 150 40 MPFOS 503.0 → 80.0 154 47 M3HFPO-DA 331.2 → 169.0 44 5 1.4 质量保证与质量控制
将标准物质用甲醇配制混合标准溶液,标准化合物的质量浓度依次为0.01、0.05、0.1、0.5、1、5、10、50、100 ng·mL−1,内标物质的质量浓度均为5 ng·mL−1。以标准化合物浓度为横坐标,以标准化合物和内标的相对浓度为纵坐标,得到标准曲线。
PFAS的方法检出限(Method detection limit, MDL)可基于加标样品的检测结果,根据美国环保署提供的方法计算[20]:
MDL=t(n−1,1−α=0.99)SS 其中,
MDL t(n−1,1−α=0.99) SS 不添加土壤样品,用本方法全流程进行定量分析,得到该方法的程序空白,能够反应SinCHERS柱体、所使用试剂、器皿、管路等的背景污染情况。
取青海省海南藏族自治州共和县廿地乡草场土壤,将其烘干、均质化、研磨至100目后作为土壤基质,添加10 ng各目标化合物,按照本文“1.3”部分所述步骤进行PFAS的分析检测,扣除本底值后计算加标回收率。由于所分析样品的理化性质受到样品种类、采样时间、采样地点等多种因素的影响,不同样品间可能存在回收率的差异,将本文所描述方法应用于实际样品时,需进行预实验,并在必要时做出适度调整。
2. 结果与讨论(Results and discussion)
2.1 HPLC-MS/MS条件优化
本研究采用Waters ACQUITY BEH C18色谱柱(1.7 µm, 2.1 mm×100 mm)进行目标化合物的分离。对比了流动相A组分中不同浓度乙酸铵含量和不同流速对20种目标化合物的分离效果的影响。基于以2 mmol·L−1与10 mmol·L−1乙酸铵水溶液作为流动相A相时得到的色谱图,发现乙酸铵含量主要影响目标化合物的保留时间和响应强度,当乙酸铵含量为10 mmol·L−1时,物质间的分离效果更好,峰形对称性更好,而乙酸铵含量为2 mmol·L−1时,各物质的响应强度更高。基于流动相速度分别为0.25、0.3 mL·min−1时得到的色谱图,发现流速主要影响目标化合物的保留时间和峰形,较高流速时目标化合物的出峰时间更早,整体比低流速时出峰时间提前约0.5 min。较高流速时,峰形更好,表现在峰宽较窄,峰形较尖,峰高较高,因此改善了相邻物质的分离度,如PFTrDA和11Cl-PF3OUdS之间,PFUnDA和9Cl-PF3ONS之间的分离度。综合考虑不同条件下的分离效果,优选10 mmol·L−1乙酸铵水溶液作为流动相A相,优选0.3 mL·min−1为流动相流速,使目标化合物达到一个更好的分离检测效果。
许多研究已经对产品PFAC-MXB中17种PFAAs,以及产品MPFAC-MXA中9种同位素内标化合物的质谱条件进行了优化[21-22],本研究重点优化了HFPO-DA及其同位素内标M3HFPO-DA,9Cl-PF3ONS,以及11Cl-PF3OUdS的质谱参数。负离子模式下,首先通过全扫确定目标化合物的母离子,之后进行离子扫描优化裂解电压,再进行子离子扫描找到子离子并优化碰撞能,最后在多反应监测模式下选择响应更高的子离子作为定量子离子。优化后的参数见表1。
2.2 吸附填料优选
为有效净化有机萃取液中所含的杂质,使用无水硫酸镁、石墨化碳黑(Graphitized carbon black, GCB)、离子交换材料的混合物作为SinCHERS柱中的净化填料,三类填料的作用分别为:吸收萃取液中可能含有的微量水分、去除色素等杂质、去除其他干扰性离子化合物。为考察具有不同层间距的GCB和不同离子交换材料对SinCHERS柱净化效果的影响,在两个污染水平下(基质样品中额外添加目标化合物10 ng、50 ng)对比了使用不同层间距的GCB和不同离子交换填料时PFAS的回收率,每种处理设置了6个重复。
层间距不同,GCB的净化能力也不同。为了选择合适的层间距,将层间距分别为10、20、30 nm的GCB与无水硫酸镁和离子交换材料HLB混合后作为SinCHERS柱内的净化填料,在两种污染水平下对比了各PFAS的回收率(图3a, b)。结果表明,当加标水平为10 ng时,若使用层间距为10 nm或30 nm的GCB,PFODA的回收率下降到57%以下。在50 ng的加标水平下,所有20种PFAS的回收率均在可接受范围内(70%—130%)[23-24],但层间距为30 nm时,SinCHERS柱去除色素的能力降低,净化后基质的颜色更深。根据回收率和净化效果对比,优选层间距为20 nm的GCB作为净化填料。GCB能吸附非极性/弱极性化合物,层间距越小,净化效果越好。但过小的层间距条件下不可逆吸附更容易发生,特别是对大分子物质。这可能是使用层间距为10 nm的GCB 时PFODA回收率较低的原因。相反,层间距为30 nm的GCB,其净化色素和其他干扰物质的能力也会降低。
为了选择合适的离子交换材料,对比了HLB、SAX、WCX 3种离子交换填料,分别将其与层间距为20 nm的GCB、无水硫酸镁混合后作为SinCHERS柱内的净化填料,在两种污染水平下对比PFAS的回收率(图3c, d)。结果表明,当使用HLB时,20种PFAS在两种加标水平下的平均回收率分别为71.0%—110.6%和74.0%—127%。而使用SAX和WCX时,无论在什么加标水平下,PFODA的回收率都下降到63%以下。在10 ng的加标水平下,使用HLB时,有12种PFAS的回收率更稳定,即回收率的标准方差低于另外两种填料。当使用SAX和WCX时,分别有4种PFAS的回收率的标准方差低于另外两种填料。HLB作为一种弱阴离子交换材料,在乙腈溶液中能吸收比PFAS酸性更强的阴离子化合物,降低了负离子模式下杂质阴离子对质谱的干扰。SAX作为一种强阴离子交换材料,对PFAS的吸附能力比HLB强。这可能是使用SAX时,PFODA回收率较低的原因。而阳离子交换材料WCX对干扰性阴离子化合物没有净化作用。
综合考虑不同填料组合条件下目标化合物的回收率范围和稳定性,优选层间距为200 Å的GCB、HLB与无水硫酸镁组合作为SinCHERS柱中的净化填料,使目标化合物同时具有较好的回收率和检测稳定性。
2.3 方法验证
用甲醇配制不同浓度梯度的标准物质混合标准溶液,拟合得到标准曲线的R2值均在0.99以上,线性范围在0.01—100 ng·mL−1,对应环境固体样品的可检测范围为0.005—50 ng·g−1 dw。
浓度为100 ng·mL−1的20种目标化合物的MRM色谱图如图4所示。可以发现,在优化的条件下,HPLC-MS/MS可以实现20种PFAS的分离。
基于该方法得到20种目标化合物的方法检出限见表2。PFAS的检出限范围0.46—2.31 ng·g-1 dw。当不添加土壤样品时,得到该方法程序空白,各目标化合物含量均低于检出限。
表 2 20种PFAS目标化合物的方法检出限(MDL, n=10)Table 2. Method detection limit (MDL) of 20 PFASs目标化合物Compound 方法检出限/(ng·g−1 dw)MDL 目标化合物Compound 方法检出限/ (ng·g−1 dw)MDL PFBA 0.95 PFTeDA 1.03 PFPeA 0.75 PFHxDA 1.44 PFHxA 0.97 PFODA 1.07 PFHpA 0.70 PFBS 0.80 PFOA 0.48 PFHxS 1.27 PFNA 0.64 PFOS 0.58 PFDA 0.75 PFDS 0.46 PFUnDA 0.62 HFPO-DA 2.31 PFDoDA 1.06 9Cl-PF3ONS 0.55 PFTrDA 0.95 11Cl-PF3OUdS 0.68 基于该方法得到20种PFAS的方法回收率如表3所示。其中,PFODA和PFBS的方法回收率为71.0%和78.4%,其余PFAS的回收率范围为84.1%—110.6%。该方法PFOA、PFODA、PFDS的回收率的标准偏差最小,为3.1%、3%、2.7%。其余PFAS的标准偏差在3.8%—13.4%之间。
表 3 20种PFAS目标化合物的方法回收率(平均值±标准偏差), n=6Table 3. Method recoveries of 20 PFASs (average±sd), n=6.目标化合物Compound 方法回收率/%Recovery rate 目标化合物Compound 方法回收率/%Recovery rate PFBA 110.2±6.9 PFTeDA 88±6.6 PFPeA 103.2±5.5 PFHxDA 95.3±10.1 PFHxA 98±6.6 PFODA 71.0±3 PFHpA 84.1±6.2 PFBS 78.4±7.7 PFOA 107.7±3.1 PFHxS 100.3±10.8 PFNA 110.6±3.8 PFOS 108.3±6.1 PFDA 99.2±4.7 PFDS 96.1±2.7 PFUnDA 103.8±5.5 HFPO-DA 91.3±13.4 PFDoDA 104.1±7.6 9Cl-PF3ONS 89.7±3.8 PFTrDA 101.5±5.9 11Cl-PF3OUdS 93.8±5.3 2.4 方法对比
再次利用青海省土壤基质样品(本文“1.4”部分),同时应用本方法和SPE样品前处理过程[22, 25-28]对样品进行处理。当在基质样品中额外添加10 ng目标化合物时,两种技术在回收率上的差异如图5所示,对于大部分PFAS,即碳链长度为4—14的全氟羧酸化合物,碳链长度为6和8的全氟磺酸化合物,HFPO-DA,以及11Cl-PF3OUdS,两种技术的回收率均在80%—120%之间。对于碳链长度为16和18的全氟羧酸化合物,即PFHxDA和PFODA,传统SPE技术的回收率仅为20%和1%,而SinCHERS技术的回收率为95%和71%,增大了可检测污染物的种类。对于PFDS和9Cl-PF3ONS,传统SPE技术的回收率为77%和79%,SinCHERS技术的回收率为96%和90%,回收效率显著提高。对于全氟丁烷磺酸来说,SinCHERS技术的回收率78%低于SPE技术102%,但仍可用于环境样品中该物质的检测定量[29]。
对于大部分PFAS,即碳链长度为4—11,14,16的全氟羧酸化合物,碳链长度为4、8、10的全氟磺酸化合物,HFPO-DA,9Cl-PF3ONS,以及11Cl-PF3OUdS,SinCHERS技术回收率的方差低于传统的SPE技术,说明对于大部分PFAS,该方法具有更好的稳定性。同时,SinCHERS技术在步骤上更为简洁,可节约大量的试剂耗材,且具有更高的时效性。
2.5 方法应用
为验证本方法对PFAS提取效果的稳定性和适用性,2020年7月,采集了黄河流域河套灌区大棚和露天条件下共67个农田土壤样品,应用本方法进行了PFAS样品加标回收率和实际样品浓度的测定,分析结果如表4所示。其中,PFODA的方法回收率为71.9%,其余PFAS的回收率范围为87.0%—110.5%。PFPeA、PFOA、PFODA的标准偏差最小,为2.9%、2.4%、2.1%,其余PFAS的标准偏差在3.5%—12.1%之间。67份土壤样品中,20种PFAS的总浓度
∑ ∑ 表 4 河套灌区土壤20种PFAS目标化合物的样品加标回收率(平均值±标准偏差, n=6)和浓度(范围)Table 4. Spiked recoveries (average ± sd, n=6) and concentrations (range) of 20 PFASs in soils from Hetao Irrigation District目标化合物Compound 浓度/(ng·g−1 dw)Concentration 加标回收率/%Spiked recovery 目标化合物Compound 浓度/(ng·g−1 dw)Concentration 加标回收率/%Spiked recovery PFBA <MDL—5.21 104.6±5.2 PFTeDA <MDL 107.7±6.9 PFPeA <MDL—3.09 87.0±2.9 PFHxDA <MDL 98.4±7.6 PFHxA <MDL 98.4±3.9 PFODA <MDL 71.9±2.1 PFHpA <MDL 88.1±3.5 PFBS <MDL 90.0±9.7 PFOA <MDL—2.62 99.6±2.4 PFHxS <MDL 92.5±10.9 PFNA <MDL—0.92 91.4±3.7 PFOS <MDL 110.5±7.3 PFDA <MDL—5.63 94.0±5.5 PFDS <MDL 100.7±4.5 PFUnDA <MDL 103.7±5.2 HFPO-DA <MDL 93.1±12.1 PFDoDA <MDL—1.23 99.4±4.3 9Cl-PF3ONS <MDL 102.5±5.3 PFTrDA <MDL 99.6±5.0 11Cl-PF3OUdS <MDL 106.7±5.7 通过对比大棚和露天条件下的污染特征可以发现,多数样点的
∑ 3. 结论(Conclusion)
该方法建立了基于SinCHERS-HPLC-MS/MS技术的环境固体样品中20种PFAS的萃取、净化和检测方法。优选出了无水硫酸镁、层间距为20 nm的GCB、HLB离子交换材料的组合作为SinCHERS柱内的净化填料,并优化了HPLC-MS/MS条件以分离并定量检测20种目标化合物。目标化合物的方法回收率在71.0%—110.6%之间。相较于SPE样品前处理流程,该方法大大缩短了样品中污染物萃取净化的时间,降低了经济成本,优化了某些长链PFAS的萃取效率。
-
表 1 20种PFAS目标化合物及10种内标物的质谱相关参数
Table 1. MS conditions for 20 PFASs and 10 Internal standards
目标化合物Compound 母离子(m/z)→子离子(m/z)Precursor ion (m/z)→Production (m/z) 裂解电压/VFragmentor 碰撞能量/eVCollision energy 内标Internal standard 目标化合物 PFBA 213.0 → 169.1 57 1 MPFBA PFPeA 263.0 → 218.9 68 2 MPFBA PFHxA 313.0 → 269.0 68 3 MPFHxA PFHpA 363.0 → 318.9 68 4 MPFOA PFOA 413.0 → 368.9 82 4 MPFOA PFNA 463.0 → 419.0 82 3 MPFNA PFDA 513.0 → 468.9 86 3 MPFDA PFUnDA 563.0 → 519.0 90 5 MPFUnDA 目标化合物 PFDoDA 613.0 → 569.0 90 5 MPFDoDA PFTrDA 662.9 → 619.0 80 5 MPFDoDA PFTeDA 713.1 → 669.0 100 7 MPFDoDA PFHxDA 813.0 → 769.0 100 9 MPFDoDA PFODA 913.0 → 869.0 118 10 MPFDA PFBS 299.0 → 80.0 135 32 MPFHxS PFHxS 399.0 → 80.0 150 40 MPFHxS PFOS 498.9 → 80.0 154 47 MPFOS PFDS 599.0 → 79.9 160 65 MPFOS HFPO-DA 329.0 → 169.0 49 5 M3HFPO-DA 9Cl-PF3ONS 530.8 → 350.9 120 22 MPFOS 11Cl-PF3OUdS 630.7 → 450.9 123 25 MPFOS 内标 MPFBA 217.0 → 172.0 57 1 MPFHxA 315.0 → 270.0 68 3 MPFOA 417.0 → 372.0 82 4 MPFNA 468.0 → 423.0 82 3 MPFDA 515.0 → 470.0 86 3 MPFUnDA 565.0 → 520.0 90 5 MPFDoDA 615.0 → 570.0 90 5 MPFHxS 403.0 → 103.0 150 40 MPFOS 503.0 → 80.0 154 47 M3HFPO-DA 331.2 → 169.0 44 5 表 2 20种PFAS目标化合物的方法检出限(MDL, n=10)
Table 2. Method detection limit (MDL) of 20 PFASs
目标化合物Compound 方法检出限/(ng·g−1 dw)MDL 目标化合物Compound 方法检出限/ (ng·g−1 dw)MDL PFBA 0.95 PFTeDA 1.03 PFPeA 0.75 PFHxDA 1.44 PFHxA 0.97 PFODA 1.07 PFHpA 0.70 PFBS 0.80 PFOA 0.48 PFHxS 1.27 PFNA 0.64 PFOS 0.58 PFDA 0.75 PFDS 0.46 PFUnDA 0.62 HFPO-DA 2.31 PFDoDA 1.06 9Cl-PF3ONS 0.55 PFTrDA 0.95 11Cl-PF3OUdS 0.68 表 3 20种PFAS目标化合物的方法回收率(平均值±标准偏差), n=6
Table 3. Method recoveries of 20 PFASs (average±sd), n=6.
目标化合物Compound 方法回收率/%Recovery rate 目标化合物Compound 方法回收率/%Recovery rate PFBA 110.2±6.9 PFTeDA 88±6.6 PFPeA 103.2±5.5 PFHxDA 95.3±10.1 PFHxA 98±6.6 PFODA 71.0±3 PFHpA 84.1±6.2 PFBS 78.4±7.7 PFOA 107.7±3.1 PFHxS 100.3±10.8 PFNA 110.6±3.8 PFOS 108.3±6.1 PFDA 99.2±4.7 PFDS 96.1±2.7 PFUnDA 103.8±5.5 HFPO-DA 91.3±13.4 PFDoDA 104.1±7.6 9Cl-PF3ONS 89.7±3.8 PFTrDA 101.5±5.9 11Cl-PF3OUdS 93.8±5.3 表 4 河套灌区土壤20种PFAS目标化合物的样品加标回收率(平均值±标准偏差, n=6)和浓度(范围)
Table 4. Spiked recoveries (average ± sd, n=6) and concentrations (range) of 20 PFASs in soils from Hetao Irrigation District
目标化合物Compound 浓度/(ng·g−1 dw)Concentration 加标回收率/%Spiked recovery 目标化合物Compound 浓度/(ng·g−1 dw)Concentration 加标回收率/%Spiked recovery PFBA <MDL—5.21 104.6±5.2 PFTeDA <MDL 107.7±6.9 PFPeA <MDL—3.09 87.0±2.9 PFHxDA <MDL 98.4±7.6 PFHxA <MDL 98.4±3.9 PFODA <MDL 71.9±2.1 PFHpA <MDL 88.1±3.5 PFBS <MDL 90.0±9.7 PFOA <MDL—2.62 99.6±2.4 PFHxS <MDL 92.5±10.9 PFNA <MDL—0.92 91.4±3.7 PFOS <MDL 110.5±7.3 PFDA <MDL—5.63 94.0±5.5 PFDS <MDL 100.7±4.5 PFUnDA <MDL 103.7±5.2 HFPO-DA <MDL 93.1±12.1 PFDoDA <MDL—1.23 99.4±4.3 9Cl-PF3ONS <MDL 102.5±5.3 PFTrDA <MDL 99.6±5.0 11Cl-PF3OUdS <MDL 106.7±5.7 -
[1] BUCK R C, FRANKLIN J, BERGER U, et al. Perfluoroalkyl and polyfluoroalkyl substances in the environment: Terminology, classification, and origins [J]. Integrated Environmental Assessment and Management, 2011, 7(4): 513-541. doi: 10.1002/ieam.258 [2] ITRC. PFAS — Per- and Polyfluoroalkyl Substances [EB/OL]. [2021-7-1]. https: //pfas-1. itrcweb. org/.https://pfas-1.itrcweb.org/ [3] UNEP. Governments unite to step-up reduction on global DDT reliance and add nine new chemicals under international treaty [EB/OL]. [2021-07-01]. http://chm.pops.int/Convention/Pressrelease/COP4Geneva9May2009/tabid/542/language/en-US/Default.aspx. [4] UNEP. The new POPs under the Stockholm Convention [EB/OL]. [2021-07-01]. http://chm.pops.int/TheConvention/ThePOPs/TheNewPOPs/tabid/2511/Default.aspx. [5] EESC. Opinion of the European Economic and Social Committee on the Proposal for a Directive of the European Parliament and of the Council relating to restrictions on the marketing and use of perfluorooctane sulfonates (amendment of Council Directive 76/769/EEC)[J]. Official Journal of the European Union, 2006(C 195): 10-13. [6] OECD. Organisation for Economic Co-operation and Development. Hazard assessment of perfluorooctane sulfonate (PFOS) and its salts [R/OL]. [2021-07-01].https://www.oecd.org/chemicalsafety/risk-assessment/2382880.pdf. [7] USEPA. Risk Management for Per- and Polyfluoroalkyl Substances (PFAS) under TSCA [EB/OL].[2021-07-01]. https://www.epa.gov/assessing-and-managing-chemicals-under-tsca/risk-management-and-polyfluoroalkyl-substances-pfass. [8] EC. Perfluorooctane sulfonate and its salts and certain other compounds regulations (PFOS regulations) [M/OL]. [2021-07-01].https://publications.gc.ca/site/eng/430879/publication.html. [9] GELLRICH V, STAHL T, KNEPPER T P. Behavior of perfluorinated compounds in soils during leaching experiments [J]. Chemosphere, 2012, 87(9): 1052-1056. doi: 10.1016/j.chemosphere.2012.02.011 [10] PETROVIC M, FARRÉ M, de ALDA M L, et al. Recent trends in the liquid chromatography-mass spectrometry analysis of organic contaminants in environmental samples [J]. Journal of Chromatography A, 2010, 1217(25): 4004-4017. doi: 10.1016/j.chroma.2010.02.059 [11] BOYACı E, RODRÍGUEZ-LAFUENTE Á, GORYNSKI K, et al. Sample preparation with solid phase microextraction and exhaustive extraction approaches: Comparison for challenging cases [J]. Analytica Chimica Acta, 2015, 873: 14-30. doi: 10.1016/j.aca.2014.12.051 [12] ANASTASSIADES M, LEHOTAY S J, ŠTAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce [J]. Journal of AOAC INTERNATIONAL, 2003, 86(2): 412-431. doi: 10.1093/jaoac/86.2.412 [13] 陈瑞. 通过式净化UPLC-MS/MS法测定植物性食品中苯脲类、苯甲酰脲类和磺酰脲类农药残留[D]. 杭州: 浙江工业大学, 2018. CHEN R. Pass through purification-UPLC-MS/MS for the determination of phenylurea, benzoylurea and sulfonylurea pesticide residues in plant food[D]. Hangzhou: Zhejiang University of Technology, 2018 (in Chinese).
[14] 孟志娟, 黄云霞, 赵丽敏, 等. 气相色谱-串联质谱法测定水果中50种农药残留 [J]. 色谱, 2018, 36(9): 917-924. doi: 10.3724/SP.J.1123.2018.04011 MENG Z J, HUANG Y X, ZHAO L M, et al. Determination of 50 pesticide residues in fruits by gas chromatography-tandem mass spectrometry [J]. Chinese Journal of Chromatography, 2018, 36(9): 917-924(in Chinese). doi: 10.3724/SP.J.1123.2018.04011
[15] 兰韬, 初侨, 郝东宇, 等. Sin-QuEChERS结合UPLC-MS/MS同时检测茶叶中10种有机磷农药残留 [J]. 质谱学报, 2019, 40(3): 268-279. doi: 10.7538/zpxb.2018.0123 LAN T, CHU Q, HAO D Y, et al. Simultaneously detection of 10 organophosphorus pesticides residues in tea by sin-QuEChERS with UPLC-MS/MS [J]. Journal of Chinese Mass Spectrometry Society, 2019, 40(3): 268-279(in Chinese). doi: 10.7538/zpxb.2018.0123
[16] 郭丽丽, 赵悠悠, 花锦, 等. SinChERS-液质联用分析远志与葛根药材中的农药残留 [J]. 中药材, 2019, 42(4): 747-753. doi: 10.13863/j.issn1001-4454.2019.04.009 GUO L L, ZHAO Y Y, HUA J, et al. Analysis of pesticide residues in polygala tenuifolia and pueraria lobata by the technology of SinChERS combined with LC-MS [J]. Journal of Chinese Medicinal Materials, 2019, 42(4): 747-753(in Chinese). doi: 10.13863/j.issn1001-4454.2019.04.009
[17] CHEN J N, LIAN Y J, ZHOU Y R, et al. Determination of 107 pesticide residues in wolfberry with acetate-buffered salt extraction and sin-QuEChERS nano column purification coupled with ultra performance liquid chromatography tandem mass spectrometry [J]. Molecules, 2019, 24(16): 2918. doi: 10.3390/molecules24162918 [18] 中国纺织工业联合会. 纺织品禁用偶氮染料快速测定方法: T/CNTAC 20—2018[S]. 中国纺织工业联合会, 2018. CNTAC. Textile—Rapid determination method of the banned azo colorants: T/CNTAC 20—2018[S]. China National Textile And Apparel Council. 2018 (in Chinese).
[19] ZHANG Q X. Extraction structure, extraction module, and liquid pretreatment device: US10150065[P]. [2018-12-11].https://patents.justia.com/patent/10150065 [20] USEPA. Definition and Procedure for the Determination of the Method Detection Limit, Revision 2[EB/OL].[2021-07-01].https://www.epa.gov/sites/default/files/2016-12/documents/mdl-procedure_rev2_12-13-2016.pdf/. [21] WANG P, LU Y L, WANG T Y, et al. Occurrence and transport of 17 perfluoroalkyl acids in 12 coastal rivers in south Bohai coastal region of China with concentrated fluoropolymer facilities [J]. Environmental Pollution, 2014, 190: 115-122. doi: 10.1016/j.envpol.2014.03.030 [22] ZHOU Y Q, MENG J, ZHANG M, et al. Which type of pollutants need to be controlled with priority in wastewater treatment plants: Traditional or emerging pollutants? [J]. Environment International, 2019, 131: 104982. doi: 10.1016/j.envint.2019.104982 [23] HIGGINS C P, FIELD J A, CRIDDLE C S, et al. Quantitative determination of perfluorochemicals in sediments and domestic sludge [J]. Environmental Science & Technology, 2005, 39(11): 3946-3956. [24] HU A L, QIU M, LIU H, et al. Simultaneous determination of phthalate diesters and monoesters in soil using accelerated solvent extraction and ultra-performance liquid chromatography coupled with tandem mass spectrometry [J]. Journal of Chromatography A, 2020, 1626: 461347. doi: 10.1016/j.chroma.2020.461347 [25] WANG C C, LU Y L, LI Q F, et al. Assessing the contribution of atmospheric transport and tourism activities to the occurrence of perfluoroalkyl acids (PFAAs) in an Alpine Nature Reserve [J]. Science of the Total Environment, 2019, 697: 133851. doi: 10.1016/j.scitotenv.2019.133851 [26] WANG P, WANG T Y, GIESY J P, et al. Perfluorinated compounds in soils from Liaodong Bay with concentrated fluorine industry Parks in China [J]. Chemosphere, 2013, 91(6): 751-757. doi: 10.1016/j.chemosphere.2013.02.017 [27] WANG P, LU Y L, WANG T Y, et al. Shifts in production of perfluoroalkyl acids affect emissions and concentrations in the environment of the Xiaoqing River Basin, China [J]. Journal of Hazardous Materials, 2016, 307: 55-63. doi: 10.1016/j.jhazmat.2015.12.059 [28] ZHANG M, WANG P, LU Y L, et al. Bioaccumulation and human exposure of perfluoroalkyl acids (PFAAs) in vegetables from the largest vegetable production base of China [J]. Environment International, 2020, 135: 105347. doi: 10.1016/j.envint.2019.105347 [29] SONG L, HAN Y T, YANG J, et al. Rapid single-step cleanup method for analyzing 47 pesticide residues in pepper, chili peppers and its sauce product by high performance liquid and gas chromatography-tandem mass spectrometry [J]. Food Chemistry, 2019, 279: 237-245. doi: 10.1016/j.foodchem.2018.12.017 [30] GHISI R, VAMERALI T, MANZETTI S. Accumulation of perfluorinated alkyl substances (PFAS) in agricultural plants: A review [J]. Environmental Research, 2019, 169: 326-341. doi: 10.1016/j.envres.2018.10.023 -




 下载:
下载: