-
三氯乙烯(trichloroethylene,TCE)是一种工业上广泛使用的氯代溶剂,历史上,因泄露或不当处置,TCE侵入地下水引发的环境安全问题日益受到关注。研发高效、绿色的地下水中TCE治理技术,是目前国内外环境工程技术领域关注的热点。
地下水中TCE的治理技术主要有化学还原、微生物降解[1]。其中,纳米零价铁因强还原活性被广泛应用于TCE污染地下水的修复[2-3]。然而,纳米零价铁在实际应用过程中存在局限:制备成本较高;在实际环境中易钝化失活,表面被氧化形成钝化层,阻碍电子传递、还原活性降低[4-6]。相比于纳米零价铁,工业铁粉更适合应用于实际TCE污染水体净化。一方面,工业铁粉具有更低的制备成本;另一方面,工业铁粉表面覆盖的氧化物钝化层,可起到保护内部还原活性组分的作用。如何利用工业铁粉的这一结构特点,原位释放工业铁粉钝化层内部的还原活性组分,是工业铁粉在实际TCE污染地下水治理中亟须解决的关键技术问题。铁还原菌广泛分布于各种环境介质中,其能够以有机物/H2作为电子供体,通过直接接触、细菌纳米线、电子穿梭体等多种机制,将零价铁表面钝化形成的铁(氢)氧化物中的Fe(Ⅲ)还原为Fe(Ⅱ),破坏零价铁表面的钝化层[7-9],释放内部更多的活性位点,消除其内部还原性铁物种与污染物之间的电子传递障碍,促进对TCE的还原降解[7, 10-11]。这为原位激活工业铁粉钝化层内部的还原活性组分,从而实现TCE污染地下水治理的实际应用提供了新的思路[4, 12]。目前,已报道的铁还原菌如Shewanella对含铁矿物类材料的铁还原效果欠佳[13],且耦合修复的周期过长[14-15]。通过筛选高活性铁还原菌,耦合具有还原活性的工业铁粉,构建全新的耦合修复技术体系,有望推动TCE污染地下水的绿色治理。
本研究从广东省中山市氯代烃污染土壤样品中分离得到了一株具有高效铁还原性能的新型铁还原菌Escherichia sp. F1,通过对菌株的全基因组测序,发现其包含多个与铁还原相关的基因。构建了“铁还原菌-工业铁粉”耦合修复技术,并考察了初始pH、菌株接种量及碳源浓度等因素对模拟地下水中TCE去除效率的影响。分析了还原前后工业铁粉和耦合材料表面形态变化及体系中的Fe(Ⅱ)浓度变化,探究了铁还原菌激活工业铁粉内部还原活性,从而提升模拟地下水中TCE去除效果的机理。研究结果可为地下水中TCE的绿色高效修复提供一种可行的方法及理论依据。
-
土壤来源:铁还原菌筛选采用的污染土壤为采自广东省中山市的氯代烃污染土壤。
以下所涉及的试剂均为分析纯,铁还原菌筛选所用培养基如下。
柠檬酸铁培养基组分:3.000 g·L−1柠檬酸铁(FeC6H5O7)、1.000 g·L−1氯化铵(NH4Cl)、0.070 g·L−1二水合氯化钙(CaCl2·2H2O)、0.600 g·L−1七水合硫酸镁(MgSO4·7H2O)、0.722 g·L−1三水合磷酸氢二钾(K2HPO4·3H2O)、0.250 g·L−1磷酸二氢钾(KH2PO4)、1.000 g·L−1葡萄糖(C6H12O6)。每升培养基中加入1 mL微量元素储备液、0.077 g·L−1二硫苏糖醇(C4H10O2S2)。用1.000 mol·L−1氯化氢(HCl)和1.000 mol·L−1氢氧化钠(NaOH)调节pH至7.2~7.4,培养基高压灭菌冷却后,加入1 mL过膜除菌后的维生素溶液及5 mg·L−1 TCE,备用。
微量元素储备液组分:10.000 mL·L−1氯化氢(HCl)、1.500 g·L−1四水合氯化亚铁(FeCl2·4H2O)、0.190 g·L−1六水合氯化钴(CoCl2·6H2O)、0.100 g·L−1四水合氯化锰(MnCl2·4H2O)、0.070 g·L−1氯化锌(ZnCl2)、0.006 g·L−1硼酸(H3BO3)、0.036 g·L−1二水合钼酸钠(Na2MoO4·2H2O)、0.024 g·L−1六水合氯化镍(NiCl2·6H2O)、0.002 g·L−1二水合氯化铜(CuCl2·2H2O)。
维生素溶液储备液组分:0.020 g·L−1生物素(C10H16N2O3S)、0.020 g·L−1叶酸(C19H19N7O6)、0.100 g·L−1盐酸吡哆醇(C8H10NO5P)、0.050 g·L−1核黄素(C17H20N4O6)、0.050 g·L−1维生素B1(C17H20N4O6)、0.050 g·L−1烟酸(C19H19N7O6)、0.050 g·L−1泛酸(C9H17NO5)、0.050 g·L−1对氨基苯甲酸(C7H7NO2)、0.050 g·L−1硫辛酸(C8H14O2S2)、0.001 g·L−1维生素B12(C63H88CoN14O14P)。
液体LB培养基组分:10 g·L−1蛋白胨、10 g·L−1氯化钠(NaCl)和5 g·L−1酵母浸粉,固体LB培养基在液体LB培养基的基础上添加15 g·L−1琼脂粉。
筛菌方法:铁还原菌的富集分离实验在厌氧手套箱中进行,称取10 g采自广东省中山市的氯代烃污染土壤样品,加入装有50 mL经高温灭菌冷却后的生理盐水的三角瓶中,充分涡旋混匀后,在厌氧箱中静置3 h,将涡旋混匀静置后的2 mL的土壤悬浊液和20 mL柠檬酸铁培养基加入40 mL透明培养瓶中,30 ℃恒温避光在厌氧培养箱中培养,每隔1 d摇匀,待溶液颜色由棕黄色变成透明色时,取培养瓶中的菌悬液转接至新的柠檬酸铁培养基中富集培养,待溶液颜色再次由棕黄色变成透明色时,连续转接富集培养3次后,将最后一次转接培养后的透明菌悬液在固体LB平板上涂布,挑选生长较快优势菌落,在固体LB平板上反复纯化5次,最终获得单一铁还原菌,将菌株命名为F1。
-
1)细菌形貌。菌落形态:在厌氧箱中将铁还原菌F1接种至固体LB培养基中,30 ℃培养24 h,观察其菌落形态。细菌的形态观察:将铁还原菌F1接种在液体LB培养基中培养24 h并5 000 r·min−1离心5 min收集菌体,使用无菌磷酸缓冲盐溶液洗涤2次,用2.5%的戊二醛溶液4 ℃固定过夜后,倒掉固定液,用30%、50%、70%、90%的乙醇溶液依次对样品进行梯度脱水,然后用100%的乙醇进行2次脱水处理,之后在超净台抽至风干,并于-80 ℃冷冻2 h后,用冷冻干燥机冷冻干燥[16]。样品经表面喷金处理后,采用扫描电子显微镜(SU8020 型,日本日立高新技术公司)进行菌株的形态观察。
2)16S rRNA测序及系统发育分析。将铁还原菌F1转接到液体LB培养基中扩大培养后,收集菌体送至苏州金唯智生物科技有限公司进行16S rRNA测序分析,测序结果与美国国立生物信息中心(NCBI)的基因库进行同源性比对,采用MEGA 11.0软件中的Neighbor-Joining方法初步构建铁还原菌F1的系统进化树。
3)菌株的生长曲线。将培养至对数期的菌液按2%的接种量转接进新的液体LB培养基中,以未接菌的液体LB培养基作为空白对照,分别于0、0.5、1、2、3、6、9、12、18、21、24、36、48、60、72 h取样,采用紫外分光光度计(LH-3BA,北京连华永兴科技发展有限公司)测定培养液在600 nm的吸光值(OD600),绘制铁还原菌F1的生长曲线。
4)铁还原菌F1的全基因组测序。将铁还原菌F1接种于液体LB培养基,30 ℃下厌氧培养至OD600约为0.6,8 000 r·min−1离心10 min收集菌体,送至百迈克生物科技有限公司进行全基因组测序。使用Canu v1.5软件对过滤后subreads进行组装。最后采用Pilon软件利用二代数据进一步对组装基因组进行纠错,最终得到准确度更高的基因组。利用预测得到的基因序列与KEGG等功能数据库做BLAST v2.2.29比对,得到基因功能注释结果。
-
1)铁还原实验设计。工业铁粉(400目,98%)购自上海阿拉丁生化科技股份有限公司。
菌悬液的制备:将铁还原菌F1转接到液体LB培养基中扩大培养至对数期,然后5 000 r·min−1离心10 min收集菌体,用灭过菌的0.85%的生理盐水洗涤3次,最后,用生理盐水悬浮菌体。
探究铁还原菌F1对Fe(Ⅲ)的还原性能:碳源添加量为5.56 mmol·L−1,在40 mL培养瓶中,接入18 mL柠檬酸铁培养基,初始Fe(Ⅲ)质量浓度为700 mg·L−1,然后接入2 mL对数期的菌液,对照组接入2 mL生理盐水。每组实验均设置3个平行。分别在1、3、5、8、15 d进行溶解态Fe(Ⅱ)和总Fe(Ⅱ)测定。
电子供体对铁还原菌F1对Fe(Ⅲ)还原性能的影响:选取葡萄糖、醋酸钠、乳酸钠3种不同电子供体,添加量均为5.56 mmol·L−1。其他实验条件同上,每组实验设置3个平行,置于30 ℃的厌氧培养箱中培养15 d,进行溶解态Fe(Ⅱ)和总Fe(Ⅱ)测定。铁还原率根据测定的Fe(Ⅱ)质量浓度与体系中加入的总Fe(Ⅲ)质量浓度比值计算,用百分数(%)表示。
2)测定方法。总Fe(Ⅱ)测定:将反应体系混匀后提取测定的样品中所有形式的Fe(Ⅱ)。Fe(Ⅱ)在pH 3~9的溶液中和邻菲啰啉(1,10-phenanthroline)发生络合反应生成橙红色络合物,利用分光光度计定量测定该络合物的质量浓度。取实验组与对照组体系溶液0.5 mL于50 mL具塞比色管中,加入5 mL缓冲溶液,2 mL 0.5%邻菲啰啉溶液,加水至标线,摇匀。显色5~10 min,用紫外可见分光光度计在510 nm处以水为参比测量吸光度。
溶解态Fe(Ⅱ)测定:测定反应溶液中不包括与固体颗粒或者其他物质结合的Fe(Ⅱ)。采用0.22 μm水系滤膜过滤实验组与对照组培养液,然后加入2 mL 0.5%邻菲啰啉溶液,加水至标线,摇匀。显色5~10 min,用紫外可见分光光度计在510 nm处以水为参比测量吸光度。
-
1)降解试验设计。参考文献中的方法配制模拟地下水[17-18]:每1.0 L超纯水中包括0.5 mmol二水合氯化钙(CaCl2·2H2O)、0.5 mmol·L−1六水合氯化镁(MgCl2·6H2O)、0.5 mmol·L−1碳酸氢钠(NaHCO3)、0.5 mmol·L−1碳酸氢钾(KHCO3),pH=7。实验在厌氧培养箱中进行,采用20 mL顶空瓶,反应体系为模拟地下水,TCE初始质量浓度为10 mg·L−1,对照组接入与菌液等量的生理盐水,工业铁粉的添加量为5 g·L−1。选定pH值、铁还原菌F1接种量、葡萄糖添加量进行降解条件的优化实验[19-20]。每组实验设置3个平行,置于30 ℃的恒温厌氧培养箱内反应7 d,采用GC-FID检测剩余TCE质量浓度,计算降解率。TCE降解率(η)的计算公式如式(1)所示。
式中:Cck为空白对照处理TCE的残留质量浓度,mg·L−1;Ct为工业铁粉或铁还原菌耦合工业铁粉降解体系中的TCE残留质量浓度,mg·L−1。
2)测定方法。TCE的检测方法:采用配有火焰离子检测器(FID)和顶空进样器(Agilent7697A,美国安捷伦公司)的气相色谱仪(Agilent7890B,美国安捷伦公司)测定反应前后的TCE质量浓度。仪器参数如下:顶空自动进样器中加热平衡温度为85 ℃,加热平衡时间为50 min。色谱柱为0.53 mm×30 m的GS-Q型毛细管柱,载气为氮气。进样口温度为200 ℃,进样口分流比为10:1,载气流速为25 mL·min−1,FID检测器温度为230 ℃。柱温箱升温程序:起始温度为50 ℃,保持7 min,然后以20 ℃·min−1升温,直至230 ℃,柱温箱维持温度230 ℃,10 min。进样物质为反应体系顶部气体,进样量为1 000 μL。通过外标法对TCE进行定量分析。TCE回收率为93.5%~98%。
材料的表征:为观察工业铁粉反应后的表面形态变化,将反应后样品用磁铁从水溶液中分离出来,采用去离子水洗涤,在厌氧条件下干燥,处理后的样品采用扫描电子显微镜(TESCAN MIRA LMS型,捷克Tescan公司)进行观察。反应前工业铁粉观察操作同上。为观察铁还原菌F1耦合工业铁粉反应后的材料表面形态,将铁还原菌F1和工业铁粉复合材料离心收集,在含有5%戊二醛和4%多聚甲醛的悬浮液中4 ℃下固定24 h,厌氧干燥后,进行扫描电子显微镜观察并获得不同组中材料表面的元素组成。通过X射线光电子能谱仪(Thermo Scientific K-Alpha型,美国赛默飞世尔公司)分析不同组中工业铁粉反应后的化学成分。
-
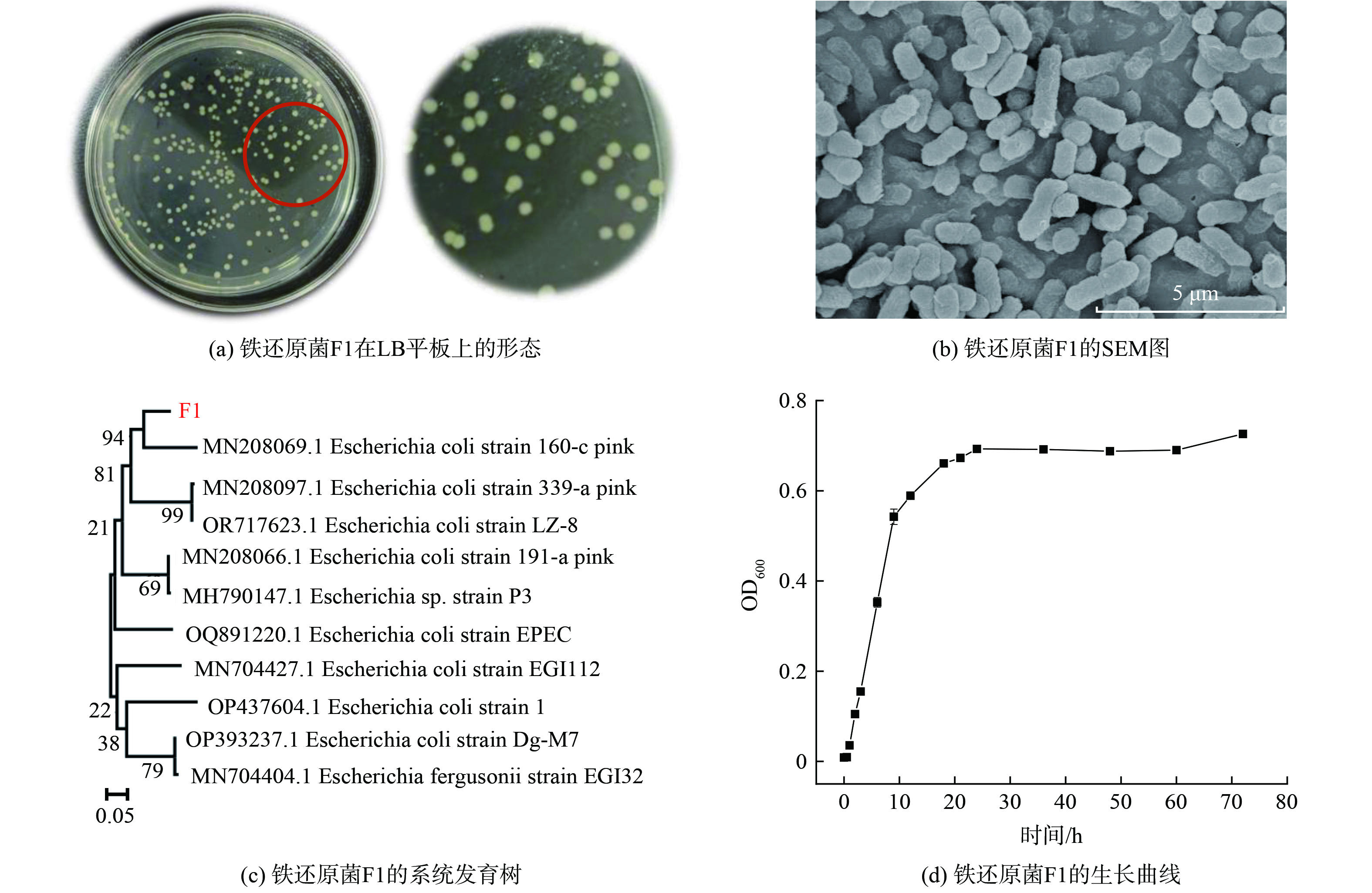
铁还原菌F1在固体LB平板上的形态如图1(a)所示,菌落为圆形,颜色为淡黄色,不透明,呈凸起状,表面光滑湿润,边缘有规律,厚度约为1.0~3.0 mm。如图1(b)所示,铁还原菌F1呈杆状,菌体直径约为0.5~1.0 μm,长度为1.0~3.0 μm。16S rRNA测序结果表明菌株与大肠杆菌Escherichia coli strain 160-c pink高度同源(99.71%),菌株命名为Escherichia sp. F1,菌株的系统发育树见图1(c)。该菌株已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.26035。铁还原菌F1的生长曲线如图1(d),菌株在12 h左右进入对数期增长,在24 h左右进入稳定期。
-
铁还原菌F1拼装好的基因组总序列长度为4 989 604 bp,GC比例为50.59%;共预测到4 572个编码基因,编码率为88.44%,预测序列总长度为4 412 811 kb,预测基因的平均长度为965 kb,并且鉴定出89个tRNA基因,22个rRNA基因。
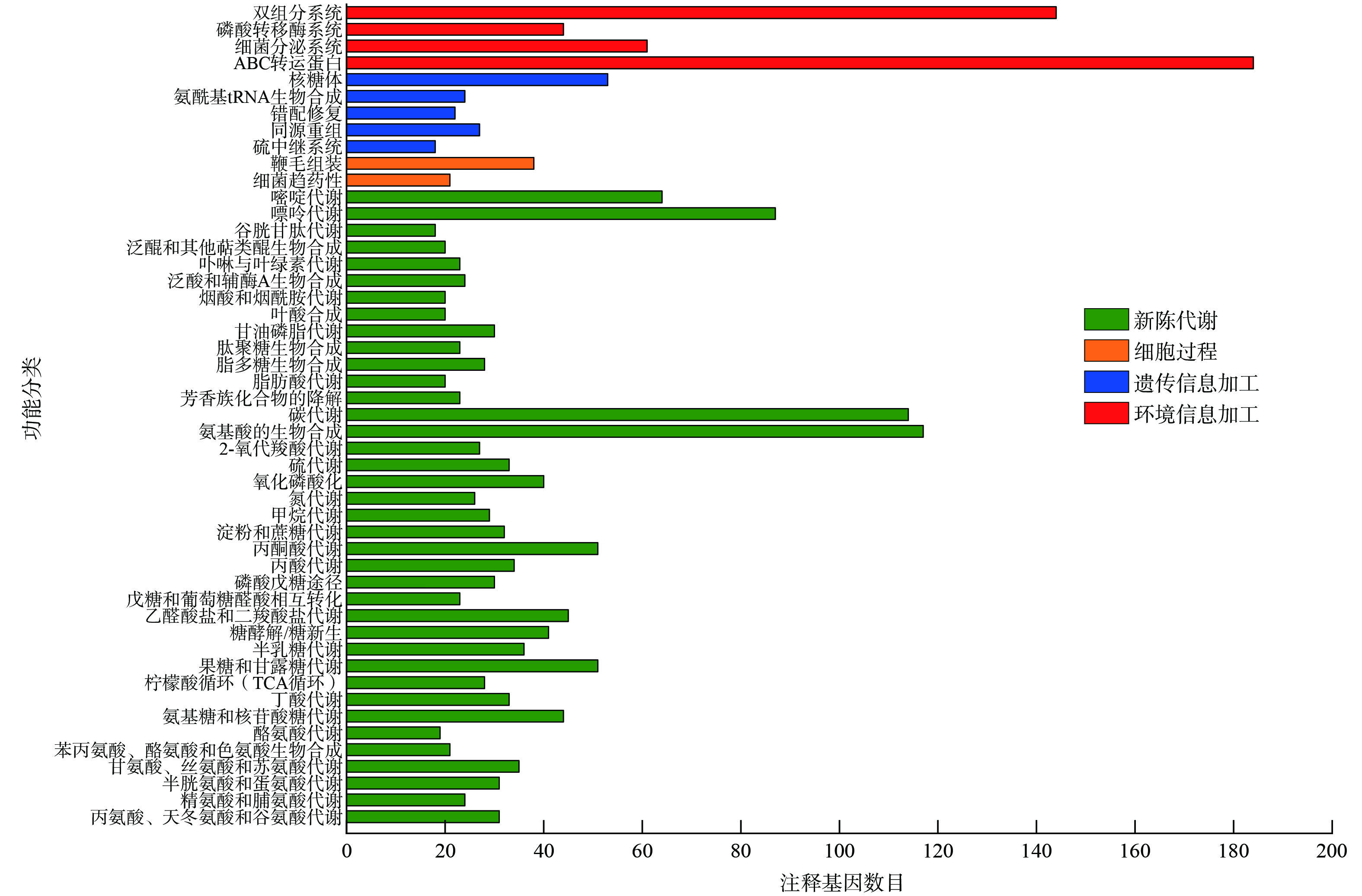
铁还原菌F1在KEGG数据库共注释到的基因共有3 112个,占总编码基因的68.07%。图2为铁还原菌F1的KEGG统计图。对铁还原菌F1的蛋白编码基因的KEGG注释分析,发现其包含的与ABC转运器(细菌质膜上的一种运输ATP酶)与双组分系统(细菌主要信号转导系统之一)有关的基因最多,分别有184、144个,将此部分基因与位于细胞膜上的与铁还原过程中直接电子传递相关的基因联系起来研究,能够为阐述铁还原菌F1还原机理提供有力证据。
研究表明铁还原菌在铁还原电子传递过程存在直接接触与间接接触两种形式[4],通过KEGG等功能分类注释结果,筛选出铁还原菌F1中与铁还原过程相关的细胞色素c、核黄素、醌类物质等相关基因,如表1所示。其中细胞色素c涉及直接接触形式,存在于细胞膜内的细胞色素c与电子在细胞内膜结合然后转移至细胞外膜,最终将电子转移至细胞外的电子受体[20-21]。核黄素、醌类物质等涉及间接接触形式[4]。核黄素不仅可与细胞外膜细胞色素c进行特异性结合从而辅助传递电子[22],还作为一种内源性电子穿梭体,变相缩短了细胞与电子受体之间的电子传递距离,提高了电子传递性能,进而提升铁还原效果[23]。且已有研究表明核黄素在铁还原过程中可促进碳钢类材料的腐蚀[24]。此外,细胞内所产生的醌类物质,如甲萘醌等,也可作为电子载体并进行跨膜运输作用[25],提高电子传递效率。上述分析表明,铁还原菌F1可通过其包含的多种基因腐蚀工业铁粉钝化层,使工业铁粉材料暴露出更多的反应位点实现钝化工业铁粉的重新激活。
-
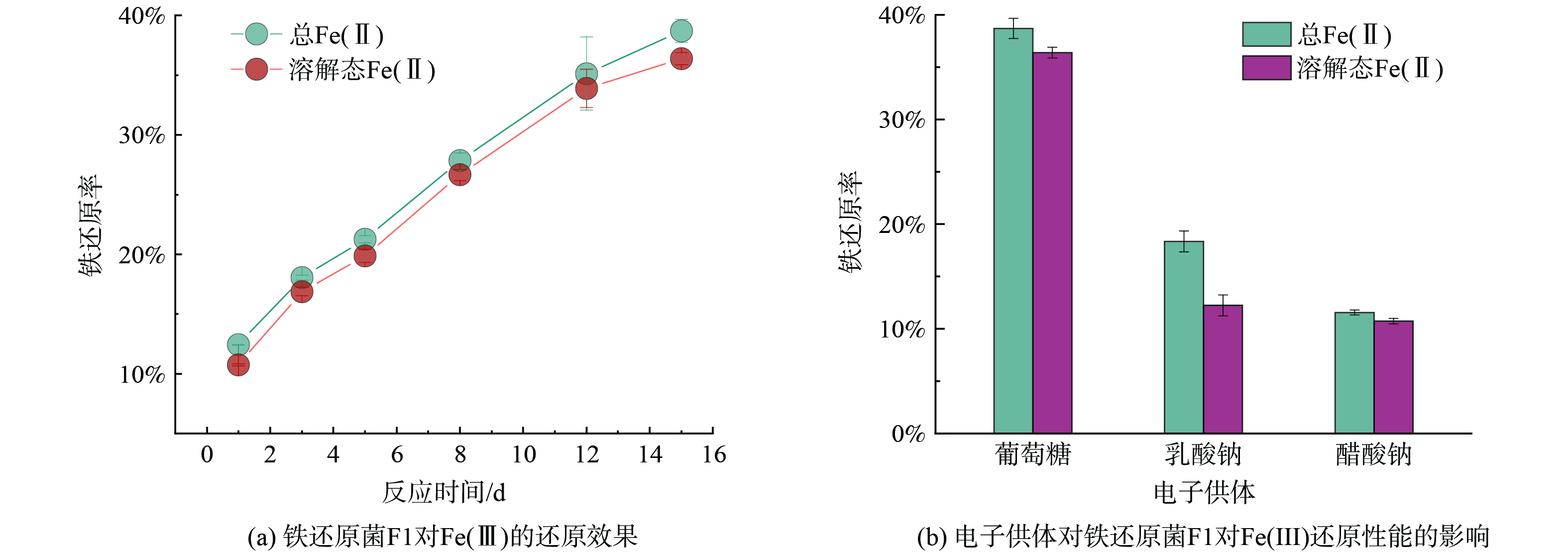
1)铁还原活性验证。在柠檬酸铁培养基中,铁还原菌F1还原Fe(Ⅲ),生成Fe(Ⅱ)的测定结果如图3(a)。铁还原菌F1在培养至1 d时,累积Fe(Ⅱ)质量浓度为(86.94±0.28)mg·L−1,已报道铁还原菌Enterococcus sp. ZQ21在以柠檬酸铁为电子受体,连续培养至1 d时,累积Fe(Ⅱ)质量浓度为(90.84±1.95)mg·L−1,虽然菌株ZQ21在1 d内有较好的活性,但继续培养后发现体系累积Fe(Ⅱ)质量浓度达到相对稳定水平[26]。而铁还原菌F1在之后的继续培养中,生成的Fe(Ⅱ)质量浓度仍在不断累积。在反应15 d时,生成的总Fe(Ⅱ)和溶解态Fe(Ⅱ)的质量浓度分别为(270.90±6.86)和(254.73±3.64)mg·L−1,铁还原菌F1对Fe(Ⅲ)的还原率为38.70%。结果表明,在15 d的铁还原过程中,铁还原菌F1对Fe(Ⅲ)表现出了持续的铁还原能力。
2)电子供体优化。在柠檬酸铁培养基中葡萄糖、乳酸钠、醋酸钠3种不同电子供体对铁还原菌F1还原Fe(Ⅲ)效率的影响见图3(b)。菌株在不同电子供体下对Fe(Ⅲ)的还原效果存在显著的差异。当菌株以葡萄糖为电子供体时,总Fe(II)和溶解态Fe(II)的还原生成率均最高,分别为38.70%与36.39%,与现有研究结果一致[27-29]。一方面,葡萄糖分子中含有的多个羟基可通过共价键断裂或者离子化的形式失电子,而乳酸钠与醋酸钠均只含有单个离子化位点,因此葡萄糖相对于乳酸钠和醋酸钠更易失去电子[30],从而能被铁还原菌F1更高效率的利用;另一方面,铁还原菌F1的全基因组测序结果表明,菌株存在合成核黄素的相关基因,而核黄素可起到促进其代谢葡萄糖所发生的电子传递过程[31]。因此,以葡萄糖为电子供体时,铁还原菌的还原效果最好。
-
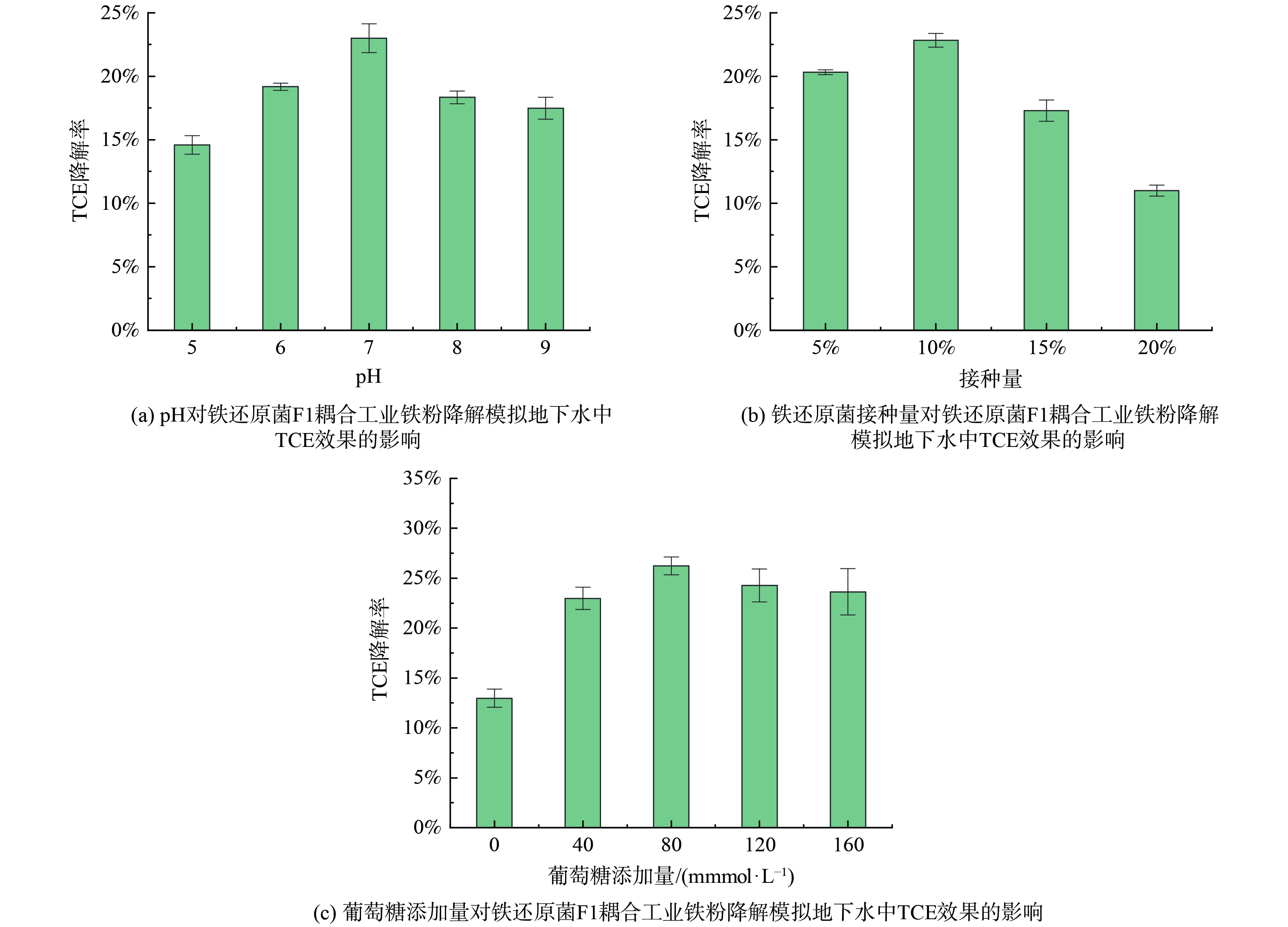
不同pH值下铁还原菌F1耦合工业铁粉对TCE的降解效果如图4(a)。结果表明,模拟地下水pH 6~9范围内,耦合后的降解效果均高于单独工业铁粉15.41%的降解率。而在单独添加铁还原菌时,无明显降解效果。当pH值小于7,耦合降解能力随pH的升高而提升,当pH值大于7时,耦合降解能力随之减弱。铁还原菌F1耦合工业铁粉最适降解pH值为7,此条件下的降解率为22.98%。已有研究表明,铁还原微生物生长的最适pH一般为中性[32]。pH值过低或者过高都会影响到微生物的活性[33-34],从而影响到铁还原及铁还原菌耦合工业铁粉降解模拟地下水中TCE过程。
铁还原菌F1接种量对耦合降解效果的影响如图4(b)。当接种量在5%~15%范围内时,铁还原菌F1耦合工业铁粉的降解能力均高于单独工业铁粉。接种量小于10%时耦合降解率随接种量的增加而提升,但接种量高于10%时,耦合降解能力随之减弱。最优铁还原菌F1的接种量为10%,此条件下的降解率为22.83%。研究表明,当接种量过低时,铁还原菌F1的生长速度缓慢,且容易被杂菌所污染;而接种量过高时,会使得有限的营养物质消耗速度过快,影响菌种的正常生长与代谢过程[35]。
葡萄糖添加量对耦合降解效果的影响如图4(c)。与单独工业铁粉添加组相比,不添加葡萄糖,铁还原菌F1耦合工业铁粉对TCE的降解率最低,但降解效果随葡萄糖添加量增加而逐渐上升,这可能由于葡萄糖作为碳源并提供电子供体使得铁还原反应正常进行[36-37]。当葡萄糖添加量小于80 mmol·L−1时,耦合降解能力随葡萄糖添加量的增加而提升,当葡萄糖添加量为80 mmol·L−1时,耦合体系对TCE的降解率最高,为26.24%。葡萄糖添加量的继续增加则导致耦合体系对TCE的降解能力减弱。可见适量添加葡萄糖有助于铁还原菌F1的代谢生长[37]。当葡萄糖添加量过低时,铁还原菌F1的正常生长繁殖和代谢会受到限制;当葡萄糖添加量过高时,可能导致菌株周围渗透压过高,影响其生长繁殖[38]。
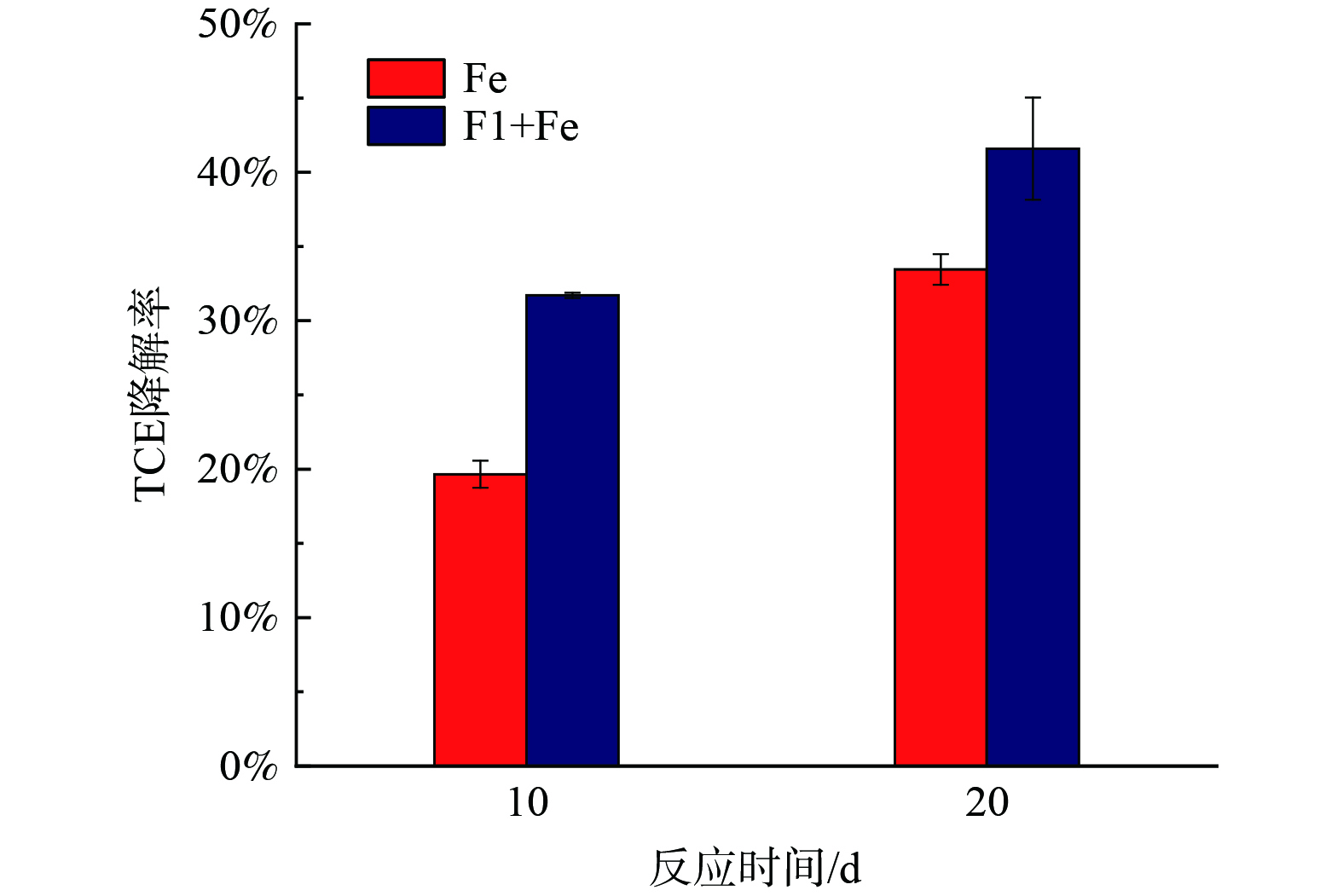
如图5所示,在pH为7、铁还原菌F1接种量为10%(v∶v)、葡萄糖添加量为80 mmol·L−1的最优降解条件下,厌氧培养10 d,单独工业铁粉与铁还原菌F1耦合工业铁粉对模拟地下水中TCE的降解率分别为19.66%和31.71%。厌氧培养20 d后,与工业铁粉33.46%的降解率相比,耦合降解率达到了41.59%。在之前的研究中,HONETSCHLAGEROVA等[11]采用铁还原菌Shewanella algae CCM
4595 耦合纳米零价铁降解水中的TCE,SHIN等[10]将Shewanella alga BrY与毫米零价铁耦合降解水中TCE,均未出现耦合增效。YANG等[14]采用Shewanella putrefaciens耦合钝化纳米零价铁对30 mg·L−1 TCE 20 d的降解率约为27%,将Shewanella putrefaciens与钝化微米零价铁耦合对水中30 mg·L−1 TCE 20 d的降解率约为60%,虽出现增效,但出现耦合增效所需时间较长,在7 d之后。而本研究中耦合材料与之相比,对模拟地下水中TCE的降解在7 d时已出现耦合增效,具有一定优势。从现有研究来看,已有铁还原菌耦合材料修复氯代烃污染地下水的研究多以希瓦氏菌Shewanella为主,尚未见埃希氏菌Escherichia作为铁还原菌耦合工业铁粉对地下水中TCE的降解研究。 -
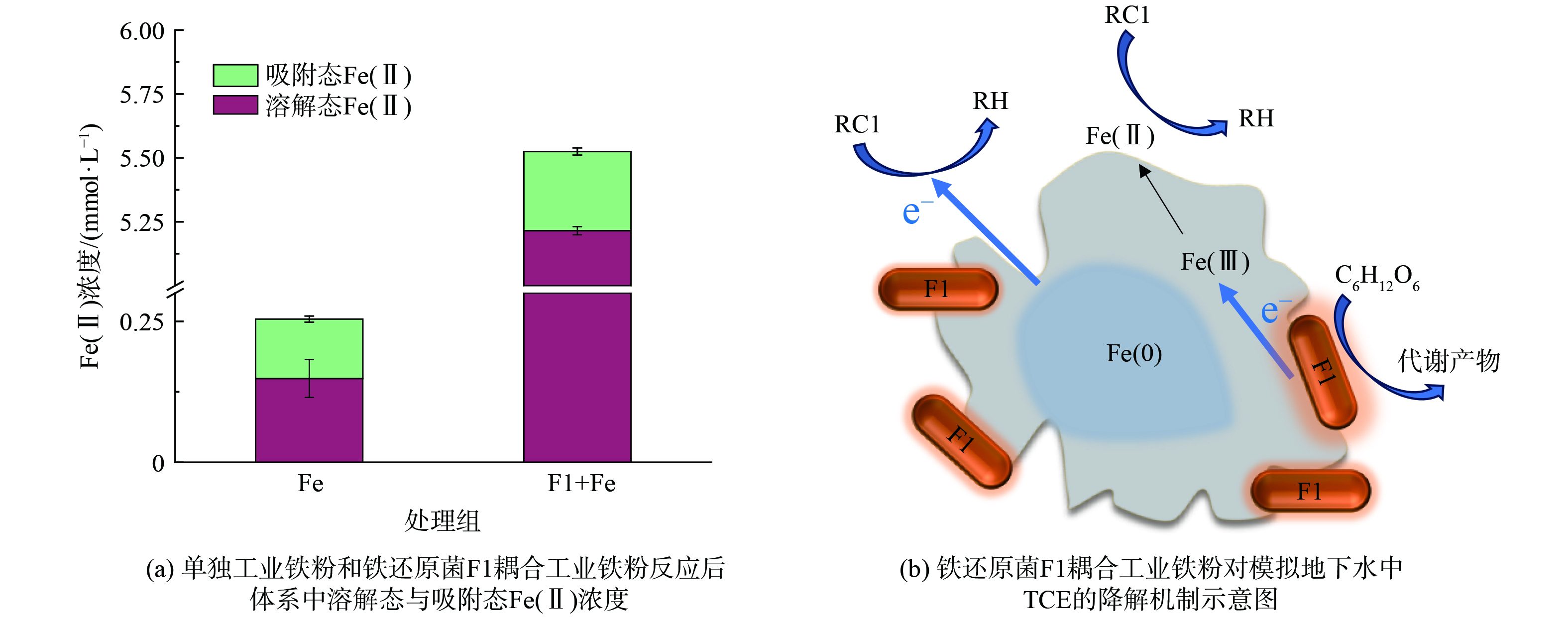
不同实验组材料的SEM结果如图6(a)~(c),由图可知,反应前工业铁粉表面较为光滑,无明显腐蚀状况;仅添加工业铁粉及耦合处理组在反应过后,表面腐蚀状况明显加剧;反应后材料的EDS分析结果如图6(d)、(e),表明加入铁还原菌F1的耦合体系中,工业铁粉表面铁原子占比从65.19%显著提升至94.59%,氧原子占比从34.81%降低到了5.41%,这表明了钝化层的减少,可见铁还原菌F1的加入使反应后工业铁粉得以暴露出更多活性铁物种与反应位点,提升了对TCE的降解[14]。XPS分析结果如图6(f)、(g)所示,单独工业铁粉反应后Fe(Ⅱ)和Fe(Ⅲ)原子占比分别为72.26和27.74%,而铁还原菌F1耦合工业铁粉反应后Fe(0)、Fe(Ⅱ)和Fe(Ⅲ)原子占比分别为25.02、70.21和4.77%,可见耦合体系中铁还原菌F1的添加,促进了工业铁粉内部Fe(0)、Fe(Ⅱ)活性铁物种的暴露。此外,经过测定反应后溶液中Fe(Ⅱ),证实在添加铁还原菌F1后,体系中的吸附态与溶解态Fe(Ⅱ)均有不同幅度提升(图7(a))。表明铁还原菌F1在破坏铁氧化物钝化层的同时,还能够利用自身铁还原特性,促进反应体系中新生态Fe(Ⅱ)的生成,从而提升了耦合修复技术对模拟地下水中TCE的去除效率[14]。
铁还原菌F1耦合工业铁粉对模拟地下水中TCE的降解机制如图7(b)所示。耦合修复体系中,铁还原菌F1能够破坏工业铁粉表面的钝化层,有利于内部还原活性组分的暴露,有效消除了还原活性铁物种与TCE间的电子传递障碍,实现工业铁粉还原性能的激活。
-
1)本研究从氯代烃污染土壤中新分离了一株铁还原菌,16S rRNA鉴定该菌株为埃希氏菌属,菌株命名为Escherichia sp. F1。全基因组测序结果表明菌株包含与直接电子传递相关的细胞色素c及与间接电子传递相关的核黄素、醌类物质等多个参与铁还原过程的功能基因。
2)铁还原菌F1对Fe(Ⅲ)的还原率为38.7%,累积Fe(Ⅱ)质量浓度可达(270.90±6.86)mg·L−1,并对Fe(ⅡI)表现出了持续的铁还原能力。
3)铁还原菌F1耦合工业铁粉在最优条件下反应20 d,对模拟地下水中10 mg·L−1 TCE的降解率可达41.59%。
4)耦合体系中,铁还原菌F1的加入加剧了工业铁粉表面的腐蚀和钝化层被破坏,促进了其反应位点及内部还原活性组分的暴露,提升了对模拟地下水中TCE的降解效果。
铁还原菌Escherichia sp. F1耦合工业铁粉对模拟地下水中三氯乙烯的降解
Degradation of trichloroethylene in simulated groundwater by the iron-reducing bacterium Escherichia sp. F1 coupled with industrial iron powder
-
摘要: 三氯乙烯(trichloroethylene,TCE)是地下水中检出较多的一种有机污染物。针对工业铁粉表面覆盖的氧化物钝化层阻碍其还原组分释放,导致对地下水中TCE还原净化效果差的问题,构建“铁还原菌-工业铁粉”耦合净化技术,以提升对模拟地下水中TCE的降解效果。从氯代烃污染土壤中富集分离新型铁还原菌,采用单因素实验探究铁还原菌耦合工业铁粉对TCE的最优降解条件,在最优降解条件下阐明耦合降解机制。结果表明,分离得到的铁还原菌Escherichia sp. F1具有高效的Fe(Ⅲ)还原能力,可还原生成质量浓度达(270.90±6.86)mg·L−1的Fe(Ⅱ),且在15 d内表现出持续的铁还原能力。在最优降解条件下(pH 7,铁还原菌接种量:10% v:v,工业铁粉投加量:5 g·L−1,葡萄糖浓度:80 mmol·L−1),反应20 d后,耦合材料对模拟地下水中TCE的降解率可达41.59%。进一步通过对耦合降解体系材料的扫描电镜、X射线能谱和X射线光电子能谱分析发现,铁还原菌F1的加入加剧了工业铁粉表面的腐蚀和钝化层被破坏,促进了其反应位点及内部还原活性组分的暴露,提升了对模拟地下水中TCE的降解效果。本研究为TCE污染地下水治理提供了一种新的方法。Abstract: Trichloroethylene (TCE) is a common organic pollutant detected in groundwater. The oxide passivation layer covering the surface of industrial iron powder prevents the release of its reducing components, resulting in poor reduction and purification of TCE in groundwater. To address this issue, an "iron-reducing bacterium-industrial iron powder" coupling remediation technology was developed to improve the degradation effect of TCE in simulated groundwater. A new iron-reducing bacterium was enriched and isolated from soil contaminated with chlorinated hydrocarbon. Single-factor experiments were used to explore the optimal degradation conditions of TCE by iron-reducing bacterium coupled with industrial iron powder, and the coupled degradation mechanism was elucidated under optimal degradation conditions. The results showed that the isolated iron-reducing bacterium Escherichia sp. F1 had high Fe(Ⅲ) reduction ability which could produce Fe(Ⅱ) with a mass concentration of (270.90±6.86) mg·L−1, and showed sustained iron-reducing capacity within 15 days. Under optimal degradation conditions (pH 7, bacterium inoculum: 10% v: v, dosage of industrial iron powder: 5 g·L−1, glucose concentration: 80 mmol·L−1), the degradation rate of TCE in simulated groundwater by the coupled material could reach 41.59% in 20 days. Further analysis of the materials in the coupled degradation system using scanning electron microscopy, X-ray energy spectroscopy, and X-ray photoelectron spectroscopy demonstrated that the addition of Escherichia sp. F1 intensified the surface corrosion and destroyed the passivation layer of industrial iron powder. As a result, the reaction sites and internal reducing active components of industrial iron powder were exposed, and the degradation effect of TCE in simulated groundwater was improved. This study provides a new method for the remediation of TCE-contaminated groundwater.
-
目前,国内外普遍在水源水体中检测到了不同种类的微量污染物[1-2]。这些微量污染物经过传统水处理工艺包括混凝、沉淀、过滤很难有效去除[3-4]。因此,高级氧化工艺如催化臭氧、紫外过氧化氢、紫外氯联合、芬顿等对微量污染物的强化去除方面的研究成为热点[5-8]。
多相芬顿技术作为高级氧化技术的一种,与活性炭工艺联用不仅可以去除水中天然有机物,还可以去除水中的有机农药、抗生素、内分泌干扰物等难降解的微量污染物,降低由微量污染物导致的水体毒性[9-12]。与其他深度处理技术相比,其不需要增加光、声、电等辅助设施,通常对温度和压力无要求,故具有非常广阔的应用前景[13]。
双酚A作为一种微量污染物,会影响人的内分泌系统,目前,对其降解的相关研究较多,除了化学法之外,也有采用微生物方法对其进行降解的研究[14-15]。在本研究中,首先以工业化合成的多相芬顿催化剂建立了多相芬顿催化柱,在北京某水厂进行了多相芬顿催化对天然有机物(NOM)的降解去除研究。在经过200 d运行后,通过对催化柱不同位置的催化剂进行取样,利用小试实验考察了生物膜对不同浓度双酚A去除效果的影响,最后为了分析生物膜的作用,对催化剂表面生物膜群落结构等进行了表征。本研究结果表明多相芬顿技术是一种很有应用前景的去除微量污染物的实用技术。
1. 材料与方法
1.1 中试装置及运行条件
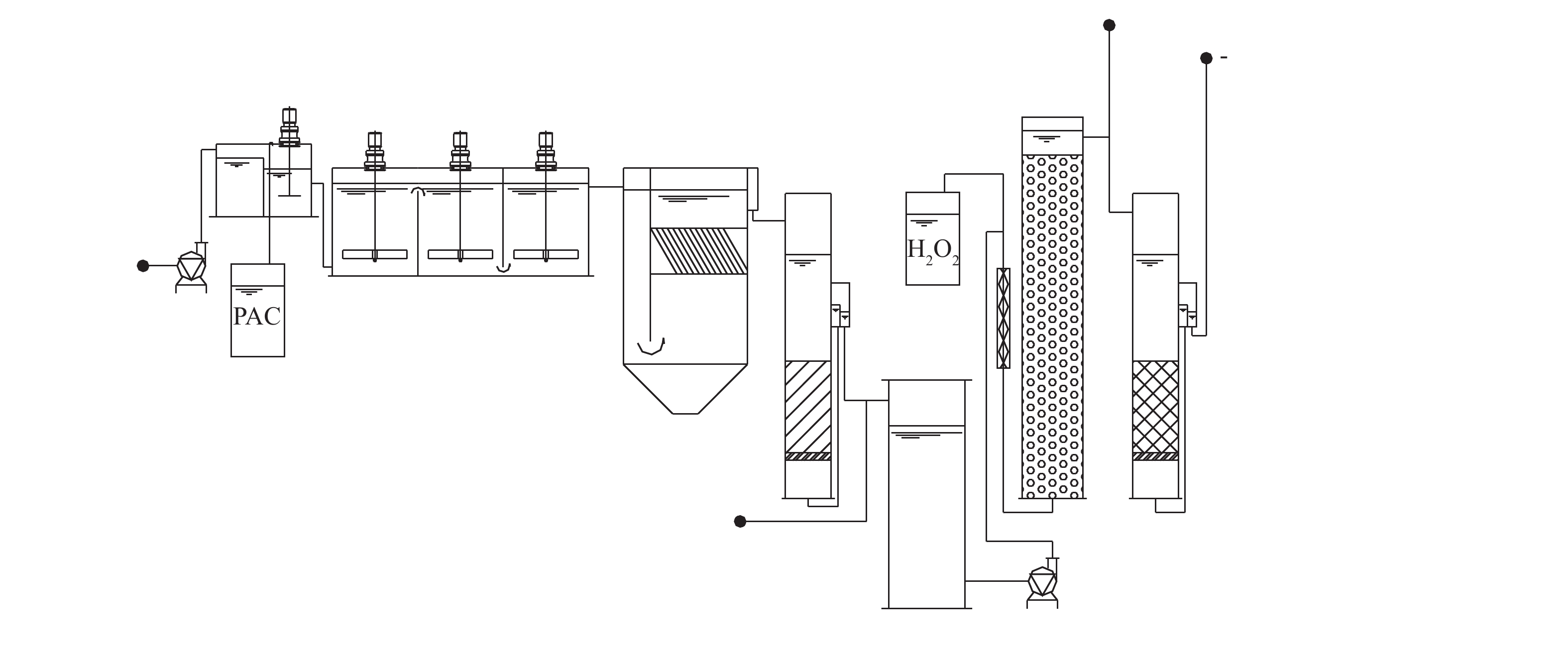
中试装置建在北京市某自来水厂实验基地内,装置采用的水处理工艺流程包括混凝-沉淀-砂滤-多相芬顿催化氧化-活性炭过滤,装置及流程图如图1所示。本研究所使用的多相芬顿催化剂以氧化铝小球为载体,以铜、钴等化合物为主要成分,并以吨级规模工业合成(目前尚未商品化生产),LYU等[16]对该类催化剂已有较多的研究报道。多相芬顿催化柱流量30 L·min−1、水力停留时间为15 min、投加过氧化氢量为0.15 mmol·L−1、活性炭柱流量为30 L·min−1、水力停留时间为15 min、反冲周期为7 d。
1.2 小试装置及运行条件
由于该水厂原水中没有检测到双酚A的存在,而且考虑到在水厂中人为添加微量污染物实验排水会影响环境,因此,在中试现场对水体中NOM进行了为期200 d的去除研究,同时考察了对消毒副产物和致病微生物控制效果,相关的研究结果[17]已发表。芬顿催化柱高度为4.0 m,经过长时间运行之后,在芬顿催化柱上、中、下层(柱高分别为3.6、1.8和0.5 m处)分别取适量材料,之后在实验室进行双酚A去除的小试研究。把上、中、下3层催化剂材料分别填装,共填装6根小柱(柱子尺寸40 mm×30 cm):3根小柱分别装填上、中、下3层的多相芬顿催化剂,另外3根小柱装填上、中、下3层经过超声振荡并清洗后无生物膜的多相芬顿催化剂。
实验分别在2种条件下运行,一种配制进水双酚A浓度为10 μg·L−1,运行条件与中试相同,停留时间为15 min;另一种条件配制进水双酚A浓度为5 mg·L−1、停留时间为40 min。2种实验条件分别连续运行7 d,并于第2、4和6天取样,分析2种条件下双酚A的去除率,且考察了生物膜对双酚A去除效果的影响。
1.3 中试进水水质
中试实验流程进水采用水厂水源水经预氯化后水,经检测水质如下:温度为(20±2) ℃、浊度为3.0 NTU、DOC为(3.5±0.6) mg·L−1、pH=7.6~8.6、硬度为80~126 mg·L−1(以CaCO3计)、碱度为75~126 mg·L−1(以CaCO3计)、其他各种离子(2~3 mg·L−1
NO−3 -N、4~8 mg·L−1 Cl-、0.2~0.5 mg·L−1 F-、21~36 mg·L−1SO2−4 )。1.4 分析方法
水中溶解性有机碳 (DOC) 采用TOC分析仪(TOC-VCPH,SHIMADZU, Japan)。H2O2浓度利用辣根过氧化氢酶采用分光光度法分析。
在进行催化剂上生物膜采样时,首先把催化剂进行冷冻干燥然后称取一定量的催化剂利用灭菌棉签擦拭催化剂表面,并用磷酸盐缓冲溶液(PBS)进行冲洗,然后把棉签和磷酸盐缓冲溶液一起进行超声震荡,收集PBS溶液[17]。催化柱上中下层出水各采集1 L溶液。上、中、下3层出水及生物膜各取样3个,分别标记为生物膜上层(RS1.1、RS1.2、RS1.3),生物膜中层(RS2.1、RS2.2、RS2.3),生物膜下层(RS3.1、RS3.2、RS3.3),上层出水(RS4.1、RS4.2、RS4.3),中层出水(RS5.1、RS5.2、RS5.3)和下层出水(RS6.1、RS6.2、RS6.3)。
把溶液过0.45 µm聚碳酸酯膜,然后用Fast DNA spin kit for soil(Qbiogene,Solon,OH)试剂盒进行DNA基因提取。利用7300实时荧光定量聚合酶链式反应系统仪器(7300 Real Time PCR System)分析检测总细菌(16S rRNA),用于表征催化剂表面的微生物量。同时基于IonS5TMXL测序平台,利用单端测序方法构建小片段文库进行单端测序。通过对Reads剪切过滤,OTU(operational taxonomic units)聚类,β多样性分析采用算术均值的非加权配对平均法(unweighted pair-group method with arithmetic mean, UPGMA)聚类分析。最后根据16S测序数据进行基于KEGG数据库的功能预测。
对传统的热提取方法进行了优化,以提取生物膜中微生物的胞外多聚物(EPS),具体步骤参照文献中的方法[18]。然后用Folin苯酚比色法测定EPS中的蛋白质,以牛血清白蛋白为标准物质。用苯酚硫酸比色法测定EPS中的多糖,以葡萄糖为标准物质,并使用三维荧光(EEM)对EPS进行成分分析。
低浓度双酚A首先利用固相萃取柱进行浓缩,然后利用超高效液相色谱四极杆-飞行时间质谱联用仪(UPLC-Q-TOF-MS,ACQUITY UPLC/Xevo G2 Q-TOF,Waters)。
2. 结果与讨论
2.1 多相芬顿对溶解性有机碳(DOC)的去除效果
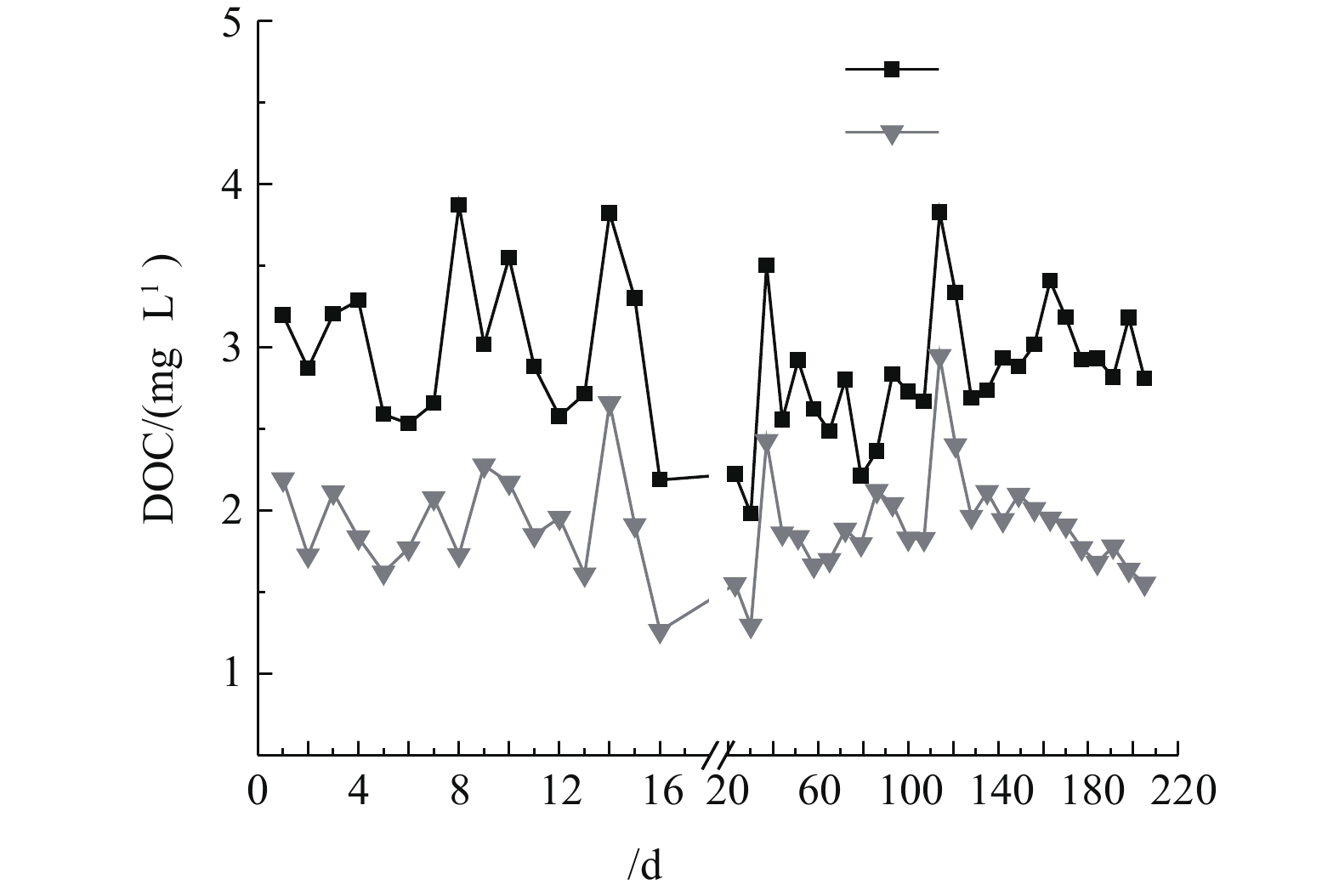
多相芬顿催化柱中试实验连续运行200 d,运行周期内多相芬顿催化柱进出水溶解性有机碳(DOC)变化如图2所示。砂滤出水(多相芬顿催化柱进水)的DOC为(3.12±0.51) mg·L−1,经过多相芬顿催化剂处理后DOC值降低至(1.96±0.49) mg·L−1,在相同运行时间条件下比砂滤出水降低了42%~63%。由图2可以看出,多相芬顿催化柱对NOM有很好的去除效果。另外,在中试运行120 d以后,多相芬顿出水DOC出现稳中有降的趋势,这可能与生物膜的形成有关。
2.2 生物膜对双酚A去除的影响
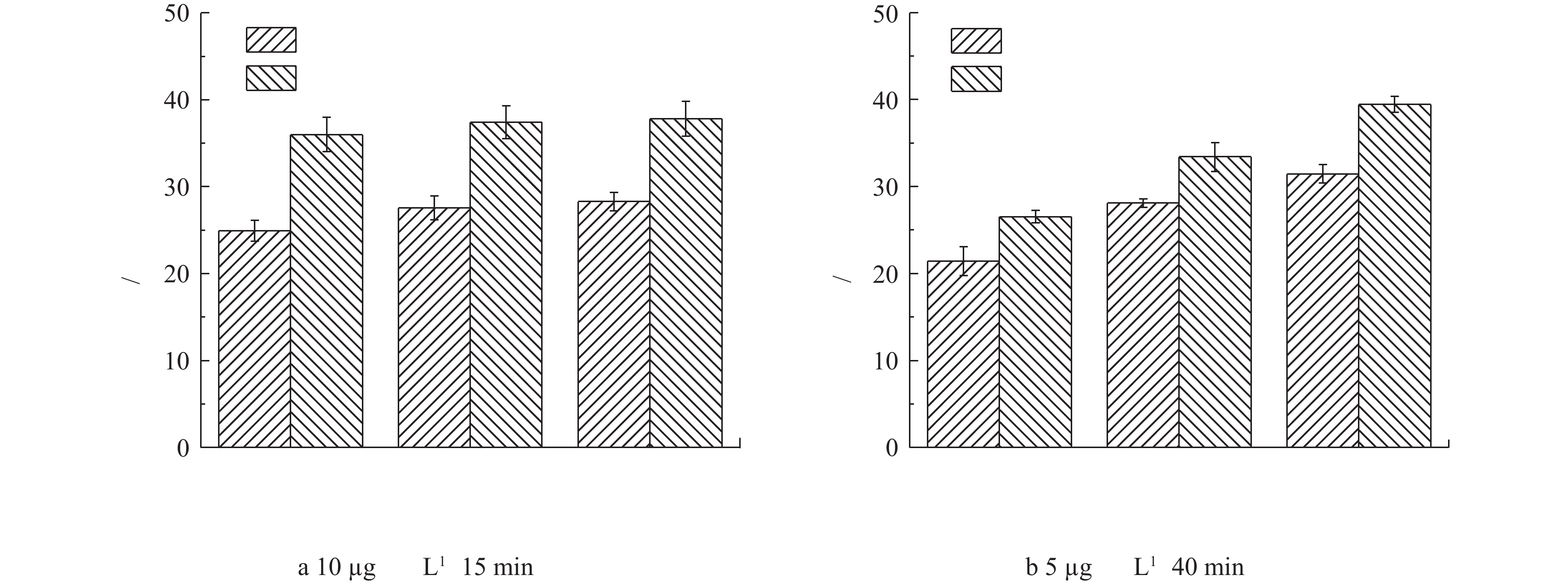
为了分析生物膜对芬顿催化剂去除双酚A的影响,我们对上、中、下3层具有不同生物膜的催化剂材料分别进行了小试实验。根据国家标准《生活饮用水卫生标准》(GB 5749-2006)中生活饮用水水质参考指标及限值规定,饮用水中双酚A浓度不得高于10 µg·L−1,因此,我们选择此浓度为低浓度进行研究。图3反映了不同起始浓度下双酚A的降解率。如图3(a)所示,在停留时间仍然为15 min且在不加H2O2的条件下,低浓度(10 µg·L−1)双酚A在无生物膜的上、中、下3层催化剂中的去除率分别为24.9%、27.6%和28.3%,而在有生物膜的上、中、下3层催化剂上去除率分别为36.0%、37.4%和37.8%。该结果说明,上、中、下3层催化剂洗去生物膜后,对双酚A去除效果基本相同,而具有不同生物膜群落组成的上、中、下3层催化剂对其去除效果也基本相同。但是,有生物膜的催化剂明显比没有生物膜的催化剂去除效果更好。
除了低浓度双酚A,本研究还进行了高浓度5 mg·L−1双酚A的去除实验,由于其浓度较高,控制停留时间为40 min,结果如图3(b)所示。与低浓度双酚A的实验结果类似,有生物膜的催化剂比没有生物膜催化剂对双酚A的去除率较高,而且有生物膜的催化剂从上层到下层其对双酚A的去除能力有逐渐增强趋势,在下层中对双酚A的去除率达到了39%。
因此,在中试条件下,控制多相芬顿催化柱流量30 L·min−1,水力停留时间为15 min,投加过氧化氢量为0.15 mmol·L−1,冲洗周期为7 d的条件下,多相芬顿催化柱表面形成的生物膜影响了小试过程中双酚A的去除,使得双酚A去除率有所提高,同时发现,随着停留时间的延长,下层生物膜影响较大。
2.3 多相芬顿催化剂表面生物膜表征
1)微生物群落多样性。根据实验分析方法描述,对催化柱上中下3层进行生物膜和出水中微生物采样分析,图4所示为6组样品的所有平行样,共18个,在微生物门水平(phylum level)上对其多样性基于进化序列差异(unweighted unifrac)距离矩阵进行的UPGMA聚类树分析。由图4可以看出,生物膜和水中微生物各自聚类在一起,这说明生物膜和水中微生物存在差别。有研究[19]表明,过滤过程中生物膜对其出水中微生物存在决定作用,该结果上层出水与生物膜相似性高,中下层出水与生物膜差别大,这可能是由于H2O2从催化剂底部投加,中、下层为H2O2初始反应阶段,产生的羟基自由基对水体中微生物生长影响较大。另外,中层生物膜RS2.1、RS2.2、RS2.3和下层生物膜RS3.1、RS3.2、RS3.3聚类在一起,相似度较高,与上层生物膜有一定差别,该结果同样说明,随着反应不断进行,H2O2浓度有搜降低,从而影响了生物膜群落组成。有研究[20]表明,加氯消毒过程对微生物群落结构影响较大,该结果也说明,多相芬顿反应投加H2O2能够影响微生物群落结构组成。
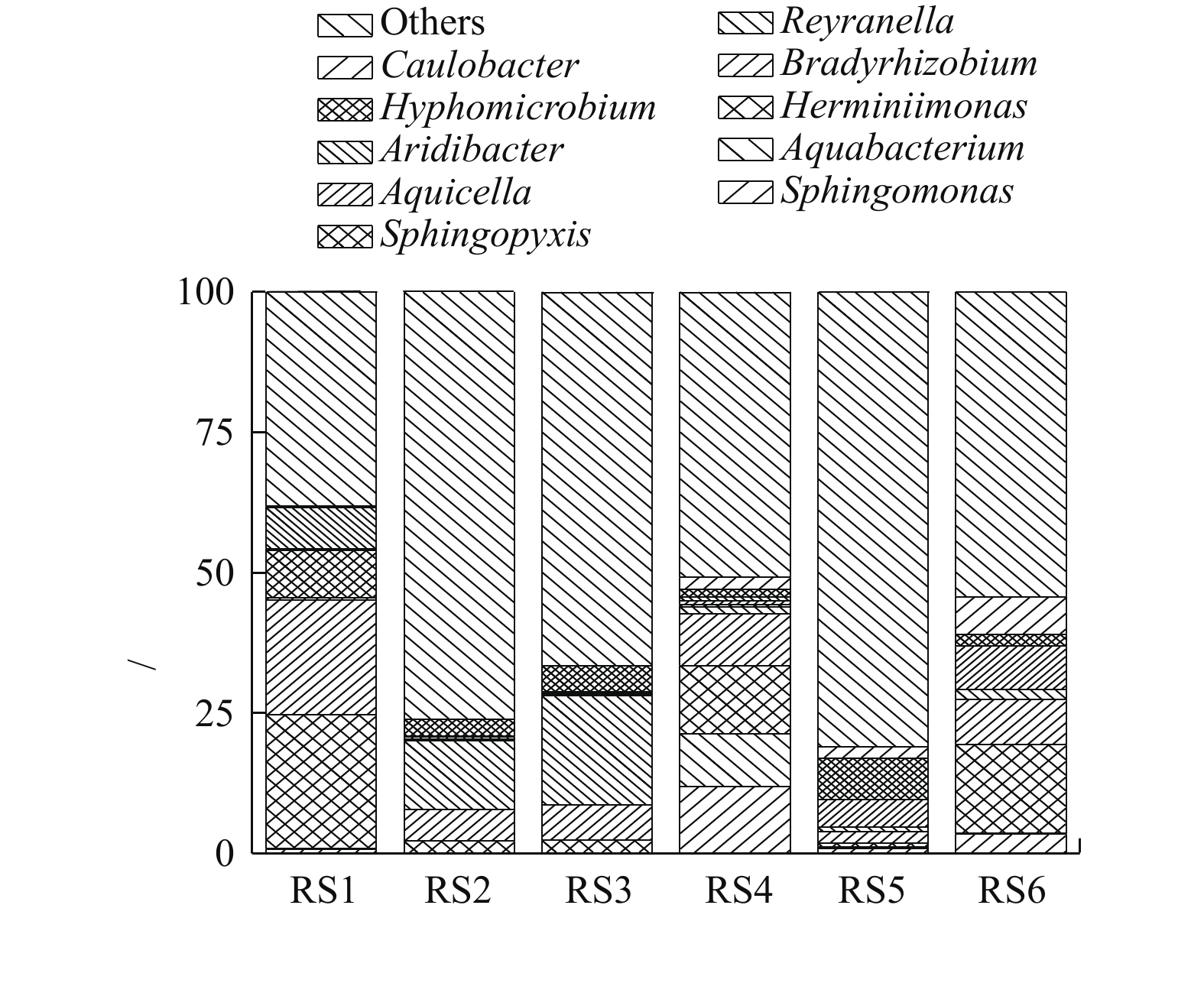
2)微生物群落组成。为了进一步分析生物膜及出水中微生物群落组成,对生物膜及出水微生物在属水平上相对丰度在前10的微生物进行作图分析(每组样品3个平行样取平均值作图),如图5所示。通过对比分析发现,上层生物膜RS1中赫山单胞菌属(Herminiimonas)、慢生根瘤菌属(Bardyrhizobium)、鞘氨醇盒菌属(Sphingopyxis)和旱杆菌属(Aridibacter)4种微生物菌属较多,其对应的相对丰度分别为23.9%、20.5%、8.5%和7.3%。中层生物膜RS2中这4种菌属分别降低至2.1%、5.6%、0.3%和0.06%,下层生物膜RS3这4种微生物菌种降低至2.2%、6.3%、0.3%和0.2%。但是在中层RS2和下层RS3生物膜中Reyranella菌属和生丝微菌属(Hyphomicrobium)含量明显升高。RS2中相对丰度分别为12.2%和3.1%,RS3中分别为19.4%和4.7%。另外,催化柱上、中、下3层出水微生物变化较大,在上层出水RS4中鞘氨醇单胞菌属(Sphingomonas)、水杆菌属(Aquabacterium)、赫山单胞菌属(Herminiimonas)和慢生根瘤菌属(Bardyrhizobium)相对丰度较高。中层出水RS5中Aquicella和生丝微菌属(Hyphomicrobium)相对丰度较高。下层出水RS6中赫山单胞菌属(Herminiimonas)、慢生根瘤菌属(Bardyrhizobium)、柄杆菌属(Caulobacter)相对丰度高。结果表明,相比于生物膜,不同层出水中微生物群落组成变化较大。另外,投加H2O2是从催化柱下面投加,H2O2接触到催化剂表面生成羟基自由基(∙OH)对有机物进行降解并灭活微生物,随着反应进行从下层到上层H2O2浓度逐渐降低。因此,生物膜中赫山单胞菌属(Herminiimonas)、慢生根瘤菌属(Bardyrhizobium)、鞘氨醇盒菌属(Sphingopyxis)和旱杆菌属(Aridibacter)相对丰度从下层到上层逐渐增加,但是芬顿催化柱中层和下层生物膜群落组成相似,其中,Reyranella菌属和生丝微菌属(Hyphomicrobium)含量明显比上层高。
3)微生物功能分析。根据测序样品在数据库中的功能注释及丰度信息,从功能查阅层面进行聚类分析。其中,微生物功能分析包括细胞过程、环境信息处理、遗传信息处理、关于人类疾病、新陈代谢、有机系统、无法归类和无功能共8种。在环境信息处理和新陈代谢方面,中层和下层催化剂生物膜的微生物功能更强。以上结果说明,受周围环境H2O2和有机物浓度的影响,中层和下层催化剂生物膜的微生物表现出更强的代谢能力。
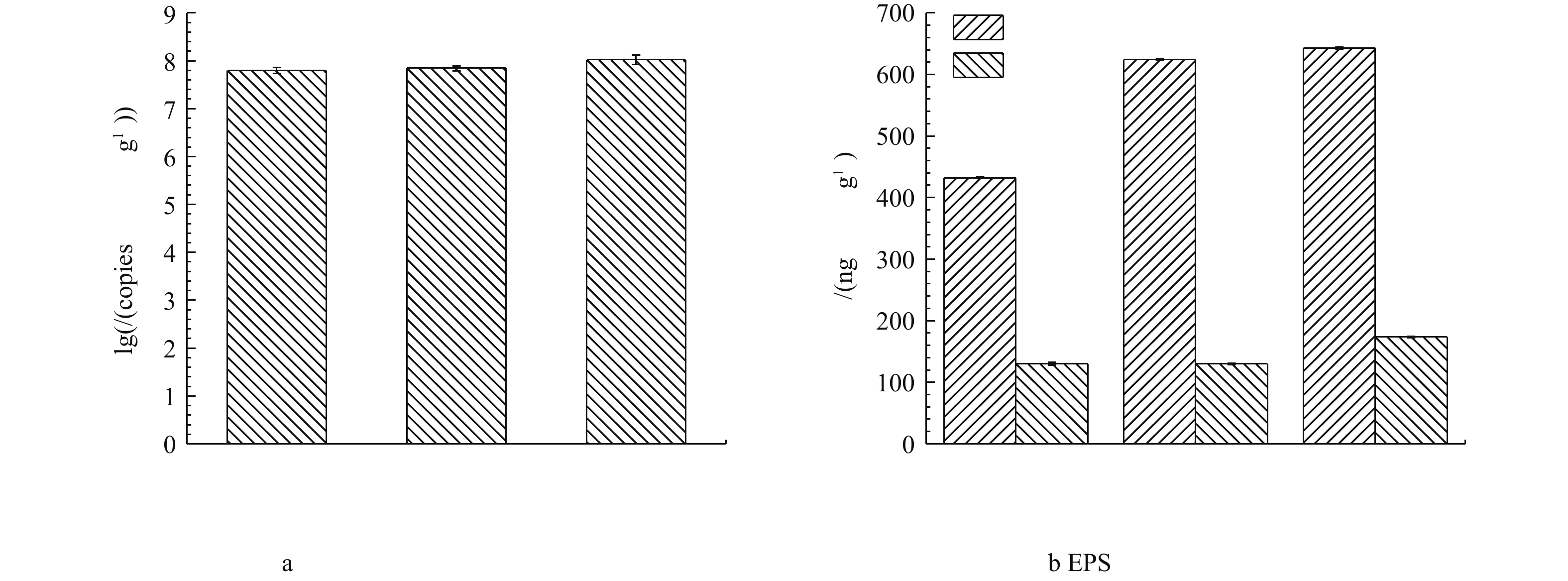
通过对生物膜上微生物16S rRNA进行定量分析,发现下层微生物总细菌含量最多,微生物基因拷贝数高达8个对数量级;中层其次,上层最少,分别为7.8个和7.7个对数量级(图6(a))。由对催化剂表面生物膜上胞外多聚物EPS表征结果可以看出,在中、下层的生物膜上微生物EPS中蛋白质含量较高,分别高达624.3 ng·g−1和642.8 ng·g−1(图6(b))。
因此,中试过程中从催化柱下部投加H2O2溶液,起始投加量为5 mg L−1,随着反应的进行,从下到上的H2O2浓度逐渐降低,出水H2O2浓度为0.45 mg L−1。随着催化柱从下到上H2O2浓度变化及其对有机物的降解,多相芬顿催化柱上、中、下3层出水中微生物群落组成变化较大,但是生物膜上微生物群落存在相似性,其中,中层和下层相似度高。上层生物膜中微生物以赫山单胞菌属(Herminiimonas)和慢生根瘤菌属(Bardyrhizobium)为主,而中层和下层生物膜中微生物以Reyranella菌属和生丝微菌属(Hyphomicrobium)为主。另外,中层和下层生物膜中微生物量相比上层多,代谢能力强,生物膜上微生物分泌的EPS多,蛋白质含量高,微生物吸附性能有所增强[21],这可能会影响催化柱对天然有机物和微量污染物的去除。小试实验结果证明,生物膜的形成影响了对双酚A的去除。在停留时间为15 min时,有生物膜的催化柱明显比没有生物膜的催化柱对10 µg·L−1双酚A的去除率高,但对于有生物膜的上、中、下层,其对双酚A的去除率差别不大。当停留时间在40 min后,有生物膜的催化柱比没有生物膜的催化柱对5 mg·L−1双酚A去除率要高,而且下层对双酚A的去除率最高,可能与下层生物膜中Reyranella菌属和生丝微菌属(Hyphomicrobium)含量较高有关。
在多相芬顿催化体系中,H2O2除了与释放到溶液中的少量金属离子发生链反应外,主要与催化剂发生界面反应,多相芬顿反应需要高活性的催化剂,其可提高H2O2的利用率[13]。本研究结果表明,在多相芬顿催化柱运行过程中,很难避免生物膜的形成,而对于微量污染物双酚A,生物膜可以提高对其的去除效果。但是,生物膜对不同种类和浓度的污染物去除的影响还需要进行深入的研究和探索,从而更好的优化运行多相芬顿催化柱,以便能尽早的解决实际问题。另外,建议今后要深入开展生物膜对芬顿反应去除不同微量污染物的影响研究。
3. 结论
1)多相芬顿催化柱在中试运行过程中对天然有机物表现出良好的去除效果,而实验过程中形成的生物膜可提高对双酚A的去除率。在无生物膜条件下,多相芬顿反应对双酚A的去除率低于30%,而在生物膜形成后,对双酚A的去除率可提高到36%~39%。
2)通过对催化柱上生物膜进行表征,发现催化柱生物膜上微生物群落存在相似性,其中,中层和下层相似度高。上层生物膜中微生物以赫山单胞菌属(Herminiimonas)和慢生根瘤菌属(Bardyrhizobium)为主,而中层和下层生物膜中微生物以Reyranella菌属和生丝微菌属(Hyphomicrobium)为主。
3)随着生物膜上微生物群落组成的变化,多相芬顿催化柱由上层到下层生物膜上生物量有所增加,微生物代谢活性增强,从而分泌更多的胞外多聚物,这可能是有生物膜的催化柱特别是下层催化柱可更好地去除双酚A的主要原因。
-
表 1 铁还原菌F1中电子传递相关基因
Table 1. Genes related to electron transfer in Escherichia sp. F1
电子传递类型 序列名称 序列长度 基因功能描述 直接电子传递 WP_000179820.1 614 细胞色素c氧化酶 直接电子传递 WP_000383352.1 587 细胞色素c553 间接电子传递 WP_000493950.1 641 核黄素合成酶α亚基 间接电子传递 ABF02652.1 470 核黄素合成酶β链 间接电子传递 WP_001389848.1 216 甲萘醌生物合成过程 -
[1] 任加国, 郜普闯, 徐祥健, 等. 地下水氯代烃污染修复技术研究进展[J]. 环境科学研究, 2021, 34(7): 1641-1653. [2] CZINNEROVA M, VOLOSCUKOVA O, MARKOVA K, et al. Combining nanoscale zero-valent iron with electrokinetic treatment for remediation of chlorinated ethenes and promoting biodegradation: A long-term field study[J]. Water Research, 2020, 175: 115692. doi: 10.1016/j.watres.2020.115692 [3] 刘诗婷, 刘静, 刘爱荣, 等. 纳米零价铁基材料用于地下水修复研究进展[J]. 环境科学与技术, 2022, 45(9): 181-193. [4] DONG H, LI L, LU Y, et al. Integration of nanoscale zero-valent iron and functional anaerobic bacteria for groundwater remediation: A review[J]. Environment International, 2019, 124: 265-277. doi: 10.1016/j.envint.2019.01.030 [5] LEFEVRE E, BOSSA N, WIESNER M R, et al. A review of the environmental implications of in situ remediation by nanoscale zero valent iron (nZVI): Behavior, transport and impacts on microbial communities[J]. Science of the Total Environment, 2016, 565: 889-901. doi: 10.1016/j.scitotenv.2016.02.003 [6] STEFANIUK M, OLESZCZUK P, OK Y S. Review on nano zerovalent iron (nZVI): From synthesis to environmental applications[J]. Chemical Engineering Journal, 2016, 287: 618-632. doi: 10.1016/j.cej.2015.11.046 [7] WU Z N, MAN Q L, NIU H Y, et al. Recent advances and trends of trichloroethylene biodegradation: A critical review[J]. Frontiers in Microbiology, 2022, 13: 1053169. doi: 10.3389/fmicb.2022.1053169 [8] GERLACH R, CUNNINGHAM A B, CACCAVO F. Dissimilatory iron-reducing bacteria can influence the reduction of carbon tetrachloride by iron metal[J]. Environmental Science & Technology, 2000, 34(12): 2461-2464. [9] 马黎颖, 和明敏, 陈绍华. 异化铁还原菌强化纳米零价铁在环境修复中的应用研究进展[J]. 广州化工, 2020, 48(21): 14-16. doi: 10.3969/j.issn.1001-9677.2020.21.007 [10] SHIN H Y, SINGHAL N, PARK J W. Regeneration of iron for trichloroethylene reduction by Shewanella alga BrY[J]. Chemosphere, 2007, 68(6): 1129-1134. doi: 10.1016/j.chemosphere.2007.01.059 [11] HONETSCHLäGEROVá L, ŠKAROHLíD R, MARTINEC M, et al. Interactions of nanoscale zero valent iron and iron reducing bacteria in remediation of trichloroethene[J]. International Biodeterioration & Biodegradation, 2018, 127: 241-246. [12] 袁梦姣, 王晓慧, 赵芳, 等. 零价铁与微生物耦合修复地下水的研究进展[J]. 中国环境科学, 2021, 41(3): 1119-1131. doi: 10.3969/j.issn.1000-6923.2021.03.014 [13] LI H, ZHANG X, ZHANG Y, et al. The iron cycling mediated by a single strain Shewanella oneidensis MR-1 and its implication for nitrogen removal[J]. Chemical Engineering Journal, 2023, 471: 144727. doi: 10.1016/j.cej.2023.144727 [14] YANG Z, WANG X L, LI H, et al. Re-activation of aged-ZVI by iron-reducing bacterium Shewanella putrefaciens for enhanced reductive dechlorination of trichloroethylene[J]. Journal of Chemical Technology & Biotechnology, 2017, 92(10): 2642-2649. [15] KOOLIVAND A, ABTAHI H, PARHAMFAR M, et al. Biodegradation of high concentrations of petroleum compounds by using indigenous bacteria isolated from petroleum hydrocarbons-rich sludge: Effective scale-up from liquid medium to composting process[J]. Journal of Environmental Management, 2019, 248: 109228. doi: 10.1016/j.jenvman.2019.06.129 [16] 符波, 廖潇逸, 丁丽丽, 等. 环境扫描电镜对废水生物样品形态结构的表征研究[J]. 中国环境科学, 2010, 30(1): 93-98. [17] TANG F, TIAN F, ZHANG L, et al. Remediation of trichloroethylene by microscale zero-valent iron aged under various groundwater conditions: Removal mechanism and physicochemical transformation[J]. Science of the Total Environment, 2021, 775: 145757. doi: 10.1016/j.scitotenv.2021.145757 [18] DRIES J, BASTIAENS L, SPRINGAEL D, et al. Combined removal of chlorinated ethenes and heavy metals by zerovalent iron in batch and continuous flow column systems[J]. Environmental Science & Technology, 2005, 39(21): 8460-8465. [19] LI L, QU Z, WANG B, et al. The response of metabolically active Clostridium community to initial pH shift is closely correlated with microbial Fe(III) reduction in flooded paddy soils[J]. Journal of Soils and Sediments, 2018, 19(2): 522-532. [20] HU J, ZENG Q, CHEN H, et al. Effect of bacterial cell addition on Fe(III) reduction and soil organic matter transformation in a farmland soil[J]. Geochimica et Cosmochimica Acta, 2022, 325: 25-38. doi: 10.1016/j.gca.2022.03.018 [21] 刘艳娟, 卢洪斌, 孟丽聪, 等. 微生物燃料电池型水质生物毒性传感器的研究进展[J]. 中国给水排水, 2023, 39(16): 1-7. [22] 洪忠强, 吕红, 王晓磊, 等. 希瓦氏菌分泌黄素对间硝基苯磺酸钠厌氧生物还原影响[J]. 大连理工大学学报, 2023, 63(6): 560-566. doi: 10.7511/dllgxb202306002 [23] 刘洪艳, 袁媛, 张姗, 等. 电子穿梭体对菌株Clostridium butyricum LQ25异化铁还原性质影响[J]. 微生物学报, 2021, 61(6): 1496-1506. [24] 李顺灵, 屈庆, 李蕾, 等. 金属-微生物界面电子传递机制及其对金属腐蚀的影响[J]. 云南大学学报(自然科学版), 2018, 40(6): 1240-1245. doi: 10.7540/j.ynu.20180360 [25] 吴朵而, 陈龙, 马香娟, 等. 基于电活性微生物的芳香烃类污染物转化机制研究进展[J]. 微生物学报, 2023, 63(1): 30-44. [26] 刘洪艳, 覃海华, 王珊. 海洋沉积物中一株铁还原细菌ZQ21异化还原Fe(Ⅲ)性质分析[J]. 海洋环境科学, 2019, 38(4): 508-512+520. doi: 10.12111/j.mes20190404 [27] 刘洪艳, 刘淼, 袁媛. 海洋沉积物中铁还原细菌组成及异化铁还原与产氢性质分析[J]. 微生物学通报, 2020, 47(9): 2711-2719. [28] 关舒元, 朱超, 王保莉, 等. 铁还原菌株P4的碳源利用特征及其系统发育学分析[J]. 西北农林科技大学学报(自然科学版), 2008(3): 117-123. [29] JIA R, LI L, QU D, et al. Enhanced iron(III) reduction following amendment of paddy soils with biochar and glucose modified biochar[J]. Environmental Science and Pollution Research, 2016, 25(1): 91-103. [30] 祝佳欣, 朱雯喆, 徐俊, 等. 基于导电材料强化抗生素胁迫厌氧消化的研究进展[J]. 化工进展, 2023, 42(2): 1008-1019. [31] 肖勇, 吴松, 杨朝晖, 等. 电化学活性微生物的分离与鉴定[J]. 化学进展, 2013, 25(10): 1771-1780. doi: 10.7536/PC130125 [32] 刘翠英, 郁李鑫, 杨超, 等. 纳米Fe3O4/生物炭促进红壤性水稻土中六氯苯厌氧脱氯作用研究[J]. 土壤学报, 2024, 61(5): 1310-1322. [33] ZHOU C S, CAO G L, WU X K, et al. Removal of antibiotic resistant bacteria and genes by nanoscale zero-valent iron activated persulfate: Implication for the contribution of pH decrease[J]. Journal of Hazardous Materials, 2023, 452: 131343. doi: 10.1016/j.jhazmat.2023.131343 [34] 李聪慧, 李振鑫, 张正玉, 等. 多黏菌素B生产菌多黏芽孢杆菌的选育和发酵过程优化[J]. 中国医药工业杂志, 2023, 54(8): 1208-1215. [35] 杨壮, 刘怡琳, 李隆熙, 等. 固态发酵制备黄精多糖的工艺优化、理化特性及抗氧化活性[J]. 食品与发酵工业, 2024, 50(7): 92-98. [36] 王泽宇, 范红叶, 吕思妮, 等. Fe-Pd/MWCNTs提升己酸巨球菌产酸性能的影响机理[J]. 环境科学学报, 2024, 44(1): 333-340. [37] 魏后军, 范志宇, 胡波, 等. 无毒性产气荚膜梭菌α毒素重组蛋白的自诱导分泌表达及免疫原性分析[J]. 江苏农业科学, 2022, 50(14): 166-169. [38] 吴娜莎, 孙亚琴, 修志龙. 耐高渗克鲁斯假丝酵母的耐受性[J]. 生物工程学报, 2024, 40(3): 908-920. -




 下载:
下载: