-
厌氧氨氧化 (Anammox) 工艺作为一项新型、节能的生物脱氮技术[1],受到了研究者的广泛关注,因其能在厌氧条件下,利用氨氮、亚硝氮作为电子供体和电子受体,将二者同时转换为氮气而从反应体系中去除[2-4]。然而该过程理论上会导致11%的硝酸盐氮生成[5],为总氮去除率的提高带来挑战。且厌氧氨氧化菌 (AnAOB) 倍增时间长[6],具有生物质易流失、环境敏感度高的特点,易受到高浓度氮素带来的抑制作用[7],从而影响体系的氮去除效率和稳定性。
为了改善目前Anammox反应体系存在的不利条件,投加生物炭成为了一种广泛采用的方式[8]。生物炭可以通过充当电子介导体促进Anammox体系中累积硝氮的还原从而提升总氮去除效果[9],同时也能通过促进细菌胞外聚合物 (EPS) 的分泌[10]、增强功能基因的表达[11]以缓解反应体系高氮负荷导致的微生物抑制。LI等[12]研究得出在100 mg N·L−1的Anammox反应体系中,生物炭的投加使硝氮还原速率提升了2.2倍,且生物炭提升了AnAOB和反硝化菌 (DNB) 等功能细菌的丰度;CHEN等[13]研究得出Anammox活性在总氮质量浓度大于250 mg N·L−1时逐渐下降,生物炭使上限提高至300 mg N·L−1;而LI等[14]研究表明总氮质量浓度在440 mg N·L−1时,体系具有更高的微生物EPS分泌质量浓度以及更大的AnAOB相对丰度。因此,生物炭在不同氮负荷下对Anammox反应体系的影响效果差异较大。目前研究多为单一负荷下生物炭对Anammox体系的影响,而不同氮负荷下生物炭介导Anammox反应体系脱氮特征的差异与作用机理仍不明确,同时不同负荷影响下生物炭对微生物群落演替和代谢途径的变化规律仍有待进一步探究。
因此,本研究通过进行批次实验考察了3种氮负荷条件下 (总氮为100、300、500 mg N·L−1) 生物炭强化Anammox体系脱氮性能的特征,结合氮转化过程与生物炭表征、EPS、微生物分布、群落结构以及功能预测的分析,探讨了生物炭强化不同氮负荷反应体系脱氮过程的差异与增效机理。
-
本研究生物炭原料采用苹果木木屑。将木屑置于马弗炉内,于300 ℃条件下热解2 h后冷却至室温,依次通过18目与35目筛网进行筛分,选取粒径0.5~1 mm生物炭干燥密封保存。
通过傅里叶变换红外光谱仪 (Nicolet iS20,美国赛默飞世尔科技公司) 测定生物炭表面官能团;场发射扫描电子显微镜 (Quanta650F,美国FEI公司) 拍摄生物炭形貌结构;将烘干后的生物炭研磨成粉末 (过200目筛) ,取50 mg生物炭粉末以及稀释10倍的萘酚 (C10H8O) 溶液以1∶6的比例混合并超声30 min,使其充分接触。将混合溶液滴加100 μL于玻碳电极上,35 ℃烘干后进行使用电化学工作站 (CHI660E,上海辰华仪器有限公司) 与三电极体系电解池 (容积100 mL) 进行循环伏安法 (CV) 测定,表征反应前后生物炭的电化学性能变化。
-
本研究使用种泥取自实验室稳定运行膨胀颗粒污泥床 (expanded granular sludge bed,EGSB) 反应器,运行温度为35 ℃,水力停留时间 (hydraulic retention time,HRT) 为10 h,污泥质量浓度MLSS、MLVSS分别为7 500、4 700 mg·L−1,颗粒污泥呈红褐色。试验前洗涤种泥,加入去离子水混合后倾倒上清液并重复3次,以去除残留的NH4+、NO2−和NO3−,减少对试验的影响。批次试验均在工作体积为100 mL的血清瓶中进行,反应体系中污泥质量浓度MLSS、MLVSS分别为1 100、700 mg·L−1。封瓶前用氮气吹扫3 min以去除血清瓶顶部氧气,并立即用橡胶塞和铝盖密封。所有批次试验均在恒温振荡器中进行,振荡速度和温度分别控制在120 r·min−1和35 ℃。
-
设置3组基质质量浓度,分别为总氮100、300、500 mg·L−1,命名为TN100、TN300、TN500。采用人工配水,向总容积为120 mL的血清瓶中加入50 mL营养液,15 mL种泥以及35 mL去离子水以获得100 mL的工作体积。生物炭投加量为10 g·L−1[9]。营养液组成见表1。
-
1) 水质指标测定。使用1 mL无菌针管取出水样后经微孔过滤器 (0.45 μm) 过滤,过滤后的水样用于分析NH4+、NO2−、NO3−的质量浓度。NH4+-N采用纳氏试剂分光光度法测定,NO2−-N采用N-(1-萘基)-乙二胺光度法测定,NO3--N采用氨基磺酸分光光度法测定。
2) 胞外聚合物提取与测定。取血清瓶内全部污泥加入50 mL离心管,加纯水至45 mL。预冷离心机至4 ℃,4 000 r∙min−1离心10 min,取上清液过滤得到SMP (soluble microbial product) ;加入70 ℃的5‰的NaCl溶液至45 mL。涡旋振荡1 min,6 000 r∙min−1离心10 min后过滤上清液得到松散结合型EPS (LB-EPS) ;最后将离心管加入70 ℃的5‰的NaCl溶液至45 mL,并在70 ℃水浴30 min,6 000 r∙min−1离心10 min后过滤上清液得到紧密结合型EPS (TB-EPS) [16]。提取EPS后烘干污泥,使用马弗炉煅烧后通过差重计算微生物质量 (g vss) 。提取的3种胞外聚合物分别采用苯酚-硫酸法、Folin-酚法测定多糖 (PS) 、蛋白质 (PN) 的质量浓度。
3) 三维荧光光谱测定。采用日立荧光分光光度计 (F-
7000 ,日本Hitachi公司) 测定EPS的荧光特性,发射波长范围为200~500 nm,激发波长为250~550 nm,扫描间隔5 nm,扫描速度为12 000 nm·min−1。 -
根据公式(1)~(5)计算总氮去除效率 (TNRE) 、总氮去除速率 (TNRR) 、氨氮去除速率 (NRR氨氮) 、亚硝氮去除速率 (NRR亚硝氮) 及硝氮还原速率 (NRR硝氮) 。
式中:
$ \Delta \mathrm{T}\mathrm{N}: $ 反应前后总氮的质量浓度变化,mg·L−1;$ {\mathrm{C}}_{\mathrm{T}\mathrm{N}} $ :初始总氮质量浓度 (氨氮、亚硝氮、硝氮之和) ,mg·L−1;$ \Delta {\mathrm{N}\mathrm{H}}_{4}^{+} $ 、$ \Delta {\mathrm{N}\mathrm{O}}_{2}^{-} $ :反应前后氨氮、亚硝氮的质量浓度变化,mg·L−1;$ \Delta {\mathrm{N}\mathrm{O}}_{3}^{-} $ :累积硝氮质量浓度最大值与反应结束质量浓度差,mg·L−1;$ \Delta \mathrm{T} $ :对应反应节点时间差,h。 -
反应结束后选取各实验对照组与生物炭组污泥样本一式二份进行16S微生物分类测序。使用E.Z.N.A™ Mag-Bind土壤DNA试剂盒 (M5635-02,美国Omega Biotek公司) 提取群落基因组DNA,使用Qubit 4.0测量DNA的质量浓度,确保提取足够的高质量DNA片段。在细菌16S rRNA基因的高变区V3–V4使用正向引物 (341F,CCTACGGGNGGCWGCAG) 和反向引物 (805R,GACTACHVGGGTATCTAATCC) 进行PCR扩增。测序完成后,使用PEAR处理fastq文件生成单独的fasta和qual文件,通过Usearch对相似性高于97%的OTU进行聚类,选择丰度最高的标记序列作为每个聚类的代表序列,利用RDP数据库对细菌OTU代表序列进行分类并进行群落多样性指数计算。利用PICRUSt对细菌进行代谢通路功能预测分析。
-
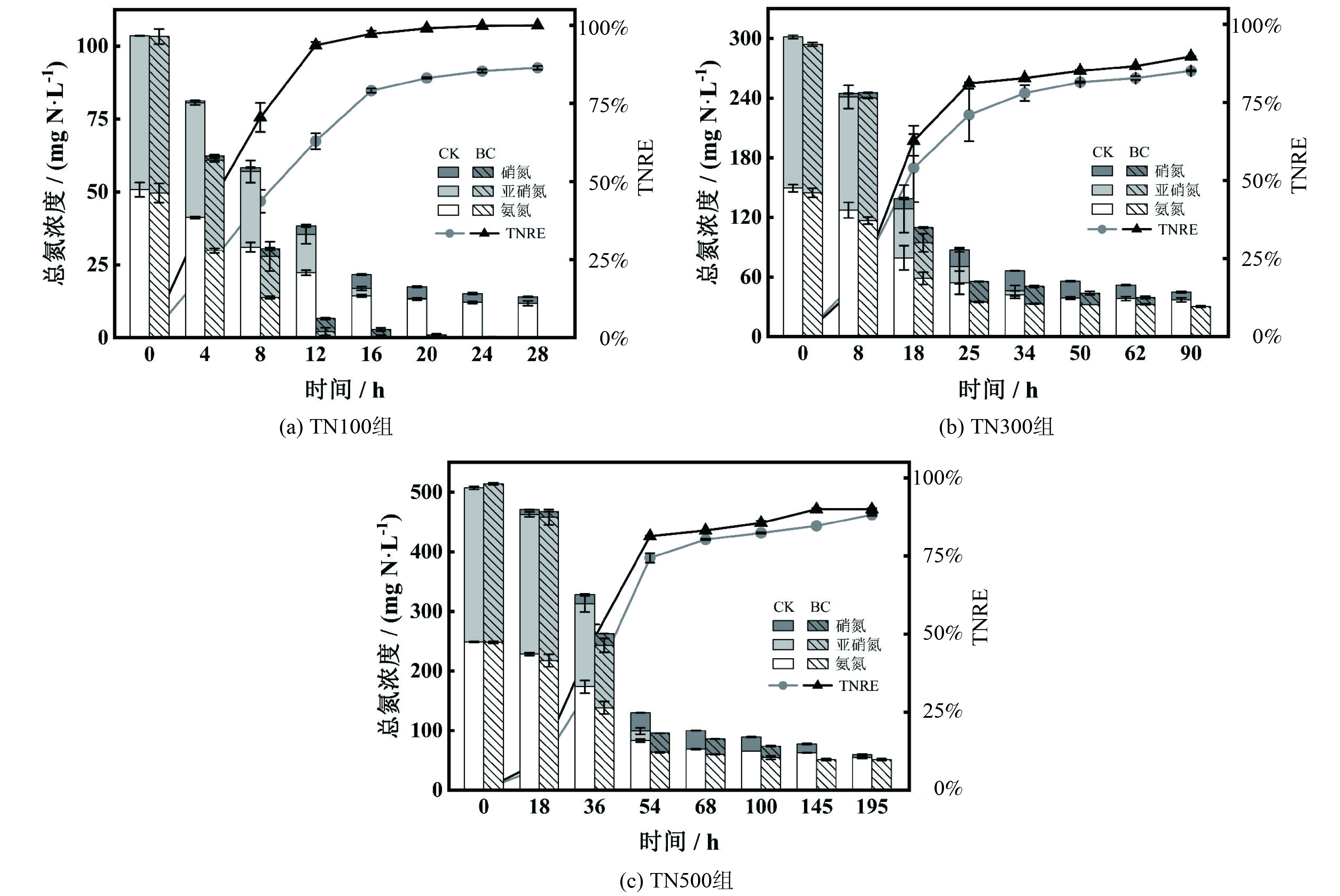
TN100、TN300、TN500对照组最终总氮去除率为86.4%、85.1%和88.2%,生物炭的投加使各对照组的去除率分别提高了13.6%、4.5%和1.8% (图1) ,即生物炭对不同氮负荷反应体系总氮去除均有促进效果,且促进效果TN100>TN300>TN500。同时,反应结束后各实验组中的TN100生物炭组具有最高的TNRR (0.103 g N·L−1·d−1) 以及最高的TNRE (100%) ,说明低负荷条件下生物炭对厌氧氨氧化体系总氮去除的提升效果更佳。随着总氮质量浓度的减少,反应过程可划分为快速反应阶段以及慢速反应阶段[12]。3种氮负荷的Anammox反应体系反应阶段变化节点分别在12、25、54 h。在快速反应阶段中,氨氮与亚硝氮充足,脱氮过程以厌氧氨氧化反应 (Anammox) 为主导;在慢速反应阶段中,亚硝氮的耗尽使Anammox反应的发生缺少理论条件,而对照组和生物炭组中剩余氨氮以及累积的硝氮均发生了缓慢的下降,这是源于反应体系中发生了部分反硝化作用 (partial denitrification,PD) ,该过程能通过将快速阶段中累积的硝氮还原成亚硝氮而使Anammox在慢速阶段继续进行反应。
反应结束时3组对照组的氨氮分别剩余11.8、37.1、54.9 mg·L−1,而对应生物炭组的氨氮分别比对照组多降解了11.8、6.7、3.5 mg·L−1;同时根据速率拟合结果 (表2) 显示,TN100、TN300、TN500生物炭组的硝氮还原速率分别比相应对照组高2.1、1.8、1.4倍,说明生物炭的投加通过促进硝氮还原强化了PD过程,从而进一步提高了Anammox反应体系的总氮去除效果,但生物炭的增效作用在低负荷条件下更加显著。这也与各负荷下反应体系气体产量增加的促进效果相一致,TN100、TN300以及TN500生物炭组气体产量分别高于对照组12.9%、7.1%以及4.2%,呈现递减趋势。
-
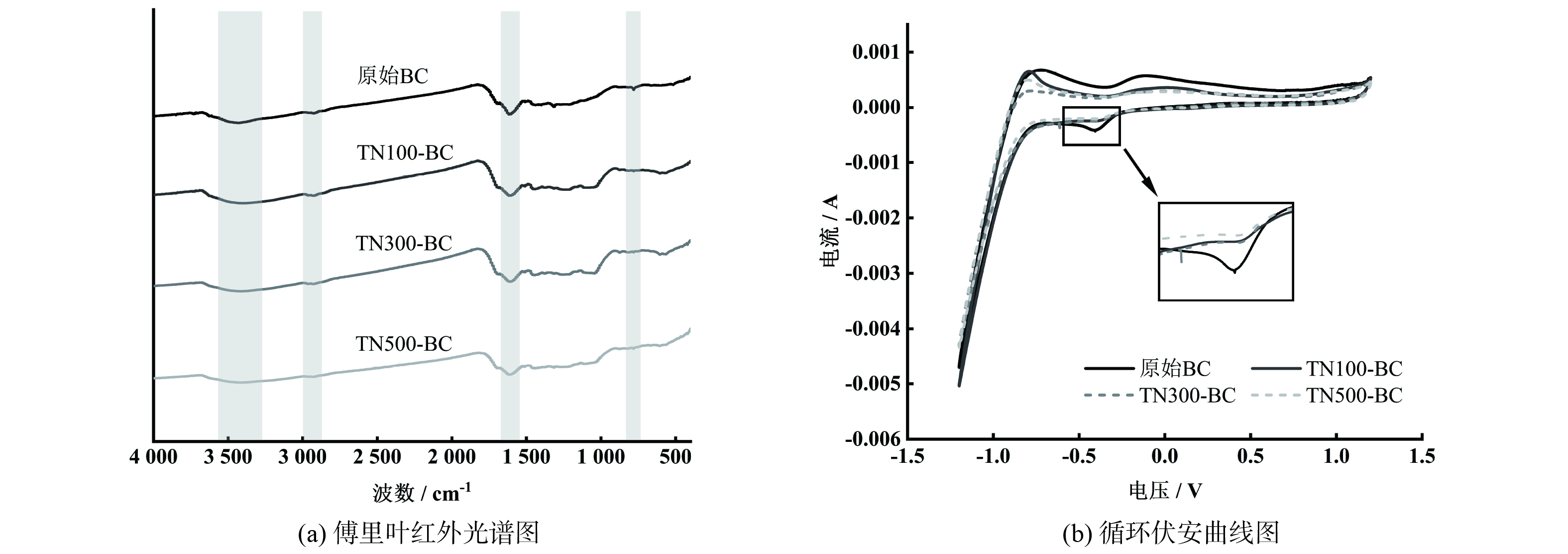
1) 生物炭强化胞外电子传递对脱氮过程的影响。通过傅里叶红外光谱分析来表征原始生物炭以及3种氮负荷下反应结束后生物炭表面官能团的变化。结果如图2(a)所示,反应后的生物炭表面有较多具有还原性的含氧供电子官能团,随着氮负荷的升高其吸收峰均有不同程度的减弱,其中,酚羟基 (d:
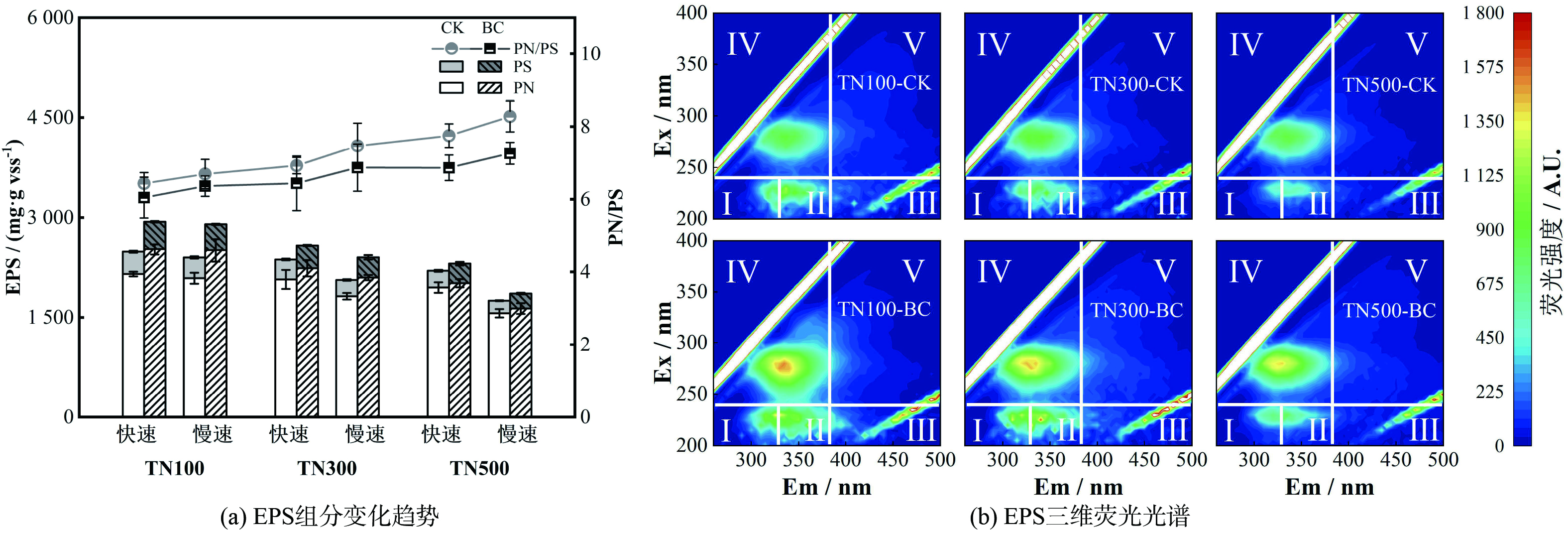
3410 cm−1,-OH) 以及醌类基团 (b:1 610 cm−1) 尤为明显。据研究,生物炭表面存在的酚羟基具有较强的供电子能力[12];醌类官能团可充当细菌的胞外电子受体,通过可逆的氧化还原循环作用促进体系中硝氮的还原[17];同时芳香烃基团 (a:800 cm−1,c:2 880 cm−1,-CH) 也能通过具电活性的共辄π电子系统促进硝氮还原过程[18],生物炭的芳香性越强,其电活性越强,与表面官能团的氧化还原得失电子过程不同,这种电子转移过程不需要化学反应,电子传递速度更快[15]。因此由上述官能团吸收峰的减弱趋势可知:反应体系中氮负荷的提高意味着更多的官能团需求,由于生物炭表面官能团的数量与供电子能力有限,因此生物炭对低氮负荷下的Anammox反应体系总氮去除具有更显著的促进效果。根据原始生物炭和不同氮负荷反应后生物炭的循环伏安曲线图显示 (图2(b)) ,原始生物炭曲线轨迹中出现了一对不可逆的氧化峰与还原峰,具有一定的氧化还原能力。而不同负荷反应后生物炭的曲线图中还原峰均有一致程度的减弱,与部分还原性官能团的减少趋势一致,说明原始生物炭的还原性能在不同氮负荷反应体系中均被消耗,而由于氮负荷的逐渐提高,生物炭对低氮浓度的反应体系具有更好的促进效果。2) 生物炭对EPS组分及质量浓度的影响。将各对照组与生物炭组于快速反应阶段、慢速反应阶段结束时分批拆瓶 (TN100:12 h、28 h;TN300:25 h、90 h;TN500:54 h、195 h) ,提取EPS进行相关指标测定。EPS与AnAOB的代谢和活性密切相关且发挥着重要作用,主要由PS和PN组成[19]。由图3(a)可知,反应期间生物炭组的EPS (PN+PS) 含量基本高于对照组,且各试验组的EPS质量浓度均随着氮负荷的提高而下降,这与YANG等[20]的研究结果一致可能源于EPS中的部分有机成分参与硝氮还原的自养反应而被消耗。慢速阶段的平均EPS质量浓度均低于快速阶段,这是由于更高氮负荷体系会产生更高的累积硝氮总量,而EPS在无外加碳源的自养体系中充当唯一的有机碳源,因此在参与硝氮还原的过程中消耗量逐渐增大。TN100组生物炭对EPS浓度的提升效果最佳,且提升效果随着负荷的增加而下降,这与生物炭促进硝氮还原速率提高的趋势一致,可能是因为生物炭通过其氧化还原活性与供电子能力促进了硝氮还原过程,从而强化细菌代谢与EPS的分泌。
EPS组分分析显示,PN是EPS的主要组成部分,其在各实验组EPS含量中比例超过80%,这可能源自于EPS在微生物和底物之间作为离子运输通道的能力以及自身参与此类主动运输的结果[21]。有研究表明,PN/PS是表示颗粒污泥稳定性的指标,较高的PN/PS比容易导致Anammox颗粒污泥的强度降低和沉降能力下降[22],而TN100对照组与生物炭组平均PN/PS值为6.6、6.2,低于TN500的8.0、7.1。综上所述,生物炭在较低氮负荷下强化Anammox反应体系EPS分泌含量更加显著,同时具有最低的PN/PS比,说明生物炭的投加提高了微生物团聚和稳定性,从而实现低氮负荷下生物炭组更好的脱氮性能[14]。
图3(b)展示了反应结束后各负荷下对照组与生物炭组的三维荧光光谱特性。EPS中各种蛋白质物质可根据不同特性分为5个区域[23]:芳香类蛋白质Ⅰ (Ⅰ) 、芳香类蛋白质Ⅱ (Ⅱ) ;富里酸 (Ⅲ) ;可溶性微生物产物 (IV) ;腐植酸 (V) 。在各组荧光图谱中总共确定了3个主要峰:Ex/Em =(235~240) nm/(325~330) nm、Ex/Em=(235~240) nm/(345~345) nm以及Ex/Em =(275~280) nm/(335~340) nm,即芳香类蛋白质Ⅰ (Ⅰ) 、芳香类蛋白质Ⅱ (Ⅱ) 和可溶性微生物产物 (Ⅳ) 。可以发现各生物炭组中这些峰的荧光区均高于相应对照组,其中增加最明显的区域为可溶性微生物产物,且其荧光区强度与面积的增加程度随着氮负荷的提高而减少。研究表明EPS中的可溶性微生物产物的含量水平可反映厌氧微生物的活性[24],而生物炭提升不同氮负荷反应体系脱氮效果的趋势与EPS中可溶性微生物产物的减少趋势一致,说明低负荷反应体系具有更强的微生物活性,从而促进了低氮负荷条件下总氮去除效果的提升。
-
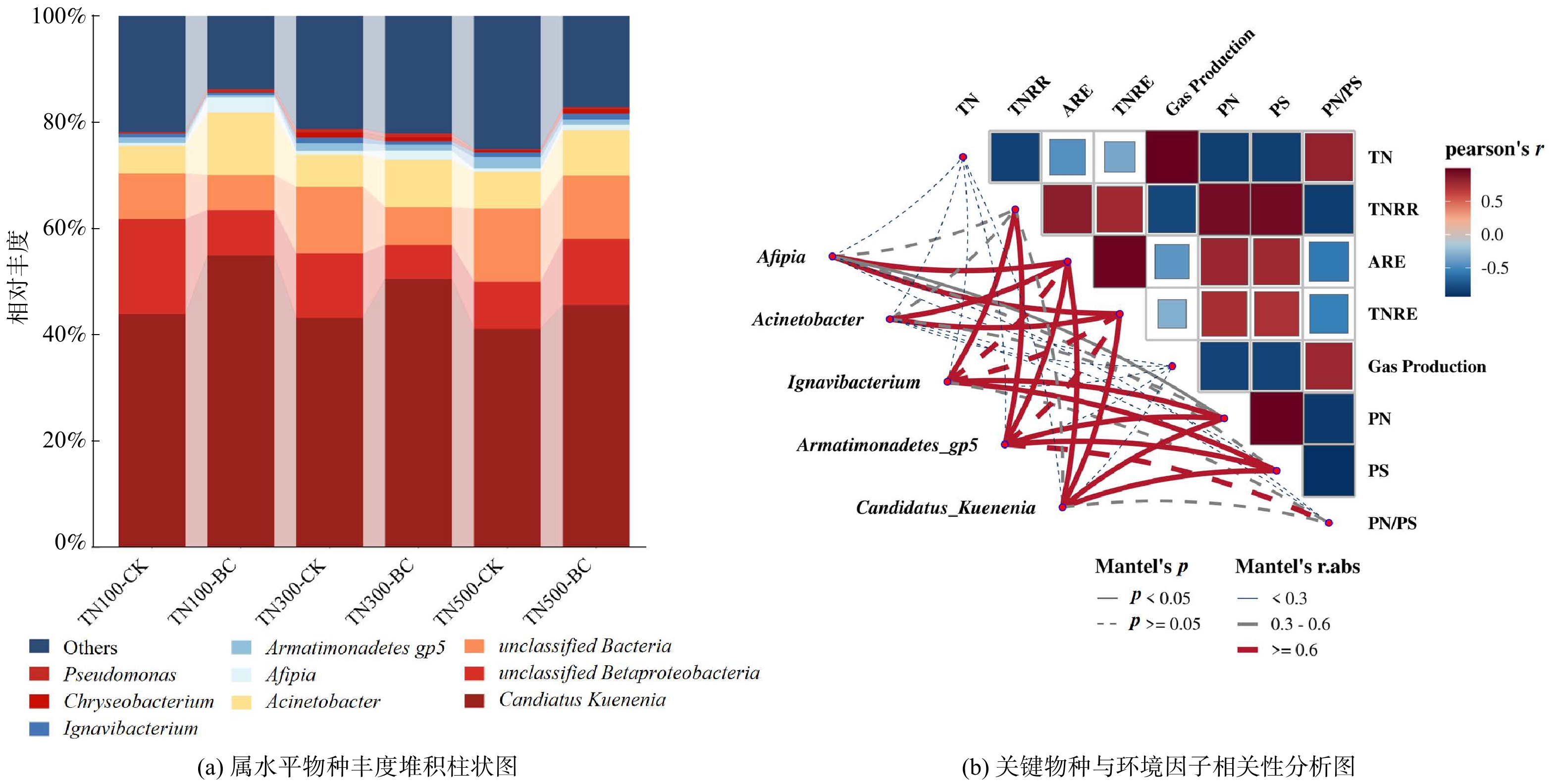
1) 生物炭对群落结构及聚集特征的影响。高通量测序结果显示,各负荷下Anammox反应体系中在门水平占主导的微生物主要包括Planctomycetes (浮霉菌门) 、Proteobacteria (变形菌门) 、Chloroflexi (绿湾菌门) 、Bacteroidetes (拟杆菌门) 、Firmicutes (厚壁菌门) 、Armatimonadetes (装甲菌门) 、Ignavibacteria以及unclassified Bacteria。反硝化菌属一般隶属于Proteobacteria、Firmicutes和Bacteroidetes,厌氧氨氧化菌属隶属于Planctomycetes[25]。
反应体系内主要的属为Candidatus Kuenenia、unclassified Betaproteobacteria、unclassified Bacteria、unclassified Anaerolineaceae 等,其中Candidatus Kuenenia为Anammox反应体系中最主要的AnAOB[26];同时体系中有多种DNB共存,如Acinetobacter[27]、Afipia[28]、Ignavibacterium[29]、Pseudomonas、Chryseobacterium[30]等。生物炭的投加提高了AnAOB的丰度,提升效果最佳为TN100生物炭组,相较于对照组提高了11.0%,TN300生物炭组和TN500生物炭组分别提高了7.4%与4.4% (图4(a)) ;其次,生物炭也促进了Acinetobacter和Afipia这2种优势DNB丰度的提高,且TN100生物炭组总反硝化菌属丰度提升程度最高为8.4%,与TN100生物炭组具有最优总氮去除效果对应。此外,Armatimonadetes gp5具有降解多糖的能力[31],其丰度随氮浓度的增加而提高,符合EPS组分中多糖的降解趋势。
基于研究结果进行了Mantel检验,分析了关键菌属与不同环境因子之间的相关性 (图4(b)) 。结果显示,关键AnAOB和DNB的丰度与TNRE具有相关性,如Candidatus Kuenenia (|r|=0.67,p<0.05) 、Acinetobacter (|r|=0.73,p<0.01) ,为提升TNRE的主要作用菌群。而Ignavibacterium与PN、PS质量浓度具有相关性 (|r|=0.86,p<0.05,PN;|r|=0.82,p<0.05,PS) ,说明Ignavibacterium可能在EPS的消耗过程中发挥重要作用。其次,Pearson相关性分析显示,TN与PN/PS呈正相关 (r=0.82) ,说明氮负荷的提高影响了EPS的组成;TNRR与PN、PS呈正相关 (r=0.94、r=0.95) ,体现出脱氮速率高的反应体系具有更高的EPS分泌水平。
根据扫描电镜图 (图5)显示,在不同氮负荷条件下,微生物聚集情况具有一定差异。根据种子颗粒污泥表面菌群形态 (图5d)可知微生物的主要形态为球状,与各氮负荷反应体系中生物炭表面富集的细菌形态一致。在3种Anammox反应体系中,由于TN500生物炭组氮负荷最高从而具有更长的反应时间,生物炭上微生物的聚集更加显著,以多个颗粒聚集体的形态黏附在生物炭表面。而在低氮负荷反应体系的TN100生物炭组中,反应后生物炭表面微生物富集程度较低,说明在高负荷反应体系中高浓度氮素的抑制作用影响微生物时,生物炭通过为细菌提供富集位点实现更长时期下总氮的稳定去除。
2) 生物炭强化代谢。根据KEGG数据库比对结果选取氮代谢通路 (M00910) 进行分析,一共获得38条三级代谢途径,选取其中18条相关通路并按不同功能蛋白分成7类。如图6所示,生物炭组中由EC:1.7.5.1、EC:1.9.6.1构成的硝酸盐还原酶的丰度有显著的增加,且随着氮负荷降低而提高,说明低负荷反应体系 (TN100) 具有更高的硝氮还原强度;生物炭的投加增加了谷氨酸脱氢酶 (EC:1.4.1.2/3/4) 与谷氨酸合成酶 (EC:1.4.1.13) 的丰度,体现出生物炭增强了Anammox反应体系的细胞代谢活性,而TN100生物炭组相关功能蛋白丰度最高,从而实现了生物炭促进低氮负荷下反应体系总氮去除率提升更高的结果。
-
1) 不同氮负荷下生物炭对厌氧氨氧化总氮去除的提升效果为TN100>TN300>TN500,且相对于对照组分别提升了13.6%、4.5%、1.8%,同时TN100生物炭组具有最高的总氮去除速率 (0.103 g N·L−1·d−1) 以及最高的总氮去除效率 (100%) ,说明低氮负荷条件下生物炭对厌氧氨氧化体系总氮去除的促进效果更佳,这是因为低氮负荷反应体系中生物炭促进PD过程更加显著,实现了剩余氨氮与累积硝氮的深度去除。
2) 生物炭表面含氧官能团提供的电子、生物炭本身的氧化还原能力以及促进微生物EPS分泌是强化硝氮还原过程的关键因素,总氮去除效率最高的TN100生物炭组具有更高的EPS平均质量浓度以及更低的PN/PS。
3) 生物炭的投加提升了反应体系中主要AnAOB:Candidatus Kuenenia与主要DNB:Acinetobacter和Afipia的丰度,同时生物炭增强了硝酸盐还原酶相关功能蛋白的活性,其中TN100生物炭组具有最高丰度,实现了生物炭促进低氮负荷下反应体系总氮去除率提升更显著的结果。
不同氮负荷下生物炭强化厌氧氨氧化体系脱氮效能的影响
Effects of nitrogen load on nitrogen removal efficiency of biochar-enhanced anammox systems
-
摘要: 为了探明生物炭对厌氧氨氧化脱氮效能的影响,通过批次实验考察了3种氮负荷条件下 (总氮100、300、500 mg·L−1) 厌氧氨氧化体系的总氮去除效果,并从反应前后生物炭性能变化、细菌胞外聚合物分泌水平以及微生物群落演替特征等方面解析了潜在作用机制。结果表明总氮100、总氮300、总氮500组生物炭的添加使体系总氮去除率较对照组分别提升了13.6%、4.5%、1.8%,且最终硝氮浓度明显低于对照组。这是由于生物炭作为电子介导体,通过其具有的电活性以及氧化还原性能与细菌胞外聚合物相互作用,强化了胞外电子传递过程从而促进了硝氮的还原,且总氮100组效果最佳。通过胞外聚合物分析得出,总氮100生物炭组具有最高平均胞外聚合物分泌浓度,而其浓度随着氮负荷的提高而减小,这源于高氮负荷反应体系具有更高的硝氮累积量,因此EPS作为唯一内源电子供体,在参与硝氮还原的过程中消耗量逐渐增大。高通量测序以及KEGG预测分析表明生物炭在低氮负荷条件下对厌氧氨氧化菌Candidatus Kuenenia以及Acinetobacter、Afipia等反硝化菌相对丰度的提升效果更显著,同时在总氮100生物炭组中由EC:1.7.5.1、EC:1.9.6.1构成的硝酸盐还原酶的相关功能基因具有更高的表达水平,揭示了低氮负荷下生物炭强化氮去除效果更显著的原因。Abstract: To investigate the effects of biochar on the nitrogen removal efficiency of Anammox, batch experiments were conducted. The total nitrogen removal efficiency of the anammox system under three different nitrogen loads (100, 300, and 500 mg/L total nitrogen) was examined. The underlying mechanisms were analyzed based on changes in biochar performance before and after reaction, bacterial extracellular polymeric substances secretion levels, and microbial community succession characteristics. Results showed that biochar addition increased the total nitrogen removal efficiency in all groups (TN100, TN300, and TN500) by 13.6%, 4.5% and 1.8%, respectively compared with the control group. Additionally, the final nitrate concentration was significantly lower in biochar-amended groups than in the control group. This improvement could be attributed to biochar's electron conductivity and redox properties, which interacted with EPS, promoting extracellular electron transfer and enhancing nitrate reduction, with the most significant effect observed under low nitrogen loads. Analysis of extracellular polymeric substances showed that the TN100 group with biochar had the highest average extracellular polymeric substances secretion concentration and better sludge structure stability. However, extracellular polymeric substances (EPS) concentration decreased with increasing nitrogen load. This was explained by the higher nitrate accumulation in high nitrogen-loaded anammox systems, leading to increased EPS consumption as an endogenous electron donor during nitrate reduction. High-throughput sequencing and KEGG prediction analysis showed that biochar significantly increased the relative abundance of anammox bacteria Candidatus Kuenenia, as well as the denitrifying bacteria Acinetobacter and Afipia under low nitrogen load conditions. Furthermore, the functional genes for nitrate reductase EC:1.7.5.1 and EC:1.9.6.1 exhibited higher expression levels in the TN100 group with biochar, revealing the reason for the more significant nitrogen removal efficiency enhanced by biochar under low nitrogen loading conditions.
-
Key words:
- nitrogen concentration /
- biochar /
- anammox /
- partial denitrification /
- microbial consortia
-

-
表 1 基质营养液组成
Table 1. Composition of substrate solution
编号 总氮质量浓度/
(mg·L−1)营养液组成/(g·L−1) 微量元素混合液[15]/
mL(NH4)2SO4 NaNO2 CaCl2 MgCl2 KH2PO4 NaHCO3 TN100 100 0.47 0.49 0.07 0.05 0.22 1.6 0.2 TN300 300 1.42 1.48 TN500 500 2.36 2.46 表 2 氮去除速率拟合结果
Table 2. Fitting results of total nitrogen removal rates
编号 快速反应阶段 慢速反应阶段 NRR氨氮/
(mg·L−1·h−1)NRR亚硝氮/
(mg·L−1·h−1)NRR氨氮/
(mg·L−1·h−1)NRR硝氮/
(mg·L−1·h−1)TN100 CK 2.29 3.17 0.07 0.21 BC 4.12 4.30 0.05 0.45 TN300 CK 3.86 5.66 0.07 0.20 BC 5.01 6.85 0.06 0.36 TN500 CK 4.26 6.31 0.10 0.20 BC 5.22 8.30 0.12 0.35 -
[1] XIAO R, NI B J, LIU S, et al. Impacts of organics on the microbial ecology of wastewater anammox processes: Recent advances and meta-analysis[J]. Water Research, 2021, 191: 116817. doi: 10.1016/j.watres.2021.116817 [2] LACKNER S, GILBERT E M, VLAEMINCK S E, et al. Full-scale partial nitritation/anammox experiences-An application survey[J]. Water Research, 2014, 55: 292-303. doi: 10.1016/j.watres.2014.02.032 [3] CAO Y, VAN LOOSDRECHT M C M, DAIGGER G T. Mainstream partial nitritation–anammox in municipal wastewater treatment: status, bottlenecks, and further studies[J]. Applied Microbiology and Biotechnology, 2017, 101(4): 1365-1383. doi: 10.1007/s00253-016-8058-7 [4] WERALUPITIYA C, WANIGATUNGE R, JOSEPH S, et al. Anammox bacteria in treating ammonium rich wastewater: Recent perspective and appraisal[J]. Bioresource Technology, 2021, 334: 125240. doi: 10.1016/j.biortech.2021.125240 [5] ZOU X, CHEN C, WANG C, et al. Combining electrochemical nitrate reduction and anammox for treatment of nitrate-rich wastewater: A short review[J]. Science of the Total Environment, 2021, 800: 149645. doi: 10.1016/j.scitotenv.2021.149645 [6] WANG P, LU B, LIU X, et al. Accelerating the granulation of anammox sludge in wastewater treatment with the drive of “micro-nuclei”: A review[J]. Science of the Total Environment, 2023, 860: 160238. doi: 10.1016/j.scitotenv.2022.160238 [7] XU J, WU X, ZHU N, et al. Anammox process dosed with biochars for enhanced nitrogen removal: Role of surface functional groups[J]. Science of the Total Environment, 2020, 748: 141367. doi: 10.1016/j.scitotenv.2020.141367 [8] LI R, WANG B, NIU A, et al. Application of biochar immobilized microorganisms for pollutants removal from wastewater: A review[J]. Science of the Total Environment, 2022, 837: 155563. doi: 10.1016/j.scitotenv.2022.155563 [9] 付静薇, 贾紫雯, 杨晓欢, 等. 热解温度对生物炭提升厌氧氨氧化性能的影响[J]. 中国环境科学, 2022, 42(12): 5695-5702. doi: 10.3969/j.issn.1000-6923.2022.12.027 [10] ZHANG D, LI W, HOU C, et al. Aerobic granulation accelerated by biochar for the treatment of refractory wastewater[J]. Chemical Engineering Journal, 2017, 314: 88-97. doi: 10.1016/j.cej.2016.12.128 [11] WANG Z, GU Z, YANG Y, et al. Review of biochar as a novel carrier for anammox process: Material, performance and mechanisms[J]. Journal of Water Process Engineering, 2022, 50: 103277. doi: 10.1016/j.jwpe.2022.103277 [12] LI Q, JIA Z, FU J, et al. Biochar enhances partial denitrification/anammox by sustaining high rates of nitrate to nitrite reduction[J]. Bioresource Technology, 2022, 349: 126869. doi: 10.1016/j.biortech.2022.126869 [13] CHEN H, CAO S, CHEN L, et al. Biochar accelerates the start-up of the anammox process: Phenomenon and potential mechanisms[J]. Journal of Water Process Engineering, 2023, 53: 103662. doi: 10.1016/j.jwpe.2023.103662 [14] LI H, ZHANG J, ZHANG C, et al. Responses of anammox and sulfur/pyrite autotrophic denitrification in one-stage system to high nitrogen load: Performance, metabolic and bacterial community[J]. Journal of Environmental Management, 2023, 332: 117427. doi: 10.1016/j.jenvman.2023.117427 [15] SUN T, LEVIN B D A, GUZMAN J J L, et al. Rapid electron transfer by the carbon matrix in natural pyrogenic carbon[J]. Nature Communications, 2017, 8(1): 14873. doi: 10.1038/ncomms14873 [16] TIAN T, QIAO S, LI X, et al. Nano-graphene induced positive effects on methanogenesis in anaerobic digestion[J]. Bioresource Technology, 2017, 224: 41-47. doi: 10.1016/j.biortech.2016.10.058 [17] COATES J D, COLE K A, CHAKRABORTY R, et al. Diversity and ubiquity of bacteria capable of utilizing humic substances as electron donors for anaerobic respiration[J]. Applied and Environmental Microbiology, 2002, 68(5): 2445-2452. doi: 10.1128/AEM.68.5.2445-2452.2002 [18] CHEN G, ZHANG Z, ZHANG Z, et al. Redox-active reactions in denitrification provided by biochars pyrolyzed at different temperatures[J]. Science of the Total Environment, 2018, 615: 1547-1556. doi: 10.1016/j.scitotenv.2017.09.125 [19] XU X, LIU G H, FAN Q, et al. Effects of gibberellin on the activity of anammox bacteria[J]. Journal of Environmental Management, 2018, 225: 104-111. [20] YANG D, ZUO J, JIANG C, et al. Fast start-up of anammox process: Effects of extracellular polymeric substances addition on performance, granule properties, and bacterial community structure[J]. Journal of Environmental Management, 2023, 338: 117836. doi: 10.1016/j.jenvman.2023.117836 [21] XIE J, GUO M, XIE J, et al. COD inhibition alleviation and anammox granular sludge stability improvement by biochar addition[J]. Journal of Cleaner Production, 2022, 345: 131167. doi: 10.1016/j.jclepro.2022.131167 [22] XING B S, QIN T Y, CHEN S X, et al. Performance of the ANAMMOX process using multi- and single-fed upflow anaerobic sludge blanket reactors[J]. Bioresource Technology, 2013, 149: 310-317. doi: 10.1016/j.biortech.2013.09.066 [23] ZHANG W, ZHOU X, CAO X, et al. Accelerating anammox nitrogen removal in low intensity ultrasound-assisted ASBBR: Performance optimization, EPS characterization and microbial community analysis[J]. Science of the Total Environment, 2022, 817: 152989. doi: 10.1016/j.scitotenv.2022.152989 [24] TANG L, SU C, WANG Q, et al. Use of iron-loaded biochar to alleviate anammox performance inhibition under PFOA stress conditions: Integrated analysis of sludge characteristics and metagenomics[J]. Science of the Total Environment, 2023, 865: 161178. doi: 10.1016/j.scitotenv.2022.161178 [25] 常尧枫, 郭萌蕾, 谢军祥, 等. 厌氧氨氧化脱氮除碳功能菌群结构及代谢途径[J]. 中国环境科学, 2022, 42(3): 1138-1145. doi: 10.3969/j.issn.1000-6923.2022.03.018 [26] ZHENG B, ZHANG L, GUO J, et al. Suspended sludge and biofilm shaped different anammox communities in two pilot-scale one-stage anammox reactors[J]. Bioresource Technology, 2016, 211: 273-279. doi: 10.1016/j.biortech.2016.03.049 [27] WU L, DING X, LIN Y, et al. Nitrogen removal by a novel heterotrophic nitrification and aerobic denitrification bacterium Acinetobacter calcoaceticus TY1 under low temperatures[J]. Bioresource Technology, 2022, 353: 127148. doi: 10.1016/j.biortech.2022.127148 [28] ZHANG D, YU H, YANG Y, et al. Ecological interactions and the underlying mechanism of anammox and denitrification across the anammox enrichment with eutrophic lake sediments[J]. Microbiome, 2023, 11(1): 82. doi: 10.1186/s40168-023-01532-y [29] TAN C, CHEN S, ZHANG H, et al. The roles of Rhodococcus ruber in denitrification with quinoline as the electron donor[J]. Science of the Total Environment, 2023, 902: 166128. doi: 10.1016/j.scitotenv.2023.166128 [30] DU J, XU B, MA L, et al. Study on denitrification of hydroponic wastewater reverse osmosis concentrate using sulfur-autotrophic denitrification[J]. Journal of Environmental Chemical Engineering, 2023, 11(6): 111195. doi: 10.1016/j.jece.2023.111195 [31] SUI Q, ZHENG R, ZHANG J, et al. Successful enrichment of anammox consortium in a single-stage reactor at full-scale: The difference in response of functional genes and transcriptional expressions[J]. Chemical Engineering Journal, 2021, 426: 131935. doi: 10.1016/j.cej.2021.131935 -



 下载:
下载: