-
人工湿地技术是一项通过模拟或强化生态系统的结构和功能,利用植物 、微生物及动物等的共同作用进行水污染治理和生态修复的水质净化工程技术,已被广泛应用于地表水的保护以及多种污废水,如生活污水、农业废水、工业废水、酸性矿山排水、城市和公路径流的脱氮处理[1-3]。其中,垂直流人工湿地,由于具有较好的有机物和氨氮去除能力[4-7],并具有占地面积小的优势,在实际工程中常用于处理含氮量较高的污水[8-9]。目前国家对于农村生活污水的排放标准主要考察COD、氨氮和总氮等指标,没有对硝态氮作出明确要求,所以在使用传统非饱和垂直流人工湿地时也是主要考虑强化其对氨氮的硝化能力,忽略了对其反硝化能力的提升,从而导致其反硝能力普遍较弱[10-13]。
微生物的硝化和反硝化作用是人工湿地脱氮的主要途径,但二者对氧的需求不同[14]。一般来说,参与硝化过程的功能微生物对氧的需求较高,大多数为好氧或兼性好氧微生物,而参与反硝化过程的功能微生物多数为兼性厌氧微生物。因此,当水中溶解氧(dissolved oxygen,DO)<1~2 mg·L−1时硝化作用会减小, DO>0.2 mg·L−1 反硝化作用受到抑制[15-16]。大多数传统垂直流人工湿地系统在运行过程中是处于水不饱和状态,大气复氧能力强,有利于硝化作用进行但不利于反硝化作用进行。因此,为了弥补传统垂直流人工湿地反硝化能力差的问题,本研究对传统垂直流人工湿地系统进行了结构改造,将系统构建成分内、外两层的多氧态垂直流人工湿地,采用内层底部连续进水,在内层形成水上行的饱和状态和厌氧环境,促进生活污水中的高浓度有机化合物进行厌氧降解,使污水中有机氮通过氨化反应转化为氨氮[17]。同时,在外层形成水下行的部分饱和状态,使系统(尤其是系统外层)中DO的分布呈持续的动态变化状态(多氧态),为硝化和反硝化过程的进行提供适宜的DO环境,在系统外层上部的非饱和区利用硝化反应将氨氮转化为硝态氮,在系统外层下部的饱和区利用反硝化反应将硝态氮转化为氮气,从而实现在同一湿地系统中将污水中的有机氮经氨化降解、再硝化、反硝化彻底去除的目的。此外,本研究对该湿地系统在不同水饱和比、不同水力停留时间(hydraulic retention time,HRT)条件下的污染物去除效率、基质中微生物群落结构的演变规律以及氮循环功能基因的分布特征进行了分析和比较,可为多氧态垂直流人工湿地系统的推广和应用提供参考。
-
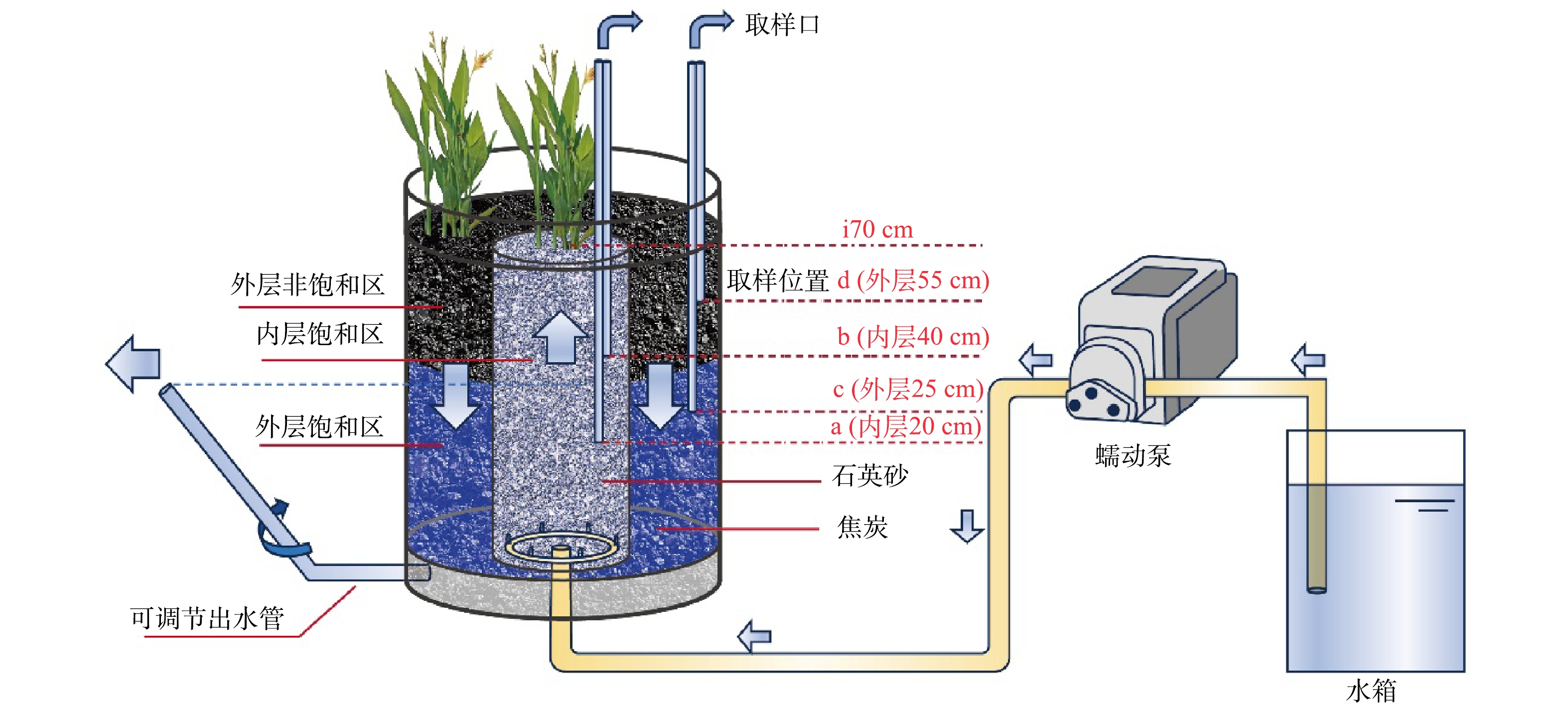
本实验采用自行设计的多氧态垂直流人工湿地系统,实验装置设置在桂林理工大学污水处理站内。系统由配水箱、蠕动泵和垂直流人工湿地3部分组成如图1所示。垂直流人工湿地部分由内外两层的PVC圆柱体建成,内层直径为16 cm,外层直径为30 cm;内层高度为0.7 m,填充高度为0.6 m;外层高度0.8 m,填充高度为0.7 m,内外层填充体积比为1:3。进水通过蠕动泵和布水装置均匀的从内层底部自下而上的流过内层床体,出水由与外层底部的出水口相连的软管排出。根据虹吸原理,通过调节出水软管高度来控制外层床体的饱和区水位,以外层饱和区水位高度与总高度比值来表示系统外层水饱和比。
湿地系统的内、外层分别采用粒径8~10 mm的石英砂颗粒和粒径5~8 mm的焦炭颗粒进行填充。内外层主体填料的上下两端各填充厚度为5 cm的鹅卵石,作为进水区和集水区,以截留悬浮物防止堵塞。内外层的填料层上种植的植物为美人蕉。填料中在内层距底部20 cm(a点)和40 cm(b点)处,以及外层距底部25 cm(c点)和55 cm(d点)处分别埋有直径8 mm的4根采样管,便于水样采集。
-
实验进水取自桂林理工大学污水站的生活污水,污水中COD、NH4+-N、NO3−-N的平均质量浓度分别为(105.60±17.36)、(51.54±14.35)、(0.78±0.45) mg·L−1。实验正式开始前,系统先在HRT为48 h的条件下连续进水1个月进行预培养,使系统运行达到稳定。
为确保系统外层水位不会影响最佳HRT的确定,正式实验以系统外层水饱和比(既外层水位高度与外层填料高度的比值)为0的条件作为对照,比较HRT 分别为6、12、24、48 h时对污染物(COD和NH4+-N)的净化效果,来确定系统污染物去除的最佳HRT。再在最佳HRT条件下,比较系统外层水饱和比分别为1、3∶4、1∶2、1∶3、0时,对污染物的去除效果,确定最优的系统外层水饱和比;同时,分析该水饱和比条件下湿地系统内部的饱和区和非饱和区DO、ORP分布特征,确定系统的多氧态形成情况。最后,在最佳外层水饱和比和最佳HRT条件下,控制进水C/N为7:1,测定系统对高负荷生活污水的污染物净化效率,分析比较系统填料微生物群落结构、以及反硝化功能基因的丰度变化情况,分析其促进污染物去除的机理。
-
1)水样采集与分析。水样采集位点如图1所示为内层20 cm(a点)、内层40 cm(b点)、内部顶层(i70 cm)、外层25 cm(c点)和外层55 cm(d点),分别标记为内层20、内层40、内层70、外层25、外层55。内、外层填料中不同高度的水样使用洗耳球通过预埋的采样管吸取,i70 cm的水样采用50 mL注射器直接抽取,出水水样直接从排水管口直接收集。每个点水样采集至少150 mL。针对特定条件运行周期,每2 d采集1次,水样采集后立即带回实验室进行分析。分析的指标包括:化学需氧量(COD)、氨氮(NH4+-N)和硝态氮(NO3−-N)。测试方法分别为:重铬酸钾法(GB11914-89),纳氏试剂分光光度法(GB7479-87)和紫外分光光度法(HJ-T346-2007)。水样采集的同时,以便携式YSI多参数水质分析仪在采样现场测定各采样点的DO、氧化还原电位(oxidation-reduction potential,ORP)。
2)微生物样品采集与分析。实验末期,控制系统外层水饱和比为1:2,进水C/N为7:1,连续运行两周。期间除了水样采集,在实验结束后,再在如图1所示的a点、b点、c点和d点4个水样采集点中,各取3个基质样品,将其均匀混合后取10 g作为该采样点的基质微生物样品,其中对b点和d点处样品进行氮循环功能基因定量PCR分析。样品采集后,立即送样至北京奥维森生物科技有限公司进行DNA提取,微生物多样性检测和氮循环功能基因定量PCR分析。其中,DNA 提取方法参照 DNA Kit (Omega Bio-tek, Norcross, GA, U.S.)试剂盒说明书。微生物多样性检测选取细菌16S rDNA V3~V4区,利用 Illumina Miseq PE300高通量测序平台测序。氮循环功能基因定量PCR分析选择氨氧化作用的三种菌(AOA,AOB与厌氧氨氧化 (Anammox) 菌和反硝化菌)的功能基因进行研究。定性和定量PCR时,AOA与AOB的扩增都采用功能基因氨单加氧酶amoA的引物,Anammox菌的扩增采用Anammox 16s-RNA;硝化检测功能基因nxrA、nxrB;反硝化菌检测功能基因narG、nirS和nirK。所有引物的合成和数据分析处理均由北京奥维森生物科技有限公司完成。
-
通过改变可伸缩U型管的出水高度,控制系统外层水饱和比为0,比较不同HRT条件下系统对污染物COD和NH4+-N的净化效果,此阶段进水COD为140.62~219.53 mg·L−1,进水NH4+-N在32.36~65.65 mg·L−1。由图2可以看到,随着HRT从6 h增加到48 h,湿地系统的COD和NH4+-N的去除率逐渐从76.03%和88.28%(6 h)增加到95.76%和98.38%(24 h),并在48 h时达到96.64%和99.04%。
在HRT为6 h和12 h时,系统对污染物的去除率较低,这可能在于停留时间较短,系统的水力冲刷大,污水在系统填料间的停留时间较短,不能充分被微生物转化、降解。而当HRT增大为24 h和48 h时,系统对污染物的去除率逐渐升高并达到最佳状态,对COD和NH4+-N的去除率可达到90%以上,可见,HRT的变化可显著影响人工湿地的污染物净化效果。分别核算HRT为24 h和48 h时的单位面积氨氮负荷去除量可得,24 h时为8.22 g·(m2·d)−1,48 h时为5.11 g·(m2·d)−1,则系统在24 h时对氨氮的去除效能最好,同时从经济性上考虑,过长的HRT可能会造成系统处理能力的浪费。因此系统HRT采用24 h时长,既可以保证污染物的最好净化效果,又能充分发挥系统的处理能力,因此后续的实验均在HRT为24 h条件下进行。
-
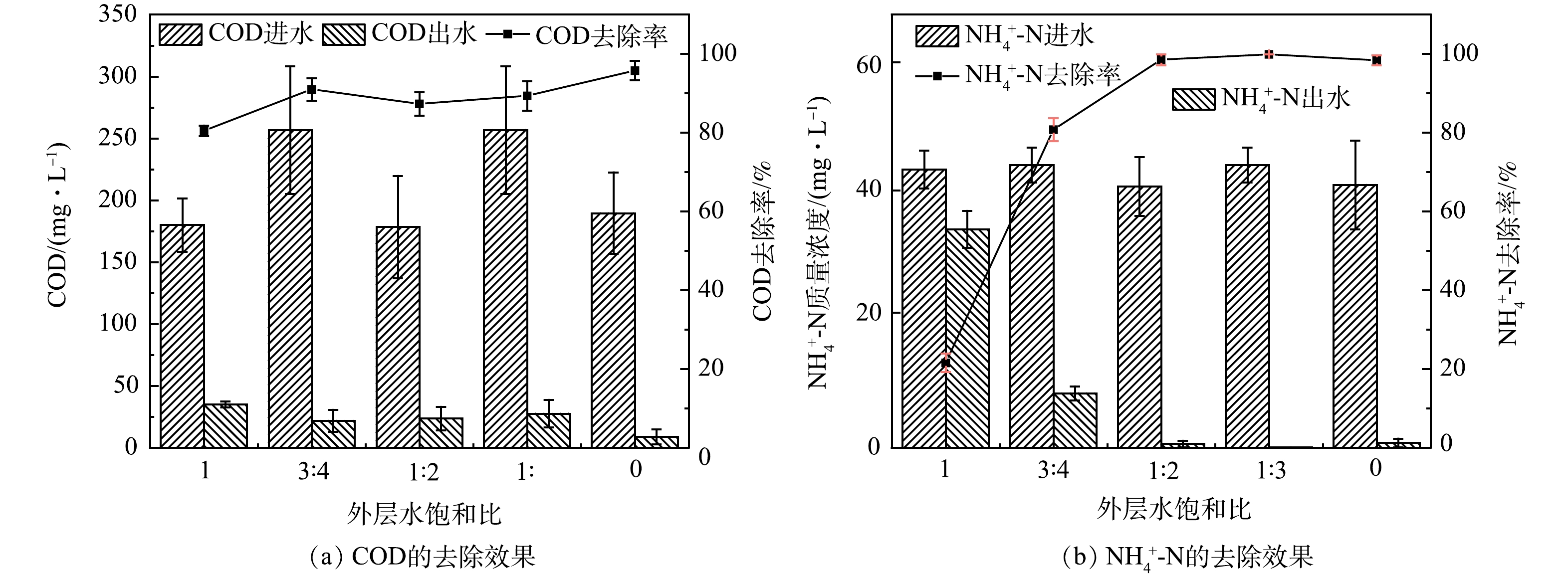
1)多氧态湿地系统的最优水饱和比。在HRT为 24 h条件下,通过改变可伸缩U型管的出水高度,控制系统外层水饱和比分别为1、3:4、1:2、1:3、0,比较系统在不同水饱和比条件下对COD和NH4+-N的去除效果,结果如图3(a)和图3(b)所示。
方差分析结果表明,系统外层水饱和比对COD和NH4+-N的去除均有显著性影响(P<0.05)。水饱和比为0时COD的去除效率最高,约为96%;水饱和比为1∶2、1∶3和0时,NH4+-N的去除效率均在98%以上,故分别核算系统外层水饱和比为1、3∶4、1∶2、1∶3和0时的单位面积氨氮负荷去除量为6.78、18.76、21.30、16.71和8.22 g·(m2·d)−1,可得本系统在外层水饱和比为1∶2时对氨氮的去除效能最好。总的来看,系统外层水饱和比为1∶2时,系统对COD和NH4+-N可以达到相对较好的净化效果。
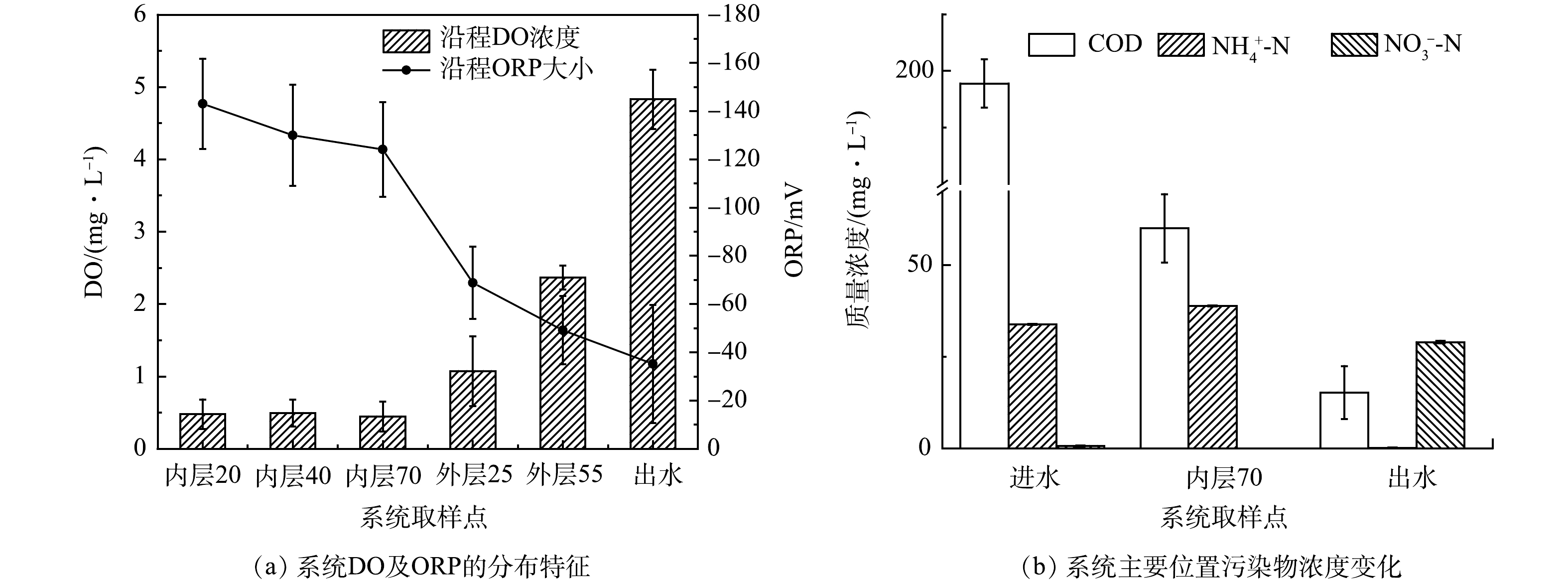
2)多氧态湿地系统的DO及ORP分布特征。DO是影响污水有机物去除效率的重要因素,ORP则可综合DO、有机物质及微生物活性等指标来反映系统中的氧化还原状态[18]。当外层水饱和比为1∶2时,湿地系统DO及ORP 分布特征如图4(a)所示。系统内层饱和区的DO普遍较低(0.2~0.7 mg·L−1),基本处于厌氧状态,ORP呈由内层底部(20 cm)的−143.04 mV向顶部(70 cm) 提升至−124.1 mV,呈逐渐升高的趋势。系统外层分为水饱和区和非饱和区,但二者的DO和ORP均显著高于内层。其中,外层的DO由底部向顶部同样呈现由低向高的逐渐变化,且表现出好氧、缺氧和厌氧区的区分,其中c点处DO值为0.7~1.7 mg·L−1,处于缺氧状态;d点DO值在2.1~2.5 mg·L−1,处于好氧状态。同时,外层中的ORP随着深度的增加呈下降趋势,−49.10 mV(d点)降到−68.80 mV(c点)。以上结果表明,本研究采用的双层垂直流人工湿地设计,可通过控制系统外层水饱和比的高低,调节系统的饱和区和非饱和区的占比,促使系统尤其是系统外层的DO和ORP分布呈持续的动态变化状态,实现系统多氧态状态的构建。
垂直流人工湿地中有机物的去除主要是通过微生物的氧化,对NH4+-N的净化主要是通过微生物的硝化作用。由图3可见,当外层的水饱和比为0时,有机物的去除效率最高;系统外层水饱和比≤1:2时,NH4+-N的去除效率即可达到98%以上。由图4(b)可以看出,i70 cm处的NH4+-N质量浓度高于进水。这可能是因为系统内层发生的厌氧发酵使得污水中的有机氮在微生物作用下转化生成NH4+-N,同时部分有机物也被降解去除,使COD的去除率接近70%,之后随着外层非饱和区利用大气的复氧作用使得水中DO含量上升,为有机物的进一步氧化分解及NH4+-N的硝化去除创造了条件,表现为出水中NO3−-N质量浓度上升,而COD和NH4+-N质量浓度持续下降。
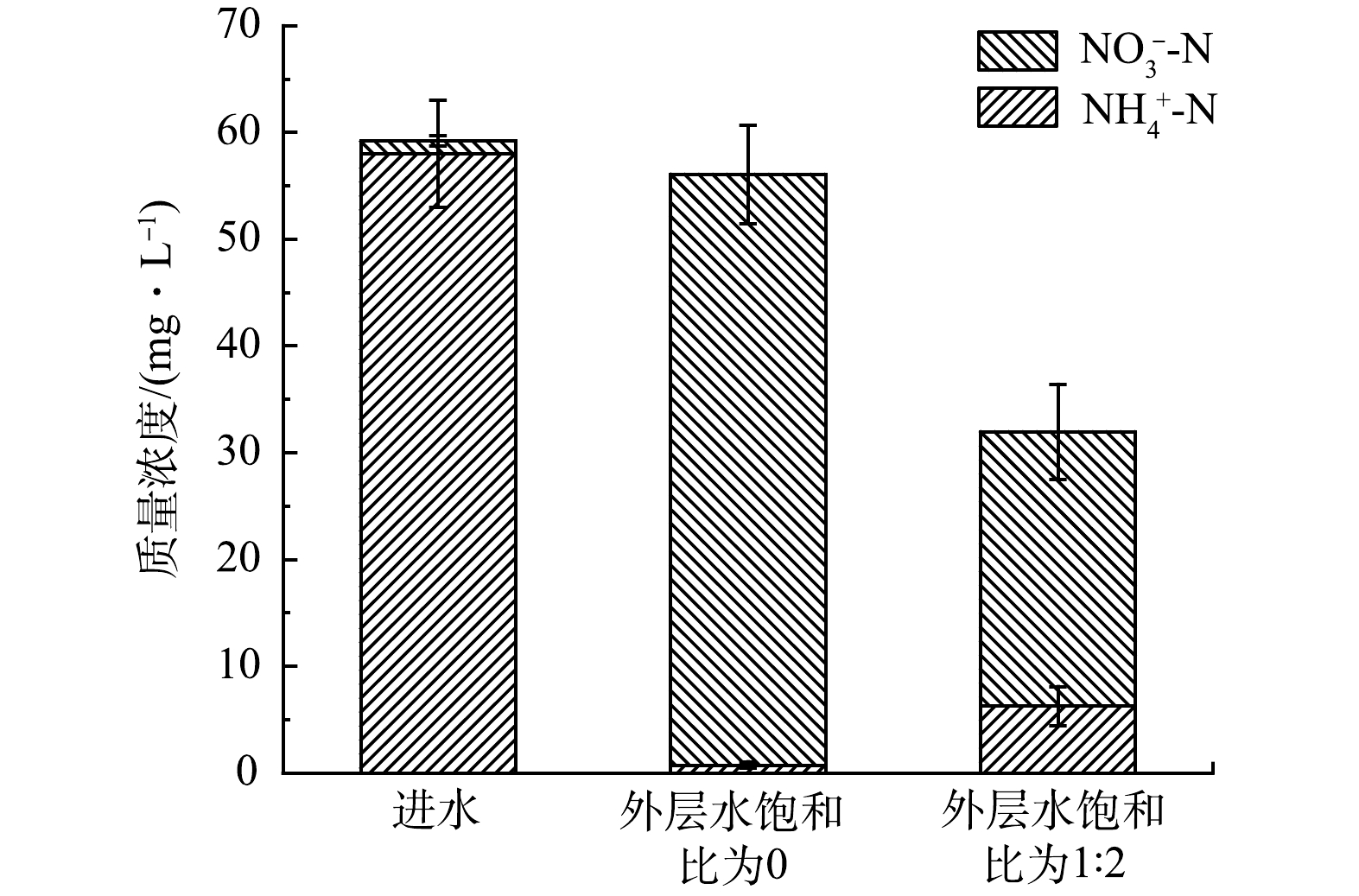
3)多氧态湿地系统中氨氮的转化。传统垂直流人工湿地中,部分饱和的垂直流人工湿地的反硝化效果明显高于不饱和垂直流人工湿地[19]。因此,在外层水饱和比分别为0和1:2的条件下,对比系统进、出水的NH4+-N和NO3−-N的浓度得到如图5所示结果。可以看出,系统外层水饱和比为0时,进水中的NH4+-N几乎全部转化成NO3−-N,且出水中NH4+-N和NO3−-N的含量与进水中的基本相当,说明此条件下,进水中NH4+-N质量浓度的降低主要是依靠硝化作用,但产生的NO3−-N 在系统中没有进一步的转化。这可能由于此条件下系统由外层底部直接出水,非饱和区占比大,所以NH4+-N的硝化作用彻底,绝大部分均转化成了NO3−-N 。但由于决定NO3−-N 去除的反硝化阶段缺失,因此系统总的脱氮效率较低。而当系统外层的水饱和比为1∶2时,外层形成了一定的饱和区,使其底部呈现缺氧状态,而顶部仍然是好氧状态,整个系统形成厌氧-好氧-缺氧的多氧态,进水中的NH4+-N可以通过硝化作用去除,其生成的NO3−-N 也能够在外层下部饱和区的缺氧环境中发生反硝化作用生成N2去除,所以该条件下出水的NO3−-N 含量更低,同时NH4+-N+NO3−-N的含量也显著下降,仅为系统外层水饱和比为0时的57%,可大大提高系统总的脱氮效率。因此,与传统非饱和垂直流湿地相比,多氧态湿地系统的不仅保留了其原本的硝化能力,还提升了一定的反硝化能力[19–20]。
-
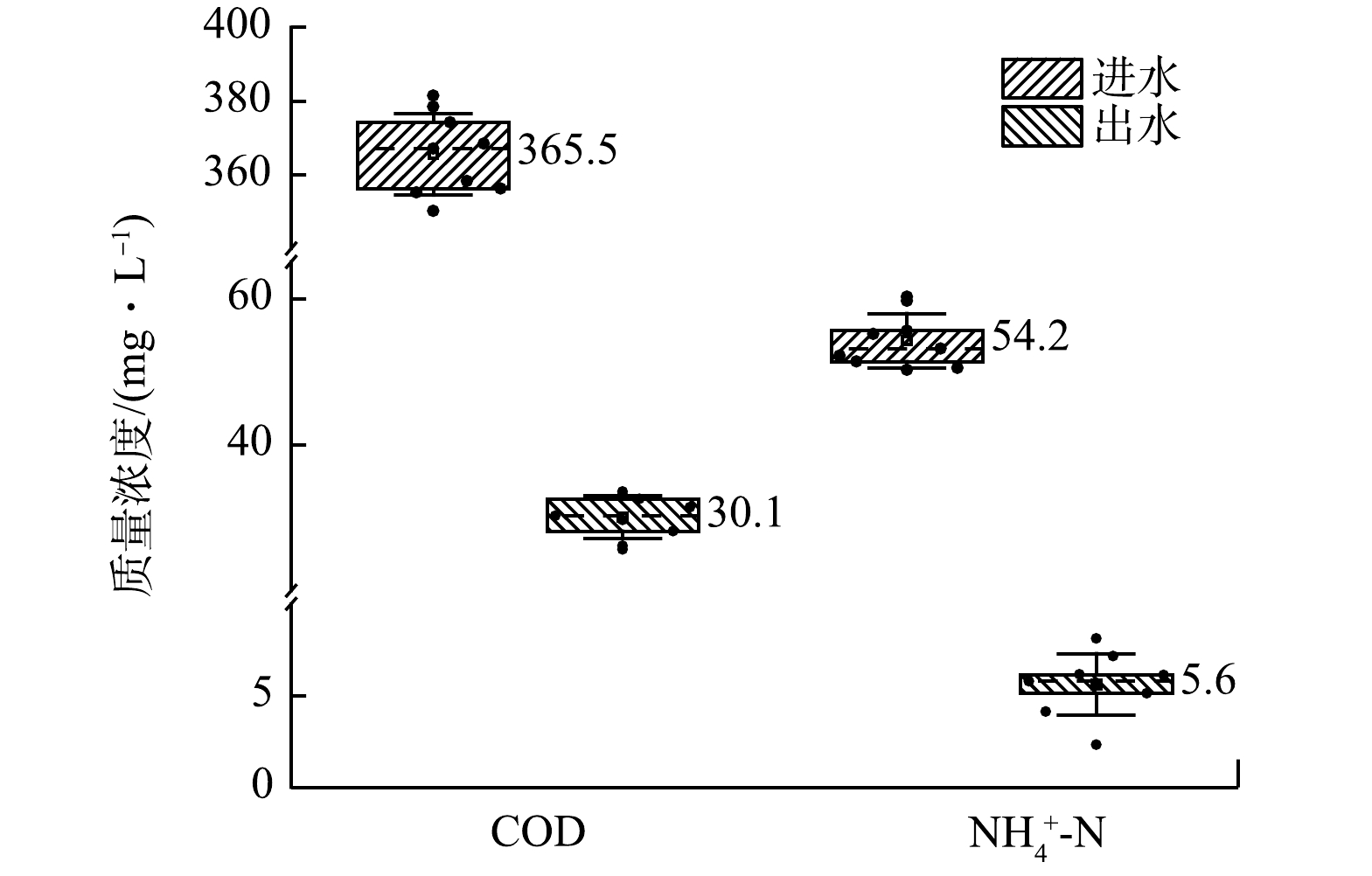
控制湿地系统外层水饱和比为1:2,进水C/N为7:1(COD为350.23~381.46 mg·L−1、NH4+-N为50.23~60.57 mg·L−1),测定系统对COD和NH4+-N的较高有机负荷污水的净化效率。如图6所示,多氧态湿地系统对污水中COD的去除率可达91.92%,而NH4+-N去除率也可达到90.53%。说明本系统具有良好的有机物降解能力,能够去除较高负荷的有机污染物,同时对于高氨氮污水也有较高的处理能力。
-
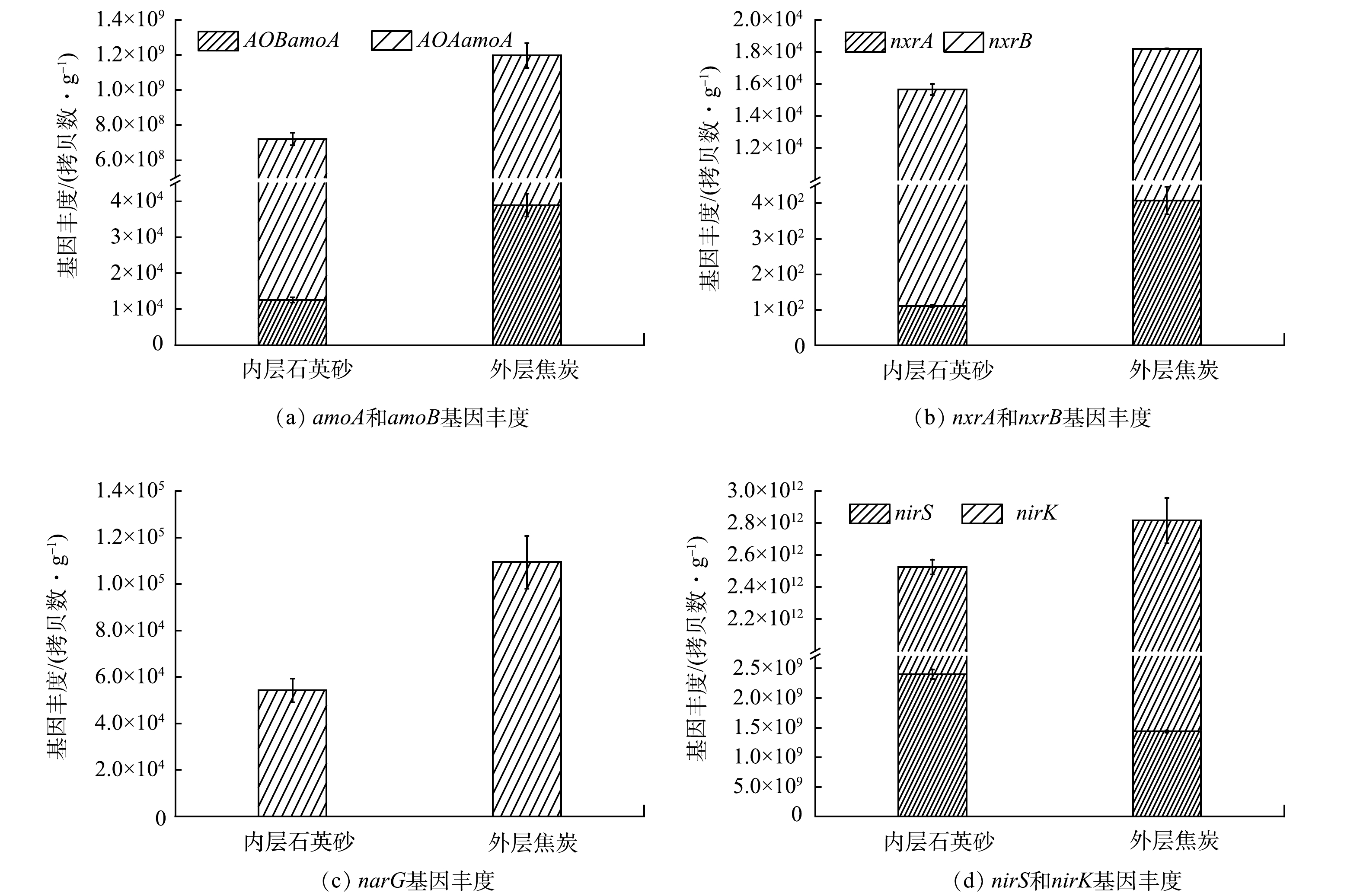
以特定功能基因或特定的16S-RNA片段作为分子标记,采用定量 PCR(Real-time PCR)来测定特定基因片段的相对数量,可以对样品中特定功能微生物数量进行定量分析[21]。本研究选择的分子标记:氨单加氧酶amoA、亚硝酸盐氧化酶nxrA和nxrB、硝酸还原酶narG、亚硝酸还原酶nirS和nirK 是参与自然界氮循环过程的关键催化酶,其分别在氨的好氧氧化、亚硝酸盐氧化、亚硝酸盐还原、硝酸盐还原过程中起到重要作用;Anammox菌介导的厌氧氨氧化过程,可直接在缺氧条件下以NH4+为电子供体,亚硝酸盐为电子受体,产生N2。
由图7(a)可知,多氧态湿地系统amoA功能基因主要来源于AOA,且外层中amoA功能基因的数量显著高于内层,说明系统的好氧氨氧化作用主要发生外层,且主要由好氧氨氧化细菌驱动[22–23]。与之类似, 通过图7(b)可看出,催化亚硝酸盐氧化的重要功能基因nxr在外层中的含量比内层高,也说明系统外层中的硝化作用更强[24]。因此,由图7(a)和图7(b)可以表明外层营造的好氧环境为硝化细菌的生存和繁殖提供了适宜的环境。
此外,系统中还同时存在一定量的Anammox菌,其中内层石英砂的丰度为2.91×109 拷贝数·g−1,外层焦炭中的丰度为7.86×108 拷贝数·g−1,与AOA的数量基本持平,但主要分布在系统内层饱和区,这与Anammox菌对氧的需求适应。Anammox菌能够在厌氧/缺氧的条件下,直接以NH4+为电子供体,NO2−为电子受体,产生N2[25]。虽然这一过程的存在,可能使亚硝酸盐氧化细菌(NOB)的因为底物竞争而生长受抑,使nxrA、nxrB基因的数量较低(图7(b)),但Anammox过程的存在,可以使NH4+直接转化为N2而去除,对提高系统总氮的去除效率是非常有利的。
narG编码的硝酸盐还原酶参与催化反硝化过程的第1步,促使硝酸盐向亚硝酸盐的转化,而nirK和nirS则是编码反硝化过程第2步中催化亚硝酸盐还原酶的关键功能基因[26–27]。由图7(c)和(d)可知,narG、nirK和nirS在系统内、外层中均有分布,但在系统内层中的含量均比外层中的少。这可能与外层中的NO3−-N含量远大于内层有关,也表明系统多氧态的形成,可以促使反硝化作用在外层进行,提升系统总的氮去除能力,这也与前期的研究结果(图5)相符合。
总的来看,本湿地系统构建形成的“多氧态”状态,可以在保持传统垂直流人工湿地系统水流特点和优势的同时,为对氧具有不同需求的氮循环功能微生物提供适宜的微生态环境,强化其生物转化作用(包括硝化、反硝化以及Anammox作用),从而提高系统的氮去除效率。
-
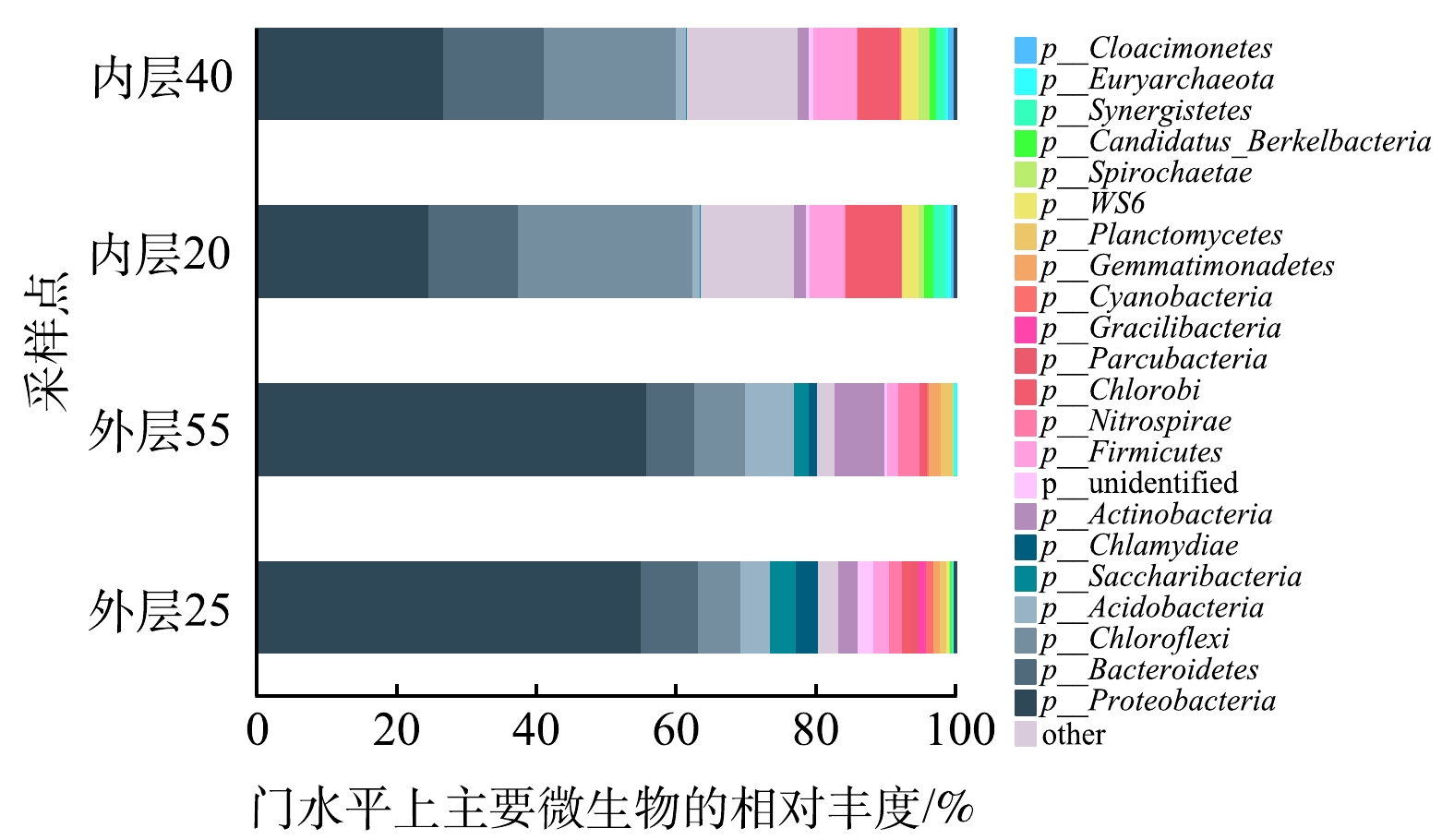
1)门水平微生物群落结构。对多氧态湿地系统内外层共4个基质样品进行微生物多样性检测分析,并对所有OTU系列进行物种注释,共得到60多种不同的细菌门。如图8所示,微生物数量最多的前3个门依次为Proteobacteria(变形菌门) 、Chloroflexi(绿弯菌门)和Bacteroidetes(拟杆菌门),这3种菌门也被广泛报道存在于水处理反应器中[28-30]。
从门水平看,Proteobacteria在4个样本中均为相对丰度最高的优势种,这与ANSOLA等[31]在人工湿地中的研究结果一致。Proteobacteria属于革兰氏阴性细菌,其物种和遗传多样性极为丰富,是COD去除和脱氮过程的重要贡献者。本研究结果表明,Proteobacteria在系统外层所占的比例(平均55.6%)比内层的(平均25.8%)高(图8),说明湿地系统多氧态的构建可以促使Proteobacteria大量繁殖,从而可能提升系统的污染物去除能力增加。
此外, 4个样本中Chloroflexi和Bacteroidetes的相对丰度仅次于Proteobacteria,但二者在系统内层所占的比例(平均21.9%)比外层的(平均6.6%)大(图8),这与Chloroflexi和Bacteroidetes均属于兼性厌氧微生物,对氧的需求较低有关。已有研究表明这两类细菌都是有机物的主要降解者,能够降解复杂的有机物[32]。因此,Chloroflexi和Bacteroidetes在内层的广泛存在,可充分发挥其对复杂有机物的降解能力,有利于系统对有机污染物的去除。同时,多氧态湿地系统中丰度较大的还有Caldiserica、Actinobacteria、Firmicutes、Acidobacteria等,他们在有机物的矿化和氮的固定等方面发挥着重要作用[33]。
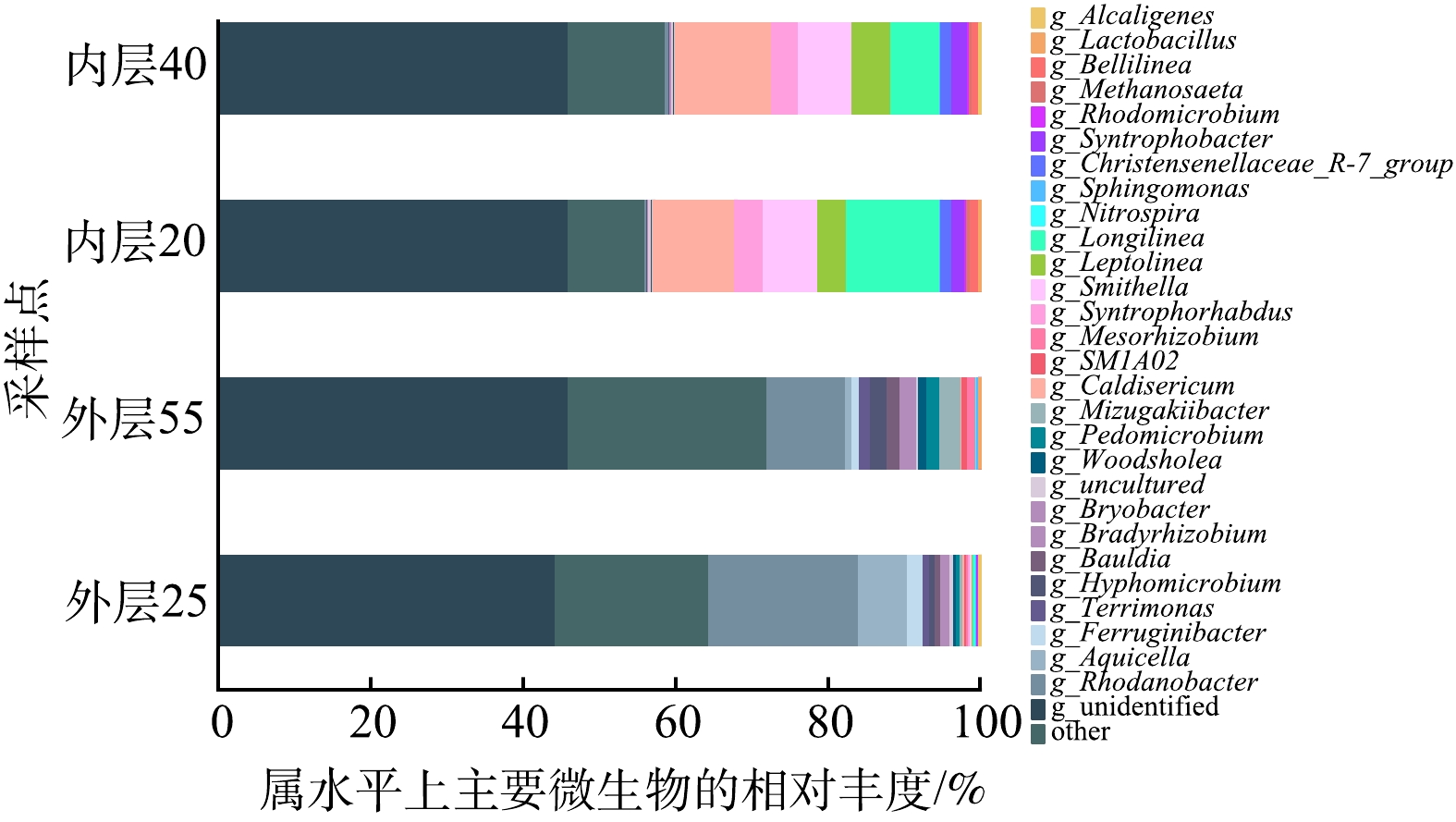
2)属水平微生物群落结构。以属为单位对多氧态湿地系统的微生物群落结构进行分析得到图9。系统内层的优势菌属为Caldisericum、Longilinea、Smithella、Leptolinea、Syntrophorhabdus等厌氧菌,他们均与有机物的代谢有关,其中,Longilinea和Leptolinea对多糖具有良好的降解能力[34],Caldisericum和Syntrophorhabdus是工业废水生物处理系统中常见菌种,有助于有机物的降解,并且Syntrophorhabdus是厌氧生态系统中的丰富细菌主要降解芳香族化合物[35]。他们在样品总丰度中的占比分别为37.74%(内层20)、34.70%(内层40)、1.09%(外层25)、0.14%(外层55),且在内层的相对丰度远大于在外层的。可以推测,系统的有机物降解过程主要在系统内层发生。
系统的外层优势菌属为Rhodanobacter、Nitrospira等。其中,Rhodanobacter属变形菌门γ-变形菌纲的黄色单胞菌科[36]。该菌在好氧的土壤表层发现并分离,具有反硝化能力[37-40],它在多氧态湿地系统的外层中大量出现,可促进反硝化反应的进行。而外层的另一优势菌Nitrospira是亚硝酸盐氧化细菌的主要菌属,主要分布在外层上部的好氧区域,丰度达2.94%。作为硝化过程中的关键菌属,它可将水体中的亚硝酸盐氧化成硝酸盐[41],其在系统外层的优势存在,也很好的解释了为何多氧态湿地系统的外层具有较强的硝化能力。
3)多氧态湿地系统促进氮去除的机理。综上所述,本实验所构建的多氧态垂直流人工湿地,可通过调节外层水饱和比,在保证系统有机物去除效率的同时,提高系统总的脱氮效率,这与其特殊的分层结构有关。首先,多氧态垂直流人工湿地分为内外两层,当外层不饱和比为0时,其内层与传统的多氧态垂直流人工湿地相似,出水中氮主要以NO3−-N为主,NH4+-N 和 NO3−-N的含量与进水相比,降低仅为5%左右。而当外层不饱和比大于0时,系统的外层被由下到上被分成了饱和区和非饱和区,这与内层在完全饱和状态下形成的单一缺氧甚至是厌氧的环境相比,外层由底部向顶部DO和ORP均逐渐上升,形成同时兼备厌氧-缺氧-好氧环境的结构特点, 这使得系统外层中参与反硝化和硝化过程的微生物如Rhodanobacter和Nitrospira等均得到优势生长(图9),系统的外层硝化和反硝化功能也比内层得到强化(图7),从而使系统的氮去除能力得到提升(图5)。
-
1)通过调节系统外层水饱和比,多氧态湿地系统的内层呈饱和状态,DO比较低,属于缺氧厌氧区;外层上部非饱和区为好氧区,底部饱和区为厌氧/缺氧区,能够形成由厌(缺)氧到好氧的氧化还原分区。
2)多氧态湿地系统对NH4+-N和COD均有较好的去除效果,而当外层水饱和比为1:2,HRT为24 h时,多氧态湿地系统对污染物的净化效果最好。
3)多氧态湿地系统氮循环功能微生物的数量在外层中的分布高于内层,对系统的硝化和反硝化功能均有促进作用,可提升系统总的氮去除效率。
4)多氧态湿地系统内、外层的微生物群落结构组成具有显著差异。在门水平上Proteobacteria、Chloroflexi和Bacteroidetes的相对丰度较大,其中Proteobacteria在系统外层的丰度较大,而Chloroflexi和Bacteroidetes在内层丰度较大。属水平上,系统外层与内层的优势菌属也不同,外层的优势菌属为Rhodanobacter,属于反硝化菌;内层的优势菌属为Caldisericum、Longilinea等厌氧菌,有助于有机物的降解。
多氧态垂直流人工湿地系统的构建及其污染物去除特性
Construction of vertical flow constructed wetland system with multi-aerobic and anerobic zones and its removal characteristics on pollutant
-
摘要: 针对传统垂直流人工湿地因缺少厌氧及缺氧环境,反硝化能力较弱的问题,本研究对传统垂直流人工湿地系统进行了结构改造,构建为分内、外两层的多氧态垂直流人工湿地,在不降低其原有硝化能力的同时,通过增加系统的厌氧及缺氧体积,提升其反硝化能力。对该湿地系统在不同水饱和比、不同HRT条件下的污染物去除效率、基质中微生物群落结构演变规律以及氮循环功能基因的分布特征等进行的研究表明:当外层水饱和比为1:2,HRT为24 h时,多氧态垂直流湿地系统对NH4+-N和COD的净化效果最好;系统氮循环功能微生物的数量在外层中的分布高于内层,且对系统的硝化和反硝化功能均有促进作用,可提升系统总的氮去除效率。以上研究结果可以为多氧态垂直流人工湿地系统的推广和应用提供参考。
-
关键词:
- 多氧态垂直流人工湿地 /
- 水饱和比 /
- 去除效率 /
- 功能菌 /
- 功能基因
Abstract: Aiming at the problem that the traditional vertical flow constructed wetland has weak nitrogen removal ability due to the lack of anaerobic and anoxic environment, in this study, the structure of the traditional vertical flow constructed wetland system was reconstructed, and a vertical flow constructed wetland system with inner and outer double-layer construction and multi-aerobic and anerobic zones was built. The denitrification ability of this wetland system was strengthened by increasing its anaerobic and anoxic volume, and its original nitrification capacity did not change. At different water saturation ratio and hydraulic residence time, the pollutant removal efficiency, matrix microbial community structure and the distribution characteristics of nitrogen cycling functional genes in the matrix of wetland system the evolution were studied. The results showed that the best removal rates of NH4+-N and COD occurred when the water saturation ratio of the outer layer was 1:2 and the hydraulic residence time was 24 h; the abundance of nitrogen cycling functional microorganisms in the outer layer of the system was higher than that in the inner layer, which could promote both nitrification and denitrification functions of the system and raise the nitrogen removal rate of the system. The results of this study can provide a reference and basis for the popularization and application of vertical flow constructed wetland system with multi-aerobic and anerobic zones. -
人工湿地技术是一项通过模拟或强化生态系统的结构和功能,利用植物 、微生物及动物等的共同作用进行水污染治理和生态修复的水质净化工程技术,已被广泛应用于地表水的保护以及多种污废水,如生活污水、农业废水、工业废水、酸性矿山排水、城市和公路径流的脱氮处理[1-3]。其中,垂直流人工湿地,由于具有较好的有机物和氨氮去除能力[4-7],并具有占地面积小的优势,在实际工程中常用于处理含氮量较高的污水[8-9]。目前国家对于农村生活污水的排放标准主要考察COD、氨氮和总氮等指标,没有对硝态氮作出明确要求,所以在使用传统非饱和垂直流人工湿地时也是主要考虑强化其对氨氮的硝化能力,忽略了对其反硝化能力的提升,从而导致其反硝能力普遍较弱[10-13]。
微生物的硝化和反硝化作用是人工湿地脱氮的主要途径,但二者对氧的需求不同[14]。一般来说,参与硝化过程的功能微生物对氧的需求较高,大多数为好氧或兼性好氧微生物,而参与反硝化过程的功能微生物多数为兼性厌氧微生物。因此,当水中溶解氧(dissolved oxygen,DO)<1~2 mg·L−1时硝化作用会减小, DO>0.2 mg·L−1 反硝化作用受到抑制[15-16]。大多数传统垂直流人工湿地系统在运行过程中是处于水不饱和状态,大气复氧能力强,有利于硝化作用进行但不利于反硝化作用进行。因此,为了弥补传统垂直流人工湿地反硝化能力差的问题,本研究对传统垂直流人工湿地系统进行了结构改造,将系统构建成分内、外两层的多氧态垂直流人工湿地,采用内层底部连续进水,在内层形成水上行的饱和状态和厌氧环境,促进生活污水中的高浓度有机化合物进行厌氧降解,使污水中有机氮通过氨化反应转化为氨氮[17]。同时,在外层形成水下行的部分饱和状态,使系统(尤其是系统外层)中DO的分布呈持续的动态变化状态(多氧态),为硝化和反硝化过程的进行提供适宜的DO环境,在系统外层上部的非饱和区利用硝化反应将氨氮转化为硝态氮,在系统外层下部的饱和区利用反硝化反应将硝态氮转化为氮气,从而实现在同一湿地系统中将污水中的有机氮经氨化降解、再硝化、反硝化彻底去除的目的。此外,本研究对该湿地系统在不同水饱和比、不同水力停留时间(hydraulic retention time,HRT)条件下的污染物去除效率、基质中微生物群落结构的演变规律以及氮循环功能基因的分布特征进行了分析和比较,可为多氧态垂直流人工湿地系统的推广和应用提供参考。
1. 材料和方法
1.1 实验装置
本实验采用自行设计的多氧态垂直流人工湿地系统,实验装置设置在桂林理工大学污水处理站内。系统由配水箱、蠕动泵和垂直流人工湿地3部分组成如图1所示。垂直流人工湿地部分由内外两层的PVC圆柱体建成,内层直径为16 cm,外层直径为30 cm;内层高度为0.7 m,填充高度为0.6 m;外层高度0.8 m,填充高度为0.7 m,内外层填充体积比为1:3。进水通过蠕动泵和布水装置均匀的从内层底部自下而上的流过内层床体,出水由与外层底部的出水口相连的软管排出。根据虹吸原理,通过调节出水软管高度来控制外层床体的饱和区水位,以外层饱和区水位高度与总高度比值来表示系统外层水饱和比。
湿地系统的内、外层分别采用粒径8~10 mm的石英砂颗粒和粒径5~8 mm的焦炭颗粒进行填充。内外层主体填料的上下两端各填充厚度为5 cm的鹅卵石,作为进水区和集水区,以截留悬浮物防止堵塞。内外层的填料层上种植的植物为美人蕉。填料中在内层距底部20 cm(a点)和40 cm(b点)处,以及外层距底部25 cm(c点)和55 cm(d点)处分别埋有直径8 mm的4根采样管,便于水样采集。
1.2 实验设计
实验进水取自桂林理工大学污水站的生活污水,污水中COD、NH4+-N、NO3−-N的平均质量浓度分别为(105.60±17.36)、(51.54±14.35)、(0.78±0.45) mg·L−1。实验正式开始前,系统先在HRT为48 h的条件下连续进水1个月进行预培养,使系统运行达到稳定。
为确保系统外层水位不会影响最佳HRT的确定,正式实验以系统外层水饱和比(既外层水位高度与外层填料高度的比值)为0的条件作为对照,比较HRT 分别为6、12、24、48 h时对污染物(COD和NH4+-N)的净化效果,来确定系统污染物去除的最佳HRT。再在最佳HRT条件下,比较系统外层水饱和比分别为1、3∶4、1∶2、1∶3、0时,对污染物的去除效果,确定最优的系统外层水饱和比;同时,分析该水饱和比条件下湿地系统内部的饱和区和非饱和区DO、ORP分布特征,确定系统的多氧态形成情况。最后,在最佳外层水饱和比和最佳HRT条件下,控制进水C/N为7:1,测定系统对高负荷生活污水的污染物净化效率,分析比较系统填料微生物群落结构、以及反硝化功能基因的丰度变化情况,分析其促进污染物去除的机理。
1.3 样品采集与分析
1)水样采集与分析。水样采集位点如图1所示为内层20 cm(a点)、内层40 cm(b点)、内部顶层(i70 cm)、外层25 cm(c点)和外层55 cm(d点),分别标记为内层20、内层40、内层70、外层25、外层55。内、外层填料中不同高度的水样使用洗耳球通过预埋的采样管吸取,i70 cm的水样采用50 mL注射器直接抽取,出水水样直接从排水管口直接收集。每个点水样采集至少150 mL。针对特定条件运行周期,每2 d采集1次,水样采集后立即带回实验室进行分析。分析的指标包括:化学需氧量(COD)、氨氮(NH4+-N)和硝态氮(NO3−-N)。测试方法分别为:重铬酸钾法(GB11914-89),纳氏试剂分光光度法(GB7479-87)和紫外分光光度法(HJ-T346-2007)。水样采集的同时,以便携式YSI多参数水质分析仪在采样现场测定各采样点的DO、氧化还原电位(oxidation-reduction potential,ORP)。
2)微生物样品采集与分析。实验末期,控制系统外层水饱和比为1:2,进水C/N为7:1,连续运行两周。期间除了水样采集,在实验结束后,再在如图1所示的a点、b点、c点和d点4个水样采集点中,各取3个基质样品,将其均匀混合后取10 g作为该采样点的基质微生物样品,其中对b点和d点处样品进行氮循环功能基因定量PCR分析。样品采集后,立即送样至北京奥维森生物科技有限公司进行DNA提取,微生物多样性检测和氮循环功能基因定量PCR分析。其中,DNA 提取方法参照 DNA Kit (Omega Bio-tek, Norcross, GA, U.S.)试剂盒说明书。微生物多样性检测选取细菌16S rDNA V3~V4区,利用 Illumina Miseq PE300高通量测序平台测序。氮循环功能基因定量PCR分析选择氨氧化作用的三种菌(AOA,AOB与厌氧氨氧化 (Anammox) 菌和反硝化菌)的功能基因进行研究。定性和定量PCR时,AOA与AOB的扩增都采用功能基因氨单加氧酶amoA的引物,Anammox菌的扩增采用Anammox 16s-RNA;硝化检测功能基因nxrA、nxrB;反硝化菌检测功能基因narG、nirS和nirK。所有引物的合成和数据分析处理均由北京奥维森生物科技有限公司完成。
2. 结果与讨论
2.1 多氧态湿地系统的最佳HRT
通过改变可伸缩U型管的出水高度,控制系统外层水饱和比为0,比较不同HRT条件下系统对污染物COD和NH4+-N的净化效果,此阶段进水COD为140.62~219.53 mg·L−1,进水NH4+-N在32.36~65.65 mg·L−1。由图2可以看到,随着HRT从6 h增加到48 h,湿地系统的COD和NH4+-N的去除率逐渐从76.03%和88.28%(6 h)增加到95.76%和98.38%(24 h),并在48 h时达到96.64%和99.04%。
在HRT为6 h和12 h时,系统对污染物的去除率较低,这可能在于停留时间较短,系统的水力冲刷大,污水在系统填料间的停留时间较短,不能充分被微生物转化、降解。而当HRT增大为24 h和48 h时,系统对污染物的去除率逐渐升高并达到最佳状态,对COD和NH4+-N的去除率可达到90%以上,可见,HRT的变化可显著影响人工湿地的污染物净化效果。分别核算HRT为24 h和48 h时的单位面积氨氮负荷去除量可得,24 h时为8.22 g·(m2·d)−1,48 h时为5.11 g·(m2·d)−1,则系统在24 h时对氨氮的去除效能最好,同时从经济性上考虑,过长的HRT可能会造成系统处理能力的浪费。因此系统HRT采用24 h时长,既可以保证污染物的最好净化效果,又能充分发挥系统的处理能力,因此后续的实验均在HRT为24 h条件下进行。
2.2 多氧态湿地系统的构建
1)多氧态湿地系统的最优水饱和比。在HRT为 24 h条件下,通过改变可伸缩U型管的出水高度,控制系统外层水饱和比分别为1、3:4、1:2、1:3、0,比较系统在不同水饱和比条件下对COD和NH4+-N的去除效果,结果如图3(a)和图3(b)所示。
方差分析结果表明,系统外层水饱和比对COD和NH4+-N的去除均有显著性影响(P<0.05)。水饱和比为0时COD的去除效率最高,约为96%;水饱和比为1∶2、1∶3和0时,NH4+-N的去除效率均在98%以上,故分别核算系统外层水饱和比为1、3∶4、1∶2、1∶3和0时的单位面积氨氮负荷去除量为6.78、18.76、21.30、16.71和8.22 g·(m2·d)−1,可得本系统在外层水饱和比为1∶2时对氨氮的去除效能最好。总的来看,系统外层水饱和比为1∶2时,系统对COD和NH4+-N可以达到相对较好的净化效果。
2)多氧态湿地系统的DO及ORP分布特征。DO是影响污水有机物去除效率的重要因素,ORP则可综合DO、有机物质及微生物活性等指标来反映系统中的氧化还原状态[18]。当外层水饱和比为1∶2时,湿地系统DO及ORP 分布特征如图4(a)所示。系统内层饱和区的DO普遍较低(0.2~0.7 mg·L−1),基本处于厌氧状态,ORP呈由内层底部(20 cm)的−143.04 mV向顶部(70 cm) 提升至−124.1 mV,呈逐渐升高的趋势。系统外层分为水饱和区和非饱和区,但二者的DO和ORP均显著高于内层。其中,外层的DO由底部向顶部同样呈现由低向高的逐渐变化,且表现出好氧、缺氧和厌氧区的区分,其中c点处DO值为0.7~1.7 mg·L−1,处于缺氧状态;d点DO值在2.1~2.5 mg·L−1,处于好氧状态。同时,外层中的ORP随着深度的增加呈下降趋势,−49.10 mV(d点)降到−68.80 mV(c点)。以上结果表明,本研究采用的双层垂直流人工湿地设计,可通过控制系统外层水饱和比的高低,调节系统的饱和区和非饱和区的占比,促使系统尤其是系统外层的DO和ORP分布呈持续的动态变化状态,实现系统多氧态状态的构建。
垂直流人工湿地中有机物的去除主要是通过微生物的氧化,对NH4+-N的净化主要是通过微生物的硝化作用。由图3可见,当外层的水饱和比为0时,有机物的去除效率最高;系统外层水饱和比≤1:2时,NH4+-N的去除效率即可达到98%以上。由图4(b)可以看出,i70 cm处的NH4+-N质量浓度高于进水。这可能是因为系统内层发生的厌氧发酵使得污水中的有机氮在微生物作用下转化生成NH4+-N,同时部分有机物也被降解去除,使COD的去除率接近70%,之后随着外层非饱和区利用大气的复氧作用使得水中DO含量上升,为有机物的进一步氧化分解及NH4+-N的硝化去除创造了条件,表现为出水中NO3−-N质量浓度上升,而COD和NH4+-N质量浓度持续下降。
3)多氧态湿地系统中氨氮的转化。传统垂直流人工湿地中,部分饱和的垂直流人工湿地的反硝化效果明显高于不饱和垂直流人工湿地[19]。因此,在外层水饱和比分别为0和1:2的条件下,对比系统进、出水的NH4+-N和NO3−-N的浓度得到如图5所示结果。可以看出,系统外层水饱和比为0时,进水中的NH4+-N几乎全部转化成NO3−-N,且出水中NH4+-N和NO3−-N的含量与进水中的基本相当,说明此条件下,进水中NH4+-N质量浓度的降低主要是依靠硝化作用,但产生的NO3−-N 在系统中没有进一步的转化。这可能由于此条件下系统由外层底部直接出水,非饱和区占比大,所以NH4+-N的硝化作用彻底,绝大部分均转化成了NO3−-N 。但由于决定NO3−-N 去除的反硝化阶段缺失,因此系统总的脱氮效率较低。而当系统外层的水饱和比为1∶2时,外层形成了一定的饱和区,使其底部呈现缺氧状态,而顶部仍然是好氧状态,整个系统形成厌氧-好氧-缺氧的多氧态,进水中的NH4+-N可以通过硝化作用去除,其生成的NO3−-N 也能够在外层下部饱和区的缺氧环境中发生反硝化作用生成N2去除,所以该条件下出水的NO3−-N 含量更低,同时NH4+-N+NO3−-N的含量也显著下降,仅为系统外层水饱和比为0时的57%,可大大提高系统总的脱氮效率。因此,与传统非饱和垂直流湿地相比,多氧态湿地系统的不仅保留了其原本的硝化能力,还提升了一定的反硝化能力[19–20]。
2.3 多氧态湿地系统对污染物的净化效率
控制湿地系统外层水饱和比为1:2,进水C/N为7:1(COD为350.23~381.46 mg·L−1、NH4+-N为50.23~60.57 mg·L−1),测定系统对COD和NH4+-N的较高有机负荷污水的净化效率。如图6所示,多氧态湿地系统对污水中COD的去除率可达91.92%,而NH4+-N去除率也可达到90.53%。说明本系统具有良好的有机物降解能力,能够去除较高负荷的有机污染物,同时对于高氨氮污水也有较高的处理能力。
2.4 氮循环功能基因在多氧态湿地系统的分布特征
以特定功能基因或特定的16S-RNA片段作为分子标记,采用定量 PCR(Real-time PCR)来测定特定基因片段的相对数量,可以对样品中特定功能微生物数量进行定量分析[21]。本研究选择的分子标记:氨单加氧酶amoA、亚硝酸盐氧化酶nxrA和nxrB、硝酸还原酶narG、亚硝酸还原酶nirS和nirK 是参与自然界氮循环过程的关键催化酶,其分别在氨的好氧氧化、亚硝酸盐氧化、亚硝酸盐还原、硝酸盐还原过程中起到重要作用;Anammox菌介导的厌氧氨氧化过程,可直接在缺氧条件下以NH4+为电子供体,亚硝酸盐为电子受体,产生N2。
由图7(a)可知,多氧态湿地系统amoA功能基因主要来源于AOA,且外层中amoA功能基因的数量显著高于内层,说明系统的好氧氨氧化作用主要发生外层,且主要由好氧氨氧化细菌驱动[22–23]。与之类似, 通过图7(b)可看出,催化亚硝酸盐氧化的重要功能基因nxr在外层中的含量比内层高,也说明系统外层中的硝化作用更强[24]。因此,由图7(a)和图7(b)可以表明外层营造的好氧环境为硝化细菌的生存和繁殖提供了适宜的环境。
此外,系统中还同时存在一定量的Anammox菌,其中内层石英砂的丰度为2.91×109 拷贝数·g−1,外层焦炭中的丰度为7.86×108 拷贝数·g−1,与AOA的数量基本持平,但主要分布在系统内层饱和区,这与Anammox菌对氧的需求适应。Anammox菌能够在厌氧/缺氧的条件下,直接以NH4+为电子供体,NO2−为电子受体,产生N2[25]。虽然这一过程的存在,可能使亚硝酸盐氧化细菌(NOB)的因为底物竞争而生长受抑,使nxrA、nxrB基因的数量较低(图7(b)),但Anammox过程的存在,可以使NH4+直接转化为N2而去除,对提高系统总氮的去除效率是非常有利的。
narG编码的硝酸盐还原酶参与催化反硝化过程的第1步,促使硝酸盐向亚硝酸盐的转化,而nirK和nirS则是编码反硝化过程第2步中催化亚硝酸盐还原酶的关键功能基因[26–27]。由图7(c)和(d)可知,narG、nirK和nirS在系统内、外层中均有分布,但在系统内层中的含量均比外层中的少。这可能与外层中的NO3−-N含量远大于内层有关,也表明系统多氧态的形成,可以促使反硝化作用在外层进行,提升系统总的氮去除能力,这也与前期的研究结果(图5)相符合。
总的来看,本湿地系统构建形成的“多氧态”状态,可以在保持传统垂直流人工湿地系统水流特点和优势的同时,为对氧具有不同需求的氮循环功能微生物提供适宜的微生态环境,强化其生物转化作用(包括硝化、反硝化以及Anammox作用),从而提高系统的氮去除效率。
2.5 多氧态湿地系统的微生物结构特征
1)门水平微生物群落结构。对多氧态湿地系统内外层共4个基质样品进行微生物多样性检测分析,并对所有OTU系列进行物种注释,共得到60多种不同的细菌门。如图8所示,微生物数量最多的前3个门依次为Proteobacteria(变形菌门) 、Chloroflexi(绿弯菌门)和Bacteroidetes(拟杆菌门),这3种菌门也被广泛报道存在于水处理反应器中[28-30]。
从门水平看,Proteobacteria在4个样本中均为相对丰度最高的优势种,这与ANSOLA等[31]在人工湿地中的研究结果一致。Proteobacteria属于革兰氏阴性细菌,其物种和遗传多样性极为丰富,是COD去除和脱氮过程的重要贡献者。本研究结果表明,Proteobacteria在系统外层所占的比例(平均55.6%)比内层的(平均25.8%)高(图8),说明湿地系统多氧态的构建可以促使Proteobacteria大量繁殖,从而可能提升系统的污染物去除能力增加。
此外, 4个样本中Chloroflexi和Bacteroidetes的相对丰度仅次于Proteobacteria,但二者在系统内层所占的比例(平均21.9%)比外层的(平均6.6%)大(图8),这与Chloroflexi和Bacteroidetes均属于兼性厌氧微生物,对氧的需求较低有关。已有研究表明这两类细菌都是有机物的主要降解者,能够降解复杂的有机物[32]。因此,Chloroflexi和Bacteroidetes在内层的广泛存在,可充分发挥其对复杂有机物的降解能力,有利于系统对有机污染物的去除。同时,多氧态湿地系统中丰度较大的还有Caldiserica、Actinobacteria、Firmicutes、Acidobacteria等,他们在有机物的矿化和氮的固定等方面发挥着重要作用[33]。
2)属水平微生物群落结构。以属为单位对多氧态湿地系统的微生物群落结构进行分析得到图9。系统内层的优势菌属为Caldisericum、Longilinea、Smithella、Leptolinea、Syntrophorhabdus等厌氧菌,他们均与有机物的代谢有关,其中,Longilinea和Leptolinea对多糖具有良好的降解能力[34],Caldisericum和Syntrophorhabdus是工业废水生物处理系统中常见菌种,有助于有机物的降解,并且Syntrophorhabdus是厌氧生态系统中的丰富细菌主要降解芳香族化合物[35]。他们在样品总丰度中的占比分别为37.74%(内层20)、34.70%(内层40)、1.09%(外层25)、0.14%(外层55),且在内层的相对丰度远大于在外层的。可以推测,系统的有机物降解过程主要在系统内层发生。
系统的外层优势菌属为Rhodanobacter、Nitrospira等。其中,Rhodanobacter属变形菌门γ-变形菌纲的黄色单胞菌科[36]。该菌在好氧的土壤表层发现并分离,具有反硝化能力[37-40],它在多氧态湿地系统的外层中大量出现,可促进反硝化反应的进行。而外层的另一优势菌Nitrospira是亚硝酸盐氧化细菌的主要菌属,主要分布在外层上部的好氧区域,丰度达2.94%。作为硝化过程中的关键菌属,它可将水体中的亚硝酸盐氧化成硝酸盐[41],其在系统外层的优势存在,也很好的解释了为何多氧态湿地系统的外层具有较强的硝化能力。
3)多氧态湿地系统促进氮去除的机理。综上所述,本实验所构建的多氧态垂直流人工湿地,可通过调节外层水饱和比,在保证系统有机物去除效率的同时,提高系统总的脱氮效率,这与其特殊的分层结构有关。首先,多氧态垂直流人工湿地分为内外两层,当外层不饱和比为0时,其内层与传统的多氧态垂直流人工湿地相似,出水中氮主要以NO3−-N为主,NH4+-N 和 NO3−-N的含量与进水相比,降低仅为5%左右。而当外层不饱和比大于0时,系统的外层被由下到上被分成了饱和区和非饱和区,这与内层在完全饱和状态下形成的单一缺氧甚至是厌氧的环境相比,外层由底部向顶部DO和ORP均逐渐上升,形成同时兼备厌氧-缺氧-好氧环境的结构特点, 这使得系统外层中参与反硝化和硝化过程的微生物如Rhodanobacter和Nitrospira等均得到优势生长(图9),系统的外层硝化和反硝化功能也比内层得到强化(图7),从而使系统的氮去除能力得到提升(图5)。
3. 结论
1)通过调节系统外层水饱和比,多氧态湿地系统的内层呈饱和状态,DO比较低,属于缺氧厌氧区;外层上部非饱和区为好氧区,底部饱和区为厌氧/缺氧区,能够形成由厌(缺)氧到好氧的氧化还原分区。
2)多氧态湿地系统对NH4+-N和COD均有较好的去除效果,而当外层水饱和比为1:2,HRT为24 h时,多氧态湿地系统对污染物的净化效果最好。
3)多氧态湿地系统氮循环功能微生物的数量在外层中的分布高于内层,对系统的硝化和反硝化功能均有促进作用,可提升系统总的氮去除效率。
4)多氧态湿地系统内、外层的微生物群落结构组成具有显著差异。在门水平上Proteobacteria、Chloroflexi和Bacteroidetes的相对丰度较大,其中Proteobacteria在系统外层的丰度较大,而Chloroflexi和Bacteroidetes在内层丰度较大。属水平上,系统外层与内层的优势菌属也不同,外层的优势菌属为Rhodanobacter,属于反硝化菌;内层的优势菌属为Caldisericum、Longilinea等厌氧菌,有助于有机物的降解。
-
-
[1] 林卉, 姜忠群, 冒建华, 等. 人工湿地在农村生活污水处理中的应用及研究进展[J]. 中国农业科技导报, 2020, 22(5): 129-136. [2] 周日宇, 张弘弢, 周明罗, 等. 垂直潜流人工湿地对农村污水的净化及微生物群落[J]. 安全与环境学报, 2022, 22(6): 3439-3447. [3] 李慧贤, 熊志鹏, 王倩, 等. 垂直流人工湿地强化地表径流脱氮的研究[J]. 环境科学与技术, 2019, 42(12): 137-143. [4] ZHANG D, GERSBERG R M, KEAT T S. Constructed wetlands in China[J]. Ecological Engineering, 2009, 35(10): 1367-1378. doi: 10.1016/j.ecoleng.2009.07.007 [5] FU G, YU T, NING K, et al. Effects of nitrogen removal microbes and partial nitrification-denitrification in the integrated vertical-flow constructed wetland[J]. Ecological Engineering, 2016, 95: 83-89. doi: 10.1016/j.ecoleng.2016.06.054 [6] ZHOU X, WANG X, ZHANG H, et al. Enhanced nitrogen removal of low C/N domestic wastewater using a biochar-amended aerated vertical flow constructed wetland[J]. Bioresource Technology, 2017, 241: 269-275. doi: 10.1016/j.biortech.2017.05.072 [7] 刘曦, 陈芳清, 杨丹, 等. 垂直流人工湿地系统中氮去除影响因素的研究[J]. 安徽农业科学, 2015, 43(15): 226-228. [8] 祝志超, 缪恒锋, 崔健, 等. 组合人工湿地系统对污水处理厂二级出水的深度处理效果[J]. 环境科学研究, 2018, 31(12): 2028-2036. [9] 王翔, 朱召军, 敏敏, 等. 组合人工湿地用于城市污水处理厂尾水深度处理[J]. 中国给水排水, 2020, 36(6): 97-101. [10] 谢林花, 吴德礼, 张亚雷. 中国农村生活污水处理技术现状分析及评价[J]. 生态与农村环境学报, 2018, 34(10): 865-870. [11] SCHALK T, EFFENBERGER J, JEHMLICH A, et al. Methane oxidation in vertical flow constructed wetlands and its effect on denitrification and COD removal[J]. Ecological Engineering, 2019, 128: 77-88. doi: 10.1016/j.ecoleng.2018.12.029 [12] VON FELDE K, KUNST S. N- and COD-removal in vertical-flow systems[J]. Water Science and Technology, 1997, 35(5): 79-85. doi: 10.2166/wst.1997.0169 [13] VYMAZAL J. Removal of nutrients in various types of constructed wetlands[J]. Science of the Total Environment, 2007, 380(1): 48-65. [14] 张巍, 赵军, 郎咸明, 等. 人工湿地系统微生物去除污染物的研究进展[J]. 环境工程学报, 2010, 4(4): 721-728. [15] 丁怡, 宋新山, 严登华. 影响潜流人工湿地脱氮主要因素及其解决途径[J]. 环境科学与技术, 2011, 34(S2): 103-106. [16] 张强, 唐娜. 潜流人工湿地系统中氮去除影响因素研究[J]. 安徽农业科学, 2008(26): 11517-11519. [17] YANG P, HOU R, LI D, et al. Nitrogen removal from rural domestic wastewater by subsurface wastewater infiltration system: A review[J]. Process Safety and Environmental Protection, 2022, 159: 309-322. doi: 10.1016/j.psep.2022.01.012 [18] TANWAR P, NANDY T, UKEY P, et al. Correlating on-line monitoring parameters, pH, DO and ORP with nutrient removal in an intermittent cyclic process bioreactor system[J]. Bioresource Technology, 2008, 99(16): 7630-7635. doi: 10.1016/j.biortech.2008.02.004 [19] SGROI M, PELISSARI C, ROCCARO P, et al. Removal of organic carbon, nitrogen, emerging contaminants and fluorescing organic matter in different constructed wetland configurations[J]. Chemical Engineering Journal, 2018, 332: 619-627. doi: 10.1016/j.cej.2017.09.122 [20] ZHANG L, LYU T, ZHANG Y, et al. Impacts of design configuration and plants on the functionality of the microbial community of mesocosm-scale constructed wetlands treating ibuprofen[J]. Water Research, 2018, 131: 228-238. doi: 10.1016/j.watres.2017.12.050 [21] GRÜNTZIG V, NOLD S C, ZHOU J, et al. Pseudomonas stutzeri nitrite reductase gene abundance in environmental samples measured by real-time PCR[J]. Applied and Environmental Microbiology, 2001. [22] LIU H, YANG C, PU W, et al. Removal of nitrogen from wastewater for reusing to boiler feed-water by an anaerobic/aerobic/membrane bioreactor[J]. Chemical Engineering Journal, 2008, 140(1-3): 122-129. doi: 10.1016/j.cej.2007.09.048 [23] DIONISI H M, LAYTON A C, HARMS G, et al. Quantification of nitrosomonas oligotropha -like ammonia-oxidizing bacteria and nitrospira spp. from full-scale wastewater treatment plants by competitive PCR[J]. Applied and Environmental Microbiology, 2002, 68(1): 245-253. doi: 10.1128/AEM.68.1.245-253.2002 [24] 张星, 林炜铁, 朱雅楠. 硝化细菌中亚硝酸盐氧化还原酶的研究进展[J]. 微生物学通报, 2008(11): 1806-1810. [25] MULDER A, VAN DE GRAAF A A, ROBERTSON L A, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor[J]. FEMS Microbiology Ecology, 1995, 16(3): 177-183. doi: 10.1111/j.1574-6941.1995.tb00281.x [26] HASSAN J, QU Z, BERGAUST L L, et al. Transient accumulation of NO2− and N2O during denitrification explained by assuming cell diversification by stochastic transcription of denitrification genes[J]. PLOS Computational Biology, 2016, 12(1): e1004621. doi: 10.1371/journal.pcbi.1004621 [27] YUAN Y, YANG B, WANG H, et al. The simultaneous antibiotics and nitrogen removal in vertical flow constructed wetlands: Effects of substrates and responses of microbial functions[J]. Bioresource Technology, 2020, 310: 123419. doi: 10.1016/j.biortech.2020.123419 [28] LIU S, LI H, KANG J, et al. Improving simultaneous N, P, and C removal and microbial population dynamics in an anaerobic–aerobic–anoxic SBR (A-O-A-SBR) treating municipal wastewater by altering organic loading rate (OLR)[J]. Environmental Technology & Innovation, 2021, 24: 102081. [29] ZHANG M, HUANG J C, SUN S, et al. Dissimilatory nitrate reduction processes and corresponding nitrogen loss in tidal flow constructed wetlands[J]. Journal of Cleaner Production, 2021, 295: 126429. doi: 10.1016/j.jclepro.2021.126429 [30] TANG G, ZHENG X, LI X, et al. Variation of effluent organic matter (EfOM) during anaerobic/anoxic/oxic (A2O) wastewater treatment processes[J]. Water Research, 2020, 178: 115830. doi: 10.1016/j.watres.2020.115830 [31] ANSOLA G, ARROYO P, SÁENZ DE MIERA L E. Characterisation of the soil bacterial community structure and composition of natural and constructed wetlands[J]. Science of The Total Environment, 2014, 473-474: 63-71. doi: 10.1016/j.scitotenv.2013.11.125 [32] 姚美辰, 段亮, 张恒亮, 等. 辽河保护区人工湿地微生物群落结构及分布规律[J]. 环境工程技术学报, 2019, 9(3): 233-238. [33] DAS S, LYLA P S, KHAN S A. Marine microbial diversity and ecology: importance and future perspectives[J]. Current Science, 2006, 90(10): 1325-1335. [34] MCILROY S J, KIRKEGAARD R H, DUEHOLM M S, et al. Culture-independent analyses reveal novel anaerolineaceae as abundant primary fermenters in anaerobic digesters treating waste activated sludge[J]. Frontiers in Microbiology, 2017, 8[2023-09-22]. [35] QIU Y L, SATOSHI H, AKIYOSHI O, et al. Syntrophorhabdus aromaticivorans gen. nov. , sp. nov. , the first cultured anaerobe capable of degrading phenol to acetate in obligate syntrophic associations with a hydrogenotrophic methanogen[J]. Applied and Environmental Microbiology, 2008, 74(7): 2051-2058. [36] KOSTKA J E, GREEN S J, RISHISHWAR L, et al. Genome sequences for six rhodanobacter strains, isolated from soils and the terrestrial subsurface, with variable denitrification capabilities[J]. Journal of Bacteriology, 2012, 194(16): 4461-4462. doi: 10.1128/JB.00871-12 [37] AN D S, LEE H G, LEE S T, et al. Rhodanobacter ginsenosidimutans sp nov. , isolated from soil of a ginseng field in South Korea[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59: 691-694. [38] THI P N B, KIM Y J, KIM H, et al. Rhodanobacter soli sp nov. , isolated from soil of a ginseng field[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60: 2935-2939. [39] MADHAIYAN M, POONGUZHALI S, SARAVANAN V S, et al. Rhodanobacter glycinis sp. nov., a yellow-pigmented gammaproteobacterium isolated from the rhizoplane of field-grown soybean[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(Pt_6): 2023-2028. [40] PRAKASH O, GREEN S J, JASROTIA P, et al. Rhodanobacter denitrificans sp. nov., isolated from nitrate-rich zones of a contaminated aquifer[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(Pt_10): 2457-2462. [41] 李霜, 沈珈琦, 范伟平. 应用PCR技术快速筛选和鉴定Nitrosomonas属细菌[J]. 土壤学报, 2005(6): 1050-1052. -






 下载:
下载: