-
南水北调中线工程作为世界上最大的调水措施,旨在缓解华北地区的水资源短缺问题。中线干渠水源来自多条河流,含有大量的营养物质如氮、磷等,且水流速度较慢,容易形成静水区域,使得藻类容易生长繁殖。水流通过干渠断面的过程中由于流速减慢,水中携带的泥沙、沉积物等物质会逐渐沉淀,形成堆积在干渠底部的底泥[1]。藻类的释放是丹江口水库溶解性有机物(dissolved organic matter, DOM)的重要来源,直接关系到南水北调水源地的水质安全[2]。而作为污染物、养分和有机物的汇,底泥中的DOM可以提供比其上覆水更多的物质循环信息[3]。总干渠水质应达到《地表水环境质量标准》(GB3838-2002)的Ⅰ-Ⅱ类水标准。近年来主河道输水至北京和天津时DOM浓度有上升趋势,导致水质的重要有机污染指标化学需氧量(chemical oxygen demand, COD)上升,对京津两地的饮用水供应安全构成威胁[4]。
地表水中的DOM是由多糖、蛋白质和木质素等各种活性物质组成的复杂和非均相混合物[5]。在输送溶解性有机碳(dissolved organic carbon, DOC)的过程中,DOM会受到阳光照射而发生转化和降解,是从地表水中除去DOC的重要途径之一[6]。MORAN等[7-8]研究了地表水DOM在紫外辐射下的光漂白和光矿化作用,包括紫外吸光度和荧光强度的损失及DOC浓度的降低。但关于比较分析不同来源DOM光反应行为的研究较少。考虑到水环境中DOM来源的复杂性及其生态重要性,需要更全面地了解控制其转化的行为。
北京段清河位于中线的末端,来水已经流经了中线所有的区域,可以提供水质累积影响的有价值的信息。本文以南水北调终点清河段的水、底泥中DOM及微囊藻衍生的I-DOM和E-DOM为研究对象,利用三维荧光光谱和紫外可见吸收光谱技术比较了不同来源DOM光学性质和光降解行为的差异性,对控制输水过程DOM的积累具有重要价值。
-
地表水和底泥采集自南水北调北京段清河(40°0′43.73″N, 116°16′27.55″E),样品分别简写为W-DOM和S-DOM。采集的底泥与Milli-Q水充分混合后在4 000 r·min−1转速下离心10 min,上清液为底泥DOM [9]。对干渠中相对丰度最高的常见藻类——微囊藻(Microcystis sp.)进行纯藻种培养,培养箱温度设置为(25±1) ℃,光照和黑暗循环时长均为12 h,光照强度2 000 lux,模拟藻类的生长环境[10]。培养结束后分别采用离心和冻融法提取胞内和胞外DOM [11],样品分别简写为I-DOM和E-DOM。
-
实验前所有DOM样品用0.22 μm的纤维素酯膜过滤。光降解实验在装有1 000W氙灯的太阳光模拟器(Sol 2A ABA,美国Newport公司)中进行,采用持续光照模式。氙灯光谱如图1所示,其在紫外波段的辐照度与实际太阳光的辐照度相近。采用恒温装置将反应器中的温度保持在约25 ℃。在光照第0、1、2、3、5、7 d取平行样品分析。
-
用Lambda 850型分光光度计(Perkinelmer,美国)检测波长范围在200~600 nm的紫外-可见吸收光谱,测得的吸光度(A)用式(1)转换为波长λ处的吸收系数(aλ)[12]。
式中:aλ为波长λ处的吸收系数,m−1;r为比色皿厚度,m。
由于原始光谱在光照过程中信号变化较微弱,所以参考DRYER等[13]对光谱的处理方法:分别将测得的原始光谱与光照前的原始光谱做差,即为吸收损失光谱。用320 nm处的吸收系数(a320)近似表示CDOM浓度[14]。特征紫外吸光度(SUVA254)通过254 nm处的吸收系数除以DOC浓度计算,代表样品的芳香性碳含量[15]。通过非线性拟合得到275~295 nm和350~400 nm的光谱斜率S275~295和S350~400,计算出斜率比(SR),其与DOM的分子质量成反比[16]。
使用F-4500型荧光光谱仪(Hitachi,日本)测量荧光激发-发射矩阵(EEM)光谱,并以5 nm的增量在200~450 nm改变激发波长(Ex),随后以5 nm的增量在270~600 nm扫描发射波长(Em)。荧光光谱分为5个峰:类腐殖质峰A(Ex/Em=260 nm/400~460 nm)、峰M(Ex/Em=290~310 nm/370~410 nm)和峰C(Ex/Em=320~360 nm/420~460 nm)、类蛋白质峰B(Ex/Em=225nm/340nm)和峰T(Ex/Em=275 nm/340 nm),并利用荧光区域积分法计算各个荧光峰强度。采用性质相似的类腐殖质荧光组分之和Ch(即A+M+C)和类蛋白质荧光组分之和Cp(即B+T)代替单一组分分析降解规律。荧光指数(fluorescence index, FI)可以表示DOM的来源,FI<1.4时;DOM主要为陆生植物及土壤有机质等外源物质输入,FI>1.9时,DOM主要为微生物活动等内源过程产生[17]。腐殖化指数(humification index, HIX)可以衡量DOM的腐殖化程度,HIX越大,说明分子组成越复杂,腐殖质的含量越高。自生源指数(biological index, BIX)主要反映DOM的生物可利用性,BIX越高,说明DOM的降解程度越高,内源碳产物越容易生成[18]。
-
DOM样品的三维荧光光谱、荧光组分含量和荧光参数分别如图2和表1所示。不同来源DOM样品在荧光峰的分布和强度上表现出明显的异质性。W-DOM中峰A、峰M和峰C的强度较高,其主要荧光组分是类腐殖质。S-DOM中峰B和峰T的强度较高,其主要荧光组分是类蛋白质和类色氨酸[19]。微囊藻衍生的DOM中5种峰的强度都较高,其中I-DOM中强度最高的是峰T,E-DOM中强度最高的是峰A。
所有样品的FI均大于2.0,说明清河DOM基本为内源过程产生。W-DOM和E-DOM的腐殖化程度较高,而S-DOM和I-DOM的腐殖化程度较低。除S-DOM的生物可利用性较高外,其余样品都较低。本研究中I-DOM的BIX值与KIM等[20]对Miho河中藻类DOM的研究结果(BIX=0.67)接近,其认为荧光参数会受生物地球化学过程影响而发生变化,从而导致高估或低估DOM源的相对贡献率。因此,荧光光谱参数只提供定性分析,FI和BIX之间没有必然的联系和相关性。W-DOM和E-DOM的荧光特征具有一定的相似性;S-DOM和I-DOM的荧光特征具有一定的相似性,这可能与不同的生物地球化学过程有关。藻类代谢产生的E-DOM不断释放到水体中,是河道DOM的主要来源之一。藻类死亡后会在河流底部沉降积累,成为沉积物的一部分。因此,藻细胞破裂后释放的I-DOM是S-DOM的重要组成部分。
-
样品的吸收损失光谱如图3所示。可以看出所有样品在UV-B波段(280~320 nm)的吸光度损失率大于UV-A波段(320~400 nm),说明CDOM的光漂白效率与光子的能量密切相关[21]。CDOM在可见光波段的吸光度损失很小,说明光照主要影响其在紫外区的吸光度损失。值得注意的是,在光照中期的某些时间点I-DOM的吸光度反而略微增加,这个现象被认为与DOM中含有更高分子质量、更高度芳香结构物质的生成有关。CHEN等[22]发现了低分子质量芳烃,如来自单宁分解的多酚或通过从生物质中浸出的低分子质量DOM的光腐殖化反应可以增强吸光度信号。
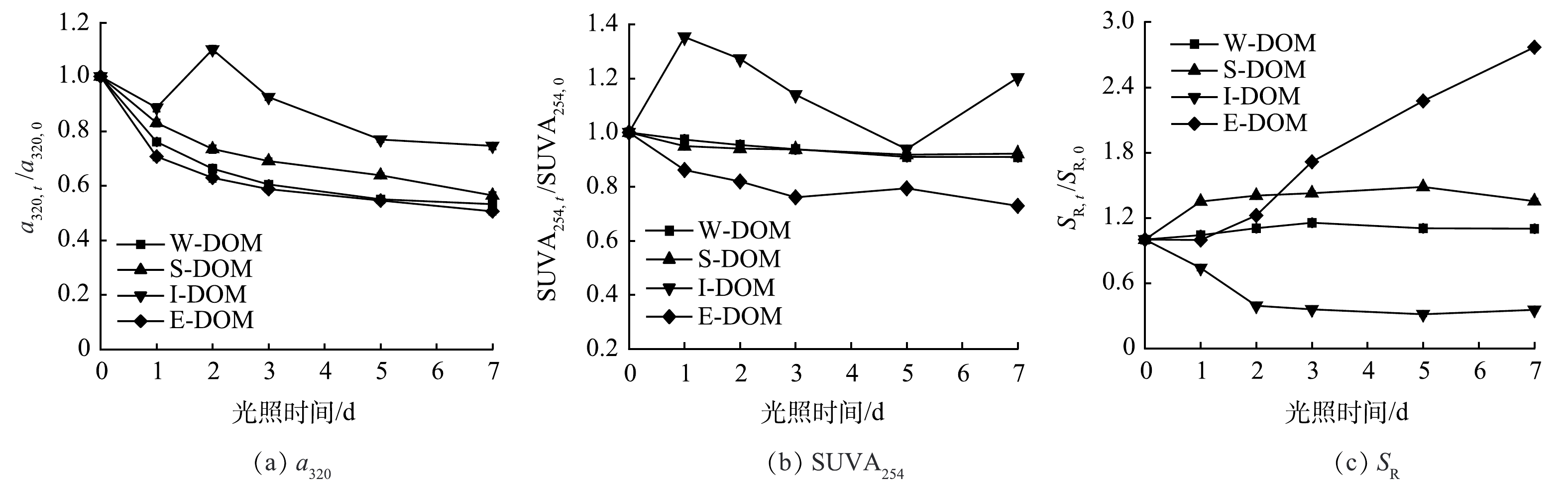
将a320、SUVA254和SR分别以第0 天为基准归一化处理后得到3种指标随光照时间的变化如图4所示。光照后所有样品的a320均显著降低,其中I-DOM降低幅度最小,约为25%,其他样品的降解比例大体相同,约为40%~50%。这表明CDOM具有很强的吸光能力,当受到光照时其吸收能力会发生变化,通过自由基反应导致化学结构和分子大小发生变化,从而降低其吸收光谱的强度。光照显著降低了E-DOM中芳香性碳含量,这是因为光照激发了水中的氧,产生一系列活性物质,如羟基自由基(·OH)和超氧自由基(O2·-),可以与芳香碳发生氧化反应,使其分解成更小的分子[23]。光照对S-DOM和W-DOM中芳香性碳含量的影响很小,而I-DOM中芳香性碳的含量波动较大,这也表明可能发生了光腐殖化作用。除I-DOM外,其他样品的SR均有增加趋势,表明光照能够将大分子DOM分解为小分子DOM。I-DOM的SR下降的确切原因尚不清楚,但先前的报道称浮游生物衍生的DOM的存在会干扰S275~295的值,因为蛋白质的典型的宽吸收带集中在280 nm[24]。
进一步分析表明,除I-DOM外,其余3个样品CDOM降解率随光照时间的增加而指数减少,最终逐渐稳定。为了定量评估光降解过程,选择指数模型进行拟合,拟合公式如式(2)所示[25]。
式中:x为光照时间,d;Y为以第0 天为基准归一化的a320;R0为耐光性组分所占百分比,%;Rp为光不稳定组分所占百分比,%;K为光降解速率常数,d−1。
拟合结果如表2所示。可以看出3个DOM样品拟合的相关系数都是0.99,拟合结果较好。结果表明E-DOM中的CDOM光降解速率最高,其次是W-DOM,S-DOM最低。
-
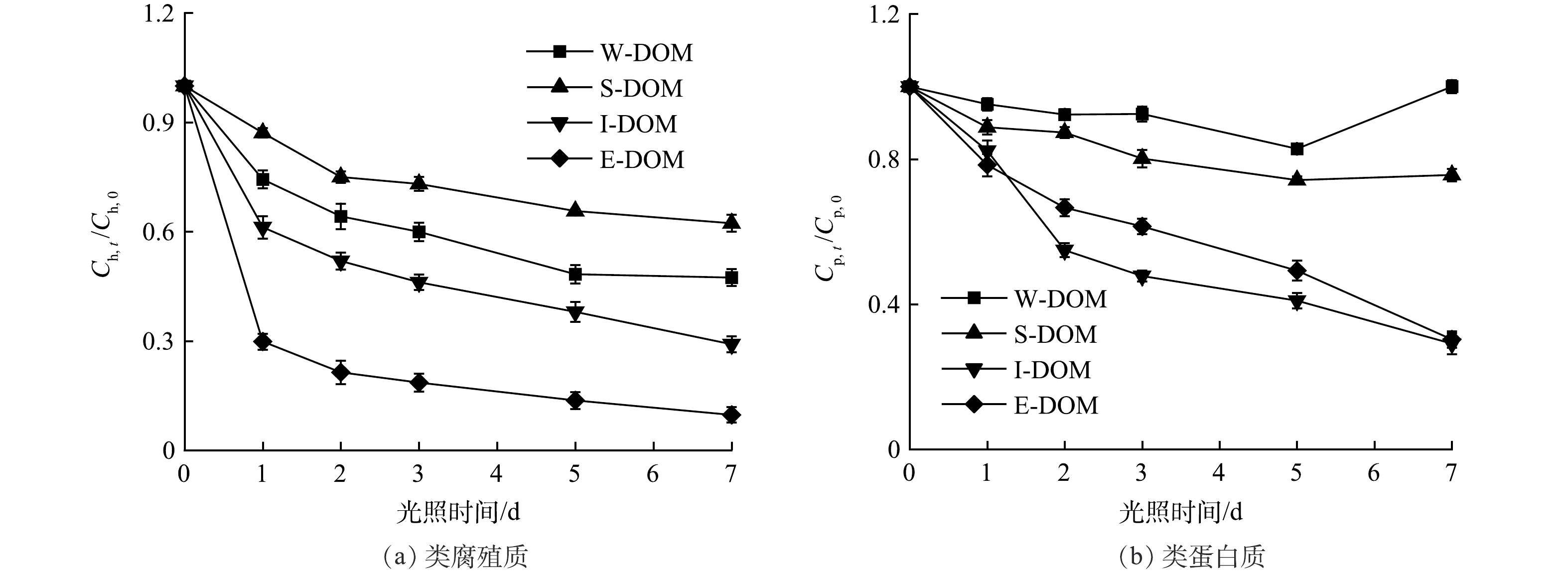
类腐殖质荧光组分Ch和类蛋白质荧光组分Cp分别以第0 d为基准归一化处理后得到其随光照时间的变化如图5所示。从图5(a)中可以看出光照过程中所有样品的类腐殖质的含量均有降低趋势,但降解比例各不相同。E-DOM的降解比例最大,超过90%;其次是I-DOM和W-DOM,分别约70%和50%;S-DOM的降解比例最低,不到40%。由图5(b)中可以看出,W-DOM的类蛋白质的含量在光照过程中小幅波动,光照后没有明显的降低;S-DOM降解了约25%;藻衍生的DOM降解比例最高,约70%。综合以上结果,类腐殖质的光降解比例普遍大于类蛋白质,表明其光活性更强。
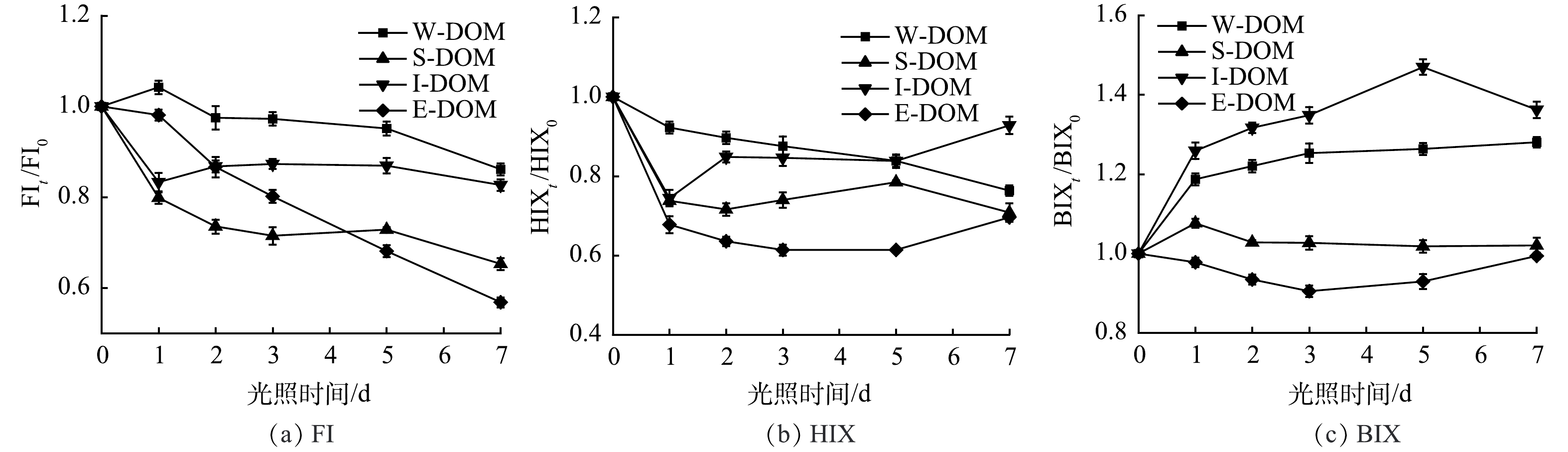
归一化的荧光光谱参数FI、HIX和BIX随光照时间的变化如图6所示。所有样品的FI和HIX均有下降趋势,表明荧光组分的降解程度不断增加,结构复杂的腐殖质类物质容易受到破坏,可被光降解为结构简单的物质。I-DOM与W-DOM样品的BIX明显升高,其余样品变化不明显。结果表明光照可以在一定程度上将难以被微生物利用的DOM转化为更具生物利用性的低分子量光产物,这取决于DOM的来源。BERTILSSON等[26]已经发现腐殖质湖中羧酸在光照中大量生成,并利用同位素示踪证明了羧酸是浮游生物利用的主要底物。
-
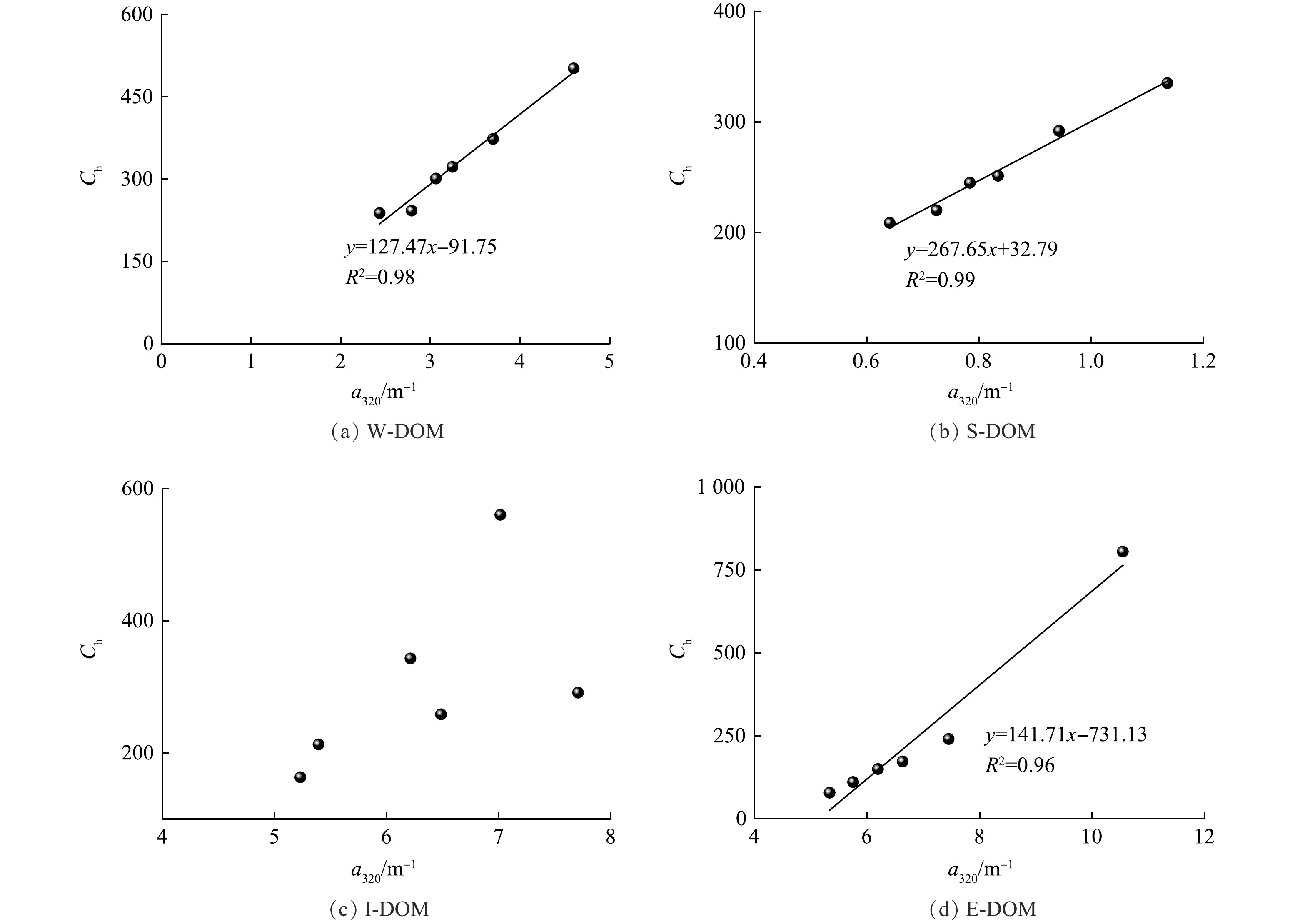
对DOM样品在7 d光漂白过程中类腐殖质含量与a320进行相关性分析,结果如图7所示。结果表明,在W-DOM、S-DOM和E-DOM中类腐殖质含量与a320变化趋势呈显著正相关,说明这些样品中CDOM的光降解速率与类腐殖质的光降解速率在相同时间下基本保持一致。
对DOM样品在7 d光漂白过程中类蛋白质含量与a320进行相关性分析,结果如图8所示。结果表明,在S-DOM和E-DOM中类蛋白质含量与a320变化趋势呈显著正相关,说明这些样品中CDOM的光降解速率与类蛋白质的光降解速率在相同时间下基本保持一致。在I-DOM中类腐殖质、类蛋白质含量与a320变化趋势均无显著相关,说明I-DOM中CDOM与类腐殖质、类蛋白质的光降解速率在相同时间下均不一致。
-
1)清河水和底泥中DOM在荧光特征上分别与微囊藻衍生的胞外和胞内DOM具有较高相似性,说明清河中的DOM主要形成于内源的微生物过程。
2)DOM的光漂白主要发生在紫外区,且UV-B波段的光漂白效率大于UV-A波段。清河水、底泥和微囊藻胞外DOM中CDOM的降解率为40%~50%,光照可以将其中复杂的大分子物质分解成结构简单的小分子物质;I-DOM中CDOM降解率相对较低,约为25%。
3)CDOM中类腐殖质的光降解率比类蛋白质更高,清河水、底泥和微囊藻胞外DOM中CDOM与类腐殖质的光降解速率在相同时间下基本保持一致;清河底泥和微囊藻胞外DOM中CDOM与类蛋白质的光降解速率在相同时间下基本保持一致。
南水北调中线清河溶解性有机物的光降解行为
Photodegradation behavior of dissolved organic matter in Qinghe river of middle route of South-to-North Water Diversion Project
-
摘要: 溶解性有机物(dissolved organic matter, DOM)在水环境中普遍存在,其光降解行为与种类和来源密切相关。近年来,南水北调中线工程沿线中DOM含量过高问题逐渐引起了人们对饮用水水源水质的关注。利用三维荧光光谱与紫外可见吸收光谱表征了清河段DOM在水(Water DOM, W-DOM)、底泥(sediment-derived DOM, S-DOM)、藻胞内(intracellular DOM, I-DOM)和胞外(extracellular DOM, E-DOM)这4种典型来源中的光学性质和光降解行为。结果表明,W-DOM的主要来源是藻类代谢产生的E-DOM;S-DOM的主要形成原因是藻细胞破裂释放I-DOM。DOM的光漂白主要发生在紫外区,且UV-B波段的光漂白效率大于UV-A波段。W-DOM、S-DOM和E-DOM中有色DOM(chromophoric DOM, CDOM)的降解率基本相同,为40%~50%;I-DOM中CDOM降解率相对较低,约为25%。光照可以将W-DOM、S-DOM和E-DOM中复杂的大分子物质分解成结构简单的小分子物质。CDOM中类腐殖质的光降解率比类蛋白质更高,W-DOM、S-DOM和E-DOM中CDOM与类腐殖质的光降解速率在相同时间下基本保持一致;S-DOM和E-DOM中CDOM与类蛋白质的光降解速率在相同时间下基本保持一致。以上结果反映了太阳辐射对水环境中DOM的转化和去除机理,为河流水质保护提供了理论依据。
-
关键词:
- 溶解性有机物(DOM) /
- 光漂白 /
- 紫外可见吸收光谱 /
- 三维荧光光谱
Abstract: Dissolved organic matter (DOM) is ubiquitous in water environment, and its photodegradation behavior is closely related to species and sources. In recent years, the problem of high content of DOM along the Middle Route Project of South-to-North Water Diversion has gradually aroused people's attention to the quality of drinking water sources. In this study, three-dimensional fluorescence spectroscopy and UV-visible absorption spectroscopy were used to characterize the optical properties and photodegradation behavior of DOM from four typical origins, i.e., water (W-DOM), sediment-derived (S-DOM) and algae-derived intracellular (I-DOM) and extracellular DOM (E-DOM) in Qinghe river section. The results showed that the main origin of W-DOM was E-DOM produced by the metabolism of algae. The main reason for the formation of S-DOM was the release of I-DOM by algal cell rupture. The photobleaching of DOM mainly occurred in the ultraviolet region, and the photobleaching efficiency of UV-B band was higher than that of UV-A band. The degradation rates of chromophoric DOM (CDOM) in W-DOM, S-DOM and E-DOM were basically same, ranging from 40% to 50%. The degradation rate of CDOM in I-DOM was relatively low and about 25%. Irradiation could decompose complex macromolecules in W-DOM, S-DOM and E-DOM into small molecules with simple structure. The photodegradation ratio of humic-like substances in CDOM was higher than that of protein-like substances. The photodegradation rates of CDOM and humic-like substances in W-DOM, S-DOM and E-DOM were basically consistent at the same time; the photodegradation rates of CDOM and protein-like substances in S-DOM and E-DOM were basically consistent at the same time. The experimental results show the transformation and removal mechanism of DOM in water environment by solar radiation, which provides a theoretical basis for the protection of river water quality. -
南水北调中线工程作为世界上最大的调水措施,旨在缓解华北地区的水资源短缺问题。中线干渠水源来自多条河流,含有大量的营养物质如氮、磷等,且水流速度较慢,容易形成静水区域,使得藻类容易生长繁殖。水流通过干渠断面的过程中由于流速减慢,水中携带的泥沙、沉积物等物质会逐渐沉淀,形成堆积在干渠底部的底泥[1]。藻类的释放是丹江口水库溶解性有机物(dissolved organic matter, DOM)的重要来源,直接关系到南水北调水源地的水质安全[2]。而作为污染物、养分和有机物的汇,底泥中的DOM可以提供比其上覆水更多的物质循环信息[3]。总干渠水质应达到《地表水环境质量标准》(GB3838-2002)的Ⅰ-Ⅱ类水标准。近年来主河道输水至北京和天津时DOM浓度有上升趋势,导致水质的重要有机污染指标化学需氧量(chemical oxygen demand, COD)上升,对京津两地的饮用水供应安全构成威胁[4]。
地表水中的DOM是由多糖、蛋白质和木质素等各种活性物质组成的复杂和非均相混合物[5]。在输送溶解性有机碳(dissolved organic carbon, DOC)的过程中,DOM会受到阳光照射而发生转化和降解,是从地表水中除去DOC的重要途径之一[6]。MORAN等[7-8]研究了地表水DOM在紫外辐射下的光漂白和光矿化作用,包括紫外吸光度和荧光强度的损失及DOC浓度的降低。但关于比较分析不同来源DOM光反应行为的研究较少。考虑到水环境中DOM来源的复杂性及其生态重要性,需要更全面地了解控制其转化的行为。
北京段清河位于中线的末端,来水已经流经了中线所有的区域,可以提供水质累积影响的有价值的信息。本文以南水北调终点清河段的水、底泥中DOM及微囊藻衍生的I-DOM和E-DOM为研究对象,利用三维荧光光谱和紫外可见吸收光谱技术比较了不同来源DOM光学性质和光降解行为的差异性,对控制输水过程DOM的积累具有重要价值。
1. 材料与方法
1.1 样品准备与预处理
地表水和底泥采集自南水北调北京段清河(40°0′43.73″N, 116°16′27.55″E),样品分别简写为W-DOM和S-DOM。采集的底泥与Milli-Q水充分混合后在4 000 r·min−1转速下离心10 min,上清液为底泥DOM [9]。对干渠中相对丰度最高的常见藻类——微囊藻(Microcystis sp.)进行纯藻种培养,培养箱温度设置为(25±1) ℃,光照和黑暗循环时长均为12 h,光照强度2 000 lux,模拟藻类的生长环境[10]。培养结束后分别采用离心和冻融法提取胞内和胞外DOM [11],样品分别简写为I-DOM和E-DOM。
1.2 光化学降解实验
实验前所有DOM样品用0.22 μm的纤维素酯膜过滤。光降解实验在装有1 000W氙灯的太阳光模拟器(Sol 2A ABA,美国Newport公司)中进行,采用持续光照模式。氙灯光谱如图1所示,其在紫外波段的辐照度与实际太阳光的辐照度相近。采用恒温装置将反应器中的温度保持在约25 ℃。在光照第0、1、2、3、5、7 d取平行样品分析。
1.3 分析方法
用Lambda 850型分光光度计(Perkinelmer,美国)检测波长范围在200~600 nm的紫外-可见吸收光谱,测得的吸光度(A)用式(1)转换为波长λ处的吸收系数(aλ)[12]。
aλ=2.303Aλ/r (1) 式中:aλ为波长λ处的吸收系数,m−1;r为比色皿厚度,m。
由于原始光谱在光照过程中信号变化较微弱,所以参考DRYER等[13]对光谱的处理方法:分别将测得的原始光谱与光照前的原始光谱做差,即为吸收损失光谱。用320 nm处的吸收系数(a320)近似表示CDOM浓度[14]。特征紫外吸光度(SUVA254)通过254 nm处的吸收系数除以DOC浓度计算,代表样品的芳香性碳含量[15]。通过非线性拟合得到275~295 nm和350~400 nm的光谱斜率S275~295和S350~400,计算出斜率比(SR),其与DOM的分子质量成反比[16]。
使用F-4500型荧光光谱仪(Hitachi,日本)测量荧光激发-发射矩阵(EEM)光谱,并以5 nm的增量在200~450 nm改变激发波长(Ex),随后以5 nm的增量在270~600 nm扫描发射波长(Em)。荧光光谱分为5个峰:类腐殖质峰A(Ex/Em=260 nm/400~460 nm)、峰M(Ex/Em=290~310 nm/370~410 nm)和峰C(Ex/Em=320~360 nm/420~460 nm)、类蛋白质峰B(Ex/Em=225nm/340nm)和峰T(Ex/Em=275 nm/340 nm),并利用荧光区域积分法计算各个荧光峰强度。采用性质相似的类腐殖质荧光组分之和Ch(即A+M+C)和类蛋白质荧光组分之和Cp(即B+T)代替单一组分分析降解规律。荧光指数(fluorescence index, FI)可以表示DOM的来源,FI<1.4时;DOM主要为陆生植物及土壤有机质等外源物质输入,FI>1.9时,DOM主要为微生物活动等内源过程产生[17]。腐殖化指数(humification index, HIX)可以衡量DOM的腐殖化程度,HIX越大,说明分子组成越复杂,腐殖质的含量越高。自生源指数(biological index, BIX)主要反映DOM的生物可利用性,BIX越高,说明DOM的降解程度越高,内源碳产物越容易生成[18]。
2. 结果与讨论
2.1 DOM光学性质差异
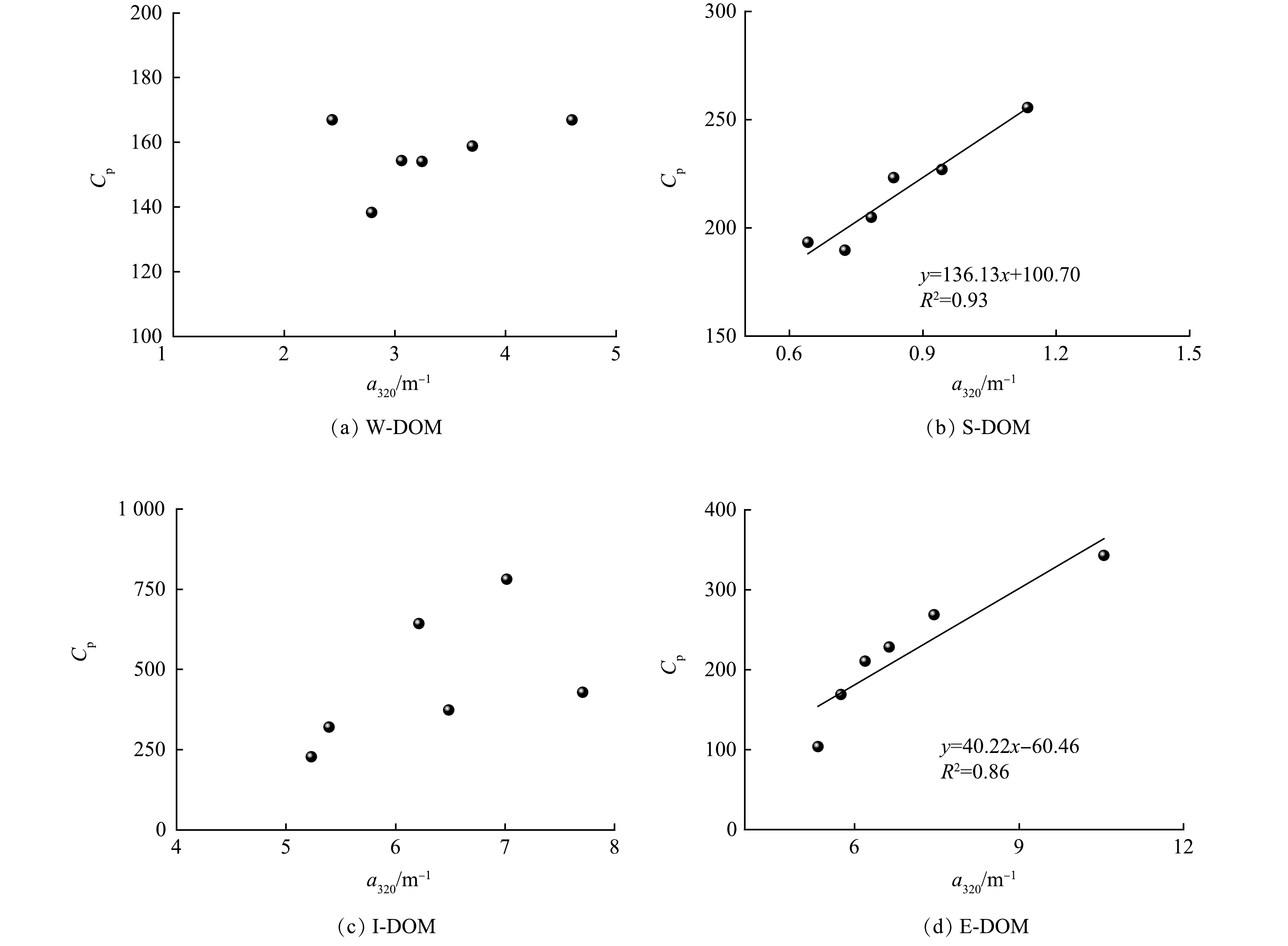
DOM样品的三维荧光光谱、荧光组分含量和荧光参数分别如图2和表1所示。不同来源DOM样品在荧光峰的分布和强度上表现出明显的异质性。W-DOM中峰A、峰M和峰C的强度较高,其主要荧光组分是类腐殖质。S-DOM中峰B和峰T的强度较高,其主要荧光组分是类蛋白质和类色氨酸[19]。微囊藻衍生的DOM中5种峰的强度都较高,其中I-DOM中强度最高的是峰T,E-DOM中强度最高的是峰A。
表 1 DOM样品荧光组分的含量和荧光光谱参数Table 1. Content of fluorescent components and fluorescence spectra parameters of DOM samples样品名称 荧光峰强度 FI HIX BIX B T A M C W-DOM 67.23 99.68 187.04 155.82 158.82 2.18 0.80 1.01 S-DOM 138.53 116.99 53.24 221.10 60.69 2.45 0.48 3.62 I-DOM 239.13 542.06 240.33 193.62 126.29 2.79 0.53 0.70 E-DOM 103.90 239.01 441.23 151.60 212.18 2.16 0.82 1.07 所有样品的FI均大于2.0,说明清河DOM基本为内源过程产生。W-DOM和E-DOM的腐殖化程度较高,而S-DOM和I-DOM的腐殖化程度较低。除S-DOM的生物可利用性较高外,其余样品都较低。本研究中I-DOM的BIX值与KIM等[20]对Miho河中藻类DOM的研究结果(BIX=0.67)接近,其认为荧光参数会受生物地球化学过程影响而发生变化,从而导致高估或低估DOM源的相对贡献率。因此,荧光光谱参数只提供定性分析,FI和BIX之间没有必然的联系和相关性。W-DOM和E-DOM的荧光特征具有一定的相似性;S-DOM和I-DOM的荧光特征具有一定的相似性,这可能与不同的生物地球化学过程有关。藻类代谢产生的E-DOM不断释放到水体中,是河道DOM的主要来源之一。藻类死亡后会在河流底部沉降积累,成为沉积物的一部分。因此,藻细胞破裂后释放的I-DOM是S-DOM的重要组成部分。
2.2 光漂白对DOM紫外可见吸收性质的影响
样品的吸收损失光谱如图3所示。可以看出所有样品在UV-B波段(280~320 nm)的吸光度损失率大于UV-A波段(320~400 nm),说明CDOM的光漂白效率与光子的能量密切相关[21]。CDOM在可见光波段的吸光度损失很小,说明光照主要影响其在紫外区的吸光度损失。值得注意的是,在光照中期的某些时间点I-DOM的吸光度反而略微增加,这个现象被认为与DOM中含有更高分子质量、更高度芳香结构物质的生成有关。CHEN等[22]发现了低分子质量芳烃,如来自单宁分解的多酚或通过从生物质中浸出的低分子质量DOM的光腐殖化反应可以增强吸光度信号。
将a320、SUVA254和SR分别以第0 天为基准归一化处理后得到3种指标随光照时间的变化如图4所示。光照后所有样品的a320均显著降低,其中I-DOM降低幅度最小,约为25%,其他样品的降解比例大体相同,约为40%~50%。这表明CDOM具有很强的吸光能力,当受到光照时其吸收能力会发生变化,通过自由基反应导致化学结构和分子大小发生变化,从而降低其吸收光谱的强度。光照显著降低了E-DOM中芳香性碳含量,这是因为光照激发了水中的氧,产生一系列活性物质,如羟基自由基(·OH)和超氧自由基(O2·-),可以与芳香碳发生氧化反应,使其分解成更小的分子[23]。光照对S-DOM和W-DOM中芳香性碳含量的影响很小,而I-DOM中芳香性碳的含量波动较大,这也表明可能发生了光腐殖化作用。除I-DOM外,其他样品的SR均有增加趋势,表明光照能够将大分子DOM分解为小分子DOM。I-DOM的SR下降的确切原因尚不清楚,但先前的报道称浮游生物衍生的DOM的存在会干扰S275~295的值,因为蛋白质的典型的宽吸收带集中在280 nm[24]。
进一步分析表明,除I-DOM外,其余3个样品CDOM降解率随光照时间的增加而指数减少,最终逐渐稳定。为了定量评估光降解过程,选择指数模型进行拟合,拟合公式如式(2)所示[25]。
Y=R0+RP⋅exp(−Kx) (2) 式中:x为光照时间,d;Y为以第0 天为基准归一化的a320;R0为耐光性组分所占百分比,%;Rp为光不稳定组分所占百分比,%;K为光降解速率常数,d−1。
拟合结果如表2所示。可以看出3个DOM样品拟合的相关系数都是0.99,拟合结果较好。结果表明E-DOM中的CDOM光降解速率最高,其次是W-DOM,S-DOM最低。
表 2 CDOM的光降解动力学拟合结果Table 2. Fitting results of photodegradation kinetics of CDOM样品名称 拟合方程 R2 光降解速率常数/d−1 W-DOM Y=0.46exp(−0.66x)+0.53 0.99 0.66 S-DOM Y=0.43exp(−0.44x)+0.57 0.99 0.44 E-DOM Y=0.46exp(−0.84x)+0.53 0.99 0.84 2.3 光漂白对DOM荧光性质的影响
类腐殖质荧光组分Ch和类蛋白质荧光组分Cp分别以第0 d为基准归一化处理后得到其随光照时间的变化如图5所示。从图5(a)中可以看出光照过程中所有样品的类腐殖质的含量均有降低趋势,但降解比例各不相同。E-DOM的降解比例最大,超过90%;其次是I-DOM和W-DOM,分别约70%和50%;S-DOM的降解比例最低,不到40%。由图5(b)中可以看出,W-DOM的类蛋白质的含量在光照过程中小幅波动,光照后没有明显的降低;S-DOM降解了约25%;藻衍生的DOM降解比例最高,约70%。综合以上结果,类腐殖质的光降解比例普遍大于类蛋白质,表明其光活性更强。
归一化的荧光光谱参数FI、HIX和BIX随光照时间的变化如图6所示。所有样品的FI和HIX均有下降趋势,表明荧光组分的降解程度不断增加,结构复杂的腐殖质类物质容易受到破坏,可被光降解为结构简单的物质。I-DOM与W-DOM样品的BIX明显升高,其余样品变化不明显。结果表明光照可以在一定程度上将难以被微生物利用的DOM转化为更具生物利用性的低分子量光产物,这取决于DOM的来源。BERTILSSON等[26]已经发现腐殖质湖中羧酸在光照中大量生成,并利用同位素示踪证明了羧酸是浮游生物利用的主要底物。
2.4 光漂白过程荧光组分与CDOM含量变化相关性
对DOM样品在7 d光漂白过程中类腐殖质含量与a320进行相关性分析,结果如图7所示。结果表明,在W-DOM、S-DOM和E-DOM中类腐殖质含量与a320变化趋势呈显著正相关,说明这些样品中CDOM的光降解速率与类腐殖质的光降解速率在相同时间下基本保持一致。
对DOM样品在7 d光漂白过程中类蛋白质含量与a320进行相关性分析,结果如图8所示。结果表明,在S-DOM和E-DOM中类蛋白质含量与a320变化趋势呈显著正相关,说明这些样品中CDOM的光降解速率与类蛋白质的光降解速率在相同时间下基本保持一致。在I-DOM中类腐殖质、类蛋白质含量与a320变化趋势均无显著相关,说明I-DOM中CDOM与类腐殖质、类蛋白质的光降解速率在相同时间下均不一致。
3. 结论
1)清河水和底泥中DOM在荧光特征上分别与微囊藻衍生的胞外和胞内DOM具有较高相似性,说明清河中的DOM主要形成于内源的微生物过程。
2)DOM的光漂白主要发生在紫外区,且UV-B波段的光漂白效率大于UV-A波段。清河水、底泥和微囊藻胞外DOM中CDOM的降解率为40%~50%,光照可以将其中复杂的大分子物质分解成结构简单的小分子物质;I-DOM中CDOM降解率相对较低,约为25%。
3)CDOM中类腐殖质的光降解率比类蛋白质更高,清河水、底泥和微囊藻胞外DOM中CDOM与类腐殖质的光降解速率在相同时间下基本保持一致;清河底泥和微囊藻胞外DOM中CDOM与类蛋白质的光降解速率在相同时间下基本保持一致。
-
表 1 DOM样品荧光组分的含量和荧光光谱参数
Table 1. Content of fluorescent components and fluorescence spectra parameters of DOM samples
样品名称 荧光峰强度 FI HIX BIX B T A M C W-DOM 67.23 99.68 187.04 155.82 158.82 2.18 0.80 1.01 S-DOM 138.53 116.99 53.24 221.10 60.69 2.45 0.48 3.62 I-DOM 239.13 542.06 240.33 193.62 126.29 2.79 0.53 0.70 E-DOM 103.90 239.01 441.23 151.60 212.18 2.16 0.82 1.07 表 2 CDOM的光降解动力学拟合结果
Table 2. Fitting results of photodegradation kinetics of CDOM
样品名称 拟合方程 R2 光降解速率常数/d−1 W-DOM Y=0.46exp(−0.66x)+0.53 0.99 0.66 S-DOM Y=0.43exp(−0.44x)+0.57 0.99 0.44 E-DOM Y=0.46exp(−0.84x)+0.53 0.99 0.84 -
[1] WANG C, ZHANG H, LEI P, et al. Evidence on the causes of the rising levels of CODMn along the middle route of the South-to-North Diversion Project in China: The role of algal dissolved organic matter[J]. Journal of Environmental Sciences, 2022, 113: 281-290. doi: 10.1016/j.jes.2021.06.003 [2] YAN X Y, ZHANG Y, LI Y Y, et al. Hydrologic and physicochemical factors co-drive seasonal changes of phytoplankton during dynamic water diversion processes in the Danjiangkou Reservoir[J]. Journal of Lake Sciences, 2021, 33(5): 1350-1363. doi: 10.18307/2021.0505 [3] TAO Y Q, LU J. Occurrence of total phosphorus in surface sediments of Chinese lakes and its driving factors and implications[J]. Journal of Hydrology, 2020, 580: 1-7. [4] 范傲翔, 王智鹏, 王超, 等. 南水北调中线总干渠水体耗氧特征及成因[J]. 环境科学学报, 2020, 40(3): 871-879. doi: 10.13671/j.hjkxxb.2019.0423 [5] AIKEN G R, GILMOUR C C, KRABBENHOFT D P, et al. Dissolved organic matter in the Florida Everglades: Implications for ecosystem restoration[J]. Critical Reviews in Environmental Science and Technology, 2011, 41(S1): 217-248. [6] WARD C P, CORY R M. Assessing the prevalence, products, and pathways of dissolved organic matter partial photo-oxidation in arctic surface waters[J]. Environmental Science-Processes & Impacts, 2020, 22(5): 1214-1223. [7] MORAN M A, SHELDON W M, ZEPP R G. Carbon loss and optical property changes during long-term photochemical and biological degradation of estuarine dissolved organic matter[J]. Limnology and Oceanography, 2000, 45(6): 1254-1264. doi: 10.4319/lo.2000.45.6.1254 [8] MORAN M A, ZEPP R G. Role of photoreactions in the formation of biologically labile compounds from dissolved organic matter[J]. Limnology and Oceanography, 1997, 42(6): 1307-1316. doi: 10.4319/lo.1997.42.6.1307 [9] ZHANG L, SUN Q X, DOU Q H, et al. The molecular characteristics of dissolved organic matter in urbanized river sediments and their environmental impact under the action of microorganisms[J]. Science of the Total Environment, 2022, 827: 1-11. [10] YANG C H, LIU Y Z, ZHU Y X, et al. Insights into the binding interactions of autochthonous dissolved organic matter released from Microcystis aeruginosa with pyrene using spectroscopy[J]. Marine Pollution Bulletin, 2016, 104(1/2): 113-120. [11] LI L, GAO N Y, DENG Y, et al. Characterization of intracellular & extracellular algae organic matters (AOM) of Microcystic aeruginosa and formation of AOM-associated disinfection byproducts and odor & taste compounds[J]. Water Research, 2012, 46(4): 1233-1240. doi: 10.1016/j.watres.2011.12.026 [12] 巩瑶, 宋贵生. 珠江口溶解有机物光化学降解活性[J]. 海洋环境科学, 2021, 40(5): 690-698. doi: 10.12111/j.mes.20200255 [13] DRYER D J, KORSHIN G V, FABBRICINO M. In situ examination of the protonation behavior of fulvic acids using differential absorbance spectroscopy[J]. Environmental Science & Technology, 2008, 42(17): 6644-6649. [14] FICHOT C G, BENNER R. A novel method to estimate DOC concentrations from CDOM absorption coefficients in coastal waters[J]. Geophysical Research Letters, 2011, 38(3): 1-5. [15] WEISHAAR J L, AIKEN G R, BERGAMASCHI B A, et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J]. Environmental Science & Technology, 2003, 37(20): 4702-4708. [16] HELMS J R, STUBBINS A, RITCHIE J D, et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter[J]. Limnology and Oceanography, 2008, 53(3): 955-969. doi: 10.4319/lo.2008.53.3.0955 [17] INAMDAR S, FINGER N, SINGH S, et al. Dissolved organic matter (DOM) concentration and quality in a forested mid-Atlantic watershed, USA[J]. Biogeochemistry, 2012, 108(1/2/3): 55-76. [18] 曹佳锐, 龚可杨, 别宇静, 等. 水土保持林恢复土壤可溶性碳氮组分动态与三维荧光特征分析[J]. 生态学报, 2021, 41(19): 7679-7688. [19] COBLE P G. Marine Optical Biogeochemistry: The Chemistry of Ocean Color[J]. Chemical Reviews, 2007, 107(2): 402-418. doi: 10.1021/cr050350+ [20] KIM M-S, LIM B R, JEON P, et al. Innovative approach to reveal source contribution of dissolved organic matter in a complex river watershed using end-member mixing analysis based on spectroscopic proxies and multi-isotopes[J]. Water Research, 2023, 1-14. [21] GRANELI W, LINDELL M, TRANVIK L. Photo-oxidative production of dissolved inorganic carbon in lakes of different humic content[J]. Limnology and Oceanography, 1996, 41(4): 698-706. doi: 10.4319/lo.1996.41.4.0698 [22] CHEN M L, JAFFE R. Photo- and bio-reactivity patterns of dissolved organic matter from biomass and soil leachates and surface waters in a subtropical wetland[J]. Water Research, 2014, 61: 181-190. doi: 10.1016/j.watres.2014.03.075 [23] CORY R M, KLING G W. Interactions between sunlight and microorganisms influence dissolved organic matter degradation along the aquatic continuum[J]. Limnology and Oceanography Letters, 2018, 3(3): 102-116. doi: 10.1002/lol2.10060 [24] FICHOT C G, BENNER R. The spectral slope coefficient of chromophoric dissolved organic matter (S275-295) as a tracer of terrigenous dissolved organic carbon in river-influenced ocean margins[J]. Limnology and Oceanography, 2012, 57(5): 1453-1466. doi: 10.4319/lo.2012.57.5.1453 [25] SONG G S, Li Y J, Hu S Z, et al. Photobleaching of chromophoric dissolved organic matter (CDOM) in the Yangtze River estuary: kinetics and effects of temperature, pH, and salinity[J]. Environmental Science: Processes & Impacts, 2017, 19(6): 861-873. [26] BERTILSSON S, TRANVIK L J. Photochemically produced carboxylic acids as substrates for freshwater bacterioplankton[J]. Limnology and Oceanography, 1998, 43(5): 885-895. doi: 10.4319/lo.1998.43.5.0885 -




 下载:
下载: