-
铬(Cr)及其化合物常用于采矿、电镀等行业中,而在水体中主要以Cr(Ⅲ)和Cr(Ⅵ)存在[1-2]。 相较于Cr(Ⅲ),Cr(Ⅵ)具有可吸附性低、生物毒性强的特点,如未经处理排放到水体中,会严重威胁我国水生态环境和人民生命健康[3-4]。目前,关于Cr(Ⅵ)的处理方法主要包括物理法[5-6]和化学法[7-8]。物理法主要是采用吸附材料(活性炭、生物炭、高分子聚合物)将Cr(Ⅵ)从水相转移至吸附材料中,该方法虽具有操作方便、材料廉价易得等优势,但却存在二次污染风险[9],需进行二次处理。而化学法主要是通过加入一定数量的还原剂,从而将Cr(Ⅵ)还原转化为毒性相对较低的Cr(Ⅲ),再通过调节水体的pH值,使Cr(Ⅲ)生成沉淀物质,实现水体和Cr(Ⅲ)的分离,达到去除Cr(Ⅵ)的目的,该方法是目前应用最为广泛的方法。
零价铁(Fe)具有还原性高、环境友好等优势,常用于水体重金属去除,但也存在颗粒易聚集、表面易氧化等缺点[10-11]。四氧化三铁(Fe3O4)是立方反尖晶石,由O2-与Fe2+、Fe3+亚晶格紧密堆积组成。其中,Fe(Ⅲ)([Fe3+]tetra)占据四面体阳离子位,Fe(Ⅱ)([Fe2+]octa)和Fe(Ⅲ)([Fe3+]octa)占据正八面体阳离子位,这使得Fe3O4电子可自由转移[12]。近几年来,Fe/Fe3O4被广泛应用于污染物催化氧化、机械脱卤过程中。一方面Fe可促进Fe(Ⅱ)/Fe(Ⅲ)的循环;另一方面Fe3O4可促进将电子传递给污染物的过程。在基于过一硫酸盐的催化氧化过程中,与Fe和Fe3O4相比,Fe/Fe3O4具有更高的催化效率和活性物种产率[13]。
机械球磨是利用磨球和物料碰撞摩擦,使得反应活化能降低、有利于固体污染物的降解。在机械球磨脱卤过程中,Fe/Fe3O4作为助磨剂可高效去除六氯苯、全氟辛烷磺酸等污染物[14-16],且在Fe/Fe3O4质量为3:7时效果最佳。由于Fe/Fe3O4具有较高的电子传递效率,将其作为助磨剂时可降低物料比(即降解单位质量污染物所需的助磨剂量),但仍面临着助磨剂尾料资源化利用的难题[16-21]。然而,研磨的Fe/Fe3O4具有良好的Cr(Ⅵ)还原性能。目前,有研究报道手动研磨的Fe和Fe3O4混合物可将Cr(Ⅵ)还原为Cr(Ⅲ),究其原因是Fe和[Fe3+]octa发生反应生成[Fe2+]octa[8]。因此,将机械球磨后的Fe/Fe3O4尾料用于Cr(Ⅵ)的还原去除,是促进尾料资源化利用的有效方式。
因此,本研究基于Fe/Fe3O4尾料资源化利用和高性能Cr(Ⅵ)还原材料开发的双重考虑,通过球磨模拟制备Fe/Fe3O4材料,研究球磨Fe/Fe3O4材料对Cr(Ⅵ)的还原性能以及其强化机理;探究最佳球磨条件(球磨氛围和时间)及还原条件(球磨材料投加量和初始pH),为研究Fe/Fe3O4尾料资源化利用以及机械球磨Fe/Fe3O4对Cr(Ⅵ)还原性能的影响提供重要数据支撑。
-
Fe、Fe3O4、H2SO4和H3PO4等试剂采购于国药集团化学试剂有限公司。丙酮、K2Cr2O7、邻菲罗啉、二苯碳酰二肼和NH2OH·HCl等试剂采购于上海麦克林生化科技股份有限公司。Pulverisette 7行星式球磨机(德国飞驰仪器公司)的球磨罐体为不锈钢材质(体积为80 mL)。
-
采用Fe和Fe3O4共球磨制备球磨Fe/Fe3O4材料(质量比为3:7,转速为600 r·min‒1)。所有Cr(Ⅵ)还原实验全部都在棕色锥形瓶(300 mL)中进行:先加入Cr2K2O7溶液(100 mL),然后加入定量球磨材料后进行搅拌(200 r·min‒1、25 ℃),定时取样1 mL进行分析。为确保实验结果的精确性,上述实验均重复操作两次以上。
-
检测Cr(Ⅵ)的质量浓度:取1 mL样品置于50 mL玻璃比色管中,用蒸馏水稀释至标线位置;然后依次加入H2SO4(50%,0.5 mL)和H3PO4(50%,0.5 mL)后进行混匀;再加入2 mL显色液(将0.2 g二苯碳酰二肼溶于50 mL丙酮中)后进行混匀;静置15 min后,用分光光度计测定样品溶液在540 nm处的吸光度。配制Cr(Ⅵ)标准溶液,绘制标准曲线(1~50 mg·L−1)。
检测Fe(Ⅱ)的质量浓度:取1 mL样品置于50 mL玻璃比色管中,用蒸馏水稀释至标线位置;依次加入5 mL乙酸-乙酸铵缓冲液(10 mmol·L−1)和0.5 mL邻菲罗啉溶液(5%)后混匀;静置15 min后,用分光光度计测定样品溶液在510 nm处的吸光度。配制Fe(Ⅱ)标准溶液,绘制标准曲线(2.5~100 mg·L−1)。
检测总铁的质量浓度:取1 mL样品置于50 mL玻璃比色管中,用蒸馏水稀释至标线位置;依次加入1 mL盐酸羟胺(10%)、0.5 mL邻菲罗啉溶液(5%)和5 mL醋酸盐缓冲液(10 mmol·L−1);静置15 min后,用分光光度计测定样品溶液在510 nm处的吸光度。配制总铁标准溶液,绘制标准曲线(2.5~100 mg·L−1)。总铁质量浓度减去Fe(II) 质量浓度即为Fe(III) 质量浓度。
材料表征:元素表征采用K-Alpha型X射线光电子能谱分析仪(X-ray photoelectron spectroscopy,XPS,Thermo Fisher Scientific)。以Al Kα为激发源,工作电压为12 kV,灯丝电流为6 mA;全谱扫描通能为100 eV,步长为1 eV,窄谱扫描通能为50 eV,步长为0.1 eV。晶型表征采用Ultima Ⅵ型X射线衍射光谱分析仪(X-Ray diffraction,XRD,Rigku)。以Cu-Kα 为测试靶,管电压为60 kV,电流为55 mA,扫描范围(2θ)为10°~80°。
-
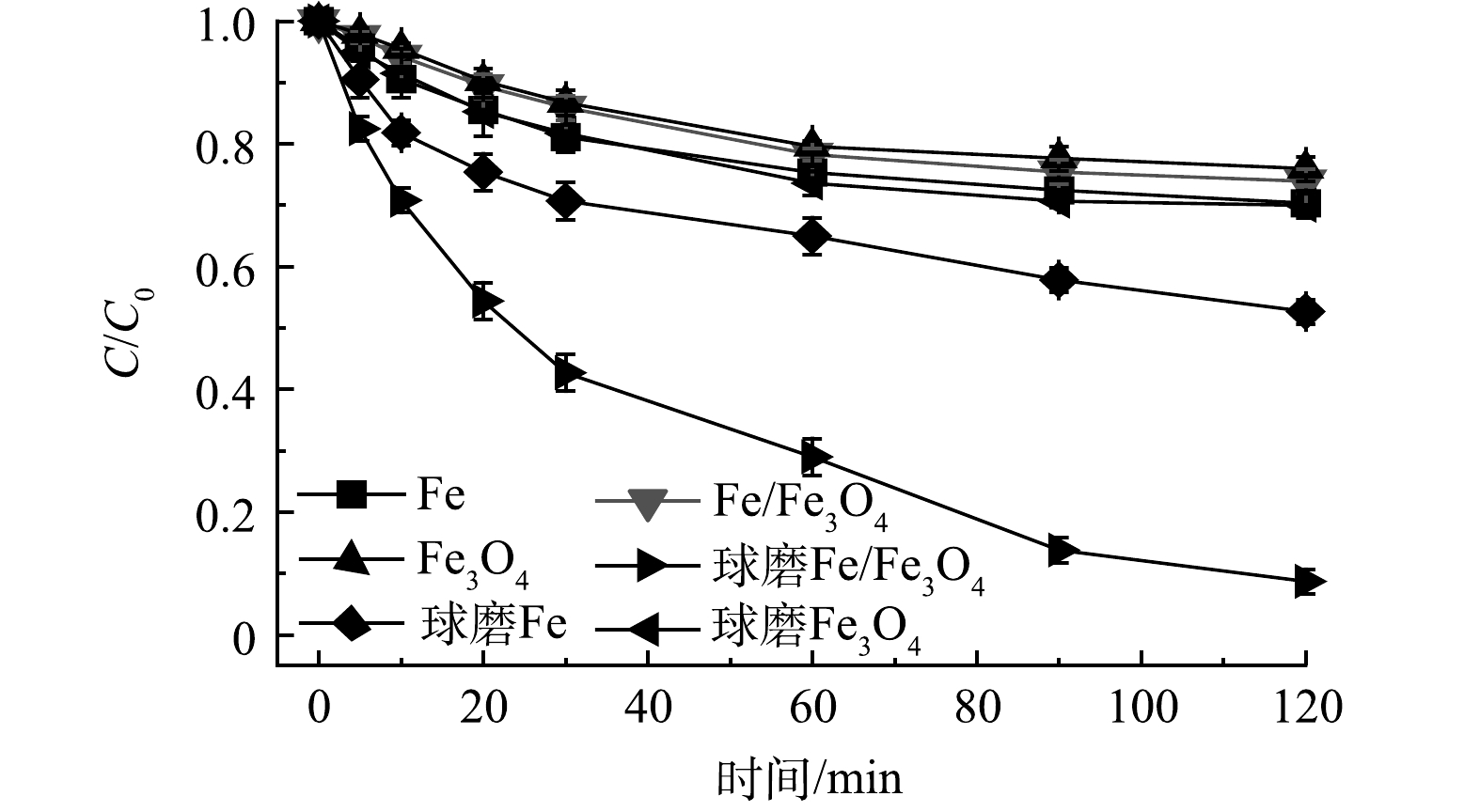
图1表示Fe、Fe3O4和Fe/Fe3O4材料的Cr(Ⅵ)还原性能状况。实验条件:Fe、Fe3O4和Fe/Fe3O4材料投加量为2.0 g·L−1,球磨氛围为空气,球磨时间为60 min,Cr(Ⅵ) 质量浓度为10 mg·L−1,初始 pH为3.0。可以发现,未球磨Fe、Fe3O4、Fe/Fe3O4材料对Cr(Ⅵ)的去除效果较差,反应120 min后,Cr(Ⅵ)去除率分别为29.7%、24.0%、26.1%。此时,Fe/Fe3O4的Cr(Ⅵ)去除效果高于Fe3O4,但低于Fe,说明Fe与Fe3O4之间的反应较弱。球磨Fe、Fe3O4、Fe/Fe3O4材料对Cr(Ⅵ)的去除效果均有提升,相比未球磨的材料,去除率分别增加了17.6%、6.0%、65.2%。对于Fe,机械球磨可去除其表面钝化层[22-23];而对于Fe/Fe3O4,机械球磨可强化Fe与Fe3O4之间的反应[8,16]。球磨Fe/Fe3O4的稳定性结果表明,在120 min 时 Cr(Ⅵ)的去除率在第1、2次循环中分别为41.3%和26.9%,再次球磨后,Cr(VI)的去除率可恢复到>90%。
-
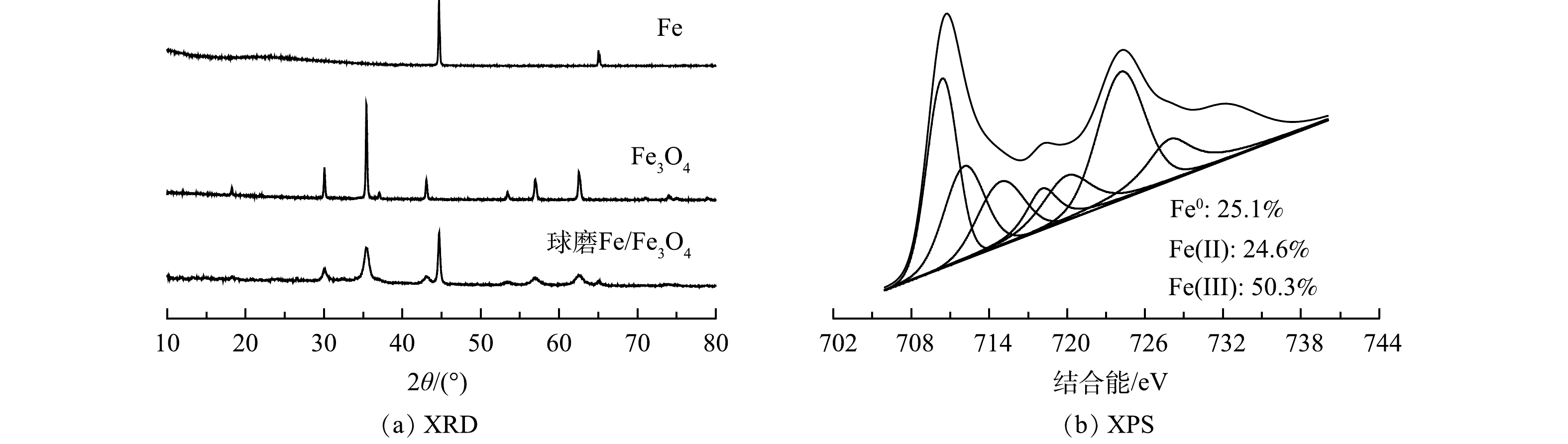
球磨Fe/Fe3O4材料的晶型和元素表征结果如图2所示。由图2(a)中 XRD结果可见,球磨后Fe和Fe3O4晶体减少;XPS结果表明 Fe0含量有所减小,而Fe(II)含量有所增加(图2(b))。该结果可能是由以下2点原因所致:一方面,Fe与含氧物质(空气中的氧或Fe3O4释放的氧)在高温下反应生成Fe(II)(式(1));另一方面,Fe与Fe3O4发生氧化还原反应生成Fe(II)(式(2))。Fe(Ⅱ)含量增加可加速Cr(VI)的还原(式(3))。然而,HU等报道球磨Fe/Fe3O4材料具有较小的电化学阻抗,Fe3O4作为导体可加速Fe释放的电子向污染物传递[13,16]。因此,机械球磨也可能强化Fe与Fe3O4的界面接触,加速Fe释放的电子向Cr(Ⅳ)传递,从而促进Cr(Ⅳ)的还原(式(4)和式(5))。
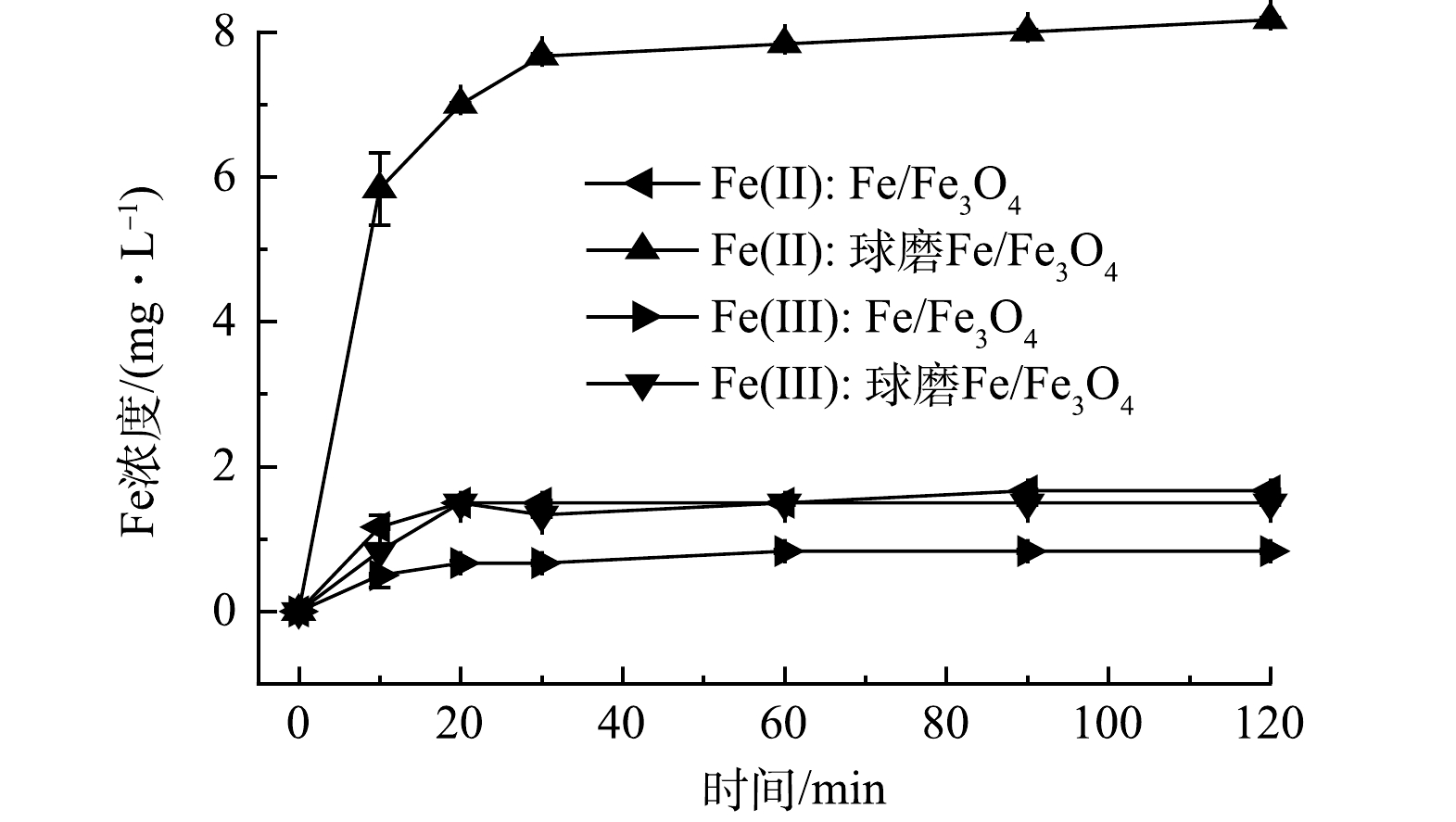
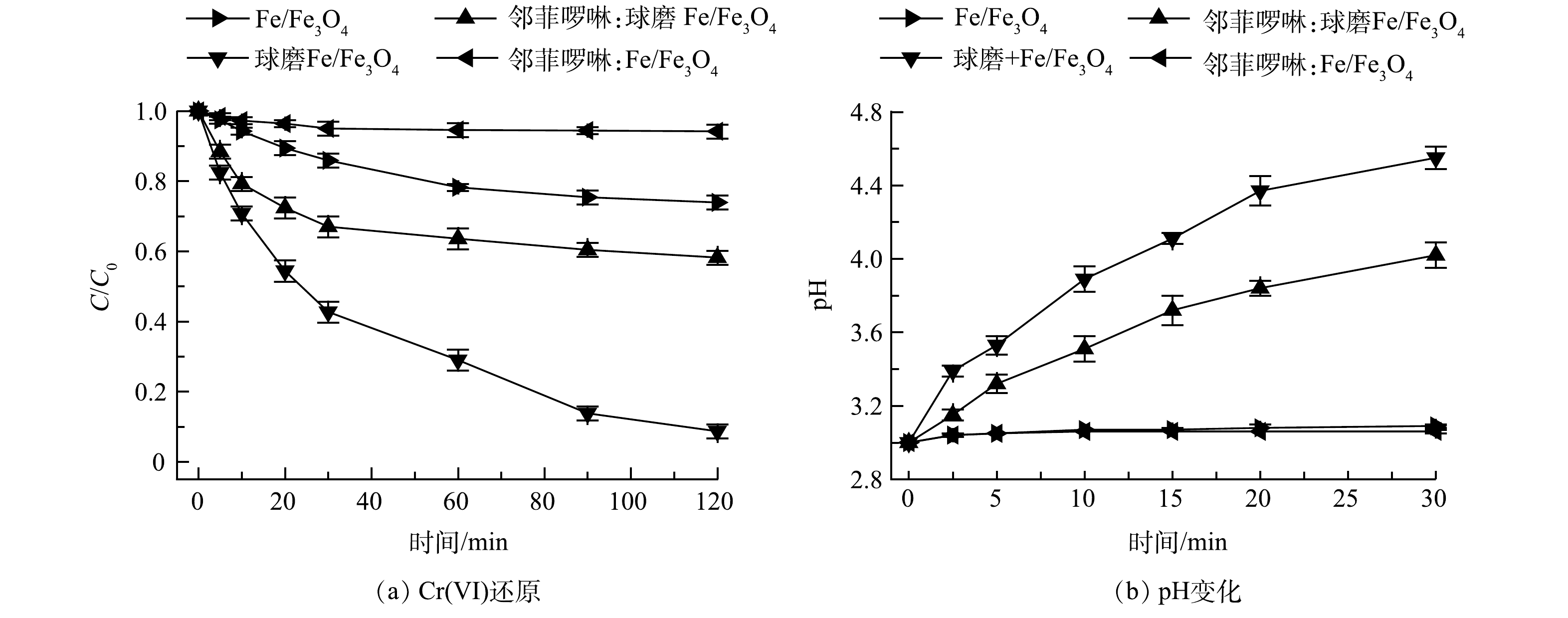
本研究探索了Fe(Ⅱ)和Fe(Ⅲ)在Fe/Fe3O4样品Cr(Ⅵ) 还原过程中的生成情况。实验条件:Fe/Fe3O4投加量为2.0 g·L−1,空气氛围下球磨时间为60 min,Cr(Ⅵ) 质量浓度为10 mg·L−1,初始 pH为3.0。实验表明球磨还原Cr(Ⅵ)过程中,Fe/Fe3O4样品Fe(Ⅱ)和Fe(Ⅲ)的生成量较高,分别稳定在8.2 mg·L−1和1.5 mg·L−1(图3)。如图4(b)所示,采用球磨Fe/Fe3O4还原Cr(Ⅵ)时,反应液pH大幅上升。这是由于H+参与了Cr(Ⅵ)还原反应(式(3))。上述结果说明,机械球磨促进了Fe(Ⅱ)生成,随后与Cr(Ⅵ)反应后转化为Fe(Ⅲ)。
SHAO等[24]报道表明邻菲啰啉可以快速淬灭Fe(Ⅱ),阻断Fe(Ⅱ)与Cr(Ⅵ)之间的氧化还原反应。因此,本研究通过加入过量邻菲啰啉作为Fe(Ⅱ) 的淬灭剂,分析Fe(Ⅱ)在球磨Fe/Fe3O4还原Cr(Ⅵ)过程中的作用。结果表明(图4(a)),加入邻菲啰啉后, Fe/Fe3O4对Cr(Ⅵ)的还原性能有所下降。经过120 min反应后,未球磨Fe/Fe3O4对Cr(Ⅵ) 的去除率由26.1%降至6.8%,而球磨Fe/Fe3O4对Cr(Ⅵ) 的去除率由91.3%降至41.8%。该结果表明,Fe(Ⅱ)在Fe/Fe3O4还原Cr(Ⅵ)过程中具有重要作用,而机械球磨可强化Fe(Ⅱ)的生成。值得注意的是,当Fe(Ⅱ)被淬灭后,与未球磨Fe/Fe3O4材料相比,球磨Fe/Fe3O4对Cr(Ⅵ)的去除率仍然较高,反应液pH上升幅度仍然较大,这说明机械球磨除了强化Fe(Ⅱ)的生成之外,还强化了Fe与Fe3O4界面的电子传递。Fe释放出电子,Fe3O4作为导体将电子传递给Cr(Ⅵ),从而加速了Cr(Ⅵ)还原(式(4)和式(5))。
-
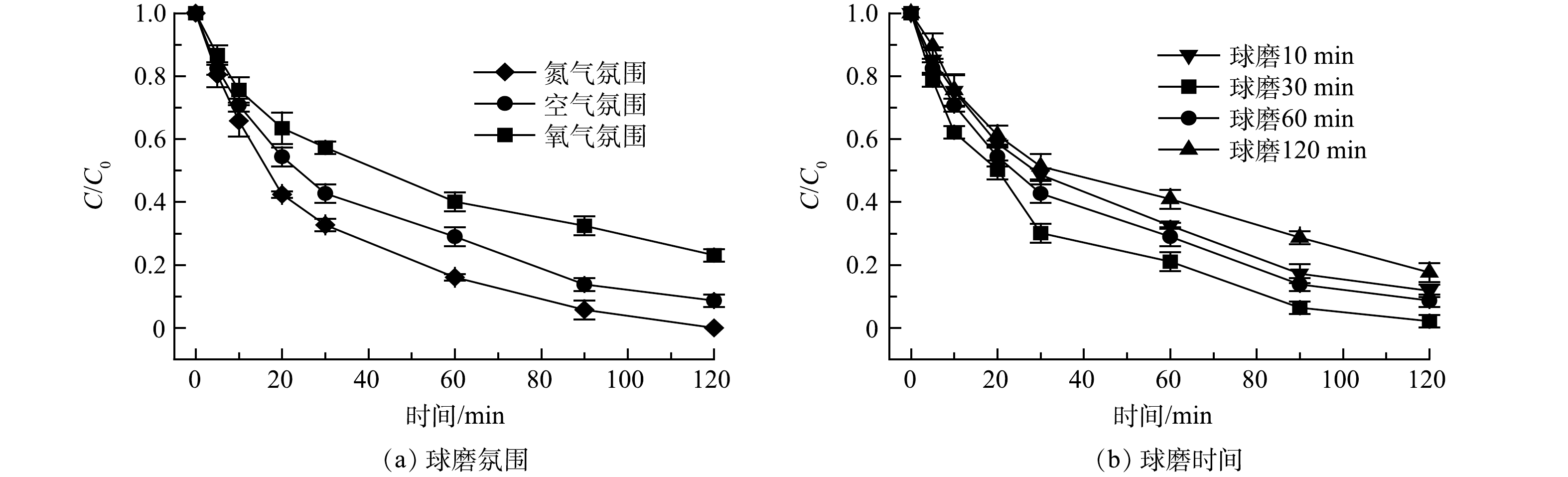
本研究探索了球磨氛围和球磨时间对Fe/Fe3O4材料还原性能可能产生的影响。图5(a)反映了球磨氛围的影响,实验条件:球磨Fe/Fe3O4投加量为2.0 g·L−1,球磨时间为60 min,Cr(Ⅵ) 质量浓度为10 mg·L−1,初始 pH为3.0。球磨Fe/Fe3O4在不同球磨氛围下的还原性能依次为氮气> 空气> 氧气,反应120 min 后, Cr(Ⅵ)去除率分别为100%、91.3%和76.9%。如前文所述,可以通过2条途径生成Fe(Ⅱ):一是Fe与Fe3O4表面反应生成Fe(Ⅱ);二是Fe与O2反应生成Fe(Ⅱ)。其中,Fe与Fe3O4的反应是Fe(Ⅱ)生成的主要途径[16]。在富氧条件下进行球磨时,过量的氧气会将生成的Fe(Ⅱ)进一步氧化为Fe(Ⅲ),从而降低球磨Fe/Fe3O4对Cr(Ⅵ) 的还原性能[21,25]。
图5(b)反映了球磨时间Cr(Ⅵ)还原性能的影响。实验条件:球磨Fe/Fe3O4投加量为2.0 g·L−1,球磨氛围为空气,Cr(Ⅵ) 质量浓度为10 mg·L−1,初始 pH为3.0。球磨时间增加,球磨Fe/Fe3O4的还原效果呈现先增强后减弱趋势。当球磨时间由10 min增加至30、60、120 min后,经过120 min 反应,Cr(Ⅵ)去除率分别为88.2%、97.9%、91.3%、82.4%。说明过长时间的球磨会导致Fe和Fe(Ⅱ)的过度氧化,不利于球磨Fe/Fe3O4对Cr(Ⅵ)的有效还原[16]。综上所述,球磨Fe/Fe3O4材料的最佳球磨条件为:氮气氛围、球磨30 min。
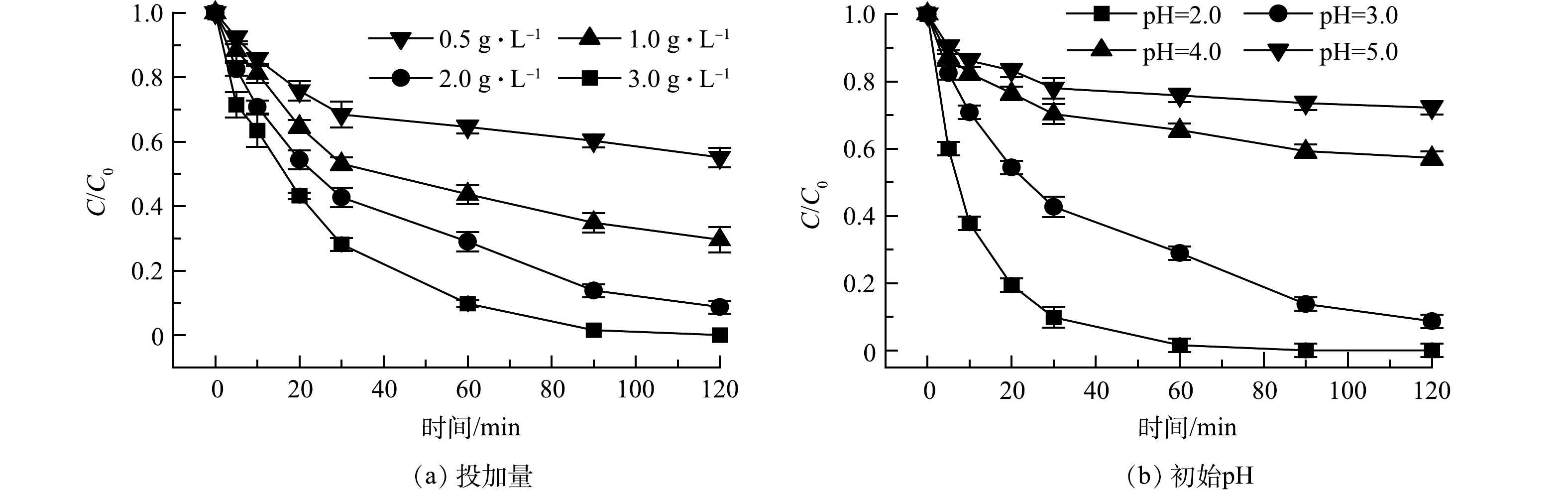
本研究探索了投加量和初始pH对球磨Fe/Fe3O4对Cr(Ⅵ)还原性能可能产生的影响。图6(a)为Fe/Fe3O4球磨材料投加量的影响,实验条件:空气氛围下球磨时间为60 min,Cr(Ⅵ) 质量浓度为10 mg·L−1,初始 pH依然设置为3.0。Cr(Ⅵ)的还原性能随着球磨Fe/Fe3O4材料投加量的增大而不断升高。当投加量为0.5、1.0、2.0、3.0 g时,经过120 min反应,Cr(Ⅵ)去除分别为44.9%、70.4%、91.3%、100%。球磨Fe/Fe3O4投加量的增加提供了更多的Fe和Fe(Ⅱ),从而可促进对Cr(Ⅵ)的还原。
图6(b)为初始pH对Cr(Ⅵ)还原性能的影响。实验条件为:球磨Fe/Fe3O4投加量为2.0 g·L−1,空气氛围下球磨时间为60 min,Cr(Ⅵ) 质量浓度为10 mg·L−1。球磨Fe/Fe3O4的还原性能随着初始pH的增加而不断降低。当初始pH为2.0、3.0、4.0和5.0时,经过120 min反应,Cr(Ⅵ)去除率分别为100%、91.3%、42.7%和27.8%。pH会影响溶液中铬的存在形态:当pH在2~4时,铬主要以Cr2O72‒和HCrO4‒存在;当pH在4~6时,铬主要以HCrO4‒和CrO42‒存在[26]。一方面,根据能斯特方程,在酸性条件下, Cr(Ⅵ)与Fe、Fe(Ⅱ)的反应具有较高的氧化还原电位和反应驱动力(ΔE)(式(4)和式(5));另一方面,高pH会降低反应液中Fe(Ⅱ) 质量浓度,从而不利于Cr(Ⅵ)的还原。
-
1)机械球磨可以有效强化Fe/Fe3O4的Cr(Ⅵ)还原性能。反应120 min后,Cr(Ⅵ)去除率从26.1%提高至91.3%。
2) Fe(Ⅱ)可显著促进Cr(Ⅵ)还原。机械球磨可强化Fe(Ⅱ)生成,促进Fe电子传递。
3) Fe/Fe3O4最佳球磨条件如下:氮气氛围,球磨30 min。过量氧气和过长球磨时间会削弱球磨Fe/Fe3O4的Cr(Ⅵ)还原性能。
4) Cr(Ⅵ)去除效果与球磨Fe/Fe3O4投加量呈正相关性,而与初始pH呈负相关性。
机械球磨强化铁/四氧化三铁对Cr(Ⅵ)的还原性能
Performance enhancement of Cr(Ⅵ) reduction for Fe/Fe3O4 by mechanical milling
-
摘要: Fe/Fe3O4作为机械球磨助磨剂可高效去除含卤污染物,但也面临着助磨剂尾料资源化利用的难题。机械球磨后的Fe/Fe3O4尾料具有良好的Cr(Ⅵ)还原性能。本研究基于尾料资源化利用和高性能材料开发的双重考虑,通过球磨模拟制备具有高Cr(Ⅵ)还原性能的Fe/Fe3O4材料。结果表明,机械球磨强化了Fe/Fe3O4材料的Cr(Ⅵ)还原性能,Cr(Ⅵ)去除率由26.1%提升至91.3%。机械球磨主要是通过促进Fe(Ⅱ)的生成和Fe释放电子的传递强化Cr(Ⅵ)还原。采用球磨Fe/Fe3O4还原Cr(Ⅵ)时,Fe(Ⅱ)的高生成量说明机械球磨促进了Fe(Ⅱ)的生成,而Fe(Ⅲ) 的高生成量和pH的大幅上升说明Fe(Ⅱ)转化为Fe(Ⅲ)。利用邻菲啰啉淬灭Fe(Ⅱ),使得球磨Fe/Fe3O4材料对Cr(Ⅵ) 的去除率降至41.8%,这表明Fe(Ⅱ)对Cr(Ⅵ) 还原起主要作用。过量的氧气和过长的球磨时间可削弱球磨Fe/Fe3O4的Cr(Ⅵ)还原性能,最佳球磨条件为氮气氛围、球磨30 min;Cr(Ⅵ)去除效果与球磨Fe/Fe3O4投加量呈正相关,而与初始pH呈负相关。Abstract: Fe/Fe3O4 as an additive for mechanical milling can efficiently degrade halogenated pollutants, but the reutilization of additive tailing is a problem. The Fe/Fe3O4 tailing has a good performance on Cr(Ⅵ) reduction. In this study, the Fe/Fe3O4 material with high performance of Cr(Ⅵ) reduction was prepared by mechanical milling simulation based on the dual consideration of tailing reutilization and material development. The results show that mechanical milling enhanced the reduction performance of Fe/Fe3O4, and the removal ratio of Cr(Ⅵ) increased from 26.1% to 91.3%. The enhancement of mechanical milling was primarily through the promotion of Fe(Ⅱ) generation and transfer of Fe-released electrons. When the milled Fe/Fe3O4 was used for Cr(Ⅵ) reduction, the high formation of Fe(Ⅱ) implies that the mechanical milling promoted its yield, and the high generation of Fe(Ⅲ) and rise of pH indicate the conversion of Fe(Ⅱ) to Fe(Ⅲ). After the quenching of Fe(Ⅱ) by phenanthroline, the removal ratio of Cr(Ⅵ) by the milled Fe/Fe3O4 decreased to 41.8%, indicating that Fe(Ⅱ) played a major role in Cr(Ⅵ) reduction, and the mechanical milling enhanced the transfer of electrons released from Fe. Excessive oxygen and milling time weakened the reduction performance of the milled Fe/Fe3O4, and the optimum conditions were nitrogen atmosphere and a milling time of 30 min. The removal ratio of Cr(Ⅵ) was positively correlated with the dosage of the milled Fe/Fe3O4 material, while was negatively correlated with the initial pH.
-
Key words:
- Fe /
- Fe3O4 /
- mechanical milling /
- Cr(Ⅵ) /
- reduction enhancement
-
化工生产及皮革制造等相关行业生产废水中所含的硫化物(S2−)具有高毒性、腐蚀性和臭味,可对人类健康造成危害[1-7]。目前S2−常用的去除方法包括酸化吸收法、化学絮凝法和化学氧化法[8]。其中,酸化吸收法设备易腐蚀且操作复杂;化学絮凝法药剂成本高且二次污泥产量大。化学氧化法有过渡金属催化氧化、过氧化氢、次氯酸钠、高锰酸钾、臭氧氧化等。其中以锰盐为催化剂,催化空气氧化法成本最低,且具有条件温和、去除率高等优点[5]。但均相锰盐在处理含硫废水的过程中会产生大量沉淀,且重金属锰离子对水体会造成二次污染。
近年来,众多学者致力于开发高效的金属氧化物等非均相催化剂用于含硫废水的处理[6-13]。郭二亮等[10]采用等体积浸渍法制得MnO2负载γ-Al2O3催化材料,该材料对初始质量浓度为1 000 mg∙L−1的模拟废水中的Na2S去除率可达98%。NHI等[11]制备了Mn-Co-Cr-聚乙烯棒,用于催化氧化初始质量浓度为1 000 mg·L−1的Na2S模拟废水,在60 ℃下,3 h内Na2S去除率可达90%。以上反应体系均已取得较好的含硫废水处理效果,但难以实现单质硫(S0)的有效回收利用。目前,将富氮材料应用于硫化物选择性氧化的研究工作已取得有效进展[14-22]。SUN等[14]通过在碳中掺杂高浓度的氮原子,制备了无金属催化剂(NMC),该NMC在低温下对H2S的氧化展现出较高的催化活性和选择性;进一步的研究表明,吡啶氮原子对H2S氧化的催化活性起到了关键作用。YANG等[15]通过直接热处理商用聚苯胺(PANI)获得了富氮碳,用于在相对较低的温度(180 ℃)下连续选择性氧化H2S,可实现99%的催化转化率和95%的选择性。据文献调研,目前还未见关于将锰氧化物负载于富氮材料表面且将其用于水溶性硫化物催化氧化的报道。
基于此,本研究以PANI为载体,以高锰酸钾(KMnO4)为前驱体,通过化学浸渍法制得了锰氧化物复合聚苯胺材料(MnxOy-PANI),并以空气为氧化剂,在常温、常压下将该材料应用于S2−的催化氧化。评价了该催化剂对S2−的选择性氧化性能,并探究了反应体系中可能的反应机理,以期为含硫废水的处理及有效利用提供参考。
1. 材料与方法
1.1 实验试剂和仪器
1)实验试剂。高锰酸钾(KMnO4)、聚苯胺(PANI)、硫化钠(Na2S)、碘(I2)、淀粉((C6H10O5 )n)、碘化钾(KI)、碘酸钾(KIO3)、硫代硫酸钠(Na2S2O3)、盐酸(HCl,99%)、氯仿(CHCl3)、乙醇(C2H5OH)、甲醛(CH2O)、亚硫酸钠(Na2SO3)、醋酸(CH3COOH)、磷酸二氢钾(KH2PO4)、磷酸氢二钾(K2HPO4)、碳酸钠(Na2CO3)均购于国药控股集团化学试剂有限公司。
2)实验仪器。纯水仪(PCDX,武汉品冠仪器公司),烘箱(DZG-6020,天津华北实验有限公司),恒温磁力搅拌水浴锅(ZNCL-S,科尔仪器设备有限公司),紫外分光光度计(UV-2600,Shimadzu,Japan),离子色谱(Dionex,ICS-1100),电感耦合等离子体发射光谱(ICP‒OES, Optima 8300, PerkinElmer, U.S.)。
1.2 MnxOy-PANI催化剂的制备
采用化学浸渍法,以KMnO4为前驱体,向1 000 mL浓度为2 mmol·L−1的KMnO4溶液中缓慢投加1.0 g聚苯胺,常温下搅拌24 h使其充分反应。将反应后溶液固液分离,对所得材料进行洗涤,置于60 ℃烘箱内干燥24 h,即得到锰氧化物复合聚苯胺材料MnxOy-PANI。
1.3 MnxOy-PANI催化剂的表征
通过N2物理吸脱附仪表征材料比表面积和孔容;使用傅立叶红外分析仪(FTIR)表征材料表面含有的官能团;使用场发射扫描电子显微镜(FE-SEM)对材料进行形貌分析;使用X射线光电子能谱仪(XPS)对材料表面锰物种的化学价态进行分析;使用X射线衍射技术(XRD)表征材料的物相和晶体结构。
1.4 Na2S去除实验及分析方法
分别配制质量浓度为50、100、150、200 mg·L−1的Na2S溶液,通过NaOH溶液调节溶液pH为10.4,向其中加入一定量催化剂,反应于恒温磁力搅拌水浴锅中进行。在一定的时间间隔内,取10 mL反应溶液,经20 μm滤头过滤后进行分析测定。
采用国标HJ/T60-2 000测定反应溶液中S2−质量浓度,按式(1)计算S2−的去除率。通过离子色谱测定反应后溶液中
S2O2−3 SO2−3 SO2−4 η=C0−CtC0×100% (1) 式中:η为S2−的去除率,%;C0为含硫废水中S2−初始质量浓度,mg∙L−1;Ct为含硫废水中反应t时刻S2−的质量浓度,mg∙L−1。
2. 结果与讨论
2.1 MnxOy-PANI催化剂的表征
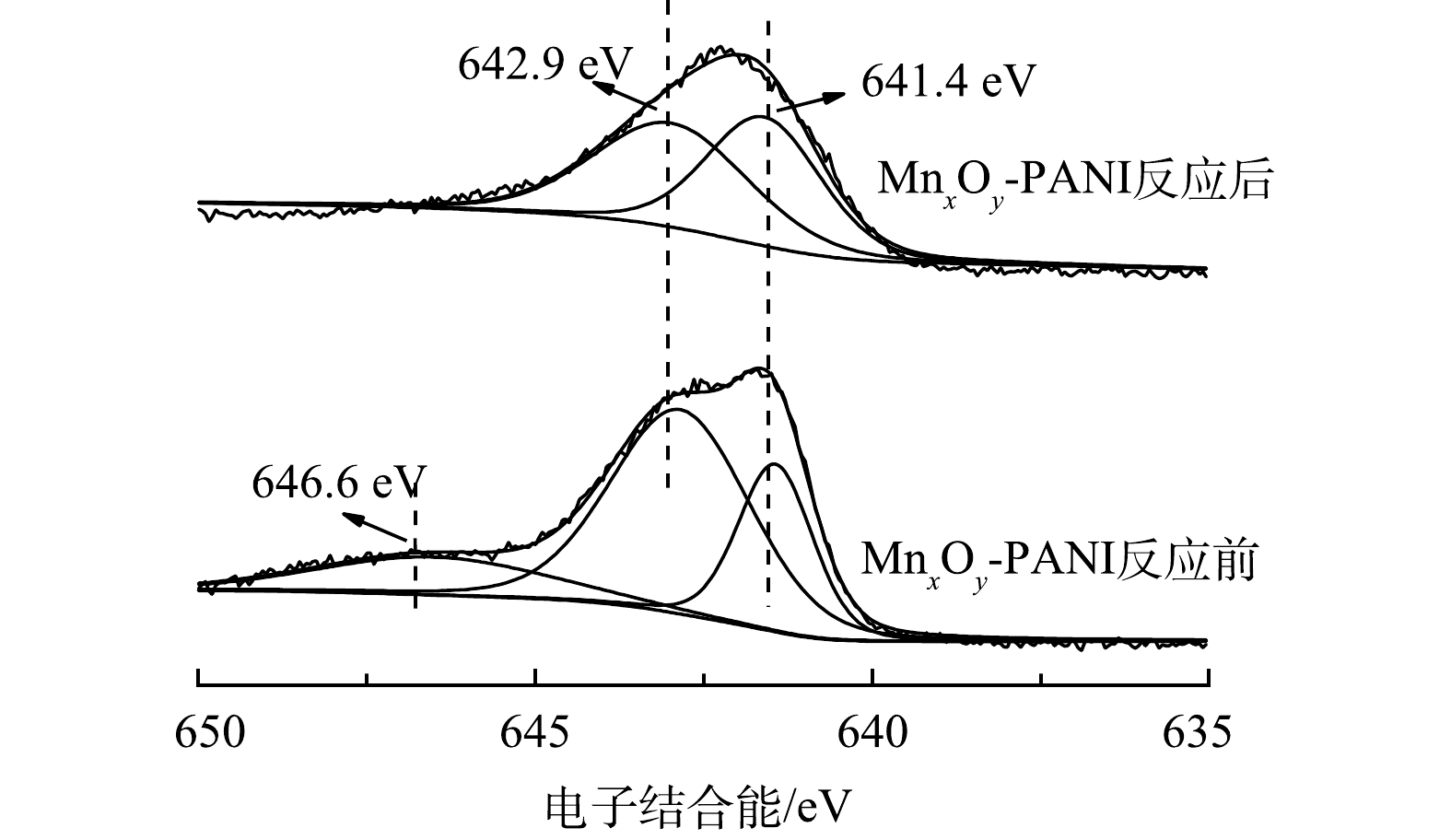
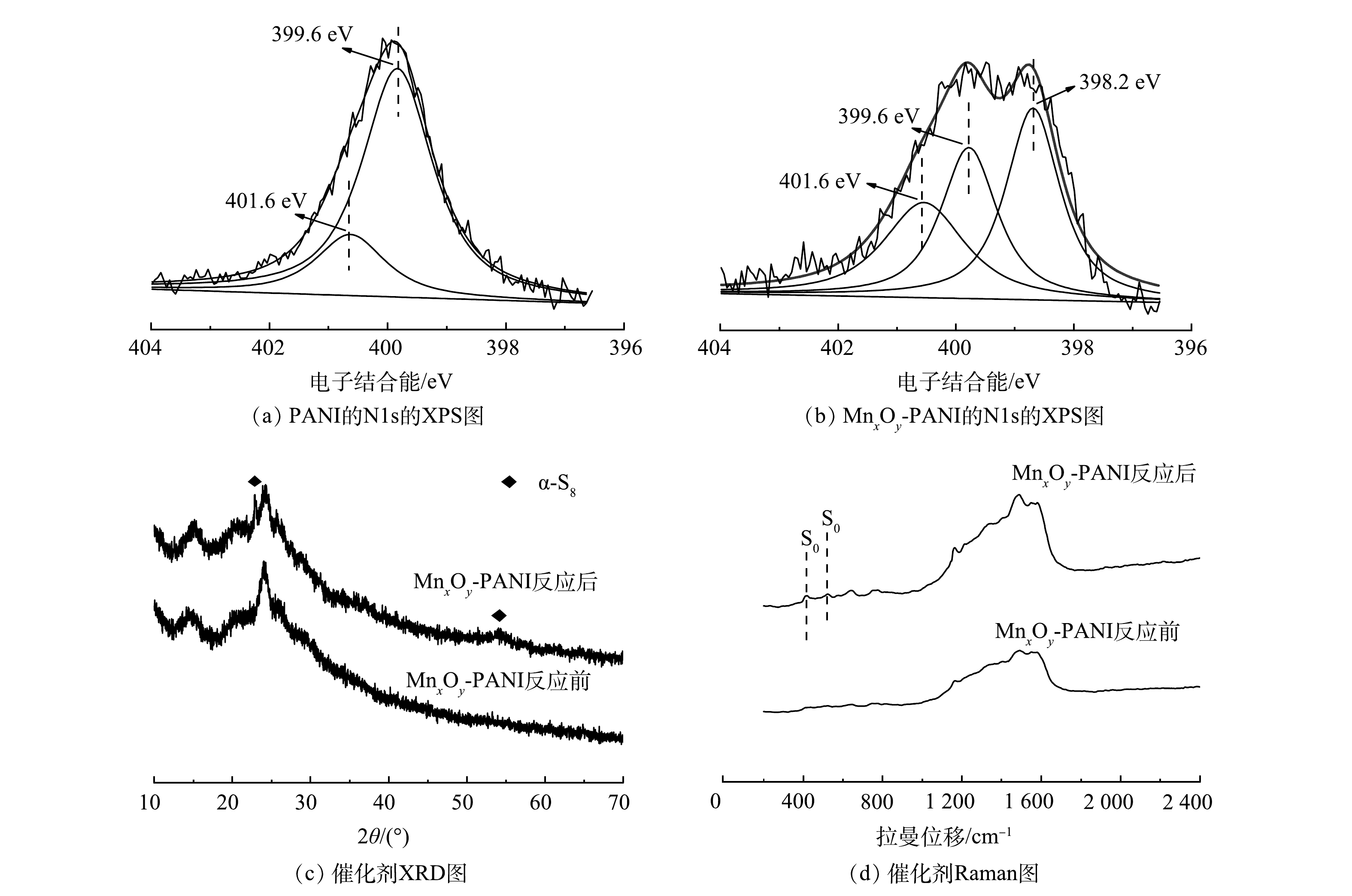
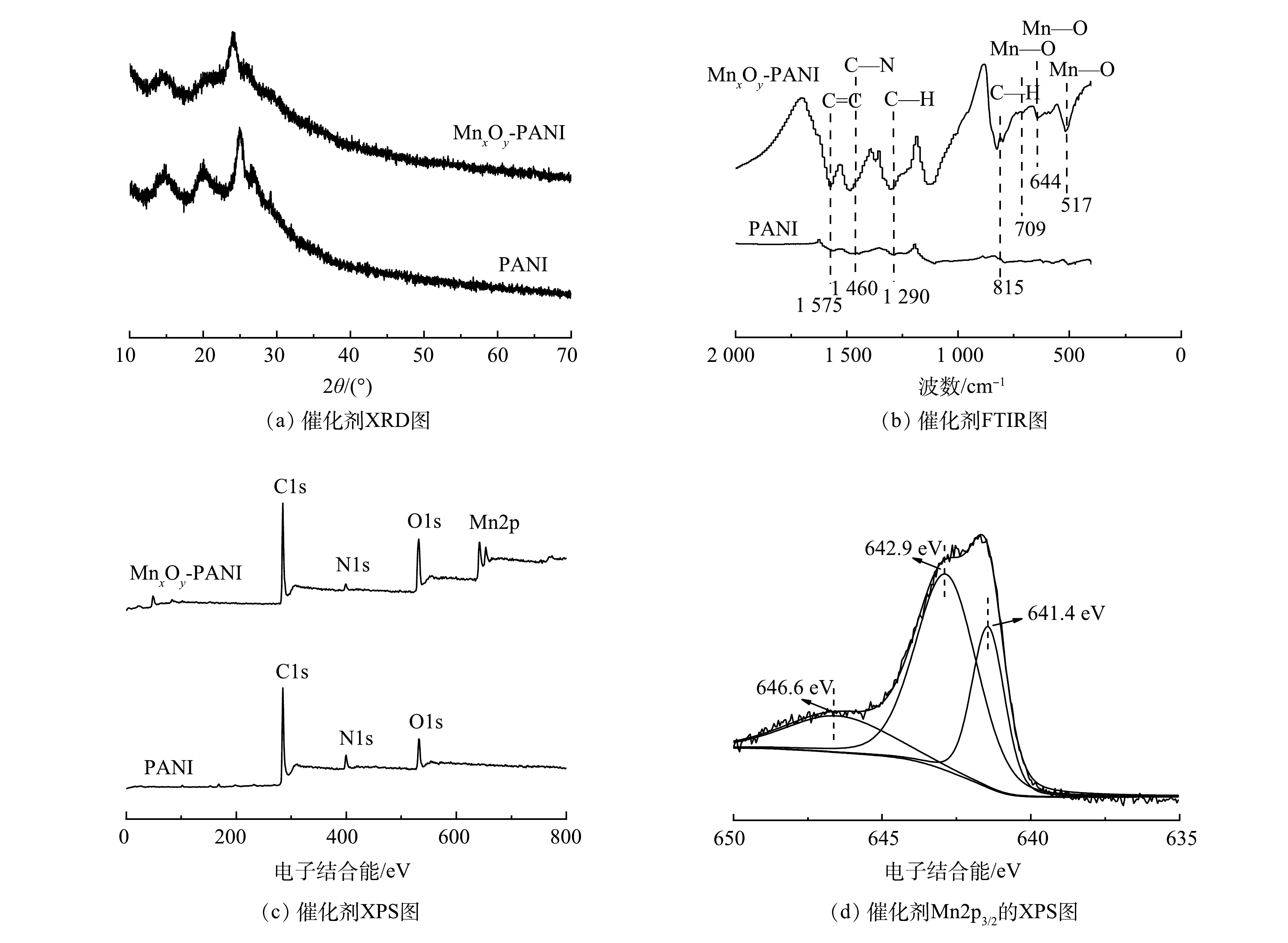
图1(a)为PANI和MnxOy-PANI的XRD图。在15.1°、20.0°、25.2°处的特征峰分别对应PANI的(010)、(100)、(011)平面衍射。这些峰可以归因于聚苯胺的聚合物链平行或垂直的周期性[23]。然而,MnxOy-PANI图谱中并未出现锰氧化物的特征衍射峰。这一结果可归因于MnxOy-PANI中锰氧化物的低结晶度和无定形结构[24]。催化剂的红外图谱如图1(b)所示。1 575、1 460、1 290、815 cm−1处出现的特征峰分别对应PANI的C=C伸缩振动峰、C—N伸缩振动峰、C—H弯曲振动峰以及C—H在平面内外的振动峰[24]。而在MnxOy-PANI红外图谱中,709 cm−1和517 cm−1处出现对应MnO2中Mn-O的特征峰,644 cm−1处出现对应Mn2O3中Mn—O的特征峰[25-26]。这表明,生成的锰氧化物为MnO2和Mn2O3。图1(c)为催化剂的XPS图谱。PANI图谱中只出现了C1s、N1s、O1s的结合能峰;而MnxOy-PANI的图谱中出现了明显的Mn2p结合能峰。如图1(d)所示,对MnxOy-PANI的Mn2p3/2峰进行分峰拟合,在646.6 eV和642.9 eV处的峰归属于Mn(Ⅳ),641.4 eV处的峰归属于Mn(Ⅲ)[27]。这与红外表征结果一致。XRD、FTIR、XPS表征结果共同证明,锰氧化物以MnO2和Mn2O3的形式成功负载于PANI载体上。
由图2(a)、图2(b)中可观察到PANI堆积团簇呈珊瑚状,而图2(c)、图2(d)中MnxOy-PANI的表面结构更为粗糙。这说明锰氧化物包覆在PANI表面。由图2(e)可以看出,PANI和MnxOy-PANI吸附脱附等温曲线为典型Ⅱ型等温线。表明其为介孔材料,这一结果可以由其孔径分布图(图2(f))进一步证实。样品比表面积和孔径数据如表1所示。MnxOy-PANI的比表面积(22 m2∙g−1)远大于PANI(8 m2∙g−1)。这可归因于聚苯胺载体上高孔隙率锰氧化物的形成[27]。MnxOy-PANI比表面积的增大能为其吸附和氧化提供更多反应活性位点。
表 1 PANI和MnxOy-PANI的比表面积和孔径Table 1. Surface area and pore size of PANI and MnxOy-PANI样品 比表面积/(m2∙g−1) 总孔容/(cm3∙g−1) 孔径/nm PANI 7 0.023 210 23.581 9 MnxOy-PANI 22 0.093 676 19.805 1 2.2 MnxOy-PANI催化剂去除Na2S
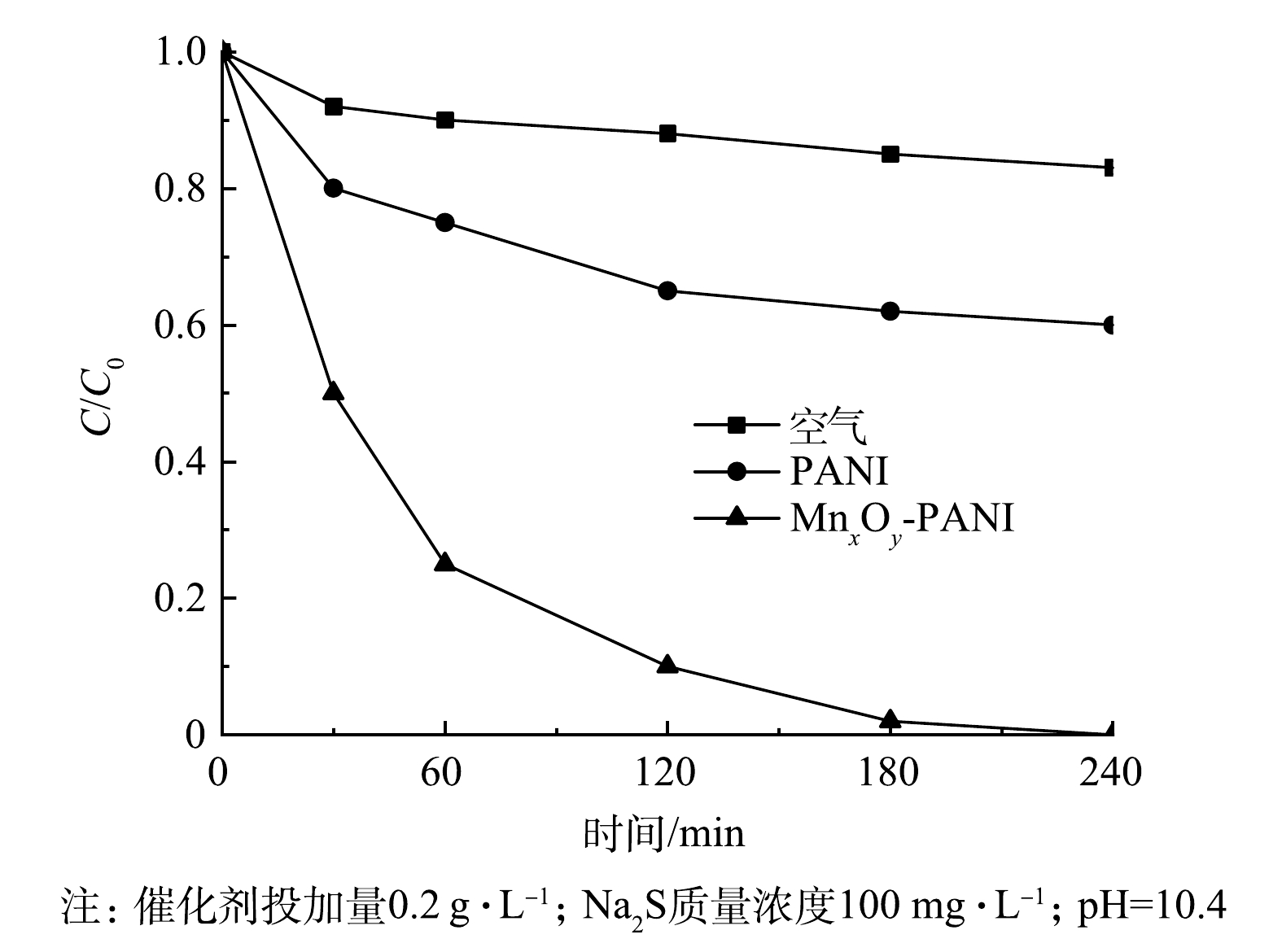
如图3所示,在仅有空气而没有催化剂的条件下,Na2S几乎没有被去除。加入单一PANI后,在240 min内Na2S的去除率为40%。以MnxOy-PANI为催化剂,以空气为氧化剂时,Na2S的去除速率显著提升,在240 min内Na2S可被完全去除。这表明MnxOy-PANI具有较好的催化氧化性能。
2.3 不同反应条件对Na2S去除的影响
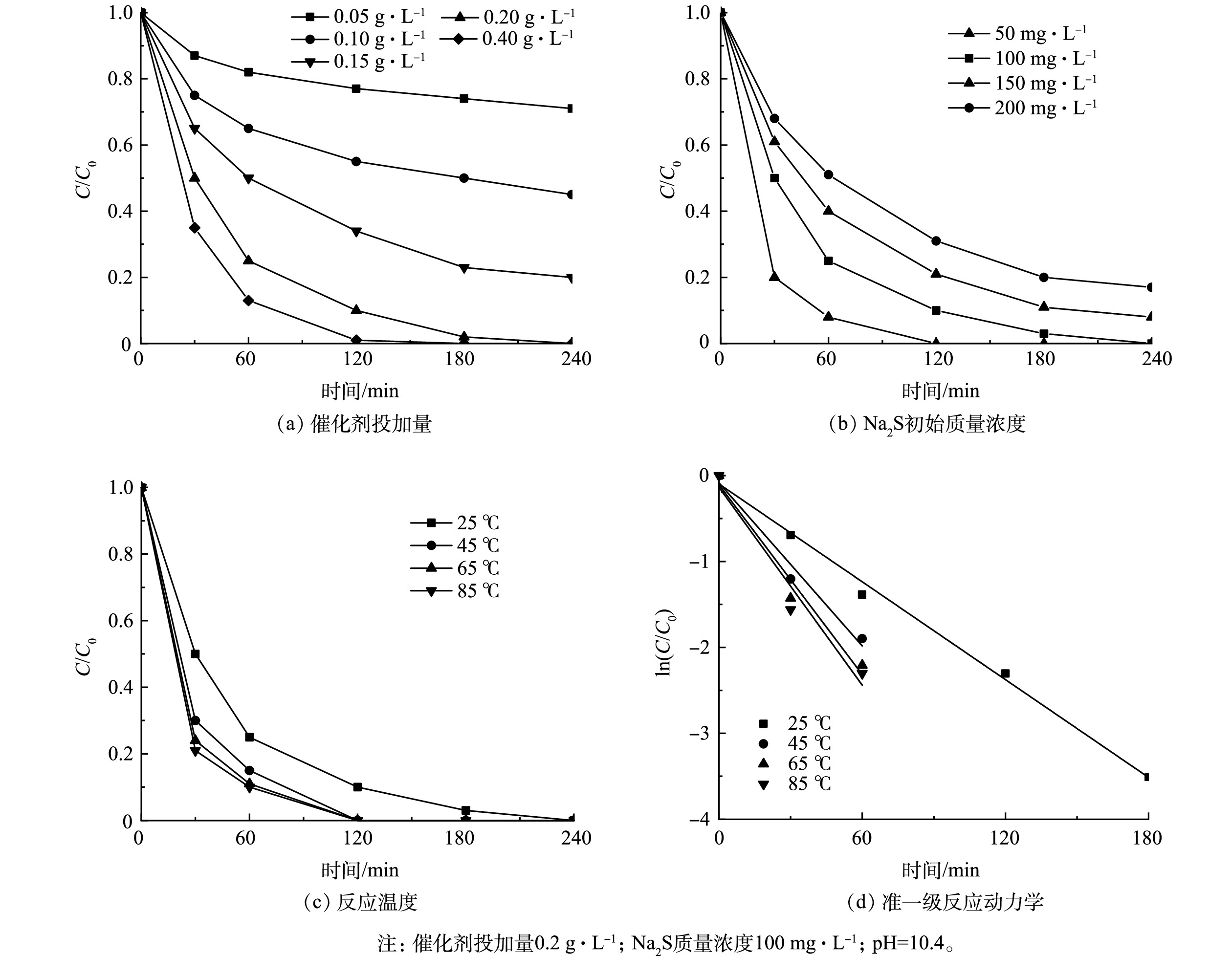
如图4(a)所示,当催化剂投加量为0.05 g∙L−1时,Na2S的氧化去除率仅为23%;增大投加量至0.1 g∙L−1和0.15 g∙L−1时,Na2S的去除率显著提升至50%和78%;继续增大投加量至0.2 g∙L−1时,Na2S可被完全氧化。这主要归因于催化剂活性位点的增多。进一步增大催化剂投加量至0.4 g∙L−1时,Na2S的去除率则提升不大,因此,后续实验催化投加量采用0.2 g∙L−1。Na2S初始质量浓度对Na2S去除率的影响如图4(b)所示。随着初始浓度的增加,Na2S的去除率逐渐降低。这可能是由于催化剂上的反应活性位点不足。但即使Na2S质量浓度高达200 mg∙L−1,MnxOy-PANI仍保持较好的催化氧化性能,反应240 min内可去除80% Na2S。当初始质量浓度为100 mg∙L−1时,反应240 min内Na2S可被完全去除,因此,后续实验的Na2S初始质量浓度设为100 mg∙L−1。
不同反应温度对Na2S去除率的影响及准一级动力学拟合速率如图4(c)、图4(d)所示。当反应温度为25、45和65 ℃时,反应速率分别为0.019 0、0.031 6、0.036 7 min−1。当继续升高温度至85 ℃时,反应速率的提升并不明显。这表明,此时反应已达到平衡,温度不再继续影响反应去除速率[10]。因此,后续实验均在室温25 ℃下进行。在25 ℃,Na2S初始质量浓度为100 mg∙L−1,催化剂投加量为0.2 g∙L−1时,考察了初始pH对MnxOy-PANI催化氧化性能的影响。由图5(a)可见,随着pH的升高,反应240 min内Na2S均可被完全去除。这表明MnxOy-PANI具有良好的适用性。在反应体系自然pH(10.4)下探究了不同反应气氛对Na2S去除的影响。如图5(b)和图5(c)所示,在氧气饱和条件下,Na2S氧化速率为3.87 min−1,是空气的91倍(0.042 1 min−1)。这说明氧气在反应体系中扮演着重要角色。向反应体系中通入足够的氩气排除氧气,240 min内Na2S的去除率不超过10%。这一结果进一步证实氧气在氧化中的关键作用。
2.4 MnxOy-PANI循环利用性
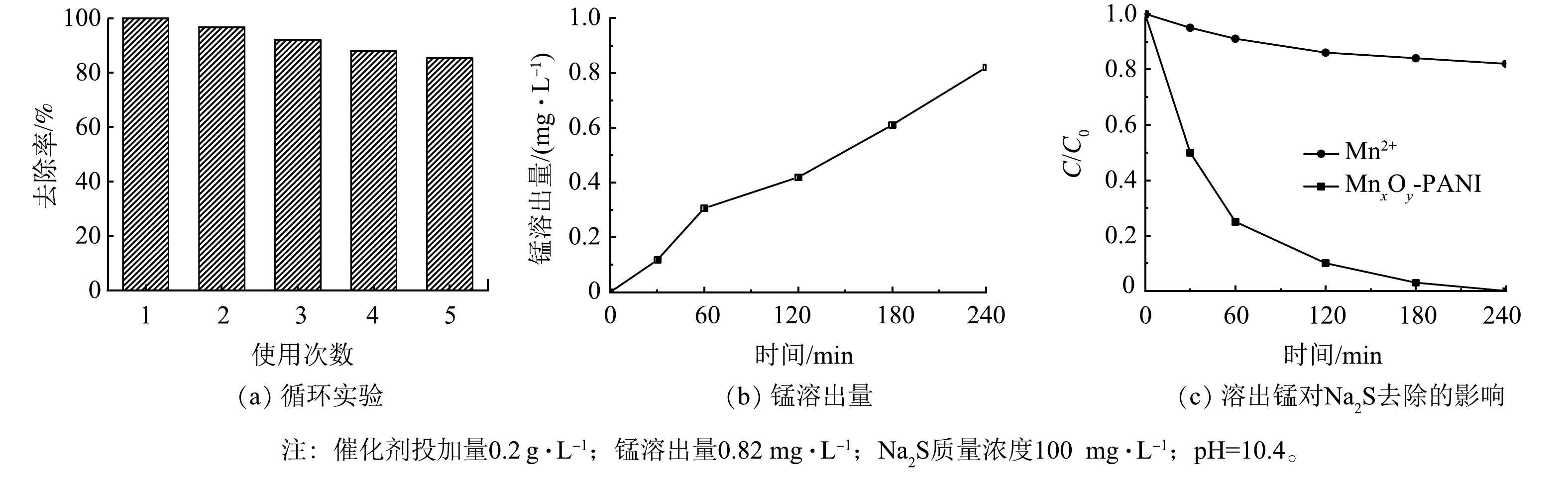
将反应后的催化剂在60 ℃下干燥后再重复利用,以考察MnxOy-PANI的循环利用性。由图6可以看出,催化剂连续重复使用5次后,反应240 min内Na2S的去除率仍可达85%。这表明该催化剂具有良好的循环稳定性。MnxOy-PANI催化氧化Na2S反应过程中锰的溶出量变化如图6(a)所示。240 min时溶液中锰离子含量为0.82 mg∙L−1,未超过《污水综合排放标准》(GB 8978—1996)中总锰最高允许排放质量浓度1.0 mg·L−1。因此,可认为不会对水体造成二次污染。采用同等锰含量的硫酸锰在相同条件下催化氧化Na2S,结果如图6(b)所示。反应240 min内Na2S的去除率为18%,表明溶出的锰对Na2S去除贡献并不大。
2.5 MnxOy-PANI催化剂的选择性氧化
据文献报道[5,8,11],含硫废水处理体系中可能的含硫产物包括硫酸根(
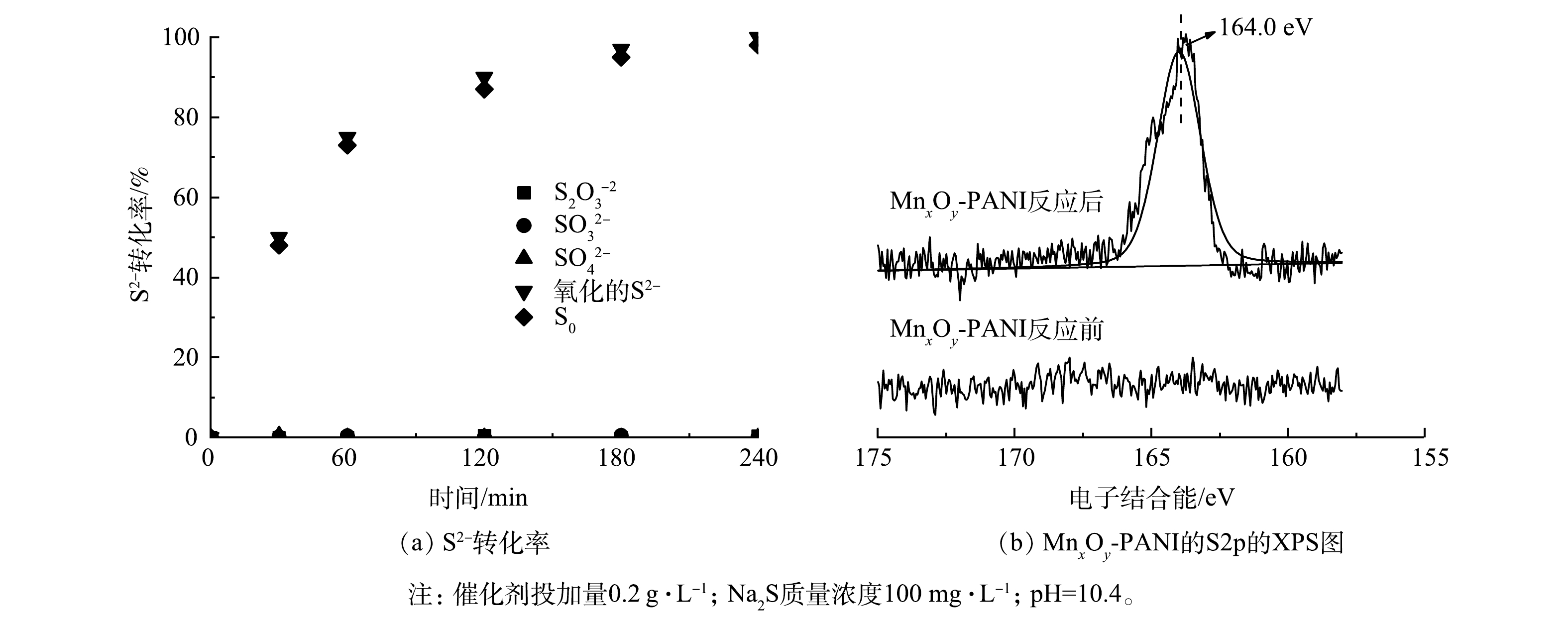
SO2−4 SO2−3 S2O2−3 2S2−+2O2+H2O→S2O2−3+2OH− (2) S2O2−3+O2+OH−→SO2−3+SO2−4+H2O (3) S2−+O2→SO2−3 (4) SO2−3+O2→SO2−4 (5) 2S2−+O2+2H2O→2S0+4OH− (6) 对反应后可能存在的各类含硫物种进行了测定,结果如图7(a)所示。反应过程中并未检测到
S2O2−3 SO2−3 SO2−4 2.6 反应过程机制
催化剂上的缺电子金属离子有利于结合溶液中的富电子离子[29],负载锰氧化物后的MnxOy-PANI对S2−的吸附能力增强。反应物S2−被吸附在活性位点上后,被催化剂上的Mn4+和吸附的氧气氧化为S0,Mn4+转化为Mn3+,催化剂表面的氧空位又将Mn3+重新氧化为Mn4+,从而实现MnxOy-PANI持续催化氧化Na2S,具体过程如式(7)~式(9)所示。MnxOy-PANI反应前后Mn2p3/2的XPS图谱如图8所示。在646.6 eV和642.9 eV处的峰归属于Mn(Ⅳ),641.4 eV处的峰归属于Mn(Ⅲ)。反应前Mn(Ⅳ)和Mn(Ⅲ)含量分别为75%和25%,反应后Mn(Ⅳ)和Mn(Ⅲ)含量分别为52%和48%,这表明部分Mn4+转化为Mn3+。
Mn4++O2−→Mn3++V0+1/2O2(g) (7) S2−+Oads+Mn4+→Mn3++V0+S0+H2O (8) Mn3++V0+O2(g)→Mn4++O2−2→Mn4++Oads+O2− (9) 在这个过程中,催化剂MnxOy-PANI上氮的含量也十分关键,其主要作用表现在以下2个方面。1)如图9(a)、图9(b)所示,PANI的N 1s的XPS图谱中在399.6 eV和401.6 eV处分别出现了对应吡咯氮和四价氮的信号峰[15]。此外,MnxOy-PANI的谱图中在398.2 eV处出现了对应吡啶氮的信号峰[15]。氧分子扩散到催化剂孔中更容易被缺陷位点的吡啶氮原子吸附[14],吡啶氮含量的增加使得MnxOy-PANI催化剂对氧分子吸附能力增强,从而使催化氧化S2−反应更易发生。2)有研究[30]表明,在碱性较强的情况下,S2−氧化生成的S0之间会通过相互作用生成以稳定的链状或者环状结构存在的聚硫化物(α-S8分子);在碱性较弱的情况下,S2−氧化生成的S0高度分散,会被进一步氧化成更高价态的含硫化合物;在酸性条件下,S2−易转换成H2S分子,通常难以被O2或其他氧化剂氧化至S0或更高价态的含硫化合物。MnxOy-PANI催化氧化S2−反应在通常碱性溶液中进行,催化剂上的碱性含氮基团使得反应活性位点的局部碱性进一步增加。因此,在MnxOy-PANI催化氧化S2−的最终产物以S0的形式稳定的存在于催化剂的孔隙中。图9(c)为MnxOy-PANI催化剂反应前后的XRD图谱。催化剂反应后的XRD图谱中出现了对应α-S8的特征衍射峰(JCPDS: 83-2284),这表明反应后生成了α-S8分子[31]。MnxOy-PANI反应前后的拉曼图谱如图9(d)所示。反应后的图谱中在411 cm−1和516 cm−1处出现对应S0的信号峰[32],这表明催化剂上S0的存在。XRD、Raman表征结果共同证明:MnxOy-PANI催化氧化S2−的最终产物S0已在催化剂上稳定存在。
3. 结论
1)以聚苯胺(PANI)为载体,以高锰酸钾为前驱体,通过化学浸渍法制备了MnxOy-PANI催化剂;XRD、FTIR、XPS和SEM表征结果表明,锰氧化物已成功负载到PANI表面。
2)在常温、常压下,以空气为氧化剂,MnxOy-PANI催化剂投加量为0.2 g∙L−1时,催化氧化初始质量浓度为100 mg∙L−1的Na2S模拟废水,在反应240 min内,Na2S的去除率达到100%。同时,该催化剂具有较好的循环稳定性,连续循环5次后,Na2S去除率未见明显下降。
3) MnxOy-PANI对Na2S的氧化表现出较高的催化活性和选择性。这得益于催化剂上的Mn4+/Mn3+氧化还原对和表面含氮基团。催化剂表面的含氮基团一方面能够增强对氧气的吸附能力,协同Mn4+氧化S2−;另一方面起可增强反应活性位点局部碱性,催化氧化S2−并生成难以被进一步氧化的聚硫化物,最后以S0的形式稳定存在于系统中。
-
-
[1] 万仲豪, 李孟, 张倩. 间苯胺改性磁性壳聚糖对六价铬的还原-吸附协同作用机制研究[J]. 环境科学学报, 2018, 38(8): 3118-3126. [2] 张力, 赵勇胜. 六价铬污染模拟含水层的注入型黄原胶凝胶阻截屏障试验研究[J]. 水文地质工程地质, 2023, 50(2): 171-177. [3] 张进德, 田磊, 裴圣良. 矿山水土污染与防治对策研究[J]. 水文地质工程地质, 2021, 48(2): 157-163. [4] 徐衍忠, 秦绪娜, 刘祥红, 等. 铬污染及其生态效应[J]. 环境科学与技术, 2002, 25: 8-9. [5] LIU Z G, ZHANG F S, WU J Z. Characterization and application of chars produced from pinewood pyrolysis and hydrothermal treatment[J]. Fuel, 2010, 89(2): 510-514. doi: 10.1016/j.fuel.2009.08.042 [6] 陈园园, 井琦, 任仲宇. 改性硅藻土负载纳米零价铁去除六价铬[J]. 应用化工, 2020, 49(3): 541-544. [7] MALLICK S, DASH S S, PARIDA K M. Adsorption of hexavalent chromium on manganese nodule leached residue obtained from NH3-SO2 leaching[J]. Journal of Colloid Interface Science, 2006, 297(2): 419-425. doi: 10.1016/j.jcis.2005.11.001 [8] COELHO F D S, ARDISSON J D, MOURA F C, et al. Potential application of highly reactive Fe(0)/Fe3O4 composites for the reduction of Cr(Ⅵ) environmental contaminants[J]. Chemosphere, 2008, 71: 90-96. doi: 10.1016/j.chemosphere.2007.10.016 [9] 平松, 杨茸茸, 吴雷, 等. 改性多孔兰炭末吸附处理模拟含铬废水[J]. 环境工程, 2023, 41(2): 7-15. [10] LI J X, ZHANG X Y, SUN Y K, et al. Advances in sulfidation of zerovalent iron for water decontamination[J]. Environmental Science & Technology, 2017, 51(23): 13533-13544. [11] WEI K, LI H, GU H, et al. Strained zero-valent iron for highly efficient heavy metal removal[J]. Advanced Functional Materials, 2022, 32(26): 2200498. doi: 10.1002/adfm.202200498 [12] RITTER M, WEISS W. Fe3O4(Ⅲ) surface structure determined by LEED crystallography[J]. Surface Science, 1999, 432: 81-94. doi: 10.1016/S0039-6028(99)00518-X [13] HU J, CHEN H, DONG H Y, et al. Transformation of iopamidol and atrazine by peroxymonosulfate under catalysis of a composite iron corrosion product (Fe/Fe3O4): Electron transfer, active species and reaction pathways[J]. Journal of Hazardous Materials, 2021, 403: 123553. doi: 10.1016/j.jhazmat.2020.123553 [14] HU J, HUANG Z Y, YU J M, Highly-effective mechanochemical destruction of hexachloroethane and hexachlorobenzene with Fe/Fe3O4 mixture as a novel additive. Science of the Total Environment. 2019, 659: 578−586. [15] 张震, 陈飞勇, 刘汝鹏, 等. 基于响应曲面法优化的臭氧/过硫酸盐/四氧化三铁工艺对结晶紫的降解[J]. 环境工程学报, 2023, 17(7): 2192-2204. [16] HU J, QIU Y F, GU B, et al. Enhancement mechanism of magnetite on the ball-milling destruction of perfluoro- octane sulfonate by iron [J]. Environmental Pollution, 2023: 121014. [17] ZHANG W, WANG H Z, HUANG J, et al. Acceleration and mechanistic studies of the mechanochemical dechlorination of HCB with iron powder and quartz sand[J]. Chemical Engineering Journal, 2014, 239: 185-191. doi: 10.1016/j.cej.2013.11.018 [18] DENG S S, KANG S G, FENG N N, et al. Mechanochemical mechanism of rapid dechlorination of hexachloro -benzene[J]. Journal of Hazardous Materials, 2017, 333: 116-127. doi: 10.1016/j.jhazmat.2017.03.022 [19] 王文豪. 零价金属及其复合物去除废水中Cr(Ⅵ)的效能与机理[D]. 重庆: 重庆大学, 2022. [20] 张文秋, 史晓国, 刘伟鑫. 湿式球磨法机械化学合成FeS2工艺[J]. 材料科学与工程学报, 2023, 41(3): 502-508. [21] 胡俊, 章献钊, 姚蕾, 等. 活性炭共球磨强化铁/四氧化三铁的六价铬还原性能[J]. 环境科学学报, 2023, 43(10): 116-122. [22] AMBIKA S, DEVASENA M. , NAMBI I M, Synthesis, characterization and performance of high energy ball milled meso-scale zero valent iron in Fenton reaction[J]. Journal of Environmental Management, 2016, 181: 84-855. [23] GU Y, WANG B, HE F, Mechanochemically sulfidated microscale zero valent iron: pathways, kinetics, mechanism, and efficiency of trichloroethylene dechlorination [J]. Environmental Science & Technology, 2017, 51(21): 12653-12662. [24] SHAO Q Q, XU C H, WANG Y H, et al. Dynamic interactions between sulfidated zerovalent iron and dissolved oxygen: Mechanistic insights for enhanced chromate removal[J]. Water Research, 2018, 135: 322-330. doi: 10.1016/j.watres.2018.02.030 [25] WANG W H, HU B B, WANG C, et al. Cr(Ⅵ) removal by micron-scale iron-carbon composite induced by ball milling: The role of activated carbon[J]. Chemical Engineering Journal, 2020, 389: 122633. doi: 10.1016/j.cej.2019.122633 [26] GAN C, LIU Y G, TAN X F, et al. Effect of porous zinc-biochar nanocomposites on Cr(Ⅵ) adsorption from aqueous solution[J]. RSC Advances, 2015, 5(44): 35107-35115. doi: 10.1039/C5RA04416B -







 下载:
下载: