-
铁炭微电解具有操作简单、条件温和的特点而被广泛用于废水净化领域。王宇峰等[1]等利用铁碳微电解预处理高盐废水,其COD去除率约为61.2%。SUN等[2]和赖波等[3]分别利用铁碳微电解净化工业废水,废水TOC的去除率分别约为55.3%和52.6%。由于铁、炭材料处于混合状态,曝气条件下铁材料容易发生钝化、板结,而且氢氧化物会包覆在活性炭的表面,影响活性炭的导电性能,并降低活性炭比表面积,最终致使传统铁炭微电解的污水净化能力下降,同时电偶腐蚀生成的Fe2+容易被氧化为Fe3+,而Fe3+则会进一步消化Fe0,导致废水处理的铁泥量大和成本增加等问题[4-7]。
利用铁、炭之间的电势差,通过形成化学原电池来实现废水污染物的净化与资源回收的研究目前较为稀少。YING等[8]在2个极室内分别放置铁电极和炭电极,以Na2SO4为电解质,采用盐桥方式形成化学原电池,考察了铁电极和炭电极在去除2,4-二氯苯酚的作用机制,但该研究的出发点仍在于探究传统铁炭微电解中的铁电极和炭电极在污染物净化中的作用。LAI等[9]以高纯度铁板作为阳极,炭材料作为阴极,并通过质子膜将两室隔开,获得了98%的废水磷回收率。针对模拟烟气的同步脱硫、脱硝、脱碳,本课题组前期采用铁炭双池原电池反应器进行了实验研究,结果表明,铁炭原电池反应器的脱硫、脱硝、脱碳率分别高达99%、85%和约50%[10]。
相对于传统的铁碳微电解,铁炭原电池反应器的铁、炭相对独立地在各自的反应极室中,铁室中不曝气,而碳室曝气。这样不仅可以避免传统铁碳微电解的铁材料消耗量大、铁泥多的问题,同时避免了铁材料的钝化、板结以及净化效率较低等问题,而且铁室和炭室各自相对独立地净化污染物,该原电池反应器具有更多的污染物净化工艺路线选择。为此,本研究考察了铁炭原电池反应器在高盐废水有机物的净化效果,并进一步探究了操作模式(间隙、半连续和连续)以及影响因素对高盐废水有机物去除的影响规律。
-
本研究中所用废水为国内某煤化工生产企业的反渗透浓缩后的高盐废水。高盐废水的pH为1.70,硫酸根离子的质量浓度为13 100 mg·L−1,氯离子的质量浓度为79 500 mg·L−1,总溶解性固体(TDS)含量为16 8000 mg·L−1,总有机碳(TOC)含量为990 mg·L−1,耗氧有机污染物的浓度(以COD计)为5 500 mg·L−1。实验中所使用的铁粉、活性炭粉末和盐酸均为分析纯。该高盐废水中的主要无机盐分别为NaCl和Na2SO4。
-
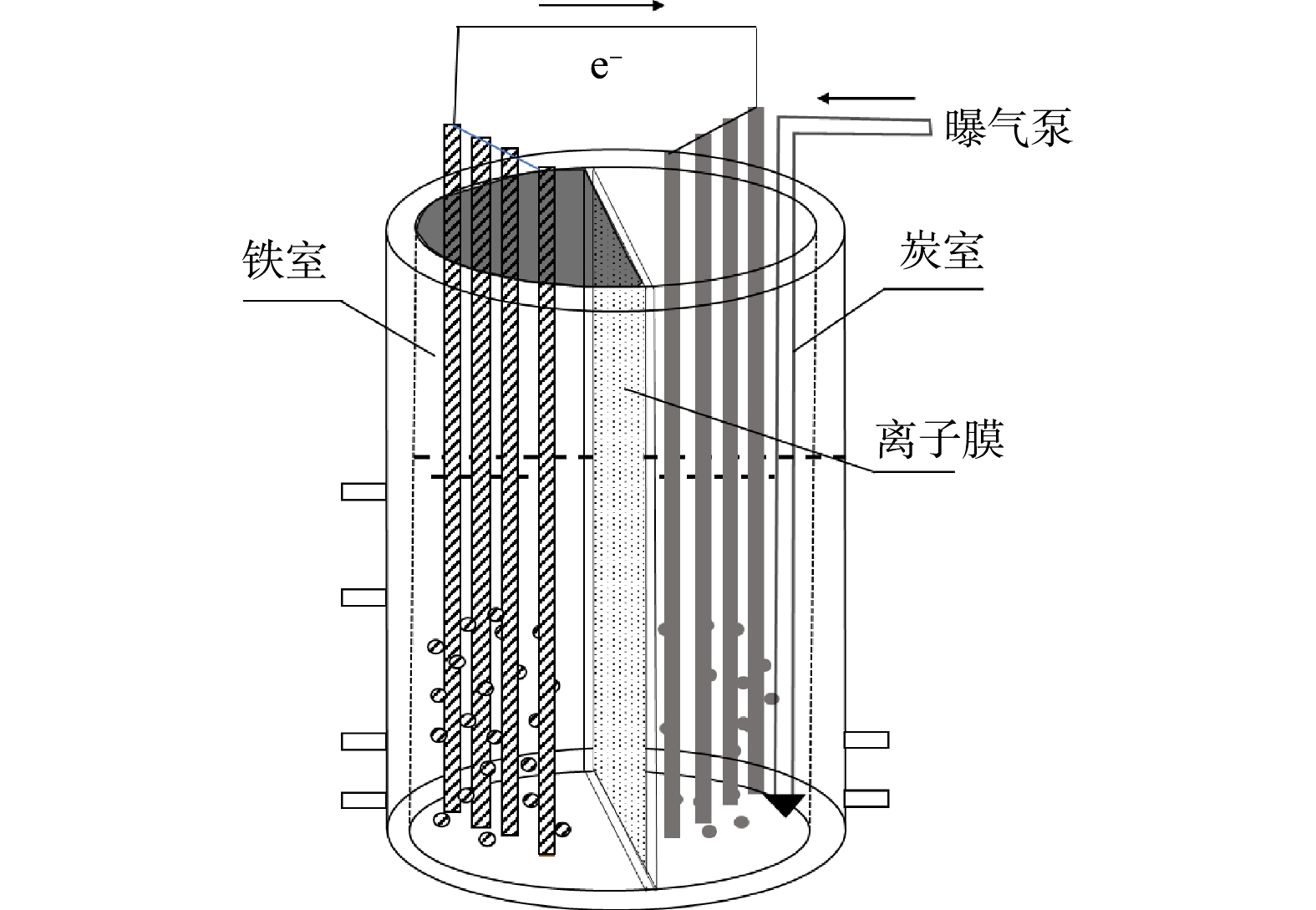
图1为铁炭原电池反应器示意图。铁室与炭室通过阴离子膜(FAA-3-20,Fumasep)分隔。铁室内放置有铁粉和铁电极(φ=4 mm×13 mm)。铁室外侧从上至下设有循环进水口、循环出水口、废水进水口和废水出水口。循环泵型号为HD-602。铁室顶部密封。炭室内放置有活性炭粉末和石墨电极(φ=6 mm×6 mm),外侧从上至下设有废水进水口和废水出水口。炭室曝气,曝气泵为DP-160S。铁电极和石墨电极均先各自采用导线连接后,再通过一根导线把铁电极和石墨电极进行连接。
-
反应器净化性能评价设计了4组实验。实验A断开导线,实验B和实验C均连接导线。实验D为传统铁炭微电解。实验A、B、C和D的铁粉均为新鲜铁粉,实验A、B、D的活性炭为新鲜原料,实验C的活性炭为实验B用过的活性炭。4组实验中的铁粉、活性炭质量比均为1:1,铁粉和活性炭质量均为54 g。实验A、B、C、D均为半连续操作模式。实验A、B、C的铁室和碳室各自的进料流量均为1.0 mL·min−1,实验D的进水流量2.0 mL·min−1。实验A、B、C的铁室和炭室的初始废水体积均为300 mL,而实验D的初始废水体积为600 mL。4组实验处理的总废水体积和净化时间均相同。
操作模式的影响实验。间歇模式,铁室和炭室内分别加入600 mL废水,关闭所有进水口和出水口。半连续模式,前0.5 h内分别向铁室和炭室加入300 mL废水,随后以1.0 mL·min−1的速度向铁室和炭室内各自加入废水。间隙以及半连续模式下,铁室和碳室被离子隔膜完全隔离。连续模式,铁室和炭室的初始废水体积分别为600 mL和300 mL,调节阴离子膜的安装高度以实现铁室废水自动流入炭室。连续操作模式下,废水由铁室进水口进入,随后越过离子膜顶部流入炭室,随后从碳室下部的出水口流出。铁室进水流量与碳室出水流量均为1.0 mL·min−1。本研究中的铁粉和活性炭用量均按照初始废水质量的15%投加。
操作因素的影响实验。在半连续操作模式下分别考察固液比(铁粉或活性炭粉末与初始废水的质量百分比)、废水pH以及废水流量对有机物净化的影响。固液比影响实验:在初始pH为1.70、进水流量为1.0 mL·min−1的条件下,设置固液比分别为5%、10%和15%。废水pH的影响实验:在固液比为15%、进水流量为1.0 mL·min−1的条件下,pH分别设为1.00、1.30和1.70。进水流量的影响:在固液比为15%、pH为1.70的条件下,设置流量分别为0.3、0.6和1.0 mL·min−1。以上实验中铁粉与活性碳质量比均为1:1。本研究中实验时间均为5 h,铁室的循环泵和炭室的曝气泵均常开,曝气流量和废水循环流量固定为3.0 L·min−1。
-
实验过程中每15 min记录1次铁室和炭室的氧化还原电位(oxidation-reduction potential, ORP)、pH和电流(I)。每1 h取水样进行有机物含量分析。ORP(ORP分析仪,型号SX630,Labsen)和pH(pH计,Phb-4,雷磁)均测定溶液中部位置。水样从溶液中部位置采取。万用表(DEM11,DELIXI ELECTRIC)测定电流。
废水有机物含量用TOC表示。TOC采用总有机碳分析仪(TOC-VCPH,岛津,日本)测定。TOC去除率根据式(1)进行计算。
式中:η为TOC去除率,%;Ct和C0分别为TOC采样质量浓度和初始质量浓度,mg·L−1。
-
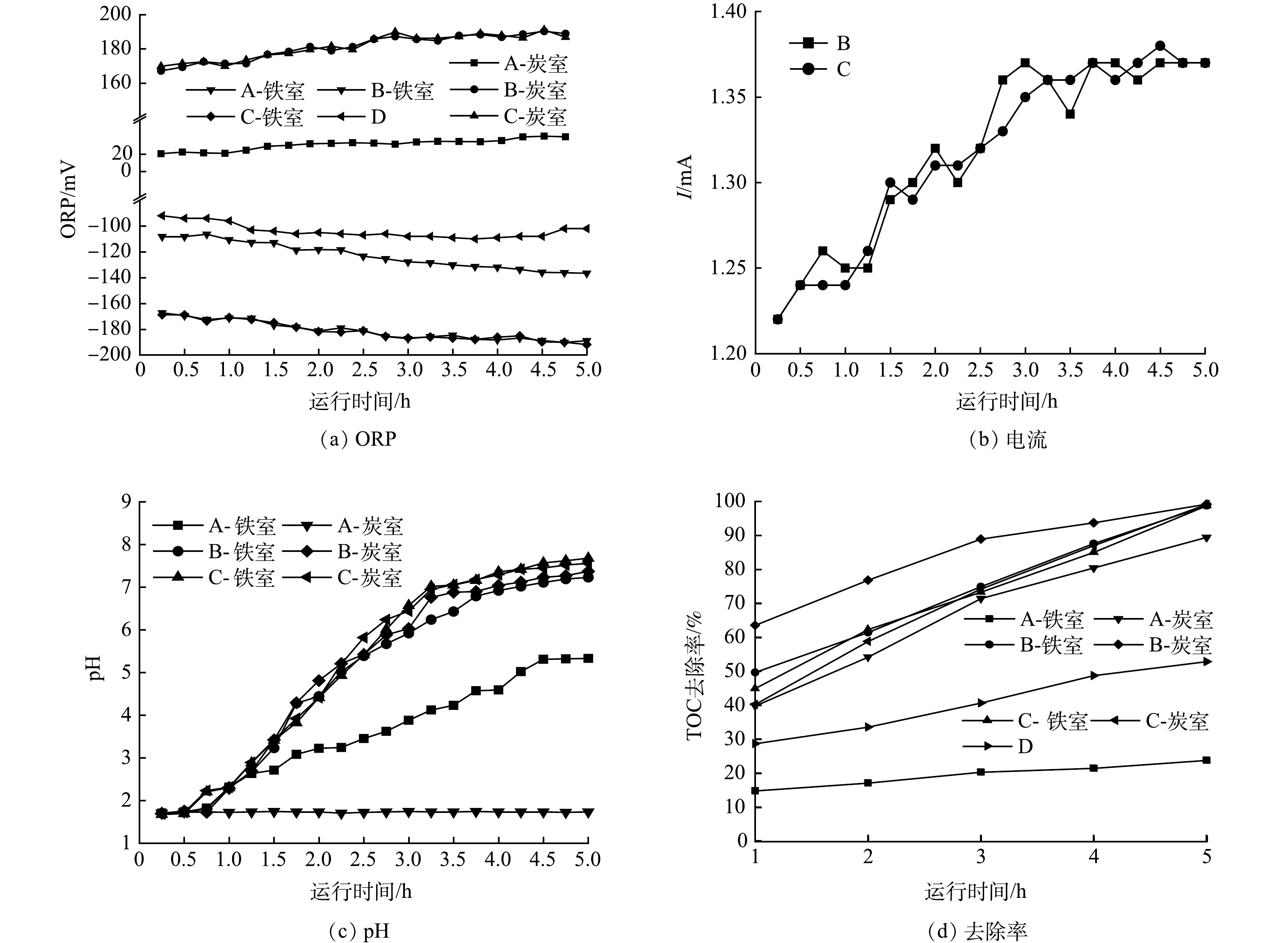
1)反应器净化性能分析。由图2(a)可见,在5 h内,实验A的炭室ORP由20.3 mV逐步升至30.2 mV,铁室ORP则由−108.2 mV下降至−136.6 mV;实验B的炭室ORP则由167.2 mV上升至188.9 mV,铁室ORP由−167.3 mV降至−188.9 mV;实验C的铁室ORP和炭室ORP与实验B的结果基本一致;实验D的ORP则基本在−100 mV附近。ORP检测结果表明,单纯铁粉环境下的ORP要比微电解下的ORP更负,而原电池反应器的铁室ORP则明显更负,说明原电池铁室的还原性比单纯的铁粉以及微电解的还原性更强;导线断开时的炭室ORP比原电池的炭室的ORP小,说明原电池的炭室的氧化性更强。由ORP可见,原电池的铁室具有更为显著的还原性,而炭室具有明显的氧化性。显然,该现象有利用铁炭原电池反应器对高盐废水中有机物的净化。图2(b)为电流变化情况。可见,实验A和D无电流,实验B和C有电流。实验B和实验C的电流数值及其变化趋势相似,初期电流约为1.26 mA,5 h后升至1.37 mA,电流在前3 h上升较为明显,随后电流趋于稳定。
图2(c)为pH的变化趋势。可见,在5 h内,实验A的铁室废水pH由1.70升至5.33,炭室废水pH基本稳定在1.70附近;实验B中铁室和炭室的pH由初期的1.70分别升高至结束时的7.23和7.74;实验C铁室和炭室的pH由初始的1.70分别升高至结束时的7.68和7.56;实验D的pH由初期的1.70升高至4.70,且其pH在前135 min变化较为明显,随后pH变化缓慢。废水净化过程中pH变化幅度从大到小的顺序为原电池反应器的铁室和炭室>单纯铁粉处理>铁炭微电解以及活性炭吸附过程。废水中pH的变化表明这4组实验在有机物净化之间的差异性。铁炭微电解过程中废水pH在前135 min升高明显,但随后变化缓慢,其原因可能与铁粉的表面钝化有关。单纯铁粉处理过程中的铁粉仅发生酸腐蚀作用,但由于没有曝气,因此,铁粉表面的钝化现象比铁炭微电解的要弱,因此,pH呈现不断上升的趋势。铁炭原电池反应器不仅避免了铁粉的钝化现象,同时也保留了酸腐蚀与间接电偶腐蚀,因此,其废水的pH最高,其最终的pH环境也有利于避免传统铁炭微电解的返色现象。
图2(d)为废水TOC去除率的5 h变化趋势。铁室和炭室中废水TOC去除率均随时间而增加。实验A的铁室的净化效果较差,最终的TOC去除率仅为23.8%;而炭室对TOC的去除效果相对较好,TOC去除率可达89.4%。实验B中的铁室对TOC去除率约为98.8%,而炭室TOC去除率约为99.2%。实验C中的铁室废水TOC去除率约为98.7%,而炭室废水TOC去除率约为99.1%。实验D中TOC去除率约为52.80%。比较4组实验中的TOC去除率可知,铁炭原电池反应器对高盐废水中有机物净化效果较好,远远优于单纯的铁粉处理效果,也明显优于传统铁炭微电解(实验D)效果,也比单纯活性炭的吸附效果要好。由此可见,铁炭原电池反应器对高盐废水有机物净化具有显著优势。比较实验B和C的炭室净化效果发现,活性炭是否更换对TOC的净化效率影响较小。该现象表明活性炭在该原电池反应器中无需更换,可以重复使用。
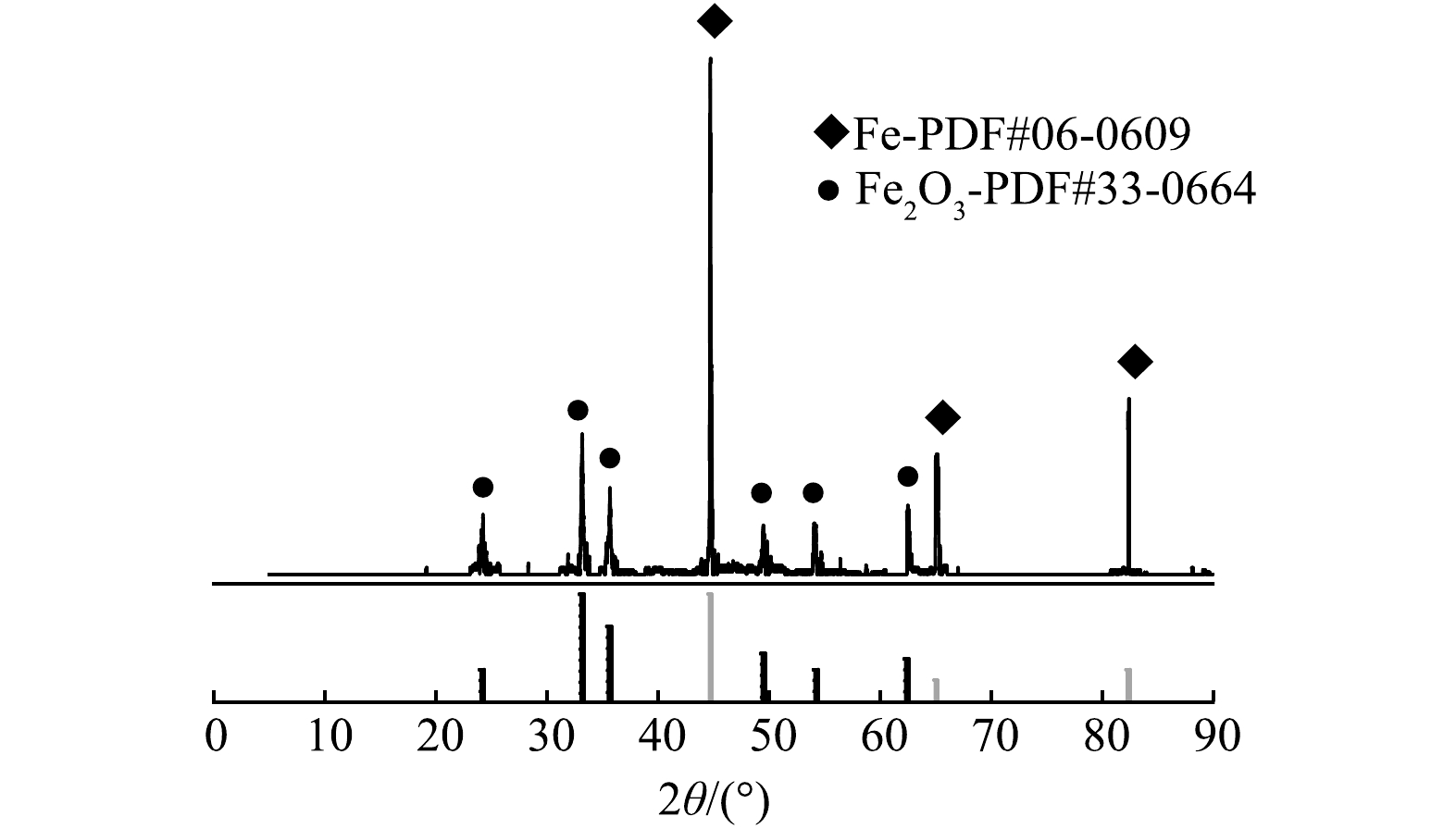
2)反应器净化原理分析。依据铁水体系的pH-电位相图[11]以及本课题组测定的铁电极电势[10],本研究中铁室不会出现Fe3+,只有Fe2+。本研究在实验结束后对铁室粉末固体进行分离、干燥、煅烧与称重。同时对煅烧粉末进行了X射线衍射(XRD)分析,发现粉末中只有铁粉和氧化铁(图3)。依据质量衡算,铁室对单位体积高盐废水5 h处理所消耗的铁粉质量为6.4~6.9 kg·m−3。依据废水pH以及氢氧化亚铁溶度积,理论分析铁室应该会生成氢氧化亚铁。根据文献[10],炭室电极电势可达0.80 V以上,而氧气与氢离子生成双氧水的标准电极电势约为0.68 V[12],显然,炭室会产生双氧水。
综上所述,本铁炭原电池反应器对高盐废水有机物的去除途径为:铁室主要通过电化学氧化还原、铁单质的化学氧化还原[13]以及氢氧化亚铁吸附;炭室主要通过电化学氧化还原、活性炭吸附以及双氧水化学氧化还原。
-
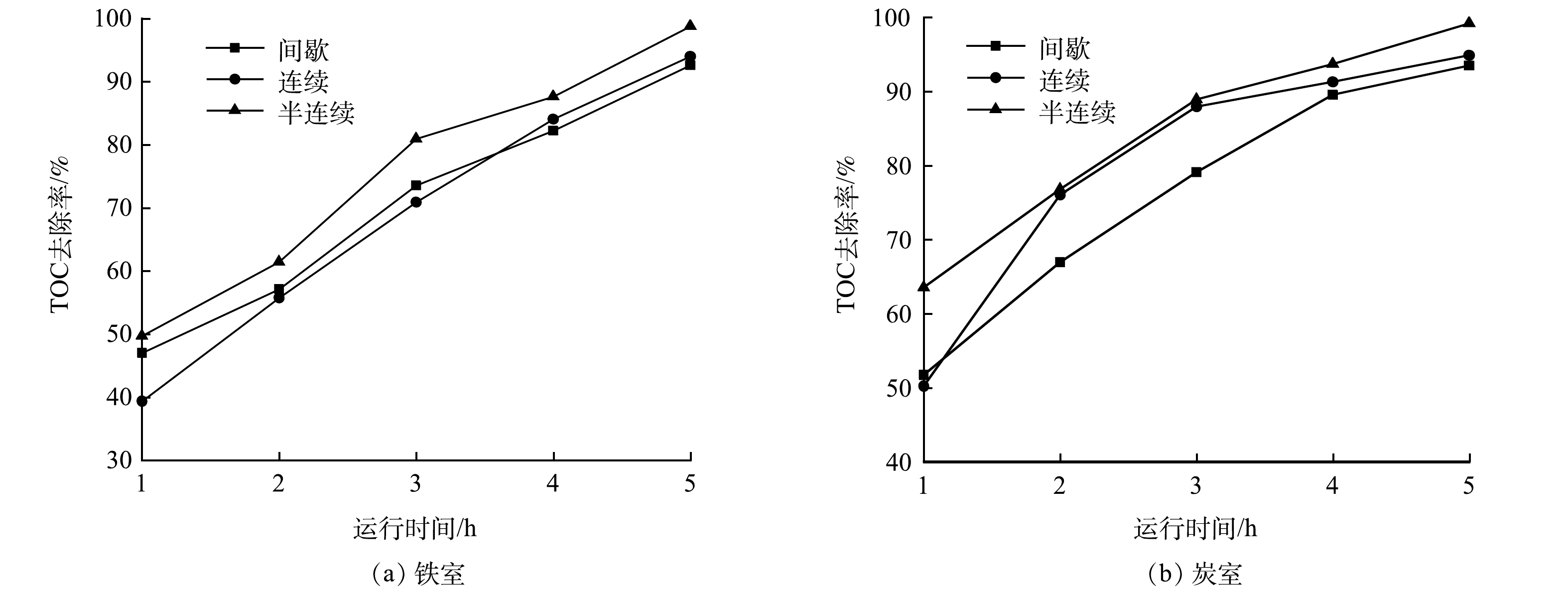
图4(a)和图4(b)为不同操作模式下铁室和炭室对废水TOC的去除率变化趋势。在3种模式下,铁室和炭室中废水TOC去除率均逐渐上升。总体上,无论是铁室还是炭室,半连续操作模式下高盐废水TOC去除效率最高,间歇模式的净化效果相对要差一些。间歇模式、连续模式以及半连续模式下,5 h后铁室废水TOC去除率分别为92.6%、94.0%和98.8%,炭室废水TOC去除率分别为93.5%、94.9%和99.2%。由此可见,铁炭原电池反应器的半连续操作模式为最佳模式。因此,后续实验中选择半连续操作模式,在此基础上考察固液比、废水pH以及废水流量对废水有机物净化的影响规律。
-
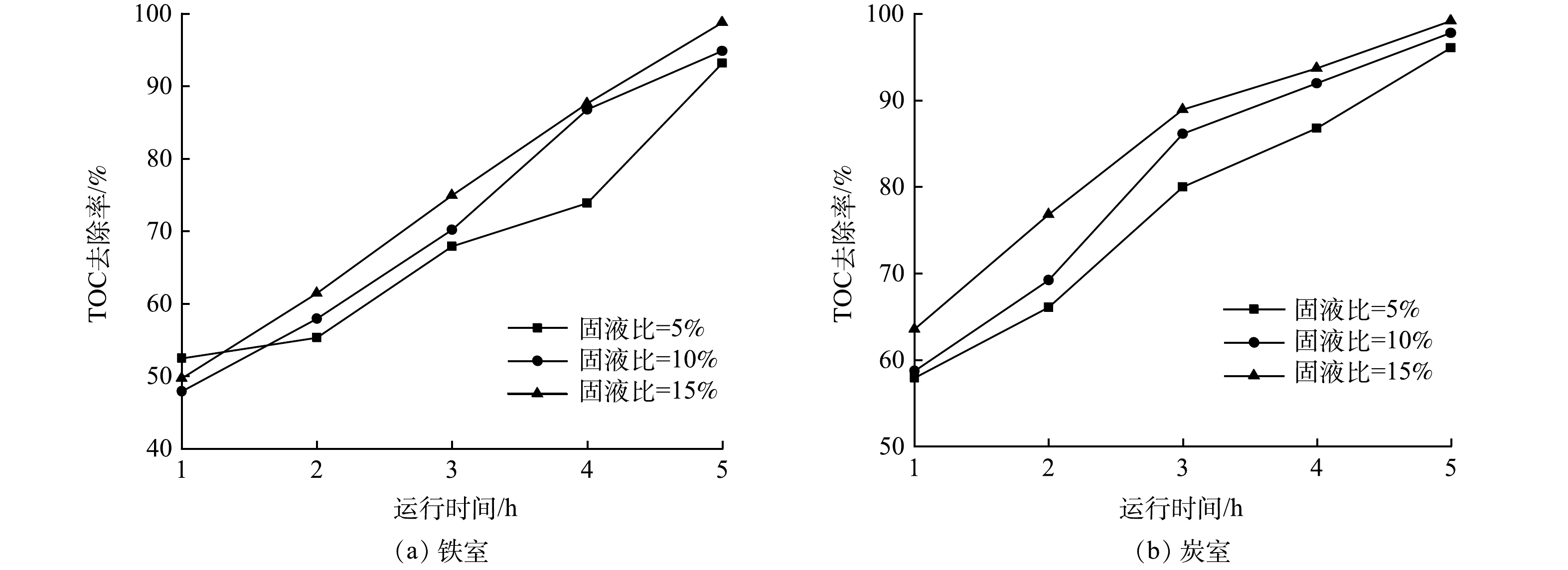
1)固液比的影响。图5(a)和图5(b)为不同固液比时铁室和炭室对废水TOC去除率的变化趋势。可见,铁室和炭室对废水TOC的去除率均随时间的增加而上升。铁室以及炭室对高盐废水中有机物的去除效率随固液比增加而升高。在固液比分别为5%、10%和15%时,5 h后铁室对废水TOC去除率分别为93.2%、94.9%和98.8%,而炭室对废水TOC去除率分别为96.1%、97.8%和99.2%。显然,高固液比有利于铁室和炭室对废水中TOC的去除。其原因是固液比的增加使得相同体积的废水中的单质铁和活性炭浓度上升,与铁电极和石墨电极的接触和碰撞概率更高,电化学反应场所扩大,电子转移数量增加,废水有机物的去除速率增加。因此,增加铁炭原电池反应器的固液比有利于提升对高盐废水中TOC的去除率。
2)初始pH的影响。图6(a)和图6(b)分别为pH对铁室和炭室废水TOC的去除率的影响趋势。3种不同pH情况下,铁室和炭室中废水TOC的去除率均随时间延长而上升。总体上,前4 h时pH较低时的去除率曲线位于最上面,而pH较高时TOC去除率曲线位于下面。但5 h后,pH对废水TOC的去除率影响不大。废水pH为1.0、1.3和1.7时,5 h后铁室对废水TOC去除率分别为98.7%、98.8%和98.8%,而炭室对废水TOC的去除率分别为99.2%、99.0%和99.2%。废水pH会影响铁室和炭室的氧化还原性能和电极电位[10],最终影响废水中有机物的去除。依据废水TOC的去除效果,选择原始废水pH为佳。
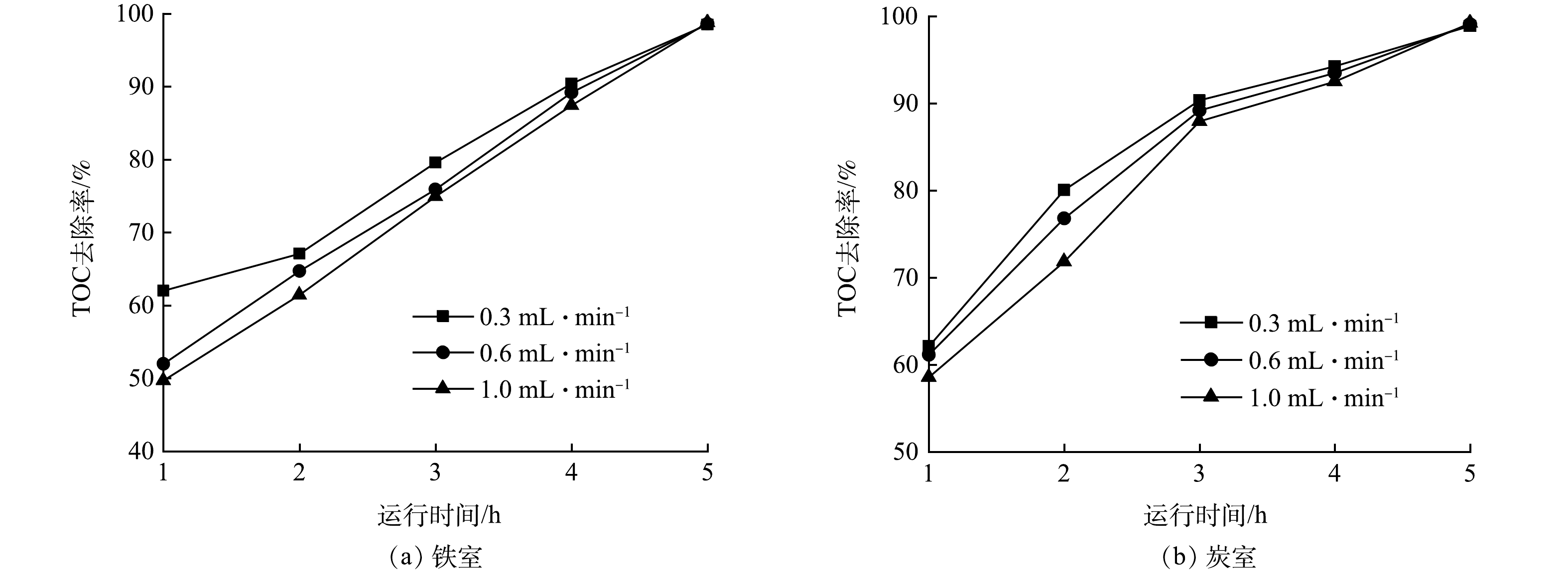
3)进水流量的影响。图7(a)和图7(b)为进水流量对废水TOC的去除率的影响情况。总体上,处理的前4 h无论是铁室还是炭室,当废水流量较低时,对应的TOC去除率要高一些。然而在5 h后则是废水流量较高时废水TOC去除率要稍高一些,但差异性并不大。当流量为0.3、0.6和1.0 mL·min−1时,5 h后铁室废水TOC去除率分别为98.5%、98.6%和98.8%,炭室废水TOC去除率分别为98.9%和99.1%和99.2%。TOC去除率随流量变化的原因应该与物料流动状态、有机物负荷以及氢离子含量有关。依据废水有机物去除效率以及废水处理体积,选择1.0 mL·min−1的为最佳流量。
-
1)铁炭原电池反应器对于高盐废水有机物具有显著的净化效果,其净化效率远高于单纯的铁粉处理,明显优于传统铁炭微电解,也优于活性炭吸附方法。
2)铁室和炭室主要通过电化学氧化还原、吸附与化学氧化还原作用对高盐废水有机物进行去除。该反应器主要消耗铁粉,而活性炭可重复使用。
3)在固液比为15%、pH为1.7、流量1.0 mL·mim−1的较佳操作条件下,铁炭原电池反应器的铁室和炭室的最佳操作方式为半连续模式。
4)在固液比为15%、pH为1.7、流量1.0 mL·mim−1操作条件下,铁炭原电池反应器的铁室对高盐废水TOC的去除率可达98.7%以上,而炭室对高盐废水TOC的去除率可达99.1%以上。
铁炭原电池反应器净化高盐废水初探
First exploration on the purification of high salinity wastewater by iron-carbon primary battery reactor
-
摘要: 利用铁、炭间接电偶腐蚀原理,设计了铁炭原电池反应器。围绕该反应器对高盐废水总有机碳(TOC)的净化性能、操作模式(间歇、连续与半连续)以及影响因素等方面进行了研究。结果表明:铁炭原电池反应器的铁室具有良好的还原性,炭室具有良好的氧化性,高盐废水有机物的去除效果显著;反应器的半连续操作模式对高盐废水有机物去除效果最佳;半连续模式下的较佳操作条件为:固液比为15%,pH=1.7,流量为1.0 mL·min−1。在较佳操作条件下,铁室对废水TOC的去除率可达98.7%以上,而炭室对废水TOC的去除率可达99.1%以上。Abstract: An iron-carbon primary battery reactor has been designed in this study using the principle of indirect galvanic corrosion of iron and carbon. The purification performance, operation mode (batch mode, continuous mode and semi continuous mode) and influencing factors of the reactor removing total organic carbon (TOC) from high salinity wastewater were experimentally explored. The results show that for the iron-carbon primary battery reactor, its iron chamber had a good reducibility, its carbon chamber had a good oxidability, and the removal effect of organic matter in high salinity wastewater was significant; The semi continuous operation mode of the reactor had the best removal effect on organic matter in high salinity wastewater; Under the semi continuous operation mode, the optimal operating conditions were following: the solid-liquid ratio of 15%, pH=1.7, and the flow rate of 1.0 mL·min−1. Under optimal operating conditions, TOC removal rate from wastewater by the iron chamber could reach over 98.7%, while TOC removal rate from wastewater by the carbon chamber could reach over 99.1%.
-
Key words:
- wastewater /
- iron-carbon primary battery /
- reactor /
- purification /
- organic carbon
-
黄河是我国第二大长河,全长5 464 km,流经青海、山东等9省区,是我国重要的生态安全屏障。黄河流域是人口活动和经济发展的重要区域。2021年,国务院将黄河流域的生态保护与高质量发展作为国家重要发展战略。重金属污染物进入水环境中,其中少部分重金属以溶解态形式存在于水体中,大部分则通过与水体中悬浮物作用,以不同形态存在于沉积物中[1],因此,沉积物既是重金属污染的汇,又成为了一个重要的污染源[2]。当水体环境发生变化,沉积物中以较强迁移形态存在的重金属可能会再度被释放,不仅会引发水体二次污染[3],同时也会通过食物链累积或其他暴露途径危害水生生态系统,进而威胁人类健康[4-5]。因此,针对沉积物中重金属的因赋存形态不同从而造成的生态风险与人类健康风险进行分析评价,对深入了解黄河流域重金属污染现状具有重要意义。
沉积物中重金属形态的风险评价主要包括生态风险和健康风险评价两大类。评价方法多基于重金属总量[6-8],这些方法一定程度上能反映该地区的重金属富集程度。但随着研究的深入,发现沉积物重金属的迁移释放能力和生物可利用性与其在沉积物中的赋存形态密切相关[9]。基于重金属形态的重金属风险评价标准[10-11] (Risk assessment code,RAC)、次生相与原生相分布比值[12]等生态风险评价方法可用以描述重金属的迁移能力大小与生物可利用性强弱,从而评估重金属对生态环境造成的危害。结合健康风险评价,可对人体因长期暴露于污染环境中所受到的损害进行定量计算。EMENIKE等[7]对干湿季的尼日利亚Atuwara河沉积物中重金属进行健康风险评价,结果显示2个季节中儿童经过口摄入As、Cd、Cr和Ni的非致癌风险均超过安全限值。WOJCIECHOWSKA等[5]对波兰北部两条河流的沉积物重金属进行非致癌健康风险分析发现,在皮肤接触暴露途径中Cr的非致癌健康风险值最高,但未超过人体可接受范围。LI等[13]在研究湘江流域表层沉积物样品时发现,S4和S5站点Pb对成人和儿童有潜在的非致癌健康风险。我国健康风险评价方法起步较晚,有关黄河流域重金属健康风险研究多集中于水体和灌溉农田土壤[14-15],对沉积物的健康风险评价较少。沉积物中重金属的残渣态主要存在于原生矿和次生矿的矿物晶格中,迁移性弱,对人体危害性小,若直接使用重金属总量指标进行评价,易造成风险值高于实际风险值的情况[16]。而针对黄河沉积物的可利用态重金属含量进行健康风险评估,能更客观地反映沉积物中重金属存在的健康风险。因此,将生态风险和健康风险评价相结合,以重金属不同赋存形态的含量为依据,定性定量的评估重金属污染对生态和人体造成的风险,可降低单一评价方式所产生的遗漏或误判的影响[17],从而对黄河干流表层沉积物中重金属污染进行综合评价。
本研究在黄河干流全流域内进行沉积物样品采集,重点分析表层沉积物样品中重金属的赋存形态及空间分布情况,通过计算重金属风险评价标准、次生相与原生相分布比值以及健康风险指数,对黄河干流沉积物中重金属各赋存形态的分布、生态风险及对人类对重金属暴露风险进行综合评估,为黄河流域重金属污染防治提供参考。
1. 实验部分
1.1 样品采集和处理
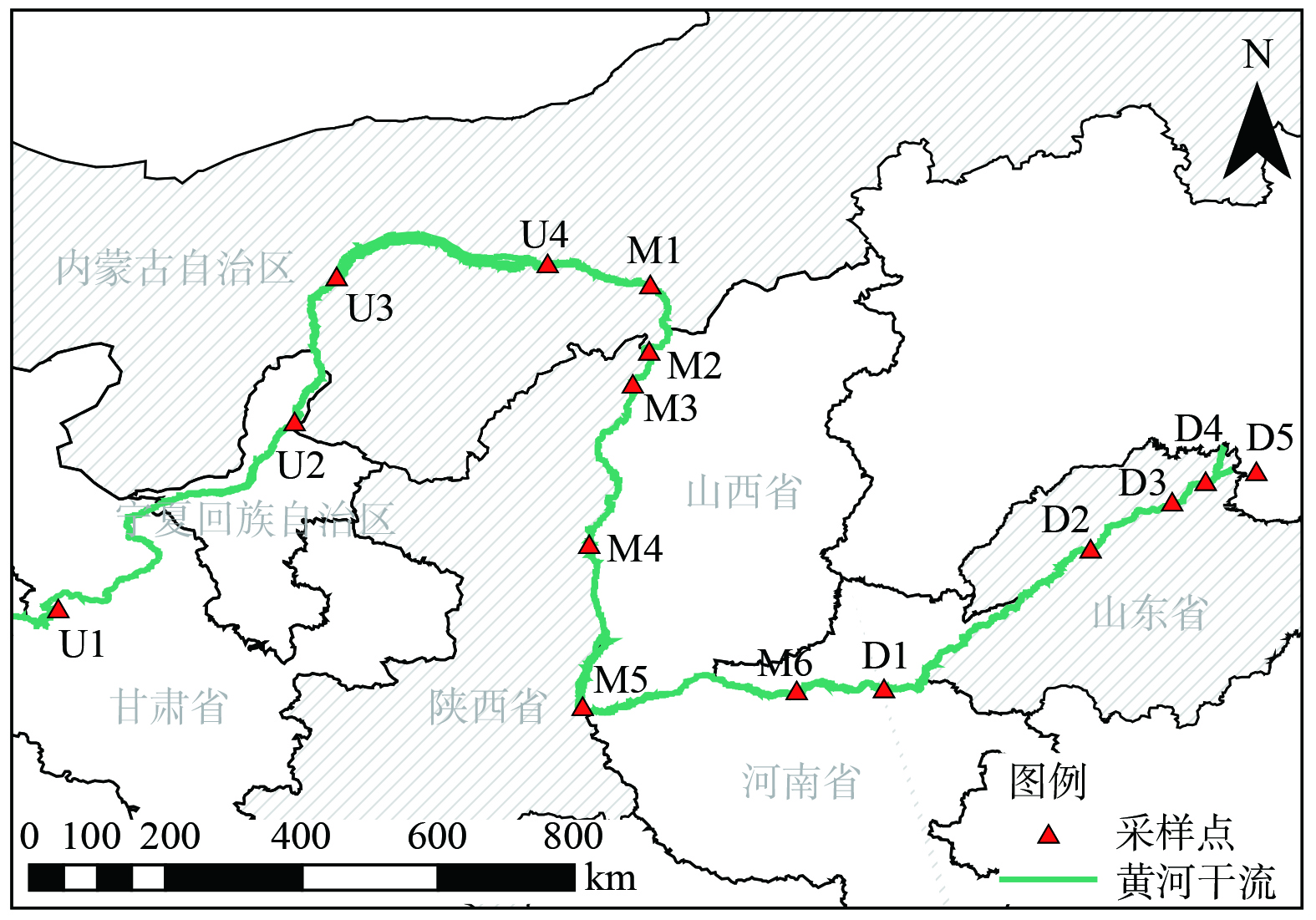
2020年9月至11月,在黄河干流内均匀采集15个表层沉积物样品,部分采样点受各河段工农业发展、大型工程建设和迁建政策等人类活动影响。具体采样点位置分布如图1所示,采样点名称和地理位置如表1所示。其中,U1~U4位于上游、M1~M6位于中游、D1~D5位于下游。表层沉积物使用彼得逊采泥器采集,采集深度均为0~20 cm,样品封存后及时运回实验室保存,取适量样品冷冻干燥24 h至恒重,用研钵研磨过150目尼龙筛备用。
表 1 采样点名称与地理位置Table 1. Sample point name and geographical location编号 采样点名称 地理坐标 U1 刘家峡 35°56′13.22″N,103°20′51.06″E U2 银川 38°21′35.93″N,106°24′52.24″E U3 三盛公 40°18′34.88″N,107°1′49.9″E U4 画匠营子 40°31′52.55″N,109°55′28.49″E M1 神泉 40°11′11.62″N,111°12′45.33″E M2 河曲 39°21′10.27″N,111°10′57.27″E M3 府谷 38°57′47.06″N,110°59′30.3″E M4 永和 36°50′10.12″N,110°24′59.61″E M5 潼关 34°36′36.03″N,110°17′16.91″E M6 七里铺 34°51′33.08″N,113°5′32.42″E D1 封丘浮桥 34°54′21.41″N,114°16′19.67″E D2 泺口 36°43′31.8″N,116°59′18.74″E D3 滨州黄河浮桥 37°20′25.19″N,118°3′35.09″E D4 胜利 37°36′17.5″N,118°31′48.51″E D5 入海口浮桥 37°45′35.42″N,119°9′53.51″E 1.2 沉积物重金属形态提取方法与含量测定
取0.25 g处理好的沉积物,按照沉积物金属元素总量消解法进行微波消解,消解液使用1% (质量分数) 硝酸定容,再用0.22 μm聚醚飒 (Polyethersulfone,PES) 滤膜过滤后待测。沉积物重金属的赋存形态提取使用改进的BCR方法[18],提取形态为弱酸态 (F1) 、可还原态 (F2) 、可氧化态 (F3) 、残渣态 (F4) 4种。具体步骤为参考文献[18-20]。
1) 弱酸态 (F1) 。取1.00 g样品,加20 mL醋酸溶液 (0.11 mol·L−1) ,摇床振荡16 h,离心10 min (4 000 r·min−1) ,取上清液加1.5 mL的浓HNO3,摇匀后定容。2) 可还原态 (F2) 。向F1的残渣中加入20 mL盐酸羟胺溶液 (pH=1.5,浓度为0.5 mol·L−1),振荡16 h,离心、转移步骤同F1。3) 可氧化态 (F3) 。向F2的残渣中加5 mL的30% (质量分数) 双氧水 (pH=2~3) ,静置1 h后,在85 ℃水浴条件下消解,再次加入5 mL的30% (质量分数) 双氧水重复在85 ℃水浴条件下消解,取出加入1.0 mol·L−1的乙酸铵溶液25 mL (pH=2) ,振荡16 h,离心、转移步骤同F1。4) 残渣态 (F4) 。同沉积物中重金属总质量分数处理方法一致,使用HF-HClO4微波消解后待测。重金属的总质量与各形态质量分数均采用电感耦合等离子体质谱仪 (ICP-MS) 检测,采用内标法定量分析。实验过程中使用水系沉积物标准物质GBW07309 (GSD-9) 做全程质量控制。BCR提取的赋存形态质量分数之和与沉积物金属总质量相比,回收率为80%~120%。
1.3 评价方法
1) 重金属风险评价标准 (Risk assessment code,RAC) 。重金属风险评价标准指弱酸态F1占总质量的百分比,用以评价重金属迁移性和生物活性的大小[19]。RAC值越大,重金属的迁移性越强,生物活性越高,风险值越大;反之则越弱。RAC<1%时,沉积物中重金属对水环境无风险;1%≤RAC≤10%时,低风险;11%≤RAC≤30%时,中等风险;31%≤RAC≤50%时,高风险;RAC>50%,极高风险。
2) 次生相与原生相分布比值法。沉积物中原生矿物称为原生相,即本研究中的残渣态,原生矿物风化后产物和外来物质称为次生相,即本研究中的可利用态 (弱酸溶态、可氧化态与可还原态含量总和) [12]。计算公式如式 (1) 所示。
KRSP=MsecMprim×100% (1) 式中:Msec为沉积物次生相的重金属质量分数,mg·kg−1;Mprim为沉积物原生相的重金属含量质量分数,mg·kg−1。比值KRSP可用以表述该地区重金属污染现状。KRSP<100%,无污染;100%≤ KRSP<200%,轻度污染;200% ≤KRSP<300%,中度污染;KRSP≥300%,重度污染。
3) 健康风险评定方法。依据美国环境总署(U.S. Environmental Protection Agency, EPA)公布的土壤健康风险评价模型,对黄河沉积物中重金属可利用态含量对人体造成的危害进行健康风险评估。将重金属分为致癌污染物 (As、Cd、Cr、Ni) 和非致癌污染物 (Cu、V、Zn、Pb) 。一般认为,致癌污染物也会产生非致癌风险,故对9种重金属进行非致癌风险评价,对As、Cd、Cr、Ni这4种重金属进行致癌风险评价。沉积物中重金属元素一般通过口摄入、呼吸摄入和皮肤接触3种方式进入人体内,计算公式如[21]公式(2)~(4),其中C为不同河段沉积物中重金属可利用态含量,其余各参数值见表2。重金属的非致癌健康风险评估模型如公式(5)~(6)。
表 2 人体健康风险评价模型参数[6]Table 2. Parameters of human health risk assessment model参数 物理意义 单位 取值 成人 儿童 BW 体重 kg 70 15 CF 单位转化因子 kg·mg−1 10−6 10−6 IR1 土壤颗粒摄入量 mg·d−1 100 200 IR2 呼吸频率 mg·d−1 20 7.65 ED 土壤暴露持续时间 a 24 6 EF 土壤暴露频率 d·a−1 350 350 SA 暴露皮肤面积 cm2 5 700 2 800 AF 皮肤的粘附系数 mg·cm−1·d−1 7×10−2 2×10−1 ABS 皮肤吸收因子 无量纲 1×10−3 1×10−3 PEF 灰尘排放因子 m3·kg−1 1.36×10−9 1.36×10−9 AT 平均总暴露时间 d ED×365 (非致癌) ED×365 (非致癌) 70×365 (致癌) 70×365 (致癌) ADD口=(C×IR1×CF×EF×ED)/(BW×AT) (2) ADD皮肤=(C×CF×SA×AF×ABS×EF×ED)/(BW×AT) (3) ADD呼吸=(C×IR2×EF×ED)/(BW×PET×AT) (4) HQ=ADD/RfD (5) HI=∑ni=1HQi=HQ口+HQ皮肤+HQ呼吸 (6) 式中:RfD为各重金属的参考剂量,mg·(kg·d)−1,具体参数如表3所示,HQ为危险商,HI是总的非致癌健康风险值。当HQ<1或HI<1时,健康风险值较小;当HQ>1或HI>1时,则存在严重的非致癌风险。
Table 3. Reference values and carcinogenic slope factors of heavy metals暴露途径 RfD/(mg·(kg·d)−1) CSF/(kg·(d·mg)−1) 口 呼吸 皮肤 口 呼吸 皮肤 As 3.00×10−4 3.01×10−4 1.23×10−4 1.50 1.50×101 3.66 Cd 1.00×10−3 1.00×10−3 1.00×10−5 1.8 6.30 3.80×10−1 Cr 3.00×10−3 2.86×10−5 6.00×10−5 5.00×10−1 4.20×101 1.00×10−3 Cu 4.00×10−2 4.02×10−2 1.20×10−2 / / / Ni 2.00×10−2 2.01×10−2 5.40×10−3 / 8.40×10−1 / Pb 3.50×10−3 3.52×10−3 5.25×10−4 / / / Zn 3.00×10−1 3.00×10−1 6.00×10−2 / / / V 5.00×10−3 / / / / / 重金属的致癌健康风险评估模型如式 (7) 和 (8) 所示。
CR=ADD×CSF (7) TCR=∑ni=1ADDi×CSFi (8) 式中:CSF为各重金属的参考剂量,具体参数如表3所示;CR是重金属致癌风险的概率;TCR是总的致癌健康风险值,是3种途径致癌风险概率之和。以EPA提出的人体接受水平10−6~10−4为标准,当CR<10−6时,致癌风险可忽略,当CR>10−4时,存在较强的可致癌风险。
2. 结果与讨论
2.1 沉积物中重金属总量与形态分布特征
黄河表层流域沉积物中不同重金属的总量与赋存形态空间分布如图2所示。其中,弱酸态 (F1) 、可还原态 (F2) 和可氧化态 (F3) 的组分是可提取的,也被称为可利用态,具有一定的潜在风险。按照F1、F2、F3的顺序,不同赋存形态的迁移性和生物可利用性逐渐加强,F1对外界环境变化最为敏感[24]。残渣态 (F4) 重金属形态稳定,一般条件下难以进行迁移转化,生物可利用性最弱[25]。
沉积物中Cd的F1和F2提取态占比较大,平均值分别为25.2%和16.98%,这与2008年黄河水系沉积物调查结果相似[26]。此外,贵州草海[3]、长江河口[20]、恒河[10]等流域表层沉积物中Cd的可利用态含量均较高。Cd总质量分数在黄河干流呈现先增长再下降趋势,平均质量分数为0.24 mg·kg−1,上游、中游和下游可利用态质量分数的平均值分别为0.11、0.13和0.06 mg·kg−1,可利用态质量分数平均占比从上游向下游逐渐加大,在M6点位达到最大百分比82.81%,D2、M2点位可利用态占比也较高,分别为79.65%和75.6%。这可能与农业、电池电气制造工业或交通污染相关[27-28]。除外来污染源影响外,水中Cd离子也容易吸附在沉积物的细小颗粒表面,易和Ca2+、Mg2+等离子发生替代反应,从而和碳酸盐形成金属结合物[29]。
除了Cd外,其余重金属存在形态均以残渣态F4为主。Cr、V、Ni的最高值分别为304.07 mg·kg−1、485.42 mg·kg−1、51.02 mg·kg−1,赋存形态中F4态占比极高,在整个流域中的平均占比分别达到98.8%、97.02%和94.15%。可利用态含量的平均值均为上中游大于下游,可利用态占比在各采样点分布均匀,且均在M6处达到最大占比,分别为3.52%、9.4%和13.39%。
Pb、Zn、Cu、Co的F4态平均占比为78.07%~91.41%,可利用态以F2态为主。Pb总质量分数在M3点位达到最大值 (44.67 mg·kg−1) ,该点位可利用态占比最低 (7.79%) 。在中游的可利用态平均质量分数 (8.62 mg·kg−1) 明显高于上游和下游地区 (4.76和3.68 mg·kg−1) ,可利用态占比在M6点位达到最大值66.16% (F2占比达41.28%) ,该点位的Pb总质量分数也较高 (41.18 mg·kg−1) ,其余点位可利用态均小于残渣态。Pb的F2态占比较高可能与黄河流域pH较高,碳酸钙离子较多有关,从而促使Pb与固体表面离子进行络合作用[26],在印度恒河[10]沉积物中也有类似报道。也可能与上游内蒙古地区的钢铁工业和中游河南地区发达的农业和煤矿业相关[28]。Zn的总质量分数在M5达到最大值180.51 mg·kg−1,在上中游的可利用态平均质量分数分别为16.40和15.66 mg·kg−1,高于下游地区11.32 mg·kg−1。Zn的可利用态百分比在上中游分布较为均匀,平均值为14.96%,下游可利用态百分比明显升高,平均值达到25.18%。Cu和Co的F4态占比较高,分别为90.56%和91.51%,Cu的总质量分数在上游高于中下游,各点位的可利用态占都较低,均不超过15%,且分布比较均匀;Co的总质量分数在上中游高于下游流域,M5处达到最高值 (31.72 mg·kg−1) ,可利用态质量分数与占比在各流域分布较为均匀,可利用态占比在M6达到最大值 (17.58%) 。
As总质量分数在下游高于上中游,在D3点位到达最高值22.52 mg·kg−1,在上中游可利用态质量分数平均值分别为1.76和1.92 mg·kg−1,高于下游的1.05 mg·kg−1,上中游的可利用态占比 (18.35%和18.74%) 也高于下游 (10.30%) ,以F3态为主 (平均百分比为8.06%) ,在中游M4、M2、M6点位占比较高,分别为36.01%、24.2%和21.01%。As常用于农药、杀虫剂中,可能与上中游发达的农业相关[28]。
沉积物中重金属在不同采样点的形态分布情况表明Cd的元素性质不稳定,易发生迁移。同时发现Cd、Cr、V、Ni、Co和Pb的可利用态所占质量分数均在M6点位达到最大值,这表明该点位的潜在风险较高。
2.2 重金属生态风险评价
1) 重金属迁移能力评价。黄河表层沉积物中重金属的RAC如表4所示。重金属的迁移活性排序为Cd> Zn>As>Co>Cu>Ni>Pb>V>Cr。其中,Cd的RAC值最高,平均值为24.4%,下游的平均值最大为33.4%,在D2点位值达到最大 (51.33%) ,具有极高风险性。上游和中游分别为20.1%和21.77%,在U2、M2、M6、D1、D3这5个点位中具有高风险性,潜在生物毒害作用较强。Cr、V在各采样点中迁移系数均小于1%,几乎没有迁移风险,主要由于这2种元素是主要的成岩元素,多源于地表径流所输送的陆源碎屑物质[30]。As、Cu、Ni、Pb、Zn、Co在各采样点均为低风险至无风险,迁移性和生物活性都比较低,故应重点关注Cd在黄河流域内的潜在危害性。
表 4 表层沉积物中重金属RAC值Table 4. RAC values of heavy metals in surface sediments点位 As Cd Cr Cu Ni Pb Zn V Co U1 L M N N L L L N L U2 L H N L L L L N L U3 L M N N N N L N L U4 L M N N N N L N N M1 L M N L N N L N N M2 L H N N L N N N L M3 L M N L N N N N N M4 L M N N N N N N L M5 N L N N N N N N N M6 L H N L L N L N L D1 L H N L L L L N L D2 N VH N L N L L N L D3 N H N L N N L N N D4 L M N N N N L N N D5 N M N L N N L N L 注:N-没有风险; L-低风险; M-中等风险; H-高风险; VH-极高风险。 2) 重金属污染水平评价。黄河表层沉积物中重金属的KRSP值如图3所示。Cd的KRSP值最高,污染程度最重,中游和下游的平均值分别为155.4%和170.6%,属于轻度污染。其中,在M2、M6、D2点位KRSP值大于300%,为重度污染;在D1点位为中度污染;其余点位为轻度至无污染。Pb自上而下在各河段的KRSP平均值分别为24.7%、50.15%和27.08%,均为低风险,仅在M6点位的KRSP值分别为195.54%,属于轻度污染,其余点位无污染。结合该点位Pb的形态分布特征可知,Pb对铁锰氧化物具有较强的亲和性,可重新释放到孔隙水中,存在潜在的生态风险[18,31]。其余重金属As、Cr、Cu、Ni、Zn、Co和V在各点位的KRSP值均小于100%,无外来污染。
结合RAC值和KRSP值发现黄河干流全流域内沉积物重金属中Cd的生态风险最高,其次为Pb。一方面是与Cd和Pb金属元素自身活性高、易发生溶解迁移有关;另一方面可能与外来污染源输入相关,这与前述形态分布特征结论一致。As、Cr、Cu、Ni、Zn、Co和V元素在黄河流域内无明显生态风险。结合表层沉积物重金属在不同采样点的形态分布情况分析可知,Cr、Ni、V元素F4态占比大,表明这3种元素广泛存在于矿物晶格之中、不易析出,其来源可能为原生地质环境,外来污染源较少,在伊朗里海南部也有类似报道[1]。其余元素在部分点位虽有外来源污染,但占比较少,故可利用态占比较低、迁移性弱,造成的生态风险较低。此外,Cd、Pb等多个重金属在M6点位的生态风险较高,这表明该点位具有一定的潜在生态危害,该采样点附近有农田分布、农业活动频繁,对黄河表层沉积物造成了影响。
2.3 重金属健康风险评价
1) 重金属元素非致癌健康风险评价。黄河全流域各采样点重金属可利用态的非致癌健康风险如表5所示,8种重金属在各点位对儿童和成人造成的健康风险值HI均小于1,属人体可接受范围。成人非致癌健康风险值中,Cd、Cr以口摄入和皮肤吸收为主要风险途径,其中HQ口占HI比重分别为71.47%、82.31%,HQ皮肤占HI比重分别为28.52%和16.42%。其余重金属的HQ口所占HI比重为97.4%~99.77%,口摄入为主要暴露途径。儿童非致癌健康风险值中,Cd和Cr的HQ皮肤占HI比重分别为21.87%和12.25%,以口摄入和皮肤吸收为主要风险途径,其余重金属的HQ口所占HI比重范围为88.29%~99.92%,口摄入为主要途径。V仅有口摄入参考剂量。
表 5 重金属非致癌健康风险平均值Table 5. Average non-carcinogenic health risk of heavy metals重金属与数据名称 口 皮肤 呼吸 HI 成人 儿童 成人 儿童 成人 儿童 成人 儿童 As 7.16×10−3 6.68×10−2 6.97×10−5 4.56×10−4 1.05×10−6 1.87×10−6 7.23×10−3 6.73×10−2 Cd 1.38×10−4 1.29×10−3 5.51×10−5 3.61×10−4 2.03×10−8 3.63×10−8 1.93×10−4 1.65×10−3 Cr 5.16×10−4 4.82×10−3 1.03×10−4 6.76×10−4 7.97×10−6 1.42×10−5 6.28×10−4 5.51×10−3 Cu 7.41×10−5 6.92×10−4 9.86×10−7 6.46×10−6 1.08×10−8 1.94×10−8 7.51×10−5 6.98×10−4 Ni 1.29×10−4 1.20×10−3 1.90×10−6 1.24×10−5 1.88×10−8 3.36×10−8 1.31×10−4 1.21×10−3 Pb 2.33×10−3 2.17×10−2 6.19×10−5 4.05×10−4 3.40×10−7 6.07×10−7 2.39×10−3 2.21×10−2 Zn 6.58×10−5 6.14×10−4 1.31×10−6 8.60×10−6 9.68×10−9 1.73×10−8 6.71×10−5 6.23×10−4 V 9.14×10−4 8.53×10−3 / / / / 9.14×10−4 8.53×10−3 总HI 1.18×10−2 1.07×10−1 3种暴露途径对成人和儿童的总HI值范围为6.14×10−3~3.46×10−2、0.06~0.32,中游HI值 (1.42×10−2和0.13) 高于上下游 (1.33×10−2和0.12、7.68×10−3和0.07) ,均在M6点位达到最大值,儿童的风险总值是成人的7.61~9.25倍,其中M6点位的儿童总HI值(0.32)最高,应重点关注。在成人和儿童的总HI值中As的贡献率均为最高,分别达到了61.28%和62.71%;其次是Pb,贡献率为21.23%和20.27%;再者是V,贡献率为8.16%和7.95%,其余重金属总贡献率不超过10%,排序为Cr、Cd、Ni、Cu、Zn。As的健康风险值最高,这与近年来黄河干流沉积物中As总含量高于中国水系沉积物元素背景平均值的结论相符[28]。Pb因其浓度较高、RfD值低,比其他元素具有更高的非致癌风险[32]。Cd的生物活性较高,但由于沉积物样品中的可利用态质量分数较低,对人体的健康风险值较低。而V的生物可利用性较低,但其儿童和成人的健康风险值却均高于Cd,当前沉积物研究中对V的关注度较低,但其具有的非致癌健康风险可能超出人们预期[33]。
2) 重金属元素致癌健康风险评价。黄河全流域各采样点重金属可利用态的致癌健康风险如表6所示,4种重金属在对儿童和成人造成的致癌健康风险值TCR均未超过10−4,处于人体可接受范围。As、Cd、Cr对儿童和成人的致癌健康风险值均为CR口>CR皮肤>CR呼吸,且CR口占TCR比重均超过98%,口摄入为主要致癌因子摄入途径。Ni仅有呼吸摄入参考剂量。
表 6 重金属致癌健康风险平均值Table 6. Average carcinogenic health risk of heavy metals口 皮肤 呼吸 TCR 成人 儿童 成人 儿童 成人 儿童 成人 儿童 As 1.10×10−6 2.58×10−6 1.07×10−8 1.76×10−8 1.62×10−9 7.25×10−10 1.12×10−6 2.59×10−6 Cd 8.53×10−8 1.99×10−7 7.18×10−11 1.18×10−10 4.39×10−11 1.96×10−11 8.54×10−8 1.99×10−7 Cr 2.66×10−7 6.20×10−7 2.12×10−12 3.47×10−12 3.28×10−9 1.46×10−9 2.69×10−7 6.21×10−7 Ni / / / / 1.09×10−10 4.86×10−11 1.09×10−10 4.86×10−11 总TCR 1.47×10−6 3.42×10−6 3种暴露途径对成人和儿童的总TCR值范围为6.73×10−7~3.77×10−6、1.56×10−6~8.76×10−6,上游TCR值 (1.75×10−6和4.07×10−6) 高于中下游 (1.7×10−6和3.95×10−6、9.67×10−7和2.25×10−6) ,且均在M6点位达到最大值,儿童的风险总值是成人风险值的2.32倍。此外,M6点位的儿童致癌健康风险总值最高(8.76×10−6),虽在可接受范围内,但也应采取相应预防措施。在成人和儿童总TCR值中As的贡献率最大,分别达到了75.91%和75.98%,其次为Cr(18.28%与18.19%)、Cd(5.81%与5.83%)、Ni(0.01%与0%)。
综上所述,黄河流域表层沉积物中重金属对人体的致癌和非致癌健康风险均较低,属于可控范围。但本研究中健康风险评价模型使用参数为EPA推荐参数模型,未实际考虑到黄河流域周边居民的健康参数,未来还需应用具体参数来完善中国境内不同区域的沉积物健康风险评价。
3. 黄河干流表层沉积物中重金属防控策略
1) Cd污染防控。本研究发现黄河干流表层沉积物重金属中Cd造成的生态风险最高,Cd主要由农业源和工业源产生[29],应控制黄河上游内蒙古地区钢铁、稀土、电池电气等行业废水废气排放量,积极引导中游河南地区农业科学化发展。同时,应在黄河沿岸种植重金属超积累植物,辅助以化学、微生物等措施[34],减少Cd在沉积物中的含量,并加强对沉积物中重金属污染的监管,设置配套监测防控措施,增强管控的可操作性[35]。
2) 农业源污染防控。本研究发现黄河干流尤其是中游地区因农业活动频繁导致Cd、Pb等重金属生态风险较高,对此建议:建立生态农业,提高农民素质,根据农作物生长情况科学施加化肥农药,加强农业活动的科学管理;采取相应工程措施,在黄河流域沿岸建立农田缓冲带[36],加强对畜禽粪便、农业灌溉水、生活污水的综合治理等,从源头减少农业污染源危害。
3) 其他涉及人群健康问题的重金属。黄河干流表层沉积物中重金属造成的人体健康风险整体属可控范围,治理措施应以预防为主。应重点监察中游部分地区居民尤其是儿童的饮食健康问题,重点关注由As和Pb等重金属引发的地方性疾病[37]。建立科学的评价方法,将健康风险评价与其他沉积物评价相结合,以更全面评价沉积物中重金属对人体和生态环境造成的危害[8]。
4. 结论
1) 黄河流域沉积物重金属中Cd的弱酸态F1和可还原态F2占比较高,其余重金属均以残渣态F4为主。其中Cr、V、Ni、Cu的可利用态占比极少;Co、Pb、Zn的可利用态中以可还原态F2为主,As以可氧化态F3为主。2) 结合重金属风险评价标准和次生相与原生相分布比值分析,发现整个黄河流域内Cd的生态风险最高,污染程度与潜在危害性最大。Cd和Pb等多个重金属在M6点位迁移性较高,表明该点位具有一定的潜在生态危害。3) 黄河流域沉积物重金属对周围居民的致癌和非致癌健康风险总值均属于人体可接受范围,且均在M6点位达到最大值。整体表现为儿童风险值大于成人,并以口摄入为主要风险源,总体上健康风险属于可控范围。
-
-
[1] 王宇峰, 俞言文, 杨尚源, 等. 铁碳微电解耦合芬顿高级氧化技术对高盐废水COD去除性能的影响研究[J]. 水处理技术, 2017, 43(6): 65-67. doi: 10.16796/j.cnki.1000-3770.2017.06.015 [2] SUN Y, GUO A, GE R, et al. Pre-treatment of centrifugal mother liquid in polyvinyl chloride production by iron-carbon microelectrolysis technique[J]. Enuivonmental Science and Technology. 2014, 37(4): 139-144. [3] 赖波, 秦红科, 周岳溪 等. 铁碳微电解预处理ABS凝聚干燥工段废水[J]. 环境科学, 2011, 32(4): 1055-1059. doi: 10.13227/j.hjkx.2011.04.031 [4] ZHU Q S, GUO S H, GUO C M, et al. Stability of Fe–C micro-electrolysis and biological process in treating ultra-high concentration organic wastewater[J]. Chemical Engineering Journal. 2014, 255: 535-540. doi: 10.1016/j.cej.2014.05.138 [5] WANG C W, LEI Z Y, LI J, et al. Operation mode of iron-carbon microelectrolysis pretreating high salinity pickle wastewater[J]. China Water & Wastewater. 2018, 34(15): 95-99. [6] ZHAO D M, SHI H X, XU G L, et al. Study on the pretreatment of p-fluoronitrobenzene wastewater by microelectrolysis[J]. Environmental Protection of Chemical Industry. 2002, 22(1): 15-18. [7] ZHANG W, CHEN L, CHEN H, et al. The effect of Fe0/Fe2+/Fe3+ on nitrobenzene degradation in the anaerobic sludge[J]. Journal of Hazard Materials. 2007, 143(1/2): 57-64. [8] YING D, PENG J, LI K, et al. Dual-cell reduction and group effect in an internal microelectrolysis reactor[J]. Electrochimica Acta. 2013, 89: 861-867. doi: 10.1016/j.electacta.2012.10.158 [9] LAI L L, LIU C, LIU M Y, et al. Condition optimization of iron-air fuel cell to treat phosphate-containing wastewater regarding sustainable development[J]. Chemosphere. 2023, 313: 137507. doi: 10.1016/j.chemosphere.2022.137507 [10] 鲁浩. 铁碳双池法再生NO络合吸收液的规律研究[D]. 天津: 天津大学, 2021. [11] 谢学军, 王浩, 邹品果, 等. 铁-水体系电位-pH图与氧化性水工况的腐蚀控制[J] 华北电力技术. 2011, 13 (5): 23-25. [12] 李子轩, 王继全. 铁碳微电解技术及其在处理工业废水中的研究进展[J] 建材世界. 2020, 41 (4): 100-102. [13] PRIYADARSHINI A, KUMAR S P, GHOSAL A, et al. Stabilization of zero-valent iron for wastewater treatment: Challenges and future prospective[J]. Materials Today: Proceedings. 2022, 67: 1073-1079. -






 下载:
下载: