-
随着全球气候变暖,大气中CO2体积分数持续升高,氮磷等营养物质大量输入,水体富营养化愈发严重,有害藻华频发[1-2]。致密的水华会消耗水中氧气,与水生生物竞争养分,破坏水产资源,导致水生态失衡[3-4]。此外,有些水华还会产生多种毒素或生物活性化合物,影响食品质量安全,危害人群健康[5]。水华已成为淡水湖泊面临的生态灾难,亦会对生态、环境和健康构成威胁[6]。因此,亟需寻找高效环保的方法来控制有害藻华。
在水生态环境中,藻细胞并不是独立存在的,其与微生物之间存在着物质交换与信息交流[7]。近年来,已有研究发现部分细菌及其分泌物具有强而特异的抑藻活性,这些细菌来源于藻际环境,在调节微藻的群落结构组成及生物量方面发挥着重要作用。因此,利用藻际细菌控制藻类水华成为研究者关注热点[8]。一些溶藻细菌在淡水水华爆发和消退过程中发挥了决定性作用[9],而部分溶藻细菌和相应的溶藻物质已被证实能有效控制有害藻华[10-11],且部分微生物的群体感应作用也能影响并调控菌藻的共生关系[12-13]。群体感应 (quorum sensing,QS) 是微生物化学信号传导的一种常见形式,主要通过释放一定量的胞外信号分子使个体获得有关邻近群落的细胞密度和物种组成信息,并相应地调整基因表达谱,实现个体无法进行的某些生理活动或者调节机制,如毒力因子产生、胞外聚合物合成、生物膜形成等[14-16]。在水华爆发过程中,溶藻细菌会跟随藻细胞的数量增长而增加,随水华的消亡而逐渐减少,但溶藻细菌在增殖初期并不表现出溶藻特性,只有数量达到一个阈值才能溶解藻细胞。因此,微生物的溶藻作用很可能受到QS的调控[17]。QS也参与溶藻物质代谢的调控。从太湖分离出一株气单胞菌GLY-2107,该菌能分泌3-甲基吲哚和3-苄基哌嗪-2,5-二酮两种溶藻活性物质,且证实该溶藻化合物的产生由AHL介导的QS调控,C4-HSL是溶藻功能菌溶藻活性的关键QS信号[11]。
扩散信号因子 (diffusible signaling factor,DSF) 家族群体感应是常见的群体感应系统之一,广泛存在于革兰氏阴性细菌中,可调节细菌种间与种内的多种与环境适应性相关的生物学功能[18]。DSF-QS信号的产生和响应主要由rpf基因簇完成。其中,rpfF基因负责合成DSF信号分子;rpfC/rpfG基因负责DSF信号识别与传导;rpfB基因负责降解DSF信号分子[19-20]。目前,DSF信号分子的生物化学功能调控机制基本上得以阐明,同时发现部分分泌DSF信号分子的微生物具有溶藻特性。周素等[21]用铜绿假单胞菌及其发酵液作用于铜绿微囊藻,发现用48 h的铜绿假单胞菌发酵液处理铜绿微囊藻7 d后,其溶藻率达到83.83%,对藻毒素的降解率达到71.35%。阴盼晴等[22]从赤潮中分离出一株能高效抑制锥状斯氏藻的嗜麦芽寡养单胞菌,该菌株能抑制藻细胞光合磷酸化电子传递过程,显著降低锥状斯氏藻的生物量。但这些报道中均未提及DSF-QS介导的群体感应对菌藻关系的影响机理,DSF-QS在微生物抑藻机制中的作用亦尚不清楚。
嗜根寡养单胞菌 (Stenotrophomonas rhizophila) 是一株革兰氏阴性菌,广泛存在于土壤、水体中,已有研究证实嗜根寡养单胞菌具有潜在抑藻能力[23-24],且其基因组中具有产生和响应DSF信号的rpf基因簇[19]。目前,嗜根寡养单胞菌的溶藻机制还不明晰,故S. rhizophila可作为DSF-QS调控溶藻作用和效果的模式菌株进行研究。基于此,本课题组以有害水华常见优势藻铜绿微囊藻为研究对象,以溶藻菌S. rhizophila野生型菌株 (WT) 和DSF合成酶基因-rpfF基因敲除株 (ΔrpfF) 为实验菌株,通过溶藻实验及基于光谱学手段,探讨DSF-QS存在或缺失条件下S. rhizophila 的溶藻作用及溶藻物质特性的差异,以期为DSF-QS调控的微生物溶藻机制提供科学依据,亦为微生物技术治理有害水华提供菌种资源及技术参考。
-
1) 菌种培养及无菌滤液的制备。实验所用菌株S. rhizophila WT购于美国典型微生物菌种保藏中心 (ATCC) ,保藏编号:ATCC BAA-473T。菌株S. rhizophila DSF信号合成酶基因缺陷突变体ΔrpfF是由本实验室前期敲除S. rhizophila WT中的rpfF基因得到。实验菌株均用NB液体培养基 (牛肉膏1.5 g·L−1,蛋白胨5 g·L−1,NaCl 2.5 g·L−1) 在30 ℃、150 r·min−1条件下震荡培养。在培养到特定时间段后,取OD600为1.0的菌液,于8 000 r·min−1条件下离心5 min后,收集上清液,过0.22 μm滤膜制备无菌滤液。
2) 藻种来源与培养方法。实验所用藻种铜绿微囊藻 (Microcystis aeruginosa,FACHB-905) 、凯氏拟小球藻 (Parachlorella kessleri,FACHB-729) 、斜生四链藻 (Tetradesmus obliquus,FACHB-416) 均购买自中国科学院水生生物研究所淡水藻种库 (FACHB) 。所有藻株均用BG11培养基并放于人工气候培养箱培养,培养温度为25 ℃,光照条件为2 000 Lux,光照周期为12 h/12 h (白/黑) 。藻液在培养7 d后,取OD680为0.4的藻液进行后续实验。
-
1) 溶藻方式。在实验菌株培养的第48 h取样,于8 000 r·min−1条件下离心5 min后分别收集上清液和菌体沉淀。所得上清液过0.22 μm滤膜制备无菌滤液,菌体沉淀用0.01 mol·L−1 无菌PBS洗涤3遍后加BG11培养液重悬。将所得菌液、重悬菌液、无菌滤液以体积分数10%比例添加到藻液中混匀培养,于培养第7 天取样测铜绿微囊藻叶绿素a (Chla) 质量浓度。
2) 不同培养时间对菌溶藻效果的影响。实验菌株S. rhizophila WT和ΔrpfF在1.1所述的培养条件下培养,分别在第12 h、24 h、48 h取菌液,制备无菌滤液,并以体积分数10%比例添加到藻液中混匀培养,于培养第7天取样测铜绿微囊藻Chla质量浓度。
3) 不同投加量对菌溶藻效果的影响。在实验菌株培养的第48 h取样离心,制备无菌滤液。将所得无菌滤液分别以体积分数5%、10%、15%比例添加到藻液中混匀培养,并于培养第7天取样测铜绿微囊藻Chla质量浓度。
4) 溶藻特异性。将48 h无菌滤液以体积分数10%添加到铜绿微囊藻、凯氏拟小球藻、斜生四链藻液中混匀培养,于第7天取样测铜绿微囊藻Chla质量浓度,评估S. rhizophila的溶藻特异性。
-
1) S. rhizophila溶藻物质热稳定性。取48 h无菌滤液于5个离心管中,分别在- 40 ℃、40 ℃、80 ℃、100 ℃水浴处理2 h,并用高压蒸汽灭菌锅121 ℃处理20 min,冷却至室温后将各处理组上清液按体积分数10%加入藻液中进行溶藻实验,并于7 d后取样测铜绿微囊藻Chla质量浓度。
2) S. rhizophila溶藻物质酸碱稳定性。取48 h无菌滤液,用2 mol·L−1 的NaOH及2 mol·L−1 的HCl溶液分别调节pH至3和12,室温处理2 h后,再回调至初始pH,以未处理的无菌上清液作为实验对照,各处理组的上清以体积分数10%的比例加入藻液中进行溶藻实验,并于培养第7天取样测铜绿微囊藻Chla质量浓度。
3) S. rhizophila溶藻物质乙醇沉淀。取48 h无菌滤液,加入3倍体积的无水乙醇,混匀震荡10 min,4 ℃静置2 h后,于8 000 r·min−1条件下离心5 min,分别收集上清和沉淀。上清用氮吹仪吹干后,用同体积的无菌水复溶残留物和沉淀,并以体积分数10%的比例加入藻液中进行溶藻实验,于培养第7天取样测铜绿微囊藻Chla质量浓度。
-
1) 叶绿素a提取方法。取10 mL藻液在4 000 r·min−1条件下离心5 min,然后弃上清,加入90%丙酮,涡旋10 s,放在4 ℃黑暗环境下萃取24 h,然后于4 000 r·min−1条件下离心20 min,上清转移至10 mL比色管中,用90%丙酮固定体积至10 mL,摇匀。最后,将上清液分光光度计比色皿置于1 cm光程下,用90%丙酮调零,分别读取750、663、645和630 nm波长的吸光度。Chla质量浓度计算公式如 (1) 所示[25],并通过计算溶藻率来评估菌的溶藻效率,计算公式如 (2) 所示。
式中:Ct为某个时间点处理组Chla质量浓度,mg·L−1;C为该时间点空白对照组Chla质量浓度,mg·L−1。
2) 无菌滤液光谱解析。紫外-可见光光谱分析:取48 h的无菌滤液,用紫外分光光度计扫描波长190~600 nm的紫外光谱图,其中以去离子水作为空白参照。三维荧光光谱分析:取48 h的无菌滤液,使用荧光光谱仪 (FluoroMax-4,美国HORIBA公司) 进行三维荧光光谱扫描。激发波长 (λex) 扫描范围为240~450 nm,发射波长 (λem) 扫描范围为290~500 nm,步长为5 nm,狭缝为1 nm。傅里叶红外光谱分析:取48 h的无菌滤液,使用真空冷冻干燥仪 (BIOBASE,山东科博生物产业有限公司) 冻干去除样品中的水分,然后研磨成细粉,用傅里叶变换显微红外光谱仪 (Nicolet iN10MX,美国赛默飞公司) 采集4 000~400 cm−1波段内样品的红外光谱信息,共扫描64次,取平均值。
-
本研究采用单因素方差分析对实验结果进行统计分析。其中,以不添加菌液的作为空白对照组,以添加NB培养基的作为实验对照组,而所有添加了无菌滤液的统一作为实验处理组,每个实验组均设置3个重复。统计分析软件为SPSS statistic 20.0,p < 0.05表示实验数据有显著性差异。
-
S. rhizophila的菌体特征和生长曲线如图1所示。图1 (a) 为菌体形态。在30 ℃、150 r/min的培养条件下,WT菌体短小,两端大多呈钝圆形,菌长为1~2 μm;ΔrpfF形态呈直杆状,菌体细长,菌长2~4 μm。在培养的72 h以内,每隔一段时间用紫外分光光度计测其OD600,估计菌的生长状况。在培养初期,WT增长速率较快,而ΔrpfF具有一段延滞期;在培养至10 h后,ΔrpfF的生物量显著高于WT (p < 0.05) ,在48 h后ΔrpfF进入衰亡期,而WT依旧处于稳定期。因此,DSF-QS缺失的嗜根寡养单胞菌菌体形态与野生株不同,而敲除株在进入稳定期后会生成更多的生物量,但会更快进入衰亡期。
-
微生物的溶藻方式主要分为2种:一种是通过微生物接触攻击藻细胞或吞噬藻细胞达到溶藻目的[26];另一种是通过营养竞争限制藻细胞必需的营养物质或者分泌具有溶藻活性的代谢产物进行间接溶藻,在现已发现的溶藻功能菌中约70%的微生物都是通过间接方式来溶藻[27]。为探究S. rhizophila对铜绿微囊藻的作用方式,分别取WT和ΔrpfF的重悬菌体和无菌滤液进行溶藻实验,结果如图2所示。在连续培养7 d后,WT重悬菌体处理组Chla质量浓度为 (6.134±0.091) mg·L−1,菌液处理组Chla质量浓度为 (3.063±0.267) mg·L−1,无菌滤液处理组Chla质量浓度仅为 (3.469±0.101) mg·L−1,菌体处理组几乎没有溶藻活性,无菌滤液的溶藻效果与菌液处理组无明显差异;而ΔrpfF重悬菌体处理组7 d后Chla质量浓度为 (6.274±0.169) mg·L−1,菌液处理组Chla质量浓度为 (1.819±0.158) mg·L−1,无菌滤液处理组Chla质量浓度仅为 (1.515±0.009) mg·L−1,ΔrpfF的重悬菌体与无菌滤液的溶藻效果呈现出与WT一样的趋势。上述结果表明,WT和ΔrpfF无菌滤液的溶藻活性并没有因为菌体的去除而降低。这说明WT和ΔrpfF主要通过分泌具有溶藻活性的代谢产物进行溶藻,属于间接溶藻方式。
-
微生物在不同的生长阶段生物活性及代谢产物会存在差异,进而可能会影响到溶藻效果[28]。分别取12 h、24 h和48 h的无菌滤液进行溶藻实验,结果如图3所示。培养7 d后,WT的12 h、24 h和48 h无菌滤液处理组的Chla质量浓度分别为 (3.330±0.103) mg·L−1、 (3.318±0.093) mg·L−1、(3.469±0.101) mg·L−1,溶藻率分别为48%、48%、46%,WT在3个时期的无菌滤液溶藻效果相近,无明显差异;而ΔrpfF的12 h、24 h和48 h无菌滤液处理组的Chla质量浓度分别为 (3.482±0.147) mg·L−1、 (1.674±0.189) mg·L−1、 (1.515±0.009) mg·L−1,溶藻率分别为50%、76%、78%,12 h无菌滤液处理组的溶藻率显著低于24 h和48 h处理组 (p < 0.05) 。从整体上来看,WT和ΔrpfF的48 h无菌滤液溶藻效果最佳,故后续研究将选择48 h的无菌滤液进行验证。
-
不同投加量对菌溶藻效果具有较大的影响,选取合适的投加量对评估菌的溶藻特性十分重要。本实验选取3种不同的投加量 (即体积分数分别为5%、10%、15%) 进行溶藻实验,结果如图4所示。对于WT来说,处理7 d后投加量为5%、10%、15%处理组中Chla质量浓度分别为 (5.453±0.178) mg·L−1、 (3.469±0.101) mg·L−1、 (2.244±0.095) mg·L−1,溶藻率分别为15%、46%、65%,溶藻效果随投加量的增加而增大。而在ΔrpfF处理组中,到实验第7天投加量为5%、10%和15%处理组的Chla质量浓度分别为 (1.721±0.031) mg·L−1、 (1.515±0.009) mg·L−1、 (1.561±0.037) mg·L−1,溶藻率分别为75%、78%、78%,溶藻效果趋于稳定。基于上述结果及可行性分析,后续研究将选择体积分数10%的投加量进行验证。
-
基于微藻种类多样性及生理生化结构的不同,菌的溶藻作用也可能表现出不一样的效果[29-30]。为研究S. rhizophila对不同藻株的溶藻作用,选取了水华常见藻中的凯氏拟小球藻和斜生四链藻作为对照测试藻株,结果如图5所示。WT与ΔrpfF的无菌滤液与凯氏拟小球藻共培养7 d后,Chla质量浓度分别增至(11.886±0.168) mg·L−1、(12.091±0.074) mg·L−1。S. rhizophila对小球藻并没有表现出显著的溶藻作用;WT与ΔrpfF的无菌滤液与斜生四链藻共培养7 d后,Chla质量浓度分别增至 (11.507±0.134) mg·L−1、 (11.753±0.102) mg·L−1。S. rhizophila同样对斜生四链藻没有表现出显著的溶藻作用。相反,实验菌株对铜绿微囊藻的溶藻作用显著 (p < 0.001) ,在共培养的第7天,WT处理组的Chla质量浓度降至 (2.928±0.135) mg·L−1,而ΔrpfF处理组的Chla质量浓度降至 (0.951±0.025) mg·L−1。综上所述,S. rhizophila具有针对铜绿微囊藻的溶藻特异性,而不是普适性溶藻功能菌。
-
为探究S. rhizophila溶藻物质的热稳定性,在不同温度梯度下处理了无菌滤液并进行溶藻实验。由图6 (a) 可知,WT无菌滤液未处理组的7 d溶藻率为65.65%,在低温−40 ℃处理2 h后,溶藻率为46.74%,与未处理组相比下降了28%;而在高温处理下,溶藻率保持在55%~65%。由图6 (b) 可知,ΔrpfF无菌滤液未处理组的溶藻率为88.43%,在各处理温度作用后,溶藻率仍保持约88%,几乎未受到任何影响。结果表明,ΔrpfF分泌的溶藻物质不管在低温还是高温处理后仍能保持较好的溶藻率,热稳定性较好,而WT的溶藻物质活性易受温度影响,稳定性相对ΔrpfF较差。
-
部分溶藻物质在强酸强碱的条件下也容易失活变性[31]。为探究S. rhizophila溶藻物质酸碱稳定性,在强酸 (pH = 3) 强碱 (pH = 9) 条件下处理无菌滤液并进行溶藻实验,结果如图7所示。WT未经过任何处理的无菌滤液处理组7 d后Chla质量浓度为 (3.242±0.248) mg·L−1,溶藻率为56.6%;而经过强酸强碱处理过后的无菌滤液处理组Chla质量浓度分别为 (3.019±0.077) mg·L−1、 (3.237±0.225) mg·L−1,溶藻率分别为59.6%和56.7%;而ΔrpfF的未经过任何处理的无菌滤液7 d后Chla质量浓度为 (0.861±0.040) mg·L−1,溶藻率为88.5%;经过强酸强碱处理过后,无菌滤液处理组Chla质量浓度分别为 (1.066±0.027) mg·L−1、(0.997±0.025) g·L−1,溶藻率分别为85.7%和86.6%。因此,对照组与处理组之间无显著性差异,这说明S. rhizophila分泌的溶藻物质具有较好的酸碱稳定性,在强酸强碱处理后依然能保持较好的溶藻作用。
-
乙醇是渗透性很强的有机溶剂,能与氨基酸、核酸、蛋白等物质反应生成絮凝沉淀[32],故利用乙醇沉淀无菌滤液并进行溶藻实验可确认S. rhizophila分泌的溶藻成分中这些物质的存在。图8表明,WT的无菌滤液经乙醇沉淀后,沉淀部分处理组7 d后Chla质量浓度为 (5.47±0.215) mg·L−1,溶藻率仅为17%,而上清液处理组Chla质量浓度为 (3.97±0.114) mg·L−1,溶藻效率为40%;ΔrpfF的无菌滤液经乙醇沉淀后,沉淀部分处理组7 d后Chla质量浓度为 (5.18±0.326) mg·L−1,溶藻率仅为22%,而上清液处理组Chla质量浓度为 (1.34±0.048) mg·L−1,溶藻效率仍保持在约79.8%。以上结果表明,WT和ΔrpfF的的主要溶藻物质存在上清液,在乙醇作用下仍表现出较好的溶藻活性,溶藻物质的稳定性较好;但同时,乙醇沉淀部分仍具有较弱的溶藻作用,故不排除部分溶藻物质为氨基酸、蛋白、核酸等物质。
-
三维荧光光谱 (3D-EEMs) 是一种强有力的荧光基团分析方法,可表征产物中的荧光有机物。根据荧光区域积分,荧光光谱可表征以下几类物质:类色氨酸物质、类酪氨酸物质、类富里酸物质、类腐殖酸物质[33]。图9表明,在WT和ΔrpfF的无菌滤液中均检测到激发和发射 (λex/λem) 中心位置为360 nm/430 nm的类腐殖酸荧光峰。类腐殖酸物质是微生物对大分子有机物的代谢产物,且这类物质不能被二次代谢[34]。同时,从图谱中可看出,ΔrpfF中类腐殖酸荧光峰强度高于WT,这说明ΔrpfF的生物活性高于WT,能在相同时间里在培养液中积累更多的类腐殖酸物质。
-
紫外-可见光谱是分子吸收紫外-可见光区域的电磁波而产生的吸收光谱,可反映无菌滤液在芳香族化合物和共轭体系方面的特性,并且吸光度与溶液中物质浓度成正比[35]。图10表明,WT和ΔrpfF的无菌滤液紫外可见光谱图趋势一致,在190~300 nm范围内的吸收峰密集杂乱,整个波段内最大吸收峰分别出现在297 nm和299 nm处。这说明WT和ΔrpfF的无菌滤液都含有丰富的芳香结构[36],而且在最大吸收峰处ΔrpfF的吸光度要显著高于WT。这说明ΔrpfF芳香族类化合物质量浓度显著高于WT,与三维荧光谱图的结果一致。同时A250/A365的比值一般与样品的腐殖化程度和芳香化程度呈负相关[37]。在本实验中,WT的A250/A365 (0.362) 大于ΔrpfF (0.104) 即说明后者的芳香化程度大于前者,与上述结果一致。
-
利用傅里叶转换红外光谱仪对S. rhizophila的无菌滤液进行分析,可表征产物的官能团性质及相对浓度[38]。图11记录了无菌滤液在4 000~500 cm−1的红外光谱吸收曲线,对比分析发现WT和ΔrpfF的无菌滤液红外光谱图趋势一致,官能团属性相似。从特征峰的归属来看,3 200~2 900 cm−1附近出现了酚羟基或醇羟基的伸缩振动;1 629 cm−1 附近出现了芳环骨架 (C == C) 的叠加振动或羧酸类化合物 (COO—) 的伸缩振动;1 400 cm−1附近出现了脂肪烃类中甲基 (—CH3) 的弯曲振动;在1 000 cm−1附近显示的是脂类骨架 (C—C) 的伸缩振动[39-40]。这些峰主要来自无菌滤液中的碳水化合物、脂肪族烷烃、多糖类、核酸等物质[41]。同时,从谱图中还发现,与WT相比,在最大吸收峰处ΔrpfF的红外吸收强度相对较高,这与三维荧光光谱以及紫外可见光光谱的强度变化一致。
-
本研究通过生理生化实验及光谱学手段探究DSF-QS系统对S. rhizophila溶藻作用的调控,探明了DSF-QS调控菌体表型及生长代谢情况 (图1) 。DSF-QS缺失的S. rhizophila菌体形态与野生株不同,而敲除株在进入稳定期后会生成更多生物量,但会更快地进入衰亡期。QS信号分子的识别和传导对于细菌生理代谢和适应性至关重要[42]。前期研究表明,WT和ΔrpfF之间的转录调节因子和信号传导相关基因的表达存在较大差异。在DSF-QS缺失的情况下,ΔrpfF的DNA复制相关的基因表达量下调,细胞增殖能力减弱,相对于WT而言会更快进入衰亡期;同时,与细菌趋化性相关基因的表达显著上调,ΔrpfF表现出更强的趋化性和生物膜形成能力[43]。而这些生理代谢的改变可能直接影响了S. rhizophila的溶藻作用。
WT能在较短时间内进入生长稳定期,故WT的3个生长时期的无菌滤液溶藻效果趋于稳定,无明显差异 (图3) 。而ΔrpfF具有一段延滞期,生长前期生物活性较低,细胞代谢较弱,分泌到胞外的溶藻物质质量浓度相对较低,故12 h无菌滤液处理组的溶藻作用弱;而ΔrpfF随着生长进入稳定期,ΔrpfF大量增殖,细胞代谢增强,培养液中积累了大量溶藻物质,溶菌效果随之显著提升;而在24 h和48 h这2个处理组中溶藻效果基本相持平,这说明ΔrpfF的溶藻效果已趋于稳定,细菌进入生长后期细胞代谢减弱,只能依靠前期培养液中累积的溶藻物质来溶藻[44]。此外,不同投加量的无菌滤液对S. rhizophila的溶藻效果也具有较大差异 (图4) 。对于WT来说,处理7 d后投加量为5%、10%、15%处理组的溶藻率分别依次增加,溶藻效果随着投加量的增加而加强,呈现出一定的剂量效应[45];而在ΔrpfF处理组中,投加量为5%、10%和15%处理组溶藻效果相近。ΔrpfF在稳定期的生物量显著高于WT,这可能导致WT的溶藻活性弱于ΔrpfF,需依靠较高的无菌滤液溶藻物质浓度才能发挥溶藻作用,而ΔrpfF分泌的溶藻物质活性较强,在低浓度下能达到较好的溶藻效果。
从整体上来看,WT和ΔrpfF的溶藻特性较为相似。WT和ΔrpfF都对小球藻和栅藻均未表现出溶藻作用,具有针对铜绿微囊藻的溶藻特异性 (图5) ,推测是由于小球藻和栅藻的细胞壁结构及生理代谢不同于铜绿微囊藻,对溶藻物质具有较强的抗性[46-47]。此外,WT和ΔrpfF的无菌滤液展现出与菌液一样的溶藻效果,溶藻活性并没有因为菌体的去除而降低。这说明WT和ΔrpfF主要通过分泌具有溶藻活性的物质进行溶藻,属于间接溶藻方式 (图2) 。目前,从溶藻菌中分离纯化出来的溶藻物质多为蛋白质、氨基酸、抗生素、多肽、生物碱等物质,部分物质耐高温高压、稳定性好,方便后续提取和保存[48]。本研究结果表明,WT和ΔrpfF的溶藻物质都具有热稳定性 (图6) 、耐强酸强碱 (图7) ,且经乙醇沉淀后上清依旧保持较好的溶藻活性 (图8) 。这表明WT和ΔrpfF的主要溶藻物质并非蛋白、糖类、核酸等易变性物质。此外,WT的溶藻物质受温度影响的波动较大,特别在- 40 ℃处理组中其溶藻率降低了28%,而ΔrpfF并无此现象。这说明WT和ΔrpfF的溶藻物质在种类上可能存在差异。
溶藻菌的溶藻物质在结构和作用方式上复杂多样,故进一步通过光谱学技术对WT和ΔrpfF的溶藻物质进行探究。结合三维荧光光谱 (图9) 、紫外可见光光谱 (图10) 、傅里叶变换红外光谱图 (图11) 结果分析发现,S. rhizophila WT和ΔrpfF的无菌滤液中主要以类腐殖酸物质为主,含有芳香基团,附带羧基、羟基等官能团。类腐殖酸物质是一种具有芳香基团的大分子多聚物,能与铁元素形成络合物,降低其生物利用度[49]。而铁元素参与藻类光合作用中电子传输蛋白的合成以及还原有机化合物,铁耗竭会抑制藻的生长[50],这为WT和ΔrpfF抑制铜绿微囊藻生长的机制提供了一个合理解释。然而,类腐殖酸物质是一类弱酸性大分子有机物,具有热稳定性但在碱性环境中并不稳定,这与上述酸碱稳定性结果并不符,由此说明类腐殖酸物质络合铁并不是WT和ΔrpfF主要的溶藻方式,可能存在其他溶藻物质。这也表明S. rhizophila并不是代谢某一类单一物质进行溶藻,而是通过分泌多种溶藻物质共同作用的结果[11]。此外,从荧光强度及吸光度看,ΔrpfF无菌滤液中类腐殖酸物质含量和芳香化程度均高于WT,结合WT和ΔrpfF的生长代谢差异分析表明,WT和ΔrpfF的溶藻物质在浓度上也存在差异。
综上所述,DSF-QS与S. rhizophila的溶藻作用密切相关。当DSF-QS缺失后,S. rhizophila的生物量显著增加,代谢活性增强,在相同的生长周期内能代谢出更多的溶藻物质,进而增强了S. rhizophila的溶藻能力。
-
1) S. rhizophila是一株溶藻功能菌,不同生长时期的无菌滤液和不同的投加量会对菌的溶藻效果有较大影响。其中,当采用48 h的无菌滤液且投加量为10%时,WT和ΔrpfF的溶藻效果最优,溶藻率分别为53%和78%。2) S. rhizophila WT和ΔrpfF主要通过分泌胞外溶藻物质进行溶藻,且溶藻物质稳定性较好,不易降解和失活,在高温高压及强酸强碱的处理下依然能保持较好的溶藻活性;同时,S. rhizophila产生的溶藻物质并非蛋白质、糖类、核酸等单一物质,不易被乙醇沉淀。3) S. rhizophila WT和ΔrpfF的无菌滤液主要以类腐殖酸物质为主,且该物质含有芳香基团,附带羧基、羟基等官能团,能络合铜绿微囊藻所必需的微量元素,进而限制铜绿微囊藻的生长。从荧光强度及吸光度看,ΔrpfF无菌滤液中类腐殖酸物质的质量浓度高于WT。这说明DSF-QS缺失使菌体能代谢出更多溶藻物质,进而增强了S. rhizophila的溶藻能力。DSF-QS系统对S. rhizophila溶藻作用的调控模式为溶藻菌的应用提供了新思路。
DSF型群体感应系统的缺失导致嗜根寡养单胞菌溶藻作用的增强
Enhancement of algicidal acrivity of Stenotrophomonas rhizophila induced by the absence of DSF quorum-sensing system
-
摘要: 水环境中的微藻与藻际微生物之间关系复杂多变,而微生物的群体感应 (QS) 作用会影响并调控菌藻的共生关系。以嗜根寡养单胞菌 (Stenotrophomonas rhizophila) 野生株 (WT) 和QS扩散信号因子 (DSF) 合成酶基因- rpfF基因敲除株 (△rpfF) 为实验菌株,阐明DSF型群体感应是否调控嗜根寡养单胞菌对铜绿微囊藻的溶藻效果。结果表明:嗜根寡养单胞菌野生株和rpfF基因敲除株的溶藻特性相似,均具有针对铜绿微囊藻的溶藻特异性,主要通过分泌溶藻物质间接作用于藻细胞;野生株和敲除株培养48 h后的无菌滤液均有显著的溶藻作用,在投加体积分数10%无菌滤液的条件下,野生株和敲除株7 d溶藻率分别为53%和78%。此外,实验菌株分泌的溶藻活性物质具有热稳定性和酸碱耐受性,且不容易被乙醇沉淀;三维荧光光谱、紫外可见光光谱、傅里叶变换红外光光谱分析表明菌株胞外滤液中主要以类腐殖酸物质为主,芳香化程度较高;通过比较荧光强度和吸光度可知DSF合成酶基因缺失的嗜根寡养单胞菌的无菌滤液中类腐殖酸物质含量显著高于野生株。结果表明,DSF-QS缺失的嗜根寡养单胞菌生物量增多,能分泌更多的溶藻物质,增强了嗜根寡养单胞菌的溶藻作用。本研究拓宽了对菌藻互作的认识,有助于更好地理解溶藻菌对有害藻华的抑制机制,同时为以微生物菌剂治理水华的技术体系提供参考。Abstract: There are complicated and volatile interrelationships between algae and microorganisms in aquatic environments, of which quorum sensing (QS) of microorganisms can influence and regulate the symbiotic relationship between bacteria and algae. In this study, S. rhizophila wild-type (WT) and an incompetent DSF production rpfF-knockout mutant(△rpfF) were used to illustrate whether DSF-QS could regulate the algicidal effects of S. rhizophila on Microcystis aeruginosa. The results showed that S. rhizophila WT and △rpfF had similar algicidal characteristics. Both strains had algicidal specificity for Microcystis aeruginosa, mainly via secreting extracellular algicidal substances indirectly against algae. After 48 h of culture, the sterile filtrate of S. rhizophila WT and △rpfF showed significant algicidal effects. The algicidal rate of wild and knockout strains was 53% and 78% after a 7-day incubation when feeding 10%(v/v) sterile filtrate. The algicidal substances had better thermal stability and acid-base tolerance and were not easy to precipitate using ethanol. Three-dimensional fluorescence spectroscopy, UV-vis absorption spectrum, and Fourier transform infrared spectroscopy showed that the extracellular filtrate of the strain was mainly composed of humic acid-like substances with a high degree of aromatification. Meanwhile, the content of humic acid-like substances in the sterile filtrate of S. rhizophila △rpfF was significantly higher than S. rhizophila WT by comparing fluorescence intensity and absorbance. The above experimental results verified that the S. rhizophila lacking DSF quorum-sensing system had more biomass and could secrete more algicidal substances, which enhanced the algicidal effects of S. rhizophila. In this study, the understanding of bacteria-algal interaction was broadened, thus a better understanding of the inhibition mechanism of algicidal bacteria on harmful algal blooms was chieved. The results of this study can provide a reference for the technical system of bacteriological agents to control blooms.
-
全氟和多氟类化合物(per-and polyfluoroalkyl substances, PFAS)是一类分子结构中烷基上的氢原子全部(全氟)或部分(多氟)被氟原子取代的脂肪族化合物[1],具有独特的理化性质。自20世纪50年代以来,PFAS被制造并广泛应用于许多军事、工业、民用领域[2]。全氟烷基酸(perfluoroalkyl acids, PFAAs),如全氟烷基羧酸(perfluoroalkyl carboxylic acids, PFCAs)和全氟烷基磺酸(perfluoroalkane sulfonic acids, PFSAs),是应用和研究最为广泛的一类PFAS,其中又以全氟辛基羧酸(perfluorooctanoic acid, PFOA)和全氟辛基磺酸(perfluorooctane sulfonic acid, PFOS)为典型。越来越多的研究表明了PFOA和PFOS具有持久性、生物累积性、毒性和长距离迁移的特性,因此这两种物质均已列入《关于持久性有机污染物斯德哥尔摩公约》的管制范围[3-4]。许多国家和国际组织已停止生产PFOA和PFOS,并不断寻求更安全、更环保的替代品[5-8]。六氟环氧丙烷二聚体(hexafluoropropylene oxide dimer acid, HFPO-DA,其铵盐的商品名为GenX),最初作为PFOA替代品而开发,但目前由于其可能对生态和人体健康产生严重影响而正在接受审查,如荷兰通过了将HFPO-DA,其盐和酰卤作为高度关注物质的提案,并得到了欧盟的支持。含8个碳和10个碳的氯代多氟烷基醚磺酸盐(potassium 9-chlorohexadecafluoro-3-oxanonane-1-sulfonate, 9Cl-PF3ONS和potassium 11-chloroeicosafluoro-3-oxaundecane-1-sulfonate, 11Cl-PF3OUdS,又称 6∶2 Cl-PFESA和8∶2 Cl-PFESA),是PFOS替代商品F53-B的主要和次要组分,用以替代PFOS作为铬雾抑制剂,其潜在的生态和人体健康影响也受到越来越多的关注。
环境固体介质对PFAS有较强的吸附性[9],使得土壤/大气颗粒物/沉积物/污泥等成为PFAS在环境中重要的汇,并可能成为其它环境介质中该类污染物的潜在来源。极限萃取(Exhaustive extraction)是环境样品中有机污染物分析的常用技术,即利用极性有机试剂一次或多次萃取样品中的目标化合物,萃取过程中通常会存在大量的基质干扰物质与目标化合物共萃取的现象。为了减少基质干扰,需要对萃取液进行净化。在土壤/大气颗粒物/沉积物/污泥等环境固体样品PFAS的萃取过程中,净化萃取液的常用手段是固相萃取(Solid phase extraction, SPE),即利用固体吸附剂将萃取液中的目标化合物吸附使其与干扰化合物分离,然后再用洗脱液洗脱,达到分离和富集目标化合物的目的。然而,繁琐的超声、振荡、离心、转移、浓缩、复溶、净化、干燥等过程非常耗时,使得基于SPE的极限萃取法样品制备所用时间占到整个污染物分析过程所用时间的75%以上[10],这往往构成分析技术的瓶颈[11]。繁琐的萃取、净化过程同时增大了目标污染物损失的可能性,使得方法的回收率不稳定。由于步骤繁琐,消耗了较多的有机试剂、超纯水、离心管、固相萃取柱、高纯氮气等,成本较高。为了提高萃取效率,快速分析环境中PFAS的赋存水平,进而探讨其风险和管控措施,亟需完善固体环境介质中PFAS的萃取方法,发展样品制备效率和成本效益较高的处理技术。
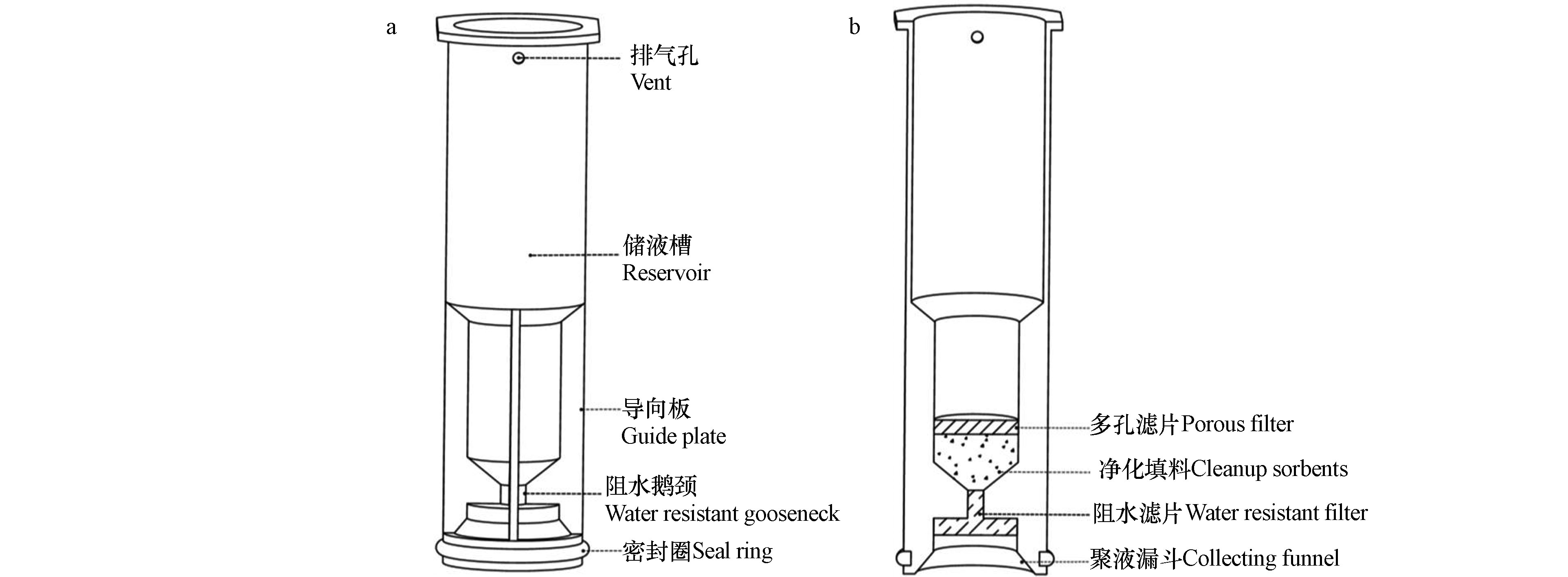
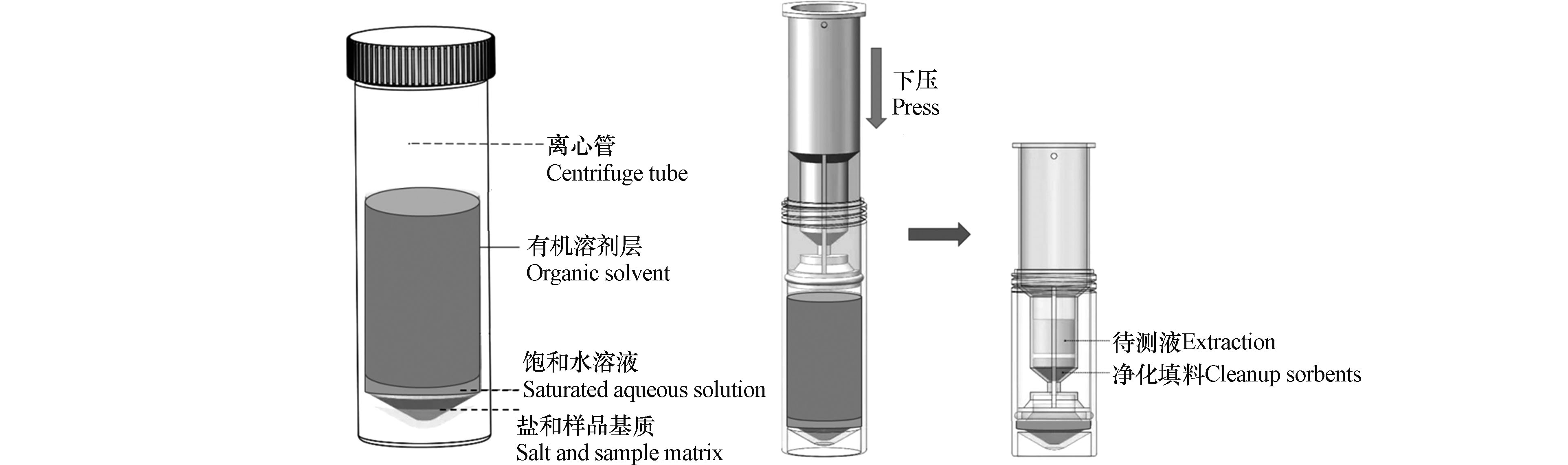
QuEChERS技术是由美国农业部在本世纪初提出的一种提取和净化农作物中农残的样品前处理方法[12],该技术利用乙腈提取目标化合物,之后采用硫酸镁等盐析分层,再加入吸附剂进行分散固相萃取,达到净化样品的目的。该技术具有快速(Quick)、简单(Easy)、便宜(Cheap)、有效(Effective)、可靠(Rugged)和安全(Safe)的特点,但存在稀释倍数大,重复性较差等问题[13]。SinCHERS技术是在SPE、QuEChERS等技术基础上开发出的一种新型快速样品制备技术,具有一步(Single–step)、经济(Cheap)、有效(Effective)、可靠(Rugged)、安全(Safe)的特点。基于SinCHERS技术的样品制备流程如图1所示。首先在碱性条件下利用有机试剂充分浸提固体样品中的目标化合物,之后向体系中加入酸调节体系pH值,振荡、离心,使得目标化合物在该体系内分配平衡,使得有机萃取液与其他组分之间分层良好。将SinCHERS前处理净化小柱(简称SinCHERS柱)置入离心管,缓慢下压,有机萃取液通过净化填料净化,并进入储液槽,取出槽内液体,浓缩、过滤后完成样品制备。相较于传统的固相萃取净化技术,SinCHERS技术节省了样品制备时间,减少了溶剂和各类器皿的使用量,并可以减少样品转移过程中目标化合物的损失,通常具有更好的稳定性和回收率。目前,SinCHERS技术已经成功应用于植物性样品中农药残留的测定[13-17]、动物性样品中兽药残留的测定以及纺织品中偶氮染料的测定[18]。
本文主要研究内容为SinCHERS技术在土壤/大气颗粒物/沉积物/污泥等固体样品PFAS检测中的应用,包括SinCHERS柱净化填料的优选和样品萃取净化流程的确定等,其目的在于提高土壤/大气颗粒物/沉积物/污泥等固体样品PFAS的萃取效率,缩短萃取时间,降低萃取成本,从而提高这些化合物的检测效率。
1. 材料与方法(Materials and methods)
1.1 试剂耗材
土壤/大气颗粒物/沉积物/污泥等固体样品;标准样品,含目标化合物PFAC-MXB (含全氟丁酸(perfluorobutanoic acid, PFBA)、全氟戊酸(perfluoropentanoic acid, PFPeA)、全氟己酸(perfluorohexanoic acid, PFHxA)、全氟庚酸(perfluoroheptanoic acid, PFHpA)、PFOA、全氟壬酸(perfluorononanoic acid, PFNA)、全氟癸酸(perfluorodecanoic acid, PFDA)、全氟十一酸(perfluoroundecanoic acid, PFUnDA)、全氟十二酸(perfluorododecanoic acid, PFDoDA)、全氟十三酸(perfluorotridecanoic acid, PFTrDA)、全氟十四酸(perfluorotetradecanoic acid, PFTeDA)、全氟十六酸(perfluorohexadecanoic acid, PFHxDA)、全氟十八酸(perfluorooctadecanoic acid, PFODA)、全氟丁烷磺酸(perfluorobutane sulfonic acid, PFBS)、全氟己烷磺酸(perfluorohexane sulfonic acid, PFHxS)、PFOS、全氟癸烷磺酸(perfluorodecane sulfonic acid, PFDS)), HFPO-DA, 9Cl-PF3ONS, 11Cl-PF3OUdS, 以及内标物质MPFAC-MXA (含MPFBA, MPFHxA, MPFOA, MPFNA, MPFDA, MPFUnDA, MPFDoDA, MPFHxS, MPFOS), M3HFPO-DA (Wellington 实验室, 加拿大);甲醇、乙腈(HPLC级,Fisher,美国);氢氧化钠(AR,麦克林,上海);盐酸(AR);乙酸铵(纯度≥98%, Sigma,美国);0.2 µm GHP针式滤器(PALL,美国);高纯氮(海科,北京);Milli-Q 超纯水(Millipore,美国);SinCHERS柱(Anybond,天津);ACQUITY BEH C18色谱柱(1.7 µm, 2.1 mm×100 mm, Waters, 美国)。
SinCHERS柱是天津安邦键合(Anybond)科技有限公司开发出的产品[19],其结构如图2所示。其中净化填料能够起到吸附有机萃取液内溶解的杂质,净化萃取液的目的,是SinCHERS柱的核心结构。填料内容需要根据目标污染物和样品所含杂质情况进行选择和配比。SinCHERS柱柱体采用医疗级聚丙烯材质,密封圈采用医疗级高级纯硅胶材质,可有效避免柱体应用带来的背景污染。
1.2 仪器设备
Agilent 1290高效液相色谱/6460三重四极杆质谱系统(HPLC-MS/MS, Agilent,美国);电动辅助工具(Anybond,天津);分析天平;超声波清洗器;振荡器;离心机;氮吹仪。
1.3 样品制备与检测
土壤/大气颗粒物/沉积物/污泥等环境固体样品中PFAS萃取净化步骤如下:称取1—2 g干燥研磨后固体样品至50 mL离心管中,加入2—10 ng同位素标记的化合物,用于内标法定量。然后加入1 mL 0.5 mol·L−1氢氧化钠溶液和4 mL乙腈溶液,涡旋混匀后水浴条件下超声30 min。再加入16 mL乙腈,振荡30 min,使样品中的待测组分充分转移至有机萃取液中。之后加入250 μL 2 mol·L−1盐酸调节pH值,涡旋混匀,然后使用离心机5000r·min−1离心5 min。将SinCHERS柱置入离心管,缓慢下压,使上清液净化后进入储液槽,下压至SinCHERS柱体无法下行,净化过程完成。将净化液转移至另一离心管中,氮吹浓缩至近干,用甲醇或初始流动相比例的混合溶液定容至0.5—1 mL,将定容后的溶液过0.2 µm GHP针式滤器,上机分析检测。
色谱条件:流动相A组分为10 mmol·L−1乙酸铵水溶液,B组分为乙腈,采用梯度洗脱:0 min A组分80%,14 min A组分10%,16 min A组分10%,20 min A组分80%;流速0.3 mL·min−1;柱温为40 ℃;进样量为5 µL。
质谱条件:离子化模式为电喷雾离子化(ESI)负离子模式;数据采集模式为多反应检测扫描模式(Multi reaction monitoring, MRM);离子源温度350 ℃;载气流量9 L·min−1;雾化器压力40 psi;毛细管电压3500 V;ΔEMV电压400 V。所分析20种PFAS及10种内标物的质谱相关参数如表1所示。
表 1 20种PFAS目标化合物及10种内标物的质谱相关参数Table 1. MS conditions for 20 PFASs and 10 Internal standards目标化合物Compound 母离子(m/z)→子离子(m/z)Precursor ion (m/z)→Production (m/z) 裂解电压/VFragmentor 碰撞能量/eVCollision energy 内标Internal standard 目标化合物 PFBA 213.0 → 169.1 57 1 MPFBA PFPeA 263.0 → 218.9 68 2 MPFBA PFHxA 313.0 → 269.0 68 3 MPFHxA PFHpA 363.0 → 318.9 68 4 MPFOA PFOA 413.0 → 368.9 82 4 MPFOA PFNA 463.0 → 419.0 82 3 MPFNA PFDA 513.0 → 468.9 86 3 MPFDA PFUnDA 563.0 → 519.0 90 5 MPFUnDA 目标化合物 PFDoDA 613.0 → 569.0 90 5 MPFDoDA PFTrDA 662.9 → 619.0 80 5 MPFDoDA PFTeDA 713.1 → 669.0 100 7 MPFDoDA PFHxDA 813.0 → 769.0 100 9 MPFDoDA PFODA 913.0 → 869.0 118 10 MPFDA PFBS 299.0 → 80.0 135 32 MPFHxS PFHxS 399.0 → 80.0 150 40 MPFHxS PFOS 498.9 → 80.0 154 47 MPFOS PFDS 599.0 → 79.9 160 65 MPFOS HFPO-DA 329.0 → 169.0 49 5 M3HFPO-DA 9Cl-PF3ONS 530.8 → 350.9 120 22 MPFOS 11Cl-PF3OUdS 630.7 → 450.9 123 25 MPFOS 内标 MPFBA 217.0 → 172.0 57 1 MPFHxA 315.0 → 270.0 68 3 MPFOA 417.0 → 372.0 82 4 MPFNA 468.0 → 423.0 82 3 MPFDA 515.0 → 470.0 86 3 MPFUnDA 565.0 → 520.0 90 5 MPFDoDA 615.0 → 570.0 90 5 MPFHxS 403.0 → 103.0 150 40 MPFOS 503.0 → 80.0 154 47 M3HFPO-DA 331.2 → 169.0 44 5 1.4 质量保证与质量控制
将标准物质用甲醇配制混合标准溶液,标准化合物的质量浓度依次为0.01、0.05、0.1、0.5、1、5、10、50、100 ng·mL−1,内标物质的质量浓度均为5 ng·mL−1。以标准化合物浓度为横坐标,以标准化合物和内标的相对浓度为纵坐标,得到标准曲线。
PFAS的方法检出限(Method detection limit, MDL)可基于加标样品的检测结果,根据美国环保署提供的方法计算[20]:
MDL=t(n−1,1−α=0.99)SS 其中,
MDL t(n−1,1−α=0.99) SS 不添加土壤样品,用本方法全流程进行定量分析,得到该方法的程序空白,能够反应SinCHERS柱体、所使用试剂、器皿、管路等的背景污染情况。
取青海省海南藏族自治州共和县廿地乡草场土壤,将其烘干、均质化、研磨至100目后作为土壤基质,添加10 ng各目标化合物,按照本文“1.3”部分所述步骤进行PFAS的分析检测,扣除本底值后计算加标回收率。由于所分析样品的理化性质受到样品种类、采样时间、采样地点等多种因素的影响,不同样品间可能存在回收率的差异,将本文所描述方法应用于实际样品时,需进行预实验,并在必要时做出适度调整。
2. 结果与讨论(Results and discussion)
2.1 HPLC-MS/MS条件优化
本研究采用Waters ACQUITY BEH C18色谱柱(1.7 µm, 2.1 mm×100 mm)进行目标化合物的分离。对比了流动相A组分中不同浓度乙酸铵含量和不同流速对20种目标化合物的分离效果的影响。基于以2 mmol·L−1与10 mmol·L−1乙酸铵水溶液作为流动相A相时得到的色谱图,发现乙酸铵含量主要影响目标化合物的保留时间和响应强度,当乙酸铵含量为10 mmol·L−1时,物质间的分离效果更好,峰形对称性更好,而乙酸铵含量为2 mmol·L−1时,各物质的响应强度更高。基于流动相速度分别为0.25、0.3 mL·min−1时得到的色谱图,发现流速主要影响目标化合物的保留时间和峰形,较高流速时目标化合物的出峰时间更早,整体比低流速时出峰时间提前约0.5 min。较高流速时,峰形更好,表现在峰宽较窄,峰形较尖,峰高较高,因此改善了相邻物质的分离度,如PFTrDA和11Cl-PF3OUdS之间,PFUnDA和9Cl-PF3ONS之间的分离度。综合考虑不同条件下的分离效果,优选10 mmol·L−1乙酸铵水溶液作为流动相A相,优选0.3 mL·min−1为流动相流速,使目标化合物达到一个更好的分离检测效果。
许多研究已经对产品PFAC-MXB中17种PFAAs,以及产品MPFAC-MXA中9种同位素内标化合物的质谱条件进行了优化[21-22],本研究重点优化了HFPO-DA及其同位素内标M3HFPO-DA,9Cl-PF3ONS,以及11Cl-PF3OUdS的质谱参数。负离子模式下,首先通过全扫确定目标化合物的母离子,之后进行离子扫描优化裂解电压,再进行子离子扫描找到子离子并优化碰撞能,最后在多反应监测模式下选择响应更高的子离子作为定量子离子。优化后的参数见表1。
2.2 吸附填料优选
为有效净化有机萃取液中所含的杂质,使用无水硫酸镁、石墨化碳黑(Graphitized carbon black, GCB)、离子交换材料的混合物作为SinCHERS柱中的净化填料,三类填料的作用分别为:吸收萃取液中可能含有的微量水分、去除色素等杂质、去除其他干扰性离子化合物。为考察具有不同层间距的GCB和不同离子交换材料对SinCHERS柱净化效果的影响,在两个污染水平下(基质样品中额外添加目标化合物10 ng、50 ng)对比了使用不同层间距的GCB和不同离子交换填料时PFAS的回收率,每种处理设置了6个重复。
层间距不同,GCB的净化能力也不同。为了选择合适的层间距,将层间距分别为10、20、30 nm的GCB与无水硫酸镁和离子交换材料HLB混合后作为SinCHERS柱内的净化填料,在两种污染水平下对比了各PFAS的回收率(图3a, b)。结果表明,当加标水平为10 ng时,若使用层间距为10 nm或30 nm的GCB,PFODA的回收率下降到57%以下。在50 ng的加标水平下,所有20种PFAS的回收率均在可接受范围内(70%—130%)[23-24],但层间距为30 nm时,SinCHERS柱去除色素的能力降低,净化后基质的颜色更深。根据回收率和净化效果对比,优选层间距为20 nm的GCB作为净化填料。GCB能吸附非极性/弱极性化合物,层间距越小,净化效果越好。但过小的层间距条件下不可逆吸附更容易发生,特别是对大分子物质。这可能是使用层间距为10 nm的GCB 时PFODA回收率较低的原因。相反,层间距为30 nm的GCB,其净化色素和其他干扰物质的能力也会降低。
为了选择合适的离子交换材料,对比了HLB、SAX、WCX 3种离子交换填料,分别将其与层间距为20 nm的GCB、无水硫酸镁混合后作为SinCHERS柱内的净化填料,在两种污染水平下对比PFAS的回收率(图3c, d)。结果表明,当使用HLB时,20种PFAS在两种加标水平下的平均回收率分别为71.0%—110.6%和74.0%—127%。而使用SAX和WCX时,无论在什么加标水平下,PFODA的回收率都下降到63%以下。在10 ng的加标水平下,使用HLB时,有12种PFAS的回收率更稳定,即回收率的标准方差低于另外两种填料。当使用SAX和WCX时,分别有4种PFAS的回收率的标准方差低于另外两种填料。HLB作为一种弱阴离子交换材料,在乙腈溶液中能吸收比PFAS酸性更强的阴离子化合物,降低了负离子模式下杂质阴离子对质谱的干扰。SAX作为一种强阴离子交换材料,对PFAS的吸附能力比HLB强。这可能是使用SAX时,PFODA回收率较低的原因。而阳离子交换材料WCX对干扰性阴离子化合物没有净化作用。
综合考虑不同填料组合条件下目标化合物的回收率范围和稳定性,优选层间距为200 Å的GCB、HLB与无水硫酸镁组合作为SinCHERS柱中的净化填料,使目标化合物同时具有较好的回收率和检测稳定性。
2.3 方法验证
用甲醇配制不同浓度梯度的标准物质混合标准溶液,拟合得到标准曲线的R2值均在0.99以上,线性范围在0.01—100 ng·mL−1,对应环境固体样品的可检测范围为0.005—50 ng·g−1 dw。
浓度为100 ng·mL−1的20种目标化合物的MRM色谱图如图4所示。可以发现,在优化的条件下,HPLC-MS/MS可以实现20种PFAS的分离。
基于该方法得到20种目标化合物的方法检出限见表2。PFAS的检出限范围0.46—2.31 ng·g-1 dw。当不添加土壤样品时,得到该方法程序空白,各目标化合物含量均低于检出限。
表 2 20种PFAS目标化合物的方法检出限(MDL, n=10)Table 2. Method detection limit (MDL) of 20 PFASs目标化合物Compound 方法检出限/(ng·g−1 dw)MDL 目标化合物Compound 方法检出限/ (ng·g−1 dw)MDL PFBA 0.95 PFTeDA 1.03 PFPeA 0.75 PFHxDA 1.44 PFHxA 0.97 PFODA 1.07 PFHpA 0.70 PFBS 0.80 PFOA 0.48 PFHxS 1.27 PFNA 0.64 PFOS 0.58 PFDA 0.75 PFDS 0.46 PFUnDA 0.62 HFPO-DA 2.31 PFDoDA 1.06 9Cl-PF3ONS 0.55 PFTrDA 0.95 11Cl-PF3OUdS 0.68 基于该方法得到20种PFAS的方法回收率如表3所示。其中,PFODA和PFBS的方法回收率为71.0%和78.4%,其余PFAS的回收率范围为84.1%—110.6%。该方法PFOA、PFODA、PFDS的回收率的标准偏差最小,为3.1%、3%、2.7%。其余PFAS的标准偏差在3.8%—13.4%之间。
表 3 20种PFAS目标化合物的方法回收率(平均值±标准偏差), n=6Table 3. Method recoveries of 20 PFASs (average±sd), n=6.目标化合物Compound 方法回收率/%Recovery rate 目标化合物Compound 方法回收率/%Recovery rate PFBA 110.2±6.9 PFTeDA 88±6.6 PFPeA 103.2±5.5 PFHxDA 95.3±10.1 PFHxA 98±6.6 PFODA 71.0±3 PFHpA 84.1±6.2 PFBS 78.4±7.7 PFOA 107.7±3.1 PFHxS 100.3±10.8 PFNA 110.6±3.8 PFOS 108.3±6.1 PFDA 99.2±4.7 PFDS 96.1±2.7 PFUnDA 103.8±5.5 HFPO-DA 91.3±13.4 PFDoDA 104.1±7.6 9Cl-PF3ONS 89.7±3.8 PFTrDA 101.5±5.9 11Cl-PF3OUdS 93.8±5.3 2.4 方法对比
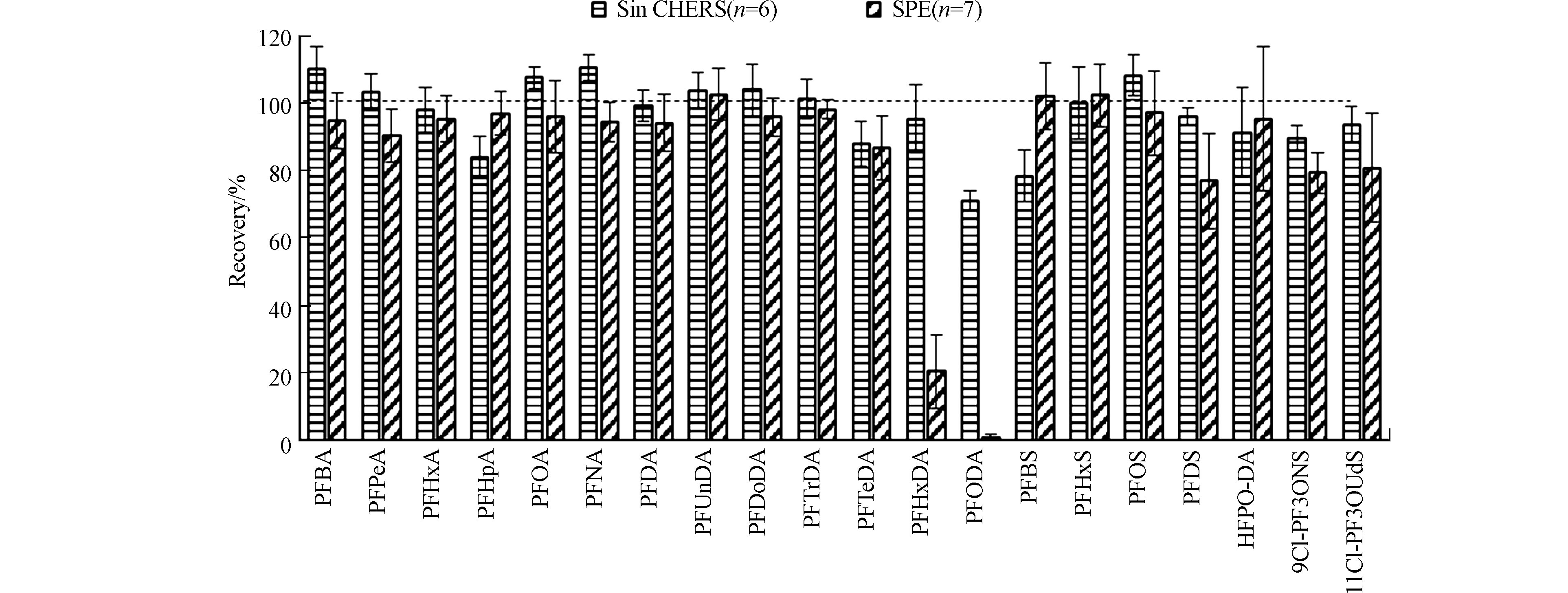
再次利用青海省土壤基质样品(本文“1.4”部分),同时应用本方法和SPE样品前处理过程[22, 25-28]对样品进行处理。当在基质样品中额外添加10 ng目标化合物时,两种技术在回收率上的差异如图5所示,对于大部分PFAS,即碳链长度为4—14的全氟羧酸化合物,碳链长度为6和8的全氟磺酸化合物,HFPO-DA,以及11Cl-PF3OUdS,两种技术的回收率均在80%—120%之间。对于碳链长度为16和18的全氟羧酸化合物,即PFHxDA和PFODA,传统SPE技术的回收率仅为20%和1%,而SinCHERS技术的回收率为95%和71%,增大了可检测污染物的种类。对于PFDS和9Cl-PF3ONS,传统SPE技术的回收率为77%和79%,SinCHERS技术的回收率为96%和90%,回收效率显著提高。对于全氟丁烷磺酸来说,SinCHERS技术的回收率78%低于SPE技术102%,但仍可用于环境样品中该物质的检测定量[29]。
对于大部分PFAS,即碳链长度为4—11,14,16的全氟羧酸化合物,碳链长度为4、8、10的全氟磺酸化合物,HFPO-DA,9Cl-PF3ONS,以及11Cl-PF3OUdS,SinCHERS技术回收率的方差低于传统的SPE技术,说明对于大部分PFAS,该方法具有更好的稳定性。同时,SinCHERS技术在步骤上更为简洁,可节约大量的试剂耗材,且具有更高的时效性。
2.5 方法应用
为验证本方法对PFAS提取效果的稳定性和适用性,2020年7月,采集了黄河流域河套灌区大棚和露天条件下共67个农田土壤样品,应用本方法进行了PFAS样品加标回收率和实际样品浓度的测定,分析结果如表4所示。其中,PFODA的方法回收率为71.9%,其余PFAS的回收率范围为87.0%—110.5%。PFPeA、PFOA、PFODA的标准偏差最小,为2.9%、2.4%、2.1%,其余PFAS的标准偏差在3.5%—12.1%之间。67份土壤样品中,20种PFAS的总浓度
∑ ∑ 表 4 河套灌区土壤20种PFAS目标化合物的样品加标回收率(平均值±标准偏差, n=6)和浓度(范围)Table 4. Spiked recoveries (average ± sd, n=6) and concentrations (range) of 20 PFASs in soils from Hetao Irrigation District目标化合物Compound 浓度/(ng·g−1 dw)Concentration 加标回收率/%Spiked recovery 目标化合物Compound 浓度/(ng·g−1 dw)Concentration 加标回收率/%Spiked recovery PFBA <MDL—5.21 104.6±5.2 PFTeDA <MDL 107.7±6.9 PFPeA <MDL—3.09 87.0±2.9 PFHxDA <MDL 98.4±7.6 PFHxA <MDL 98.4±3.9 PFODA <MDL 71.9±2.1 PFHpA <MDL 88.1±3.5 PFBS <MDL 90.0±9.7 PFOA <MDL—2.62 99.6±2.4 PFHxS <MDL 92.5±10.9 PFNA <MDL—0.92 91.4±3.7 PFOS <MDL 110.5±7.3 PFDA <MDL—5.63 94.0±5.5 PFDS <MDL 100.7±4.5 PFUnDA <MDL 103.7±5.2 HFPO-DA <MDL 93.1±12.1 PFDoDA <MDL—1.23 99.4±4.3 9Cl-PF3ONS <MDL 102.5±5.3 PFTrDA <MDL 99.6±5.0 11Cl-PF3OUdS <MDL 106.7±5.7 通过对比大棚和露天条件下的污染特征可以发现,多数样点的
∑ 3. 结论(Conclusion)
该方法建立了基于SinCHERS-HPLC-MS/MS技术的环境固体样品中20种PFAS的萃取、净化和检测方法。优选出了无水硫酸镁、层间距为20 nm的GCB、HLB离子交换材料的组合作为SinCHERS柱内的净化填料,并优化了HPLC-MS/MS条件以分离并定量检测20种目标化合物。目标化合物的方法回收率在71.0%—110.6%之间。相较于SPE样品前处理流程,该方法大大缩短了样品中污染物萃取净化的时间,降低了经济成本,优化了某些长链PFAS的萃取效率。
-
-
[1] ULLAH H, NAGELKERKEN I, GOLDENBERG S U, et al. Climate change could drive marine food web collapse through altered trophic flows and cyanobacterial proliferation[J]. PLoS biology, 2018, 16(1): e2003446. doi: 10.1371/journal.pbio.2003446 [2] RAVEN J A, GOBLER C J, HANSEN P J. Dynamic CO2 and pH levels in coastal, estuarine, and inland waters: Theoretical and observed effects on harmful algal blooms[J]. Harmful Algae, 2020, 91: 101594. doi: 10.1016/j.hal.2019.03.012 [3] HUISMAN J, CODD G A, PAERL H W, et al. Cyanobacterial blooms[J]. Nature Reviews Microbiology, 2018, 16(8): 471-483. doi: 10.1038/s41579-018-0040-1 [4] MOUSTAKA-GOUNI M, SOMMER U. Effects of harmful blooms of large-sized and colonial cyanobacteria on aquatic food webs[J]. Water, 2020, 12(6): 1587. doi: 10.3390/w12061587 [5] KARLSON B, ANDERSEN P, ARNEBORG L, et al. Harmful algal blooms and their effects in coastal seas of Northern Europe[J]. Harmful algae, 2021, 102: 101989. doi: 10.1016/j.hal.2021.101989 [6] YU R, LU S, QI Y, et al. Progress and perspectives of harmful algal bloom studies in China[J]. Oceanologia et Limnologia Sinica, 2020, 51(4): 768-788. [7] COYNE K J, WANG Y F, JOHNSON G. Algicidal bacteria: a review of current knowledge and applications to control harmful algal blooms[J]. Frontiers in Microbiology, 2022, 13: 871177. doi: 10.3389/fmicb.2022.871177 [8] CRUMP B C, WOJAHN J M, TOMAS F, et al. Metatranscriptomics and amplicon sequencing reveal mutualisms in seagrass microbiomes[J]. Frontiers in Microbiology, 2018, 9: 388. doi: 10.3389/fmicb.2018.00388 [9] ZHANG P, ZHAI C M, CHEN R Q, et al. The dynamics of the water bloom-forming Microcystis aeruginosa and its relationship with biotic and abiotic factors in Lake Taihu, China[J]. Ecological Engineering, 2012, 47: 274-277. doi: 10.1016/j.ecoleng.2012.07.004 [10] LIN S Q, GENG M X, LIU X L, et al. On the control of Microcystis aeruginosa and Synechococccus species using an algicidal bacterium, Stenotrophomonas F6, and its algicidal compounds cyclo-(Gly-Pro) and hydroquinone[J]. Journal of Applied Phycology, 2016, 28(1): 345-355. doi: 10.1007/s10811-015-0549-x [11] GUO X L, LIU X L, WU L S, et al. The algicidal activity of Aeromonas sp strain GLY-2107 against bloom-forming Microcystis aeruginosa is regulated by N-acyl homoserine lactone-mediated quorum sensing[J]. Environmental Microbiology, 2016, 18(11): 3867-3883. doi: 10.1111/1462-2920.13346 [12] SEYEDSAYAMDOST M R, CASE R J, KOLTER R, et al. The Jekyll-and-Hyde chemistry of Phaeobacter gallaeciensis[J]. Nature chemistry, 2011, 3(4): 331-335. doi: 10.1038/nchem.1002 [13] QIXIN L, XUAN F, ZHIYA S, et al. Enhanced wastewater treatment performance by understanding the interaction between algae and bacteria based on quorum sensing[J]. Bioresource Technology, 2022, 354: 127161. doi: 10.1016/j.biortech.2022.127161 [14] WHITELEY M, DIGGLE S P, GREENBERG E P. Progress in and promise of bacterial quorum sensing research[J]. Nature, 2018, 555(7694): 126-126. [15] EICKHOFF M J, BASSLER B L. Snapshot: bacterial quorum sensing[J]. Cell, 2018, 174(5): 1328-1328.e1. doi: 10.1016/j.cell.2018.08.003 [16] PAPENFORT K, BASSLER B L. Quorum sensing signal–response systems in Gram-negative bacteria[J]. Nature Reviews Microbiology, 2016, 14(9): 576-588. doi: 10.1038/nrmicro.2016.89 [17] LIU J, LEWITUS A J, KEMPTON J W, et al. The association of algicidal bacteria and raphidophyte blooms in South Carolina brackish detention ponds[J]. Harmful Algae, 2008, 7(2): 184-193. doi: 10.1016/j.hal.2007.07.001 [18] ZHOU L, ZHANG L H, CAMARA M, et al. The DSF family of quorum sensing signals: diversity, biosynthesis, and turnover[J]. Trends in Microbiology, 2017, 25(4): 293-303. doi: 10.1016/j.tim.2016.11.013 [19] HUEDO P, YERO D, MARTINEZ-SERVAT S, et al. Decoding the genetic and functional diversity of the DSF quorum-sensing system in Stenotrophomonas maltophilia[J]. Frontiers in Microbiology, 2015, 6: 761. [20] 宋凯, 周莲, 何亚文. DSF-家族群体感应信号生物合成途径与调控机制研究进展[J]. 微生物学通报, 2021, 48(4): 1239-1248. doi: 10.13344/j.microbiol.china.200710 [21] ZHOU S, YIN H, TANG S, et al. Physiological responses of Microcystis aeruginosa against the algicidal bacterium Pseudomonas aeruginosa[J]. Ecotoxicology and Environmental Safety, 2016, 127: 214-221. doi: 10.1016/j.ecoenv.2016.02.001 [22] 阴盼晴. 海洋嗜麦芽寡养单胞菌JX14对锥状斯式藻抑藻机理的研究[D]. 兰州: 兰州理工大学, 2019. [23] ZHANG Q, WANG Y, ZHOU J. Complete genome sequence of Stenotrophomonas Rhizophila kc1 a quorum sensing-producing algicidal bacterium isolated from Mangrove Kandelia candel[J]. Molecular Plant-Microbe Interactions, 2021, 34(7): 857-861. doi: 10.1094/MPMI-12-20-0346-A [24] YIN P Q, ZHANG Q, ZHU J M, et al. The data of genomic and phenotypic profiles of the N-acyl homoserine lactone-producing algicidal bacterium Stenotrophomonas rhizophila GA1[J]. Data in Brief, 2018, 21: 966-971. doi: 10.1016/j.dib.2018.10.051 [25] ZENG G M, ZHOU J, HUANG T, et al. Extraction of chlorophyll-a from eutrophic water by repeated freezing and thawing-extraction method[J]. Asian Journal of Chemistry, 2014, 26(8): 2289-2292. doi: 10.14233/ajchem.2014.15700 [26] SEYMOUR J R, AMIN S A, RAINA J B, et al. Zooming in on the phycosphere: the ecological interface for phytoplankton-bacteria relationships[J]. Nature Microbiology, 2017, 2(7): 1-12. [27] ROTH P B, TWINER M J, MIKULSKI C M, et al. Comparative analysis of two algicidal bacteria active against the red tide dinoflagellate Karenia brevis[J]. Harmful Algae, 2008, 7(5): 682-691. doi: 10.1016/j.hal.2008.02.002 [28] YU Y, ZENG Y D, LI J, et al. An algicidal Streptomyces amritsarensis strain against Microcystis aeruginosa strongly inhibits microcystin synthesis simultaneously[J]. Science of the Total Environment, 2019, 650: 34-43. doi: 10.1016/j.scitotenv.2018.08.433 [29] MEYER N, BIGALKE A, KAULFUSS A, et al. Strategies and ecological roles of algicidal bacteria[J]. Fems Microbiology Reviews, 2017, 41(6): 880-899. doi: 10.1093/femsre/fux029 [30] 张嗣萍. 一株广谱性溶藻细菌的筛选鉴定、溶藻特性及溶藻机理的研究[D]. 重庆: 西南大学, 2018. [31] ZHENG X W, ZHANG B Z, ZHANG J L, et al. A marine algicidal actinomycete and its active substance against the harmful algal bloom species Phaeocystis globosa[J]. Applied Microbiology and Biotechnology, 2013, 97(20): 9207-9215. doi: 10.1007/s00253-012-4617-8 [32] 范德朋, 胡亚冬, 杨敏志, 等. 鱼腥藻藻华水体一株溶藻菌BWFA55的鉴定及溶藻特性[J]. 广东海洋大学学报, 2021, 41(6): 9-17. doi: 10.3969/j.issn.1673-9159.2021.06.002 [33] CHEN W, PAUL W, LEENHEER J A, et al. Fluorescence excitation - emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(24): 5701-5710. [34] JIAO N, HERNDL G J, HANSELL D A, et al. Microbial production of recalcitrant dissolved organic matter: long-term carbon storage in the global ocean[J]. Nature Reviews Microbiology, 2010, 8(8): 593-599. doi: 10.1038/nrmicro2386 [35] ZHAO X Y, ZHAO K, SUN P Q. A method to describe the shapes of UV-vis absorbance spectra during the aggregation process of conjugated polymer solutions quantitatively[J]. Chemical Physics Letters, 2019, 730: 582-586. doi: 10.1016/j.cplett.2019.06.030 [36] 李岩岩, 赵娜, 马丽娟, 等. 土壤腐殖酸的紫外-可见光谱表征[J]. 大连民族学院学报, 2011, 13(5): 538-539. doi: 10.13744/j.cnki.cn21-1431/g4.2011.05.008 [37] SUN B, LI Y S, SONG M J, et al. Molecular characterization of the composition and transformation of dissolved organic matter during the semi-permeable membrane covered hyperthermophilic composting[J]. Journal of Hazardous Materials, 2022, 425: 127496. doi: 10.1016/j.jhazmat.2021.127496 [38] CHAVEZ-VERGARA B, MERINO A, VAZQUEZ-MARRUFO G, et al. Organic matter dynamics and microbial activity during decomposition of forest floor under two native neotropical oak species in a temperate deciduous forest in Mexico[J]. Geoderma, 2014, 235: 133-145. [39] 段漓童, 刘正猛. 红外光谱图的分区[J]. 华北煤炭医学院学报, 2006, 8(3): 336-337. [40] 张明洋, 朱兆龙, 李好好, 等. 不同傅里叶变换红外光谱法研究土壤光谱特征的比较与应用[J]. 水土保持研究, 2022, 29(6): 121-128. doi: 10.13869/j.cnki.rswc.20220414.006 [41] 倪文海, 刘欢, 刘振涛, 等. 水稻秸杆腐解过程溶解性有机质红外光谱研究[J]. 土壤, 2013, 45(2): 1220-1226. doi: 10.3969/j.issn.0253-9829.2013.02.005 [42] KROL E, SCHAPER S, BECKER A. Cyclic di-GMP signaling controlling the free-living lifestyle of alpha-proteobacterial rhizobia[J]. Biological Chemistry, 2020, 401(12): 1335-1348. doi: 10.1515/hsz-2020-0232 [43] LIU Y, GAO J, WANG N, et al. Diffusible signal factor enhances the saline-alkaline resistance and rhizosphere colonization of Stenotrophomonas rhizophila by coordinating optimal metabolism[J]. Science of the Total Environment, 2022, 834: 155403. doi: 10.1016/j.scitotenv.2022.155403 [44] 司晓光, 张晓青, 郝建安, 等. 芽孢杆菌dhs-330-021对链状亚历山大藻的溶藻机理研究[J]. 生物技术通讯, 2017, 28(4): 485-489. doi: 10.3969/j.issn.1009-0002.2017.04.015 [45] 卢露, 马金玲, 牛晓君, 等. 铜绿微囊藻溶藻菌EA-1的分离鉴定及溶藻特性[J]. 中国环境科学, 2021, 41(11): 5372-5381. doi: 10.3969/j.issn.1000-6923.2021.11.046 [46] 李超, 惠晓梅, 潘子鹤, 等. 四尾栅藻和蛋白核小球藻对模拟生活污水的处理性能研究[J]. 太原理工大学学报, 2021, 52(6): 880-886. doi: 10.16355/j.cnki.issn1007-9432tyut.2021.06.005 [47] SARANYA D, SHANTHAKUMAR S. Green microalgae for combined sewage and tannery effluent treatment: performance and lipid accumulation potential[J]. Journal of Environmental Management, 2019, 241: 167-178. [48] LI Z H, LIN S Q, LIU X L, et al. A freshwater bacterial strain, Shewanella sp Lzh-2, isolated from Lake Taihu and its two algicidal active substances, hexahydropyrrolo 1, 2-a pyrazine-1, 4-dione and 2, 3-indolinedione[J]. Applied Microbiology and Biotechnology, 2014, 98(10): 4737-4748. doi: 10.1007/s00253-014-5602-1 [49] SUN B K, TANJI Y, UNNO H. Influences of iron and humic acid on the growth of the cyanobacterium Anabaena circinalis[J]. Biochemical Engineering Journal, 2005, 24(3): 195-201. doi: 10.1016/j.bej.2005.02.014 [50] IMAI A, FUKUSHIMA T, MATSUSHIGE K. Effects of iron limitation and aquatic humic substances on the growth of Microcystis aeruginosa[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1999, 56(10): 1929-1937. doi: 10.1139/f99-131 -




 下载:
下载: