-
城镇污水厂排水中总氮排放量超过地表水体自净容量,容易诱发水体富营养化及其相关水环境问题[1-2]。在低碳氮比(C/N)或低电子供体条件下降低排水总氮负荷是世界性难题,碳源添加是提高生物脱氮效率的方式之一[3]。但传统碳源的额外添加存在成本高、投加量难控制等诸多问题[4-5],且增加了碳源生产过程中的能量消耗。利用外界废弃植物作为固体碳源不仅可以为脱氮提供碳源,还可成为良好的生物膜载体,同时也利用了废弃碳源,助力我国“双碳”目标的实现[6]。赵文莉[7]将体积为1 cm3的玉米芯采用1.5% NaOH浸泡18 h后作为碳源,实验用水中NO3−-N质量浓度为40 mg·L−1,41 d后NO3−-N去除率为91.37%,但玉米芯容易悬浮造成碳源与生物和液体分层使得物质传递不均匀,降低了脱氮速率。凌宇等[8]将直径5~10 mm的玉米芯采用1% NaOH浸泡24 h后作为反硝化碳源,控制配水NO3−-N质量浓度为15 mg·L−1,11 d后NO3−-N去除率为94.6%,但随着微生物生长繁殖,玉米芯颗粒在分解过程中黏度会逐渐变大,相互粘连易将滤池堵塞。为解决单一植物在做碳源时所存在的问题,XIONG等[9]和YANG[10]等使用植物复合人工合成可降解聚合物制备的碳源反硝化效果明显优于单一植物。王润众等[11]将PVA与淀粉混合,当淀粉含量为58.2%时,将其用于NO3−-N质量浓度35 mg·L−1的实验配水脱氮,NO3−-N去除率几乎达到100%。闫续[12]等将淀粉和PVA共混,并于硼酸溶液中浸泡交联,制备了淀粉含量为43%的缓释碳源,反硝化脱氮15 d后,随着碳源的释放殆尽,脱氮效果开始下降。因此,需对植物预处理方法、植物复合人工合成可降解聚合物方式、复合碳源的释碳速率进行研究。
微生物在进行电子传递时,一部分电子供体直接被微生物利用传递给电子受体,一部分电子供体需通过电子传递中间体的转移被微生物利用后,再传递给电子受体[13],往往电子传递中间体的缺失也是导致脱氮效率低的原因之一。海绵铁中以Fe0为主,腐蚀产生H2为氢自养反硝化菌提供了电子供体,而且生成的Fe2+、Fe3+充当部分电子供体与微生物之间的电子转移中间体[14],形成
碳源(电子供体e−)生物作用→(Fe2+、Fe3+arrayc+e−↔−e−arrayFe0、Fe2+)电子转移中间体生物作用→NO3−+e−生物作用→N2 的电子传递过程。李斌等[15]在研究玉米芯与海绵铁复合填料的反硝化脱氮特性时,控制配水的NO3−-N质量浓度为20 mg·L−1,将玉米芯与海绵铁分层填入生物滤柱中,海绵铁的缓慢腐蚀也在不断产生氢气,供氢自养反硝化菌生长,去除率可达90%以上,但玉米芯与海绵铁分层会影响生物种群分布与电子传递效率,导致脱氮效率与效果受到影响。也有研究表明,Fe3+对生物脱氮系统中功能菌的酶活性、群落结构及脱氮性能具有显著影响[16]。本研究分别使用机械粉碎(JX)、机械粉碎+碱处理(JJ)、机械粉碎+生物处理(JS)对玉米芯进行预处理后作为填料核心基材,采用1%的NaOH碱处理12 h,以提高预处理效率。使用人工合成可降解聚合物将处理后的玉米芯与海绵铁粘结成直径为(15±0.2) mm的球型填料,以增加质量与接触面积,解决填料悬浮造成碳源与生物、液体分层物质传递不均匀和堵塞问题。将海绵铁掺杂入玉米芯释碳填料内部,从而提高复合释碳填料释放电子释放与传递能力,生成的Fe2+、Fe3+充当碳源-微生物-硝酸盐之间的电子转移中间体,进而可提高微生物对玉米芯释放出来碳源的利用速率与效率。海绵铁作为释碳物质与反硝化微生物菌剂之间的架桥,其可提高释碳填料附着脱氮菌群的活性及生物群落结构,可大幅度提高脱氮速率。本研究考察了3种填料碳源与二次污染物TN释放情况、填料中溶解性荧光有机物释放组分及静态反硝化特性,以期为高效和稳定利用玉米芯作为反硝化碳源提供参考。
-
实验用水:采用NaNO3和KH2PO4配制实验用水(氮磷比例为5:1),并且加入适量微量元素溶液,控制实验配水中NO3−-N质量浓度为100 mg·L−1。制备复合释碳填料所需材料:普通玉米芯、人工合成可降解聚合物——聚乙烯醇,海绵铁(含铁量为95.0%~98.0%)。
-
将烘干备用的玉米芯按照以下3种方法进行处理:1)机械粉碎方法:机械粉碎后放入蒸馏水中浸泡12 h(JX填料);2)机械粉碎+碱处理方法:机械粉碎后放入1% NaOH中浸泡12 h(JJ填料);3)机械粉碎+生物处理方法:机械粉碎后发酵48 h(发酵菌主要为枯草芽孢杆菌、乳酸杆菌等,其中枯草芽孢杆菌≥5×107 CFU·g−1)(JS填料)进行处理,机械粉碎后粒径为0.5~1.0 mm,处理之后洗净干燥备用。
将经过以上3种方法处理后的玉米芯粉末,以聚乙烯醇为粘结剂与海绵铁固定成直径为(15±0.2) mm的球型填料(前期实验得玉米芯粉:聚乙烯醇:海绵铁组分比为3:1:0.3时硬度、密度最佳),浸水密度为1.1~1.3 g·cm−3。3种填料实物外观如图1所示。
-
1)填料静态释碳、释氮实验。为研究3种填料释碳能力的差异,将3种填料各取(6.5±0.2) g分别放入250 mL棕色瓶中,加入200 mL蒸馏水浸泡,常温静置。并在实验开始后每3 d取浸出液样品,测量水样的COD,同时在15、30 d测定浸出液荧光光谱,每次取样后彻底换蒸馏水200 mL;为研究3种填料释氮情况,将3种填料各取(6.5±0.2) g分别放入250 mL棕色瓶中,加入200 mL蒸馏水浸泡,常温静置。并在实验开始后每5 d取浸出液样品,测量水样的TN指标,每次取样后彻底换蒸馏水200 mL。
2)静态反硝化实验。为探究3种填料反硝化特性,取4个500 mL棕色瓶作为反应器,在3个棕色瓶中分别加入3种填料(9±0.2) g,另外1个不添加任何填料和碳源作为空白样。全部添加富集培养反硝化菌的活性污泥50 mL(使用前用蒸馏水清洗3次)和实验配水400 mL,盖紧瓶盖后放入恒温振荡培养箱中培养(20 ºC、60 r·min−1),每隔24 h取样400 mL,密封沉淀1 h后测定TN、NO3−-N、NO2−-N和NH4+-N质量浓度及COD,取样完后补充实验配水400 mL。将添加填料作为反硝化碳源的实验组依次命名JX填料组、JJ填料组、JS填料组,将不添加填料和碳源的实验组作为对照。
-
1)水质测试。所有理化指标的测定均参照中国环境科学出版社出版的《水和废水监测分析方法》(第四版)[17]所述方法进分析,COD采用快速消解-分光光度法测定(盛奥华 6B-12消解仪/6B-201速测仪,江苏),总氮(TN)采用碱性过硫酸钾消解-分光光度法(岛津 Uvmini 1240,日本),硝态氮(NO3−-N)采用麝香草酚-分光光度法(岛津 Uvmini 1240,日本),亚硝态氮(NO2−-N)采用N-(1-萘基)-乙二胺-分光光度法(棱光 721G,上海),氨氮(NH4+-N)采用纳氏试剂-分光光度法(棱光 721G,上海)。
2) DOM测定。三维荧光光谱测定采用荧光分光光度计(Hitachi F-7100,日本)测定[18]。将水样用孔径0.45 μm滤膜过滤,用超纯水作为实验空白,激发波长(Ex)扫描范围200~400 nm,发射波长(Em)扫描范围250~550 nm,狭缝宽带5 nm,扫描速度12000 nm·min−1。
3)扫描电子显微镜测定。表面结构采用扫描电子显微镜(Zeiss GeminiSEM 500,德国)测定。对3种预处理的玉米芯进行干燥和喷金3 min后,置于扫描电子显微镜(SEM)下观察表面结构。
-
1)动力学分析。为了解3种填料静态释碳机制,采用2种动力学方程建立时间t与COD释放量的关系,并拟合出不同填料释碳过程。准二级动力学方程如式(1)所示。传质系数根据式(2)进行计算。Ritger-peppas方程如式(3)所示。
式中:Ct为t时释放的COD量,mg·(g·L)−1;Cm为COD释放的最终总量,mg·(g·L)−1;k2为碳释放速率常数,g·L·(d·mg)−1;K为传质系数,mg·(g·L·d)−1;t1/2为释碳特征曲线中COD达到最终释放总量(Cm)50%时所需的时间,d。
式中:Ct为t时释放的COD量,mg·(g·L)−1;Cm为COD释放的最终总量,mg·(g·L)−1;k为动力学方程常数;N为碳释放指数,当N<0.45时扩散过程占优势,当N为0.45~0.89时主要机制为扩散和分解,当N>0.89时分解过程占优势。
2) DOM分析。运用Origin 2021软件处理数据得到三维荧光谱图。根据WANG等[19]和蔡华玲等[20]的研究,可将三维荧光光谱划分为6个区域(表1),结合区域积分法(FRI)计算得到各区域积分标准体积。
3) COD理论利用率分析。将1 mg NO3−还原为NO2−只需消耗1.15 mg的COD,而完全还原为N2则需要消耗2.86 mg的COD [4],通过计算NO3−-N去除的质量及NO2−-N生成的质量,可得COD理论消耗量和利用率。
-
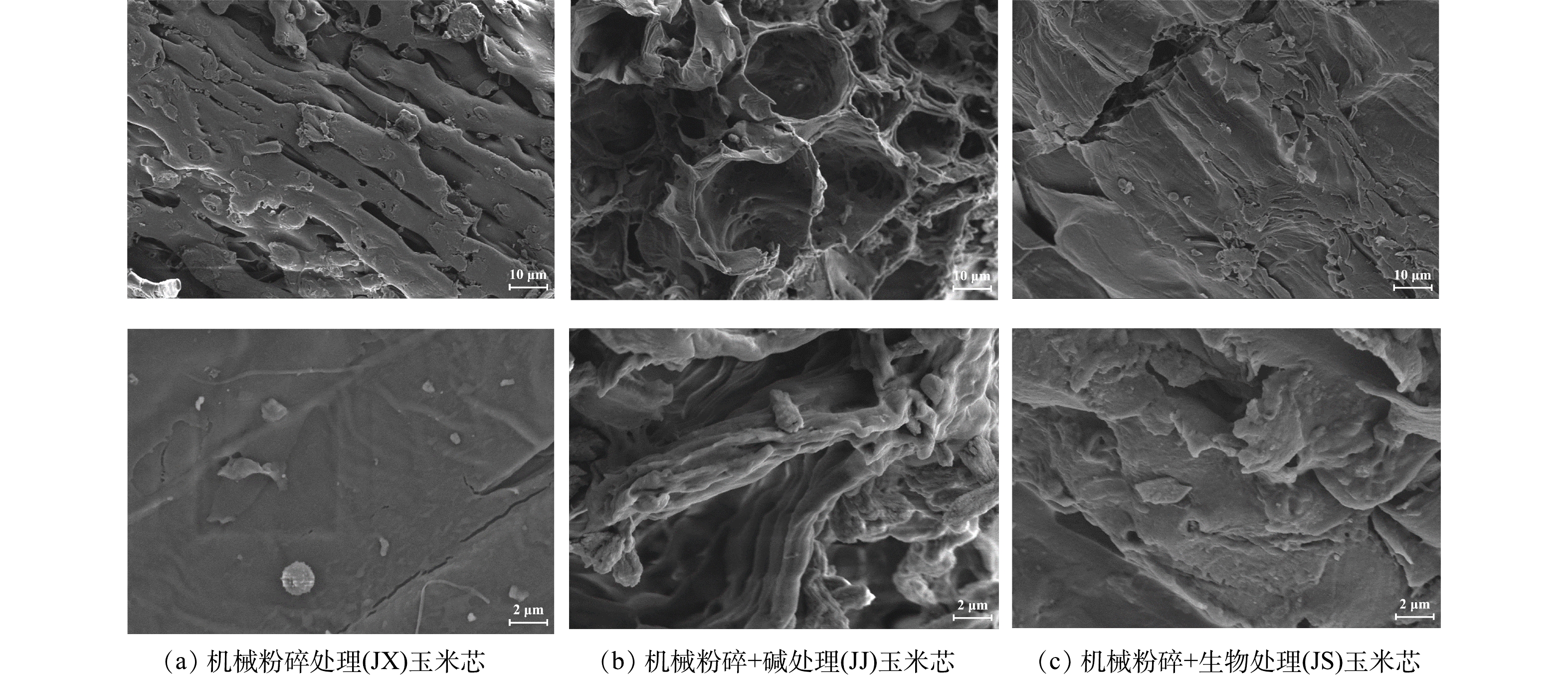
图2为机械粉碎、机械粉碎+碱处理、机械粉碎+生物处理的玉米芯不同放大倍数表面扫描电镜图。如图2所示,只经过机械粉碎的玉米芯结构紧密表面平整光滑,机械粉碎+碱处理和机械粉碎+生物处理的玉米芯表面呈现出不同程度的断层凹陷、网状孔洞,机械粉碎+碱处理的释碳填料表面粗糙程度最大、孔洞最多,并且孔洞分布相对均匀。机械粉碎+碱处理可有效破坏原有玉米芯表面的封闭结构,形成有效释放孔道,从而促使碳源的释放更加持续稳定,且其结构更适合微生物的附着生长[21]。
-
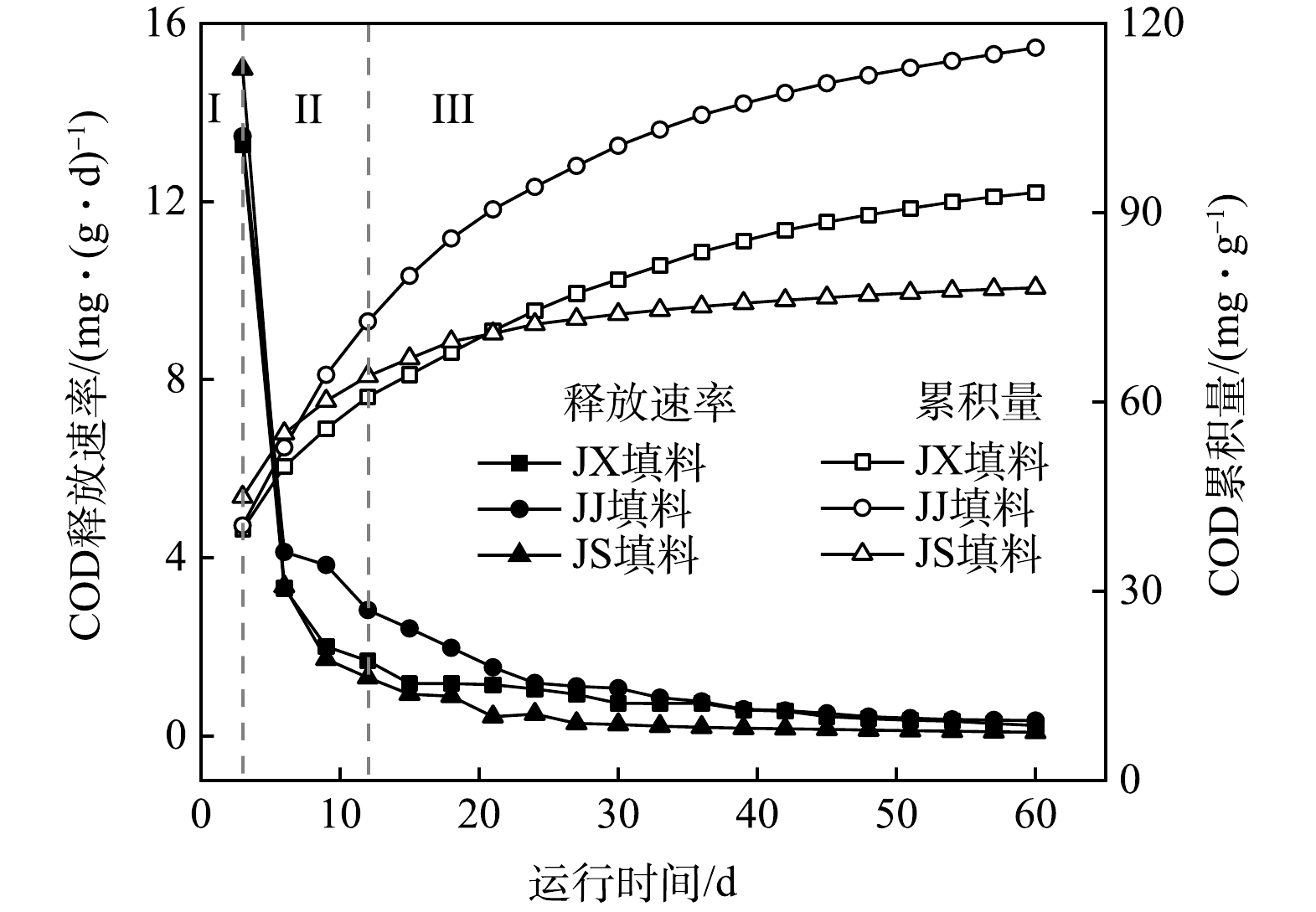
1) 3种填料静态释碳过程分析。3种填料碳源静态释放过程可分为3阶段:急速释放(阶段Ⅰ)、快速释放(阶段Ⅱ)和缓释阶段(阶段Ⅲ)。如图3所示,第Ⅰ阶段(1~3 d)为急速释放阶段,3种填料的释放速率均在该阶段达到最大值,分别为13.266、13.462、14.976 mg·(g·d)−1;第Ⅱ阶段(4~12 d)为快速释放阶段,3种填料的释放速率减小,分别为2.333、3.595、2.128 mg·(g·d)−1;第Ⅲ阶段(13~60 d)为缓释阶段,此阶段3种填料释放速率下降且趋于稳定,分别为0.675、0.904、0.292 mg·(g·d)−1。范天凤等[22]使用20%甲醇与1% NaOH改性枸杞枝后研究碳源释放速率时,只出现急速释放和缓慢释放2个阶段,相比而言,本论文制作的复合碳源存在稳定且长期的3个阶段,这有利于微生物对碳源的稳定长效利用。
碳源释放出现3个阶段的原因主要是:第Ⅰ、Ⅱ阶段,由于填料表面裸漏和内部包裹的玉米芯粉中含有大量水溶性物质和易分解的碳水化合物[23],导致COD快速释放;第Ⅲ阶段,由于玉米芯粉中易溶解和分解的有机物已溶出,剩余难分解的有机物在少量微生物的作用下缓慢释放从而达到稳定状态[22]。以上结果证实聚乙烯醇作为填料骨架可均衡整个释放过程的速率。此外,通过对3种填料60 d静态释碳累积量相比较,得JJ填料(116.139 mg·g−1)>JX填料(93.200 mg·g−1)>JS填料(78.079 mg·g−1)。综上所述,JJ填料在4~60 d内释放速率都处于最大,在整体释放过程中释放速率相比其他两者较稳定且静态释碳累积量最多。
2) 3种填料释碳动力学机制分析。为了解3种填料静态释碳机制,参考LV等[24]和RITGER等[25]使用的动力学拟合方法对本研究中3种填料释碳过程进行拟合。3种填料释碳过程通过式(1)和式(3)进行拟合,具体方程及参数见表2。可见,3种填料释碳过程均满足准二级动力学方程,且具有很高的相关性;同时Ritger-Peppas方程也表现出较好的拟合效果。由准二级动力学拟合结果可知,当Cm越大,填料的COD最终释放总量越大,K越大,填料的传质阻力越小,t1/2越小,这表明填料在短时间内释放出大量碳源[24]。3种填料中JJ填料的Cm值最大,具有较好的释碳能力;JS填料的K值最大,其传质阻力最小,导致其在释放过程前期快速释放,JX、JJ填料K值较小,在释放过程中释放缓慢;JS填料的t1/2值最小,其在短时间内释放大量碳源,这与前面提及的JS填料所有传质阻力最小、最易释放碳源的结论相一致;JJ填料t1/2值最大,其在释放过程中稳定,前后期释放速率差距小,这与3种填料静态释碳速率分析结果一致。由Ritger-Peppas方程拟合结果可知,3种填料N值均小于0.45,说明释碳机制主要为扩散过程,从而表明3种填料中溶解性有机物可通过填料孔洞溶出。
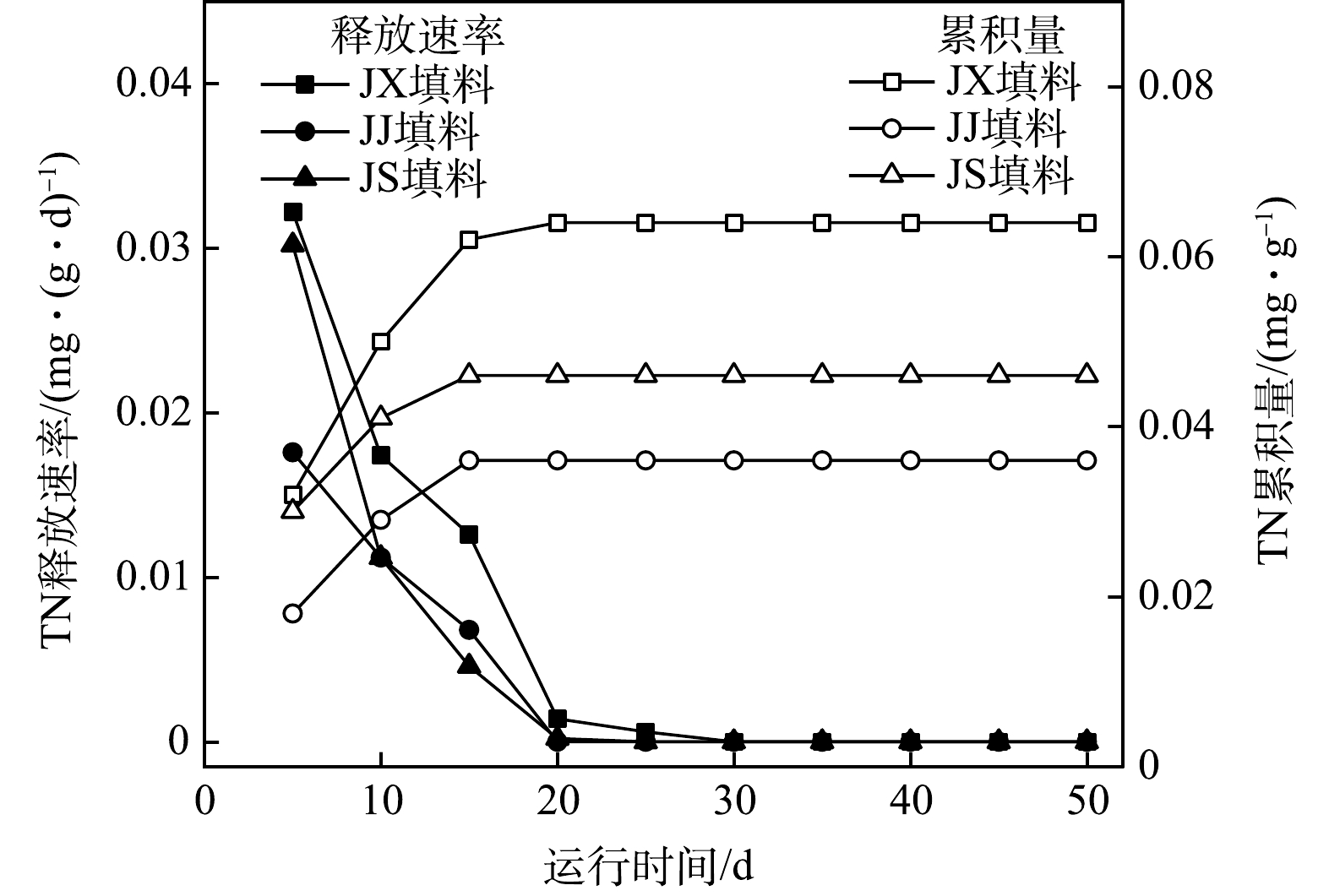
3) 3种填料TN释放过程分析。图4为3种填料二次污染物TN释放情况。如图4所示,TN表现出与碳释放类似的释放过程,3种填料TN释放速率在1~5 d均达到最大值,JJ填料1~5 d释放速率最小,为0.018 mg·(g·d)−1,JX填料、JS填料释放速率均小于0.032 mg·(g·d)−1,且3种填料在20 d后释放速率接近于0 mg·(g·d)−1。此外,3种填料TN释放累积量为JX填料(0.064 mg·g−1)>JS填料(0.046 mg·g−1)>JJ填料(0.036 mg·g−1)。以上结果表明:3种填料中TN经前期少量释放后,释放速率总体接近于0 mg·(g·d)−1的极低水平,这与已报道的玉米芯、玉米淀粉、植物秸秆释放结果接近[2,18];生物处理和1% NaOH碱处理对玉米芯中的氮元素有一定的去除,且1% NaOH碱处理效果更佳。
4) 3种填料浸出液荧光光谱分析。已有研究表明[26],玉米芯浸出液存在大量的甲酸、乙酸、草酸等小分子有机酸和葡萄糖、木糖等糖类物质,均具有较高的可生化性,可作为反硝化良好的碳源,通过三维荧光检测继续研究分析释放的可溶荧光性有机物的种类。图5为JX、JJ和JS填料浸出液三维荧光光谱解析图。如图5所示,从3种填料在13~15 d和28~30 d浸出液的三维荧光光谱观察到2个明显的峰,峰A(Ex/Em 220~225 nm/310~320 nm),峰B(Ex/Em 275 nm /320~330 nm),分别代表为酪氨酸/色氨酸[19]、酪氨酸/色氨酸蛋白[27,28],有研究表明,类酪氨酸物质和类色氨酸物质均属于类芳香蛋白物质,易被生物降解[29],且色氨酸类的有机物在生物降解过程中,容易被微生物所利用[30]。凌宇等[18]就6种农业废弃物初期碳源及溶解性有机物释放机制研究表明,玉米芯浸出液的可生化性好,更易被反硝化菌利用,不易造成二次污染。而三维荧光光谱对应的聚羧酸类腐植酸(IV区)、多环芳烃类腐植酸(V区)、富里酸(VI区)难生化的可溶荧光性有机物未在对应区域显示明显峰,表明玉米芯释放出的可溶荧光性有机物具有较好的可生化性。结合区域积分法(FRI)计算得到各区域积分标准体积(表3),随着时间的延长JX、JS填料浸出液区域积分标准体积大幅度减小,而JJ填料变化不大,说明JJ填料的酪氨酸/色氨酸类物质释放更均匀与稳定,这与填料静态释碳实验中COD的释放速率结果吻合。
-
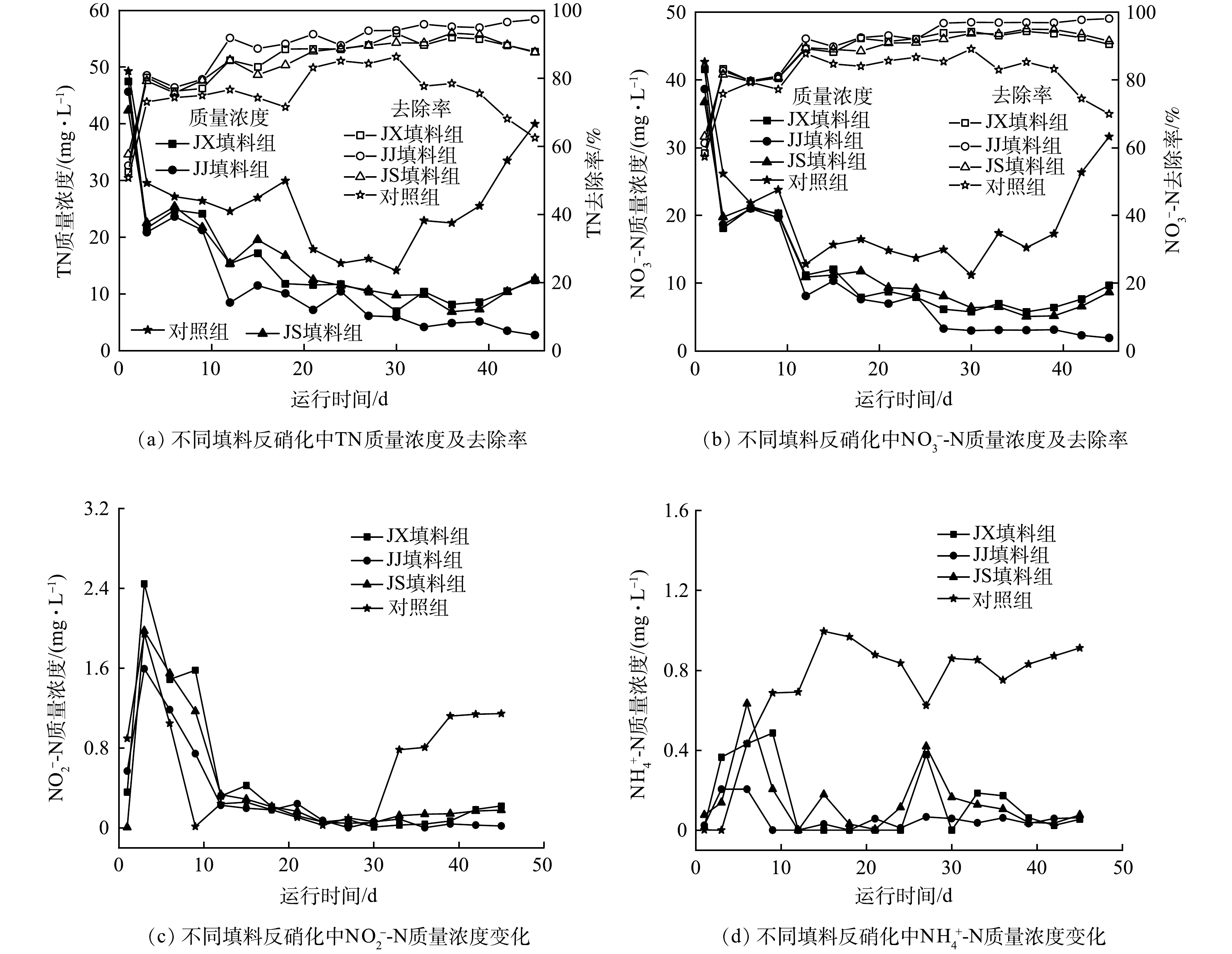
1)不同填料对反硝化过程TN去除效果的影响。图6为不同填料条件下不同形态氮元素质量浓度及去除率变化。TN的去除率及质量浓度变化如图6(a)所示,3种填料均呈现较好的脱氮效果,JJ填料组在第12天、JX、JS填料组在第30天去除率达90%以上。而赵文莉[7]将体积为1 cm3的玉米芯采用1.5% NaOH浸泡18 h后作为碳源,其NO3−-N质量浓度为40 mg·L−1时,运行至41 d时NO3−-N去除率才为91.37%,杨惠兰等[2]用PCL与PCL/玉米淀粉批式反硝化脱氮效果对比,试验进水NO3−-N质量浓度均为15 mg·L−1左右时,PCL的NO3−-N去除率最高仅为50.60%,PCL/玉米淀粉的NO3−-N去除率最高仅为64.20%。
填料中铁离子溶出可增强异养微生物活性,加速了木质素的分解并提供电子供体。同时,海绵铁的缓慢腐蚀也在不断产生氢气,供氢自养反硝化菌生长,可进一步加强反硝化[15]。随着时间延长,3种填料对TN的去除出现差异,JX、JS填料组在39 d后对TN的去除率开始呈现下降趋势,JJ填料组在45 d内去除率持续上升且TN的去除率稳定,第45天去除效率达到97.3%。这说明机械粉碎+碱处理相比机械粉碎和机械粉碎+生物处理更能使植物木质素结构遭到破坏使纤维素和半纤维素暴露出来,更容易为反硝化细菌提供电子供体。对照组在45 d内对TN有一定的去除率,前3 d去除率为50.7%,在第30天去除率最高,为86.3%,之后去除率迅速下降到62.5%。对照组前期部分微生物死亡分解,可为异养型反硝化菌提供电子供体,后期随着微生物被分解消耗殆尽导致电子供体不足,异养型反硝化菌逐渐分解,只剩余自养型反硝化菌,后期微生物的衰亡会释放含氮磷物质,导致溶液中TN质量浓度不降反升。
2)不同填料对反硝化过程NO3−-N、NO2−-N及NH4+-N去除效果的影响。反硝化菌利用有机碳作为电子供体在一系列的生物酶作用下先将NO3−还原为NO2−,再逐步还原为N2的过程,且硝酸盐还原酶对碳源的竞争能力强于亚硝酸盐还原酶[21]。填料静态反硝化实验过程中NO3−-N的去除率及NO3−-N、NO2−-N质量浓度变化见图6(b、c),3种填料NO3−-N的去除趋势与TN一致,JJ填料组在45 d内NO3−-N的去除率持续上升,最高为98.1%。而SHEN等[31]将PLC与淀粉混合,用其进行NO3−-N质量浓度仅有25 mg·L−1的实验配水脱氮,对NO3−-N去除率为90%,闫续[12]等将淀粉和PVA共混,并于硼酸溶液中浸泡交联,制备了淀粉含量为43%的缓释碳源,反硝化脱氮15 d后,随着碳源的释放殆尽,脱氮效果就开始出现下降现象。添加填料组与对照组在1~6 d均出现NO3−-N质量浓度快速下降和NO2−-N少量累积的现象,主要由于前期提供的碳源被硝酸盐还原酶利用[22],导致NO3−还原为NO2−的速率大于NO2−还原为N2的速率,从而造成NO2−-N的累积。添加填料组在6 d后NO2−-N的累积逐渐降低,其中JJ填料组在24~45 d的NO2−-N平均累积量最小,为0.037 mg·L−1,而对照组在33~45 d时再次开始出现NO2−-N的累积现象,原因是对照组没有添加外部电子供体,当电子供体不足时,容易引起NO2−-N的积累[32]。填料静态反硝化实验过程中NH4+-N质量浓度变化见图6(d),添加填料组在1~9 d内NH4+-N的质量浓度高于对照组,最高为0.633 mg·L−1,结合释放实验推测NH4+-N可能由于玉米芯粉自身浸泡产生,在10~45 d内NH4+-N质量浓度趋于稳定,保持在0.073 mg·L−1左右,JJ填料组NH4+-N质量浓度最低。对照组在10~45 d内NH4+-N质量浓度远高于添加填料组,原因是对照组无外部碳源供养微生物,可能导致微生物死亡释放NH4+-N。
3)不同填料条件下反硝化过程中COD的变化。图7为不同填料反硝化中COD变化及JJ填料组COD利用率。如图7(a)所示,添加填料组在1~9 d反硝化实验出水COD呈快速降低趋势,并且与图6(a)中TN的去除率在1~12 d呈现快速增长趋势吻合。这表明填料中附着的小分子有机物被微生物大量利用,从而表现出良好的脱氮效果[33]。添加填料组在10~45 d反硝化实验出水COD处于稳定状态,JX、JJ和JS填料反硝化实验出水COD平均值分别为15.412、29.690、19.877 mg·L−1,表明释碳与反硝化耗碳达到平衡,且机械粉碎+碱处理的玉米芯粉合成的填料更能为反硝化脱氮提供足够的碳源,从而保持着较高的脱氮效率,这与TN的去除结果吻合。而唐丹琦等[4]以聚乳酸/淀粉固体缓释碳源生物反硝化实验时平均出水COD高达30~70 mg·L−1,李斌等[34]单独以农业废弃物稻草、玉米芯作为反硝化固体碳源,出水COD均超过80 mg·L−1。反硝化中COD的释放量大于静态释碳中COD的释放量,表明玉米芯中的纤维素、木质素容易被微生物分解释放。实验周期内对照组COD为0~20.271 mg·L−1,这是由于对照组无外部碳源供养微生物,导致部分微生物在死亡和被其它存活的微生物降解之间循环,从而使COD处于波动状态。理论上还原1 mg NO3−-N为需要消耗2.86 mg COD。通过计算NO3−-N的去除量可得COD的理论消耗量。如图7(b)所示,JJ填料组在1~12 d对COD理论利用率由53.21%升高至94.25%,12~45 d对COD理论利用率稳定在90.34%。以上结果表明微生物在反硝化过程中对JJ填料释放出的碳源利用率较高,降低了因碳源利用不足而导致的COD残余。
-
1) 60 d静态释碳累积量为JJ填料(116.139 mg·g−1)>JX填料(93.200 mg·g−1)>JS填料(78.079 mg·g−1),TN释放总体上近于0 mg·(g·d)−1的极低水平,表明JJ填料在释放过程中前后释放速率较稳定且释碳量多,二次污染物释放最小。
2) 3种填料释碳过程同时符合准二级动力学方程和Ritger-Peppas方程。JJ填料Cm、t1/2值最大,具有较好的释碳能力和稳定的释放速率;Ritger-Peppas方程拟合结果为3种填料N<0.45,释放机制均为扩散。
3) 3种填料释放出的可溶荧光性有机物均为酪氨酸/色氨酸、酪氨酸/色氨酸蛋白类物质,易被生物降解;机械粉碎+碱处理后的玉米芯结构使碳源的释放更加多而稳定,且适合微生物的附着生长。
4)通过在玉米芯中掺杂海绵铁增加了释碳填料的反硝化功能。JJ填料组在第12天,JX、JS填料组在第30天对TN的去除率达90%以上,JJ填料组对TN的去除率最高达97.3%;JX、JJ和JS填料组在10~45 d反硝化过程中的出水COD平均值分别为15.412、29.690、19.877 mg·L−1,JJ填料组对COD理论利用率稳定在90.34%,表明玉米芯经机械粉碎+1% NaOH碱处理与海绵铁、聚乙烯醇复合后,更适合作为长期反硝化复合释碳填料。
复合释碳填料的制备及其反硝化性能
Preparation of composite carbon release filler and its denitrification properties
-
摘要: 为探究长期反硝化过程中复合释碳填料释碳能力及脱氮效能的提高途径,采用机械粉碎(JX)、机械粉碎+碱处理(JJ)、机械粉碎+生物处理(JS)3种方法对玉米芯进行预处理后作为填料核心基材,掺杂海绵铁提高复合释碳填料释放电子供体能力,生成的Fe2+、Fe3+充当碳源-微生物-硝酸盐之间的电子转移中间体,聚乙烯醇作为粘结剂将其与海绵铁粘结,制备了JX、JJ和JS 3种生物膜载体复合释碳填料。研究3种填料的释碳性能及静态反硝化特性。结果表明: 3种填料在60 d内的静态释碳过程可分3个阶段,释碳累积量为JJ填料(116.139 mg·g−1)>JX填料(93.200 mg·g−1)>JS填料(78.079 mg·g−1),二次污染物TN释放量接近于0 mg·(g·d)−1;采用准二级动力学拟合释碳过程,JJ填料的Cm、t1/2值最大,具有较好的释碳能力和稳定的释放速率,Ritger-Peppas方程拟合结果为3种填料N<0.45,释放机制均为扩散; 3种填料释放出的可溶荧光性有机物均为酪氨酸/色氨酸、酪氨酸/色氨酸蛋白类物质,易被生物降解,机械粉碎+碱处理后的玉米芯结构使碳源的释放更加多而稳定,且适合微生物附着生长; 3种填料静态反硝化稳定期,对TN的去除率均能达到90%以上,JJ填料组对TN的去除率最高达97.3%,JX、JJ、JS填料在10~45 d反硝化过程中COD平均值分别为15.412、29.690、19.877 mg·L−1,JJ填料组对COD理论利用率稳定在90.34%。研究结果表明,玉米芯经机械粉碎+1% NaOH碱处理与海绵铁、聚乙烯醇复合后,更适合作为长期反硝化复合释碳填料。Abstract: In order to explore the ways to improve the carbon-releasing and denitrifying performance of composite carbon-releasing fillers during the long-term denitrification process, three methods of mechanical pulverization (JX), mechanical pulverization+alkali treatment (JJ), and mechanical pulverization+biological treatment (JS) were used to treat corncob. After pretreatment, it was used as the core substrate of the filler, and sponge iron was added to improve the electron donors release ability of the composite carbon-releasing filler. The generated Fe2+ and Fe3+ acted as electron transfer intermediates between carbon source, microorganisms and nitrate, and polyvinyl alcohol was used as binder for the adhension of the core substrate and sponge iron. Three kinds of biofilm carrier composite decarburization fillers, JX , JJ and JS filler, were prepared. Their release performance and static denitrification characteristics were studied. The results showed that the 60 d static carbon release process of the three fillers was divided into three stages, and the accumulation amount of carbon release was JJ filler (116.139 mg·L−1) > JX filler (93.200 mg·L−1) > JS filler (78.079 mg·L−1), and the secondary pollutant TN release was close to 0. Pseudo-second-order kinetics were used to fit the carbon release process. JJ filler had the largest Cm and t1/2 values, and better carbon release ability and stable release rate. The fitting result of Ritger-Peppas equation was following: N values of 3 kinds of fillers were lower than 0.45, and their release mechanisms were diffusion. The soluble fluorescent organic matter released from the three fillers were tyrosine/tryptophan amino acid and tyrosine/tryptophan protein, which were easily biodegradable, and the structure of corncob after mechanical crushing+alkali treatment made carbon source release more abundant and stable, which was suitable for microbial attachment and growth. In the static denitrification process of the three fillers, TN removal rate was higher than 90% during the stabilization period, and the highest TN removal rate of 97.3% was achieved by the JJ filler group. The average COD concentrations of JX, JJ and JS fillers in the 10-45 d denitrification experiments were 15.412, 29.690 and 19.877 mg·L−1, respectively. The theoretical utilization rate of COD in JJ filler group was stable at 90.34%. In conclusion, the results showed that corncob was suitable for long-term denitrification composite carbon release filler after mechanical crushing+1% NaOH alkali treatment and compounding with sponge iron and polyvinyl alcohol.
-
Key words:
- denitrification /
- composite carbon release filler /
- corncob /
- denitrification efficiency /
- kinetics
-
芳香胺类化合物广泛应用于染料、杀虫剂、橡胶制品及树脂等化工产品的生产合成中。这些产品的降解及生产废水的排放都会导致芳香胺释放到环境中[1]。由于芳香胺类化合物具有生物毒性,会造成肝肾等器官的损伤及“三致效应”[2]。因此,芳香胺类化合物亟待得到有效处理。
芬顿高级氧化法是一种高效处理芳香胺废水的方法,H2O2与亚铁离子(Fe2+)反应产生的HO·具有较高的氧化电位,可有效降解芳香胺类化合物。但传统的芬顿反应必须在酸性条件下进行,且须持续不断地投加芬顿试剂(Fe2+、H2O2),其成本较高。AHMADI等[3]利用PAC@Fe(II)Fe2(III)O4做催化剂构建光/电芬顿反应,使苯胺的降解率可达到93.8%,但该过程同样须引入光照并持续投加H2O2。为此,SEKAR等[4]利用微生物好氧呼吸产生的H2O2及铁还原菌厌氧还原Fe3+产生的Fe2+构建芬顿反应,并通过厌氧-好氧循环来不断地产生Fe2+和H2O2。然而,微生物好氧呼吸产生的H2O2非常有限。据研究[5-6],真菌G. trabeum胞外分泌的2,5-二甲氧基-1,4-氢醌和4,5二甲氧基-1,2-氢醌与Fe3+反应,产生Fe2+和醌自由基,后者与氧气反应产生H2O2,从而构建芬顿反应以降解聚乙二醇。然而,真菌生长速率缓慢,且产生的氢醌浓度也非常有限。KEREM等[5]研究表明,在有氧条件下,厌氧生物还原后的醌化合物可以自氧化产生醌自由基,进而与氧气发生反应,生成H2O2。
基于上述研究,本研究采取外加醌类化合物的方法来提高H2O2的产生量,在厌氧条件下,醌类化合物能够作为氧化还原介体[7]提高Fe3+还原为Fe2+的速率,从而加快芬顿反应的构建;为使醌化合物能够重复利用,采用化学方法将蒽醌-2-磺酸(AQS)固定在大孔聚氨酯泡沫上,来构建固定化醌耦合生物驱动的芬顿反应,并研究了该反应对苯胺和难生物降解的磺酸萘胺的降解性能。
1. 材料与方法
1.1 实验原料
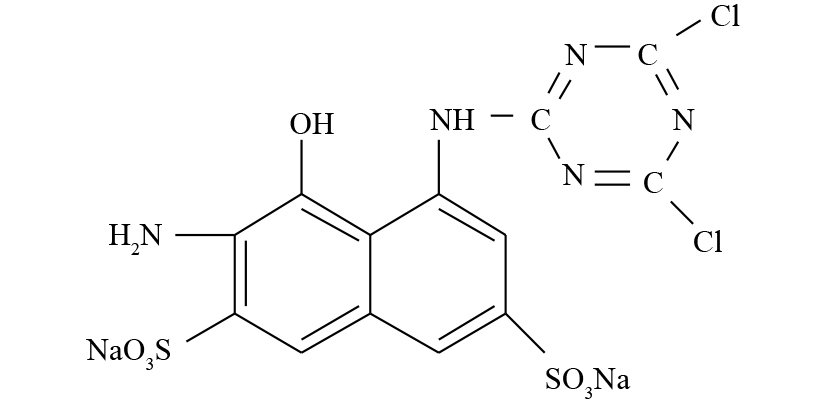
苯胺购自美仑生物科技公司;2-氨基-8-N-(4, 6-二氯-1, 3, 5-三嗪-2-基)氨基-1-萘酚-3,6-二磺酸钠盐(ADCTNDS)为本实验室制备提纯(结构式见图1);蒽醌-2-磺酸钠盐(AQS)购于美国Sigma有限公司;大孔聚氨酯泡沫(PUF)来自大连博多科技开发有限公司(1 cm × 1 cm × 1 cm),其比表面积为18 000 m2·m−3。液相色谱所用甲醇等均为色谱纯;其他试剂均为分析纯。实验用菌株Shewanella sp. ROs-106由本实验室分离纯化,活化培养基和无机盐培养基不变[8]。
厌氧培养基为无机盐培养基加乳酸钠。采用化学方法将AQS固定到泡沫材料上[9-10]。通过元素分析可知,制成的醌改性大孔泡沫(AQS-PUF)中醌含量为(0.047 5 ± 0.019 0) mmol·g−1 PUF。采用傅里叶红外漫反射光谱法研究AQS-PUF反应前后表面基团的变化。
1.2 实验仪器
紫外-可见分光光度仪(UV-5500,上海元析仪器有限公司);化学发光仪(MPI-B型,西安瑞迈分析仪器有限责任公司);高效液相色谱(SIL-20A,岛津公司);电子顺磁共振(A200,德国布鲁克仪器公司);元素分析仪(Vario EL cube,德国元素分析系统公司);傅里叶红外光谱仪(EQUINOX55,德国布鲁克仪器公司)。
1.3 实验方法
1) 菌株的活化与培养。从−80 ℃冰箱中取出菌株RQs-106,常温解冻后接入灭菌后的20 mL LB培养基,在30 ℃,150 r·min−1条件下培养5 h后,按1%的接种量将菌液接入100 mL LB培养基中扩大培养,12 h后,高速离心(10 000 r·min−1,5 min,4 ℃),弃去上清液,然后用磷酸盐缓冲液将细胞洗涤3次,并悬浮在磷酸盐缓冲液中待用。
2) 生物蒽醌法产H2O2条件优化。在125 mL血清瓶中,加入100 mL厌氧培养基以及一定浓度游离态的AQS,丁基胶塞封口后曝氮气15 min,钳口铝盖密封并于121 ℃下灭菌20 min,冷却至室温,然后在厌氧箱中将菌株ROs-106加入到血清瓶中培养。定时用注射器取样,并使样品与空气充分反应,最后测量样品中H2O2浓度。分别研究AQS浓度(0~0.20 mmol·L−1)、生物量(0~0.22 g·L−1)和乳酸钠浓度(0~60 mmol·L−1)对反应体系中H2O2产生量的影响。
3) 柠檬酸铁浓度对苯胺降解的影响。分别向125 mL血清瓶中加入100 mL厌氧培养基(乳酸钠 40 mmol·L−1)、制备的AQS-PUF泡沫0.5 g(0.20 mmol·L−1 AQS)和不同浓度柠檬酸铁(0~6.0 mmol·L−1),曝气灭菌方法同上,待冷却至室温后,于厌氧箱中加入0.16 g·L−1生物量,每间隔1.5 h取样,测量样品中Fe2+浓度,以确定厌氧反应需要持续时间。当厌氧反应结束后,好氧反应开始,当体系中Fe2+浓度低于25%时,好氧反应结束,这段时间为好氧反应所需时间。厌氧-好氧反应时间确定后,于不同浓度柠檬酸铁(0~6.0 mmol·L−1)体系中,加入初始浓度为50 μmol·L−1的苯胺,开始厌氧-好氧循环反应。厌氧反应条件为反应开始前曝氮气20 min,将瓶口用胶塞密封,放入厌氧箱30 ℃培养;好氧反应条件为将胶塞换为透气棉塞,于30 ℃,150 r·min−1摇床中培养。在好氧反应开始和结束时取样并测定水中苯胺浓度,研究不同浓度柠檬酸铁对苯胺降解的影响。
4) 芬顿反应的构建和芳香胺的降解。向125 mL血清瓶中加入100 mL厌氧培养基(40 mmol·L−1乳酸钠、0.5 g AQS-PUF(0.20 mmol·L−1 AQS)和4.5 mmol·L−1柠檬酸铁),曝气灭菌方法同上,待冷却至室温后,于厌氧箱中加入0.16 g·L−1生物量和初始浓度为50 μmol·L−1的苯胺和ADCTNDS,开始厌氧-好氧循环(21 h/3 h)反应;同时,以无柠檬酸铁或者无生物量作为空白对照实验,其他反应条件相同。在好氧反应开始和结束时取样,测量样品中2种芳香胺的浓度。
1.4 分析方法
细胞浓度采用分光光度法检测;H2O2浓度采用鲁米诺化学发光法[11]检测;Fe2+浓度采用Ferrozine方法检测;苯胺的检测方法为高效液相色谱法(分析条件:甲醇∶水 = 40∶60,UV检测波长为280 nm,色谱柱为Sapphire C18(尺寸:4.6 mm × 250 mm × 5 μm),流速为1.0 mL·min−1,柱温为40 ℃);ADCTNDS检测方法为高效液相色谱法(分析条件:甲醇∶乙酸铵水溶液(0.385 g·L−1) = 60∶40,检测波长为462 nm,流速为0.5 mL·min−1,其他测定条件同苯胺);反应体系中菌株RQs-106细胞数量采用细菌菌落计数法检测;体系中羟基自由基采用电子自旋共振法(以80 mmol·L−1二甲基吡咯啉氮氧化物(DMPO)捕捉水样中的HO·)检测。
2. 结果与讨论
2.1 生物蒽醌法产H2O2特性
生物还原AQS为AH2QS的反应,通常较慢,而AH2QS与氧气接触产生H2O2的过程是化学反应过程,反应速率非常快,因此,AQS的厌氧还原过程是限速步骤。在这一过程中,AQS浓度、初始生物量和碳源浓度是影响H2O2产生量和产生速率的重要因素。因此,本研究以乳酸钠作为碳源,研究了AQS浓度、初始生物量和碳源浓度对H2O2产生量和产生速率的影响,结果如图2所示。
AQS作为产H2O2反应的主要反应物,其浓度对H2O2产量有直接影响[12]。考虑到固定化AQS浓度有限以及泡沫体积的影响,反应体系中添加的固定化AQS浓度最大为0.20 mmol·L−1。0~0.20 mmol·L−1 AQS浓度对H2O2产生量的影响如图2(a)所示,可以看出,反应体系中H2O2产量随AQS浓度增大而增大,当AQS浓度为0.20 mmol·L−1,H2O2的产生量最大。
图2(b)表明,随着初始生物量的增加,H2O2的产生量逐渐增高,当初始菌浓度为0.16 g·L−1时,在11 h内,生成了44.9 μmol·L−1 H2O2;但当生物量继续增加到0.22 g·L−1时,虽然在反应开始阶段H2O2的产生速率较快,但是之后速度明显降低,推测可能是大量的微生物代谢消耗了作为电子供体的乳酸钠,因此,最适的生物量为0.16 g·L−1。
图2(c)表明,乳酸钠浓度为0~60 mmol·L−1时,随乳酸钠浓度增大,H2O2产生量也增大,60 mmol·L−1乳酸钠体系在9 h产生了55.0 μmol·L−1的H2O2;但在随后的反应中,H2O2浓度随反应时间大幅降低。相比较,40 mmol·L−1乳酸钠体系在9 h产生的53.4 μmol·L−1 H2O2与60 mmol·L−1体系产量相差不大且较为稳定,因此,选择乳酸钠浓度为40 mmol·L−1。
综上可知,本研究中用生物还原AQS的方法产生的H2O2为53 μmol·L−1左右,高于MCKINZI等[13]构建生物驱动的芬顿反应中H2O2的产生量30 μmol·L−1,且远小于会对细胞造成毒性的浓度(1 mmol·L−1)[14],因此,采用0.20 mmol·L−1 AQS、0.16 g·L−1生物量和40 mmol·L−1乳酸钠作为最优条件用于H2O2的制备。
2.2 柠檬酸铁浓度对苯胺降解的影响
固定化AQS耦合生物驱动的芬顿反应的厌氧反应具体分为2个阶段。第1阶段为Fe2+的制备,菌株RQs-106作为铁还原菌,在厌氧条件下以乳酸钠为电子供体,将柠檬酸铁中的Fe3+还原为Fe2+,同时,AQS-PUF的存在能够加速这一反应过程[7]。由图3可以看出,当柠檬酸铁为0~6.0 mmol·L−1时,体系中Fe2+浓度达到最大所需的时间为12 h。第2阶段为氢醌的制备,Fe3+完全还原为Fe2+后,菌株RQs-106作为AQS还原菌,在厌氧条件下,以乳酸钠为电子供体,可以将AQS-PUF还原为AH2QS-PUF,这一阶段反应需要12 h(图2(c))。
然后开始进行好氧反应,AH2QS-PUF自氧化产生H2O2和Fe2+构建芬顿反应,进而降解苯胺,结果如图4所示。可以看出,苯胺去除率随柠檬酸铁浓度的增大而增大,4次厌氧-好氧循环(24 h/3 h)后,在无柠檬酸铁的反应体系中,苯胺的去除率为12.8%;在无生物量的反应体系中,苯胺的去除率仅为7.6%,即泡沫对苯胺的吸附量占7.6%。由此可见,空白对照组中苯胺浓度的降低主要为泡沫材料对苯胺的吸附所致。当柠檬酸铁浓度为4.5 mmol·L−1和6.0 mmol·L−1时,反应体系中苯胺去除率可分别达到46.2%和45.3%。由此可见,4.5 mmol·L−1柠檬酸铁体系对苯胺的去除率最大。由于4.5 mmol·L−1柠檬酸铁体系中的Fe2+浓度在9 h达到最大,因此,厌氧反应第1阶段的反应时间设为9 h。从图2可知,第2阶段时间为12 h,在好氧阶段,当体系中Fe2+浓度低于总铁含量的25%时,好氧反应结束,这段时间为3 h。综上可知,在后续反应中,厌氧-好氧循环的时间为21 h/3 h。
2.3 芬顿反应对芳香胺物质的降解
偶氮染料X-3B的脱色产物为苯胺和ADCTNDS。本研究以这2种芳香胺为模型化合物,苯胺稍溶于水,ADCTNDS含有磺酸基团,使其易溶于水,难于生物降解。据报道[15],芬顿反应的非特异性使其对多种芳香胺均有较好的降解效果,因此,须继续研究AQS-PUF耦合生物驱动的芬顿反应对这2种芳香胺的降解。在最适条件下,添加0.20 mmol·L−1固定化AQS、4.5 mmol·L−1柠檬酸铁、50 μmol·L−1的苯胺和ADCTNDS,结果如图5所示。可以看出,经过7次厌氧-好氧循环后,苯胺去除率为48.6%(无柠檬酸铁的反应体系中苯胺去除率仅为10.0%,其中,AQS-PUF对苯胺的吸附量占6.6%),ADCTNDS的去除率为43.3%(无柠檬酸铁的反应体系中ADCTNDS去除率仅为7.3%,其中,AQS-PUF对ADCTNDS的吸附量占4.3%)。其主要的降解反应发生在前4次循环中,苯胺和ADCTNDS在前4次循环中的去除率分别达到了44.6%和35.4%。在无柠檬酸铁体系中,对应的去除率分别为6.9%和6.8%。
可以看出,苯胺和ADCTNDS的去除率在后3次循环中有所下降。为了探究其原因,以无芳香胺体系作为空白对照,检测了7次循环体系中的Fe2+、H2O2和菌株RQs-106活细胞数目变化,结果如图6(a)所示。在7次循环反应过程中,厌氧阶段结束后产生的Fe2+的浓度均能维持在3.5~4.5 mmol·L−1,好氧阶段结束后,Fe2+浓度在芬顿反应和空气中O2氧化的作用下降低至0~1.5 mmol·L−1,芳香胺的存在对Fe2+的生成量和消耗量几乎没有影响。但是,在最后3次循环中,Fe2+的生成量和消耗量低于前4次的循环。由图6(b)可以看出,7次循环中AH2QS-PUF自氧化产生的H2O2浓度维持在25 μmol·L−1以上,最高可达42.9 μmol·L−1。与空白对照相比,有芳香胺存在的体系,H2O2的消耗量更大一些,这表明H2O2参与了芳香胺的降解。同样,在最后3次循环中,双氧水的产生量也低于前4次的循环。为了探究后3次循环苯胺去除率降低的原因,对反应体系中的生物量进行测量。在前4次循环中,虽然在厌氧结算体系内RQs-106出现死亡,但是好氧阶段细胞增长快速,活细胞数仅略低于初始细胞浓度水平;但是在后3次循环中,体系内的菌株RQs-106在厌氧期间大量死亡,且最后一次循环中的体系中活细胞数仅为4.2 × 106 mL−1,小于0 h的105 × 106 mL−1,这可能是由于在厌氧反应阶段须消耗大量电子供体乳酸钠还原Fe3+和AQS-PUF,最后3次循环中电子供体的不足,造成了菌体死亡,从而导致芳香胺去除率的降低。因此,可以通过每3次循环后向体系中添加乳酸钠来提高芳香胺的去除率。
采用自由基捕获剂DMPO对体系中的HO·进行测定,其结果如图7所示。相对于空白体系,添加柠檬酸铁的体系中检测到峰高比例为1∶2∶2∶1的HO·加合物特征峰[16],证明了体系中HO·的存在,由此可判定体系中发生了芬顿反应。但是体系中产生的HO·的氧化性没有选择性,可能会进攻材料结构以及AQS-PUF材料上共价键结合的AQS,从而造成材料的不可逆损失。因此,对反应前后的AQS-PUF进行了傅里叶红外漫反射检测。如图8(a)所示,反应前后泡沫骨架结构并未发生改变,且图8(a)表明了泡沫表面各基团特征峰也未发生明显变化,1 658 cm−1处的醌式结构特征峰未出现明显降低,可见芬顿反应对材料的影响极小,表明采用这种固定化的AQS-PUF用于H2O2浓度较低(0~50 μmol·L−1)的芬顿反应中是可行的。
上述研究表明,本研究成功构建了固定化醌耦合生物驱动的芬顿反应。其反应过程为:首先,固定化AQS在体系中作为氧化还原介体加快了Fe3+向Fe2+的还原;然后,固定化AQS在菌株RQs-106的作用下参与厌氧/好氧循环从而产生H2O2;最后,Fe2+与H2O2在好氧体系中发生芬顿反应,产生的HO·能够降解芳香胺。可见,固定化AQS的加入不仅提高了H2O2的产生量,并且该材料可以循环利用,使得AQS-PUF耦合生物驱动的芬顿反应在处理芳香胺类物质方面具有潜在的应用价值。
3. 结论
1)在AQS-PUF耦合生物驱动的芬顿反应中,H2O2来自于AQS-PUF厌氧生物还原-好氧自氧化循环,Fe2+来自于AQS-PUF介导的柠檬酸铁厌氧生物还原。反应的最适条件为:0.20 mmol·L−1固定化AQS、0.16 g·L−1生物量、40 mmol·L−1乳酸钠、4.5 mmol·L−1柠檬酸铁。
2)在最适条件下,在厌氧-好氧(21 h/3 h)循环过程中,H2O2浓度最高可达42.9 μmol·L−1,循环7次后,对苯胺和ADCTNDS去除率分别可达48.6%和43.3%。
3)本研究中的芬顿反应对固定化AQS的影响很小,表明采用这种固定化的AQS用于H2O2浓度小于50 μmol·L−1的芬顿反应中是可行的。
-
表 1 荧光光谱区域及对应物质类型
Table 1. Fluorescence spectral region and the corresponding substance type
荧光区域 Ex/nm Em/nm 物质类型 Ⅰ 200~250 250~400 酪氨酸/色氨酸 Ⅱ 250~300 250~400 酪氨酸/色氨酸蛋白 Ⅲ 300~400 250~400 多糖 Ⅳ 300~400 400~550 聚羧酸类腐植酸 Ⅴ 250~300 400~550 多环芳烃类腐植酸 Ⅵ 200~250 400~550 富里酸 表 2 3种填料释碳动力学拟合结果
Table 2. Fitting results of carbon release kinetics of three fillers
填料类型 准二级动力学方程 Ritger-peppas方程 拟合方程 R2 Cm K t1/2 拟合方程 R2 N JX填料 t/Ct=0.001 91t+0.0160 4 0.995 523.56 62.34 8.40 Ct=151.798t0.279 0.996 0.279 JJ填料 t/Ct=0.001 50t+0.0141 8 0.998 666.67 70.52 9.45 Ct=165.619t0.316 0.975 0.316 JS填料 t/Ct=0.002 44t+0.0076 8 0.999 409.84 130.21 3.15 Ct=213.452t0.155 0.940 0.155 表 3 3种填料13~15 d、28~30 d浸出液的荧光区域积分标准体积
Table 3. Fluorescence region integral standard volume of leachate from 13 to 15 days and 28 to 30 days for three fillers
填料类型 13~15 d 28~30 d 区域Ⅰ积分标准体积/(au·nm2) 区域Ⅱ积分标准体积/(au·nm2) 区域Ⅰ积分标准体积/(au·nm2) 区域Ⅱ积分标准体积/(au·nm2) JX填料 2.293 2×107 1.900 1×107 1.216 5×107 7.980 2×106 JJ填料 3.127 1×107 3.138 3×107 2.387 3×107 2.047 1×107 JS填料 2.842 6×107 2.719 7×107 8.243 4×106 5.613 2×106 -
[1] LIU Y, WEI D, XU W, et al. Nitrogen removal in a combined aerobic granular sludge and solid-phase biological denitrification system: system evaluation and community structure[J]. Bioresource technology, 2019, 288: 121504. doi: 10.1016/j.biortech.2019.121504 [2] 杨惠兰, 张丹, 兰书焕, 等. 聚己内酯复合固体碳源的制备及其深度脱氮性能研究[J]. 环境科学学报, 2022, 42(5): 263-273. doi: 10.13671/j.hjkxxb.2021.0415 [3] QI W, TAHERZADEH M J, RUAN Y, et al. Denitrification performance and microbial communities of solid-phase denitrifying reactors using poly (butylene succinate)/bamboo powder composite[J]. Bioresource Technology, 2020, 305: 123033. doi: 10.1016/j.biortech.2020.123033 [4] 唐丹琦, 王娟, 郑天龙, 等. 聚乳酸/淀粉固体缓释碳源生物反硝化研究[J]. 环境科学, 2014, 35(6): 2236-2240. doi: 10.13227/j.hjkx.2014.06.027 [5] WANG J, CHU L. Biological nitrate removal from water and wastewater by solid-phase denitrification process[J]. Biotechnology Advances, 2016, 34(6): 1103-1112. doi: 10.1016/j.biotechadv.2016.07.001 [6] YU S, DONG X, ZHAO P, et al. Decoupled temperature and pressure hydrothermal synthesis of carbon sub-micron spheres from cellulose[J]. Nature Communications, 2022, 13(1): 1-10. doi: 10.1038/s41467-021-27699-2 [7] 赵文莉. 复合碳源填料深度反硝化脱氮特性研究[D]. 北京: 北京工业大学, 2015. [8] 凌宇. 高效缓释碳源填料用于污水厂尾水深度脱氮的研究[D]. 北京: 中国环境科学研究院, 2021. [9] XIONG R, YU X, YU L, et al. Biological denitrification using polycaprolactone-peanut shell as slow-release carbon source treating drainage of municipal WWTP[J]. Chemosphere, 2019, 235: 434-439. doi: 10.1016/j.chemosphere.2019.06.198 [10] YANG Z, SUN H, ZHOU Q, et al. Nitrogen removal performance in pilot-scale solid-phase denitrification systems using novel biodegradable blends for treatment of waste water treatment plants effluent[J]. Bioresource Technology, 2020, 305: 122994. doi: 10.1016/j.biortech.2020.122994 [11] 王润众, 郝瑞霞, 赵文莉. 新型缓释碳源的制备及其性能[J]. 环境工程学报, 2016, 10(1): 81-87. doi: 10.12030/j.cjee.20160113 [12] 闫续, 许柯, 耿金菊等. 两种释碳材料的制备及其性能研究[J]. 中国环境科学, 2012, 32(11): 1984-1990. doi: 10.3969/j.issn.1000-6923.2012.11.009 [13] WATANABE K, MANEFIELD M, LEE M, et al. Electron shuttles in biotechnology[J]. Current Opinion in Biotechnology, 2009, 20(6): 633-641. doi: 10.1016/j.copbio.2009.09.006 [14] LIU H, CHEN Z, GUAN Y, et al. Role and application of iron in water treatment for nitrogen removal: A review[J]. Chemosphere, 2018, 204: 51-62. doi: 10.1016/j.chemosphere.2018.04.019 [15] 李斌, 郝瑞霞, 赵文莉. 玉米芯与海绵铁复合填料的反硝化脱氮特性[J]. 中国给水排水, 2014, 30(7): 31-34. doi: 10.19853/j.zgjsps.1000-4602.2014.07.008 [16] JIA W, WANG Q, ZHANG J, et al. Nutrients removal and nitrous oxide emission during simultaneous nitrification, denitrification, and phosphorusremoval process: Effect of iron[J]. Environmental Science and Pollution Research, 2016, 23: 15657-15664. doi: 10.1007/s11356-016-6758-2 [17] 国家环境保护总局. 水和废水监测分析方法[J]. 4版. 北京:中国环境科学出版社, 2002: 210-284. [18] 凌宇, 闫国凯, 王海燕, 等. 6种农业废弃物初期碳源及溶解性有机物释放机制[J]. 环境科学, 2021, 42(5): 2422-2431. [19] WANG Z P, ZHANG T. Characterization of soluble microbial products (SMP) under stressful conditions[J]. Water Research, 2010, 44(18): 5499-5509. doi: 10.1016/j.watres.2010.06.067 [20] 蔡华玲, 宁寻安, 陈晓晖, 等. 印染外排废水中溶解性有机质的荧光特性[J]. 环境化学, 2021, 40(5): 1592-1601. doi: 10.7524/j.issn.0254-6108.2020010402 [21] 赵文莉, 郝瑞霞, 李斌, 等. 预处理方法对玉米芯作为反硝化固体碳源的影响[J]. 环境科学, 2014, 35(3): 987-994. [22] 范天凤, 董伟羊, 赵转军, 等. 改性枸杞枝作为反硝化脱氮碳源的研究[J]. 环境科学学报, 2021, 41(9): 3513-3520. doi: 10.13671/j.hjkxxb.2021.0093 [23] 商振达, 谭占坤, 李家奎, 等. 西藏地区荞麦与玉米混合青贮对发酵品质和微生物多样性的影响[J]. 草业学报, 2019, 28(4): 95-105. doi: 10.11686/cyxb2018676 [24] LV D, ZHOU X, ZHOU J, et al. Design and characterization of sulfide-modified nanoscale zerovalent iron for cadmium (II) removal from aqueous solutions[J]. Applied Surface Science, 2018, 442: 114-123. doi: 10.1016/j.apsusc.2018.02.085 [25] RITGER P L, PEPPAS N A. A simple equation for description of solute release II. Fickian and anomalous release from swellable devices[J]. Journal of controlled release, 1987, 5(1): 37-42. doi: 10.1016/0168-3659(87)90035-6 [26] 张雯, 张亚平, 尹琳, 等. 以10种农业废弃物为基料的地下水反硝化碳源属性的实验研究[J]. 环境科学学报, 2017, 37(5): 1787-1797. [27] 陈诗雨, 李燕, 李爱民. 溶解性有机物研究中三维荧光光谱分析的应用[J]. 环境科学与技术, 2015, 38(5): 64-68+73. [28] 周圆, 李怀波, 郑凯凯, 等. 新型组合工艺处理印染废水中试效能及微生物菌群分析[J]. 环境工程学报, 2020, 14(11): 3030-3041. doi: 10.12030/j.cjee.201912118 [29] MENG F, ZHOU Z, NI B J, et al. Characterization of the sizefractionated biomacromolecules: tracking their role and fate in a membrane bioreactor[J]. Water Research, 2011, 45(15): 4661-4671. doi: 10.1016/j.watres.2011.06.026 [30] LEE M H, OSBUM C L, SHIN K H, et al. New insight into the applicability of spectroscopic indices for dissolved organic matter(DOM)source discrimination in aquatic systems affected by biogeochemical processes[J]. Water Research, 2018, 147: 164-176. doi: 10.1016/j.watres.2018.09.048 [31] SHEN Z, WANG J. Biological denitrification using cross-linked starch/PCL blends as solid carbon source and biofilm carrier[J]. Bioresource technology, 2011, 102(19): 8835-8838. doi: 10.1016/j.biortech.2011.06.090 [32] 宋亚男, 陆圆, 陆勇泽, 等. 电流对DF-BER反硝化和有机物转化的影响[J]. 中国环境科学, 2020, 40(7): 2880-2887. doi: 10.3969/j.issn.1000-6923.2020.07.011 [33] 彭锦玉, 张克峰, 王全勇, 等. 以4种天然植物材料为碳源的固相反硝化研究[J]. 工业水处理, 2021, 41(10): 104-108. doi: 10.19965/j.cnki.iwt.2021-0087 [34] 李斌, 郝瑞霞. 固体纤维素类废物作为反硝化碳源滤料的比选[J]. 环境科学, 2013, 34(4): 1428-1434. doi: 10.13227/j.hjkx.2013.04.058 -





 下载:
下载: