-
寻求和利用可再生绿色清洁能源替代化石燃料,是解决能源与环境危机的重要途径。微生物燃料电池(microbial fuel cell, MFC)作为一种集污水处理与生物产电于一体的新型技术,以产电细菌为主体,可将化学能转化为电能,同时去除水体中的污染物[1-2]。电极材料是影响MFC性能的关键因素之一,也是MFC产电微生物的附着载体和生长场所[3]。因此,找到一种可供微生物大量附着和生长的载体,同时具有良好导电性能的材料至关重要。
MFC电极多采用碳质材料,拥有良好的生物相容性、导电性和化学稳定性[4]。碳质材料一般包括石墨烯、碳毡、碳布、生物炭等。其中石墨烯电极机械强度较好,但其材料表面相对光滑,不利于微生物附着,因而导致胞外电子传递效率低[5-6];碳毡电极柔韧性良好,但其在MFC运行时,由于材质较厚,生物膜会妨碍底物由外向内的扩散,影响对污染物的降解效率;碳布电极表面粗糙但机械强度较差,不适于投入大规模的实际工程应用中[7]。相比于传统电极材料,生物炭材料具有来源广泛、成本低廉、电化学性能较好、比表面积高和孔隙结构多等优点。2018年CHEN等[8]大麻槿秸秆通过简单的碳化处理制成MFC阳极,其电流密度达到了32.5 A·m−2,是对照组石墨棒电极的3倍,由此可见生物炭作为MFC电极材料是具有一定优势的。
据2020年中国统计年鉴统计,我国核桃栽培面积为5.54×1010 m²,约1.3×109株[9]。每年有大量的废弃核桃壳产生,如何有效处理这些固体废物,实现减量化和资源化是环境领域的研究热点。采用高温裂解法制备生物炭,再通过化学活化,可使其表面结构相对于碳基材料的平面结构更为粗糙,更有效的提升活性表面积[10-13]。常见的生物炭化学活化剂包括ZnCl2、HPO4、KOH等,其中ZnCl2活化制备的活性炭具有产率高、过渡孔发达、价廉易得等优点[14],JIANG等通过ZnCl2活化甘蔗渣发现,锌离子浓度越高,比表面积越大[15]。
目前,以改性核桃壳作为电极材料的研究鲜有报道。因此,本研究主要以改性核桃壳作为生物炭基电极材料,通过不同温度的碳化、不同浓度的ZnCl2活化、不同比例的材料复合制成微生物燃料电池电极,通过表征分析,考察不同制备方法制备出的材料的性能差异,分析其在MFC中产电性能的差异,以及最佳条件MFC去除污染物的能力,为微生物燃料电池的发展方向提供参考。
-
将市场上购买的核桃取果皮后粉碎,过40目分子筛后,置于石英舟中,再将其放入管式炉(OTF-1200 X),真空400 ℃炭化90 min后,得到黑色产物。称取一定量的黑色产物与氯化锌固体按质量比分别为5:1、5:3、5:5,置于烧杯中加去离子水刚好完全淹没,搅拌后,再将其置于105 ℃烘箱中烘干24 h。将烘干好的黑色产物放于管式炉中央,分别在400、600、800 ℃温度条件下真空煅烧2 h,反应结束后在真空保护下冷却至室温。煅烧好的样品先用10% HCl溶液洗涤,然后用去离子水洗涤,直至中性,最后将其置于105 ℃烘箱中烘干24 h,得到核桃壳碳化产物。
制备好的生物炭样品与聚苯胺和热熔胶按5:1:4和5:1:5质量比进行混合,然后将混合材料置于刚玉舟模具中压实,再放入200 ℃管式炉进行真空热熔,热熔30 min后,自然冷却至室温取出。制备后的电极材料样品尺寸为2 cm×3 cm×0.5(±0.05) cm。
-
实验采用扫描电镜(捷克TESCAN MIRA LMS),通过磨成粉末过0.4 mm筛网制样,对生物炭基电极材料表面形貌进行表征;采用拉曼光谱(激光器波长532 nm,扫描范围50~4 000 cm−1)分析电极材料的石墨化程度;采用孔隙及比表面积分析仪(康塔4000 e,脱气温度120 ℃)分析电极材料的比表面积、孔体积和孔径;采用电化学工作站(CHI 660 e),通过LSV、EIS测试,分析电极材料的导电性能的差异;采用HACH高量程(20~1 500 mg·L−1)消解法测定COD;采用国标纳氏试剂比色法测定氨氮;采用电流电压数据采集器(KEYSIGHT 34972A)测定MFC产电性能、采集电流电压及功率密度。
-
实验采用空气阴极单室MFC反应器,由有机玻璃制成,内径为10 cm,高度为14 cm,设置溢流堰用于出水,底部设置0.4 cm有机玻璃管用于进水。反应器阴阳极用尼龙螺栓固定,有效容积为377 mL。配制模拟废水(实验所用的去离子水为灭菌除氧后的水)用于MFC产电性能分析,每隔24 h进出水150 mL,其组成为1.356 g·L−1 C4H4Na2O4,0.15 g·L−1 (NH4)2SO4,0.253 5 g·L−1 KH2PO4,0.125 g·L−1 MgSO4·7H2O,0.125 g·L−1 NaCl,0.002 5 g·L−1 FeSO4·7H2O,0.002 g·L−1 MnSO4·H2O,1 mL·L−1 微量元素。其中微量元素包括1.5 g·L−1 FeC13·6H2O,0.02 g·L−1 CuC12·2H2O,0.18 g·L−1 KI,0.12 g·L−1 MnCl2·4H2O,0.01 g·L−1 ZnC12,0.06 g·L−1 Na2MoO4·2H2O,0.15 g·L−1 CoC12·6H2O,0.15 g·L−1 H3BO3,0.06 g·L−1 Na2MoO4·2H2O。
-
实验所用接种微生物为本研究组前期实验筛选出的异养硝化-好氧反硝化菌[16]。通过扩大培养,鉴定其异养硝化与好氧反硝化性能后接种至MFC反应器。具体过程如下:将菌种接种至LB液体培养基,在(30±2) ℃培养箱中培养24 h后,取菌种培养液与去离子水以1:9比例混合,用10 mL离心管离心去除上清液后加适量水摇匀,倒入好氧反硝化培养基,恒温振荡培养(160 min−1,30 ℃),每12 h测1次硝氮浓度和OD600;再取培养液置于异养硝化培养基,厌氧箱中恒温培养(30 ℃),每12 h测1次氨氮浓度和OD600。实验所用LB液体培养基含有3.0 g·L−1 牛肉膏、5.0 g·L−1 NaCl、10.0 g·L−1 蛋白胨(pH=7.0);好氧反硝化培养基(100 mL)含有1.356 g·L−1 C4H4 Na2O4、0.064 1 g·L−1 KNO3、0.253 5 g·L−1 KH2PO4、0.125 g·L−1 MgSO4·7H2O、0.125 g·L−1 NaCl、0.002 5 g·L−1 FeSO4·7H2O、0.002 g·L−1 MnSO4·H2O;异养硝化培养基(100 mL)含有1.356 g·L−1 C4H4Na2O4、0.253 5 g·L−1 KH2PO4、0.125 g·L−1 MgSO4·7H2O、0.125 g·L−1 NaCl、0.002 5 g·L−1 FeSO4·7H2O、0.002 g·L−1 MnSO4·H2O、0.15 g·L−1 (NH4)2SO4。
-
将目标菌株菌悬液接种至MFC反应器中,接种比例10%,上下电极间距4 cm。MFC置于恒温气候箱中,温度和湿度分别控制30 ℃、50%。进水pH为7.0±0.1,连接1 kΩ的外电阻,每5 min对MFC输出电流电压进行实时监控。在MFC电压达到稳定输出时,测量分析极化曲线和功率密度曲线(文中功率密度和电流密度以反应器有效容积为参比)。具体方法为:依次将外电阻由2 000 Ω调到100 Ω,每30 s记录1次MFC外阻的电流电压值,其中每更换一次电阻需等待3 min让电压值稳定。
-
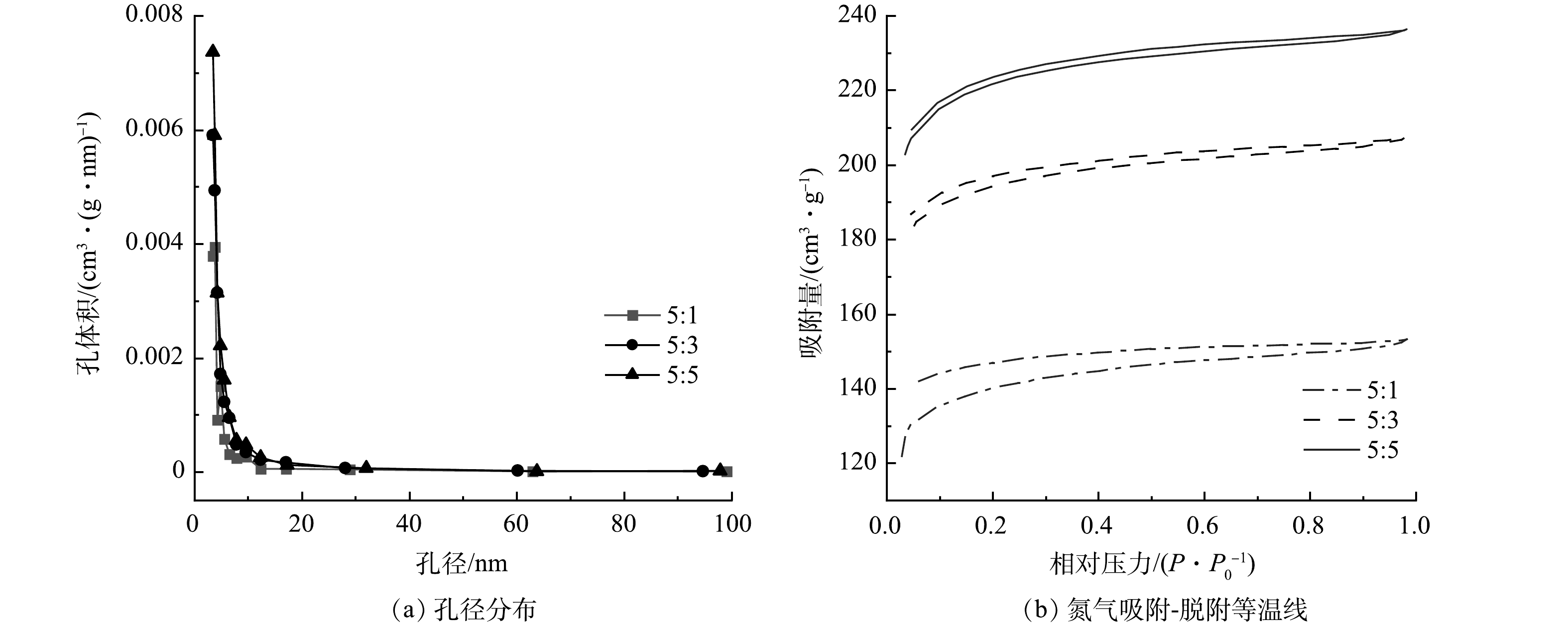
为阐明ZnCl2用量对生物炭材料孔隙结构的影响,实验采用生物炭/氯化锌质量比分别为5:1、5:3、5:5的电极材料,在600 ℃煅烧后,通过比表面积和孔径分布来评估核桃壳生物炭的比表面积及相应孔径分布。由图1可知,ZnCl2活化后的生物炭孔结构的孔径主要集中在3.5 nm附近,在相对压力为0.1~1.0内出现较显著的滞后环,按照国际纯化学和应用化学联合会的定义,核桃壳生物炭是典型的Ⅰ型和Ⅱ型特性[17],说明核桃壳生物炭的结构属于尺寸较小的介孔结构。由表1可知,随着ZnCl2质量比的不断增加,改性核桃壳生物炭的比表面积由590 m2·g−1增加到883 m2·g−1,孔容由0.009 cm3·g−1逐渐增加到0.017 cm3·g−1。这说明随着ZnCl2用量的增加,活化后的核桃壳生物炭的比表面积也越大,可为微生物的生长提供更多的场所[18],做成MFC电极后其微生物负载量可得到提升,从而促进MFC的产电。
-
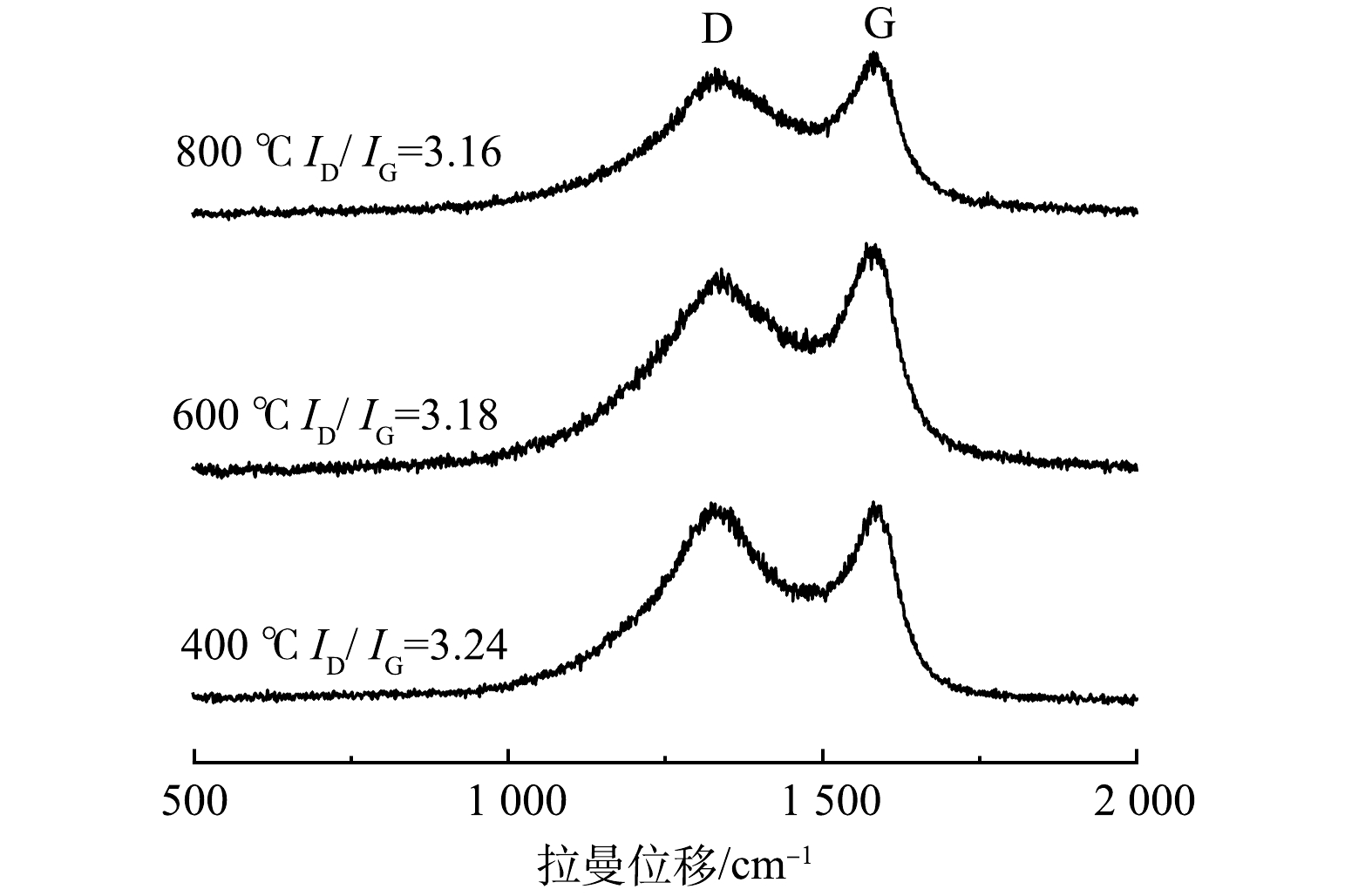
为阐明热处理温度对生物炭材料分子结构的影响规律,控制生物炭/氯化锌质量比为5:5,分别在400、600、800 ℃热处理条件下,对制备的生物炭进行拉曼光谱分析,实验结果如图2所示。由图2可见,核桃壳生物炭在1 316 cm−1和1 586 cm−1处有2个显著的拉曼峰,分别为炭材料的特征D峰和G峰[19-20]。其中D峰主要是芳香环之间的C—C结构,为环数大于6环的芳香环结构,是由炭材料缺陷引起;G峰与炭材料的C=C键Sp2杂化有关。D峰与G峰的强度比(ID/IG)可以在一定程度反映材料的缺陷程度,ID/IG值越高,代表材料的无序率越高;ID/IG值越低,说明材料的石墨化程度越高,导电性能越好[21]。根据拉曼光谱图Gauss拟合曲线方法可以得到ID/IG。由图2可以看出,随着热解温度的增加,ID/IG比值变小。这说明材料的石墨化程度增加,导电性能越好,制作的MFC电极性能越好。
-
聚苯胺与热熔胶比例也是考察MFC电极制作过程的因素之一。图3为在真空煅烧温度为600 ℃、生物炭与氯化锌活化质量比为5:3的条件下,生物炭/聚苯胺/热熔胶比例分别为5:1:4和5:1:5所制成的MFC复合电极的扫描电镜图。
由于当生物炭/聚苯胺/热熔胶的比例为5:1:1和5:1:2时,经过煅烧的生物炭电极几乎不成型,依旧保持粉末状态;当生物炭/聚苯胺/热熔胶添加比例为5:1:3时,经过煅烧的生物炭电极机械强度低,易碎,因此这些复合比例均不能到达作为MFC电极材料的要求,故实验选用的生物炭/聚苯胺/热熔胶比例为5:1:4和5:1:5。由图3可以看出,随着热熔胶中聚乙烯粉末和导电态聚苯胺的加入,其对生物炭的表面起到了修饰作用,但未对生物炭的多孔结构产生明显的影响。
-
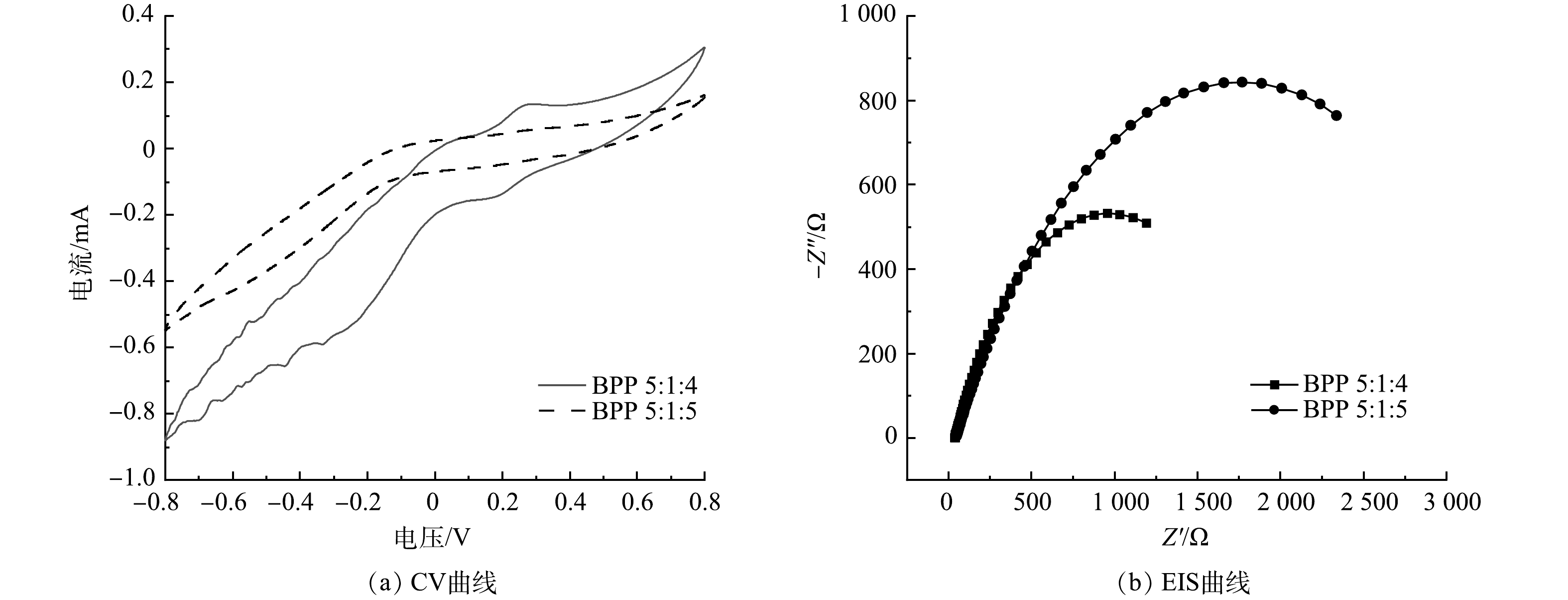
图4反映了电解池三电极体系中生物炭/聚苯胺/热熔胶复合电极的电化学性能。以1 cm2的铂片作为辅助电极,以Ag/AgCl作为参比电极,将制备得到BPP 5:1:4和BPP 5:1:5的复合电极分别连接在电极夹上作为工作电极。所有的电化学性能测试均是在1 mmol·L−1 铁氰化钾混合溶液(0.1 mol·L−1 KCl)中完成。
如图4(a)所示,BPP 5:1:4材料在-0.8~0.8 V内的电流为0.305~-0.879 9 mA,且CV曲线有2对微弱的氧化还原峰;而BPP 5:1:5材料的电流为0.154~-0.546 mA,CV曲线没有氧化还原峰。材料氧化还原峰越多越明显,材料的电子传递能力越好[22],因此,BPP 5:1:4材料比BPP 5:1:5材料具有更良好的电子传递能力,更易促进氧化还原反应。
交流阻抗(EIS)曲线如图4(b)所示,其中,正弦信号频率为0.01~105 Hz,交流振幅为0.006。MFC中EIS的表征大多用于分析欧姆内阻和扩散内阻,由于低频区对扩散内阻的表征存在较大偏差,所以在数据拟合过程中未将低频区部分纳入拟合范围[23]。本次拟合使用软件Zview2,等效电路模型中RΩ为欧姆内阻,Rct为电荷转移内阻,电荷转移内阻与一个双电层电容并联,但因弥散效应的存在,该电容偏离理想双电层电容器,因而在本次拟合电路中使用常相位角原件代替传统双电层电容器。根据拟合结果,BPP 5: 1: 4欧姆内阻为37.17 Ω,电荷转移内阻为1 854 Ω,BPP 5:1:5欧姆内阻为46.54 Ω,电荷转移内阻为343 Ω。总的来看,Rct均大于RΩ,说明MFC系统内组主要受Rct控制。就Rct而言,BPP 5:1:4小于BPP 5:1:5,Rct主要反映电活性微生物与电极之间电子传递过程的内阻[24],Rct越小,其电子传递速率越快,因此,BPP 5:1:4生物电化学活性优于BPP 5:1:5。
-
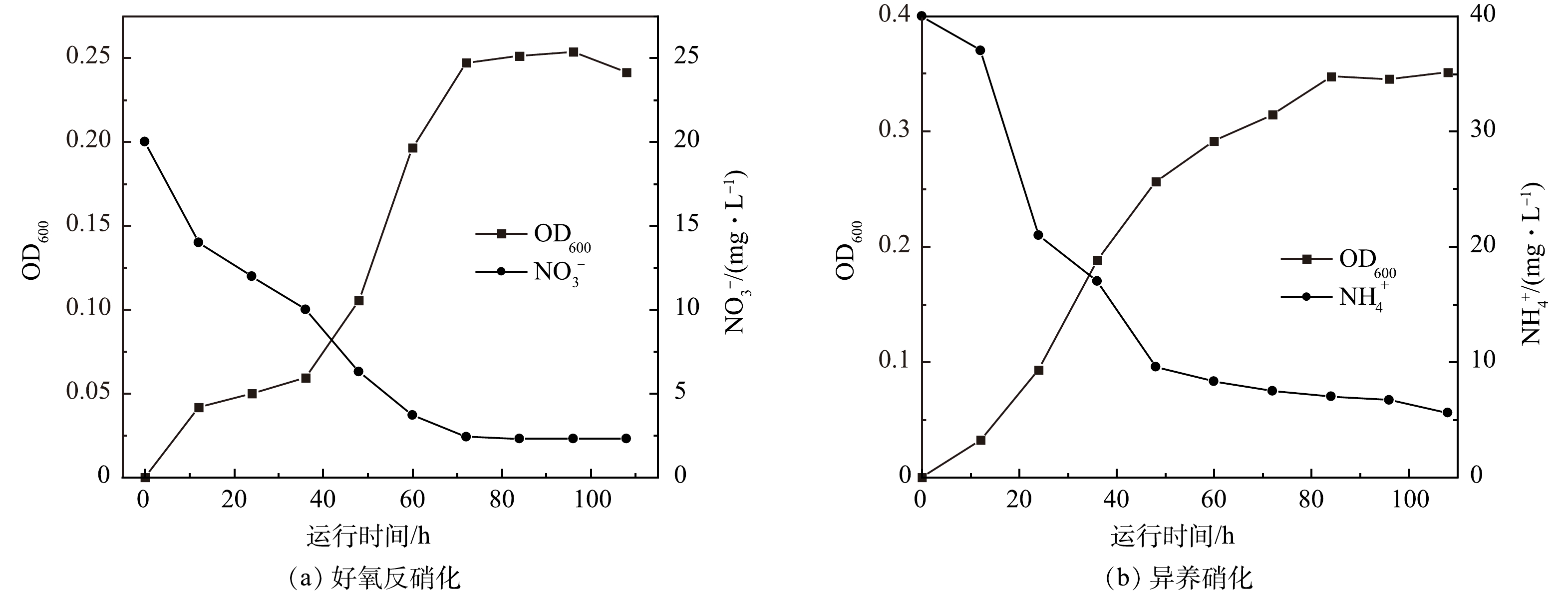
本研究组前期筛选出的异养硝化-好氧反硝化菌[16],通过扩大培养后,接种到异养硝化与好氧反硝化培养基中。由图5可见,在好氧反硝化、异养硝化培养基中菌株不断进行自我繁殖,并消耗培养基中的硝酸根与氨氮。这说明实验接种的微生物具有好氧反硝化与异养硝化能力,后续实验将采用此细菌做为MFC的产电菌。
-
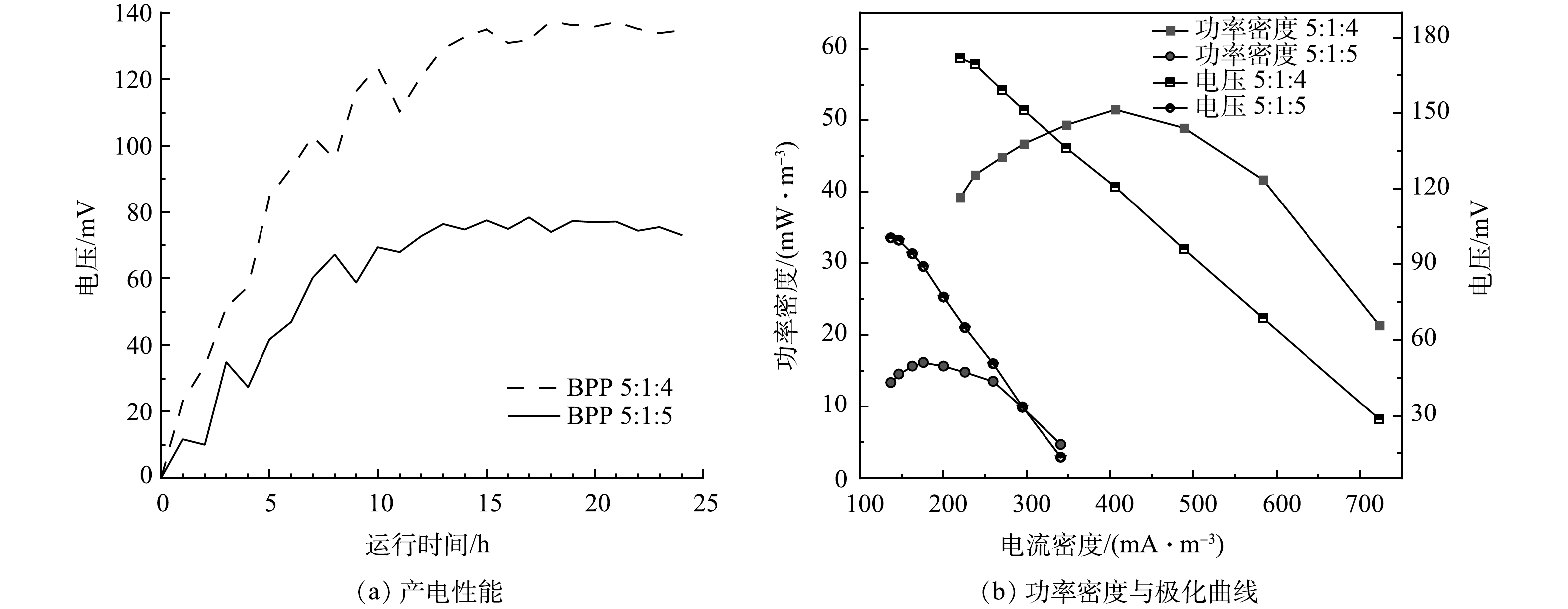
实验构建单室MFC反应器,将脱氮菌株接种至MFC反应器中,连接不同条件下制备的改性核桃壳基生物炭电极材料,每5 min对MFC输出电流电压进行实时监控,其产电性能、功率密度与极化曲线如图6所示。
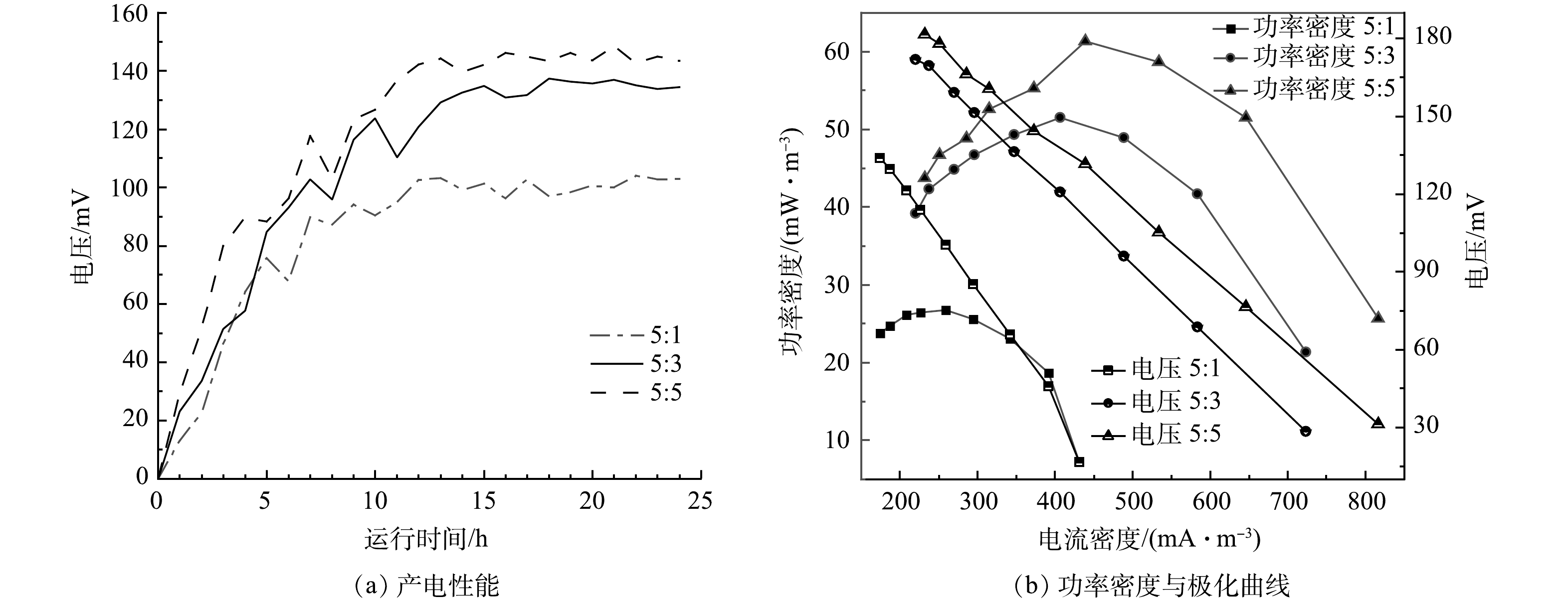
在真空煅烧温度为600 ℃,BPP为5:1:4的条件下,考察了不同浓度氯化锌对产电性能的影响,结果如图6(a)和图6(b)所示。当生物炭/氯化锌质量比为5:1时,MFC电极最大输出电压为0.103 V,随外电阻由大到小变化,反应器极化曲线电压由133 mV降至16 mV,最大体积功率为26 mW·m−3,电流密度为259 mW·m−3;当生物炭/氯化锌质量比为5:3时,最大输出电压为0.137 V,随外电阻由大到小变化,反应器极化曲线电压由171 mV降至28 mV,最大体积功率为51 mW·m−3,电流密度为406 mA·m−3;当生物炭/氯化锌质量比为5:5时,MFC电极最大输出电压为0.148 V,随外电阻由大到小变化,反应器极化曲线电压由181 mV降低至31 mV,最大功率密度为61 mW·m−3,电流密度为438 mA·m−3。根据极化曲线斜率可以得出MFC电极电阻,斜率越小MFC的内阻越大[25]。随着ZnCl2质量比的增加,MFC的产电能力增加,内阻逐渐减小,电极材料的产电性能越好。当生物炭/氯化锌质量比从5:3提升到5:5,MFC的产电性能提升不大,可能原因是ZnCl2对生物炭的造孔能力几乎达到饱和[26]。
在BPP为5:1:4,生物炭/氯化锌比为5:3条件下,考察了煅烧温度对电极性能的影响,结果如图7(a)和图7(b)所示。在400 ℃煅烧条件下,MFC电极最大输出电压为0.096 V,随外电阻由大到小变化,反应器极化曲线电压由119 mV降低至17 mV,最大功率密度为22 mW·m−3,电流密度为238 mA·m−3;在600 ℃煅烧条件下,最大输出电压为0.137 V,随外电阻由大到小变化,反应器极化曲线电压由171 mV降低至28 mV,最大体积功率为51 mW·m−3,电流密度为406 mA·m−3;在800 ℃煅烧条件下,MFC电极最大输出电压为0.143 V,随外电阻由大到小变化,反应器极化曲线电压由181 mV降低至29 mV,最大功率密度约为57 mW·m−3,此时的电流密度为436 mA·m−3。随着煅烧温度的增加,MFC的产电能力增加,内阻逐渐减小,电极材料的产电性能越好。结合图2可知,这是由于材料石墨化程度的增加,导致MFC的内阻减小。由图7可见,在600 ℃和800 ℃条件下,制备的电极性能相差不大。由此可见,当煅烧温度达到一定程度,MFC的产电性能提升不大,可能的原因是温度的增加破坏了部分生物炭的微孔和大孔,虽然生物炭石墨化程度增加,但是微生物的负载量减少[27]。
在生物炭/氯化锌比为5:3,真空煅烧温度为600 ℃条件下,考察了不同材料复合情况对电极产电性能的影响,结果如图8(a)和图8(f)所示。当生物炭/聚苯胺/热熔胶复合比例为5:1:4时,最大输出电压为0.137 V,随外电阻由大到小变化,反应器极化曲线电压由171 mV降至28 mV,最大体积功率为51 mW·m−3,电流密度为406 mA·m−3;当生物炭/聚苯胺/热熔胶复合比例为5:1:5时,最大输出电压为0.077 V,随外电阻由大到小变化,反应器极化曲线电压由100 mV降至13mV,最大体积功率为16 mW·m−3,电流密度为176 mA·m−3。由此可见,生物炭的含量对复合材料有显著影响。结合图3可知,在保证材料成型的前提下,生物炭含量越高,MFC的内阻越小,材料的产电性能越好[28]。
-
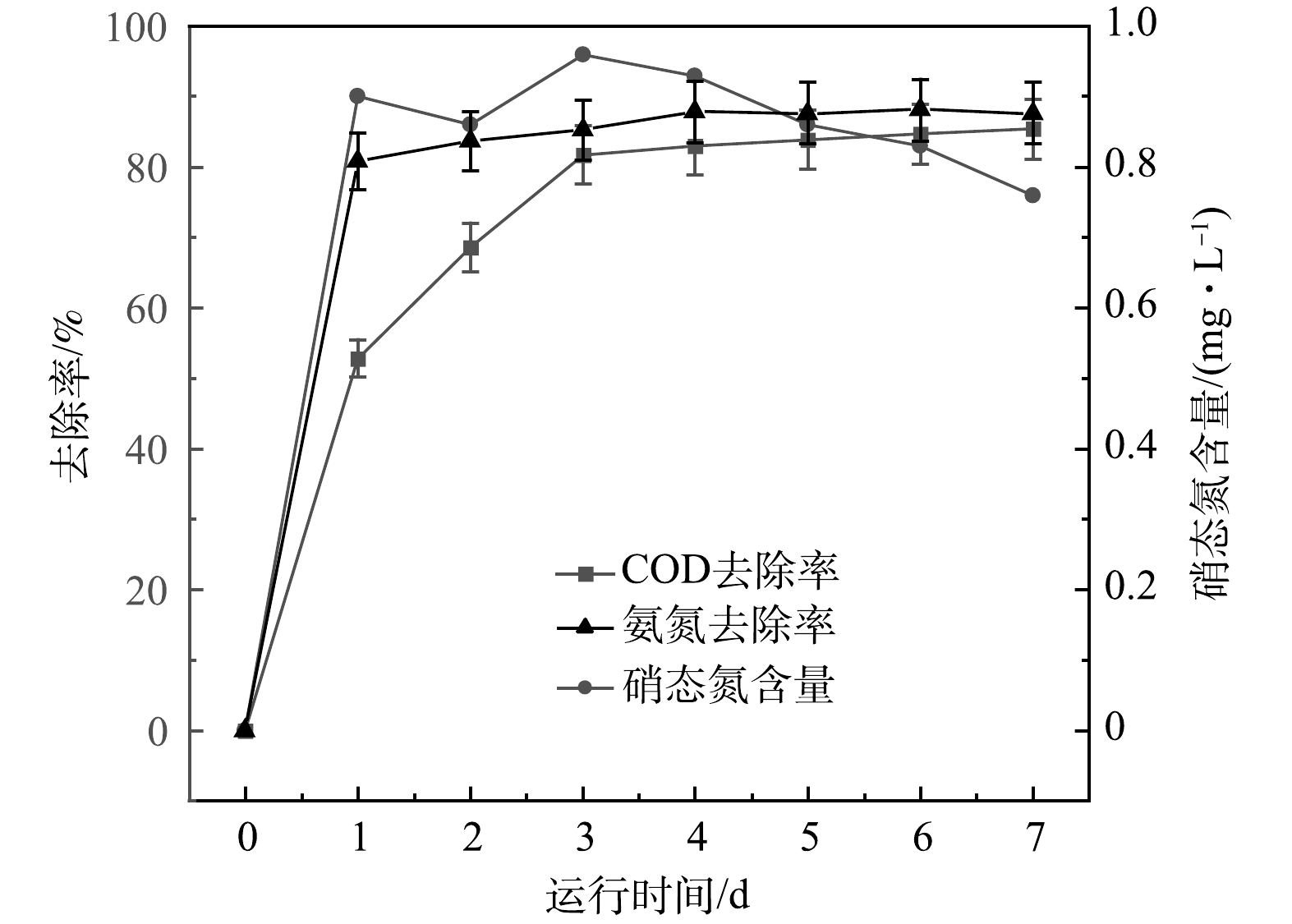
根据以上结果,确认电极制备的最佳条件为BPP 5:1:4、煅烧温度600 ℃、生物炭/氯化锌比5:3时,即节约了生产成本,又达到最大产电量的90%,为减少对环境的污染,选用此种方法制备的电极材料用来探讨改性核桃壳生物炭电极材料用于MFC反应器降解污染物的长期效果,结果如图9所示。可以看出,随着时间的推移,MFC中出水COD由685 mg·L−1降至100 mg·L−1。第1天时,出水COD大幅下降,这说明微生物在反应初期消耗废水中大量有机物用于增殖。随着微生物增殖所需能量减少,有机物需求也逐渐减少,最终COD稳定去除率为85%。出水氨氮质量浓度由38 mg·L−1降低至4.5 mg·L−1,在第4天达到稳定,改性核桃壳生物炭MFC对氨氮的去除率最终达到88%。水体中的硝氮在7 d内先上升后下降,可以看出硝化菌株产生的硝态氮会被好氧反硝化菌株利用,MFC具有较好的脱硝态氮能力。
-
1) MFC电极的最佳制备条件:活化时生物炭/氯化锌质量比5:3,真空煅烧温度为600 ℃,生物炭/聚苯胺/热熔胶复合电极比例为5:1:4,应用于MFC中最大的体积功率密度可达51 mW·m−3,对模拟废水中COD和氨氮的去除率分别为85%和88%。
2)相较于传统生物炭电极在水体中易碎,通过复合聚苯胺与热熔胶来制作生物炭电极可以在模拟废水中稳定运行。
3)用核桃壳生物炭通过简单的过程制备的MFC电极,为成本低廉,绿色清洁,操作简单的MFC发展方向提供了新的选择。
核桃壳生物炭电极在微生物燃料电池中的产电性能及其对污染物的去除性能
Electricity production and pollutant removal performance of walnut shell biochar electrode in microbial fuel cell
-
摘要: 微生物燃料电池(MFC)的电极材料是决定MFC性能的关键。本研究利用核桃壳生物炭制成MFC电极材料,对核桃壳生物炭基电极的制备条件、MFC的产电性能进行了探讨,利用比表面积分析、扫描电镜、拉曼光谱及电极电化学等方法对生物炭电极进行表征。结果表明: 最佳电极制备条件为活化时生物炭:氯化锌质量比5:3,真空煅烧温度600 ℃,生物炭:聚苯胺:热熔胶质量比5:1:4,在进水COD平均值为685 mg·L−1、氨氮平均值为38 mg·L−1、外电阻为1 000 Ω条件下,MFC的稳定输出电压为0.136 V,最大功率密度达到51 mW·m−3,内阻为762 Ω,运行7 d后,COD和氨氮的去除率分别可达到85%和88%,以上研究结果为制备有前景的MFC的电极材料提供了参考。Abstract: The electrode material is the key to determine the performance of microbial fuel cell (MFC). In this study, walnut shell biochar was used to prepare the MFC electrode. Both the preparation conditions of walnut shell biochar based electrode and MFC electricity production performance were discussed. The biochar electrode was characterized by specific surface area analysis scanning electron microscopy, Raman spectroscopy and electrochemistry. The experimental results showed that the optimum fabrication conditions were as follows: the mass ratio of biochar to zinc chloride was 5:3, the vacuum calcination temperature was 600 ℃, the mass ratio of biochar, polyaniline and hot melt glue was 5:1:4. At the average influent COD concentration of 685 mg·L−1, the average ammonia nitrogen concentration of 38 mg·L−1 and the external resistance of 1000 Ω, the stable output voltage of MFC was 0.136 V, the maximum power density reached 51 mW·m−3 and the internal resistance was 762 Ω. After 7 days of operation, the removal rates of COD and ammonia nitrogen could reach 85% and 88%, respectively. These results provide a reference for the preparation of the promising MFC electrode materials.
-
Key words:
- microbial fuel cell /
- walnut shell electrode /
- electricity generation /
- electrode /
- activization
-
寻求和利用可再生绿色清洁能源替代化石燃料,是解决能源与环境危机的重要途径。微生物燃料电池(microbial fuel cell, MFC)作为一种集污水处理与生物产电于一体的新型技术,以产电细菌为主体,可将化学能转化为电能,同时去除水体中的污染物[1-2]。电极材料是影响MFC性能的关键因素之一,也是MFC产电微生物的附着载体和生长场所[3]。因此,找到一种可供微生物大量附着和生长的载体,同时具有良好导电性能的材料至关重要。
MFC电极多采用碳质材料,拥有良好的生物相容性、导电性和化学稳定性[4]。碳质材料一般包括石墨烯、碳毡、碳布、生物炭等。其中石墨烯电极机械强度较好,但其材料表面相对光滑,不利于微生物附着,因而导致胞外电子传递效率低[5-6];碳毡电极柔韧性良好,但其在MFC运行时,由于材质较厚,生物膜会妨碍底物由外向内的扩散,影响对污染物的降解效率;碳布电极表面粗糙但机械强度较差,不适于投入大规模的实际工程应用中[7]。相比于传统电极材料,生物炭材料具有来源广泛、成本低廉、电化学性能较好、比表面积高和孔隙结构多等优点。2018年CHEN等[8]大麻槿秸秆通过简单的碳化处理制成MFC阳极,其电流密度达到了32.5 A·m−2,是对照组石墨棒电极的3倍,由此可见生物炭作为MFC电极材料是具有一定优势的。
据2020年中国统计年鉴统计,我国核桃栽培面积为5.54×1010 m²,约1.3×109株[9]。每年有大量的废弃核桃壳产生,如何有效处理这些固体废物,实现减量化和资源化是环境领域的研究热点。采用高温裂解法制备生物炭,再通过化学活化,可使其表面结构相对于碳基材料的平面结构更为粗糙,更有效的提升活性表面积[10-13]。常见的生物炭化学活化剂包括ZnCl2、HPO4、KOH等,其中ZnCl2活化制备的活性炭具有产率高、过渡孔发达、价廉易得等优点[14],JIANG等通过ZnCl2活化甘蔗渣发现,锌离子浓度越高,比表面积越大[15]。
目前,以改性核桃壳作为电极材料的研究鲜有报道。因此,本研究主要以改性核桃壳作为生物炭基电极材料,通过不同温度的碳化、不同浓度的ZnCl2活化、不同比例的材料复合制成微生物燃料电池电极,通过表征分析,考察不同制备方法制备出的材料的性能差异,分析其在MFC中产电性能的差异,以及最佳条件MFC去除污染物的能力,为微生物燃料电池的发展方向提供参考。
1. 材料和方法
1.1 电极材料的制备
将市场上购买的核桃取果皮后粉碎,过40目分子筛后,置于石英舟中,再将其放入管式炉(OTF-1200 X),真空400 ℃炭化90 min后,得到黑色产物。称取一定量的黑色产物与氯化锌固体按质量比分别为5:1、5:3、5:5,置于烧杯中加去离子水刚好完全淹没,搅拌后,再将其置于105 ℃烘箱中烘干24 h。将烘干好的黑色产物放于管式炉中央,分别在400、600、800 ℃温度条件下真空煅烧2 h,反应结束后在真空保护下冷却至室温。煅烧好的样品先用10% HCl溶液洗涤,然后用去离子水洗涤,直至中性,最后将其置于105 ℃烘箱中烘干24 h,得到核桃壳碳化产物。
制备好的生物炭样品与聚苯胺和热熔胶按5:1:4和5:1:5质量比进行混合,然后将混合材料置于刚玉舟模具中压实,再放入200 ℃管式炉进行真空热熔,热熔30 min后,自然冷却至室温取出。制备后的电极材料样品尺寸为2 cm×3 cm×0.5(±0.05) cm。
1.2 表征与测试
实验采用扫描电镜(捷克TESCAN MIRA LMS),通过磨成粉末过0.4 mm筛网制样,对生物炭基电极材料表面形貌进行表征;采用拉曼光谱(激光器波长532 nm,扫描范围50~4 000 cm−1)分析电极材料的石墨化程度;采用孔隙及比表面积分析仪(康塔4000 e,脱气温度120 ℃)分析电极材料的比表面积、孔体积和孔径;采用电化学工作站(CHI 660 e),通过LSV、EIS测试,分析电极材料的导电性能的差异;采用HACH高量程(20~1 500 mg·L−1)消解法测定COD;采用国标纳氏试剂比色法测定氨氮;采用电流电压数据采集器(KEYSIGHT 34972A)测定MFC产电性能、采集电流电压及功率密度。
1.3 MFC的构建
实验采用空气阴极单室MFC反应器,由有机玻璃制成,内径为10 cm,高度为14 cm,设置溢流堰用于出水,底部设置0.4 cm有机玻璃管用于进水。反应器阴阳极用尼龙螺栓固定,有效容积为377 mL。配制模拟废水(实验所用的去离子水为灭菌除氧后的水)用于MFC产电性能分析,每隔24 h进出水150 mL,其组成为1.356 g·L−1 C4H4Na2O4,0.15 g·L−1 (NH4)2SO4,0.253 5 g·L−1 KH2PO4,0.125 g·L−1 MgSO4·7H2O,0.125 g·L−1 NaCl,0.002 5 g·L−1 FeSO4·7H2O,0.002 g·L−1 MnSO4·H2O,1 mL·L−1 微量元素。其中微量元素包括1.5 g·L−1 FeC13·6H2O,0.02 g·L−1 CuC12·2H2O,0.18 g·L−1 KI,0.12 g·L−1 MnCl2·4H2O,0.01 g·L−1 ZnC12,0.06 g·L−1 Na2MoO4·2H2O,0.15 g·L−1 CoC12·6H2O,0.15 g·L−1 H3BO3,0.06 g·L−1 Na2MoO4·2H2O。
1.4 脱氮微生物接种
实验所用接种微生物为本研究组前期实验筛选出的异养硝化-好氧反硝化菌[16]。通过扩大培养,鉴定其异养硝化与好氧反硝化性能后接种至MFC反应器。具体过程如下:将菌种接种至LB液体培养基,在(30±2) ℃培养箱中培养24 h后,取菌种培养液与去离子水以1:9比例混合,用10 mL离心管离心去除上清液后加适量水摇匀,倒入好氧反硝化培养基,恒温振荡培养(160 min−1,30 ℃),每12 h测1次硝氮浓度和OD600;再取培养液置于异养硝化培养基,厌氧箱中恒温培养(30 ℃),每12 h测1次氨氮浓度和OD600。实验所用LB液体培养基含有3.0 g·L−1 牛肉膏、5.0 g·L−1 NaCl、10.0 g·L−1 蛋白胨(pH=7.0);好氧反硝化培养基(100 mL)含有1.356 g·L−1 C4H4 Na2O4、0.064 1 g·L−1 KNO3、0.253 5 g·L−1 KH2PO4、0.125 g·L−1 MgSO4·7H2O、0.125 g·L−1 NaCl、0.002 5 g·L−1 FeSO4·7H2O、0.002 g·L−1 MnSO4·H2O;异养硝化培养基(100 mL)含有1.356 g·L−1 C4H4Na2O4、0.253 5 g·L−1 KH2PO4、0.125 g·L−1 MgSO4·7H2O、0.125 g·L−1 NaCl、0.002 5 g·L−1 FeSO4·7H2O、0.002 g·L−1 MnSO4·H2O、0.15 g·L−1 (NH4)2SO4。
1.5 MFC启动
将目标菌株菌悬液接种至MFC反应器中,接种比例10%,上下电极间距4 cm。MFC置于恒温气候箱中,温度和湿度分别控制30 ℃、50%。进水pH为7.0±0.1,连接1 kΩ的外电阻,每5 min对MFC输出电流电压进行实时监控。在MFC电压达到稳定输出时,测量分析极化曲线和功率密度曲线(文中功率密度和电流密度以反应器有效容积为参比)。具体方法为:依次将外电阻由2 000 Ω调到100 Ω,每30 s记录1次MFC外阻的电流电压值,其中每更换一次电阻需等待3 min让电压值稳定。
2. 结果与讨论
2.1 生物炭/氯化锌质量比对电极材料性能的影响
为阐明ZnCl2用量对生物炭材料孔隙结构的影响,实验采用生物炭/氯化锌质量比分别为5:1、5:3、5:5的电极材料,在600 ℃煅烧后,通过比表面积和孔径分布来评估核桃壳生物炭的比表面积及相应孔径分布。由图1可知,ZnCl2活化后的生物炭孔结构的孔径主要集中在3.5 nm附近,在相对压力为0.1~1.0内出现较显著的滞后环,按照国际纯化学和应用化学联合会的定义,核桃壳生物炭是典型的Ⅰ型和Ⅱ型特性[17],说明核桃壳生物炭的结构属于尺寸较小的介孔结构。由表1可知,随着ZnCl2质量比的不断增加,改性核桃壳生物炭的比表面积由590 m2·g−1增加到883 m2·g−1,孔容由0.009 cm3·g−1逐渐增加到0.017 cm3·g−1。这说明随着ZnCl2用量的增加,活化后的核桃壳生物炭的比表面积也越大,可为微生物的生长提供更多的场所[18],做成MFC电极后其微生物负载量可得到提升,从而促进MFC的产电。
表 1 BET测量时获得的比表面积、孔径和孔容Table 1. Specific surface area, pore size and pore volume determined by BET measurement生物炭/氯化锌质量比 比表面积/(m2·g−1) 孔径/nm 孔容/(cm3·g−1) 5:1 590 3.818 0.009 5:3 657 3.424 0.015 5:5 883 3.421 0.017 2.2 煅烧温度对电极材料性能的影响
为阐明热处理温度对生物炭材料分子结构的影响规律,控制生物炭/氯化锌质量比为5:5,分别在400、600、800 ℃热处理条件下,对制备的生物炭进行拉曼光谱分析,实验结果如图2所示。由图2可见,核桃壳生物炭在1 316 cm−1和1 586 cm−1处有2个显著的拉曼峰,分别为炭材料的特征D峰和G峰[19-20]。其中D峰主要是芳香环之间的C—C结构,为环数大于6环的芳香环结构,是由炭材料缺陷引起;G峰与炭材料的C=C键Sp2杂化有关。D峰与G峰的强度比(ID/IG)可以在一定程度反映材料的缺陷程度,ID/IG值越高,代表材料的无序率越高;ID/IG值越低,说明材料的石墨化程度越高,导电性能越好[21]。根据拉曼光谱图Gauss拟合曲线方法可以得到ID/IG。由图2可以看出,随着热解温度的增加,ID/IG比值变小。这说明材料的石墨化程度增加,导电性能越好,制作的MFC电极性能越好。
2.3 生物炭/聚苯胺/热熔胶复合比例对电极材料性能的影响
聚苯胺与热熔胶比例也是考察MFC电极制作过程的因素之一。图3为在真空煅烧温度为600 ℃、生物炭与氯化锌活化质量比为5:3的条件下,生物炭/聚苯胺/热熔胶比例分别为5:1:4和5:1:5所制成的MFC复合电极的扫描电镜图。
由于当生物炭/聚苯胺/热熔胶的比例为5:1:1和5:1:2时,经过煅烧的生物炭电极几乎不成型,依旧保持粉末状态;当生物炭/聚苯胺/热熔胶添加比例为5:1:3时,经过煅烧的生物炭电极机械强度低,易碎,因此这些复合比例均不能到达作为MFC电极材料的要求,故实验选用的生物炭/聚苯胺/热熔胶比例为5:1:4和5:1:5。由图3可以看出,随着热熔胶中聚乙烯粉末和导电态聚苯胺的加入,其对生物炭的表面起到了修饰作用,但未对生物炭的多孔结构产生明显的影响。
2.4 生物炭/聚苯胺/热熔胶复合电极电化学表征
图4反映了电解池三电极体系中生物炭/聚苯胺/热熔胶复合电极的电化学性能。以1 cm2的铂片作为辅助电极,以Ag/AgCl作为参比电极,将制备得到BPP 5:1:4和BPP 5:1:5的复合电极分别连接在电极夹上作为工作电极。所有的电化学性能测试均是在1 mmol·L−1 铁氰化钾混合溶液(0.1 mol·L−1 KCl)中完成。
如图4(a)所示,BPP 5:1:4材料在-0.8~0.8 V内的电流为0.305~-0.879 9 mA,且CV曲线有2对微弱的氧化还原峰;而BPP 5:1:5材料的电流为0.154~-0.546 mA,CV曲线没有氧化还原峰。材料氧化还原峰越多越明显,材料的电子传递能力越好[22],因此,BPP 5:1:4材料比BPP 5:1:5材料具有更良好的电子传递能力,更易促进氧化还原反应。
交流阻抗(EIS)曲线如图4(b)所示,其中,正弦信号频率为0.01~105 Hz,交流振幅为0.006。MFC中EIS的表征大多用于分析欧姆内阻和扩散内阻,由于低频区对扩散内阻的表征存在较大偏差,所以在数据拟合过程中未将低频区部分纳入拟合范围[23]。本次拟合使用软件Zview2,等效电路模型中RΩ为欧姆内阻,Rct为电荷转移内阻,电荷转移内阻与一个双电层电容并联,但因弥散效应的存在,该电容偏离理想双电层电容器,因而在本次拟合电路中使用常相位角原件代替传统双电层电容器。根据拟合结果,BPP 5: 1: 4欧姆内阻为37.17 Ω,电荷转移内阻为1 854 Ω,BPP 5:1:5欧姆内阻为46.54 Ω,电荷转移内阻为343 Ω。总的来看,Rct均大于RΩ,说明MFC系统内组主要受Rct控制。就Rct而言,BPP 5:1:4小于BPP 5:1:5,Rct主要反映电活性微生物与电极之间电子传递过程的内阻[24],Rct越小,其电子传递速率越快,因此,BPP 5:1:4生物电化学活性优于BPP 5:1:5。
2.5 菌株硝化反硝化能力的分析
本研究组前期筛选出的异养硝化-好氧反硝化菌[16],通过扩大培养后,接种到异养硝化与好氧反硝化培养基中。由图5可见,在好氧反硝化、异养硝化培养基中菌株不断进行自我繁殖,并消耗培养基中的硝酸根与氨氮。这说明实验接种的微生物具有好氧反硝化与异养硝化能力,后续实验将采用此细菌做为MFC的产电菌。
2.6 改性核桃壳生物炭电极MFC产电性能
实验构建单室MFC反应器,将脱氮菌株接种至MFC反应器中,连接不同条件下制备的改性核桃壳基生物炭电极材料,每5 min对MFC输出电流电压进行实时监控,其产电性能、功率密度与极化曲线如图6所示。
在真空煅烧温度为600 ℃,BPP为5:1:4的条件下,考察了不同浓度氯化锌对产电性能的影响,结果如图6(a)和图6(b)所示。当生物炭/氯化锌质量比为5:1时,MFC电极最大输出电压为0.103 V,随外电阻由大到小变化,反应器极化曲线电压由133 mV降至16 mV,最大体积功率为26 mW·m−3,电流密度为259 mW·m−3;当生物炭/氯化锌质量比为5:3时,最大输出电压为0.137 V,随外电阻由大到小变化,反应器极化曲线电压由171 mV降至28 mV,最大体积功率为51 mW·m−3,电流密度为406 mA·m−3;当生物炭/氯化锌质量比为5:5时,MFC电极最大输出电压为0.148 V,随外电阻由大到小变化,反应器极化曲线电压由181 mV降低至31 mV,最大功率密度为61 mW·m−3,电流密度为438 mA·m−3。根据极化曲线斜率可以得出MFC电极电阻,斜率越小MFC的内阻越大[25]。随着ZnCl2质量比的增加,MFC的产电能力增加,内阻逐渐减小,电极材料的产电性能越好。当生物炭/氯化锌质量比从5:3提升到5:5,MFC的产电性能提升不大,可能原因是ZnCl2对生物炭的造孔能力几乎达到饱和[26]。
在BPP为5:1:4,生物炭/氯化锌比为5:3条件下,考察了煅烧温度对电极性能的影响,结果如图7(a)和图7(b)所示。在400 ℃煅烧条件下,MFC电极最大输出电压为0.096 V,随外电阻由大到小变化,反应器极化曲线电压由119 mV降低至17 mV,最大功率密度为22 mW·m−3,电流密度为238 mA·m−3;在600 ℃煅烧条件下,最大输出电压为0.137 V,随外电阻由大到小变化,反应器极化曲线电压由171 mV降低至28 mV,最大体积功率为51 mW·m−3,电流密度为406 mA·m−3;在800 ℃煅烧条件下,MFC电极最大输出电压为0.143 V,随外电阻由大到小变化,反应器极化曲线电压由181 mV降低至29 mV,最大功率密度约为57 mW·m−3,此时的电流密度为436 mA·m−3。随着煅烧温度的增加,MFC的产电能力增加,内阻逐渐减小,电极材料的产电性能越好。结合图2可知,这是由于材料石墨化程度的增加,导致MFC的内阻减小。由图7可见,在600 ℃和800 ℃条件下,制备的电极性能相差不大。由此可见,当煅烧温度达到一定程度,MFC的产电性能提升不大,可能的原因是温度的增加破坏了部分生物炭的微孔和大孔,虽然生物炭石墨化程度增加,但是微生物的负载量减少[27]。
在生物炭/氯化锌比为5:3,真空煅烧温度为600 ℃条件下,考察了不同材料复合情况对电极产电性能的影响,结果如图8(a)和图8(f)所示。当生物炭/聚苯胺/热熔胶复合比例为5:1:4时,最大输出电压为0.137 V,随外电阻由大到小变化,反应器极化曲线电压由171 mV降至28 mV,最大体积功率为51 mW·m−3,电流密度为406 mA·m−3;当生物炭/聚苯胺/热熔胶复合比例为5:1:5时,最大输出电压为0.077 V,随外电阻由大到小变化,反应器极化曲线电压由100 mV降至13mV,最大体积功率为16 mW·m−3,电流密度为176 mA·m−3。由此可见,生物炭的含量对复合材料有显著影响。结合图3可知,在保证材料成型的前提下,生物炭含量越高,MFC的内阻越小,材料的产电性能越好[28]。
2.7 改性核桃壳生物炭MFC对污染物的去除性能
根据以上结果,确认电极制备的最佳条件为BPP 5:1:4、煅烧温度600 ℃、生物炭/氯化锌比5:3时,即节约了生产成本,又达到最大产电量的90%,为减少对环境的污染,选用此种方法制备的电极材料用来探讨改性核桃壳生物炭电极材料用于MFC反应器降解污染物的长期效果,结果如图9所示。可以看出,随着时间的推移,MFC中出水COD由685 mg·L−1降至100 mg·L−1。第1天时,出水COD大幅下降,这说明微生物在反应初期消耗废水中大量有机物用于增殖。随着微生物增殖所需能量减少,有机物需求也逐渐减少,最终COD稳定去除率为85%。出水氨氮质量浓度由38 mg·L−1降低至4.5 mg·L−1,在第4天达到稳定,改性核桃壳生物炭MFC对氨氮的去除率最终达到88%。水体中的硝氮在7 d内先上升后下降,可以看出硝化菌株产生的硝态氮会被好氧反硝化菌株利用,MFC具有较好的脱硝态氮能力。
3. 结论
1) MFC电极的最佳制备条件:活化时生物炭/氯化锌质量比5:3,真空煅烧温度为600 ℃,生物炭/聚苯胺/热熔胶复合电极比例为5:1:4,应用于MFC中最大的体积功率密度可达51 mW·m−3,对模拟废水中COD和氨氮的去除率分别为85%和88%。
2)相较于传统生物炭电极在水体中易碎,通过复合聚苯胺与热熔胶来制作生物炭电极可以在模拟废水中稳定运行。
3)用核桃壳生物炭通过简单的过程制备的MFC电极,为成本低廉,绿色清洁,操作简单的MFC发展方向提供了新的选择。
-
表 1 BET测量时获得的比表面积、孔径和孔容
Table 1. Specific surface area, pore size and pore volume determined by BET measurement
生物炭/氯化锌质量比 比表面积/(m2·g−1) 孔径/nm 孔容/(cm3·g−1) 5:1 590 3.818 0.009 5:3 657 3.424 0.015 5:5 883 3.421 0.017 -
[1] GOWTHAMI P, JUNG H Y, SADHASIVAM T, et al. A comprehensive review on microbial fuel cell technologies: Processes, utilization, and advanced developments in electrodes and membranes[J]. Journal of Cleaner Production, 2019, 221: 598-621. doi: 10.1016/j.jclepro.2019.02.172 [2] LI W Y, LIU Y X, REN R P, et al. Research progress on removal of nitrogen in water and wastewater by microbial fuel cell[J]. Chemical Industry and Engineering Progress, 2019, 38(2): 1097-1106. [3] ZHANG K X, MA Z K, SONG H H, et al. Macroporous carbon foam with high conductivity as an efficient anode for microbial fuel cells[J]. International Journal of Hydrogen Energy, 2020, 45(21): 12121-12129. doi: 10.1016/j.ijhydene.2020.02.123 [4] CHEN J F, HU Y Y, ZHANG L H, et al. Bacterial community shift and improved performance induced by in situ preparing dual graphene modified bioelectrode in microbial fuel cell[J]. Bioresource Technology, 2017, 238: 273-280. doi: 10.1016/j.biortech.2017.04.044 [5] LV W, LING Z J, DENG Y Q, et al. Graphene-based materials for electrochemical energy storage devices: Opportunities and challenges[J]. Energy Storage Materials, 2016, 2: 107-138. doi: 10.1016/j.ensm.2015.10.002 [6] CAI T, MENG L J, CHEN G, et al. Application of advanced anodes in microbial fuel cells for power generation: A review[J]. Chemosphere, 2020, 248(c): 125985. [7] LOGAN B, CHENG S, WATSON V, et al. Graphite fiber brush anodes for increased power production in air-cathode microbial fuel cells[J]. Environmental Science & Technology, 2007, 41(9): 3341-3346. [8] CHEN S L, HE G H, HU X W, et al. A three-dimensionally ordered macroporous carbon derived from a natural resource as anode for microbial bioelectrochemical systems[J]. Chemsuschem, 2012, 5(6): 1059-1063. doi: 10.1002/cssc.201100783 [9] 邓金龙. 我国核桃生产现状及发展策略[J]. 林产工业, 2016, 43(10): 56-58. doi: 10.3969/j.issn.1001-5299.2016.10.014 [10] JUAN J L, GUZMAN, MERYEM O, et al. Performance of electro-spun carbon nanofiber electrodes with conductive poly(3, 4-ethylenedioxythiophene) coatings in bioelectrochemical systems[J]. Journal of Power Sources, 2017, 356: 331-337. doi: 10.1016/j.jpowsour.2017.03.133 [11] LI Y Y, ZHU L H, SHEN F, et al. Highly conductive microfiber of graphene oxide templated carbonization of nanofibrillated cellulose[J]. Advanced Functional Materials, 2014, 24(46): 7366-7372. doi: 10.1002/adfm.201402129 [12] KARTHIKEYAN R, WANG B, XUAN J, et al. Interfacial electron transfer and bioelectrocatalysis of carbonized plant material as effective anode of microbial fuel cell[J]. Electrochimica Acta, 2015, 157: 314-323. doi: 10.1016/j.electacta.2015.01.029 [13] RAJAPAKSHA A U, GAO B, ZHANG M, et al. Engineered/designer biochar for contaminant removal/immobilization from soil and water: Potential and implication of biochar modification[J]. Chemosphere, 2016, 148: 276-291. doi: 10.1016/j.chemosphere.2016.01.043 [14] LI D, WANG Y, YANG J, et al. Activation characteristics comparison of activated carbons prepared from biomass and lignite[J]. Journal of Chemical Industry, 2013, 64(9): 3338-3347. [15] SI W J, WU X J, XING W, et al. Bagasse-based nanoporous carbon for supercapacitor application[J]. Journal of Inorganic Materials, 2010, 26(1): 107-112. [16] SONG S R, ZHANG M C, XU X Y, et al. Isolation of a heterotrophic nitrification-aerobic denitrification strain and identification of its potential electricity generation ability in microbial fuel cells.[J]. Environmental Technology, 2021, 1: 21-25. [17] SING K S W, EVERETT D H, HAUL R A W, et al. Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity (recommendations 1984)[J]. Pure and Applied Chemistry, 1985, 57(4): 603-619. doi: 10.1351/pac198557040603 [18] 王乐, 周娴娴, 陈良, 等. 核桃壳衍生活性炭孔结构的调控及其对锂硫电池性能的影响[J]. 太原理工大学学报, 2021, 52(6): 863-872. doi: 10.16355/j.cnki.issn1007-9432tyut.2021.06.003 [19] SONG H H, LI H, WANG H, et al. Chicken bone-derived N-doped porous carbon materials as an oxygen reduction electrocatalyst[J]. Electrochimica Acta, 2014, 147: 520-526. doi: 10.1016/j.electacta.2014.09.146 [20] YANG G H, LI X, WANG Y Y, et al. Three-dimensional interconnected network few-layered MoS2/N, S co-doped graphene as anodes for enhanced reversible lithium and sodium storage[J]. Electrochimica Acta, 2019, 293: 47-59. doi: 10.1016/j.electacta.2018.10.026 [21] 缺少内容 [22] LU M, QIAN Y J, YANG C C, et al. Nitrogen-enriched pseudographitic anode derived from silk cocoon with tunable flexibility for microbial fuel cells[J]. Nano Energy, 2017, 32: 382-388. [22]CHENG Z, DENG Y D, HU W B, et al. A review of electrolyte materials and compositions for electrochemical supercapacitors[J]. Chemical Society Reviews, 2015, 44(21): 7484-539. [23] HUTCHINSON A J, TOKASH J C, LOGAN B E. Analysis of carbon fiber brush loading in anodes on startup and performance of microbial fuel cells[J]. Journal of Power Sources, 2011, 196(22): 9213-9219. doi: 10.1016/j.jpowsour.2011.07.040 [24] ZHOU G, ZHOU Y, SHI H. Assessment of a novel overflow-type electrochemical membrane bioreactor (EMBR) for wastewater treatment, energy recovery and membrane fouling mitigation[J]. Bioresource Technology, 2015, 196: 648-655. doi: 10.1016/j.biortech.2015.08.032 [25] LIANG P, FANMZ, CAO X X, et al. Composition and measurement of the apparent internal resistance in microbial fuel cell[J]. Environmental Science, 2007, 28(8): 1894-1898. [26] 廖绍华, 杨晓梅, 黄毕生, 等. 氯化锌活化柚子皮制备生物炭及其对亚甲基蓝的吸附[J]. 大理大学学报, 2020, 5(12): 15-20. doi: 10.3969/j.issn.2096-2266.2020.12.003 [27] YE X F, ZHOU H J, YU X N, et al. Physiochemical properties and yields of corn-stalk-biochar under different pyrolyzed temperatures[J]. Journal of Plant Nutrients and Fertilizer, 2017, 23(5): 1268-1275. [28] WANG R F, WANG H, ZHOU T B, et al. The enhanced electrocatalytic activity of okara-derived N-doped mesoporous carbon for oxygen reduction reaction[J]. Journal of Power Sources, 2015, 274: 741-747. doi: 10.1016/j.jpowsour.2014.10.049 -




 下载:
下载: