-
施氏矿物(schwertmannite)是BIGHAM等[1]于1990年在酸性矿山废水中发现的一种结晶度差的次生羟基硫酸铁沉淀[2-3],并在1994年被命名[4],化学式为Fe8O8(OH)8−2x(SO4)x(1≤x≤1.75)[5]。有研究表明,施氏矿物是降解有机污染物的高效催化剂,常被用来催化降解甲基橙[6-8]、罗丹明B[9]、苯酚[10-11]等有机污染物。甲基橙作为典型的偶氮染料被广泛应用于纺织印染行业,由于其具有可生化性差、色度大和难降解等特点,其降解行为备受关注。
施氏矿物是亚稳态的[12-13],溶液体系中存在的一价阳离子(Na+,K+,
NH+4 )会促进其向黄铁矾转化[14-15],且成矾能力表现为K+>NH+4 >Na+[15-16]。然而,在传统生物合成施氏矿物的过程中,总Fe沉淀量约为30%,大量的Fe3+仍然存在于溶液中,故矿物得率较低[17-18]。因此,促进施氏矿物合成过程中Fe3+的高效沉淀,提高矿物得率是施氏矿物合成领域亟待解决的问题。BH−4 可以与Fe3+反应生成Fe,Fe在溶液中可与Fe3+或与H+反应产生Fe2+[19-22]。涉及的化学反应如式(1)~式(3)所示。首先,施氏矿物生物合成后,通过在滤液中加入
BH−4 ,滤液中的Fe3+会在BH−4 作用下转化为Fe2+,Fe2+作为能源物质被A. ferrooxidans生物氧化为Fe3+,并进一步水解为次生铁矿物,可能会提高总Fe的沉淀率和矿物得率;其次,由于Na+成矾能力最弱,故本研究选择向施氏矿物合成后的滤液中加入NaBH4,考察了其对滤液pH、Fe2+、总Fe含量及次生铁矿物生成量的影响,并揭示了次生铁矿物形貌、矿相和比表面积的变化;此外,基于硫酸根自由基高级氧化技术,探究了所得矿物在254 nm紫外光照射下催化降解偶氮染料甲基橙的效果。本研究可为次生铁矿物合成的生物化学调控及其在偶氮染料降解领域的应用提供参考。
全文HTML
-
将A. ferrooxidans LX5 (CGMCC No. 0727)菌体在150 mL改进型9K液体培养基中活化3次后,通过离心得到浓缩30倍A. ferrooxidans LX5细胞悬浮液[23-24]。采用QIAO等[23]提供的方法,在149 mL溶解有6.67 g FeSO4·7H2O的溶液中,加入1 mL A. ferrooxidans LX5细胞悬浮液,置于28 ℃、180 r·min−1的恒温振荡器中反应,合成施氏矿物,待Fe2+氧化完全后,抽滤收集矿物并分析其矿物生成量、形貌、XRD及其比表面积,滤液用于后续研究。
-
分别量取上述所得滤液120 mL置于5个250 mL锥形瓶中,设置NaBH4加入浓度为0.42、0.83、1.25、1.67和2.08 g·L−1的5个处理组,并设置对照组(记为CK),每个处理组3个重复,置于恒温振荡器中反应,各处理组在Fe2+氧化完全后再经过滤,滤液再次加入NaBH4后进行下个批次实验,共3个批次。实验过程中定时监测各处理组中的pH,并取样测定Fe2+及总Fe含量。将5个处理组对应3个批次生成的共15个矿物分别在50 ℃下干燥,过100目标准筛后收集保存。
-
根据矿物生成量,选择加入1.25 g·L−1和1.67 g·L−1 NaBH4的2个处理组各3个批次合成的矿物,与初始合成的施氏矿物共计7个矿物,使用光化学反应仪(XPA-7G8,南京胥江机电厂,中国),在254 nm紫外光照射下开展次生铁矿物催化过硫酸钠(Na2S2O8)降解甲基橙的实验。反应温度稳定在(23±1) ℃,使用100 W的汞灯作为254 nm紫外光源。
配制0.1 mmol·L−1的甲基橙溶液,称取7个矿物各10 mg于石英管,加入50 mL甲基橙溶液,并设置纯紫外光照射降解甲基橙的对照处理组(记为CK紫外光)。每个处理组3个重复。分别在10、30、60、90、120、150和180 min时取样3 mL,过0.45 μm滤膜后,利用721型可见分光光度计在470 nm波长下测定吸光度,根据吸光度计算甲基橙的降解率。
分别称取7个矿物各10 mg于石英管,每个矿物称2次,并加入50 mL甲基橙溶液。然后,配制浓度为0.1 mol·L−1的Na2S2O8溶液,每个矿物的石英管中分别加入50 μL和250 μL Na2S2O8溶液,即设置Na2S2O8的浓度分别为0.1 mmol·L−1和0.5 mmol·L−1,并设置不加矿物,只加Na2S2O8的对照处理组(记为CK过硫酸钠)。每个处理3个重复,取样时间和方法同上。其中,在Na2S2O8浓度为0.5 mmol·L−1的实验中各处理组中的甲基橙降解迅速,在90 min时降解效率即可达到100%,故不再延长取样时间至180 min。
-
用邻菲罗啉比色法测定样品中Fe2+、总Fe含量;用扫描电子显微镜(JSM-7001F,日本东京)观察矿物形貌;用X射线衍射仪(MiniFlex II,日本东京)分析矿物矿相;用比表面积分析仪(Tristar3020,Micromeritics Instrument Corporation,USA)测定矿物比表面积。
1.1. 施氏矿物初始生物合成
1.2. NaBH4对次生铁矿物合成的影响
1.3. 次生铁矿物催化过硫酸钠降解去除甲基橙
1.4. 各指标测定方法
-
在施氏矿物初始合成过程中,总Fe沉淀率为26%,与刘奋武等[17]的研究结果相近,矿物合成量为5.72 g·L−1(以干物质计)。通过分析矿物的XRD衍射图谱(图1(a))可知,其为施氏矿物,比表面积为4.94 m2·g−1。由图1(b)可以看出,合成的施氏矿物为表面粗糙、具有毛刺状结构的微小球体,直径为1~2 μm,其形貌与前人报道的结果[25-26]相似。
-
5个处理组在3个批次实验过程中的pH变化情况如图2所示。各处理组在一个批次实验结束后立即开始下一批次实验,其中CK处理组与NaBH4加入量为2.08 g·L−1的处理组反应时间一致。CK处理组中在整个实验过程中pH基本保持不变(2.00)。添加NaBH4的各处理组中的pH均表现为先上升、后下降且在一定时间后趋于稳定的变化趋势,随着反应批次增加,各处理组pH上升幅度均有增大,pH稳定所需要的时间也逐渐延长。在第3批次中(图2(c))pH变化差异最大,在NaBH4加入量为0.42 g·L−1和0.83 g·L−1的2个处理组中的pH分别在108 h和360 h时稳定,而NaBH4加入量为1.25、1.67和2.08 g·L−1的3个处理组,pH在600 h后仍未稳定。
NaBH4是强碱弱酸盐,加入水中会导致pH上升。为探究NaBH4加入后各处理组的pH上升情况是否与NaBH4和H2O的反应有关,用H2SO4配制pH为2.00的酸性溶液,分别量取120 mL置于5个250 mL锥形瓶中,对应5个处理组的加入量分别加入NaBH4,振荡1 h后测得pH分别为3.25、8.90、9.22、9.34和9.43,均高于第1批次实验中,5个处理组加入NaBH4 1 h后的pH最大值(NaBH4加入量为2.08 g·L−1处理组的pH为2.32)。由此可见,在酸性溶液中加入NaBH4,
BH−4 会将溶液中的H+还原成H2[19],pH上升幅度较大,而在施氏矿物合成后滤液中加入NaBH4,NaBH4主要先还原Fe3+,同时产生大量的H+,抵消部分H+的消耗,因此,pH上升幅度较小。 -
CK处理组在整个实验过程中几乎无Fe2+,添加NaBH4的5个处理组均有Fe2+产生。在第1批次实验中(图3(a)),各体系生成的Fe2+含量与NaBH4加入量呈正相关关系(Pearson相关系数r=0.998,在0.01级别,相关性显著),且加入NaBH4的各处理组Fe2+均能被氧化完全。在第2批次实验中(图3(b)),各处理组产生的Fe2+含量与第1批次相近,但Fe2+完全氧化所需要时间较长。这可能与A. ferrooxidans LX5的活性有关,随着NaBH4加入量的增加,各处理组中Na+含量增加,导致A. ferrooxidans LX5菌体活性减弱或细胞裂解死亡[27]。在第3批次实验中(图3(c)),各处理组Fe2+氧化情况相差较大,NaBH4加入量为0.42 g·L−1与0.83 g·L−1 2个处理组中的Fe2+分别在72 h和312 h氧化完全,这表明A. ferrooxidans LX5仍能发挥生物氧化作用。而NaBH4加入量为1.25、1.67和2.08 g·L−1 3个处理组分别在反应了696、624和624 h后,Fe2+氧化率仅为28.68%、34.94%和26.80%。
为探究第3批次反应后各处理组内A. ferrooxidans LX5的活性,将反应结束后各处理组的滤液各15 mL分别加入到135 mL溶有6.67 g FeSO4·7H2O的溶液中,同时设置加入新活化菌液和不加菌的处理,比较在48 h后的Fe2+氧化情况。结果表明,反应48 h后,加入新活化菌液的处理Fe2+已经氧化完全,而不加菌处理的Fe2+氧化率仅为1.04%,添加第3批次反应后滤液的各处理Fe2+氧化率为1.18%~4.09%。可见,经过了3个批次的反应,各处理组内A. ferrooxidans LX5已经基本失活,无法快速氧化Fe2+,因此,3个批次后再开展次生铁矿物的强化合成意义不大。
总Fe含量变化情况如图4所示,CK处理组在整个实验过程总Fe基本不变,其他处理组均呈现下降趋势。在第1批次中(图4(a)),加入NaBH4后,5个处理组总Fe含量均下降,且与NaBH4加入量呈现负相关(Pearson相关系数r=−1.000,在0.01级别,相关性显著)。在第2批次中(图4(b)),5个处理组总Fe下降趋势与第1批次相同。在进入第3批次后(图4(c)),总Fe沉淀量的差异变的明显,在实验结束时,5个处理组的总Fe沉淀率分别达到14.57%、37.63%、47.00%、62.67%和60.91%。
-
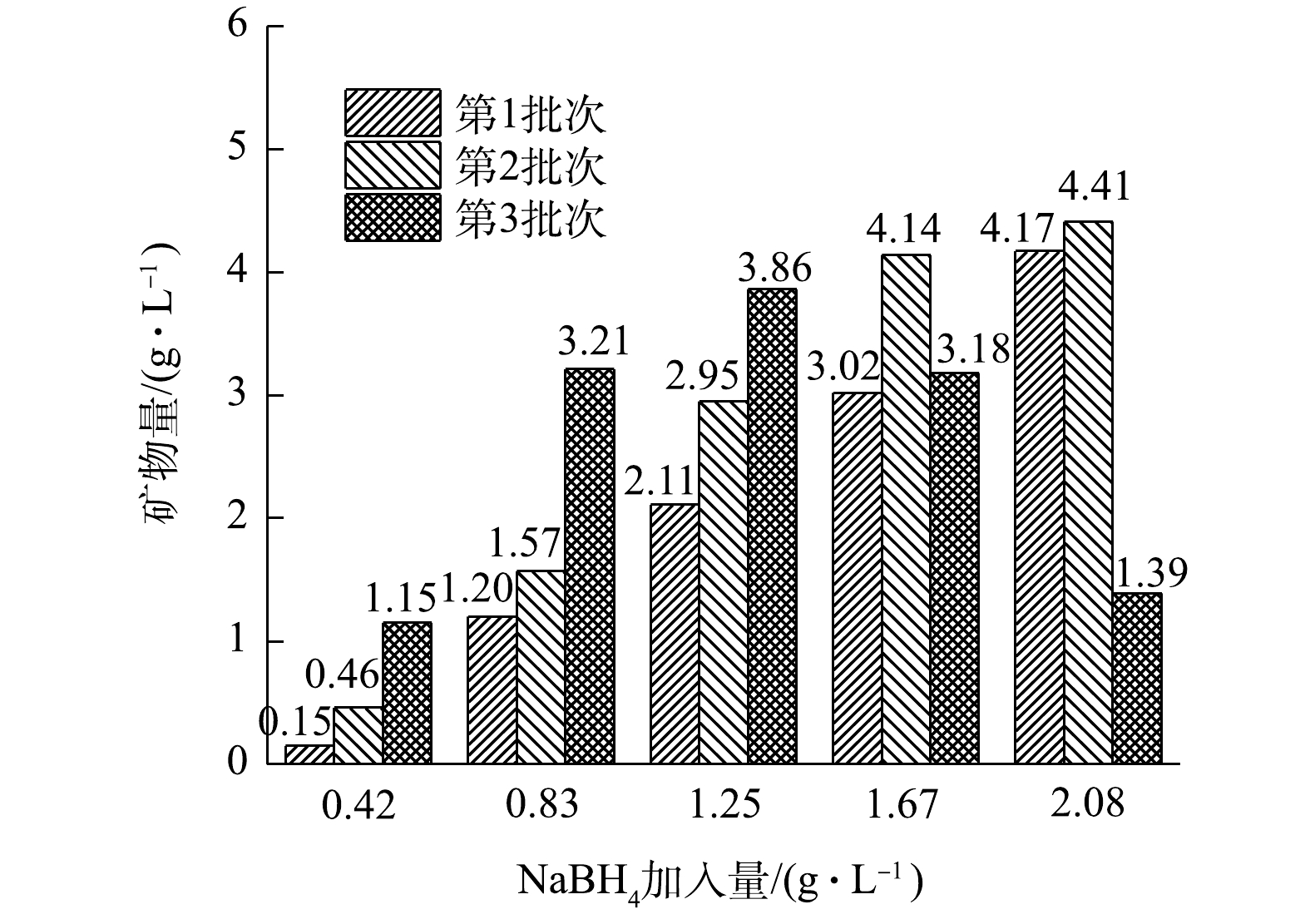
各处理组生成的矿物量情况如图5所示。在NaBH4加入量为0.42、0.83和1.25 g·L−1的3个处理组中,随着NaBH4反应批次增加,矿物生成量有所增加,在3个处理组中第2批次矿物生成量分别比第1批次提高了3.07、1.31和1.40倍,第3批次矿物生成量比第1批次分别高了7.67、2.68和1.83倍。在1.25 g·L−1处理组中,第3批次的Fe2+虽然没有被氧化完全,但其矿物生成量仍比前2个批次高,而在1.67 g·L−1和2.08 g·L−1的2个处理组中,由于第3批次的反应中体系中Fe2+没有被氧化完全,导致矿物生成量减少,没能超过同处理组的第2批次矿物生成量。经过3个批次反应后,添加NaBH4的5个处理组中的矿物生成总量分别为1.76、5.98、8.92、10.34与9.97 g·L−1。
为探究5个处理组的矿物生成量与A. ferrooxidans LX5的关系,将施氏矿物合成后的滤液过0.22 μm滤膜后(去除A. ferrooxidans LX5),分别取120 mL加入到5个250 mL锥形瓶中,按照5个处理组的加入量加入NaBH4,并对应第1批次实验中各处理组的反应时间,实验结束后抽滤获得次生铁矿物,矿物生成量分别为0.28、1.02、1.66、2.20和2.55 g·L−1。可见,在无A. ferrooxidans LX5的情况下,将NaBH4加入滤液中也能产生矿物沉淀,但A. ferrooxidans LX5的存在可以进一步提高矿物生成量。在第1批次中,当NaBH4加入量为0.83、1.25、1.67和2.08 g·L−1时,矿物生成量分别提高了17.65%、27.11%、37.27%和63.53%。
-
选择NaBH4加入量为1.25 g·L−1和1.67 g·L−1 2个处理组对应的3个批次所生成的6种矿物,对其进行了XRD、SEM表征且测定了其比表面积,将XRD表征结果与施氏矿物(PDF#47-1775)和黄钠铁矾(PDF#30-1203)的JCPDS标准卡片衍射峰进行比较[28-29]。由图6可知:2个处理组中第1批次生成的次生铁矿物均具有施氏矿物的特征衍射峰,且峰较宽,这说明2种矿物是施氏矿物;第2批次生成的2种矿物的XRD图谱中,虽然施氏矿物的特征衍射峰依然存在,但在其他位置出现数条黄钠铁矾的特征峰,表明这2种矿物是黄钠铁矾和施氏矿物的混合物。这可能是由于NaBH4加入量的增加,Na+浓度增高,导致生成黄钠铁矾。第3批次生成的矿物的XRD图谱中显示的均为黄钠铁矾的特征峰[30],由此可见,2个处理组中第3批次合成的矿物是黄钠铁矾。
NaBH4加入量为1.25 g·L−1和1.67 g·L−1的2个处理组合成的次生铁矿物的形貌各不相同(图7),2个处理组对应的同一批次矿物形貌相差较小,同一处理组不同批次之间矿物形貌相差较大。第1批次合成的次生铁矿物(图7(a)和图7(d))仍具有施氏矿物的形貌特征,即微小的球形结构,表面带有毛刺状,颗粒之间互相粘连形成几个或几十个团聚在一起的结构,与前文2.1中初始合成的施氏矿物相比,没有明显差别。而第2批次合成的次生铁矿物(图7(b)和图7(e))是球状结构与不规则块状结构粘连在一起的混合物,且增加NaBH4加入量可增加生成的次生铁矿物中立方体(假立方体)的块状结构。而第3批次合成的次生铁矿物(图7(c)和图7(f))已经全部由块状结构组成。结合XRD和SEM结果可知,立方体(假立方体)块状结构为黄钠铁矾。
就矿物比表面积而言(表1),NaBH4加入量为1.25 g·L−1和1.67 g·L−1的2个处理组中3个批次合成的矿物比表面积为第2批次>第1批次>第3批次,而在相同批次中,NaBH4加入量为1.67 g·L−1的处理组合成的矿物比表面积大于投加量为1.25 g·L−1处理组对应的矿物比表面积。由此可见,加入NaBH4不仅能够进一步沉淀总Fe,促进次生铁矿物的合成,而且能够增加次生铁矿物的比表面积。其中,第2批次合成的矿物比表面积增加更为显著,但在第3批次中,由于矿物以黄钠铁矾为主,比表面积会大幅度减小。值得一提的是,尽管在第2批次合成的矿物中已经有黄钠铁钒的生成,但相对于第1批次生成的矿物,比表面积仍然呈现增加的趋势。由此可见,在第2批次合成的矿物中,施氏矿物对矿物比表面积的贡献较大。综合矿物矿相、比表面积、矿物生成量可以得出,在初始合成施氏矿物滤液中适量引入NaBH4,可以在提高矿物生成量的同时,得到比表面积较大的施氏矿物。
在本研究中,通过加入1.67 g·L−1的NaBH4,在第1批次实验结束时就可以得到3.02 g·L−1的施氏矿物,生成量增加了52.80%,生成的施氏矿物比表面积为20.02 m2·g−1,提高了4.05倍。本研究所用NaBH4(优级纯)价格为1 250 元·kg−1,从滤液中每多合成1 g高比表面积施氏矿物,需要投入的成本为0.69元。
-
NaBH4加入量为1.25 g·L−1和1.67 g·L−1的2个处理组各3个批次合成的矿物,与初始合成的施氏矿物共计7个矿物,在紫外光下催化Na2S2O8降解甲基橙的效果如图8所示。在无Na2S2O8的实验中(图8(a)),CK紫外光处理组在180 min时,甲基橙去除率为1%,加入次生铁矿物的7个处理组对甲基橙的去除率相差不大,为3.90%~9.28%。其中1.25 g·L−1处理组第1批次矿物(比表面积为0.84 m2·g−1)催化去除甲基橙的效果最差。在Na2S2O8加入量为0.1 mmol·L−1时(图8(b)),次生铁矿物的引入能够催化高级氧化去除甲基橙的过程。在反应120 min时,CK过硫酸钠处理组的甲基橙去除率为58.28%,当加入比表面积为0.84 m2·g−1的次生铁矿物时,去除率为72.83%,降解效果提升不明显。当矿物比表面积在4.94~42.74 m2·g−1时,去除率均能达到90%,而加入1.67 g·L−1处理组第1批次和第2批次矿物时,去除率分别可达98.12%和98.45%。在反应180 min时,CK过硫酸钠处理组对甲基橙的去除率为70.44%,加入1.25 g·L−1处理组中第3批次矿物对甲基橙的去除率为94.58%,其余处理组对甲基橙的去除率均达到100%。笔者认为,也许由于本研究中次生铁矿物的加入量为10 mg,加入量较大,当矿物比表面积差异较大时(4.94~42.74 m2·g−1),其对甲基橙催化去除效果的差异未能较好地体现出来。
在Na2S2O8浓度为0.5 mmol·L−1的实验中,增大Na2S2O8浓度能够提高甲基橙降解速率,缩短反应时间,各处理组对甲基橙去除效果的差异变小,且均能在90 min时将甲基橙完全去除。可见,在Na2S2O8浓度较低时(0.1 mmol·L−1)引入次生铁矿物,可以提升甲基橙的去除率,对催化高级氧化去除偶氮染料更有价值。而在Na2S2O8达到一定浓度后(0.5 mmol·L−1),次生铁矿物加入对提升甲基橙高级氧化去除效果并不明显。
2.1. 初始合成施氏矿物的表征分析
2.2. NaBH4对生物成矿后滤液pH的影响
2.3. 加入NaBH4后各处理组Fe2+和总Fe的变化情况
2.4. 各处理组次生铁矿物生成量的比较
2.5. 次生铁矿物的矿相、形态和比表面积
2.6. 次生铁矿物在紫外光下催化Na2S2O8去除甲基橙
-
1)利用A. ferrooxidans LX5生物合成施氏矿物,溶液体系中仅有26%的总Fe参与生物成矿。在生物成矿后的滤液中引入NaBH4,总Fe沉淀量与矿物生成量增加。
2)当NaBH4添加量为1.25~1.67 g·L−1时,第1批次得到的矿物是施氏矿物,第2批次获得矿物是施氏矿物和黄钠铁矾的混合物,第3批次获得矿物是黄钠铁矾,且第2批次合成的矿物比表面积最大,第3批次合成的矿物比表面积最小。
3)当Na2S2O8浓度为0.1 mmol·L−1时,次生铁矿物的引入可以明显提高甲基橙去除率;当Na2S2O8浓度为0.5 mmol·L−1时,次生铁矿物的引入并未明显提升甲基橙的去除。



 下载:
下载: