-
作为新型脱氮工艺,anammox因其无需外加碳源和曝气、负荷高等优点而受到广泛关注[1-2]。颗粒污泥沉降性能好、生物活性高、抗冲击负荷强。但anammox菌的生长容易受到温度、pH、底物浓度等外界环境因素干扰,从而导致anammox工艺启动难度较大。Anammox颗粒污泥反应器的快速启动是其工程化应用的重要前提。
群体感应(quorum sensing,QS)是指微生物自发合成并释放信号分子,浓度达阈值后被细胞感知并调控相关基因的表达[3],如生物膜的形成、毒力因子的表达、生物发光[4]等。Anammox菌代谢过程中合成并分泌AHLs信号分子,通过调控相关功能基因的表达、胞外聚合物 (extracellular polymeric substance,EPS) 合成等生理行为,最终影响微生物聚集体形成,即AHLs介导QS以调控EPS含量和组成,从而诱导anammox体系中的污泥颗粒化[5]。
LIU等[6]发现anammox菌释放的信号分子中C6-HSL和C8-HSL浓度最高。C6-HSL可改善颗粒的活性,C8-HSL对颗粒的稳定性和沉降性起着关键作用[7]。ZHANG[8]通过在UASB反应器中添加150 μmol·L−1 C6-HSL,使得anammox颗粒污泥的活性提高了16%,达到了1.08 kg·kg−1·d−1 (以每天每千克悬浮物消耗N的质量计) 。HAN等[9]发现C8-HSL在总氮容积负荷为1.68 kg·m−3·d−1的条件下,促进了紧密结合型EPS的蛋白质 (protein,PN) 分泌,提高了污泥的沉降性。张向晖等[10]向升流式厌氧污泥床 (upflow anaerobic sludge blanket,UASB) 反应器中分别添加C6-HSL和C8-HSL,发现质量浓度为0.5 g·L−1的AHLs会抑制anammox菌群生长,但能提高其脱氮性能,并显著促进hzs A的表达。目前,较多研究集中在C6-HSL或C8-HSL单独投加对anammox工艺脱氮性能等方面的影响。但在实际体系中,C6-HSL和C8-HSL同时存在,因此,本研究选择联合投加C6-HSL和C8-HSL以探究其对anammox颗粒污泥工艺启动的影响。
本研究在UASB反应器中接种污水厂剩余污泥和anammox污泥以启动anammox颗粒污泥系统,再联合投加外源信号分子C6-HSL和C8-HSL,通过定期检测并分析进出水氮的质量浓度、沉降指标、EPS质量浓度、污泥粒径、功能基因相对丰度、AHLs质量浓度等以探究外加AHLs对anammox污泥颗粒化过程的作用及其对anammox菌活性和富集的影响,以期为anammox颗粒污泥工艺的启动提供参考。
-
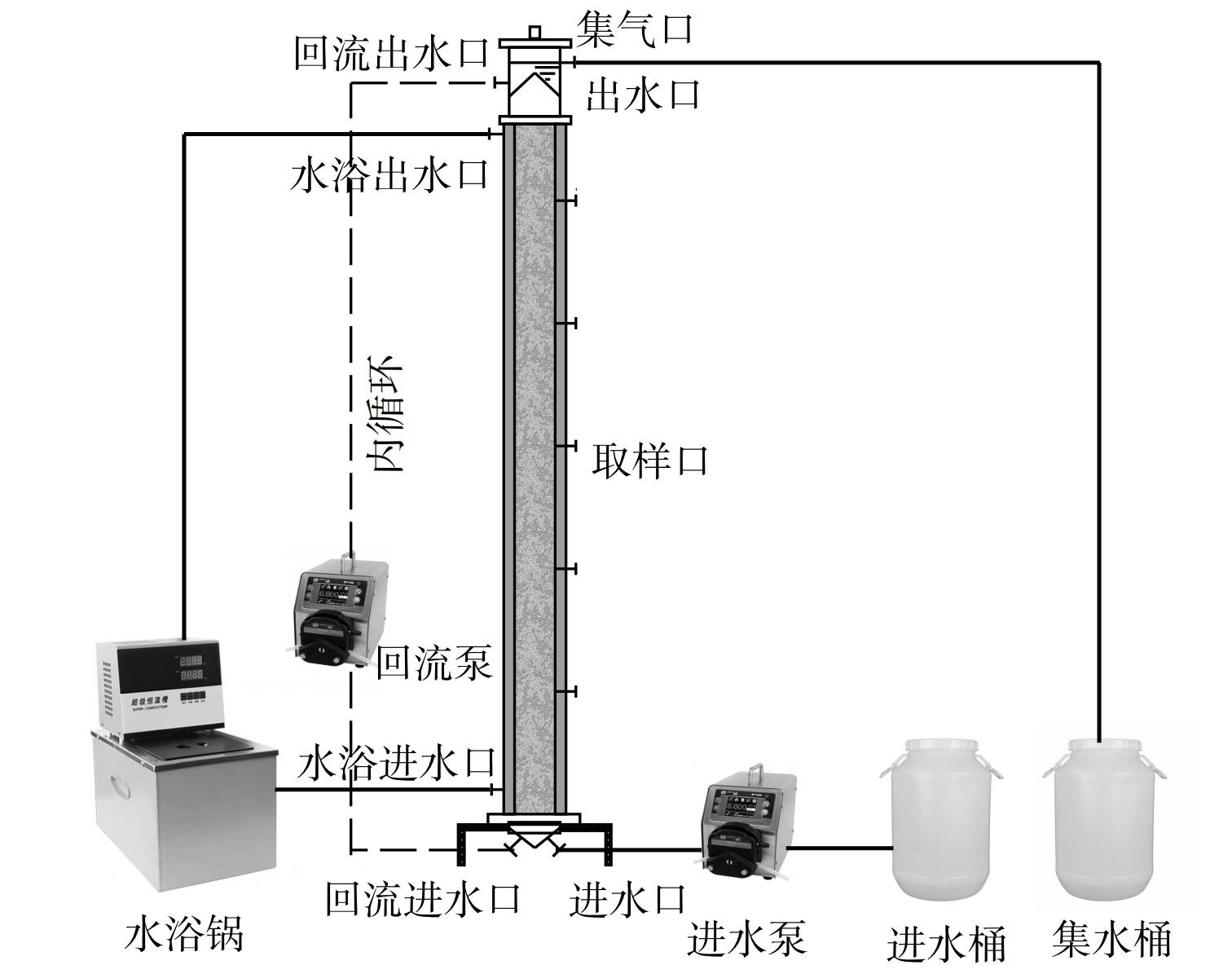
本实验系统主要由UASB反应器、蠕动泵、水浴加热装置、进水箱、集水箱等组成 (图1) 。UASB反应器主体为有机玻璃材质,内径9 cm,高径比15∶1,体积10 L,有效体积8.6 L。从下至上每24 cm设置一个取样口。整套装置气密性良好,三相分离器与反应器顶盖为一体。反应器外有水浴层,水浴控制在 (35±1) °C。利用蠕动泵进水和内循环控制上升流速在6 m·h−1。
-
本实验的接种污泥为污水厂剩余污泥和anammox污泥的混合污泥,两者质量比为2∶1。剩余污泥取自天津市津南污水处理厂,anammox污泥取自1 m3的厌氧序批式反应器 (anaerobic sequencing batch reactor,ASBR) 。接种后混合液污泥浓度 (MLSS) 为3.0 g·L−1,混合液挥发性悬浮固体浓度 (MLVSS) 为1.6 g·L−1,MLVSS/MLSS为0.53。
-
实验所用模拟废水采用自来水人工配置,氨氮 (NH4+-N) 和亚硝氮 (NO2−-N) 分别来源于硫酸铵 ((NH4)2SO4) 和亚硝酸钠 (NaNO2) 。NO2−-N与NH4+-N质量浓度之比为1.3,按需进行配制。矿物成分为碳酸氢钠 (NaHCO3) 0.5 g·L−1、磷酸二氢钾 (KH2PO4) 0.027 g·L−1、氯化钙 (CaCl2) 0.18 g·L−1、七水合硫酸镁 (MgSO4·7H2O) 0.1 g·L−1。此外,加入微量元素Ⅰ、Ⅱ溶液[11],体积浓度为1 mL·L−1,用高纯氮气吹扫配水至少10 min,以除去溶解氧,并用1 mol·L−1盐酸 (HCl) 调节pH至7.5~8.0。
-
UASB反应器共运行92 d,分为4个阶段。氨氮去除率增长至稳定后即可进入下一阶段。从第13天开始,向反应器R1投加0.1 μmol·L−1的C6-HSL和0.1 μmol·L−1的C8-HSL,向反应器R2投加0.2 μmol·L−1的甲醇做对照[12]。不同阶段的时间、进水TN、水力停留时间 (HRT) 如表1所示。反应器R1和R2运行工况相同。
-
1) 常规项目及测试方法。每天取1次出水水样,经0.45 μm滤膜过滤后,放入4°C冰箱保存。按《水和废水监测分析方法》[13]中的分析方法测定水质指标:采用纳氏试剂-紫外分光光度比色法测定氨氮质量浓度;采用N - (1-萘基) -乙二胺分光光度法测定亚硝氮质量浓度;采用紫外分光光度法测定硝氮质量浓度;采用重量法测定MLSS;采用马弗炉燃烧-重量法测定MLVSS。污泥体积指数 (SVI5) 根据污泥的MLSS和污泥沉降比 (SV5) 计算得出。
2) 污泥粒径。颗粒污泥粒径采用湿氏筛分法测定。取50 mL泥水混合物,依次通过孔径为2.00、0.90、0.45、0.15 mm的不锈钢网筛,利用MLSS的测定方法分别测定不同粒径范围的质量,并计算其所占的百分比[11]。
3) EPS提取及测定。对污泥中EPS进行提取,提取后的EPS进行PN、多糖 (polysaccharide,PS) 的测定[14]。PN采用Lowry法试剂盒测定,以牛血清蛋白为标准物质,于550 nm波长下用紫外分光光度计进行测定,根据样品的吸光度和标准曲线计算PN浓度。PS采用苯酚-浓硫酸法测定,以葡萄糖为标准物质,在490 nm波长处测定吸光度,根据样品的吸光度和标准曲线计算PS浓度。
4) 群体感应物质的测试。在各阶段末期进行泥相的群体感应物质的测试,对泥相进行预处理。预处理步骤为:取一定量污泥在-80 ℃下冷冻干燥24 h。称一定量干污泥于50 mL离心管中,每次加入10 mL乙酸乙酯,振荡20 min,离心,取上清液过0.45 μm滤膜 (重复3次) ,加入1 mL 1 mol·L−1 HCl,分装至500 mL试剂瓶中,进行固相萃取,浓缩至1 mL,过0.22 μm滤膜后用超高效液相色谱质谱联用 (UPLC-MS) 测定其浓度[6]。
5) 污泥DNA提取。为探究微生物群落的变化,在不同阶段末取污泥样品提取DNA。将冻存的样品在室温下化冻后,于转速3 000 r·min−1离心10~20 min后,弃去上清液作为提取DNA的基质样品,采用E.Z.N.A. Soil DNA Kit试剂盒 (Omega, Norcross,GA,USA) 提取污泥总DNA。将所得DNA提取物-20 ℃冻存。
6) 实时定量PCR (qPCR) 反应。提取的DNA样品为待测样品,通过qPCR测定16S rRNA基因与功能基因的相对丰度,用荧光染料SYBR-GreenⅡ检测qPCR。qPCR程序在95 ℃变性2 min后开始,然后进行40个循环,每个循环包括变性95 ℃ 5 s,退火温度60 s和72 ℃延伸30 s。不同基因的引物和退火温度见表2。该反应在型号为BIO-RAD MJ MiniTM的机器上运行,联机以CFX Manager Software进行实时数据采集与分析。
7 )高通量测序。提取完的DNA样品为待测样品,以16S V4区引物 (515F和806R) 经过PCR扩增,产物纯化,文库制备及库检后进行HiSeq上机测序。通过对Reads拼接过滤、OTUs (Operational Taxonomic Units) 聚类进行物种注释及丰度分析,揭示样品物种构成。
-
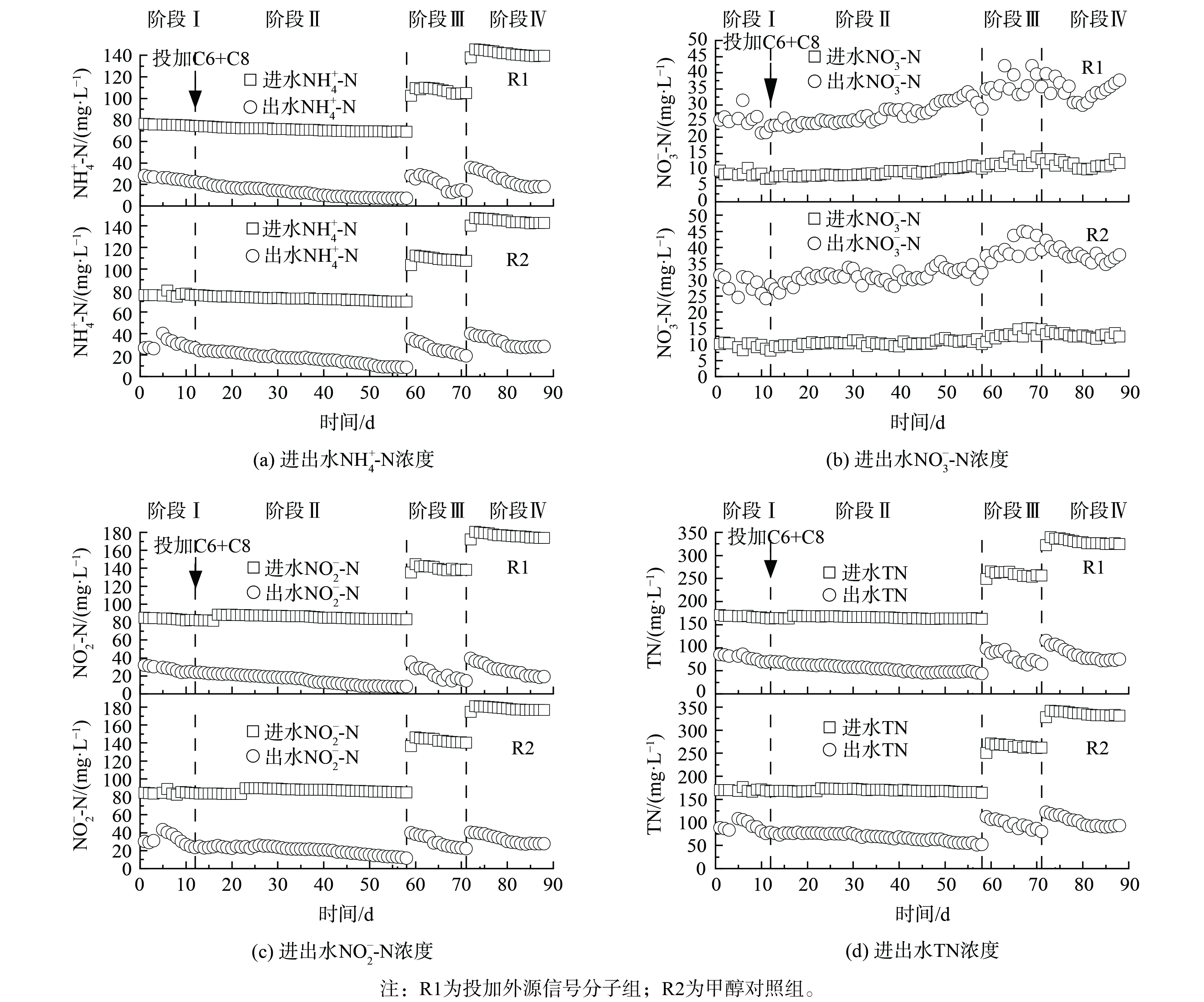
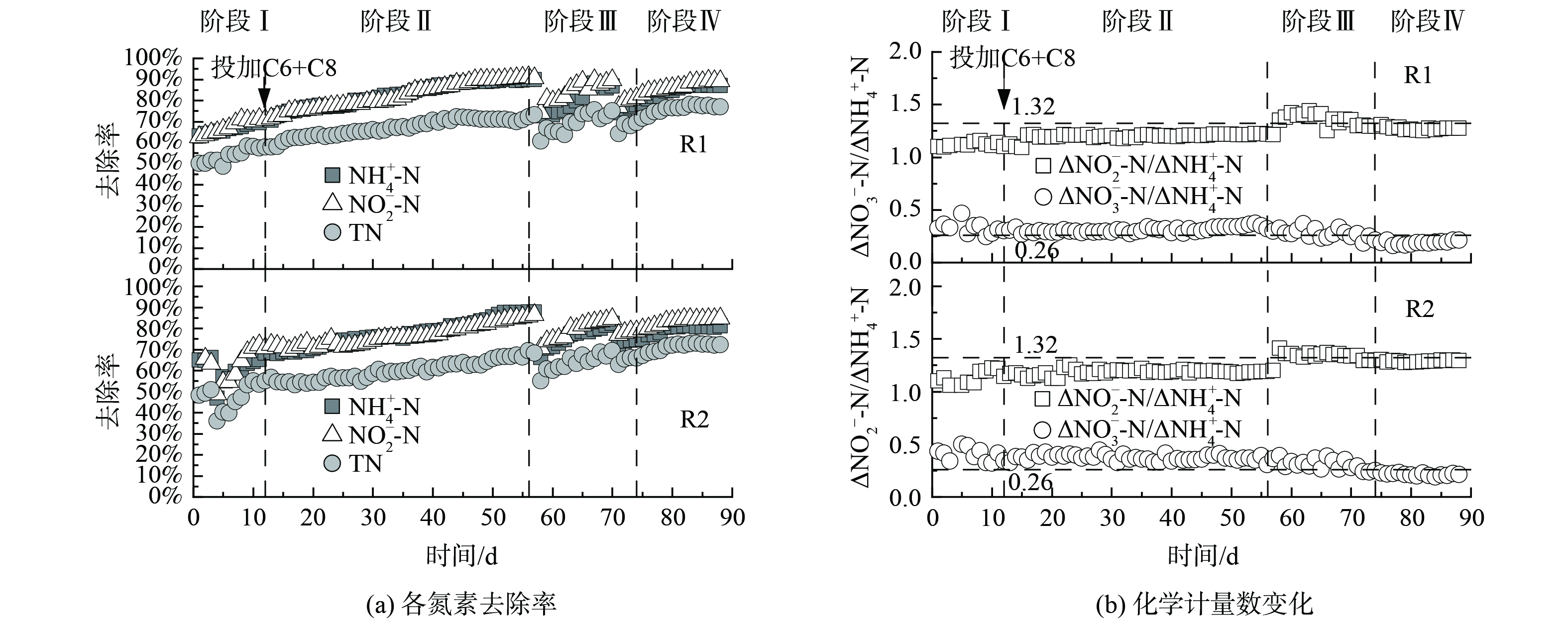
在阶段Ⅰ,进水TN为165 mg·L−1。由图2可知,R1中NH4+-N、NO2−-N和TN去除率逐渐增加,R2由于反应器故障,在第4天NH4+-N、NO2−-N出水质量浓度突然增加,之后NH4+-N、NO2−-N和TN去除率逐渐增加。在阶段Ⅰ,R1的TN去除率高于R2,对R1和R2的TN去除率进行独立样本T分析,得出R1有显著的脱氮优势 (p<0.05) 。
从阶段Ⅱ开始R1投加0.1 μmol·L−1 C6-HSL和0.1 μmol·L−1 C8-HSL,R2投加等量的甲醇,进水TN为232 mg·L−1 (实际反应器周期初始质量浓度165 mg·L−1) 。随着反应器的持续运行,脱氮性能逐渐增强,R1、R2中NH4+-N、NO2−-N和TN去除率显著增加 (p<0.05) 。在阶段Ⅱ末,R1的NH4+-N、NO2−-N和TN去除率分别达到89.88%、90.50%和73.15%,NO3−-N生成量为18.48 mg·L−1;R2的NH4+-N、NO2−-N和TN去除率分别达到87.75%、86.33%和68.22%,NO3−-N生成量为22.07 mg·L−1。图3表明,该过程中R1、R2的化学计量数ΔNO2−-N/ΔNH4+-N均值分别为1.18、1.16,ΔNO3−-N/ΔNH4+-N均值分别为0.31、0.38。投加信号分子后,NH4+-N的去除量以及NO3−-N的生成量均高于理论值。这可能是由于当反应器出水DO为1.04~1.56时,硝化细菌利用DO和基质发生硝化作用,消耗了部分NH4+-N,从而生成NO3−-N[12]。
在阶段Ⅲ,提升进水TN至270 mg·L−1。在该阶段初期,反应器脱氮性能下降,随着反应器的持续运行,脱氮性能逐渐恢复。R1、R2中化学计量数ΔNO2−-N/ΔNH4+-N和TN去除率逐渐增加。在阶段Ⅲ末,R1的NH4+-N、NO2−-N和TN去除率分别达到86.86%、89.55%和75.07%,NO3−-N的生成量为22.47 mg·L−1;R2的NH4+-N、NO2−-N和TN去除率分别达到82.37%、84.39%和69.49%,NO3−-N的生成量为24.62 mg·L−1。该过程中R1的化学计量数ΔNO2−-N/ΔNH4+-N均值为1.37,高于理论值 (1.32) ,ΔNO3−-N/ΔNH4+-N均值为0.29,高于理论值 (0.26) ;R2的化学计量数ΔNO2−-N/ΔNH4+-N均值为1.36,ΔNO3−-N/ΔNH4+-N均值为0.32。由此可见,投加信号分子更有利于体系脱氮主反应向anammox方向发展。R1的TN去除率可达到70%以上,提高进水TN之后,在13 d内可恢复,而R2的TN去除率仍在70%以下,这说明投加C6-HSL和C8-HSL有利于体系脱氮性能的恢复。
在阶段Ⅳ,继续提升进水TN至350 mg·L−1,R1、R2中NH4+-N、NO2−-N和TN去除率显著增加 (p<0.05) 。在阶段Ⅳ末,R1的NH4+-N、NO2−-N和TN去除率分别达到87.09%、89.13%和76.83%,NO3−-N的生成量为25.68 mg·L−1;R2的NH4+-N、NO2−-N和TN去除率分别达到81.07%、84.70%和72.18%,NO3−-N的生成量为24.68 mg·L−1。该过程中R1和R2的化学计量数ΔNO2−-N/ΔNH4+-N均值分别为1.28、1.29,ΔNO3−-N/ΔNH4+-N均值分别为0.20、0.22,均低于理论值。这可能是系统存在少量的硝化菌和反硝化菌降解NH4+-N和NO3−-N造成的。在投加C6-HSL和C8-HSL期间,R1中NH4+-N、NO2−-N、TN去除率均高于R2,故联合投加C6-HSL和C8-HSL有助于提高启动期氮的去除率。
-
在每个阶段末取一定量污泥检测其沉降性能和粒径分布。R1和R2的污泥质量浓度在3 g·L−1以下,R1和R2的MLSS均呈先下降后上升的趋势。呈下降的原因是启动期初期污泥没有形成稳定的颗粒,在上升流速形成的选择压力下,絮状污泥随出水流失。R1的SVI5从96.70降至44.10,R2的SVI5从104.90降至56.65。R1中污泥的SVI5低于R2,说明R1污泥的沉降性能更优[19]。这表明联合投加C6-HSL和C8-HSL有助于污泥沉降性能的改善 (p<0.05) ,且对污泥浓度有显著促进作用 (p<0.005) 。
一般来说,把颗粒粒径大于0.2 mm的污泥称为颗粒污泥[20]。颗粒污泥占比达到55%时,可认为颗粒污泥系统启动成功[21]。图4表明,在阶段Ⅱ末,R1中粒径>0.15 mm的污泥达到57.44%,这说明R1在第56天完成了anammox颗粒污泥系统启动。在启动期末,R2中粒径>0.15 mm的污泥所占比例仅为53.37%,这说明R2尚未完成anammox颗粒污泥系统启动。
粒径为0.45~0.90 mm时污泥脱氮效果及物理、生化性能最佳[22]。R1中粒径在0.45~0.90 mm的污泥占比从4.93%增至17.05%,增加了13.88%,而R2中粒径在0.45~0.90 mm的污泥占比从7.67%增至15.42%,增加了8.45%。随着各阶段进水基质浓度的提高,大颗粒污泥占比有所增加。这可能是由EPS的分泌及微生物群落结构变化而引起的。TANG[23]研究了外源添加信号分子对anammox颗粒污泥的影响,发现外源添加2 μmol·L−1的C6-HSL、C8-HSL使污泥的中位直径分别增加了8%、24%,从而促进了anammox污泥的颗粒化进程。该结果与本研究结果一致。R1中颗粒污泥的比例明显大于R2,故联合投加C6-HSL和C8-HSL可促进颗粒污泥的比例增加,从而加快了anammox污泥颗粒化进程。
-
本实验中EPS成分主要以PN为主,外源投加C6-HSL和C8-HSL可促进污泥EPS的分泌,特别是PN分泌,增加细胞表面的相对疏水性,可促进微生物的聚集生长。表3表明,随着进水TN逐渐增加,R1和R2的EPS质量浓度均逐渐增加。文献[24]指出EPS质量浓度的增加有利于anammox菌细胞间的互相粘附聚集及细胞交流进而促进颗粒污泥的形成,这与粒径分布的变化情况一致。PN为疏水性物质,PN/PS的提高可增强污泥的相对疏水性,从而触发污泥颗粒化的进程[25],使得微生物细胞更易于从水相中脱离出来并互相聚集[26]。
-
在每个阶段末取样检测AHLs的质量分数,启动期检测到4种AHLs信号分子,分别是C6-HSL、C8-HSL、C14-HSL、3-oxo-C14-HSL。图5表明,AHLs信号质量分数呈升高的趋势。R1中的C6-HSL在阶段Ⅰ末质量分数为248.90 ng·g−1。而在从阶段Ⅱ至阶段Ⅳ,C6-HSL质量分数分别为1 071.50、984.80、952.40 ng·g−1,虽稍有下降,但均比阶段Ⅰ增加近4倍,R1中的C8-HSL质量分数在阶段Ⅰ至阶段Ⅳ呈升高趋势。这说明通过联合投加C6-HSL和C8-HSL使水相中AHLs质量分数的增加达到QS系统的阈值,激活相关基因如编码AHLs合成酶[27]的基因LuxI的表达,进而释放出更多的AHLs。R2中C6-HSL质量分数在阶段Ⅰ至阶段Ⅳ分别为184.00、286.81、292.20、681.80 ng·g−1,其增加归因于内源C6-HSL合成并扩散到细胞外;R2中的C8-HSL质量分数始终保持在较低水平。AHLs从不同的方面影响anammox反应,如C6-HSL和C8-HSL会影响anammox反应的电子传输载体并促进EPS的分泌[23]。
C14-HSL和3-oxo-C14-HSL在R1和R2中均呈升高趋势,且R1中的质量分数高于R2,这说明外源投加的C6-HSL和C8-HSL可诱导其他信号分子在颗粒中持续内源性释放。
-
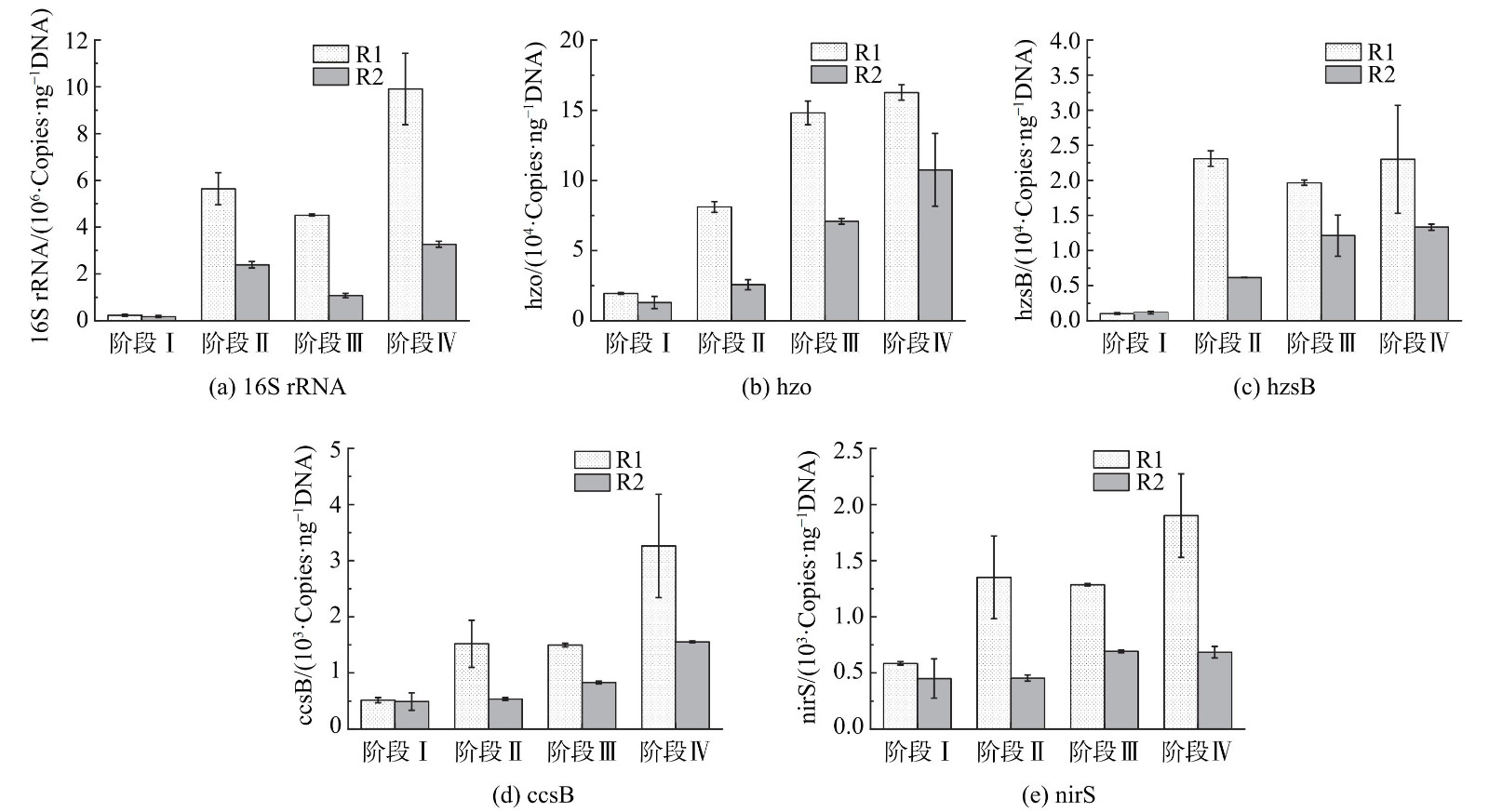
在不同的阶段末期取适量污泥提取DNA为待测样品进行qPCR反应,由标准曲线得各样品的16S rRNA、hzo、hzsB、ccsB、nirS基因拷贝数,如图6所示。16S rRNA基因的拷贝数均在106 copies·g−1数量级内,且R1中的基因拷贝数均高于R2。这表明R1中有更高的菌群丰度,更有利于脱氮性能的提高。投加信号分子后R1中hzo、nirS的基因拷贝数显著增加 (p<0.05) ,hzsB的基因拷贝数变化趋势不明显;R2中hzo、hzsB、nirS的基因拷贝数逐渐增加,但明显低于R1。R1和R2中的ccsB基因拷贝数均随着进水浓度的增加呈现逐渐增加的趋势,且R1高于R2。这说明联合投加C6-HSL和C8-HSL可促进anammox功能基因相对丰度的增加。
-
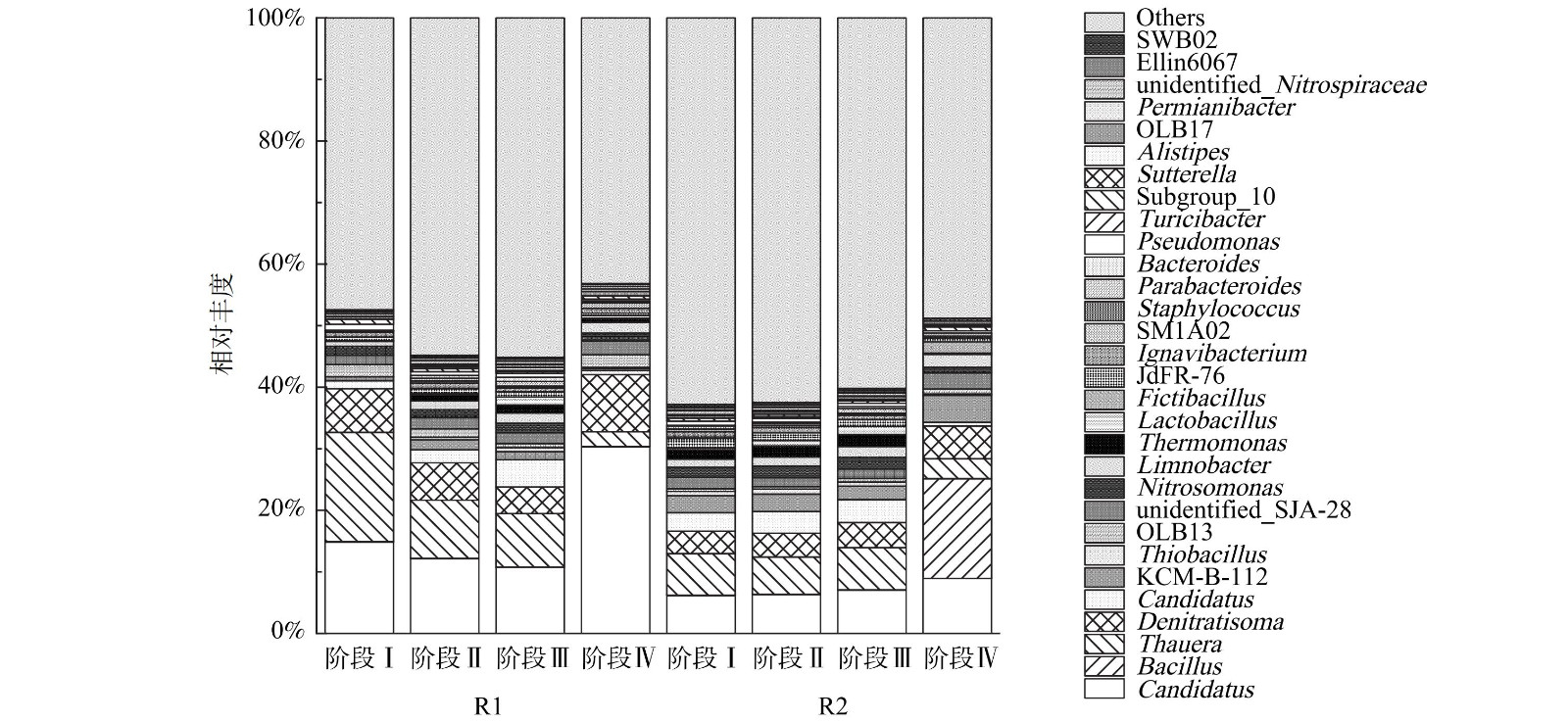
1) 门水平微生物物种。在不同阶段末取适量污泥提取DNA为待测样品进行高通量测序,结果如图7所示。在门水平上,浮霉菌门 (Planctomycetes) 、变形菌门 (Proteobacteria) 、厚壁菌门 (Firmicutes) 、拟杆菌门 (Bacteroidetes) 、绿弯菌门 (Chloroflexi) 是主要的菌群。Anammox菌属于浮霉菌门,R1和R2中浮霉菌门相对丰度均呈上升趋势,阶段Ⅰ至阶段Ⅲ的变化不明显,阶段Ⅳ,R1和R2中的浮霉菌门分别为36.01%和19.11%,较阶段Ⅰ分别增加了17.30%和5.28%,但R1中的浮霉菌门相对丰度高于R2。这说明逐步提高进水基质浓度和外源联合投加C6-HSL和C8-HSL均有利于Anammox菌的富集和生长。其他门类的细菌在系统中呈现下降的趋势,变形菌门在R1和R2中分别从36.25%、31.56%降至26.50%、28.76%;拟杆菌门在R1和R2中分别从11.75%、10.58%降至6.66%、5.61%。这可能是由于外源投加的信号分子促进作用,以及利于anammox菌生长的环境条件使得anammox菌具有更好的竞争优势。
2) 属水平微生物物种。Anammox菌属主要以Candidatus Brocadia为主,如图8所示,Candidatus Brocadia在R1中的相对丰度先降低后增加,在阶段Ⅰ至阶段Ⅳ的相对丰度分别为14.80%、9.75%、10.11%和30.30%。阶段Ⅱ至阶段Ⅳ,随着进水TN的增加,R1和R2中Candidatus Brocadia的丰度逐渐增加,该菌属逐渐富集。VAN DER STAR[28]发现高浓度含氮废水更适合Candidatus Brocadia生存,这与本研究的结果一致。Candidatus Jettenia是anammox菌属,在R1和R2中的相对丰度先增加后降低,这可能是因为阶段Ⅱ、Ⅲ中C6-HSL和C8-HSL质量分数增加有利于Candidatus Jettenia的富集;阶段Ⅳ,Candidatus Brocadia的丰度高,占据生长优势,而Candidatus Jettenia的竞争能力较弱,故丰度有所下降。
R1和R2中具有反硝化作用的菌群为反硝化菌 (Denitratisoma) 、陶厄氏菌属 (Thauera) 、硫杆菌属 (Thiobacillus) 、假单胞菌属 (Pseudomonas) ,总丰度分别从25.86%、11.90%降至12.19%、9.08%。R1和R2中具有硝化作用的菌群为亚硝化单胞菌属 (Nitrosomonas) 和假单胞菌属 (Pseudomonas) ,总丰度分别从2.42%、2.28%降至1.56%、1.27%。这说明体系的主反应向着anammox方向进行。
-
C6-HSL和C8-HSL的联合投加提高了氮的去除率。联合投加C6-HSL和C8-HSL促进污泥分泌EPS,诱导其他信号分子的内源释放,进一步促进污泥之间形成聚集体及颗粒化过程,增大了颗粒污泥占比,加快了anammox污泥的颗粒化进程。 R1中16S rRNA、hzo、hzsB、ccsB、nirS基因拷贝数均增加且Candidatus Brocadia菌属的丰度明显高于R2。投加C6-HSL和C8-HSL有利于功能基因相对丰度的提高及anammox菌属的生长和富集。




 下载:
下载: