-
厌氧氨氧化 (anaerobic ammonium oxidation,anammox) 是指厌氧或缺氧条件下,厌氧氨氧化菌 (anammox ammonium oxidation bacteria,AnAOB) 以亚硝态氮 (NO2−-N) 为电子受体,将氨氮 (NH4+-N) 氧化为氮气 (N2) 的生物过程[1-2]。传统生物脱氮工艺常用来去除生活污水中的氮元素,主要是通过好氧硝化和缺氧反硝化来实现。在好氧阶段,NH4+-N需要充足氧气以实现硝化,而缺氧阶段则需要足够有机碳源进行反硝化,从而使得氮元素的去除过程能耗非常高[3-4]。Anammox技术相较于传统生物脱氮工艺具有无需外加有机碳源、氮去除负荷高、运行费用低、剩余污泥产量低、无二次污染等优点[3, 5],将其应用于生活污水中污染物的去除是污水生物处理领域的研究热点。
目前,个别生活污水处理厂实现了AnAOB的富集和anammox脱氮。如在新加坡樟宜回用水厂anammox工艺的自养脱氮贡献率为37.5%[6];中国西安第四污水处理厂anammox工艺的脱氮贡献率约为15%[7]。然而,上述污水处理厂的主流工艺并不是anammox,因此,目前尚无一个真正意义上的anammox处理生活污水的工程实例。生活污水存在氨氮浓度较低、冬季水温低 (低于15 ℃,AnAOB活性急剧降低) 等问题[8],使得anammox在工程上存在一定的局限性。低氨氮浓度情况下亚硝酸盐氧化菌 (nitrite oxidizing bacteria,NOB) 的生长速率比氨氧化菌 (ammonium oxidation bacteria,AOB) 高,使得短程硝化过程很难稳定实现[9]。另外,AnAOB最佳生长温度为30~37 ℃,当温度超过45 ℃时AnAOB会出现不可逆失活,而当温度低于15 ℃时反应器内还会因积累大量NO2−-N导致反应器失稳[10-11]。因此,如何在低氨氮浓度下保证NH4+-N稳定转化为NO2−-N,以及在低温条件下 (尤其是冬季) 如何维持anammox工艺稳定运行是亟需解决的问题。
针对上述问题,本研究结合传统硝化反硝化系统的稳定性优势,将anammox与MBR工艺耦合,组成一种兼顾低能耗、高负荷的新型生物脱氮工艺 (AX-MBR) ,通过对生活污水进行连续处理分析温度对AX-MBR工艺的脱氮效果,并探究anammox脱氮贡献率和微生物群落结构变化,从而分析系统的脱氮机理,以期为工艺的工程应用提供参考。
-
本研究采用的AX-MBR装置如图1所示。整个反应器以有机玻璃为主,分为缺氧反应器、好氧反应器、膜组件3个部分。其中,膜组件放置于好氧反应器中。缺氧反应器的有效容积为4 L,长、宽、高为9 cm×9 cm×74 cm;好氧反应器有效容积为6 L,长、宽、高为18 cm×10 cm×50 cm。生活污水先在缺氧反应器中经过微生物处理,再经过好氧反应器中的微生物处理和膜组件过滤。缺氧反应器进水口设置有液位控制器并连接进水泵,用于控制进水。挂膜有AnAOB的聚氨酯填料放置于缺氧反应器,投加量为2 L。2个反应器间设有1台回流泵,膜组件出水通过时间控制器控制。其中,2#和4#为出水调节阀,1#和3#为反冲洗调节阀,用来调节出水和反冲洗时间,二者时间比为9:1。反应器采用黑布遮盖,避免光线对细菌的影响[12]。
-
本研究接种污泥主要来自桂林市雁山污水处理厂,并配以课题组自行培养且具有较好活性的AnAOB,通过方形的聚氨酯填料进行固着[13-14]。实验用水为桂林理工大学的校园生活污水[3]。此外,进水先经过制氮机吹脱降低污水中的溶解氧 (DO) ,以便后续调节、控制反应系统中的DO指标。实验分成3个阶段 (共248 d) 。在I阶段取适量污水厂好氧池内污泥投加入反应器,校园生活污水作为进水,进水TN为70.16~123.25 mg·L−1 ,NH4+-N为42.5~85.6 mg·L−1,COD为110.88~174.72 mg·L−1。在系统启动并稳定运行后,降低好氧反应器DO至0.5 mg·L−1,共运行14 d。在II阶段投加600 mL厌氧氨氧化污泥,并继续保持DO低于0.5 mg·L−1,其余运行条件不变,共计130 d。在III阶段,从第146天开始共运行102 d,主要考察温度对AX-MBR工艺的影响。3个阶段均未对反应器进行温度控制,实验期间的水温为5~35 ℃。水力停留时间 (HRT) 控制在4 h,回流比为1:2,DO小于0.5 mg·L−1,pH为7.45~7.55。
-
NH4+-N:纳氏试剂分光光度法;NO2−-N:N-(1-奈基)-乙二胺光度分光光度法;TN:碱性过硫酸钾消解紫外分光光度法;COD:重铬酸钾微波快速密闭消解法;pH/温度:北京天健在线监测DEC数字化pH计DPH10AC;DO:美国哈希便携式溶解氧仪[5, 15]。
-
取AX-MBR系统稳定运行后的污泥并进行预培养以消耗样本中残留的O2和NOx−。样品分为3个组,分别为E-0、E-A和E-D。E-0加15NH4+检验预培养过程是否耗尽O2和NOx−,并排除由纯化学反应生成N2的可能性;E-A组添加14NO3−和15NH4+检测污泥中anammox反应;E-D组添加15NO3−与样品本底的14NH4+发生anammox和反硝化反应,用于定量分析anammox的反应速率和脱氮贡献率。同位素示踪法具体步骤和计算方法参考文献[16]。
-
对实验不同阶段的污泥进行取样,委托生工生物工程 (上海) 有限公司进行高通量测序分析,以探究微生物多样性和优势菌种的变化,具体测序步骤参考文献[5]。进行3次采样共6个样品,分别取缺氧反应器和好氧反应器的污泥。第一次取样为AX-MBR工艺成功启动并稳定运行 (50 d),分别为Y1、H1;第二次取自III阶段(230 d),主要研究低温环境下群落结构的变化,记为Y2、H2;最后一次取样则是所有实验结束后(248 d),分别是H3、Y3。
-
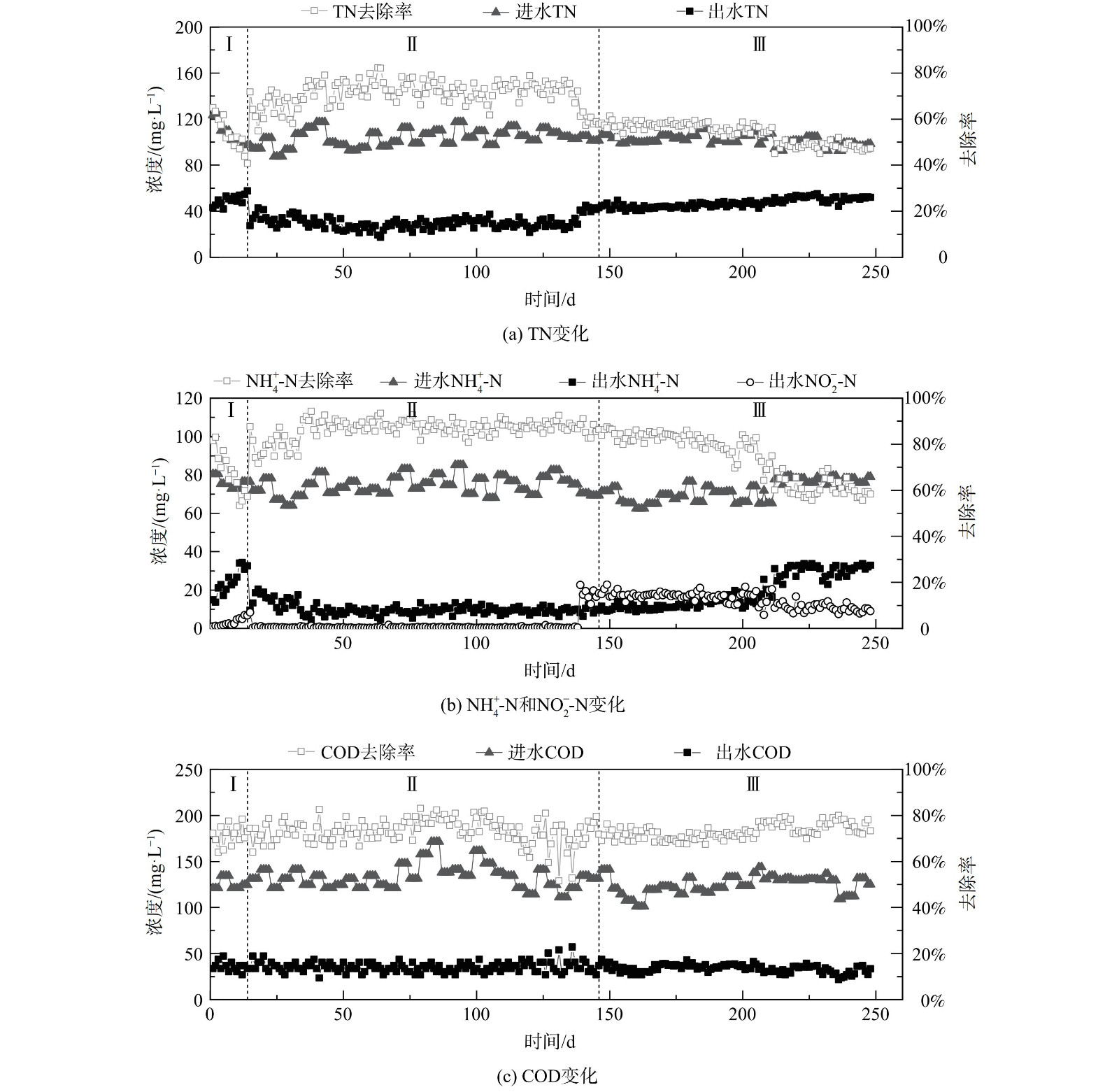
在AX-MBR工艺运行过程中各氮素质量浓度变化如图2所示。在I阶段通过减少曝气量控制反应器的DO,从0.89 mg·L−1逐渐降至0.5 mg·L−1以下。该阶段出水NH4+-N质量浓度增加,最高为34 mg·L−1,出水NO2−-N质量浓度并随之增加。该阶段的AOB对氧的半饱和系数大于NOB,NOB在低DO下竞争氧能力较弱,系统可能由短程硝化的原因产生NO2−-N的积累。第II阶段投加了AnAOB污泥后,NH4+-N去除率迅速增加,最后去除率稳定为约89%。这说明anammox作用具有高效脱氮的能力。第III阶段结果表明,随着运行天数的增加,温度降低会导致微生物活性降低,NH4+-N和TN去除率逐渐降低,NH4+-N去除率从最开始的84%将至58%,TN去除率也从67%将至47.28%。这说明温度对AX-MBR的脱氮效率具有较大影响。
在AX-MBR运行过程中,进水COD约为111~171.36 mg·L−1,出水COD约为21.77~50.4 mg·L−1,降低了58%~80%,可达到城镇污水处理厂污染物排放标准 (GB18918-2002) 的一级标准。从I阶段到III阶段,出水COD没有明显变化,在整个运行过程中保持稳定的处理效果。一方面,反应系统的微生物中存在着消耗有机物质的异养菌;另一方面,膜组件的有效过滤阻断作用也可保证出水COD的稳定性。
-
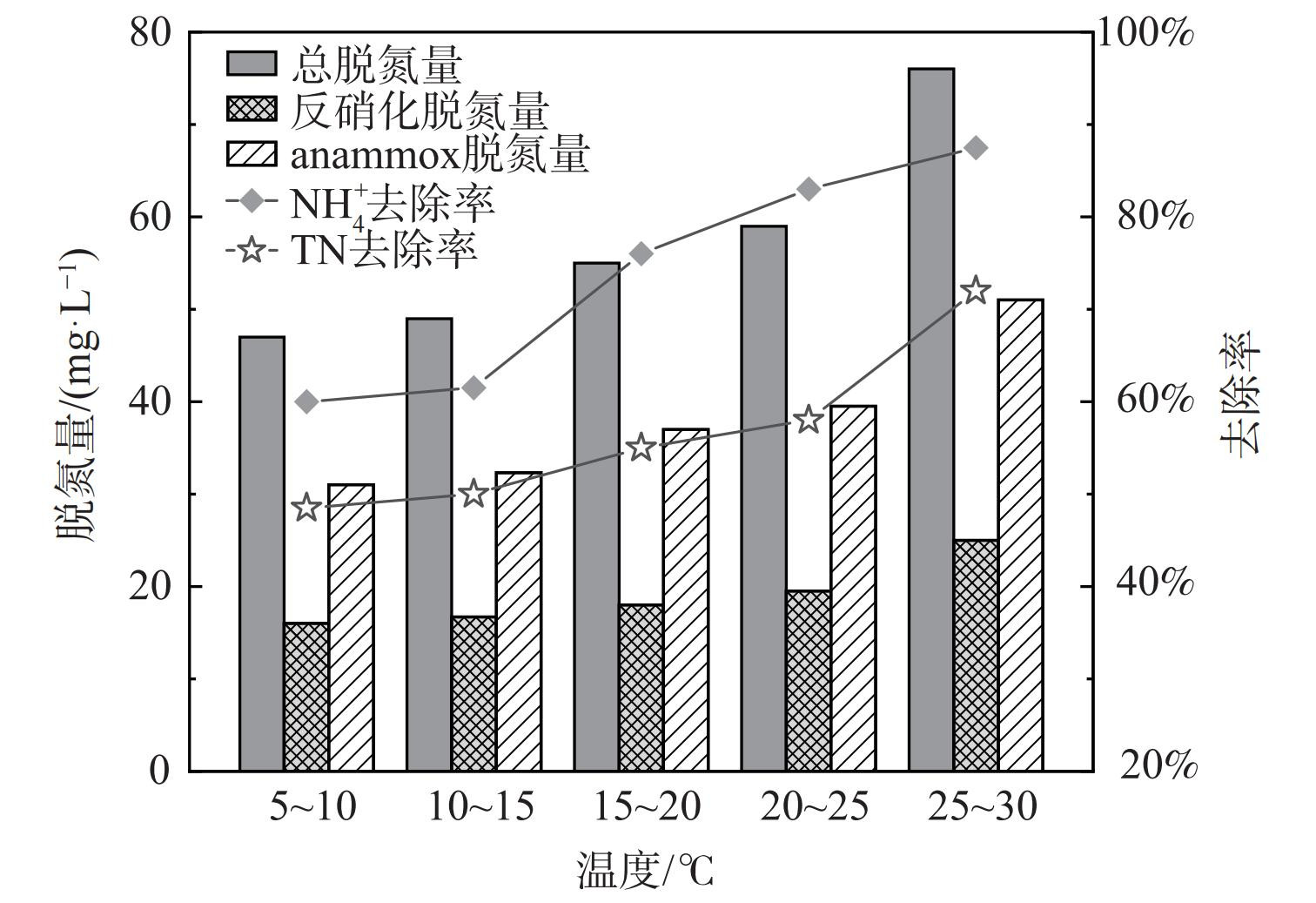
为考察温度变化对AX-MBR工艺脱氮性能的影响,将III阶段温度从低到高排列,以间隔5 ℃为一组,探究温度在5~35 ℃时的脱氮情况及厌氧氨氧化和反硝化的脱氮贡献量,结果如图3所示。NH4+-N的平均去除率随温度的增加逐渐由59%增至87%,TN去除率也从49%升至73%。当温度大于20 ℃时,NH4+-N去除率维持在较高水平,平均去除率达85%以上;当温度小于20 ℃时, NH4+-N和TN去除率都有所下降,此时温度降低开始影响微生物基础代谢的能力。这说明反硝化和厌氧氨氧化等脱氮反应速率受温度影响而降低。由于外回流会促进NH4+-N硝化产物NOx−-N在缺氧阶段被去除,而且反应器硝化液回流比为1∶2,理论上反硝化的最大脱氮贡献率为33.3%,因此可根据最大的反硝化脱氮贡献率和已知的总脱氮量推导出anammox的脱氮贡献量。当温度为25~30 ℃时,工艺总脱氮量为76.74 mg·L−1,anammox和反硝化作用的脱氮贡献量为51.42 mg·L−1 和25.32 mg·L−1。当温度为20~25 ℃时,工艺总脱氮量下降了17.12 mg·L−1,anammox和反硝化的脱氮量为39.95 mg·L−1和19.67 mg·L−1,当温度为15~20 ℃时,工艺总脱氮量再次降低3.14 mg·L−1。因此,随着温度的降低,微生物活性下降,脱氮量也逐渐降低,但整体上anammox的脱氮贡献率大于反硝化贡献率,anammox和反硝化作用二者同时保证AX-MBR工艺的高效脱氮性能。当温度在20~30 ℃范围内时,温度每下降1 ℃,anammox活性会降低约2.23%,而温度在15~20 ℃时每降低1 ℃,anammox活性下降1.05%。由于AnAOB和反硝化细菌的生存温度范围较广,但细菌的活性受温度影响较大,低温时活性降低,AnAOB和反硝化效率降低。AX-MBR工艺在低温环境运作时,可采用降低进水氮负荷的方法来保证处理效果,其他相关研究也表明可采用提高生物量和降低氮负荷等方式降低低温对AnAOB或其他菌活性的抑制作用[17-18]。
-
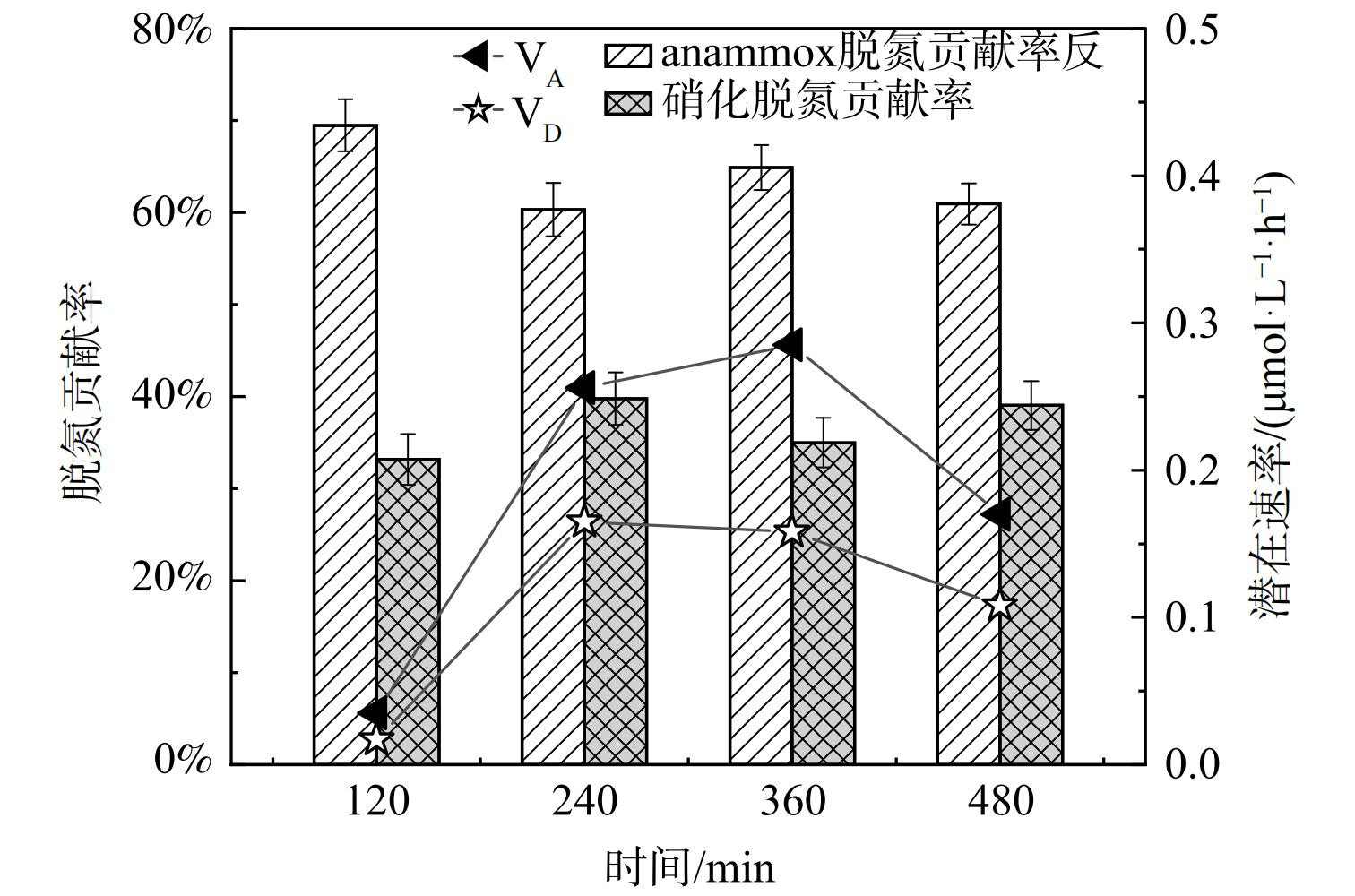
本研究通过15N同位素示踪法探究anammox和反硝化脱氮贡献率,验证上述AX-MBR稳定运行过程中各反应的脱氮贡献率。污泥取自稳定运行阶段的缺氧反应器。将污泥先进行离心,超纯水也经氦气吹脱20 min至厌氧状态,最后以1:5的泥水比例混匀,并分为E-0、E-A和E-D 3组。E-0组无29N2、30N2生成,这表明样品经预处理后NOx−消耗殆尽,E-A组29N2产量随时间变化明显积累且30N2无积累,因此该组只存在anammox反应。E-D组均有29N2和30N2积累,这说明该组同时发生anammox和反硝化反应。由于14NO3−的存在使得E-D组的反硝化反应产物包含有28N2、29N2和30N2,而anammox的产物只有28N2和29N2,进而通过30N2的量可以反推出反硝化所产生的N2总量,最后得出anammox的脱氮贡献率和潜在速率。由图4可知,AX-MBR工艺的anammox潜在速率为0.04~0.29 µmol·(L·h)−1,反硝化速率为0.02~0.17 µmol·(L·h)−1,厌氧氨氧化潜在速率较反硝化的速率高。不同反应时间可对应系统的HRT,当反应时间为2 h时,anammox脱氮贡献率为69.83%,并且为最大脱氮贡献率,但微生物反应不充分出水氮素质量浓度较高,不予采用。当反应4 h时,与实际运行HRT一致,此时anammox脱氮贡献率为60.11%。由于微生物作用的系统脱氮贡献率受HRT的影响,故反应进行6 h时的anammox脱氮贡献率增加为64.93%。较长的HRT会导致微生物颗粒污泥发生裂解,故当HRT大于6 h之后,会出现anammox脱氮贡献率下降的趋势。本研究为实验室规模小型反应器,其微生物组成与丰度受人为控制,anammox的脱氮贡献率始终大于反硝化反应,但这也进一步说明AX-MBR工艺中以anammox脱氮为主。
-
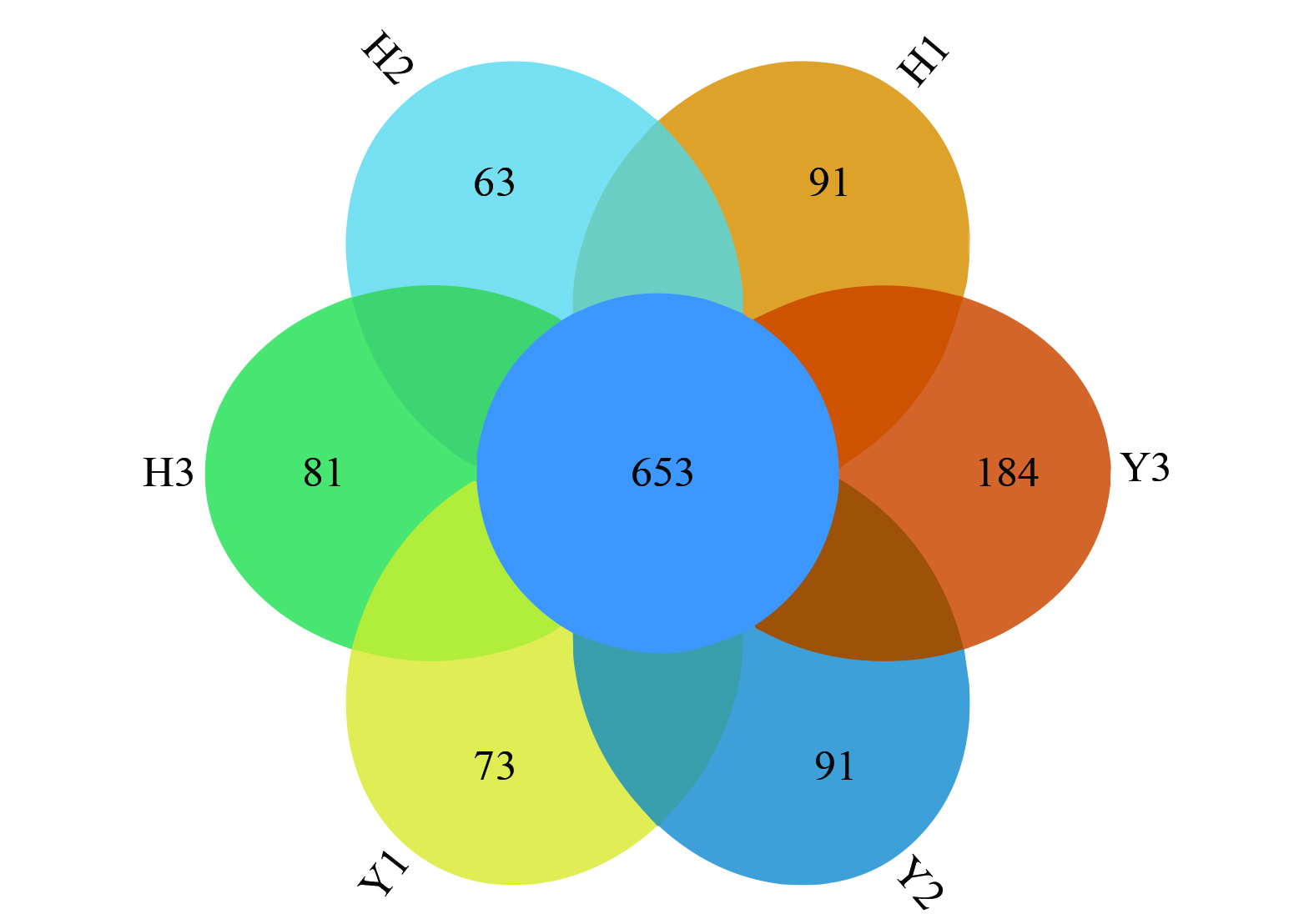
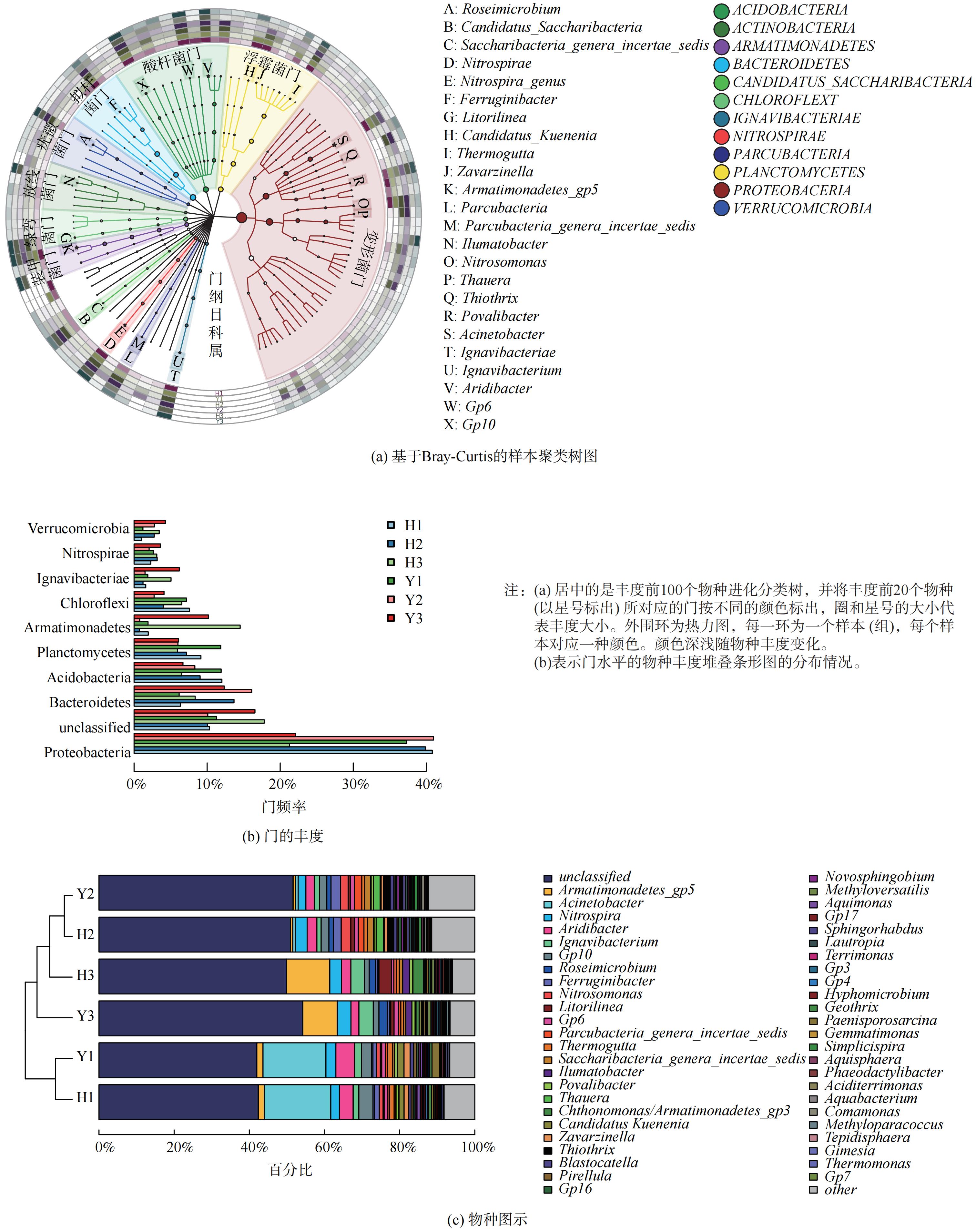
本研究采用16S rDNA高通量测序分析AX-MBR工艺中微生物群落结构及多样性的变化,从微生物的角度阐释其脱氮的机理。表1 通过不同多样性指数来评估微生物多样性特征,耦合系统中各样品的OUT数目变化情况见图5。结合图5和表1可知,系统的微生物为适应环境在不断的变化,群落多样性和丰度都在变化,但整体上工艺脱氮效果稳定,具有一定的耐冲击负荷的能力。其中,Y2、H2的特异OTU数目较Y1、H1有变化,主要因为低温环境中微生物优胜劣汰,但也唤醒了反应器内更多的低温菌。从3次样品的多样性指数来看,样品群落结构复杂、物种数目多、丰度较高。从Shannon指数、ACE指数和Chao1指数分析发现Y2、H2的指数值较Y1、H1高。这说明温度变化可能唤醒了工艺中的低温菌,原有优势菌种对温度耐受能力强,故群落多样性和丰度增加。综上所述,系统的微生物为适应环境在不断的变化,群落多样性和丰度都在变化,但整体上污水脱氮处理效果稳定,具有一定的耐冲击负荷的能力。
实时监测数据显示缺氧和好氧反应器的DO较低。因此,硝化作用及部分硝化驱动的anammox过程造成的氨氮损失是有限的。因此,短程反硝化可能是与anammox结合的主要途径,且导致缺氧和好氧反应器的氨氮损失可能是反硝化和anammox作用。AX-MBR中各样品的分类和系统发育信息可视化、门水平的物种丰度堆叠条形图、属水平的物种丰度柱状图见图6。Proteobacteria、Patescibacteria和Bacteroidetes门是絮状污泥中含量最多的3个门。这些门已被报道为负责氮和碳循环的典型门,并且已在以前的 PD/A 系统中广泛检测到[19]。在缺氧和好氧反应器污泥样品中,观察到Proteobacteria和Bacteroidetes、Acidobacteria为优势属。Bacteroidetes占比约40%,但 H3、Y3中Bacteroidetes有所下降。
图6 (c) 中AnAOB主要为Candidatus Kuenenia,相对丰度为1.7%。Armatimonadetes-gp5属于装甲菌门,与AnAOB菌属存在关联性[20]。由于AnAOB具有生长速率缓慢、低温抑制菌活性等原因,具有anammox的Candidatus Kuenenia菌属对环境温度敏感,其H1、Y1中Candidatus Kuenenia相对丰度较H1、Y1和H3、Y3样品相比最低,说明低温可能会促进NO2−-N积累,这与GAO等[21]的研究一致,即PD/A工艺在低温条件下能实现较好的脱氮效果。在属水平中,厌氧和缺氧反应器的反硝化细菌 (Aridibacter 、Pseudomonas、Paracoccus, Planctomicrobium、Bacillus和Thauera) 丰度远大于AOB丰度,其中AOB (Nitrosomonas) 丰度均小于NOB (Nitrospira) 丰度,故污水中亚硝酸盐主要来源于部分反硝化,这在群落水平上证明了PD/A的存在。
-
1) AX-MBR工艺可成功实现anammox工艺应用于处理低氨氮生活污水,工艺运行稳定,NH4+-N去除率可稳定在89%左右,COD去除率稳定在75%左右,出水可达到城镇污水处理厂污染物排放标准 (GB18918-2002) 的一级标准。
2) 随着季节温度变化,微生物活性下降导致氮元素去除效率逐渐降低,但anammox的脱氮贡献率始终大于反硝化贡献率,这说明anammox脱氮占据主体地位。AX-MBR工艺中anammox和反硝化作用二者同时保证了工艺的高效脱氮性能,这表明AX-MBR工艺可为anammox工艺的工程应用提供参考。
3) 反应器中微生物群落结构复杂,反硝化细菌丰度大于AOB丰度,且好氧反应器回流至缺氧反应器时给反硝化菌提供NO3−,故污水中NO2−主要来源于部分反硝化。这在群落水平上证明了PD/A的存在。
Anammox-MBR耦合工艺在生活污水中的脱氮性能及其机理
Nitrogen removal performance and mechanism of anammox-MBR coupling process in sewage treatment
-
摘要: 厌氧氨氧化工艺在处理生活污水过程中存在处理效率不稳定的问题,阻碍了其在生活污水处理中的工程应用。采用包括缺氧反应器、好氧反应器、膜组件3个部分的anammox-MBR (AX-MBR) 耦合工艺来处理生活污水,以期解决该问题。实验开始时,先投加污水处理厂好氧活性污泥进行启动,后降低反应系统的溶解氧,最后再投加厌氧氨氧化菌 (AnAOB) 。结果表明,投加AnAOB可有效提高AX-MBR的NH4+-N去除率,NH4+-N平均去除率由68%升至87%。实验过程中未对反应器进行温度控制,故在反应温度低于20 ℃时发现,AnAOB活性随着温度降低急剧下降。在低温环境运行时,可采用降低进水负荷的方式来保证处理效果。采用15N稳定同位素示踪法对AnAOB脱氮贡献率进行分析表明,AX-MBR氮元素的去除主要由AnAOB主导的途径完成,其脱氮贡献率可达65%。而16S高通量测序结果表明,缺氧反应器中的AnAOB主要为Candidatus Kuenenia,且缺氧反应器和好氧反应器的反硝化细菌丰度远大于氨氧化细菌丰度。这表明AX-MBR中NO2--N主要来源于部分反硝化,这在群落水平上证明了短程反硝化-厌氧氨氧化的存在。本研究结果可为厌氧氨氧化的工艺发展提供参考。
-
关键词:
- 厌氧氨氧化(anammox) /
- 生活污水 /
- MBR /
- 微生物多样性 /
- 脱氮机理
Abstract: Anaerobic ammonia oxidation (anammox) process has the problem of unstable treatment efficiency in treating domestic sewage, which seriously hinders its engineering application of sewage treatment. In view of the above problems, this paper proposed to use anammox-MBR (AX-MBR) coupling process to treat sewage, which included anoxic reactor, aerobic reactor and membrane module. During the startup of the experiment, the activated sludge of the sewage treatment plant was added, then the dissolved oxygen of the system was reduced, and the anaerobic ammonia oxidizing bacteria (AnAOB) was added. The results showed that the addition of AnAOB could effectively improve the NH4+-N removal rate of AX-MBR, and the average NH4+-N removal rate increased significantly from 68% to 87%. During the experiment, the temperature of the reactor was not controlled. The results indicated that the activity of AnAOB decreased sharply with decreasing temperature when the temperature was lower than 20 ℃. During the operation in low temperature environment, the way of reducing the influent load could be adopted to ensure the treatment rate. The research data of 15N stable isotope tracer method on the nitrogen removal contribution rate of anammox showed that the nitrogen removal of AX-MBR was mainly completed by the way dominated by anammox, and its nitrogen removal contribution rate could reach 65%. The 16S high throughput sequencing results showed that the AnAOB in the anoxic reactor was mainly Candidatus Kuenenia, and the abundance of denitrifying bacteria in the anoxic reactor and aerobic reactor was greater than that of ammonia-oxidizing bacteria, which indicated that the NO2--N in AX-MBR mainly formed from partial denitrification, which proved the existence of partial denitrification/anammox process.The results of this study can provide reference for the development of anammox process.-
Key words:
- anaerobic ammonia oxidation /
- domestic sewage /
- MBR /
- microbial diversity /
- removal mechanism
-
塑料给人们带来很多方便的同时,也给人们带来了困扰。由于产量大,耐受性强,回收率低等原因,塑料在环境中不断积累,在赤道、极地、峰顶和海底都能找到不同种类的塑料残体。在这些塑料残体中,尺寸小于5 mm的塑料被定义为微塑料,由于其特有的理化性质和毒性效应而受到广泛关注[1-3]。目前,微塑料包括初级微塑料和次级微塑料。顾名思义,初级微塑料就是尺寸小于5 mm塑料颗粒的直接应用和排放,例如洗面奶中去角质的颗粒物主要成分就是微塑料[4];次级微塑料来源于大尺寸塑料残体的光解、热解、水解以及生物降解等[5-8]。
微塑料一旦被摄取,会引起摄食活性,存活率和繁殖率的降低等毒性效应,并常伴有炎症反应[9-11]。此外,微塑料还可以随循环系统在生物体内迁移,进入不同的组织和器官,从而在生物体内富集[2]。常常除了自身的毒性,微塑料可以通过吸附作用作为有机和无机污染物传输载体,如多氯联苯、多环芳烃、多溴联苯醚和有机氯农药等[12-16]。Bakir等模拟了肠道系统内污染物的吸附/解吸行为,发现在模拟肠道内污染物从微塑料上的解吸速率是海水中的30倍[17]。一旦被摄取,就像“特洛伊木马”一样将所携带污染物快速解吸,从而提高污染物的毒性和生物可利用性,进一步增加了微塑料的潜在风险。除了不断吸附外源污染物之外,塑料本身会根据特定的用途引入不同的化学添加剂,这些添加剂会随着塑料的老化渗滤到环境中,引起雌激素效应和内分泌干扰效应[16]。
光化学降解是塑料在环境中老化和降解的主要途径。暴露于空气中,经太阳光或紫外光照射,微塑料可以生成含氧基团,如羰基和羟基。未经老化的微塑料往往对疏水性有机物具有很好的吸附性能,随着老化程度的加深,含氧官能团的增加,对亲水性有机污染物的吸附显著增加。Liu等研究了老化前后聚氯乙烯微塑料对抗生素环丙沙星的吸附,发现老化后PVC微塑料结构中的含氧官能团可以与环丙沙星分子之间形成氢键作用,使得环丙沙星的吸附量显著提高[18]。因此,光解老化可以显著改变微塑料的环境行为,从而产生新的环境效应。然而,目前有关微塑料环境转化的研究还很有限。因此,有关不同性质微塑料光解老化过程亟待研究。
本研究以常用塑料制品为研究对象,经机械破碎得到相应的微塑料,于空气中进行太阳光照暴露,研究它们的红外光谱变化情况,并与标准谱图对比,确定塑料种类,以及自然光解老化对塑料结构的影响,从而为分析其潜在的环境行为提供理论指导。
1. 材料和方法(Materials and methods)
1.1 微塑料制备
收集生活与实验室中常见的塑料制品(如图1),包括塑料袋、饮料瓶、外卖盒、离心管、枪头和注射器(注射器筒与注射器推杆)。将各种塑料制品经液氮冷冻处理后用研磨粉碎机(A11 basic Analytical mil,IKA,Germany)机械破碎,得到相应的粉末状微塑料样品,装瓶待用。
1.2 光照暴露实验
将制备好的微塑料进行太阳光光照暴露,暴露地点为江苏省南京市栖霞区南京大学仙林校区环境学院(北纬N32°07′10.16″,东经E118°56′52.71″),样品倾斜角度为30°,以便于更充分接触光照。暴露时间为2019年1月1日—2019年12月31日,共计365 d,天气信息见网址http://www.tianqihoubao.com/lishi/nanjing/month/201901.html。分别使用光强仪(CEL-NP2000-10, Ceaulight Inc., Beijing, China)和温度计测定了9:00、12:00和15:00光照强度和温度。光照强度(365 nm)为0.1—2.8 mW·cm−2(平均(1.2±0.6) mW cm−2),温度为−3—38 ℃(平均(22±9) ℃)。
1.3 微塑料表征
本研究采用衰减全反射-傅里叶变换红外光谱(ATR-FTIR)(Tensor 27,Bruker,Germany)分析光照前后微塑料的种类以及红外光谱变化情况,分辨率为4 cm−1,扫描次数为32,采集范围600—4000 cm−1。为分析微塑料在光照前后表面形貌变化,场发射扫描电子显微镜(SEM,FEG Quanta 250,FEI Co.,Netherland)被用来采集微塑料的SEM图片,操作电压为10 kV。Brunauer-Emmett-Teller(BET)分析仪(Micrometrics ASAP2020)和测角仪(Rame-Hart 250, Succasumna, NJ, USA)分别用于测定微塑料老化前后的BET比表面积和接触角。
2. 结果和讨论(Results and discussion)
2.1 塑料样品种类分析
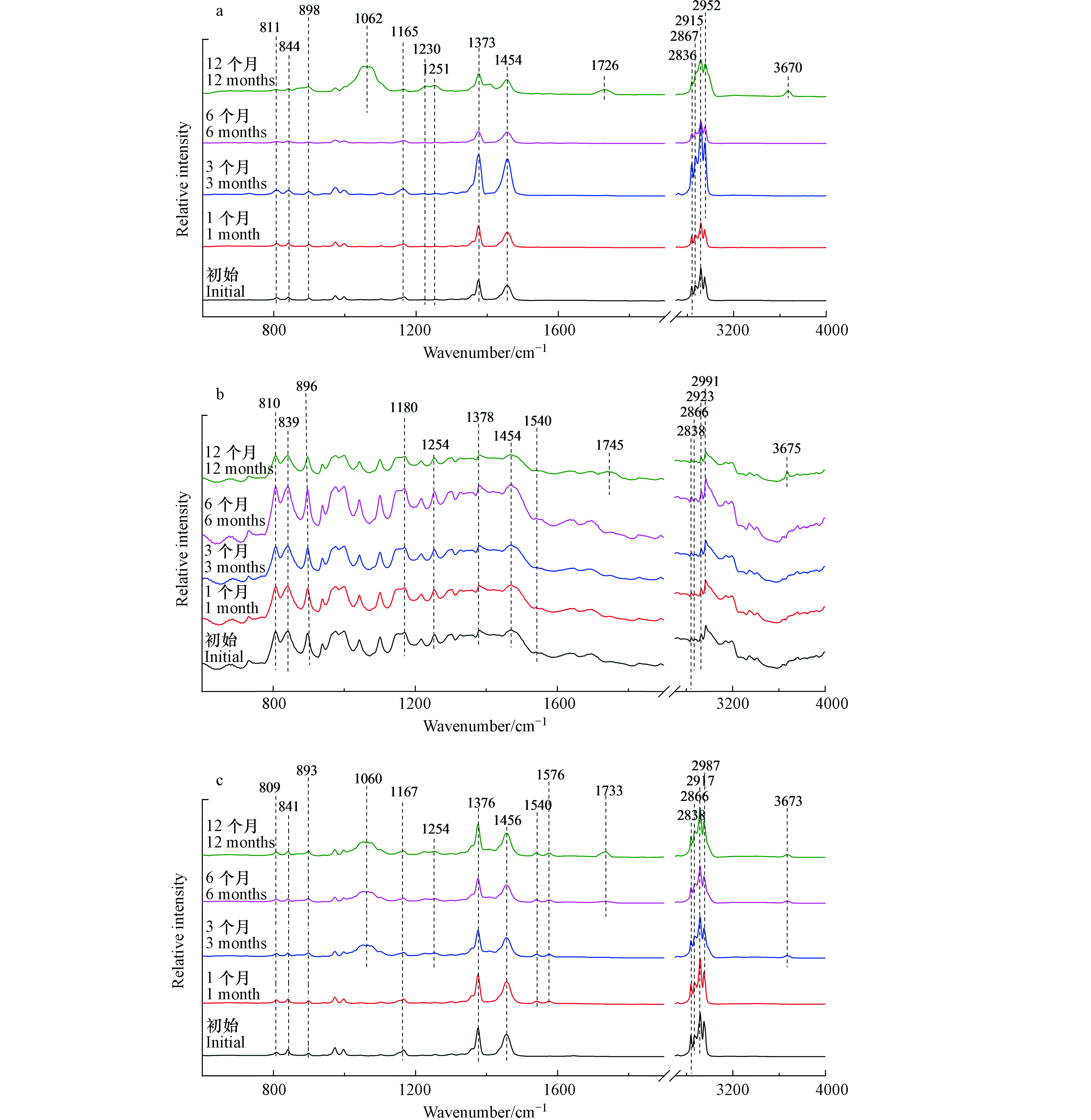
测量7种常见塑料样品的红外光谱图,并与红外光谱仪自带数据库中的标准红外谱结果以及文献进行匹配和比较,分析其主要成分。红外结果表明,塑料袋和注射器推杆属于PE塑料,外卖盒、离心管、枪头和注射器筒属于PP塑料,饮料瓶属于PET塑料。
2.2 微塑料红外光谱分析
2.2.1 PE类常见塑料
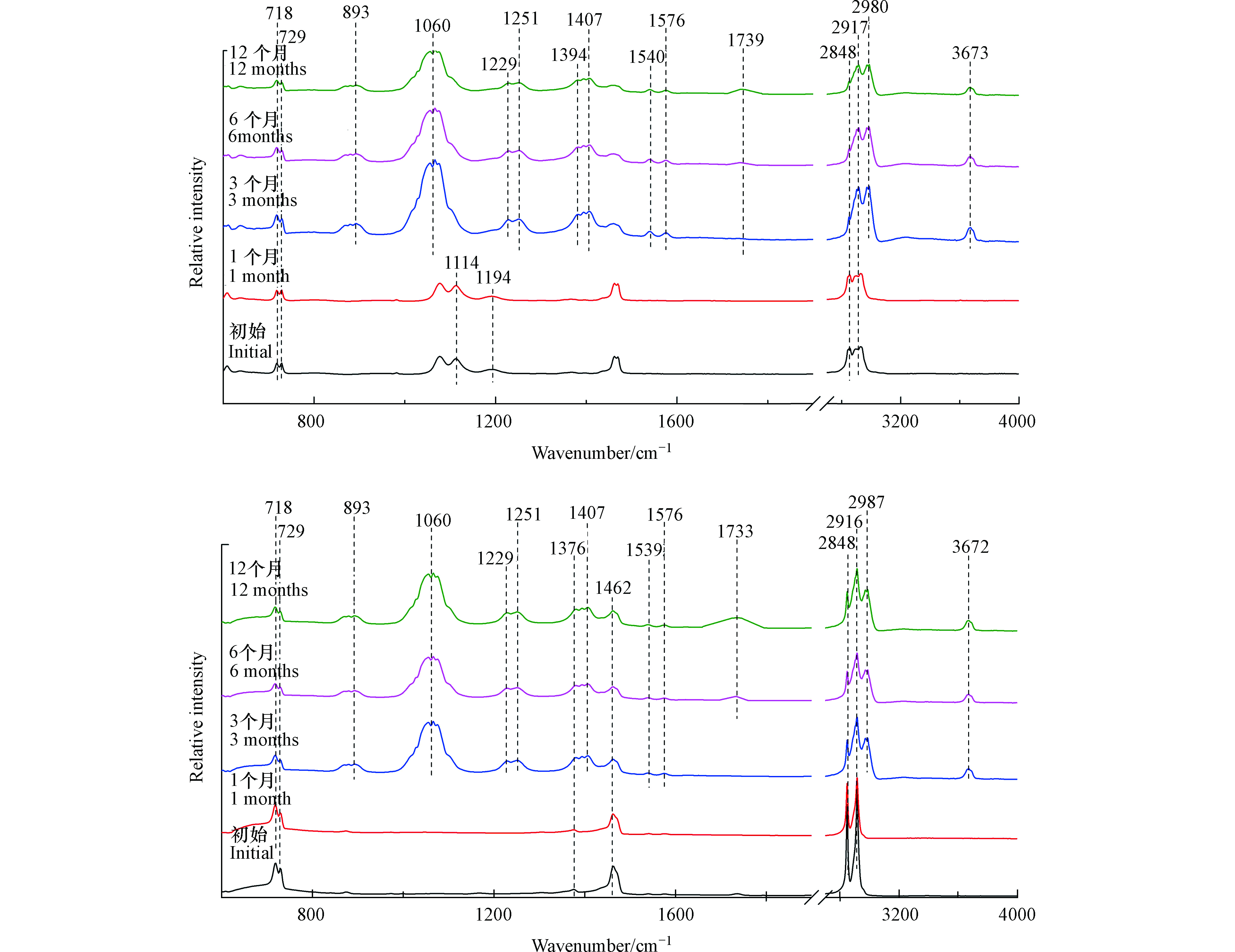
如图2(a)所示,塑料袋样品在光照1个月后,其红外光谱图没有发生显著变化。
然而,在光照3个月后,出现了新的红外吸收峰。3673 cm−1处的红外吸收峰表示O—H伸缩振动,2987 cm−1与2972 cm−1处的红外吸收峰表示甲基C—H伸缩振动,1576 cm−1与1540 cm−1处的红外吸收峰对应芳烃的C=C伸缩振动,1407 cm−1处的红外吸收峰表示O—H弯曲振动,893、1056、1066、1229、1251 cm−1处的红外吸收峰表示C—O伸缩振动[19]。所以塑料袋在光照3个月后可能生成了羟基与苯环。此外,光照3个月后,1194 cm−1与1114 cm−1处的红外吸收峰逐渐减弱,这两个峰代表醚键C—O—C的伸缩振动[20],这说明在光照导致塑料袋微塑料表面醚键的断裂。如图2(b)所示,注射器推杆微塑料三阶段变化与塑料袋微塑料相似。由于添加剂成分的不同,未检测到醚键C—O—C红外特征吸收峰。
2.2.2 PP类常见塑料
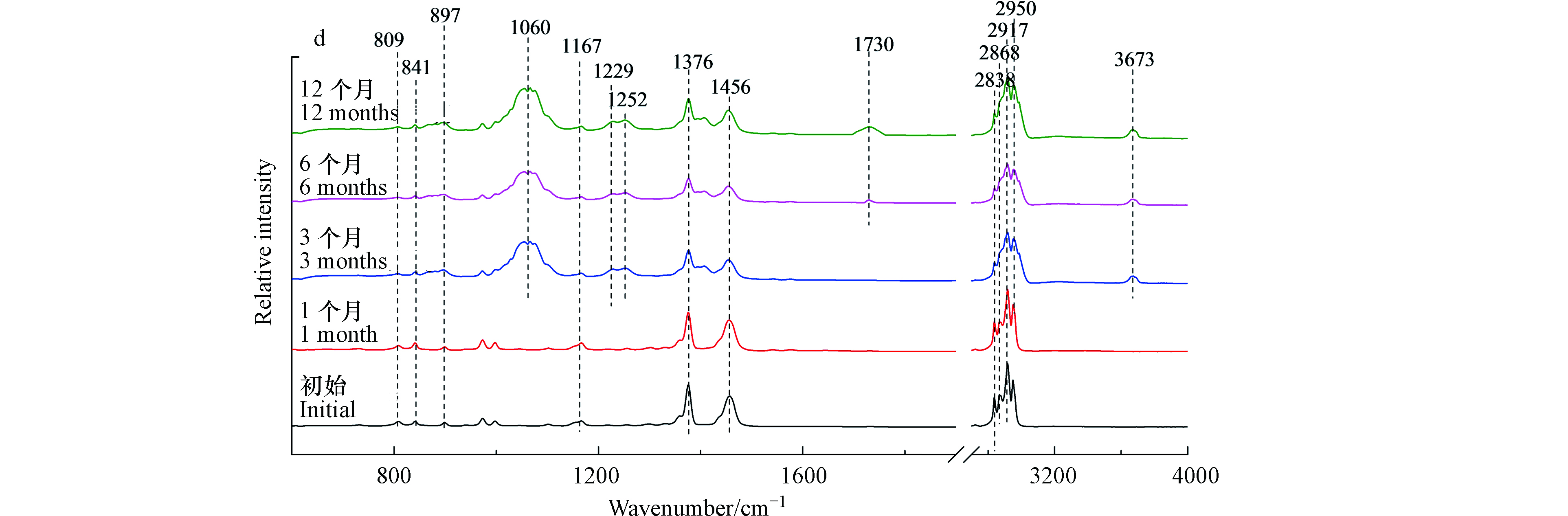
外卖盒红外光谱如图3(a)所示,暴露前6个月,外卖盒的红外光谱没有发现显著变化。然而,在光照12个月后,出现一些新的红外吸收峰。1062 cm−1和1251 cm−1处的红外吸收峰表示C—O伸缩振动[19]。1726 cm−1和3670 cm−1处的红外吸收峰分别表示光老化过程中产生的碳基(—C=O)和羟基(O—H)的伸缩振动[21]。对于注射器筒来说,光照12个月后,其红外光谱出现的—C=O(1745 cm−1)和O—H(3675 cm−1)红外特征峰是其光老化过程中的主要变化(图3(b))。
图3(c)与图3(d)分别为枪头与离心管的红外光谱。光照3个月后,红外光谱发生显著变化。在1060、1254、1540/1576 cm−1出现新的吸收峰,分别对应C—O伸缩振动和芳烃的C=C伸缩振动[19]。当光照6个月以后,在1733 cm−1和3673 cm−1出现新的吸收峰,分别对应—C=O伸缩振动和O—H的伸缩振动[21]。离心管微塑料也有类似的结果,光照3个月后出现C—O和芳烃的C=C结构,6个月后出现羰基和羟基官能团。
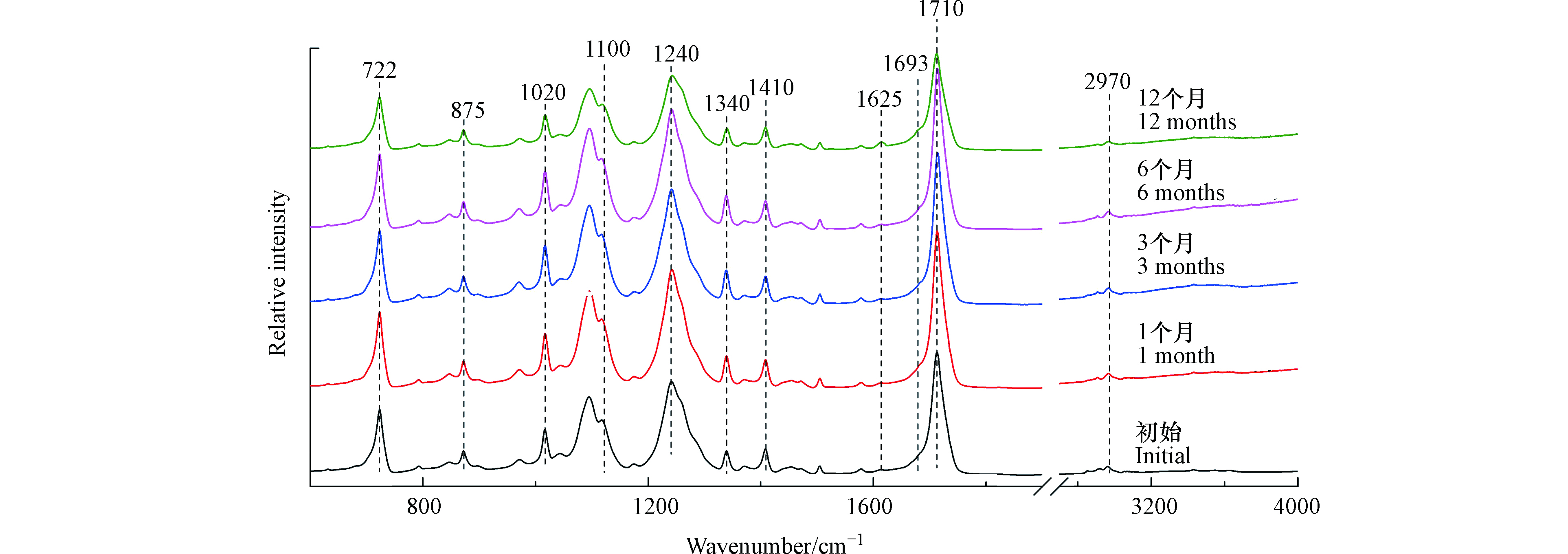
2.2.3 PET类常见塑料
如图4所示,1100、1240、1710、2970 cm−1分别代表PET结构中亚甲基伸缩振动、酯基伸缩振动、羰基伸缩振动和C—H伸缩振动[22]。饮料瓶在光照12个月后,其红外光谱图没有出现新的红外吸收峰,但是在1625 cm−1和1693 cm−1处的红外吸收峰显著增强,这两个红外吸收峰分别代表脂肪链上C=C的伸缩振动和羧基的伸缩振动[22]。因此,PET微塑料在光照12个月后,会产生C=C双键和羧基。
2.3 微塑料老化前后表面形貌和性质分析
测定了SEM照片来表征微塑料自然光解老化前后的表面形貌,如图5所示。塑料袋和注射器推杆微塑料在自然光照处理后,表面出现明显的龟裂。然后对于其他类型的微塑料,在光照12个月之后,微塑料的表面形貌没有发生显著变化。因此,PE材质的微塑料更容易发生光解老化,进而发生破碎分解现象,这与红外光谱的结果一致。此外,分别测定了微塑料老化前后的BET比表面积和接触角。如图6所示,自然光解后,微塑料的水滴接触角显著降低,表明微塑料在光照老化之后亲水性增强。自然光解老化后,微塑料BET比表面积增加,尤其塑料袋和注射器推杆微塑料(表1),这是由于光照后微塑料表面龟裂,微孔增加,这与微塑料的SEM结果一致。
 图 5 微塑料老化前后的扫描电镜图。Figure 5. SEM images of microplastics before and after aging treatment.(a)-(g)分别代表塑料袋、饮料瓶、外卖盒、离心管、枪头、注射器筒和注射器推杆。(a)-(g) represent the SEM images of microplastics derived from plastic bag, drink bottle, take-out box, centrifuge tube, tip, syringe barrel and injector handspike, respectively.
图 5 微塑料老化前后的扫描电镜图。Figure 5. SEM images of microplastics before and after aging treatment.(a)-(g)分别代表塑料袋、饮料瓶、外卖盒、离心管、枪头、注射器筒和注射器推杆。(a)-(g) represent the SEM images of microplastics derived from plastic bag, drink bottle, take-out box, centrifuge tube, tip, syringe barrel and injector handspike, respectively. 图 6 微塑料老化前后的水接触角数码图片。Figure 6. Digital droplet images of microplastics before and after aging treatment.(a)-(g)分别代表塑料袋、饮料瓶、外卖盒、离心管、枪头、注射器筒和注射器推杆。(a)-(g) represent the digital images of microplastics derived from plastic bag, drink bottle, take-out box, centrifuge tube, tip, syringe barrel and injector handspike, respectively.表 1 微塑料老化前后的比表面积。Table 1. BET specific surface areas of microplastics before and after aging treatment.
图 6 微塑料老化前后的水接触角数码图片。Figure 6. Digital droplet images of microplastics before and after aging treatment.(a)-(g)分别代表塑料袋、饮料瓶、外卖盒、离心管、枪头、注射器筒和注射器推杆。(a)-(g) represent the digital images of microplastics derived from plastic bag, drink bottle, take-out box, centrifuge tube, tip, syringe barrel and injector handspike, respectively.表 1 微塑料老化前后的比表面积。Table 1. BET specific surface areas of microplastics before and after aging treatment.BET比表面积/(m2 g−1) 光照前Before photo-irradiation 光照后After photo-irradiation 塑料袋Plastic bag 0.12 0.23 饮料瓶drink bottle 0.15 0.17 外卖盒Take-out box 0.23 0.26 离心管Centrifuge tube 0.31 0.33 枪头Tip 0.54 0.55 注射器筒Syringe barrel 0.32 0.34 注射器推杆Injector handspike 0.27 0.37 3. 结论(Conclusion)
通过测定7种生活与实验室常见塑料产品不同光照时间的红外光谱和表面形貌性质,得到以下结论:(1)PE类微塑料在光照暴露3个月后,有对应羟基、甲基与苯环C=C伸缩振动的红外吸收峰出现,同时对应醚键的红外吸收峰消失。所以PE类微塑料在自然光照条件下不稳定,结构极易产生变化;(2)PP类微塑料外卖盒和注射器筒的稳定性要强于枪头和离心管;(3)PET类微塑料在光照6个月没有显著变化,在光照12个月后会产生C=C双键和羧基;(4)除PET以外,微塑料在自然光照12个月以后,都会产生羰基和羟基等亲水性官能团,接触角减小,亲水性增强;(5)微塑料光解老化后,表面出现龟裂,并伴随比表面积的增加。微塑料的自然老化将会对其理化性质和环境行为产生影响。
-
表 1 样本的多样性指数统计表
Table 1. Statistical Table of Sample Diversity Index
样本 Shannon指数 ACE指数 Chao1指数 盖度 Simpson指数 H1 5.36 2930.14 2860.94 0.99 0.04 Y1 5.39 2699.78 2644.48 0.98 0.03 H2 6.00 3109.33 3102.02 0.99 6.3e-03 Y2 6.00 3026.31 2928.73 0.99 6.4e-03 H3 5.28 2678.70 2597.72 0.99 0.02 Y3 5.32 2899.24 2815.25 0.99 0.02 -
[1] LIU X N, JIN Y, ZHANG W J, Effect of nitrite concentration on the growth and microbial diversity of anaerobic ammonia oxidation (anammox) sludge[J]. Desalination and Water Treatment, 2020, 179: 54-62. [2] MA B, WANG S Y, CAO S B, et al. Biological nitrogen removal from sewage via anammox: Recent advances[J]. Bioresource Technology, 2016, 200: 981-990. [3] WEI Y, JIN Y, ZHANG W. Domestic sewage treatment using a one-stage anammox process[J]. International Journal of Environmental Research and Public Health, 2020, 17: 796-805 . [4] ZHANG M, WANG S, JI B, LIU Y. Towards mainstream deammonification of municipal wastewater: Partial nitrification-anammox versus partial denitrification-anammox[J]. Science of the Total Environment, 692 (2019) 393-401. [5] YU D, ZHANG W. Integration of ANAMMOX into the MBR process for main stream sewage treatment[J]. Journal of Water Supply:Research and Technology-Aqua, 2021, 71: 193-210. [6] 沈明玉, 吴莉娜, 李志, 等. 厌氧氨氧化在废水处理中的研究及应用进展[J]. 中国给水排水, 2019, 35: 16-21. doi: 10.19853/j.zgjsps.1000-4602.2019.06.003 [7] 王胤, 吴嘉利, 陈一, 等. 主流厌氧氨氧化工艺的研究与应用进展[J]. 净水技术, 2021, 40: 16-27. doi: 10.15890/j.cnki.jsjs.2021.11.003 [8] HENDRICKX T L G, WANG Y, KAMPMAN C, et al. Autotrophic nitrogen removal from low strength waste water at low temperature[J]. Water Research, 2012, 46: 2187-2193. [9] LEE D S, CHE O J, PARK J M. Biological nitrogen removal with enhanced phosphate uptake in a sequencing batch reactor using single sludge system[J]. Water Research, 2001, 35(16): 3968-3976. doi: 10.1016/S0043-1354(01)00132-4 [10] GUO Q, XING B S, LI P, et al. Anaerobic ammonium oxidation (anammox) under realistic seasonal temperature variations: Characteristics of biogranules and process performance[J]. Bioresource Technology, 2015, 192: 765-773. [11] LAURENI M, WEISSBRODT D G, SZIVÁK I, et al. Activity and growth of anammox biomass on aerobically pre-treated municipal wastewater[J]. Water Research, 2015, 80: 325-336. [12] JETTEN M S M, CIRPUS I, KARTAL B, et al. 1994-2004: 10 years of research on the anaerobic oxidation of ammonium[J]. Biochemical Society Transactions, 2005, 33: 119-123. [13] ZHANG W J, ZHANG Y Y, LI L, et al. Fast start-up of expanded granular sludge bed (EGSB) reactor using stored Anammox sludge[J]. Water Science and Technology, 2014, 69: 1469-1474. [14] ZHANG W J, ZHANG. Y Y, LI L, et al[J]. Fast start-up of expanded granular sludge bed (EGSB) reactor using stored Anammox sludge[J]. Water Science and Technology, 2014, 69: 1469-1474. [15] WANG H, Han J, ZHANG W. Effects of NH4+-N and NO2−-N on carbon fixation in an anaerobic ammonium oxidation reactor[J]. Journal of Environmental Management, 2019, 241: 450-457. [16] SUN R L, ZHANG W J. Addition of anaerobic ammonium oxidation bacteria to lower running cost during the membrane bioreactor process treating sewage[J]. Water Science and Technology, 2022, 85: 166-173. [17] WANG Y Y, XIE H C, WANG D L, et al. Insight into the response of anammox granule rheological intensity and size evolution to decreasing temperature and influent substrate concentration[J]. Water Research, 2019, 162: 258-268. [18] LI M C, SONG Y, SHEN W, et al. The performance of an anaerobic ammonium oxidation upflow anaerobic sludge blanket reactor during natural periodic temperature variations[J]. Bioresource Technology, 2019, 293: 122039. [19] DU R, PENG Y, JI J, et al. Partial denitrification providing nitrite: Opportunities of extending application for anammox[J]. Environment International, 2019, 131: 105001. [20] ZHAO Y P, LIU S F, JIANG B, et al. Genome-centered metagenomics analysis reveals the symbiotic organisms possessing ability to cross-feed with anammox bacteria in anammox consortia[J]. Environmental Science & Technology, 2018, 52: 11285-11296. [21] GAO R, PENG Y, LI J, et al. Improving performance and efficiency of partial anammox by coupling partial nitrification and partial denitrification (PN/A-PD/A) to treat municipal sewage in a step-feed reactor[J]. Bioresource Technology, 2021, 341: 125804. -





 下载:
下载: