-
重金属是指相对密度大于4.5 g·cm−3的金属,其对环境的污染主要来自化石燃料的燃烧、城市垃圾、污水灌溉、农药化肥的施用、矿山开采、金属冶炼等[1-2]。《全国土壤污染状况调查公报》表明,我国土壤环境质量状况不容乐观,土壤重金属污染突出[3]。其中,镉、汞、砷、铜、铅、铬、锌、镍的点位超标率分别为7%、1.6%、2.7%、2.1%、1.5%、1.1%、0.9%、4.8%。土壤重金属含量超标势必会影响粮食安全[4],威胁经济的可持续发展。重金属毒性高、具有不可降解性[5],会沿食物链传递并最后进入人体,威胁人群健康[6]。因此,迫切需要具有成本效益、高效、环保的重金属污染土壤治理方法。
生物炭 (Biochar, BC) 是含碳生物质在相对低温、有限氧或无氧环境下热解产生的材料[7],具有比表面积大、含氧官能团丰富、孔隙结构发达、导电性良好等特点[8-9]。作为一种土壤改良剂[10],生物炭既能改善土壤性质,影响土壤微生物的丰度和活性[11-12],又能降低包括重金属在内的多种污染物的生物有效性,近年来常用于治理土壤中的有机和无机污染物[13-16]。随着研究的深入,生物炭的一些弊端逐渐显现。如生物炭对重金属的吸附效率比活性炭低[17],表面官能团种类少、粒径大、力学性能较差等限制了其实际应用[18-19],对于一些阴离子污染物 (如砷等) 的固定达不到预期效果[20-21]。因此,一些学者通过表面改性来优化生物炭的性能,提高钝化重金属效果。
由铁基化合物或混合物和生物炭制备的铁改性生物炭,在重金属污染治理上受到了国内外学者的广泛关注[22-26],比表面积大、机械性能强、能提供铁离子、官能团丰富等优点使得其对重金属表现出优异的吸附和固定能力[27-31]。生物炭可有效地降低纳米铁颗粒的团聚性和对土壤微生态的毒性[32-33],同时具备组分材料的优异特性,在重金属的固定化方面发挥出了两者的协同性能。本文综述铁改性生物炭的制备方法,以及该材料对重金属污染土壤修复的研究进展,并梳理制备及修复过程中的主要影响因素,从而阐明铁改性生物炭对重金属的固定化机制,分析施用铁改性生物炭对土壤微生态的影响,以期为铁改性生物炭在重金属污染土壤修复中的应用提供参考。
-
1) 液相还原法。液相还原法是指利用还原剂还原溶液中的铁离子进而负载到生物炭上的方法[34-35]。QIAN等[36]先限氧热解稻草,再用盐酸酸化制备生物炭,然后在50 mL蒸馏水加入1.0 g FeSO4·7H2O和0.2 g生物炭,25 ℃下振荡24 h后转至三颈烧瓶中,N2吹扫1 h,并持续进行剧烈搅拌,以排除溶解氧,然后以5 mL·min−1的滴速将100 mL KBH4 (0.5 mol·L−1) 滴加至溶液中。反应完全后,用磁铁将样品从液相中分离、乙醇洗涤,最后真空干燥得到铁改性生物炭。SU等[37]也通过液相还原法制备了nZVI与BC理论质量比为1:1的零价铁改性生物炭。该法合成的零价铁改性生物炭在修复过程中避免了铁的过度释放。液相还原法在实验室里被广泛采用。该法制备的纳米铁颗粒粒径小、活性高,能在生物炭表面均匀分布[38],但成本高、还原剂毒性大、二次污染严重,不适合大规模生产。
2) 炭热还原法。一步炭热还原法利用生物质作为还原剂和铁盐的载体,在石墨化组分、热解产生的还原性气体等作用下,将铁盐进行原位还原[39]。LIU等[29]采用一步炭热还原法,在稻壳生物炭上原位生成了nZVI颗粒,研究表明即使在氧化条件下,该法合成的铁改性生物炭对重金属污染土壤也具有良好的修复性能。首先将5 g稻壳与50 mL的Fe2(SO4)3溶液 (217.38 g·L−1) 混合,200 r·min−1振荡2.5 h后真空抽滤并洗涤,以除去多余的铁盐。将所得混合物在105 ℃下干燥12 h,整个过程通氮气作为保护气体,然后以5 ℃·min−1的速率升温到600、800和1 000 ℃后热解30 min。SEM和XRD表征显示通过该方法生成了平均尺寸约为100 nm、形状良好的零价铁粒子。炭热还原法是简单、经济的一步还原法,适合大规模工业推广,生物炭的形成和纳米铁颗粒的合成在此过程中同时发生,生成的纳米颗粒尺寸可控性好、质量高,产物结晶度高,但受热解温度影响较大[40-41]。
3) 水热炭化法。水热炭化法是一种以亚临界水作为反应介质,在150~350 ℃下将干湿生物质转化为碳产物的热化学转化技术[42]。WEI等[43]以污泥为生物质原料,通过水热炭化法制备了铁改性生物炭。首先将污泥离心以降低其水分含量,将获得的污泥放入1 L高压釜中,然后加入铁盐 (NH4)2Fe(SO4)2·6H2O) 反应制备铁改性污泥生物炭,实验证明水热温度180 ℃、反应3 h是最佳制备条件。水热炭化法的优点是炭固定效率高,能得到分散性好、纯度高的纳米颗粒,该法善于处理含水率高、较分散的原料,反应环境密闭可有效防止有毒害物质的挥发,是一种相对环境友好的反应方法,但反应釜在高温高压下的安全性能有待关注[44]。
4) 浸渍法/浸渍热解法。采用铁盐溶液作为改性剂,对生物质进行浸渍/浸渍热解从而制备铁改性生物炭材料[45]。LYU等[27]采用浸渍法将纳米FeS成功负载到了稻壳生物炭。SHIN等[40]以废弃咖啡渣为原材料,经三氯化铁溶液浸渍后,在氮气氛围下于管式炉中热解制备了铁改性生物炭。ZHANG等[46]用三氯化铁预处理的棉白杨生物质为原料,通过热解制备了γ-Fe2O3/BC复合材料,合成步骤是首先称取40 g FeCl3·6H2O溶于60 mL去离子水中,然后将生物质放入配制好的FeCl3溶液中浸渍2 h,浸渍结束后在80 ℃下干燥2 h,最后将预处理好的生物质在氮气保护下600 ℃热解1 h。该方法易操作、产量大,合成的铁改性生物炭是很有前景的原位修复重金属污染的材料,缺点是热解过程会产生污染性气体。
5) 化学共沉淀法。是在N2等惰性气体氛围和碱性条件下 (氨水等) ,通过Fe2+/Fe3+的盐溶液反应生成纳米铁颗粒,并负载到生物炭上的方法[41]。LI等[47]将FeCl3和FeCl2 (质量比2:1) 溶于80 ℃的150 mL脱氧去离子水中,在98~100 ℃水浴锅中加热混匀,而后加入生物炭,用NaOH调节溶液pH为10,固化30 min后过滤沉淀物,于105 ℃烘干最终得到Fe3O4/BC,即使在酸雨淋溶条件下,该法合成的铁改性生物炭也可有效固定土壤中的铅。PHILIPPOU等[48]也通过化学共沉淀法制备了质量比为3:1的磁性生物炭。此方法较为简单、易操作、适合批量生产,但是该方法受pH、温度等因素影响较大,得到的纳米铁颗粒粒径通常较大[49]、结晶性差、团聚严重[44]。
6) 球磨法。球磨法是利用球磨仪器的不断转动和搅拌实现材料尺寸细化的方法,材料颗粒的尺寸和形状受转速、时间、球磨介质、球磨珠大小、球磨珠与材料的质量比的影响[50]。WANG等[51]以玉米秸秆为原材料利用行星球磨机制备纳米零价铁改性生物炭。在真空不锈钢研磨罐中加入1.2 g玉米秸秆生物炭和1.8 g铁粉,然后放入150 g氧化锆球 (3、5、15 mm直径的球以3:5:2的质量比混合) ,氮气吹扫20 min后进行球磨。该方法环保经济、可重复破碎、制备的颗粒粒径小、反应活性高[52],但机械球磨消耗能量较大、摩擦损耗大,运作时会放出大量的热能,温度升高可能会导致一些金属材料的氧化。
7) 绿色合成法。绿色合成法的基础是植物还原剂的提取,利用植物 (如谷物、绿茶等) 提取液负责将金属化合物还原成合适的纳米颗粒,然后通过共沉淀技术等将其浸渍到基质上[53]。ZHANG等[54]用香蕉皮提取物和硫酸亚铁对香蕉皮生物炭进行超声改性,制备FexOy改性生物炭。首先进行香蕉皮中还原剂的提取,将风干的香蕉皮加入到去离子水 (60 g·L−1) 中,在353 K下保持1.5 h,真空过滤分离浸提液和香蕉皮。然后,将过滤后的香蕉皮放入马弗炉,在氮气保护下873 K热解1 h,制备生物炭。在室温下将1.2 g香蕉皮生物炭加入到200 mL香蕉皮提取液中先超声15 min,然后在连续超声作用下滴加200 mL 0.1 mol·L−1的FeSO4溶液,继续超声1.5 h后离心出固体物质,分散到去离子水中进行烘干。硫酸亚铁被香蕉皮提取剂还原,先形成的是零价铁改性生物炭,然后,零价铁在水中溶解氧的作用下,被氧化水解形成FexOy/BC。MANDAL等[55]用绿茶提取剂还原FeCl2,对绿茶生物炭进行改性,并制备了纳米零价铁改性生物炭。第一步,将烘干好的绿茶按不同比例加入到100 mL去离子水中,85 ℃下搅拌0.5 h,然后过滤分离提取液和绿茶生物质。第二步,将配制的100 mL 0.3 mol·L−1 FeCl2溶液转移到三颈烧瓶中,在50 ℃、氮气吹扫下边搅拌边逐滴加入绿茶提取液。第三步,加入绿茶生物质继续搅拌0.5 h,反应结束后先烘干,然后在氮气保护下热解2 h最终得到nZVI/BC,胶体稳定性和流动性研究证实了该法合成的铁改性生物炭的稳定性,并有利于土壤中重金属的长期固定。绿色合成法打破了传统合成方法的局限性,使用绿色材料、在合成过程中消耗更少的能源和资源,避免了二次污染,被认为是目前较为环保的制备方法[56]。
-
1) 元素分析。元素分析仪可分析样品中元素的种类和含量。WANG等[57]利用天然赤铁矿改性松木生物炭制备了磁性生物炭,通过元素分析发现,改性后磁性生物炭中铁的含量是原始生物炭的118倍;此外,由于赤铁矿中还含有铝和镁,磁性生物炭中铝和镁的含量也略有增加,而砷则倾向于积聚在含有铁、锰、铝、铜和钴的金属氢氧化物的表面。
2) N2-BET吸附。利用N2-BET吸附法可测定材料的比表面积和孔径分布。ZHANG等[25]通过化学共沉淀法制备了Fe3O4/BC,用于修复镉污染土壤。对制备的材料进行BET表征,结果表明,铁改性生物炭的比表面积为101.9 m2·g−1,为原始生物炭的50倍,改性后总孔体积增加了60.5倍,微孔比表面积和体积分别增加了7.4倍和6倍。负载纳米铁颗粒后复合材料比表面积、孔体积和微孔比例的增加,增大了铁改性生物炭和重金属污染物间的接触面积,对重金属镉的吸附而言具有积极作用。
3) SEM/EDS及TEM表征。利用扫描电子显微镜 (SEM) -能量色散X射线能谱 (EDS) 或透射电子显微镜 (TEM) 对样品微观形貌特征进行观察,可得到材料表观形貌及元素分布。WANG等[58]制备FeCl3改性生物炭,对砷镉共污染土壤进行了修复。SEM图片表明原始生物炭呈多孔、片状结构,铁改性之后生物炭微孔和中孔中出现了颗粒,表面变得粗糙。同时,EDS能谱中出现了Fe显著峰,生物炭表面负载的铁量调节了土壤中Cd(II)和As(V)的固定化,并提高了土壤中有效态铁的含量,有利于土壤中重金属与铁氧化物和氢氧化物的结合。FAN等[59]以木屑为原料,通过一步碳热还原法制备了nZVI/BC,并将其用于修复两个受砷污染的矿山土壤。与原始生物炭相比,nZVI/BC的SEM图像呈典型的多孔结构,且在生物炭的表面和多孔中分散着白色颗粒,颗粒直径约为200 nm,EDS数据初步证明了这些白色颗粒是由Fe组成。此外,该学者还采用了双聚焦离子束 (FIB) 垂直于生物炭表面进行了切割,然后通过SEM和EDS表征生物炭内部与表面nZVI转变的差别,发现砷主要被固定在生物炭表面的氧化铁中。ZHU等[60]以芦苇生物炭为原料,制备了nZVI-BC,SEM图显示原始生物炭表面光滑,孔道清晰,改性后BC表面出现了大量的零价铁颗粒,并主要分布于大孔中 (见图1) 。
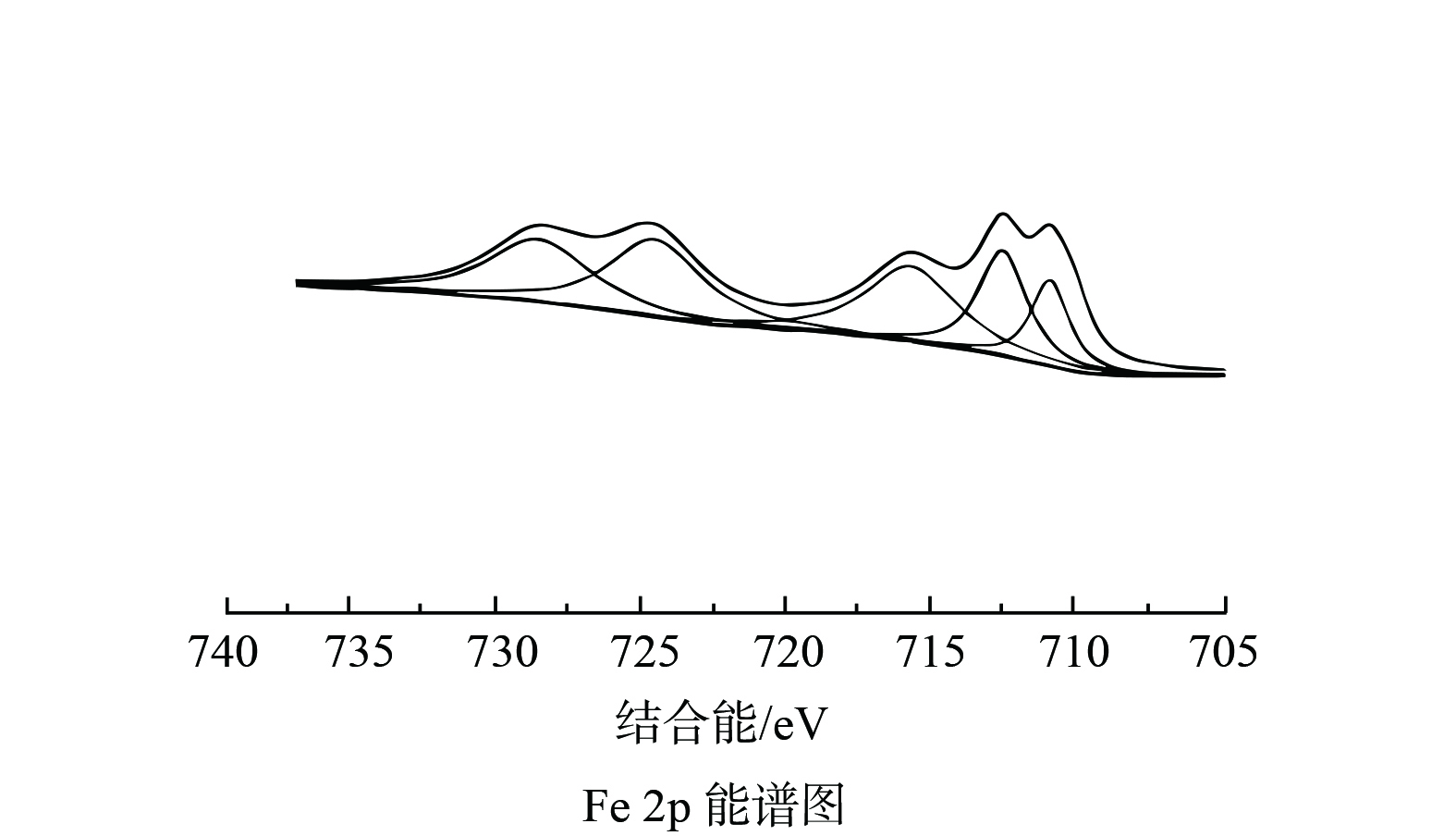
4) X射线衍射分析。X射线分析方法包括X射线光电子能谱 (XPS) 和X射线衍射 (XRD) 。XPS能测定材料表面的元素价态,XRD可分析材料的物相和晶体结构。WANG等[57]制备了γ-Fe2O3/BC,通过XRD图谱初步推断出现的衍射峰可能归属于γ-Fe2O3或者Fe3O4。通过XPS能谱显示Fe2p1/2和Fe2p3/2的结合能分别为724.48 eV和710.85 eV,这与Fe(III)化合物的结合能接近。XRD和XPS分析结果共同证明了生物炭上的氧化铁颗粒是γ-Fe2O3。LIU等[29]对制备的稻壳生物炭负载纳米零价铁材料 (Fe-RBC-800) 进行XPS分析,C1s图谱中284.8 eV和286.2 eV的衍射峰分别归属于C—C和C—OH,O1s图谱中530.3 eV处的峰归因于Fe3O4中的O2-,531.7 eV和532.7 eV处的峰值对应于—OH和C==O中的O。这表明铁改性生物炭表面官能团丰富,从而为重金属离子提供了较多的吸附位点,Fe2p图谱中724.6 eV的峰值属于Fe0,Fe0的存在证明零价铁成功负载于生物炭表面,并在后续反应中参与铬的还原。曹媛等[61]通过浸渍热解法制备FeCl3改性生物 (MBC300) ,如Fe2p图谱所示,在711.0和724.4 eV处观察到Fe(III)的2p3/2和2p1/2峰 (见图2) 。
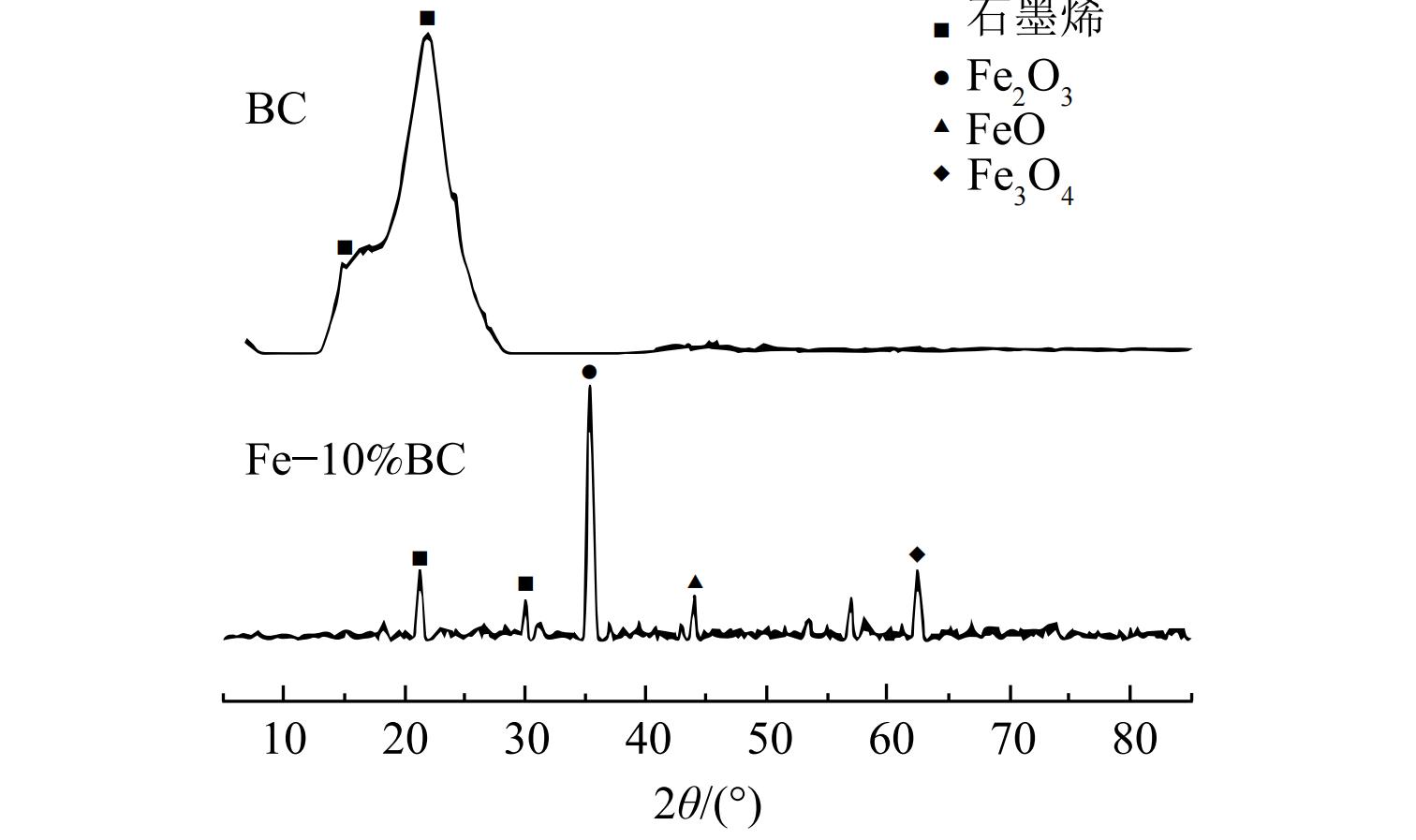
利用X射线衍射 (XRD) 亦可对材料结晶度进行分析。WU等[62]制备了不同铁材料改性的生物炭用于土壤中砷的固定化,XRD图谱显示不同材料的矿物结构组成之间存在明显差异,BC—FeCl3无结晶峰,BC—Fe中只存在一个Fe(0)的峰,BC—FeOS中出现的KFe3(SO4)2(OH)6峰与材料的合成途径有关,而KFe3(SO4)2(OH)6中的SO42-能与AsO43-发生置换反应从而实现对As的固定。LI等[47]通过XRD证明了Fe3O4和nZVI对生物炭的改性是成功的。分析XRD图谱可发现,在37.12°、43.12°、57°和62.56°处出现了强衍射峰,证实了Fe3O4颗粒的存在。而nZVI颗粒在衍射角44.7°处有明显特征峰,对比标准图谱也发现了相应晶面衍射。这表明nZVI/BC制备成功,相比之下,由于nZVI具有较强的吸附性和还原性,故nZVI/BC对土壤中铅的固定效果较好。QIN等[63]采用XRD对原始生物炭表征,在13°和22°处观察到明显的石墨衍射峰;铁改性生物炭XRD图谱在22°和42°处也观察到了石墨衍射峰。另外,在35.2°、43.8°和62.6°处出现了Fe2O3、FeO和Fe3O4衍射峰,Fe2O3衍射峰强度较大,这表明Fe2O3是铁存在的主要形式 (见图3) 。
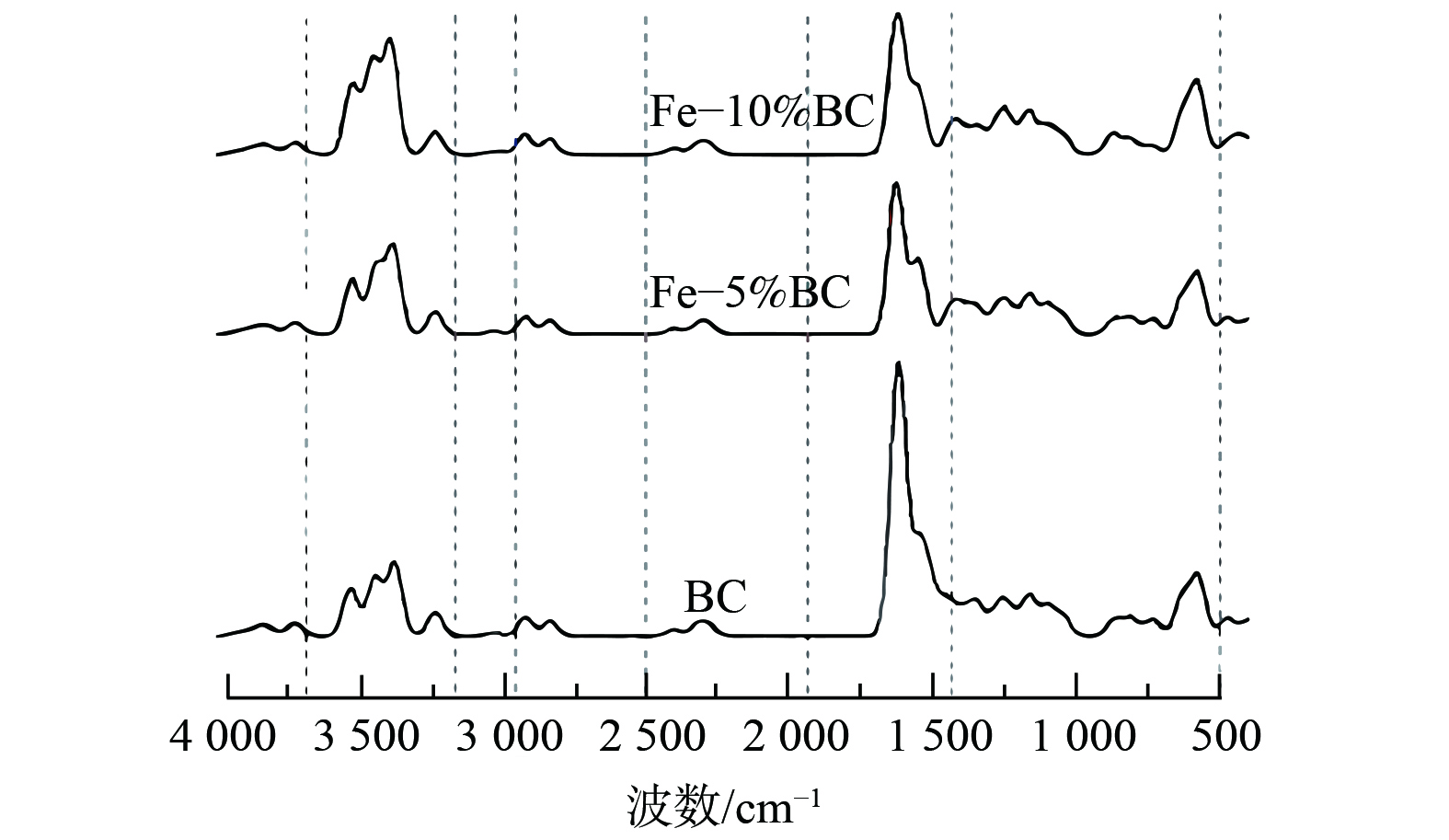
5) 傅立叶变换红外光谱 (FTIR) 。FTIR可用于材料表面官能团的测定。ZHANG等[54]利用FTIR对原始香蕉皮生物炭和FexOy/BC进行了对比分析,结果表明,在原始生物炭表面存在含氧官能团,羟基 (—OH) 伸缩振动产生了位于3 368~3 429 cm−1处的光谱,1 386、1 049 cm−1处的特征峰归因于C=O、C—O的拉伸振动。FexOy/BC在586 cm−1处出现了Fe—O的特征峰,说明FexOy的改性是成功的,但同时C—O、C—H的特征峰被抑制,可能是表面改性掩盖了这部分功能。ZHANG等[25]对制备的Fe3O4/BC进行FTIR分析,发现与原始生物炭相比,铁改性生物炭具有更高的峰强度,在532 cm−1处出现的典型Fe—O特征峰意味着纳米氧化铁颗粒的负载。铁改性的同时也增加了—OH、C=O、—COOH的数量,而土壤中镉通过络合、沉淀作用被固定,主要取决于这些含氧官能团。QIN等[63]制备了不同炭铁质量比例的铁改性生物炭,发现BC的FTIR光谱主要分为4个区域:—OH振动区 (3 700~3 200 cm−1) 、C—H/N—H伸缩振动区 (2 900~2 500 cm−1) 、双键振动区 (1 900~1 400 cm−1) 、指纹区 (1 400~500 cm−1) ;与BC相比,铁改性后生物炭表面含氧官能团种类变化不大,但复合材料中铁含量越高,含氧官能团伸缩振动越强 (见图4) 。
-
1) 磁性。PHILIPPOU等[48]制备的Fe3O4/BC能被外部磁铁棒强烈吸引,证明了磁性生物炭的成功制备。ZHANG等[46]为了研究γ-Fe2O3/BC的磁性,在室温下通过超导量子干涉仪磁力计记录了γ-Fe2O3/BC的磁滞曲线,结果表明γ-Fe2O3/BC的饱和磁化强度为69.2 emu·g−1,在测量基础上得到复合材料中γ-Fe2O3粒子的饱和磁化强度应为93.2 emu·g−1,高于纯γ-Fe2O3材料的饱和磁化强度 (76.0 emu·g−1) 。这说明复合材料中含有其他磁性材料,如Fe0可能是铁氧化物被碳或者还原性气体还原得到的,复合材料优良的铁磁特性,使其具有较强的砷吸附能力。
2) 热稳定性。热重分析 (TGA) 能考察材料的热稳定性。WANG等[57]通过TGA分析发现,改性后的磁性生物炭热稳定性略高于原始松木生物炭。由于热不活跃的赤铁矿用作稀释剂,磁性生物炭在较高温度下才开始分解;MANDAL等[64]通过TGA证实了nZVI与生物炭的结合有利于生物炭热稳定性的提高。在土壤的实际应用处理中可能受益于复合材料的热稳定性,这通常被认为是一种有效的固碳方法。复合材料热稳定性的增强也为土壤中更好的碳汇提供了机会。
3) 迁移性。SU等[65]通过石英砂柱迁移实验比较了纳米零价铁颗粒和nZVI/BC材料的迁移性差异。按一定的时间间隔收集材料悬浮液通过石英砂玻璃柱后的流出液,测定总铁浓度,结果表明,纯纳米零价铁颗粒的迁移性低于nZVI/BC。纯nZVI的团聚作用导致大部分颗粒都被保留在进水端。而生物炭的存在促进了nZVI的迁移,这是由于nZVI与BC的结合降低了磁吸引力,使得nZVI/BC能顺利穿过石英砂。nZVI@BC比纯nZVI具有更好的迁移性,有利于与土壤中重金属的接触,可有效固定土壤中的铬。
4) 稳定性。通过沉降实验可分析铁改性材料的稳定性[66-67]。MANDAL等[55]通过沉降实验探究了纳米零价铁铁改性生物炭的稳定性,利用紫外可见分光光度计测定了nZVI颗粒、nZVI/BC材料悬浮液的吸光度,比较了其沉降速率。沉降曲线显示,随着时间的增加,nZVI的吸光度下降幅度明显大于nZVI/BC,这说明nZVI/BC的稳定性要优于nZVI。纯nZVI沉降速度最快是由于纳米颗粒的迅速团聚导致的,而nZVI与BC的结合抑制了零价铁的团聚性,提高了材料的稳定性。这是由于生物炭表面的含氧官能团固定了nZVI,或者零价铁颗粒之间的静电吸引受到了BC表面的电荷性质影响。沉降实验证实了nZVI在绿茶基质中的稳定性,在固定土壤铅的长期有效性方面发挥了作用。
-
1) 原材料。重金属的固定效率因生物炭原材料而异。WANG等[58]以稻草 (RB) 、小麦秸秆 (WB) 和玉米秸秆 (CB) 为原材料制备原始生物炭,然后经FeCl3改性得到铁改性生物炭FRB、FWB和FCB,将其应用于修复砷镉复合污染土壤。与FWB和FRB相比,FCB的pH值和含铁量是最高的,这与原材料本身的理化性质和实验过程有关。生物炭的pH值受表面官能团和阳离子交换量的影响,3种生物炭在含氧官能团、表面电荷组成等方面的差异,决定了它们对重金属的吸附能力。同时,生物炭表面负载的Fe含量对土壤中Cd(II)和As(V)的固定起调节作用。结果表明,在10%最佳投加量下,铁改性玉米秸秆 (FCB) 对Cd(II)和As(V)的固定效率最高,此时土壤中铁铝结合态砷含量最高,镉主要以有机结合态存在。
2) 热解温度。热解温度对铁改性生物炭的产率和性能有着重要影响,不同的温度会影响材料的比表面积、孔径、官能团等理化性质[68]。一般情况下,热解温度升高,氢氧元素含量降低,—COOH、—OH等含氧官能团减少,不利于与重金属的结合;但随着热解温度的提高,材料比表面积增大,重金属吸附点位也会增多[69]。MANDAL等[55]通过绿色合成法,在150、250、350、450、550和650 ℃下热解制备了磁性绿茶生物炭,对合成的材料进行了表征。结果表明,热解温度显著影响与BC相关联的nZVI颗粒的稳定性。在450 ℃下制备的nZVI/BC在粒径、比表面积和表面电荷方面具有优良的特性。该温度下制备的复合材料官能团含量明显高于其他材料,表面含氧官能团是重金属吸附络合的主要结合位点。LIU等[29]于600、800、1 000 ℃热解稻壳,通过一步炭热还原法制备了铁改性生物炭材料。表征显示,随着温度的升高,生物炭虽然保持着非晶态碳形态,但石墨化程度增强。600 ℃炭热还原的主要铁产物是Fe3O4;在800 ℃下生成了形状良好、平均尺寸约为100 nm的nZVI。nZVI支撑着生物炭的孔结构,提高了复合材料的力学性能。当还原温度提高到1 000 ℃时,材料表面含氧官能团受损,剥离的氧原子与nZVI结合,导致nZVI的氧化腐蚀。同时,生物炭孔结构发生崩塌,比表面积下降且不利于纳米颗粒的负载和形成。结果表明,在800 ℃下制备的铁改性生物炭对Cr(VI)污染土壤具有良好的修复效果,污染土壤中酸溶态Cr消失,Cr不仅以不易利用的形式存在于土壤中,而且渗滤液中的Cr(VI)也被完全去除。
3) 炭铁质量比。通过优化炭铁质量的配比获得最大的钝化效益。SU等[65]以甘蔗渣为生物质原料,合成了nZVI与BC质量比为1:0.5、1:1和1:2的复合材料。对nZVI/BC材料性能进行研究发现,质量比为1:1的nZVI/BC,零价铁在生物炭表面负载分散情况最好。通过沉降实验和柱实验发现,与纯nZVI颗粒相比,在nZVI与BC的质量比为1:1时,材料的稳定性和迁移性更好。该配比下对Cr(VI)和总铬的固定效率分别达到了100%和92.9%。QIAO等[70]制备了4种含0.5%、1.0%、2.5%、5.0% Fe的零价铁改性生物炭材料。通过盆栽试验,探讨零价铁改性生物炭材料对Cd和As生物有效性的影响。结果表明,铁含量与材料的复合效应成正相关。5.0%铁含量处理组促进了铁斑的形成,增加了铁斑块中Cd和As的积累。不同水稻组织中Cd和As含量为0.5 Fe-C > 1.0 Fe-C > 2.5 Fe-C > 5.0 Fe-C。这说明5.0%铁含量的复合材料能显著降低Cd和As的生物有效性。
4) 投加量。修复材料的用量是实际重金属土壤应用中应考虑的一个重要因素,通过铁改性生物炭的合理投加,使其发挥到最大的吸附能力,又避免对土壤性质产生危害。LYU等[27]通过液相反应制备硫化铁改性生物炭材料来修复Cr(VI)污染土壤。结果表明,2.5、5、10 mg·g−1硫化铁改性生物炭处理下TCLP可提取的Cr(VI)浓度分别降低94.7%、96.5%、96.6%,降低了Cr(VI)的迁移率和生物有效性。林昌华等[71]针对华南地区镉污染酸性菜田红壤,通过小白菜室内盆栽实验,研究了在镉胁迫条件下,施加不同比例 (0.1%、0.3%、0.5%、1%) 硫酸亚铁改性生物炭对土壤中有效态镉和小白菜品质的影响。结果表明,改性生物炭在0.5%最佳添加量下,小白菜根际土壤水溶态镉含量最低,仅为未加生物炭对照组的58.55%。同时小白菜地上部分镉含量降低了,小白菜的总生物量亦有提高。
5) 反应时间。铁改性生物炭对重金属污染土壤的修复效果随着时间而变化。WU等[72]针对冶炼厂附近农田镉污染土壤,通过土培实验,分别在第7、15、30、45、60、90天取样,探讨了随着时间的变化,硫铁改性生物炭对土壤Cd的固定效果。研究表明,硫铁改性生物炭处理组土壤中有效态Cd在第7、15、30、45、60、90天分别下降67.56%、11.47%、40.91%、59.63%、8.82%、4.03%。并不是随着时间的延长,土壤有效态Cd含量越低,而是呈现先降低后升高的趋势。在45 d内,有效Cd含量较对照组显著降低。MANDAL等[73]制备了纳米零价铁改性生物炭用于固定土壤中的Se。在第1、7、15、30天分别取土样进行分析,结果发现,纳米零价铁改性生物炭对Se的固定效率随着时间的增加而提高。在土培30 d后对Se固定效率达到了60.61%,有效态Se含量从58.49 mg·kg−1降至27.57 mg·kg−1。
6) 土壤pH。施用到土壤中的钝化剂会引起土壤pH的变化。pH是影响土壤中重金属形态和有效性的重要因素[74]。YAO等[75]通过盆栽实验研究了Fe3O4改性生物炭对土壤As生物有效性的影响,发现施用Fe3O4改性生物炭降低了土壤的pH值。这可能是由于制备材料时进行了硝酸改性,同时铁离子的水解产生了大量H+。热解温度和灰分含量也会对材料pH产生影响,灰分的多次洗脱也导致材料pH的降低。同时,铁改性后增加了酸性官能团。相关性分析表明,经CaCl2提取的As含量与土壤pH呈显著负相关。土壤中的砷主要以阴离子形式存在,较低的土壤pH促进了As与修复剂表面的静电作用,导致As的迁移能力减弱,降低了As的生物有效性。熊静等[76]利用FeCl3改性生物炭修复Cd-As复合污染土壤,结果表明,受钝化剂自身pH值的影响,施用铁改性生物炭降低了土壤的pH,促进了As向残渣态转化。然而,pH降低导致土壤胶体和修复剂表面正电荷增加,与Cd2+形成静电斥力,影响了对镉的吸附能力。
7) 土壤有机质。添加铁改性生物炭会对土壤有机质含量产生影响。土壤中的有机物质具有大量的官能团,如羟基、羧基和氨基等,可有效吸附重金属离子。更重要的是,有机质分解形成的小分子有机酸、腐殖酸等可与重金属结合后形成稳定的络合物,从而降低重金属的有效性。WU等[72]探讨了硫铁改性生物炭对污染土壤中Cd的固定效果,表明有机质含量是影响Cd有效性的重要土壤因素。与对照组相比,硫铁改性生物炭的施加提高了土壤10.12%~21.32%有机质含量,线性回归分析得到土壤有效态镉的含量与有机质含量呈显著负相关。因为硫铁改性生物炭吸附了土壤中的有机分子,并通过表面催化作用合成了有机分子,同时生物炭富含碳,增加了土壤的储碳量,经过缓慢分解形成了腐殖质,提高了土壤有机质浓度,从而通过吸附作用和络合作用固定Cd,降低Cd的迁移性。
8) 土壤阳离子交换量。阳离子交换量 (Cation Exchange Capacity, CEC) 也是影响重金属固定的因素之一,修复剂的使用会导致土壤CEC的变化,可通过离子交换作用提高对重金属的吸附能力[77]。ZHANG等[25]发现除了土壤pH外,CEC也是影响Cd有效性的重要因素。随着Fe3O4改性生物炭的施加,土壤CEC显著提高,在0.2%、0.4%和1.6%投加量下,分别提高了164.1%、110.0%和72.2%,使土壤具有较高的离子交换能力,Cd2+通过与Ca2+、Mg2+、K+、Na+的离子交换而被固定,有效态Cd的含量显著降低。
-
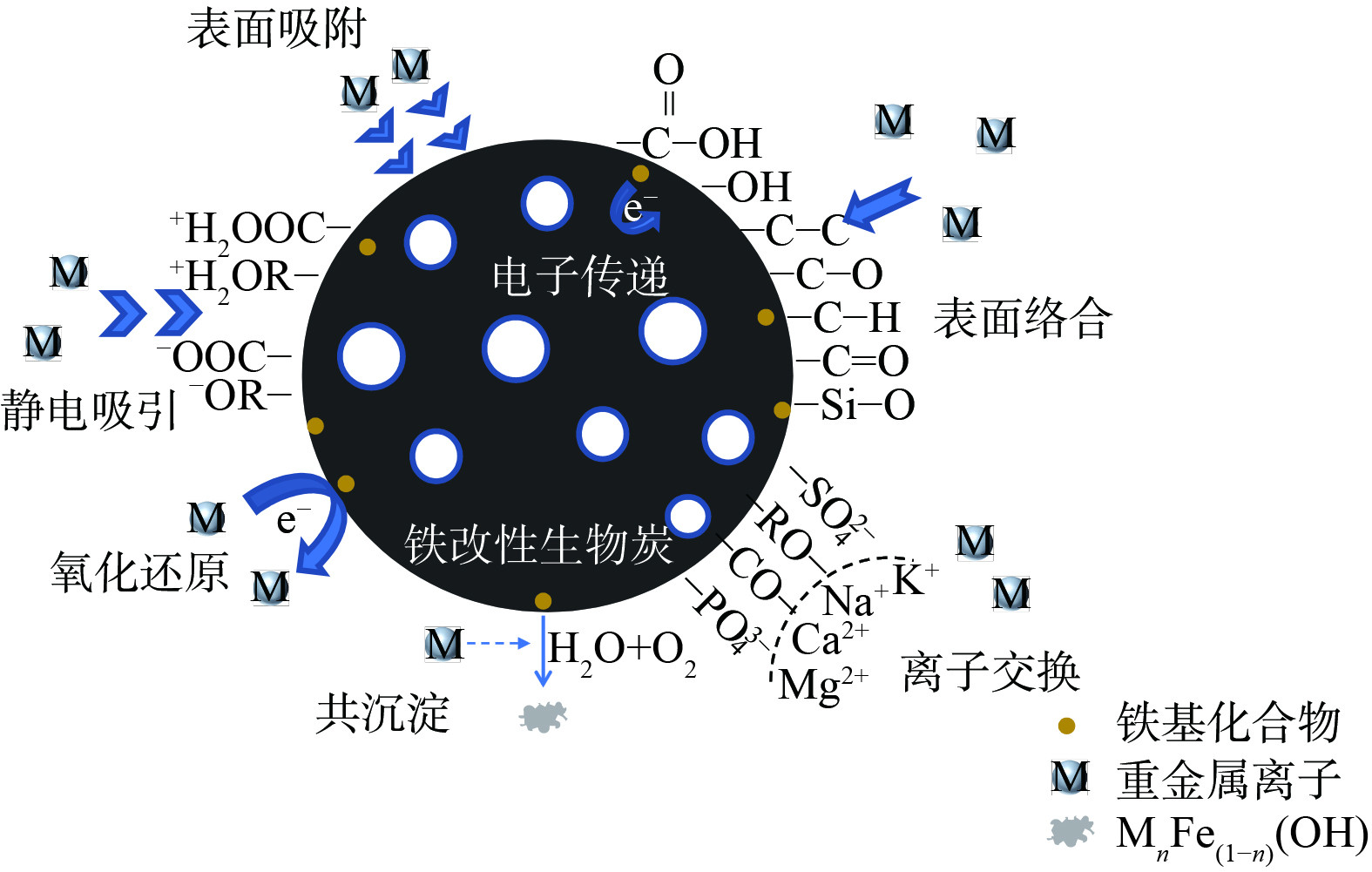
铁改性生物炭对重金属污染土壤的修复机制较为复杂,通常是多个机制共同作用 (如图5) 。其中,主要的反应有表面吸附作用、静电作用、离子交换、络合作用、氧化还原、共沉淀作用等[35, 49, 78]。
1) 对重金属的固定化机制。铁改性生物炭通过表面吸附、静电作用、沉淀作用固化土壤重金属。由于铁改性生物炭比表面积大、孔隙度高,可通过表面吸附将重金属离子固定。LI等[47]发现生物炭作为载体支撑着纳米零价铁颗粒,在进入土壤后增大了与Pb的接触面积。同时,由于nZVI的强吸附性,土壤中的Pb首先被吸附固定在铁改性生物炭表面。生物炭表面带负电荷[18],可通过静电吸引作用于重金属阳离子,而对一些阴离子污染物如As(V)等,吸附效果不理想。铁改性后生物炭表面电荷和pHzpc会发生变化,对阴离子污染物的静电吸附作用增强[79]。WU等[72]发现,硫铁改性生物炭提高了土壤pH,从而不仅增加了土壤胶体负电荷量,也增加了铁改性生物炭表面负电荷量,通过静电作用阻止了Cd的迁移,降低了有效态Cd的含量。WANG等[58]针对砷镉复合污染土壤的修复结果。这表明铁改性生物炭在吸附Cd2+后表面电荷可能发生反转现象,并影响其对As的吸附。某些重金属离子会通过沉淀作用,以氢氧化物、碳酸盐或磷酸盐形式被结合固定[80]。施加硫铁改性生物炭提高了土壤pH,Cd与CO32-和PO43-结合形成沉淀被固定[72],显著降低了土壤可交换态Cd的含量。LI等[81]发现与原始生物炭相比,经Fe2O3改性后的生物炭比表面积增大,具有了更多的吸附点位。土壤中游离的As被吸附后可通过沉淀作用形成Fe(As)—OH,实现As的固定化,降低土壤As的迁移性。
2) 离子交换/络合作用机制。铁改性生物炭通过离子交换作用、络合作用降低土壤重金属的迁移率。ZHANG等[25]研究表明Fe3O4改性生物炭可提高土壤阳离子交换量,使土壤具有较高的离子交换能力。Cd2+可通过与Ca2+、Mg2+、K+、Na+间的离子交换作用而被吸附固定。MANDAL等[55]发现随着土壤pH和表面电荷密度的变化,铁改性生物炭中的官能团会在土壤中发生解离,多酚基团和腐植酸可通过螯合作用形成高度稳定的金属络合物。随着作用时间的延长,铁与铅、碳的结合也倾向于形成络合物,从而固定土壤中的铅。MANDAL等[73]利用花生壳制备低成本的铁改性生物炭用于硒污染土壤修复。结果表明,铁改性生物炭促进了水溶态和交换态硒向有机结合态和残渣态硒转化,Se通过与铁改性生物炭表面Fe2O3间的络合被固定。As可通过络合作用与—COOH和—OH等官能团结合,Fe—O—As络合物的形成也是As(V)在铁改性生物炭上吸附的原因[82]。
3) 氧化还原/共沉淀作用机制。铁改性生物炭还可以通过氧化还原作用、共沉淀作用降低重金属的有效性。LIU等[29]利用铁改性生物炭修复Cr(VI)污染土壤,在整个固液修复体系中,Cr的生物利用度明显降低。随着铁离子的氧化,Cr(VI)被还原为Cr(III),同时Fe0被氧化成Fe2+和Fe3+,Cr(VI)与nZVI氧化还原反应的主要产物为FeCr2O4、Cr(OH)3和Cr2O3,溶解有机碳也可将部分Cr(VI)还原。FAN等[59]利用nZVI改性生物炭修复As污染矿山土壤,nZVI/BC对As表现出良好的钝化效果,在5%投加量下,广西壮族自治区 (GX) 和江西省 (JX) 矿山土壤中弱吸附态砷的含量分别降低了93.7%、97.7%。从修复后的GX和JX矿山土壤里收集nZVI/BC,发现随着铁离子的氧化,As(V)被还原为As(III)。XPS分析得到As(III)含量分别占66.7%、69.7%。同时,该学者还发现修复剂处理后土壤非晶态铁含量显著增加。XRD结果表明,Fe0被腐蚀后形成了FeOOH,As和FeOOH通过共沉淀作用形成了Fe(As)OOH,实现了As的固定化,同时由于GX、JX土壤中分别富含Ca、Al,也同时被FeOOH吸附,As与Fe—O—Ca、Fe—O—Al共沉淀。刘书四[83]针对镉砷超标的农田土壤,以棕榈为原料制备铁改性生物炭,研究发现纳米铁颗粒促进了铁膜的形成,添加改性生物炭的实验组水稻根表面铁膜砷含量相比对照组增加了46.3%。砷在铁膜中存在共沉淀作用,从而减少了水稻对砷的吸收。熊静等[76]也发现FeCl3改性生物炭的添加有效降低了有效态砷的含量,促进其向残渣态转化,对As的钝化效果比原始生物炭高出了43.68%。这可能是由于As易与Fe离子结合,形成了移动性较低的非晶态砷酸铁 (FeAsO4·H2O) 。
4) 电子转移机制。铁改性生物炭固化土壤重金属还涉生物炭的电子转移功能。生物炭的电子容量高达2 mmol·kg−1[84],生物炭表面的芳香族、醌、对苯二酚等结构[85-86]是电子传递的主要贡献者,使其具有了导电性。这个功能加速了纳米铁颗粒与生物炭之间的电子传递[87],加快了铁颗粒的腐蚀作用[88],最终氧化成非晶态铁氧化物来吸附固定重金属。同时,腐蚀过程刽消耗质子提高土壤pH[89],某些金属离子在高pH下的溶解度较低,这也有利于一些重金属的固定化。LIU等[29]发现,生物炭作为Fe0和Cr(VI)之间的电荷转移通道来维持氧化还原反应,从而使Cr(VI)仍然可以缓慢而连续地被去除。热解制备的Fe-RBC-800降低了生物炭的含氧量,增加了芳香族结构,而芳香族结构在生物炭的电子传递中起主要作用。同时,在Fe-RBC-800合成过程中,nZVI的存在加速了生物炭的石墨化过程,石墨化区域也能起到传递电子的作用[90]。FAN等[59]发现nZVI改性生物炭和BC+nZVI物理混合处理组对As的钝化都比单一nZVI效果好。这是由于在生物炭电子转移功能的作用下,BC协同nZVI促进了对As的吸附。该学者还发现,nZVI直接负载于生物炭表面,更有利于电子转移,nZVI的快速腐蚀致使材料吸附点位增多。另外,nZVI/BC在土壤中的迁移性更强,这不同于BC和nZVI的简单物理混合。因此,nZVI/BC对土壤中弱吸附态砷含量的降低程度远远大于BC+nZVI物理混合处理。
-
生物炭和纳米铁颗粒的协同作用可以有效提高复合材料对污染物的去除能力,铁改性生物炭具有良好的反应性和稳定性,在重金属污染土壤修复中的应用也越来越广泛,但由于生物炭材料来源不同、铁改性方法不同、重金属种类不同,相应的环境功能和产生的效应也不同 (如表1) 。
1) 对镉 (Cd) 污染土壤的修复。镉是我国土壤中污染最严重的重金属,分别占农田和城市土壤污染33.54%和44.65%[91]。由于其不可生物降解、毒性和持久性,随着食物链的摄入可能导致肾和肝损害,甚至癌症。
杨兰等[92]利用浸渍热解法制备了FeCl3改性生物炭,通过恒温静态培养实验探讨了复合材料对Cd污染土壤的修复作用。FeCl3改性后的生物炭平均孔径扩大了1.52倍,同时表面酸性官能团数量增加。当土培90 d后,在10%投加量下铁改性生物炭处理组土壤有效态Cd含量降低了22.5%~32.3%。ZHANG等[25]通过化学共沉淀法制备了Fe3O4改性生物炭,研究了铁改性生物炭对土壤镉生物有效性的影响。结果表明,施用0.05%~1.6%铁改性生物炭可使土壤有效Cd降低6.81%~25.0%,添加浓度大于0.4%时显著降低土壤有效Cd含量。Fe3O4改性生物炭对土壤Cd产生了激活和钝化两种效应,但钝化效应更加显著。尽管Fe3O4改性增加了生物炭表面酸性官能团的含量,同时纳米铁水解产生了氢离子,降低了土壤pH,提高了Cd的生物有效性,但Fe3O4改性生物炭释放的铁水解产物会与Cd形成配合物。另外,复合材料具有较高的离子交换能力,提高土壤CEC的同时通过离子交换作用吸附Cd2+,Cd2+还与生物炭表面CO32-和PO43-结合形成沉淀而被固定。
2) 对砷 (As) 污染土壤的修复。近30年来,农业土壤中砷污染呈逐渐增加的趋势。中国中部、南部和西南地区的砷含量高于其他地区。许多人类疾病,如癌症、心血管疾病、神经系统疾病和糖尿病等,都受到砷暴露的影响[93]。
LI等[81]通过化学共沉淀法合成了Fe2O3改性生物炭并将其应用于土壤-油菜系统中砷的固定化研究。Fe2O3改性生物炭施用后改善了土壤质量,降低了土壤中As的迁移率。土壤水溶态砷含量减少了89.74%,与对照组相比,增加了油菜生物量,地上部和根系对As的吸收分别下降44.55%和45.40%,地上部As的转移系数下降了43.91%,As的生物有效性降低。铁改性后生物炭的比表面积由4.12 m2·g−1增加到了107.62 m2·g−1,并通过吸附和共沉淀作用固定As,形成了Fe(As)-氢氧化物,从而降低了土壤中有效态As含量。YAO等[75]以稻壳为原材料,采用化学共沉淀法制得Fe3O4改性生物炭,通过盆栽试验探讨其对土壤中As迁移率和生物有效性的影响。结果表明,1.6%投加量处理下,水稻各组织中As含量最低,0.4%处理下非专性吸附态、专性吸附态和无定形铁铝氧化物结合态砷浓度分别降低42.4%、9.7%和19.8%,提高了残渣态砷含量。对钝化机理进行分析,发现施用铁改性生物炭降低了土壤pH,促进了As与吸附剂表面的静电结合。材料表面形成的氧化铁对As也具有很强的吸附能力,复合材料具有较大的比表面积、较高的孔隙率和丰富的官能团,再通过离子交换、与-COOH/-OH络合、π电子吸引、沉淀作用固定土壤砷离子。施用铁改性生物炭还促进了水稻根系表面铁斑的形成,通过Fe-O-As的形成将As吸附在水稻根系表面,从而降低As的生物有效性。
3) 对铬 (Cr) 污染土壤的修复。在过去50年里,全球释放到环境中的铬量超3×104 t。我国农田中铬的浓度范围为1.48~820.24 mg·kg−1,其中Cr(VI)生物毒性更高,会引起皮肤损伤、耳膜穿孔、肺癌等疾病,对人类健康构成巨大威胁[94]。
SU等[37]制备了纳米零价铁改性生物炭用于铬土壤修复,土培15 d之后,铁改性生物炭对Cr(VI)的固定效率为100%,对总Cr的固定效率为92.9%。LIU等[29]以稻壳生物炭负载纳米零价铁作为修复土壤中Cr(VI)的材料,发现在800 ℃一步热解法制备的铁改性生物炭材料 (Fe-RBC-800) 具有较高的热稳定性和抗氧化性。当Fe-RBC-800的投加量为8%和12%的时候,可在30 min和120 min完全去除土壤渗滤液中的Cr(VI),并且连续6 d未检测到Cr(VI),证明了Fe-RBC-800对Cr(VI)污染土壤的长期修复能力。这种长期修复作用可能与生物炭的电子转移功能有关。同时,经Fe-RBC-800处理后的铬污染土壤中的酸溶态完全消失,表明该修复材料对Cr(VI)污染土壤具有良好的修复效果。ZHU等[95]以柳渣为原材料,通过液相还原法也制备了纳米零价铁改性生物炭 (nZVI-HBC) ,研究其在低中高三种不同铬污染水平下对土壤中六价铬的去除作用。结果发现,在250 mg·kg−1 Cr(VI)污染水平下,nZVI-HBC处理组玉米生物量显著提高了31%,施用nZVI-HBC降低了土壤中Cr(VI)的含量,降低了Cr(VI)对玉米的毒性效应。
4) 对铅 (Pb) 污染土壤的修复。作为农业大国,我国土壤Pb污染比例为1.5%,土壤中累积的铅不仅会抑制植物生长,还会被作物吸收,通过食物链对人类健康构成威胁[96],铅摄入或吸入会导致高血压,严重的情况下还会导致基因突变和致癌,其损害是不可逆转的。
MANDAL等[55]以绿茶为原材料,通过绿色合成法制得纳米零价铁复合绿茶生物炭材料 (nZVI@GTBC) ,研究了在不同pH土壤条件下其对铅的固定化。结果表明,土壤pH条件影响Pb的固定效率,nZVI@GTBC在实际土壤 (pH=6.8) 条件下的固定效果优于酸碱土壤条件,并且固定效率随着时间的延长呈升高的趋势,在第30天达到98.33%,此时Pb的生物有效性达到最低。土壤Pb的固定是一个涉及表面吸附、静电吸引、氧化还原、离子交换、表面络合、共沉淀的复杂过程。LI等[47]通过液相还原法和化学共沉淀法分别制备了生物炭负载零价铁 (BC-nZVI) 和生物炭负载纳米氧化铁 (BC-nFe3O4) 材料,研究了它们对污染土壤中铅的固定效果。相关性分析表明,土壤pH值、可交换态铅含量、固定化效率与材料投加量之间呈正相关关系。在8 g·kg−1投加量下,BC-nZVI和BC-nFe3O4处理组下土壤可交换态铅含量分别降低了77%和55%。同时,采用土柱淋溶实验模拟酸雨条件下添加固化剂对Pb迁移的影响。结果表明,酸雨活化了土壤中的铅,增加了铅的迁移,添加铁改性生物炭后可减少土壤中弱酸可提取态铅的含量。其中,BC-nZVI对土壤中Pb的固定效果最显著。首先,BC-nZVI的加入提高了土壤pH,降低了Pb的溶解度。nZVI具有较强的吸附性和还原性,Pb先被BC-nZVI吸附,表面Fe0与铅发生反应。nZVI改性后的生物炭在土壤中易分散、孔隙度高、比表面积大、反应活性高,并通过离子交换、沉淀作用、络合作用固定Pb。
5) 对复合重金属污染土壤的修复。土壤重金属污染呈复杂和多样化,通常会以多金属复合污染的形式存在。潘亚男等[97]以凤眼莲为原材料制备铁改性生物炭,研究了其对复合污染土壤中砷、汞、镉的固定化。与原始生物炭相比,铁改性生物炭的加入降低了土壤砷、汞、镉可交换态和碳酸盐结合态的含量,修复机制可能涉及表面吸附、配位基交换作用、表面官能团络合作用等。PAN等[98]以悬铃木和死猪尸体为原材料制备绿色悬铃木生物炭 (GWB) 和猪生物炭 (PB) ,并对其进行三氯化铁改性,施用于砷铅复合污染土壤。结果表明,与对照组相比,Fe-GWB和Fe-PB处理后土壤中有效态As含量分别降低了32.8%和35.9%,铁改性生物炭的添加降低了土壤pH值,导致土壤颗粒正电荷的增加,增强了对阴离子As的静电吸附作用,铁改性生物炭上的官能团,包括—NH、—OH和—COOH等与As离子形成稳定络合物。同时,由铁改性生物炭产生的铁氧化物可通过共沉淀作用固定土壤砷,所以生物炭经铁改性后固砷能力得到了提高。而与铁改性生物炭相比,原始生物炭在固定铅方面更有效。Fe-GWB和Fe-PB降低了土壤pH,提高了Pb在土壤中的溶解度,增加了Pb的迁移率,并且该研究中原始生物炭比铁改性生物炭阳离子交换量更高,通过离子交换固定铅的能力更强,与从原始生物炭上释放出来的磷酸根离子形成沉淀也是Pb固定化的主要原因。WANG等[58]以稻草、小麦秸秆和玉米秸秆为生物炭原材料制备了三氯化铁改性生物炭,对As(V)和Cd(II)复合污染土壤进行了修复试验。铁改性生物炭对镉砷的固定效率因原料类型、培养时间、投加量而异,与单一重金属污染不同,As(V)和Cd(II)在生物炭改性土壤上的拮抗和协同作用更复杂。结果表明,土培第10天,铁改性玉米秸秆在10%投加量下对Cd(II)和As(V)固定化效果最好,固定效率分别达到63.21%和95.1%。铁改性生物炭改良后土壤的pH值和有效态铁含量均高于原始生物炭处理组,有效态铁能促进重金属在铁氧化物和氢氧化物上的分布,土壤性质的改变间接影响重金属的固定。固定化效率动态结果表明,重金属与活性中心之间的吸附竞争、表面络合和沉淀作用是一个复杂的动态过程。As(V)的存在可能会提高铁改性生物炭对Cd(II)的去除率,负电荷的静电吸引作用和Fe-As-Cd络合物的形成都有助于Cd(II)的去除。生物炭表面负载的铁量为重金属固定提供了更多的活性中心和表面电荷,调节了Cd(II)和As(V)的固定化,铁改性生物炭在吸附Cd(II)后会发生表面电荷反转现象。随着铁改性生物炭对Cd(II)的吸附,表面对As(V)的吸附减少。
-
土壤微生态不仅能反映土壤的功能和肥力,更是反应土壤环境中重金属毒性的重要指标。铁改性生物炭已被广泛应用于重金属污染土壤环境的修复。但同时,铁基纳米颗粒对土壤微生态的毒性也逐渐引起人们的关注。学者们在探究铁改性生物炭钝化土壤重金属潜力的同时,也考察了对土壤微生态的影响。然而,目前关于铁改性生物炭通过作用于土壤微生态进而间接影响重金属固定的研究还较少,因此,微生物在铁改性生物炭对重金属污染的修复过程中所扮演的角色尚不明确。
-
WEN等[104]探究了铁改性悬铃木生物炭对水稻土中砷、镉、铅生物有效性及土壤酶的影响。结果表明,原始生物炭的多孔结构为微生物提供了更好的生长环境,提高了土壤脲酶和过氧化氢酶的活性。同时,原始生物炭处理组提高了土壤pH,也可能是促进土壤脲酶和过氧化氢酶的活性的原因。铁改性生物炭处理组土壤pH减小,高浓度的Cl−增加了土壤离子浓度,抑制了土壤脲酶和过氧化氢酶的活性。殷西婷[105]制备铁改性松木生物炭,探究了其对砷污染土壤中赋存形态和酶活的影响。结果表明,施用松木生物炭和铁改性生物炭均促进了土壤中脲酶、碱性磷酸酶和过氧化氢酶的活性。生物炭可增加土壤pH和有机质含量,为微生物的生存提供营养物质,同时增强土壤通气和持水能力,有利于土壤微生物的生长和代谢,缓解砷对土壤酶活的抑制。PENG等[99]制备了纳米零价铁改性生物炭 (nZVI@BC) 、硫化亚铁改性生物炭 (FeS-NPs@BC) 、四氧化三铁改性生物炭 (Fe3O4-NPs@BC) 材料用于铅污染土壤的修复,并探究了铁改性生物炭材料对土壤酶的影响。结果表明,所有处理组均提高了转化酶活性,但是FeS-NPs@BC显著降低了土壤脱氢酶、脲酶、FDA水解酶活性,nZVI@BC显著降低了土壤脲酶活性,Fe3O4-NPs@BC显著提高了土壤脱氢酶、脲酶、蔗糖酶、FDA水解酶活性,提高了重金属污染土壤的质量。
-
1) 对微生物量的影响。WU等[41]以桉树木屑和猪粪为原料制备磁性生物炭,实验证明原始生物炭能增加土壤养分的有效性,并为微生物提供栖息地,从而增加了土壤微生物生物量。然而,磁性生物炭降低了真菌和细菌的生物量,细菌生物量下降尤其显著。这是由于与真菌相比,细菌对铁氧化物更为敏感。PENG等[99]发现硫化亚铁改性生物炭 (FeS-NPs@BC) 增加了土壤细菌数量,促进了微生物的生长。纳米零价铁改性生物炭 (nZVI@BC) 和四氧化三铁 (Fe3O4-NPs@BC) 改性生物炭具有一定的微生物毒性,降低了土壤细菌数量。Fe3O4对土壤微生物的影响较小,nZVI产生的Fe2+/Fe3+和活性氧会导致微生物的细胞膜破坏和氧化应激损伤,对土壤微生物量不利。FeS中硫元素的氧化能提供更富营养的土壤环境,同时也会降低Fe2+/Fe3+对土壤微生物的影响,促进微生物的生长。ZHANG等[106]研究了在砷污染土壤中,Fe3O4改性生物炭对土壤理化性质和微生物量的影响,发现铁改性生物炭影响土壤微生物的生物量是通过改变土壤C:N,而不是改变土壤pH来实现的。同时,土壤有机碳与土壤微生物总量呈显著负相关,Fe3O4改性生物炭显著降低了土壤微生物总生物量和土壤细菌、真菌、放线菌和原生动物的生物量。这表明铁改性生物炭对土壤微生物量和土壤理化性质的影响不同于单独使用生物炭和Fe3O4的叠加效应。
2) 对微生物群落的影响。WU等[72]探究了硫铁改性生物炭 (SF-BC) 在镉污染土壤中的固定化效果及对微生物群落的影响。与对照组相比,铁改性生物炭处理组增加了微生物物种的丰富度和多样性,显著提高了微生物Chao1、observed、Shannon和Simpson多样性指数。同时,变形菌门、拟杆菌门、放线菌门的相对丰度增加,而酸杆菌门和芽单胞菌门的相对丰度减少。PENG等[99]发现,与对照组相比,只有nZVI处理组对变形菌门的相对丰度有不利影响。但nZVI@BC处理组实验结果表明,生物炭的存在可削弱这种不利影响。其余处理组土壤变形菌的相对丰度都高于对照,这是由于修复后土壤环境中营养物质含量较高,有效重金属含量较低的原因;除nZVI处理组的放线菌和FeS-NPs处理组的糖化菌外,其余各组放线菌和糖化菌的相对丰度均降低。除Fe3O4-NPs处理组外,其他土壤样品中拟杆菌门的相对丰度均有所增加。其中,nZVI和FeS-NPs处理组较对照组显著增加,说明nZVI和FeS能促进拟杆菌门的生长与土壤中铁含量的增加有关。同时,FeS-NPs和FeS-NPs@BC(T5)处理组中酸杆菌门的百分比明显升高,而绿弯菌门的百分比下降。WU等[41]发现,与未改性生物炭相比,磁性生物炭中氧化铁的存在提高了土壤团聚体的稳定性,但降低了氧的有效扩散,不利于需氧细菌的增殖,降低了需氧菌的丰度。LIU等[107]制备纳米零价铁改性氨基生物炭 (ABC/NZVI) 应用于砷污染水稻土的修复,同时研究了水稻全生育期根际微生物群落的动态变化,发现ABC/NZVI对根际微生物群落有显著影响。在分蘖期,ABC/NZVI处理组土壤中细菌比例提高了175%,ABC/NZVI处理组土壤中地杆菌的相对丰度是对照组的两倍。由于地杆菌具有使用氧化铁作为电子受体的能力,而ABC/NZVI中的纳米零价铁氧化导致土壤氧化铁含量升高,导致地杆菌的增加。在分蘖期和成熟期,施用ABC/NZVI后抑制了与氮素转化相关的亚硝化球菌的丰度,亚硝化球菌的比例分别减少了61%和20%。土壤氮素流失减少,提高了水稻氮素利用率。
-
1) 总结了铁改性生物炭材料的制备方法,但关于影响制备参数的信息还相对有限。其中,优化合成条件尤为重要,这决定了铁改性生物炭的性能及其去除土壤中重金属的能力。同时,铁改性生物炭材料产量偏低,仍需开发适用于大规模应用的绿色合成方法,避免造成环境污染。
2) 与单一重金属污染土壤相比,复合重金属污染土壤具有特殊性、复杂性。铁改性生物炭在影响复合污染土壤中重金属迁移率方面的作用尚不清楚。例如,在As(V)的存在下对铁改性生物炭固定Pb没有显著影响,但As(V)的存在有助于铁改性生物炭对Cd的去除。铁改性生物炭修复重金属复合污染土壤过程中的协同和拮抗作用规律有待进一步探究。
3) 铁改性生物炭对土壤酶、土壤微生物的生物量、活性、群落结构,以及对参与碳氮等循环的功能基因研究有待深入。相关铁改性生物炭通过作用土壤微生态间接影响土壤中重金属固定的研究甚少,且微生物在修复过程中所扮演的角色尚不明确。同时,可考虑采用宏基因组学等手段,获取高分辨率功能代谢谱和物种组成谱,在组成和功能水平上深入挖掘铁改性生物炭修复重金属污染土壤过程中的微生物学机制。
4) 现阶段所开展的修复实验,大都基于实验室进行异位修复,铁改性生物炭实际的原位修复应用案例还较少。铁改性生物炭在不同环境条件下可能出现不同行为。由于土壤污染修复是一个长期动态过程,铁改性生物炭材料在修复过程中可能出现稳定性降低、短期固定化后释放固定化成分的风险。后续应考虑铁改性生物炭对污染土壤的长期修复效果及环境效应,以确保土壤环境质量稳定安全。
5) 联合修复不仅能提高修复的效率和速率,还能打破单一修复方法的局限,是研究土壤修复技术的新方向。目前,铁改性生物炭与植物联合修复重金属污染土壤的案例较为少见,还有待进一步深入探索,以期完善不同类型重金属超积累植物与铁改性生物炭联合修复的研究。
Preparation of iron-modified biochar and its application in heavy metal contaminated soils
- Received Date: 28/01/2022
- Available Online: 31/12/2022
-
Key words:
- iron-modified biochar /
- heavy metal /
- soil remediation /
- mechanism of immobilization /
- microecology
Abstract: At present, biochar has been widely used in the remediation of heavy metal contaminated soil, but its practical application is limited due to the shortcomings of large particle size, poor mechanical properties, and less adsorption sites. It was found that iron-modified biochar prepared by iron-based compounds and biochar could optimize the performance of biochar, make up for the lack of biochar repair ability, and show excellent heavy metal passivation effect. In this paper, the preparation and remediation of iron-modified biochar for heavy metal contaminated soil were reviewed. Firstly, the preparation and characterization methods of iron-modified biochar were introduced, and the main influencing factors (raw materials, temperature, dosage, time, etc.) in the process of preparation and remediation were summarized. Then, the immobilization mechanism of iron-modified biochar for heavy metals was elucidated from the aspects of electrostatic interaction, ion exchange, complexation, oxidation-reduction, and coprecipitation. The effects of iron-modified biochar on soil microecology were analyzed. Finally, the possible problems in the application of iron-modified biochar materials were pointed out, in order to provide theoretical basis for the application of iron-modified biochar in remediation of heavy metal contaminated soil.






 DownLoad:
DownLoad:
