-
溴酸盐(
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ 在电化学还原
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ 本研究以CF作为基底,通过原位生长制备CoP与CF耦合自支撑电极(CoP/CF),该电极不使用粘结剂,增加了电子传递速率和电催化产H*性能,具备较好的电还原
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ -
溴酸钠(NaBrO3)、硫酸钠(Na2SO4)、丙酮(CH3COCH3)、无水乙醇、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、磷酸二氢钠(NaH2PO4)等药剂均从国药集团化学试剂有限公司购买,药品均为分析纯且在使用前未经任何前处理。泡沫钴(CF)从北京鹏达科技有限公司采购,其面密度为600 g·m2,孔径为450 μm,厚度约0.5 mm。
-
CoP/CF自支撑电极以CF作为钴源和载体,以NaH2PO4作为磷源,通过高温原位一步磷化法制备。具体方法:取一小片有效面积为5 cm2 (5 cm ×1 cm)的CF,用乙醇、盐酸(1 mol·L−1)、丙酮以及超纯水依次清洗数次去除其表面的杂质,在鼓风干燥箱中60 ℃烘干12 h。将 0.5 g NaH2PO4、CF、0.5 g NaH2PO4依次按照5 cm的间距排列后,N2氛围保护下在管式炉(OTF-1200X, HF-Kejing, China)中进行高温磷化(300~450 ℃),并将在300、350、400和450 ℃下制备的复合电极分别记作CoP/CF-300、CoP/CF-350、CoP/CF-400和CoP/CF-450。
-
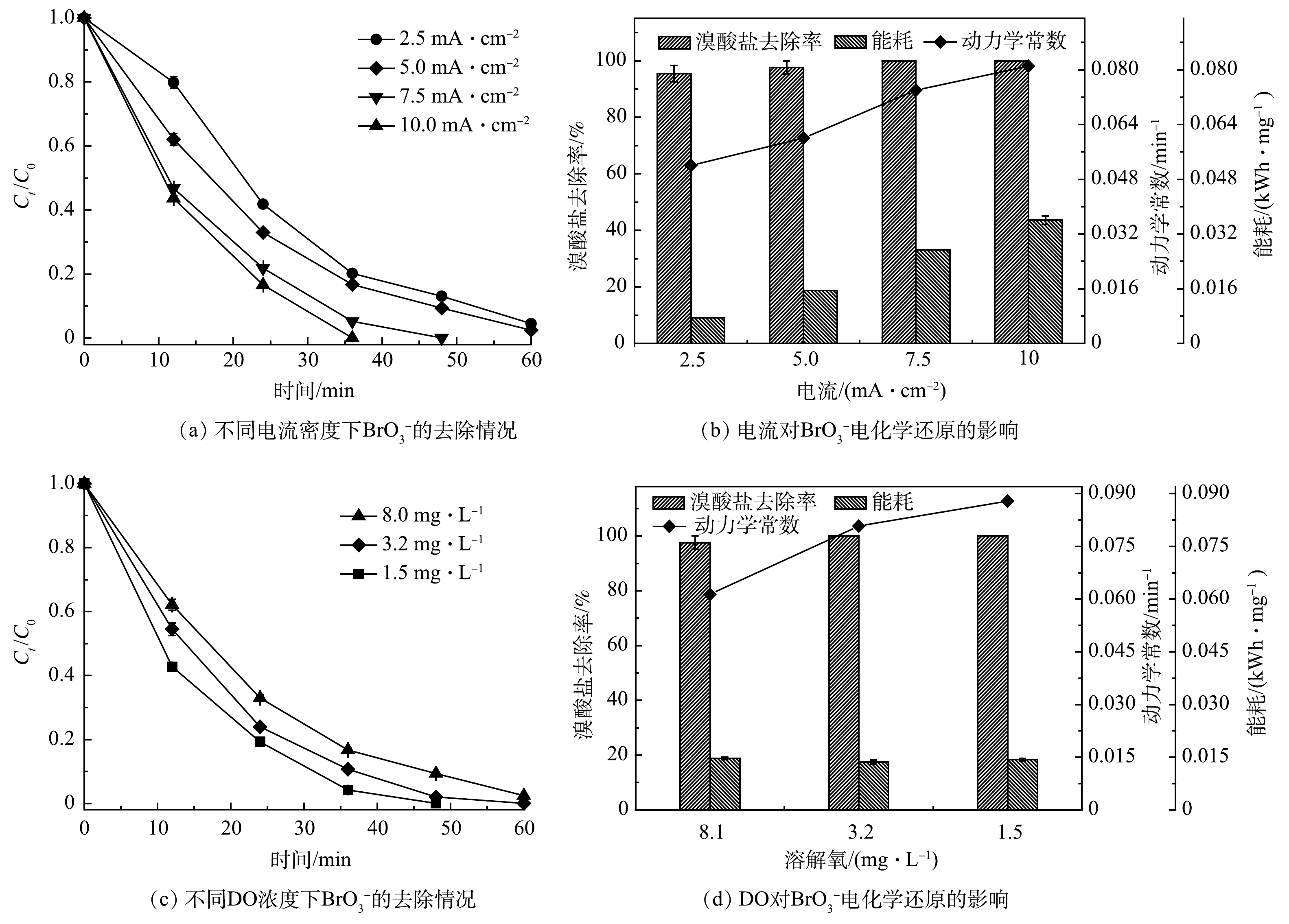
电化学还原BrO3−实验均在直流电源(ATTEN, PPS3005T-3S, China)提供的恒定电流下开展(电流密度2.5~10 mA·cm−2),槽压为~18.0 V,50 mM Na2SO4为电解质,
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ -
溶液中
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ 电极中的Co和P的价态采用X-射线光电子能谱仪(XPS, Escalab 250Xi, Thermol scientific, USA)对Co 2p和P 2p进行分析;电极的表面形貌和形态利用扫描电子显微镜(SEM, FEI QuANTA 200 CZ, Netherlands)进行观察;晶体结构采用X射线衍射(XRD, Ultima IV, Rigaku, Japan)进行分析,以JCPDS (Joint Committee on Powder diffraction Standards) 数据库为参考,采用MDI (MDI) Jade 5.0对衍射峰和晶相进行分析。
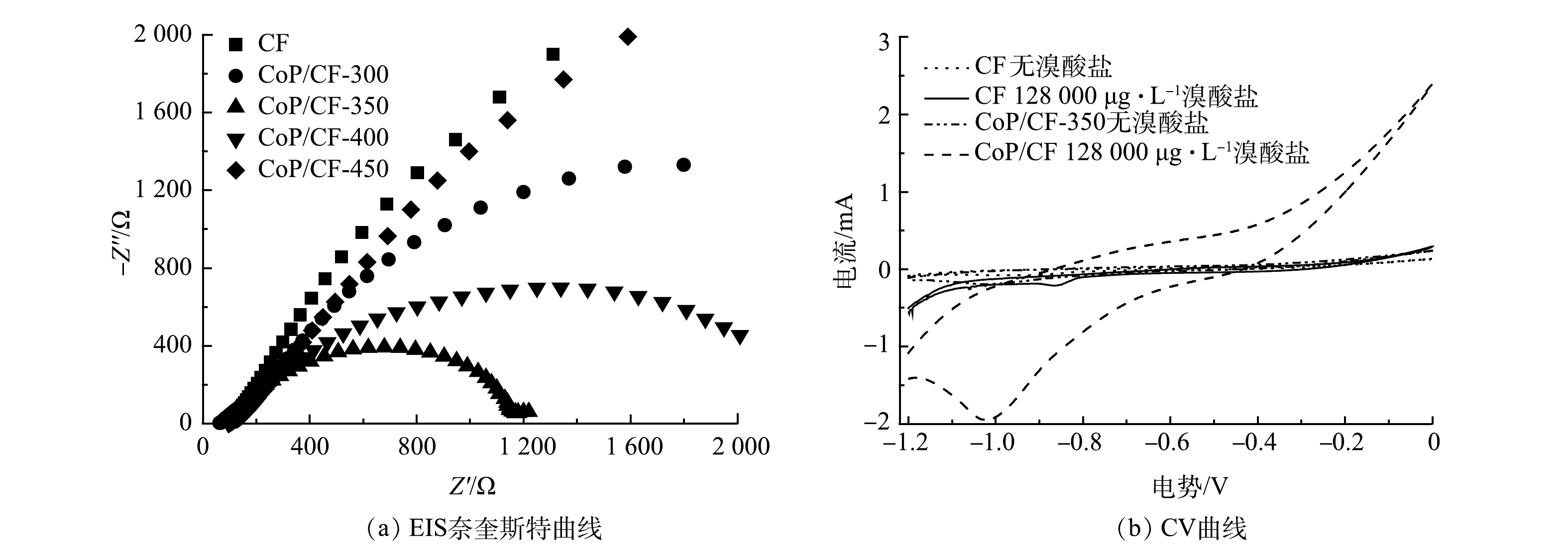
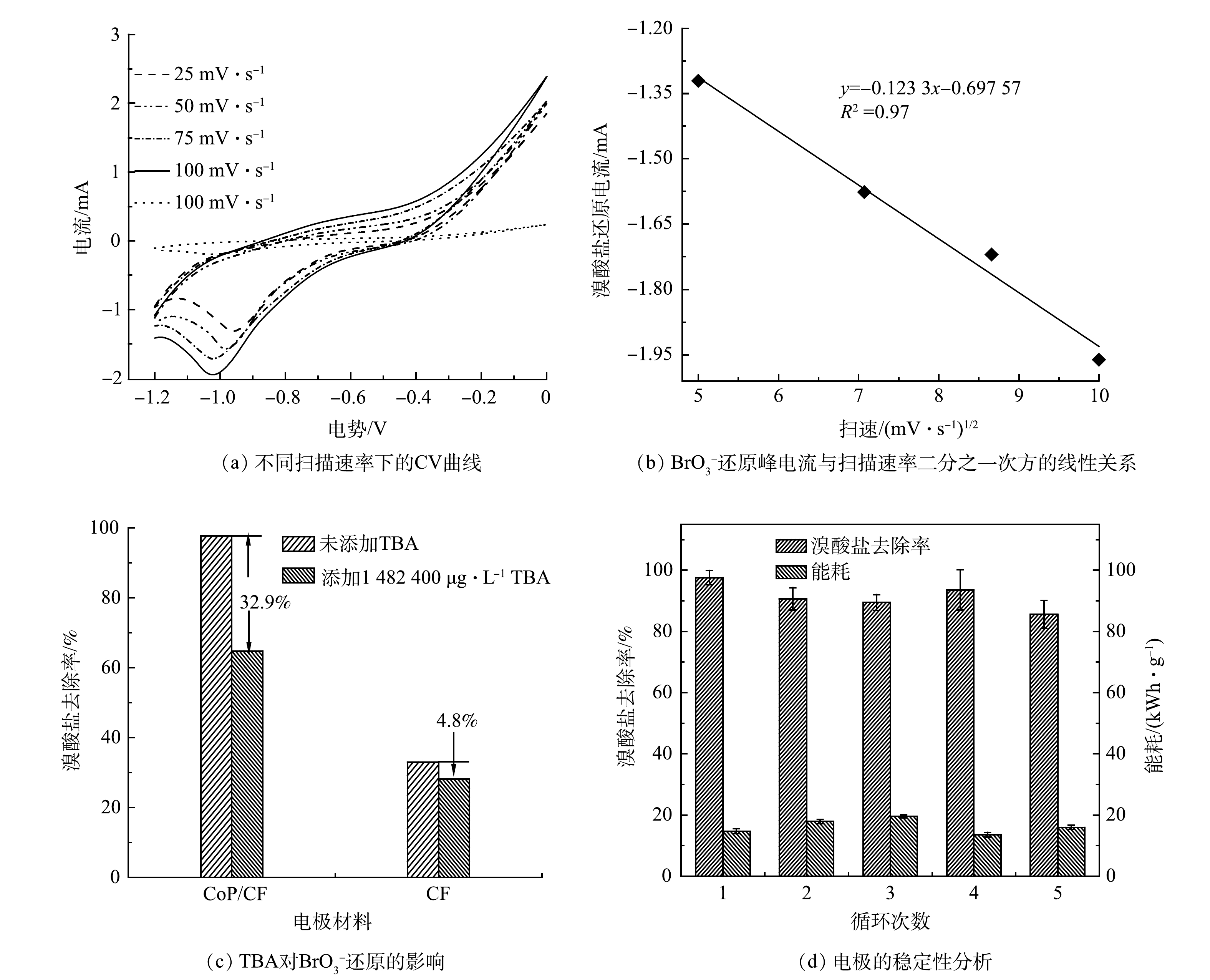
电化学阻抗谱(EIS)奈奎斯特图中弧半径大小可以表示电解过程中电极表面电子传输速率的快慢[24]。本研究采用特定大小的CoP/CF(1 cm2)为工作电极在电化学工作站(辰华CHI7760E,中国上海)上利用三电极体系进行EIS图谱和循环伏安曲线(CV)分析,其中EIS的扫描频率为105~10−2 Hz,对电极为Pt片,参比电极是Ag/AgCl。CV的扫描范围为−1.2~0 V(以Ag/AgCl为参比电极)。
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ 式中:R为
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ -
本研究以NaH2PO4为磷源,在高温下将CF直接磷化合成CoP/CF自支撑电极。在此过程中CF不仅作为CoP的Co源,还作为CoP的载体或支撑体。显然,这种原位生长方式在不使用粘合剂的条件下可实现CoP和CF的紧密接触,提高了电化学氧化还原反应中的电子转移速率,从而改善了电极的电化学性能[15]。如图1(a)和图1(b)所示,原始CF具有多孔骨架结构且表面光滑。高温磷化后的CF保持了其原有的宏观结构,但在其表面生长出了均匀的纳米颗粒(图1(c)和图1(d))。该变化可能是由于高温下CF表面发生结构塌陷和再固结形成CoP所致[25]。
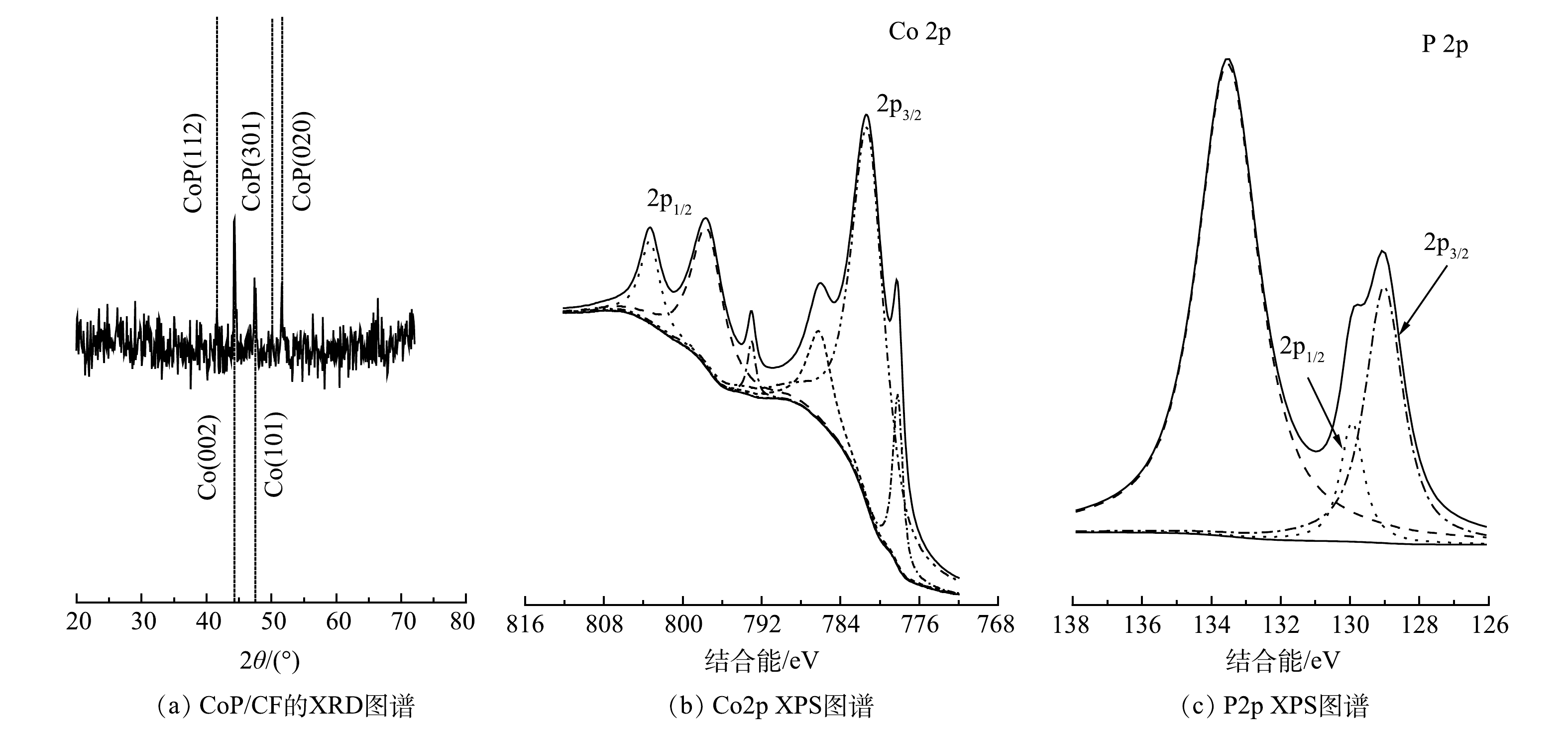
为了证明CoP成功地原位生长在CF表面,利用X射线衍射(XRD)对CoP/CF自支撑电极表面的晶相和主要物质成分进行分析(图2(a))。在CoP/CF的XRD图谱中,在衍射角为44.51°和47.37°处有2个明显的衍射峰,这2个峰与金属钴的标准特征峰的位置一致,分别对应钴的(002)和(101)晶面(JCPDS 89-7373)。此外,在衍射角为40.81°、50.27°和51.4°处观察到3个峰,分别对应CoP的(112)、(301)和(020)晶面(JCPDS 65-2380)。上述结果证明,经过高温磷化后CoP纳米颗粒成功地原位生长在CF表面,CoP/CF自支撑电极制备成功。
为了进一步分析电极的表面元素组成及相应的价态,采用X射线光电子能谱(XPS)对CoP/CF进行了表征,结果如图2(b)和图2(c)所示。Co2p图谱中结合能为793.0 eV和778.1 eV处对应金属钴的特征峰。此外,结合能为781.2 eV和797.5 eV以及位于786.1 eV和803.3 eV的2个肩峰分别对应钴的氧化物[15]。从P2p的图谱中可以看出,结合能在129.5 eV和130.3 eV处的峰对应磷化物[26-27]。而位于134.1 eV的峰对应的是磷的氧化物。钴和磷的氧化物的出现主要是材料在制备过程中被空气氧化所致。上述结果进一步证明:高温磷化的方法能够直接将CoP原位生长在CF的表面,从而获得CoP/CF自支撑电极。虽然在电极表面不可避免的存在少量磷和钴的氧化物,但不影响自支撑电极的结构和组成。
-
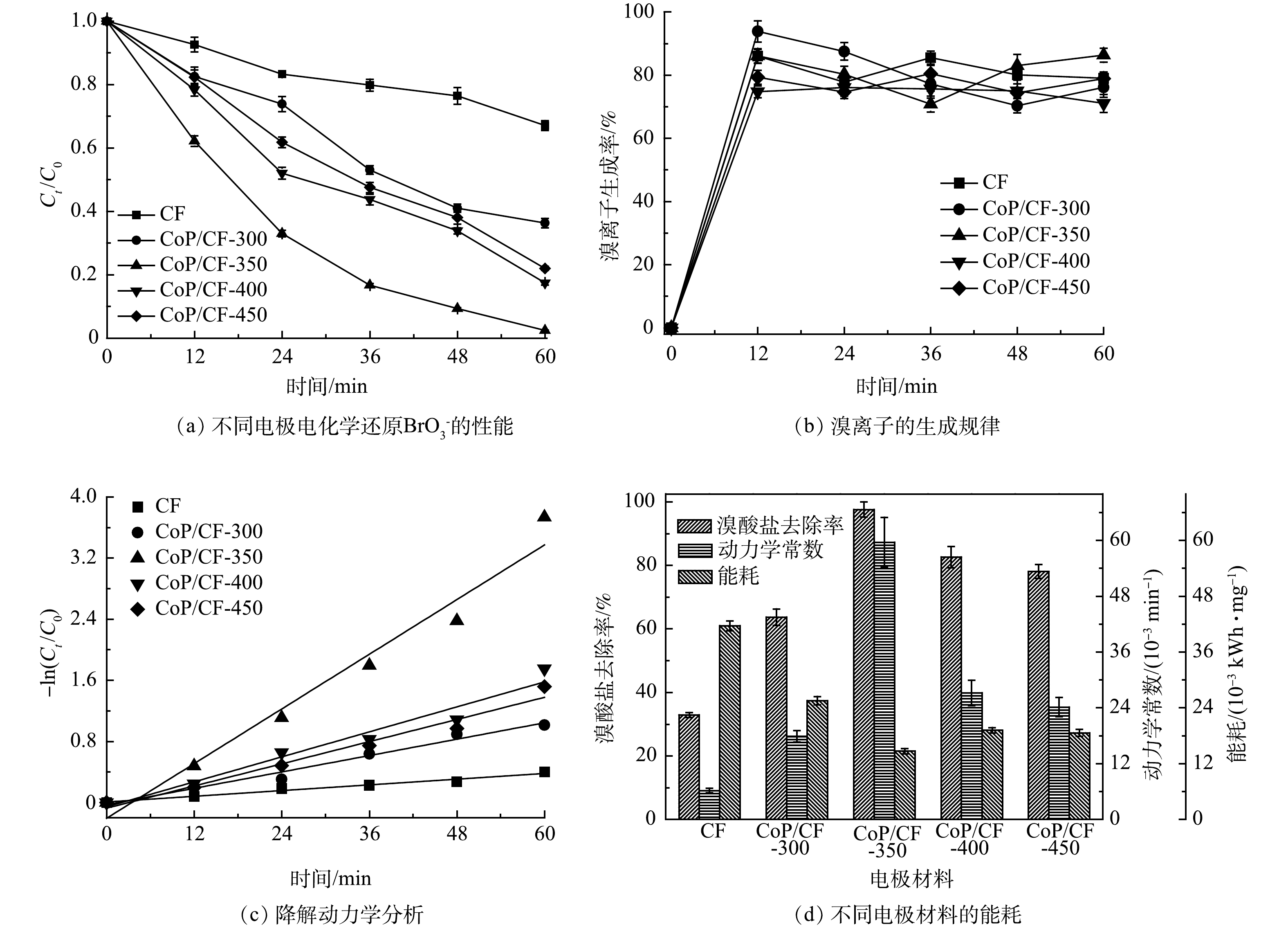
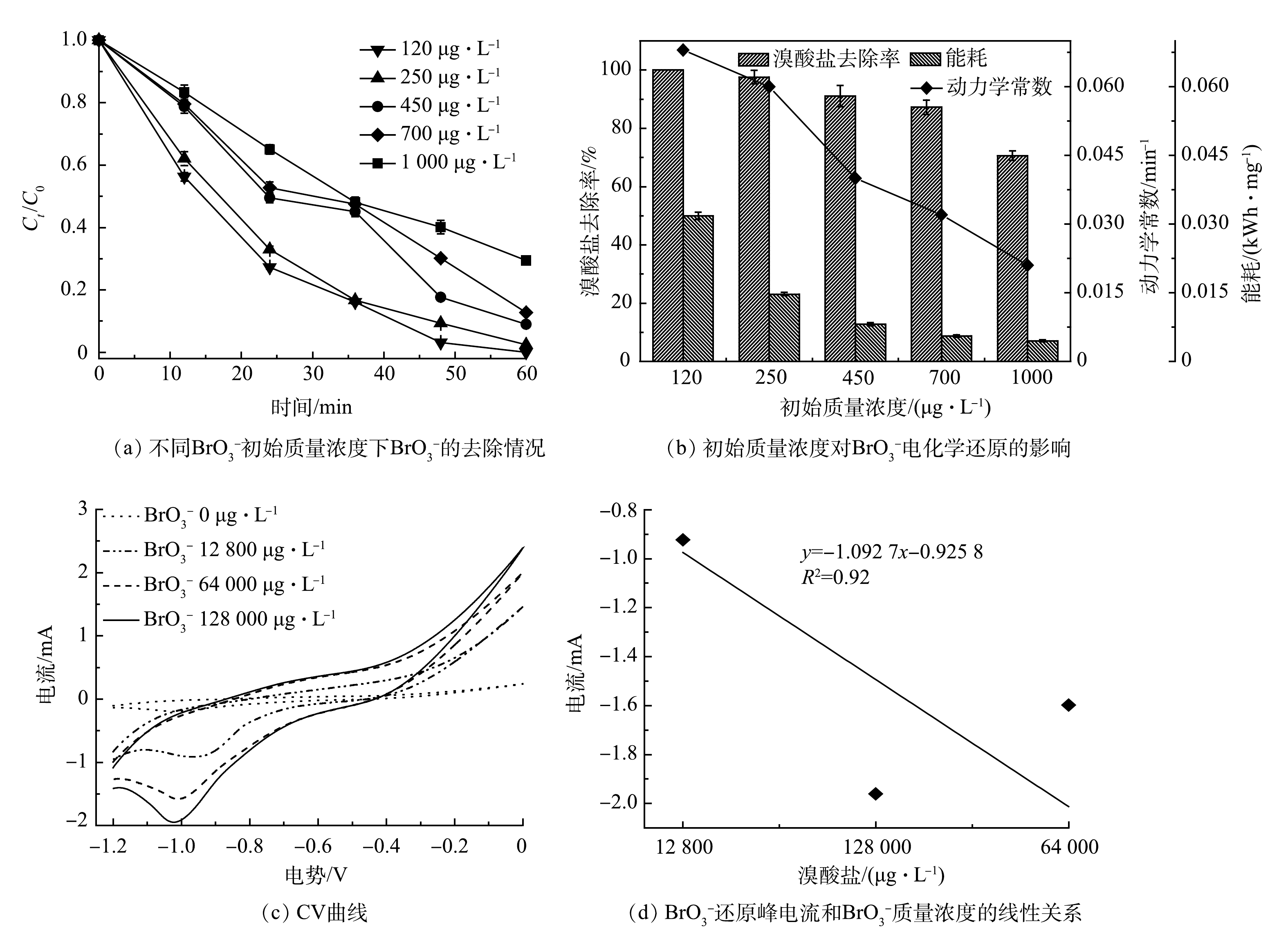
在本研究中,CoP/CF自支撑电极的理化和电化学特性主要受制备的磷化温度所影响。为优化制备条件,本研究使用在不同温度下(300~450 ℃)得到的CoP/CF自支撑电极作为阴极开展电化学还原
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ 有研究[16]表明,CoP在电化学反应过程中不仅可以作为电子传递媒介或桥梁促进电子传递,还能作为催化剂电催化还原H+产生H*。H*作为一种强还原物质可以将
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ -
本研究中,电化学还原
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ -
在电化学反应过程中,溶液中溶解氧(DO)会与
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ -
在实际水体中,
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ 如图6(c)所示,
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ -
电化学还原
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ CoP在电化学反应过程中不仅能够促进电子传递,还可以电催化还原H+产生H*。因此,本研究以CoP/CF-350和CF电极分别作为阴极,在添加一定浓度叔丁醇(TBA)下开展电化学还原
$ {\rm{BrO}}_3^ -$ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ 综上所述,CoP/CF自支撑电极电化学还原
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_{3{\rm{ads}}}^ - $ ${\rm{BrO}}_{3{\rm{ads}}}^ - $ ${\rm{BrO}}_3^ - $ -
电极的稳定性是电化学反应的一个重要指标,其不仅包括电极的性能稳定,也包括电极在反应过程是否会有溶出或渗出从而导致水体的二次污染。为了有效地评估电极的可持续利用性能,本研究在最优条件下(350 ℃磷化CoP/CF电极,电流密度5.0 mA·cm−2,溴酸盐初始质量浓度250 μg·L−1),在反应60 min内开展了CoP/CF-350电极电化学还原
${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ ${\rm{BrO}}_3^ - $ -
1)当磷化温度为350 ℃时,CoP/CF自支撑电极对
$ {\rm{BrO}}_3^ - $ $ {\rm{BrO}}_3^ - $ 2) CoP/CF自支撑电极电化学还原
$ {\rm{BrO}}_3^ - $ $ {\rm{BrO}}_3^ - $ $ {\rm{BrO}}_3^ - $ $ {\rm{BrO}}_3^ - $ 3) CoP/CF自支撑电极电化学还原
$ {\rm{BrO}}_3^ - $ $ {\rm{BrO}}_3^ - $ $ {\rm{BrO}}_3^ - $ $ {\rm{BrO}}_3^ - $ 4) CoP/CF自支撑电极在循环5次后仍然保持较高的电化学活性。
Efficient electrochemical bromate reduction using cobalt phosphide self-supported cobalt foam electrode
- Received Date: 11/11/2021
- Available Online: 10/03/2022
-
Key words:
- CoP /
- self-supported electrode /
- electrochemical reduction /
- ${\rm{BrO}}_3^ - $ /
- reaction mechanism
Abstract: Exploring highly active and inexpensive electrode are the keys in electrochemical reduction of bromate (





















 DownLoad:
DownLoad:
