-
在传统的活性污泥法中,功能微生物生长容易受到环境条件的影响。有研究[1]表明,向反应器中添加载体,可以为微生物提供更多的附着点,微生物会与载体耦合形成稳定的微生物复合体,从而增加污染物的截留与功能微生物的持留效果,能够显著提高反应器的微生物生物量和耐冲击能力[2],可以充分发挥其原有的效率和优势,使得出水水质更稳定。
微生物在载体表面的增殖生化过程主要受到载体表面孔道结构分布的影响,复合微生物体形成的关键在于载体的选择[3]。最初的载体主要是鹅卵石、玻璃颗粒等颗粒状的材料[4],但随着生物膜的生长,颗粒载体的空隙会逐渐被堵塞,从而影响到载体内部的物质转化,因而近年来相关研究在选择载体时,会优先考虑具有较大孔隙、良好亲水性和生物亲和性的材料[5]。EROL等[6]利用壳聚糖纳米粒子作为载体固定漆酶,可以去除水溶液中96%的苯酚。TING等[7]使用藻酸盐-EM(功能微生物)复合微生物体系去除水中的铅(Pb),对于Pb的去除量可达4.011 mg·g−1。VANOTTI等[8]利用聚乙烯醇颗粒作为载体固定硝化污泥,
NH+4−N 活性炭是一种廉价易得的材料[10],具有丰富的孔隙结构,常被应用于吸附研究中,将其作为微生物载体具有一定的可行性。王真真等[11]固定微生物的研究结果表明,活性炭纤维的使用可以有效减少微生物损失;练文标[12]发现添加粉末活性炭的序批式活性污泥反应器在污泥驯化成熟稳定后,废水COD平均去除率可增加至90%,比普通反应器提高了10%,反应器的耐负荷冲击能力显著提高,其污泥膨胀和生物泡沫问题也得到了有效解决。WU等[13]发现,活性炭分子链上分布了大量的羟基、羧基等活性基团,对水体中带正电荷的污染物具有良好的络合吸附和絮凝作用,这些基团同样有利于细胞粘附和增殖[14-15]。因此,活性炭可以作为一种合适的生物膜载体,在降低成本的同时亦能更好地发挥复合生物体的优势[16]。此外,针对活性炭对微生物种群构成产生的影响进行系统性地研究,目前鲜有报道。
因此,根据课题组前期预实验,本研究选取中孔发达且比表面积较大的150目煤质活性炭作为孔隙尺寸和颗粒粒径较为合适的载体材料,在传统的序批式活性污泥反应器(sequencing batch reactor,SBR)中投加煤质活性炭构建活性污泥体系,通过对比实验组(投加材料)与对照组(不投加材料)的SBR在脱氮性能、复合微生物体表面形态和内部结构、反应器中EPS 含量及其主要微生物种群结构组成和关键脱氮除磷菌群的区别,探究了微生物体耦合活性炭在传统SBR中的脱氮增效机制,以期为强化生物脱氮提供参考。
HTML
-
实验装置为2套相同的圆柱形SBR,单个SBR装置由聚氯乙烯(PVC)材料制成,有效体积为7 L,每一周期的运行时间为12 h(进水0.5 h,曝气和搅拌反应10.0 h,静置1.0 h,排水0.5 h),处理水量为每周期4.8 L。反应器底部装有曝气头并设有机械搅拌装置,进出水均由蠕动泵间歇控制。将未添加载体的对照组标号为R1组,添加活性炭作为载体的实验组标号为R2组。
本实验中使用的菌种为本课题组实验室前期实验中分离得到的脱氮菌种。在经高压蒸汽灭菌锅灭菌2 h的生物培养液中加入菌种,于30 ℃的恒温培养箱中培养3~5 d得到实验菌液。
-
根据微生物的生长周期,SBR分为3个运行阶段:启动期(阶段 Ⅰ)、适应期(阶段 Ⅱ)和稳定期(阶段 Ⅲ),各阶段实验参数见表1。在每个SBR中接种1 L实验菌液,控制反应器内悬浮固体(mixed liquor suspended solids,MLSS)质量浓度为2 000 mg·L−1,运行温度维持在室温((25±2) ℃)。
反应器进水采用人工合成废水,由CH4N2O提供氮源(浓度为5.9~23.8 mg·L−1);由C6H12O6提供碳源(16.4~59.6 mg·L−1);KH2PO4作为磷源(3 mg·L−1),此外添加微量元素,包括10 mg·L−1EDTA-Na2·2H2O、1.5 mg·L−1 FeCl3·6H2O、0.2 mg·L−1 ZnSO4·7H2O、0.15 mg·L−1 CoCl2·6H2O、0.15 mg·L−1 MnCl2·4H2O、0.15 mg·L−1 CuSO4·5H2O、0.22 mg·L−1 Na2MoO4·2H2O、0.15 mg·L−1 NiCl2·6H2O、0.05 mg·L−1 H3BO3、0.15 mg·L−1 KI、10 mg·L−1 CaCl2和20 mg·L−1 MgSO4。调节合成废水的pH为7.0~7.3。
-
1)水质检测指标与方法 每隔24 h取反应器进出水进行检测,检测指标为氨氮(
NH+4 NO−2 NO−3 NH+4 NO−2 NO−3 2)胞外聚合物(EPS)的测定方法 胞外聚合物(extracellular polymeric substances,EPS)可以分为可溶性和结合态,主要成分为蛋白和多糖。EPS的提取参考钱玉兰[19]的实验方法,采用以牛血清白蛋白(BSA)为标准物的酚试剂法检测蛋白(PN)含量;采用以葡萄糖为标准物的硫酸-蒽酮法测定多糖(PS)含量。
3)复合微生物体形貌结构分析 本实验对于复合微生物体的前处理方法参考黄俊等[20]研究中所使用的方法,样品先后经过2.5%的戊二醛溶液与1%的锇酸溶液进行双固定,用梯度浓度(30%、50%、70%、80%)的乙醇溶液对其进行脱水处理,冷冻干燥,利用扫描电子显微镜(SEM;Supra55;Sapphire,德国;加速电压:0.02~30 kV)观察样品表面形貌。上述脱水后的样品继续使用Spurr包埋剂与丙酮处理过夜后在超薄切片机(EM UC7;Leica,德国)中切片,利用透射电子显微镜(TEM;Libra 120;Carl Zeiss,德国;加速电压:40~120 kV)观察其微观结构。
4)微生物群落结构多样性与差异性分析 反应器运行稳定后采集泥样进行微生物菌群结构分析,参考王彬浩[21]等的研究方法,使用 Power Soil DNA 试剂盒(Omega Bio-Tek,美国)提取微生物 DNA,利用 V3-V4 区通用引物 341F /805R 进行 PCR,将 DNA 扩增子连续测序接头,构建文库,利用 Illumina Miseq PE 250 平台进行成对末端测序(2×250)。对所得的数据利用SPSS软件(Statistical Product and Service Solutions)进行线性回归分析,根据P值进行数据之间的显著性检验。
1.1. 实验装置及实验菌种
1.2. 反应器运行方案
1.3. 检测参数与分析方法
-
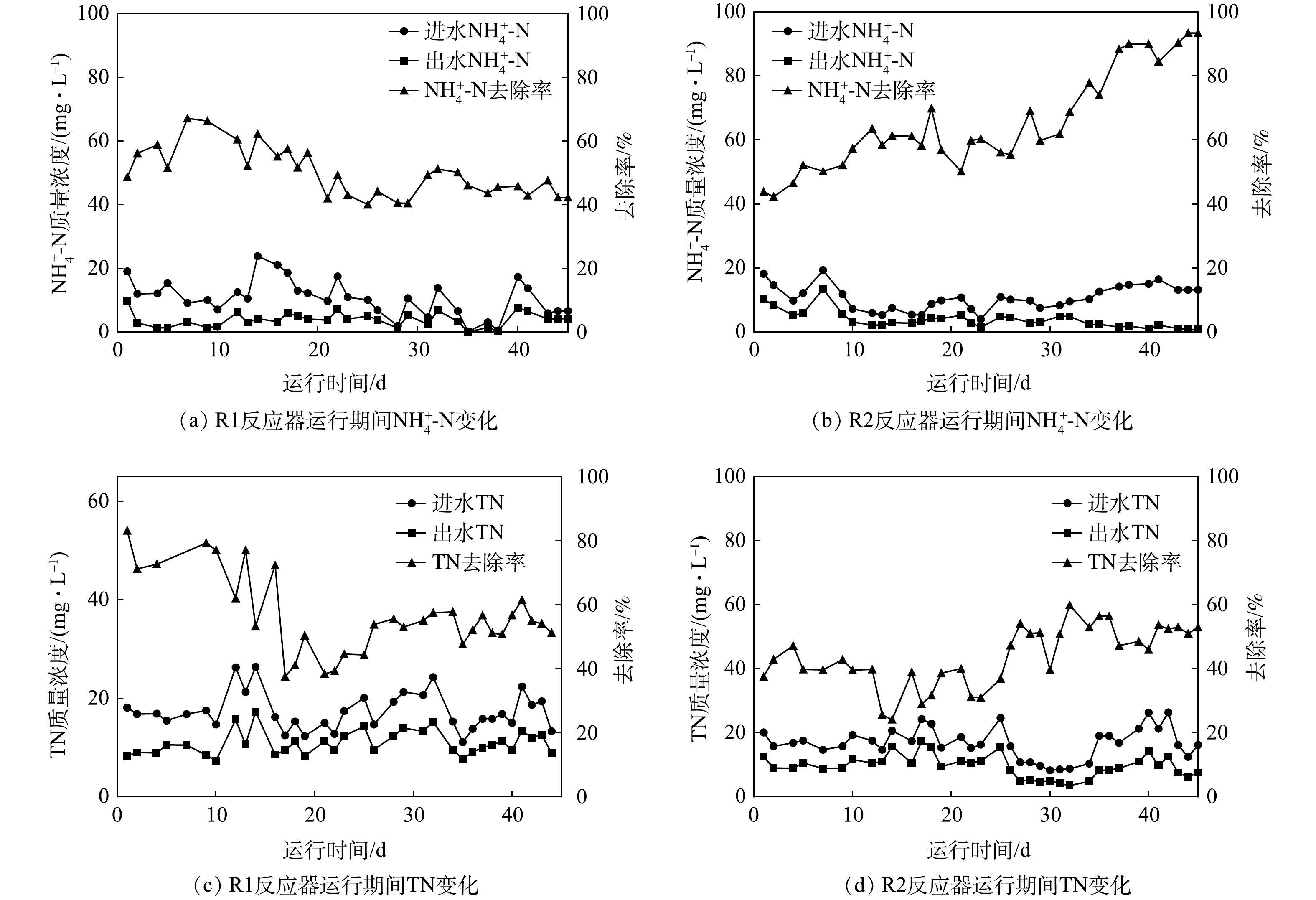
图1反映了R1和R2反应器在运行期间进出水
NH+4 NH+4 NH+4 NH+4 NH+4 NH+4 NH+4 NH+4 NH+4 NH+4 由此可以看出,活性炭在一定程度上提高了SBR对
NH+4 NH+4 NH+4 NH+4 NH+4 NO−2 NO−3 NO−2 NO−3 活性污泥法增加载体后,可以起到固定微生物、提高混合液过滤性能的作用,能够为污泥微生物提供稳定生长的惰性表面,显著提升生物量,增加停留时间[25],以上因素均能显著影响微生物群落结构组成,从而影响系统稳定性和脱氮效能。各种载体对污泥性能有不同的改善效果,载体材质、规格、形状、结构、表面亲水性等性质会显著影响微生物的富集和最终处置效果。根据已报道的研究结果可知,形成复合微生物体所用的载体材料不同,在相近条件下反应器中污泥驯化至稳定所需要的时间和反应器的脱氮能力也会有所不同。表3总结了一些投加不同载体对SBR污泥驯化稳定时长与氮去除效果的数据。由表3可以看出,本实验选用活性炭作为载体材料时污泥驯化至稳定的时间为45 d,短于目前的大部分研究中的驯化时间,反应器中的污泥体积指数较小,为96 mg·L−1。
煤质活性炭是均匀的煤粒经炭化、活化生产的多孔材料,其本身具有强度高、孔隙发达、比表面积大,尤其微孔容积大等优点,可为微生物提供定殖空间[26]。相比于普通活性炭材料,该材料除了对于污染物具有一定的吸附作用,还可以对水中物质含量变化起到一定缓冲作用,从而对反应器中微生物起到一定的保护作用。此外,活性炭动态吸附过程[27]可以使微生物与污染物接触时间延长。由于较大的比表面积能够吸附污染物到材料表面[28-29],使煤质活性碳和微生物可以以更大颗粒结构形成耦合体,从而减少水体通过耦合体时的阻力,因而可以获得更好的脱氮效果。可以看出,在投加煤质活性炭后,反应器不仅具有较优的脱氮性能,而且在缩短污泥驯化时间的同时使得污泥具有较好的沉降性。
-
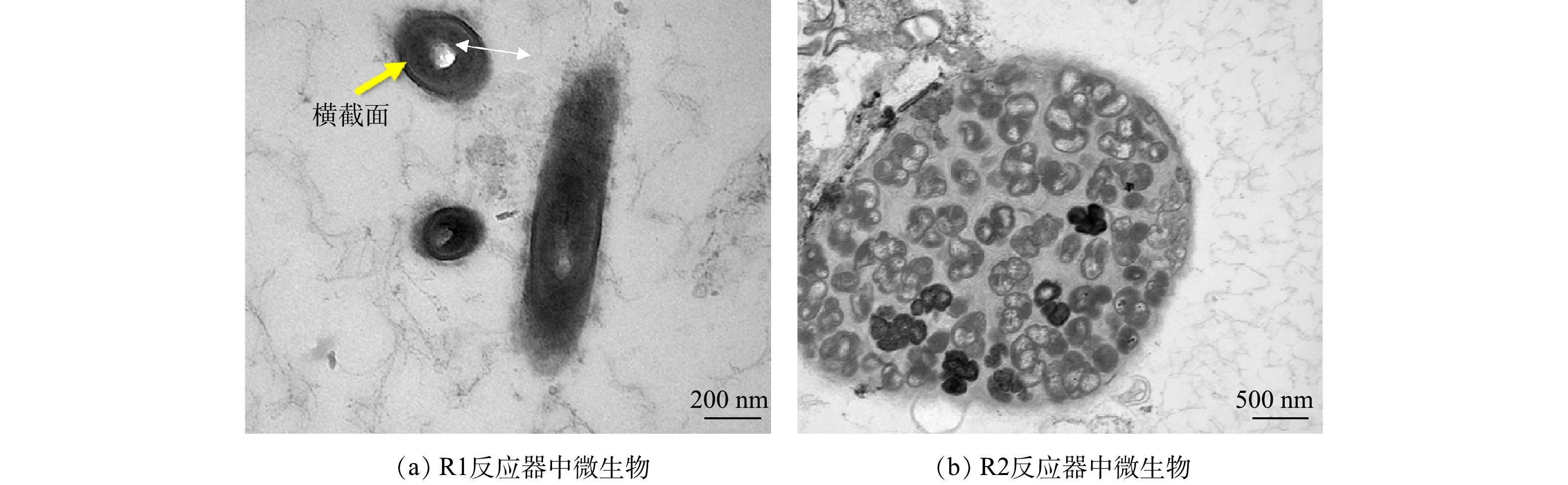
通过扫描电子显微镜(SEM)、透射电子显微镜(TEM)分别对原始煤质活性炭及R1和R2反应器中运行第45 天的污泥表面形貌特征和内部结构进行了观察和表征,结果分别如图2和图3所示。本实验采用的煤质活性炭材料(图2(a))成颗粒状且表面粗糙,具有较为丰富的孔隙结构,直径在115 μm左右。SEM测试结果表明,R1反应器(图2(b))中的微生物长度在1 μm左右,长度均一、短平,外表光滑,与张春雷等[33]在观察活性炭滤池中微生物特征时呈现的电镜图形态相似,但菌群呈现出游离状态,较为松散。由图2(c)可以看到,R2反应器中的微生物在活性炭材料的表面呈不规则网状团聚富集,形成结构紧密的复合微生物体。TEM表征结果表明,在同等倍数的视野下观察,R1反应器中(图3(a))微生物较为分散,呈长圆柱形,菌体平直、两端钝圆,长度在1 μm左右,横切面呈圆形,直径约为0.2 μm。结合上述SEM结果可推测,其属于短杆菌[34]。而R2反应器(图3(b))中可以看到在活性炭团聚富集的菌体。此时R2反应器的脱氮性能相比于不投加载体组更优,由此推测活性炭作为一种适合微生物生长的载体材料,形成了活性炭复合微生物体。
-
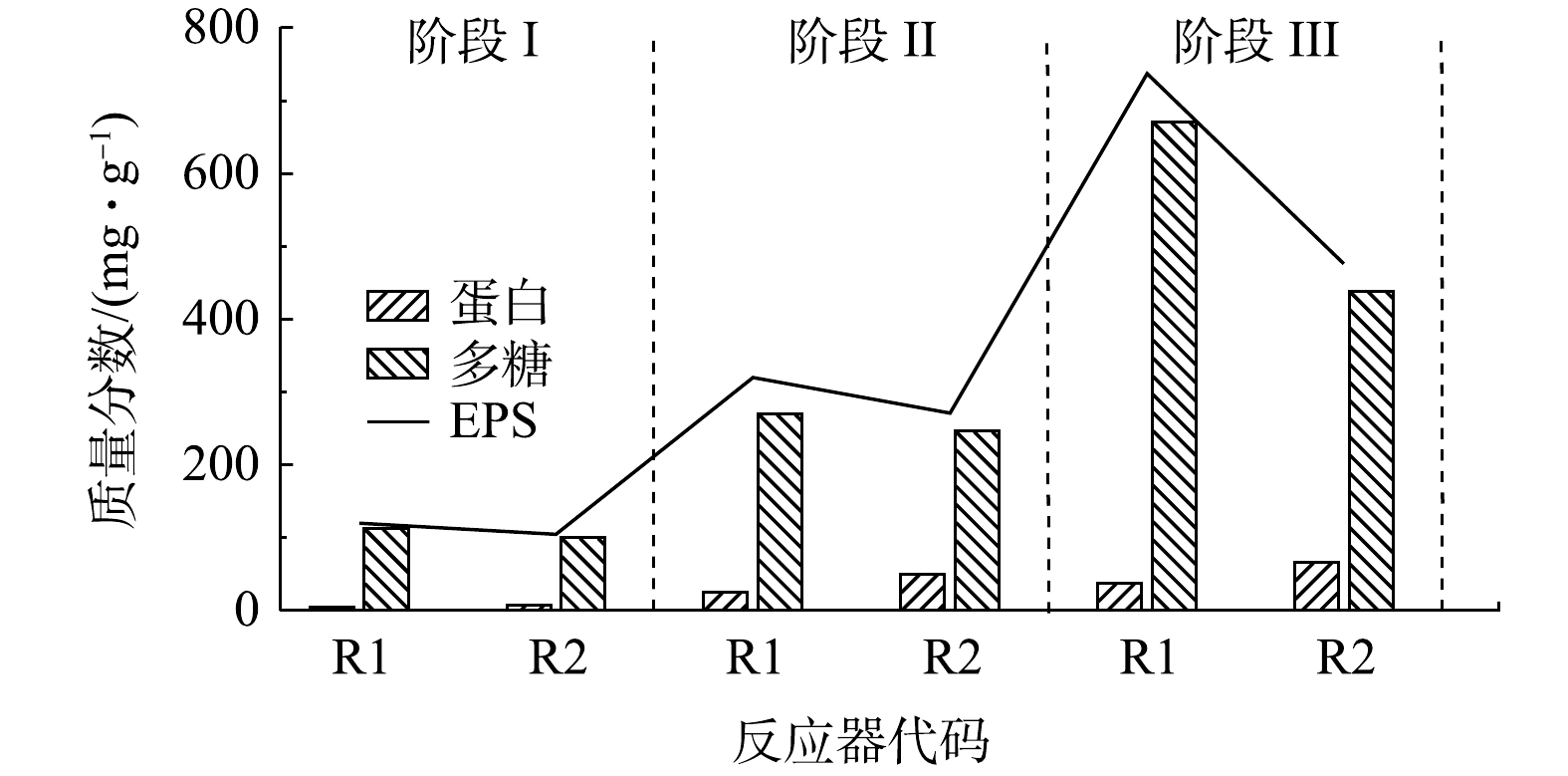
1)对EPS含量的影响。胞外聚合物(extracellular polymeric substances,EPS)的变化可以代表微生物主动运输和扩散等传质活动的变化[31],其变化会导致脱氮复合微生物系统在反硝化过程中
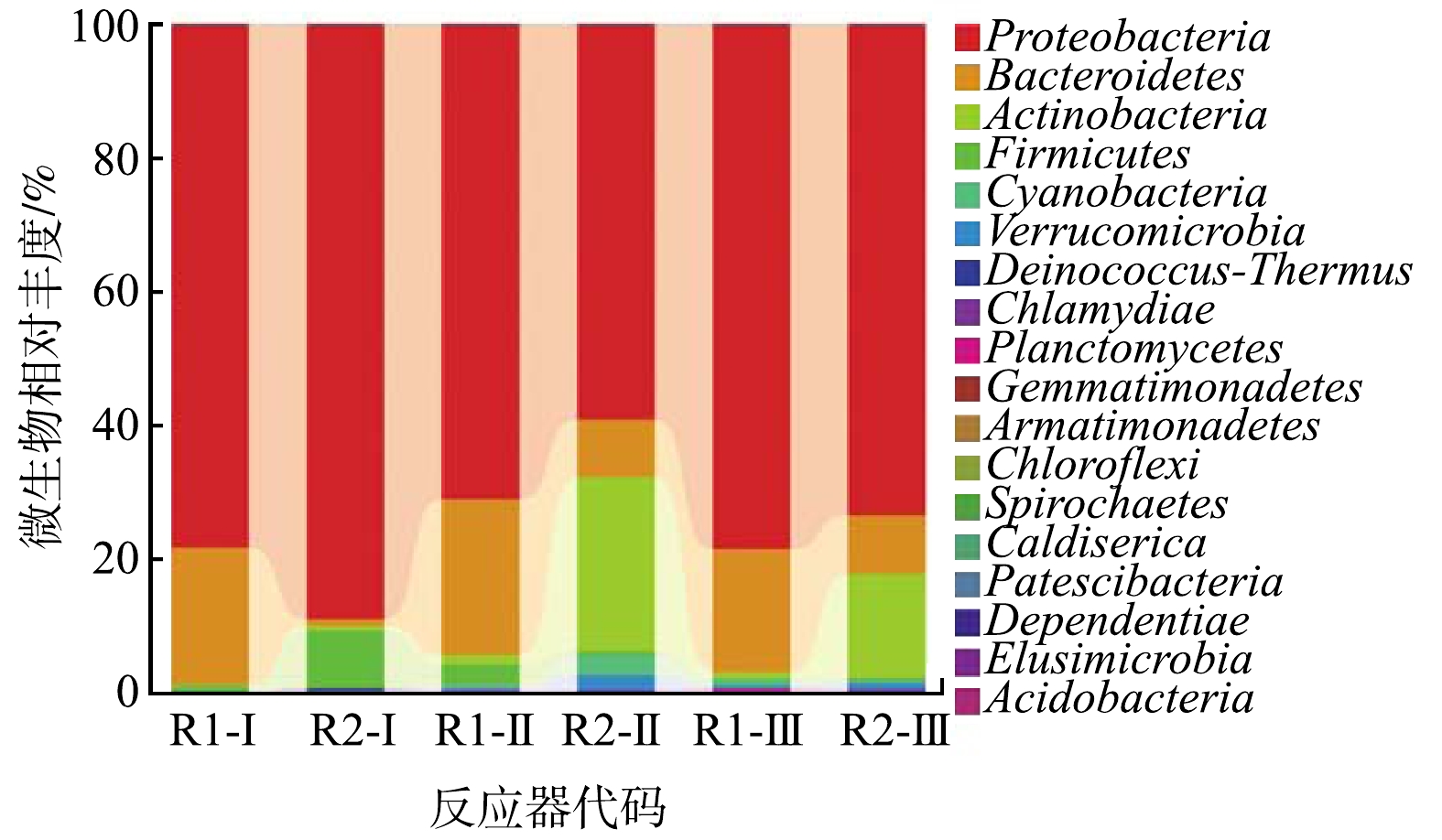
NO−2 2) 对微生物多样性的影响。如图5所示,随着微生物的逐渐稳定,Proteobacteria(变形菌门)在R1和R2反应器中均占有较大优势,相对丰度分别为78.45%和83.79%。以 rRNA 序列为划分依据,可以将 Proteobacteria 划分为5个亚纲,分别为α、β、γ、δ和ε[40]。与废水处理密切相关的细菌有β-Proteobacteria 和γ-Proteobacteria,这2种亚纲的细菌不仅能进行呼吸代谢,也能进行发酵代谢,属于典型的兼性异养菌[41]。正因为如此,3个阶段中R1和R2反应器具有较好的脱氮性能。随着反应器成功启动,Proteobacteria相对丰度有所下降并逐渐稳定。在阶段Ⅱ,水中营养物质不足,使Proteobacteria相对丰度逐渐下降。在阶段Ⅲ中,活性炭的添加为脱氮功能微生物的生长提供基础,随着生物膜的逐渐形成,Proteobacteria相对丰度因为营养物质充足而逐提高,使得Proteobacteria菌门占据优势并得以增殖。Firmicutes菌门的细菌的物理形态主要以圆形或杆状为主,大多为革兰氏阳性菌。Firmicutes菌门中的细菌可以产生芽孢来抵抗外部极端环境,同时还能分泌多种生物酶,来分解废水中的有机物[42]。Firmicutes菌门中芽孢杆菌就是典型代表。其既可以在好氧环境中生存,同时也能在缺氧/厌氧的条件下生存[43]。这与该反应器在连续流实验中得到的脱氮性能变化趋势相符。
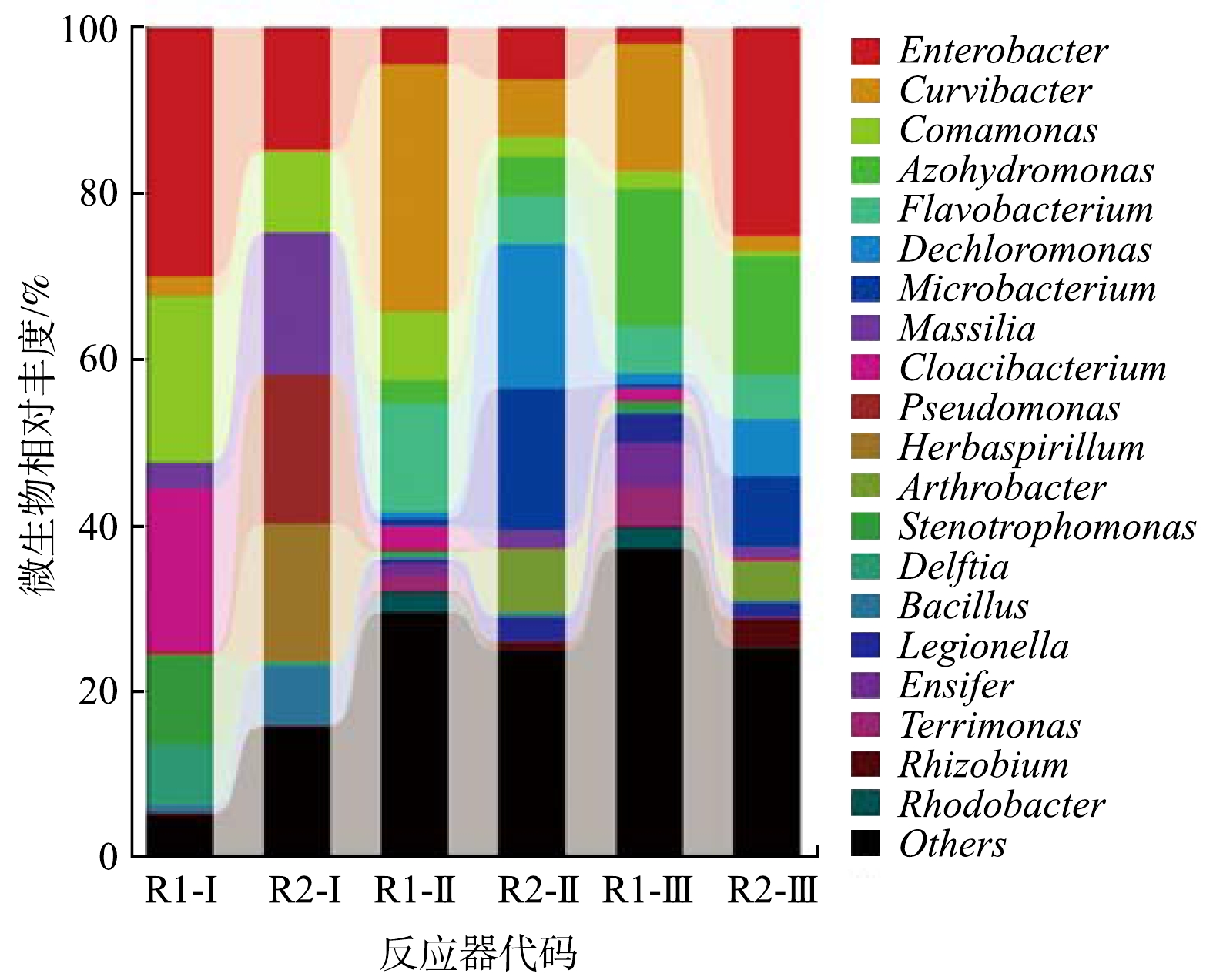
不同载体微生物群落属水平组成分析结果见图6。2组反应器在不同阶段属水平上的种群结构呈现明显的差异:在阶段I,在R1反应器中,细菌优势属主要为Enterobacter (30.0%)、Comamonas (19.97%)、Cloacibacterium (19.59%)、Stenotrophomonas (10.81%)、Delftia (7.23%)、Massilia (3.07%)和Curvibacter (2.48%),说明R1系统具有较强的脱氮性能;在R2反应器中,细菌优势属主要为Pseudomonas (17.82%)、Massilia (17.71%)、Enterobacter (14.76%)、Herbaspirillum (16.60%)、Comamonas (7.75%)和Bacillus (7.17%)。上述菌属中Pseudomonas与Bacills属于具有反硝化功能的杆菌属[44],和前文TEM镜检观察到的细菌结构相似。以上结果说明R2反应器中形成了反硝化系统且有一定的好氧反硝化能力。
在阶段II,R1反应器中优势属被Curvibacter (29.99%)替代,第2优势菌属为Flavobacterium (12.93%),优势属主要为废水处理中常见的反硝化菌。其原因可能是Curvibacter和Flavobacterium分泌EPS,形成功能菌群并通过自凝聚的形式形成颗粒状污泥[45]。但是,在功能菌群形成颗粒状污泥时,会消耗一定量的碳源。因此,Curvibacter和Flavobacterium消耗了部分碳源。导致R1反应器的
NH+4 NO−2 NO−3 在阶段III,R1反应器中的优势属主要为Azohydromonas (16.64%)、Curvibacter (15.41%)、Flavobacterium (5.64%)、Ensifer (5.28%)和Terrimonas (4.68%)。Azohydromonas菌属作为固氮微生物的一种,在氮循环中具有重要[49]。同时,Curvibacter相对丰度的提高,可以间接说明R1系统中功能微生物菌群逐渐絮凝,使其容易与菌胶团块结合[50]。Flavobacterium不仅具有反硝化的能力,同时也是指示颗粒污泥成熟与否的重要指标之一[51-52]。Flavobacterium菌的相对丰度的提高可间接说明R1反应器中功能菌群颗粒结构已经逐渐稳定,从而逐渐提高了R1反应器的脱氮性能;R2反应器中的优势属主要为Enterobacter (25.11%)、Azohydromonas(14.24%)和Microbacterium(8.38%)。Enterobacter具有好氧反硝化功能,Microbacterium是铁自养反硝化菌[53],Azohydromonas是重要的固氮菌[54],三者以不同物质作为电子受体,提高了反硝化的效率。同时,在R2反应器中的活性炭表面,在功能菌利用炭有机物质进行生物代谢的过程中同时实现了对吸附点位的再生,从而提高了R2反应器的脱氮性能。
利用LEfSe分析,来确定不同载体之间具有显著差异的微生物(LDA阈值为3.5)。各分类水平上的微生物标记35.3 %属于变形菌门,在反应器系统样品中,变形菌门(Proteobacteria)出现在所有系统中;变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)只在R2中出现;此外,在丰度较高的几个门类中,浮霉状菌门(Planctomycetes)、厚壁菌门(Firmicutes)未能体现。有研究[49]表明,Proteobacteria和Bacteroidetes在废水处理中起着重要的作用,而Proteobacteria又包含了非常重要的反硝化菌属。同时,Actinobacteria门下的微生物可以代谢糖类物质,且与污泥膨胀密切相关[55],在COD 的去除中起着重要的作用。该结果表明,煤质活性炭载体会使得Proteobacteria,Bacteroidetes,Firmic这个门的微生物在一定程度上富集。在种水平上,两个反应器中呈现出差异的微生物为Curvibacter、Enterobacter、Comamonas、Azohydromonas、Flavobacterium和Micrococcales。Azohydromonas、Enterobacter和Micrococcales具有反硝化的能力[56],这3种菌在在R2反应器中丰度较高,从而强化R2反应器去除氨氮的能力。这与微生物多样分析所获得的结果基本一致。
2.1. 活性炭复合微生物体对SBR反应器氮去除性能的影响
2.2. 活性炭复合微生物体对SBR反应器污泥性状的影响
2.3. 活性炭复合微生物体对SBR生物性能的影响
-
1)利用150目煤质活性炭作为载体与微生物耦合在SBR中构建活性污泥系体系,脱氮效果得到明显提升,系统出水中
NH+4 2)微生物可以在活性炭表面和孔隙内部呈团聚状富集,污泥颗粒直径为115 μm左右,粒径较大。
3)活性炭复合微生物体可使反应器中胞外聚合物(EPS)的质量分数增加,且蛋白质(PN)/多糖(PS)比值为8.55。
4)添加活性炭复合微生物体的SBR反应器中发现Proteobacteria (83.79%)、Bacteroidetes (9.34%)、Firmicutes (2.87%)的相对丰度较高,而与脱氮功能有密切关联的菌属Enterobacter (25.11%)、Azohydromonas (14.24%)和Microbacterium (8.38%)的丰度上升,而和污泥膨胀相关的菌门Actinobacteria的丰度有所下降。





 DownLoad:
DownLoad: