-
近年来,微量有机污染物(药品与个人护理品、内分泌干扰物等)被频繁检出,成为影响环境和公众健康的重大问题[1]。传统的水处理技术无法有效去除多数微量有机污染物,因此,针对水的深度处理技术尤为重要[2]。四环素(TC)是目前世界上应用最为广泛的抗生素之一[3],其有效去除技术受到广泛关注。大量研究结果表明,基于紫外(UV)的高级氧化工艺(UV-AOPs)可有效去除饮用水、废水和再生水中的大多数微量有机污染物[4-8]。其中,UV/H2O2工艺具有流程简单、氧化能力强以及无二次污染等优点,显示出良好的发展潜力和应用前景[9],其反应原理见式(1)。目前,世界上已有以荷兰Andijk、加拿大Cornwall为代表的多家饮用水厂采用UV/H2O2工艺作为水深度处理工艺[10]。
在UV/H2O2工艺中,UV光源的选择至关重要,目前几种常见的UV光源获得了较好的实际应用。低压UV(LPUV)汞灯可发出254 nm单色光,具有效率高和造价低的优点。真空UV/UV(VUV/UV) 汞灯通过对LPUV汞灯灯管材料的改进(采用高纯石英玻璃)及电气参数调节,可同时输出254 nm和185 nm波长的UV光[11],185 nm的VUV可通过光解水产生强氧化性HO·(式(2)),进而氧化有机污染物。
同时,最近的研究表明,双波长(254 nm/185 nm)UV辐照对UV-AOPs具有协同强化作用[12]。中压UV(MPUV) 汞灯的特点是结构紧凑、输出功率高及具有较宽的UV发射光谱(200~400 nm)。但是,MPUV汞灯在UV区(200~300 nm)电光转换效率低及寿命短的缺点限制了其应用。
探讨UV/H2O2工艺去除微量污染物的适合光源需考虑多个方面,包括目标污染物降解动力学、光源在UVC波段的电光转换效率、灯的使用寿命及长期运行的稳定性。其中,通过实验及模型计算对比不同光源下目标污染物降解动力学是关键。污染物降解动力学反映了基于相同辐照剂量下,不同光源激发UV/H2O2工艺对目标污染物的降解效果。由于不同光反应器中平均辐照剂量率不同,为使UV/H2O2实验结果具有对比性,一般采用剂量基动力学进行研究[13-14]。
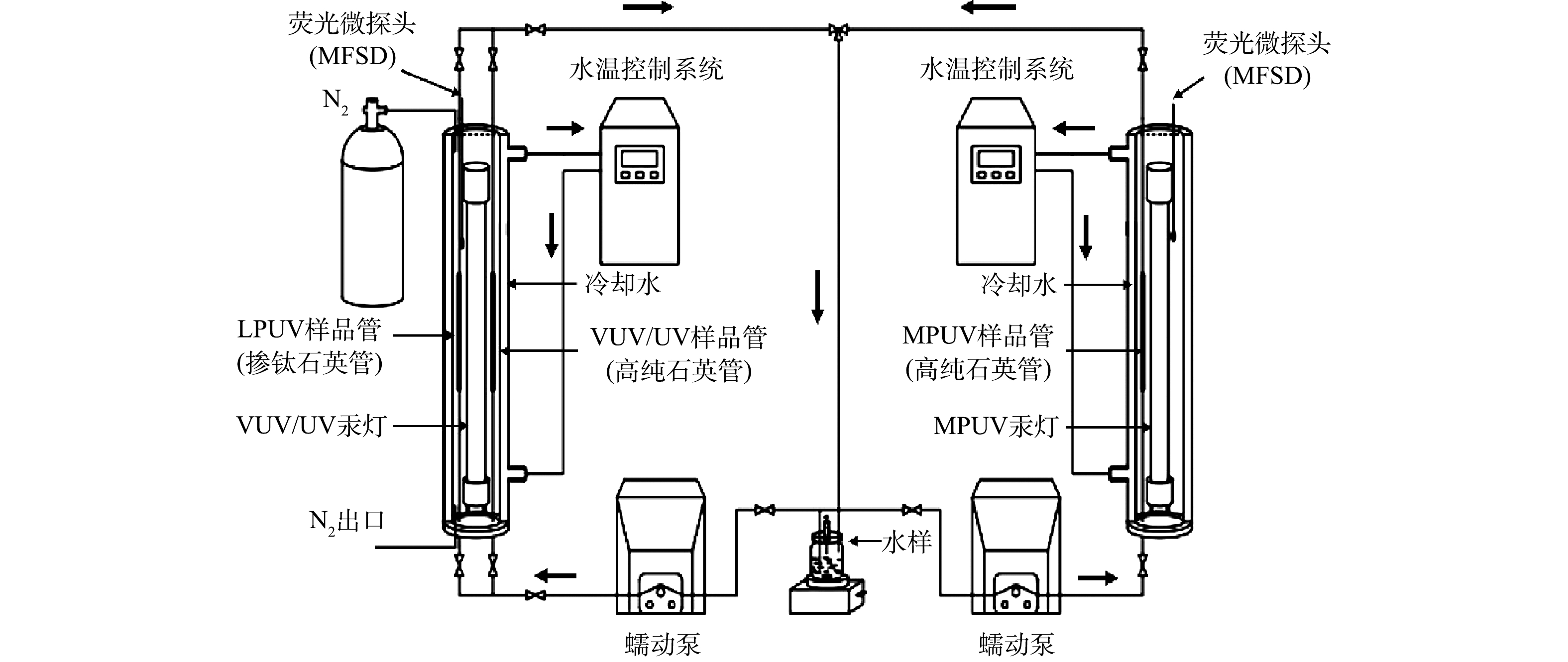
不同光源降解动力学的对比中,光反应器的选择是关键。目前,序批式光反应器和准平行光束仪应用最为广泛。序批式光反应器易于搭建,形状常为圆筒式,UV光源安装于圆筒反应器轴线处,与实际UV反应器相似,可采用尿苷或阿特拉津等化学感光剂测定辐照剂量。然而,UV光源在反应器中剂量率分布不均,导致剂量准确测定较难,此外,该反应器安装MPUV汞灯时,溶液温度通常较难控制。在准平行光束仪下,辐照剂量可根据UV辐照计在光斑中心测得的数值,结合佩特里系数(petri factor)、发散系数(divergence factor)、反射系数(reflection factor)和水系数(water factor)等参数修正得到[15]。但是,应用VUV/UV光源时,由于VUV在空气中透射率很低且样品到灯管的距离较远,VUV很难辐照到样品上,因此,利用准平行光束仪无法开展VUV辐照实验。本实验室前期开发的细管流光反应系统(MFPS)可准确测量LPUV、VUV/UV和MPUV 3种光源的剂量基反应速率常数[16]。此外,MFPS还具有所需样品量小,最大辐照强度接近实际工程等优点。本研究基于MFPS,实验测定3种UV光源激发UV/H2O2工艺对TC的降解动力学。同时建立相应的光降解动力学模型模拟,探讨各光源的优势。本研究对于UV/H2O2工艺中适宜光源的选择、高效工艺的研发具有重要意义。
HTML
-
光反应实验在配装VUV/UV和MPUV汞灯的MFPS(图1)上开展[16]。VUV/UV汞灯(浙江硖石万华,8 W)可同时输出185 nm VUV和254 nm UV,MPUV汞灯(佛山柯维,500 W)可输出200~300 nm UV。LPUV样品管为掺钛石英管,其滤过VUV/UV汞灯发射的185 nm VUV辐照,使得管内样品仅可接受254 nm UV辐照。VUV/UV和MPUV样品管均由高纯石英材料制成,不过滤任何波长UV。样品管的内径(r)和长度(h)分别为0.24 cm和10.0 cm。样品管均放置于距离灯表面3.0 mm处接受辐照。
本文中,MFPS采用循环模式进行实验,在实验时间,任一时刻只有部分实验水样受到辐照。为了准确计算出实验中每个时刻样品所接受的剂量,需定义等效辐照时间(tree),即在相同辐照强度下,全部水样达到与同时辐照(相同辐照剂量率)处理效果所消耗的时间(式(3))。因此,循环模式下LPUV、VUV、VUV/UV和MPUV的辐照剂量计算公式分别见式(4)~式(7)。
式中:V为样品的总体积,mL;t为实验时间,s。
式中:
E0LPUV E0MPUV E0VUV E0LPUV E0MPUV E0VUV -
不同光源UV/H2O2对TC的降解速率常数(k′)(式(8))包括直接光解速率常数(k′d)和间接氧化速率常数(k′i),分别根据式(9)和式(10)进行计算。
式中:ΦTC为TC光降解的量子产率,mol·einstein−1;q0为在不同光源下TC的光子通量,einstein·s−1;fTC为在不同光源下TC的光子吸收比例,%;a为在不同光源下溶液的吸光系数,cm−1;l′为有效光程,cm。
式中:kTC,HO·为TC与HO·的二级反应速率常数,L·(mol·s)−1;CHO·为稳态时HO·的浓度(见式(11)),mol·L−1;E0为不同光源的辐照强度,einstein·(m2·s)−1。
式中:rHO·为HO·的生成速率,mol·s−1;
kH2O2 kHPO2−4 HPO2−4 kH2PO−4 H2PO−4 在LPUV和VUV/UV汞灯下,UV/H2O2工艺对TC的降解速率常数(
k′LPUV/H2O2 k′VUV/UV/H2O2 k′MPUV/H2O2 -
所有实验均采用超纯水(Milli-Q,Advanrtage A10)配置。TC购自北京沃凯生物科技有限公司,乙腈和甲酸购自Fisher Scientific公司。磷酸盐和H2O2购自北京国药试剂公司。采用磷酸盐缓冲溶液调节和控制pH。TC浓度通过高效液相色谱(Shimadzu LC-20AT series,Kyoto,Japan)测定,色谱柱为C18反相柱(250 mm×4.6 mm,5 µm,Dikma Beijing,China),柱温20 ℃,流速0.8 mL·min−1,流动相为80% 0.01 mol·L−1草酸水(A)和20%纯乙腈(B),采用二极阵列UV/vis检测器在360 nm处检测TC。高浓度H2O2通过240 nm 吸光度测定其浓度,低浓度H2O2通过N,N-二乙基-1,4-苯二胺硫酸盐(DPD)法进行测定。
1.1. MFPS
1.2. 不同光源UV/H2O2对TC降解动力学模型
1.3. 化学试剂及分析方法
-
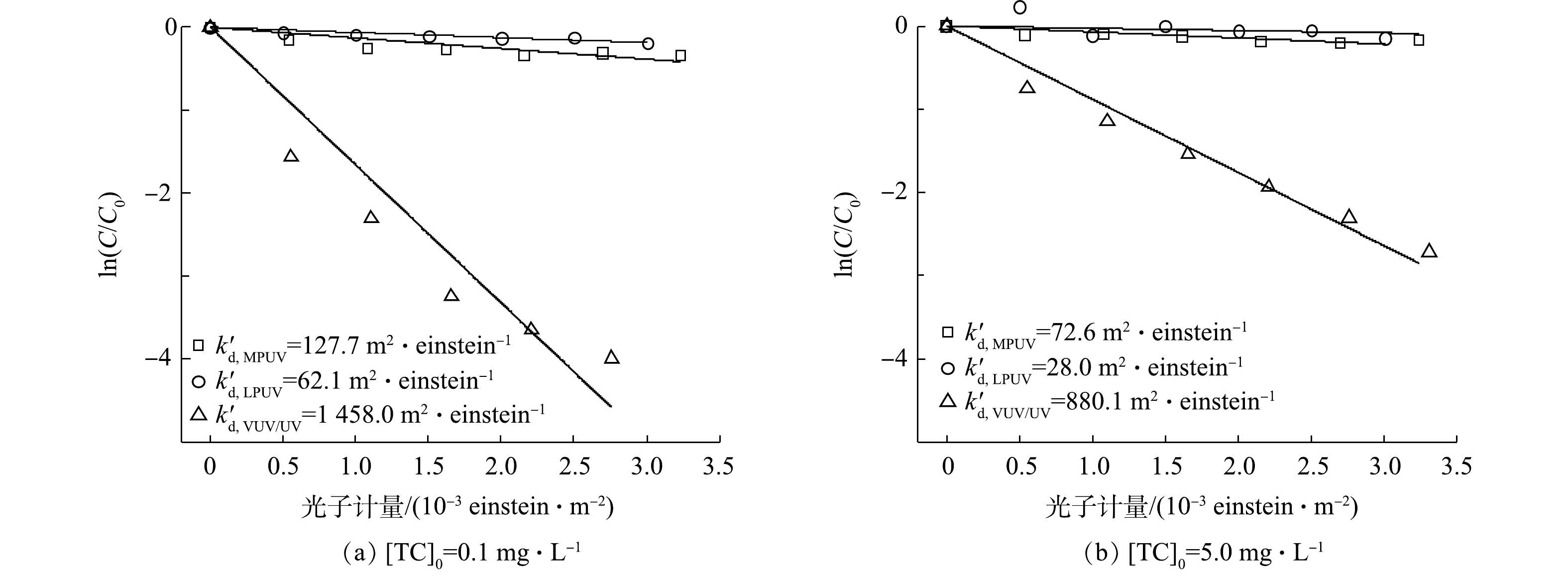
不同质量浓度TC(0.1 mg·L−1和5.0 mg·L−1)在LPUV、MPUV和VUV/UV汞灯辐照下的直接光解结果见图2。由图2可见,各光源对TC的直接光解均符合准一级动力学,光解速率常数由高到低依次为VUV/UV汞灯、LPUV汞灯和MPUV汞灯。VUV/UV汞灯的直接降解速率远高于LPUV和MPUV汞灯,这是由于TC溶液同时受到VUV和UV辐照,其中VUV光解水产生强氧化性的HO·,可快速降解TC。由表2可知,MPUV汞灯发射出的低波长(200~230 nm)可被TC有效吸收,因此,k′d,MPUV>k′d,LPUV。此外,随着TC初始质量浓度的增加,3种光源对TC的光解速率常数均降低,这是由于较高的污染物初始浓度会增大溶液的UV吸光度,导致TC受到的平均UV辐照强度下降,降低了UV光解速率。对于VUV/UV光源,高浓度TC同时还会竞争HO·,从而降低稳态时HO·的浓度,降低TC降解速率。
-
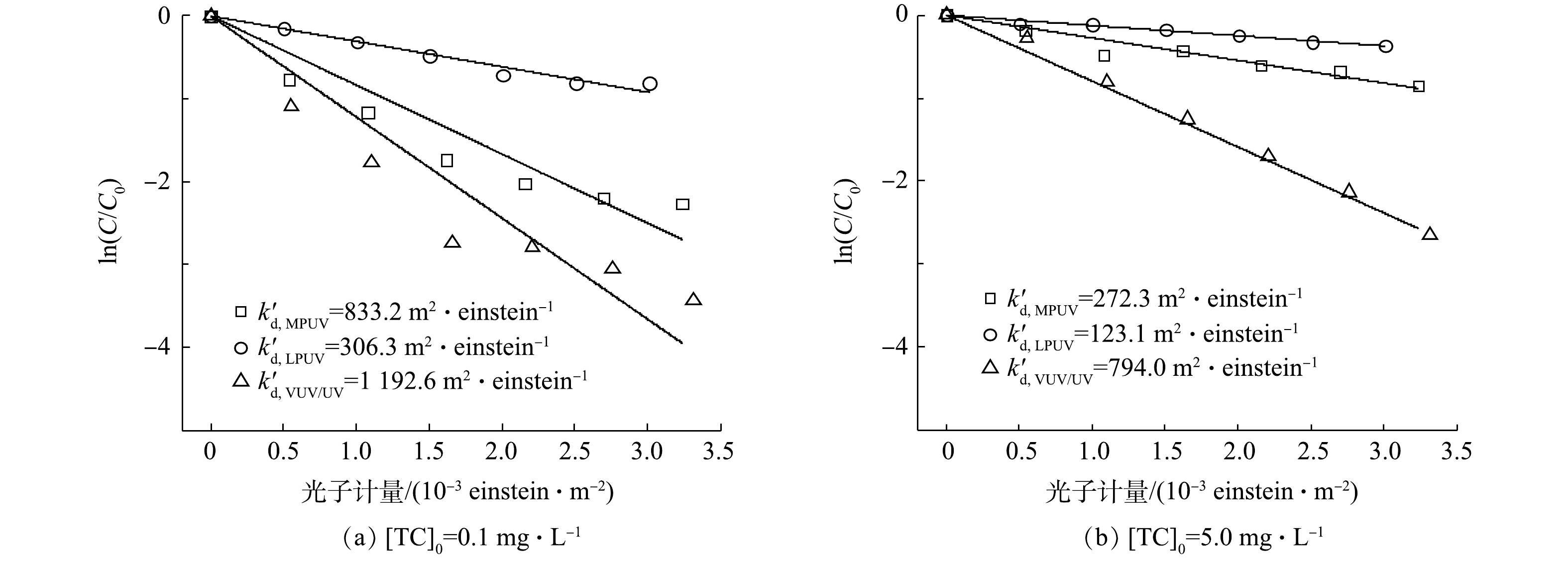
H2O2在UV激发下可产生高效降解TC的 HO·。不同光源UV/H2O2工艺对不同浓度TC的降解效果见图3。由图3可以看出,不同光源UV/H2O2工艺对低质量浓度(0.1 mg·L−1)及高质量浓度(5.0 mg·L−1)TC降解均符合准一级动力学。在3种光源中,VUV/UV汞灯的
k′VUV/UV/H2O2 k′MPUV/H2O2 k′LPUV/H2O2 -
在不同H2O2质量浓度(0、0.5、5.0及25.0 mg·L−1)下,不同光源UV/H2O2工艺对不同质量浓度TC(0.1 mg·L−1和5.0 mg·L−1)的降解速率见表3。由表3可以看出,随着H2O2浓度的提高,不同质量浓度TC(0.1 mg·L−1和5.0 mg·L−1)对应的
k′MPUV/H2O2 k′LPUV/H2O2 k′VUV/UV/H2O2 k′VUV/UV/H2O2 -
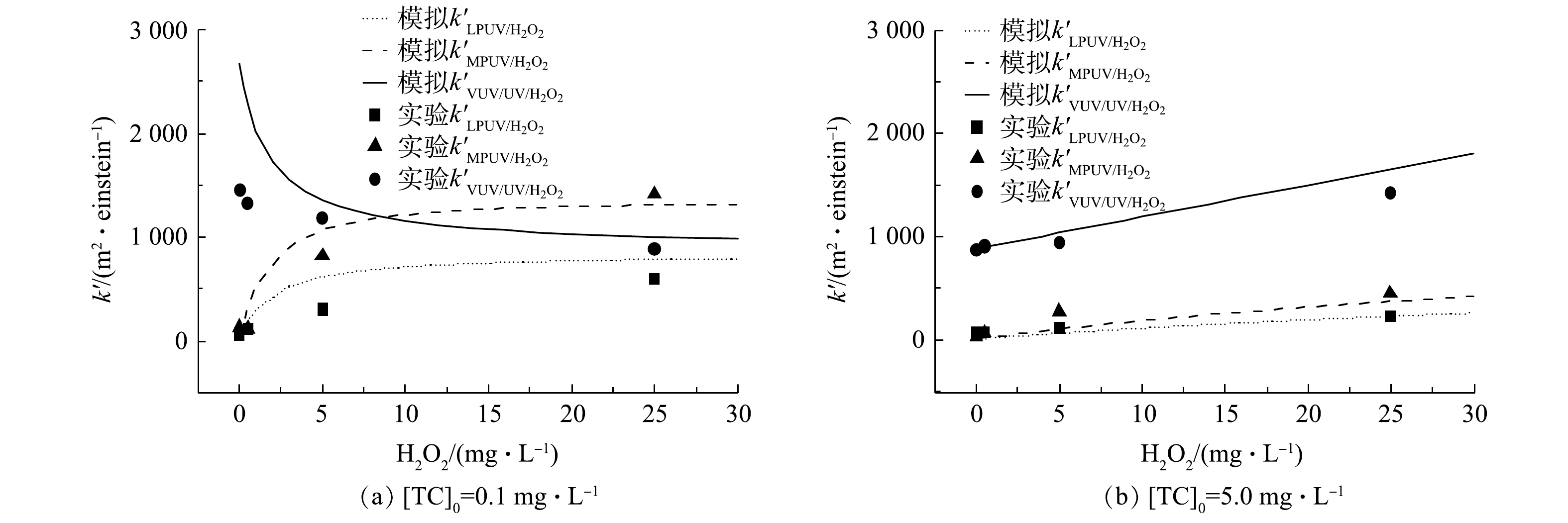
不同光源UV/H2O2工艺对不同质量浓度TC(0.1 mg·L−1和5.0 mg·L−1)降解速率常数的模型模拟与实验测试结果见图4。模型计算结果表明,随着H2O2投加量(0~30.0 mg·L−1)的提高,不同浓度TC的
k′MPUV/H2O2 k′LPUV/H2O2 k′VUV/UV/H2O2 -
适宜的光源是提高UV-AOPs效率的重要因素,但目前相关研究较少。本文基于MFPS开展了不同光源UV/H2O2工艺降解动力学的对比研究,其实质是在相同辐照剂量下,从剂量基反应速率常数的角度比较各光源UV-AOPs对目标污染物的降解效果,此方法具有准确性高、费用低等优势。然而,不同光源UV-AOPs会受到UV灯电光转化效率、氧化剂费用等因素的影响,生成相同辐照剂量所需的能耗并不相同。此外,实际应用中不同光源UV反应器的优化效果也并不相同。因此,单纯剂量基动力学对比研究并不能给工程人员提供直接依据以选择适宜光源。在实际应用中,光源选择还应结合中试实验的能耗数据进行综合考虑。
2.1. 不同光源对TC的直接光解
2.2. 不同光源UV/H2O2工艺对TC的处理效果
2.3. H2O2浓度对UV/H2O2工艺的影响
2.4. 实验测定与模型模拟的降解速率常数对比
2.5. 应用前景
-
1) 3种光源(LPUV、MPUV及VUV/UV汞灯)对TC的直接光降解过程均符合准一级动力学,且k′d, VUV/UV大于k′d, MPUV和k′d, LPUV。随着初始H2O2投加量的加大,不同质量浓度TC的
k′MPUV/H2O2 k′LPUV/H2O2 k′LPUV/H2O2 k′VUV/UV/H2O2 2) 3种光源(LPUV、MPUV及VUV/UV汞灯)下UV/H2O2工艺对TC的降解动力学模型模拟与实验结果趋势一致,表明模型可较为准确的模拟不同光源UV/H2O2工艺。此外,本研究中,动力学比较方法也可应用于其他UV光源,如UV-LEDs和准分子灯。
3)适宜光源的选择是高效UV-AOPs的重要因素,降解动力学对比具有测试结果准确性高、费用低等优势及无法考虑灯效、氧化剂费用等缺陷,因此,光源选择还应结合中试实验的能耗数据进行综合考虑。




 下载:
下载: