-
鉴于饮用水在隐孢子虫和贾第鞭毛虫(简称两虫)传播以及其在大规模爆发流行病中的明确作用,两虫不仅被公共卫生部门关注,更是日益受到各国水行业专家的广泛关注和高度重视,并被世界卫生组织(WHO)作为原生动物病原体明确纳入《饮用水水质准则》[1]。我国于2006年将两虫纳入了《生活饮用水卫生标准》(GB 5749-2006),并规定每10 L水中检出不得超过1个。目前,被广泛认可和使用的水中两虫检测方法是美国环境保护署(EPA)的方法1623,即免疫磁分离荧光抗体法,我国《生活饮用水标准检验方法》(GB/T 5750. 12-2006)亦采用此法。但由于该方法耗材和设备成本较高,难以在一般水质监测单位或实验室推广并广泛应用。本团队在借鉴日本2007年颁布的《水道水指示菌及隐孢子虫等检测方法》(健水发第0330006号)的基础上,使用醋酸纤维膜代替滤囊/滤芯过滤样品、膜溶解法代替淘洗浓缩样品、密度梯度离心代替免疫磁分离纯化样品,建立了基于膜溶解-密度梯度分离的两虫检测方法[2-3]。该方法在保障美国EPA 1623号方法和国标方法回收率的基础上,可降低耗材成本85%,同时还可降低设备投入成本75%。目前,该方法已列入住房与城乡建设部行业标准《城镇供水水质标准检验方法》(CJ/T 141-2018)。
在行业应用和实际生产过程中,饮用水及其水源水中通常含有一定量的颗粒物质[4]。作为反映水中颗粒物的综合参数,浑浊度是水质检测中的常规指标[5]。我国水厂出水的浑浊度中值为0.26 NTU,95%置信区间为0.07~0.87 NTU[6]。水源水根据区域具有不同的浑浊度特征,北方地区如松花江为水源水的冬季浑浊度低于20 NTU,夏季浑浊度高达120 NTU[7];中西部地区以渭河为代表的水源水浑浊度高达150 NTU[8];而南方水源水具有低浊的特点,以长江、东江、闽江等12处水源地的调查研究结果显示[9-10],其78.6%的水源水浑浊度平均值在50 NTU以下。因此,我国水厂进水的浑浊度变化范围较宽,中值为11.00 NTU,95%置信区间则为0.81~208.80 NTU [6]。水体中颗粒物可通过吸附沉降或者团聚包裹等影响两虫检测方法的准确性和稳定性[11-12]。有研究发现,高浑浊度水样的两虫回收率均小于低浑浊度水样[13],且隐孢子虫卵囊的回收率与浑浊度呈负相关[14-15],这说明高浓度颗粒物不利于两虫的检测。但FENG等[12]研究发现颗粒物的添加可以提高隐孢子虫的回收率。同时,也有部分研究认为,浑浊度对两虫的回收率无显著影响[16-17]。因此,水中颗粒物对两虫检测回收率的具体影响有待进一步细致深入的研究。
根据我国水质浑浊度状况,本研究结合颗粒物大小进行了双因素实验,分析了颗粒物大小和浑浊度对滤膜浓缩/密度梯度分离荧光抗体法检测两虫影响,并在此基础上分析了适用于滤膜浓缩/密度梯度分离荧光抗体法检测两虫的浑浊度条件,以期为实际水样的两虫检测提供参考。
HTML
-
天然水体中造成浊度的胶体颗粒主要是黏土[18]。高岭土作为一种黏土矿物,具有良好的吸附能力,是模拟水样浑浊度最常用的物质,目前已广泛用于实验室内模拟生活饮用水以及水源水等水样的颗粒物研究[19-23]。本研究根据两虫大小(贾第鞭毛虫孢囊椭圆形,长为8~14 μm,宽为7~10 μm;隐孢子虫卵囊圆形,直径2~6 μm),选用粒径2.5、5、11 μm的高岭土(麦克林,上海)和纯水配置成10 L浑浊度分别为5、10、20、40、60 NTU的悬液。2100Q便携式浑浊度仪(哈希,美国)用于水中浑浊度的测定。100个贾第鞭毛虫孢囊和100个隐孢子虫卵囊(Waterborne,美国)加入上述不同浑浊度的水样,每个浑浊度水平的样品制备3个平行。两虫检测使用滤膜浓缩/密度梯度分离荧光抗体法进行检测,步骤参考CJ/T 141-2018 10.1。
-
使用5 μm粒径的高岭土(麦克林,上海)和纯水配置10 L浑浊度分别为0.26、1、3、5、10、20、40、60 NTU的悬液。浑浊度使用2100Q便携式浑浊度仪(哈希,美国)测定。100个贾第鞭毛虫孢囊和100个隐孢子虫卵囊(Waterborne,美国)加入上述不同浑浊度的水样,每个浑浊度水平的样品制备6个平行。滤膜浓缩步骤以及密度梯度分离荧光抗体染色步骤参考CJ/T 141-2018 10.1。
-
使用粒径5 μm的高岭土(麦克林,上海)和纯水配置10 L浑浊度分别为15、20、30、50、75、100 NTU的悬液。浑浊度使用2100Q便携式浑浊度仪(哈希,美国)测定。100个贾第鞭毛虫孢囊和100个隐孢子虫卵囊(Waterborne,美国)加入上述不同浑浊度的水样,每个浑浊度水平的样品制备6个平行。沉淀浓缩步骤以及密度梯度分离荧光抗体染色步骤参考CJ/T 141-2018 10.1。
-
统计学分析使用PASW Statistics 18软件进行。对颗粒物粒径与浑浊度双因素实验的结果进行双因素方差分析,比较各因素对两虫回收率影响的大小及其显著性。图形绘制使用OriginPro 2017软件进行。
1.1. 颗粒物大小与浑浊度的双因素实验
1.2. 浑浊度对滤膜浓缩/密度梯度分离荧光抗体法的影响实验
1.3. 浑浊度对沉淀浓缩/密度梯度分离荧光抗体法的影响实验
1.4. 统计分析
-
不同颗粒物大小和浑浊度下水中两虫检测的结果如表1所示。贾第鞭毛虫的回收率为9.00%~63.33%,隐孢子虫的回收率在2.67%~31.00%。其中,在2.5 μm大小颗粒物构成的浑浊水样中,浑浊度5 NTU时贾第鞭毛虫有最佳回收率59.33%,浑浊度10 NTU时隐孢子虫有最佳回收率20.67%,相对标准偏差(RSD)分别为4.24%和10.07%。在5 μm大小颗粒物构成的浑浊水样中,浑浊度5 NTU时贾第鞭毛虫有最佳回收率61.33%,浑浊度10 NTU时隐孢子虫有最佳回收率31.00%,RSD分别为4.10%和3.23%。在11 μm大小颗粒物构成的浑浊水样中,浑浊度10 NTU时贾第鞭毛虫有最佳回收率63.33%,浑浊度10 NTU时隐孢子虫有最高回收率30.67%,RSD分别为3.97%和6.79%。综合以上结果可以看出,该方法在低浑浊度水样中两虫检测时可获得相对较高的回收率和稳定性,且在相同浑浊度下对不同颗粒物大小所对应两虫的回收率存在差异。
通过双因素方差分析的结果(表2)可以看出,贾第鞭毛虫的回收率受浑浊度的影响(P=0.00)和颗粒物大小与浑浊度交互作用的影响(P=0.00)均为显著(P <0.05),而受颗粒物大小的影响不显著(P=0.19>0.05);根据主体间效应检验后F值的大小[24],可以看到,浑浊度对回收率的影响要大于颗粒物大小与浑浊度的交互作用。
隐孢子虫的回收率经过双因素方差分析之后(表3),可以看到其受浑浊度、颗粒物大小及颗粒物大小与浑浊度的交互作用的影响均显著(P<0.05);根据三者的F值可以看出,浑浊度对隐孢子虫回收率的影响最大,颗粒物大小的影响次之,颗粒物大小与浑浊度的交互作用影响最小。
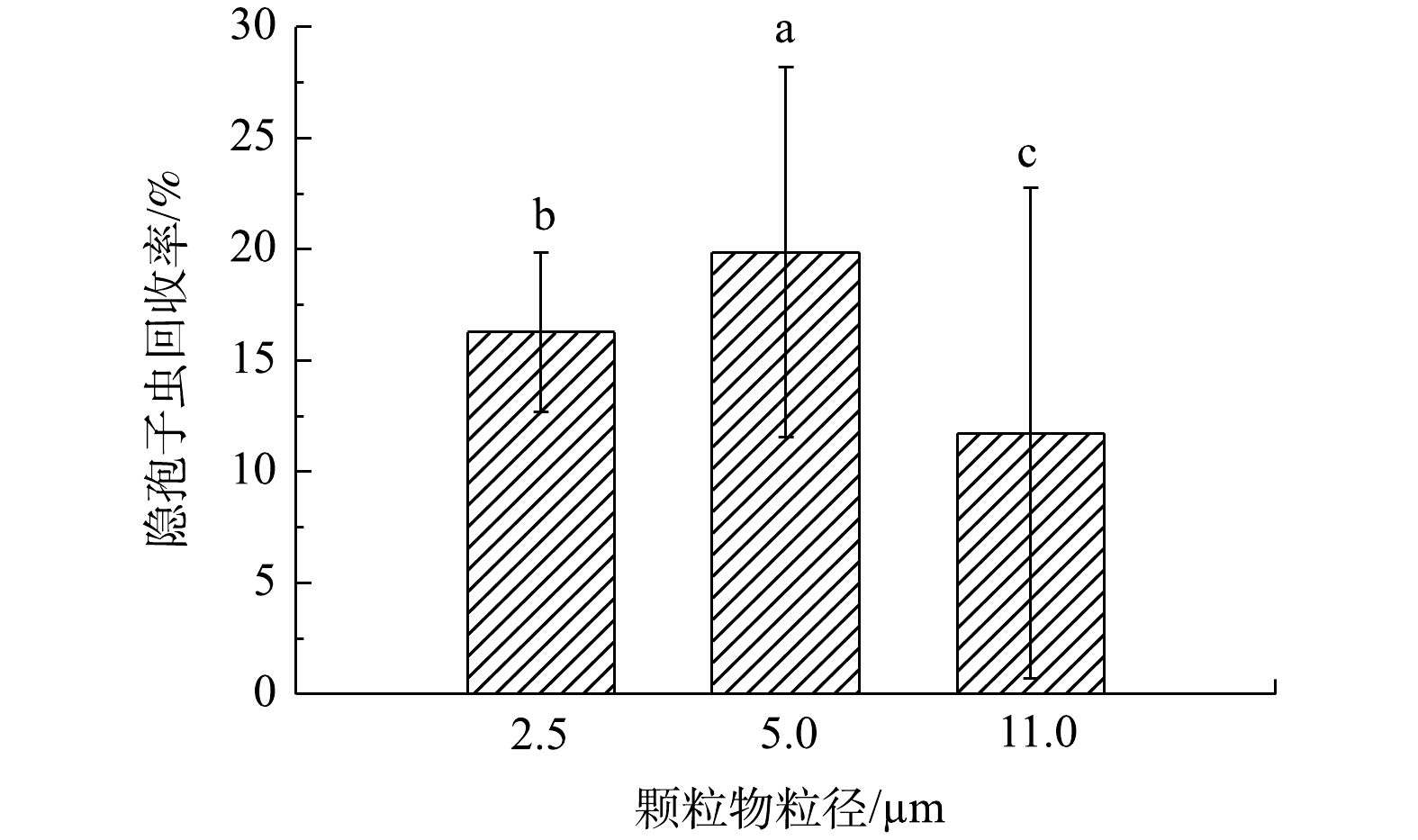
综合以上结果可知,浑浊度是影响两虫回收率的主要因素,颗粒物大小仅对隐孢子虫的回收率有显著影响,在颗粒物大小对隐孢子虫回收率的影响中,粒径为5 μm的颗粒物对隐孢子虫回收率要显著高于2.5 μm和11 μm的颗粒物(图1)。在HSU等[25]的研究中发现,粒径为3~10 μm的微粒与隐孢子虫卵囊的检出显著相关,但与贾第鞭毛虫包囊的检出不相关,这种相关性则很可能来自于水样中颗粒物的大小对隐孢子虫检测回收率的影响。
-
将浑浊度对滤膜浓缩/密度梯度分离荧光抗体法检测两虫的影响进行进一步研究,结果表明,不同浑浊度下两虫检测的回收率随着浑浊度的升高呈现先增加后降低的趋势(图2和图3)。贾第鞭毛虫的回收率在5 NTU时有最高值46%,并在0.26~20 NTU内保持在20%以上,在高浑浊度40 NTU和60 NTU下的回收率分别降至17%和12%。隐孢子虫的回收率在3 NTU时有最高值(50%),在0.26~10 NTU内保持在20%以上,在20 NTU时的回收率降为16%,在高浑浊度40 NTU和60 NTU下的回收率分别降至10%和7%。以上结果说明,滤膜浓缩/密度梯度分离荧光抗体法较适合浑浊度小于20 NTU的低浑浊度水样两虫检测,尤其在浑浊度3~5 NTU时具有较高的两虫回收率。这一结果与文献中通过提高水样浑浊度至4 NTU来有效提高低浑浊度水样的浓缩回收率[26]的结果相一致,这说明一定浓度颗粒物的存在有利于两虫附着,使两虫在离心浓缩时更容易被富集[26],而颗粒物浓度过高则容易堵塞滤膜,从而使回收率降低。而我国饮用水的浑浊度一般较低,因此,推荐采用此方法进行两虫检测,并且可通过在检测时添加5 μm的颗粒物将浑浊度调整至3~5 NTU以提高回收率。
-
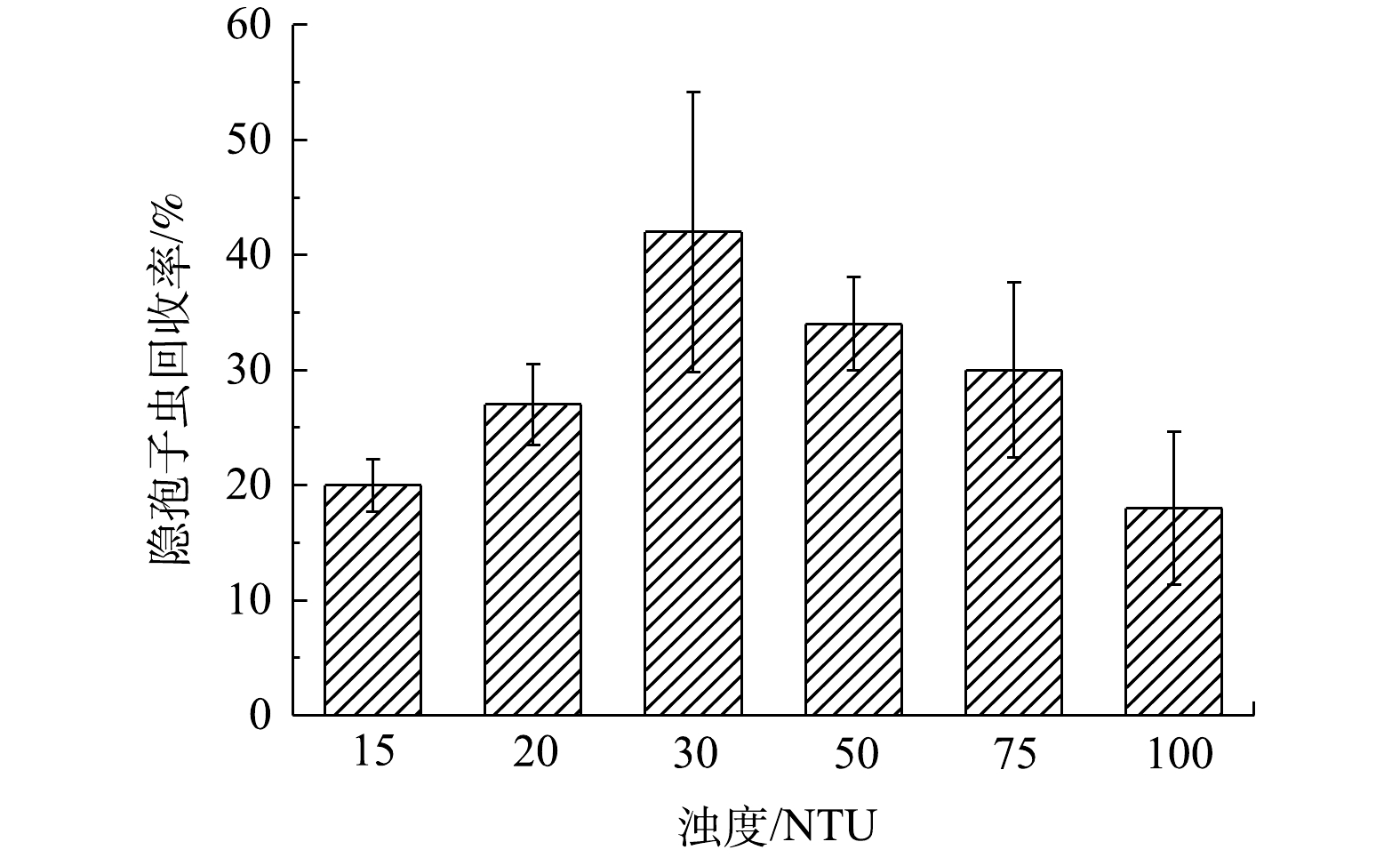
为进一步探索高浑浊度水中两虫检测的适用方法,本研究采用沉淀浓缩/密度梯度分离荧光抗体法进行检测,并考察了不同浑浊度对两虫检测回收率的影响,实验结果如图4和图5所示。在15~100 NTU内贾第鞭毛虫和隐孢子虫的回收率均随着浑浊度的升高而呈现先增加后降低的趋势。贾第鞭毛虫在浑浊度50 NTU时有最高的回收率28%,并在20~75 NTU内保持回收率20%以上,100 NTU时的回收率为10%。隐孢子虫在30 NTU时有最高的回收率42%,并在15~75 NTU内保持回收率20%以上,100 NTU时的回收率为18%。
综上分析可知,高浑浊度水样适合采用沉淀浓缩/密度梯度分离荧光抗体法进行检测,尤其在30~50 NTU内可获得较好的检测回收率,并且可在20 NTU时获得与滤膜浓缩/密度梯度分离荧光抗体法相近的贾第鞭毛虫回收率,以及显著(P<0.05)高于滤膜浓缩/密度梯度分离荧光抗体法的隐孢子虫回收率。沉淀浓缩法对高浊度水样的检测优势与沉淀浓缩过程中的混凝作用相关,高浊度水样中的离子间碰撞概率增大,有利于两虫在碳酸钙沉淀的生成过程中被裹挟着沉积下来[27-28]。周美芝等[29]采用此方法对40 NTU水样进行检测,获得的两虫回收率也均高于20%。在实际水样检测中,水源水的浑浊度范围较宽,建议在检测两虫之前先测定水样浑浊度,根据水样浑浊度选择相应的检测方法,20 NTU以下水样采用滤膜浓缩/密度梯度分离荧光抗体法,20 NTU及其以上浑浊度水样建议采用沉淀浓缩/密度梯度分离荧光抗体法。
2.1. 颗粒物粒径和浑浊度对水中两虫检测的双因素影响
2.2. 浑浊度对滤膜浓缩/密度梯度分离荧光抗体法检测两虫的影响
2.3. 浑浊度对沉淀浓缩/密度梯度分离荧光抗体法检测两虫的影响
-
1)与两虫大小相近的颗粒物大小对贾第鞭毛虫的检测回收率无显著影响,对隐孢子虫回收率的影响较为显著,其中5 μm大小颗粒物有利于提高隐孢子虫检测回收率。
2)浑浊度是影响两虫回收率的主要因素。滤膜浓缩/密度梯度分离荧光抗体法适用于浑浊度小于20 NTU的低浑浊度水样的检测,尤其对于3~5 NTU 时有最佳回收率;20 NTU及其以上浑浊度的水样适合采用沉淀浓缩/密度梯度分离荧光抗体法,并在30~50 NTU时可获得最佳回收率。
3)根据我国水质浑浊度状况,建议采用滤膜浓缩密度梯度分离荧光抗体法检测生活饮用水,并可在浓缩水样前通过约5 μm颗粒物调节浑浊度至3~5 NTU来提高方法回收率;检测水源水中两虫含量时,可根据实际浑浊度值选择相应的方法进行检测。




 DownLoad:
DownLoad: