纳米Al2O3和Cd联合暴露对铜锈环棱螺体内Cd的生物积累和抗氧化酶活性的影响
Effects of Cd and Al2O3 -NPs Co-exposure on Bioaccumulation of Cd and Antioxidase Enzyme Activities in Bellamya aeroginosa
-
摘要: 金属氧化物纳米颗粒的广泛应用导致它们大量地释放到水环境中,其独特的理化性质有可能改变水环境中其他共存污染物(如重金属)的生态毒性。为评价沉积物中纳米氧化铝(Al2O3-NPs)对重金属Cd生态毒性的影响,采用底栖生物慢性暴露研究了Al2O3-NPs存在条件下Cd在底栖动物铜锈环棱螺体内生物积累的变化和Cd对肝胰脏抗氧化防御系统关键成分超氧化物歧化酶(SOD)与脂质过氧化指标丙二醛(MDA)以及Ⅱ相反应的关键酶谷胱甘肽-S-转移酶(GST)的影响。结果表明,低Cd浓度(5μg·g-1)时,Al2O3-NPs对Cd生物积累没有影响;中、高Cd浓度(25、100μg·g-1)时,Al2O3-NPs显著促进Cd的生物积累,Al2O3-NPs对Cd的生物转运具有明显的携带效应。低Cd浓度时,无Al2O3-NPs处理组和Al2O3-NPs处理组的SOD活性与对照组相比均没有显著差异;中Cd浓度时,SOD活性显著升高,而高Cd浓度时,SOD活性显著下降,而且Al2O3-NPs处理组的SOD活性显著低于无Al2O3-NPs处理组,Al2O3-NPs的存在加重了Cd对肝胰脏细胞的氧化胁迫或损伤。高Cd浓度时,无Al2O3-NPs处理组和Al2O3-NPs处理组的MDA水平均显著升高,但Al2O3-NPs处理组的MDA水平显著低于无Al2O3-NPs处理组,进一步证明Al2O3-NPs对Cd氧化损伤的增强作用。中、高Cd浓度时,无Al2O3-NPs处理组和Al2O3-NPs处理组的GST活性均显著下降,但Al2O3-NPs处理组的GST活性均显著低于无Al2O3-NPs处理组,同样说明了Al2O3-NPs对Cd毒性的增强作用。本研究提供了在沉积物-底栖动物体系中Al2O3-NPs促进重金属生物积累的证据,而且Cd毒性的变化与肝胰脏中Cd的生物积累水平的变化基本一致,在中、高Cd浓度下,由于Al2O3-NPs的存在显著促进了Cd的生物积累,因而增强了Cd对铜锈环棱螺的生态毒性。Abstract: The widespread applications of metal oxide nanoparticles lead to unintentional release of these materials into aquatic environments, the unique physico-chemical properties may potentially alter the ecotoxicity of co-existingcontaminants, such as heavy metals. In this work, the dynamics of Cd accumulation and the effects of Cd on two key components of antioxidant defense system, superoxide dismutase(SOD) and lipid peroxidation index malondialdehyde(MDA), and phase Ⅱ biotransformation enzyme glutathione-S-tansferase(GST) in the hepatopancreas of Bellamya aeroginosa, a benthic macroinvertebrate, were investigated in the presence of aluminum oxide nanoparticles(Al2O3-NPs) by applying chronic exposure to assess the impacts of Al2O3-NPs on ecotoxicity of Cd. The results showed that Al2O3-NPs had no significant effect on Cd bioaccumulation at low Cd concentration(5 μg·g-1). By contrast, Cd bioaccumulation was significantly enhanced by Al2O3-NPs at medium and high Cd concentration(25and 100 μg·g-1), indicating obvious carrier effect of Al2O3-NPs on Cd biotransport. At low Cd concentration, SOD activities in treatments with or without Al2O3-NPs, had no significant difference compared to the controls; at medium Cd concentration, SOD activities in all treatments significantly increased. But at high Cd concentration SOD activities significantly decreased, and moreover SOD activities in treatments with Al2O3-NPs were statistically lower than those in treatments without Al2O3-NPs, indicating the presence of Al2O3-NPs aggravated oxidative stress or damage caused by Cd. For MDA, at high Cd concentration, MDA levels in treatments with or without Al2O3-NPs significantly increased, but MDA levels in treatments with Al2O3-NPs were lower than those in treatments without Al2O3-NPs,which further testified the enhancement of Al2O3-NPs on oxidative damage by Cd. As for GST, at medium and high Cd concentration, GST activities in treatments with or without Al2O3-NPs significantly decreased, but GST activities in treatments with Al2O3-NPs were significantly lower than those in treatments without Al2O3-NPs, which also confirmed above enhancement effects. Overall, our study provided the evidence that Al2O3-NPs enhanced Cd bioaccumulation in the sediment-zoobenthos system, and the change of Cd toxicity coincided with the body burden of Cd, at medium and high Cd concentration, high levels of Cd bioaccumulation enhanced ecotoxicity of Cd on B.aeroginosa.
-
Key words:
- Cd /
- Al2O3-NPs /
- Bellamya aeruginosa /
- zoobenthos /
- sediment /
- SOD /
- MDA /
- GST
-
近年来,在西方部分国家大麻合法化的冲击下,大麻逐渐成为全球范围内使用最广的成瘾性物质. 《2021年中国毒情形势报告》[1]指出,北美地区大麻向我国输入大幅增加,涉及我国23个省份. 因此,对我国大麻滥用情况进行准确评估愈加重要. 由于毒品犯罪的特殊性和隐蔽性,传统意义上的精神活性物质调查方法较难获得准确的吸毒人员情况,污水流行病学凭借便捷、客观和实时监测等优势在毒情研判领域起到了愈加重要的作用[2 − 3]. 利用污水验毒技术评估大麻滥用情况时,常以大麻植物中的主要精神活性成分四氢大麻酚(tetrahydrocannabinol, THC)的生物代谢物四氢大麻酸(tetrahydrocannabinoic acid, THC-COOH)作为目标检测物[4 − 6]. 但由于THC-COOH是THC人体代谢后的产物,检测结果仅反映了被人体吸收代谢后的部分,忽略了通过非生物代谢等其他方式进入水环境中的部分[7],因此采用THC-COOH作为生物标志物评估大麻使用人群、追溯大麻来源时存在一定的偏差. THC、大麻酚(cannabinol, CBN)和大麻二酚(cannabidiol, CBD)是大麻植物中的三种主要活性成分[8 − 10],经人体吸食、代谢后随尿液进入污水处理系统或自然环境中,以THC、CBN和CBD作为目标物质进行大麻使用评估可能更具有代表性.
生活污水是从居民住户、公共设施和工厂的厨房、浴室、卫生间和洗衣房等生活设施中排放的废水. 人们日常生活中消费的烟草[11]、药物[12]、个人护理用品[13],以及瘾君子吸食精神活性物质后[14 − 15],其中的有效成分和代谢产物也通过生活污水排放到环境中. 因此,未处理的生活污水中也记载着这些物质的消费量等重要信息,成为污水流行病学的主要信息载体. 但精神活性物质及其代谢产物的输入一定程度上会改变水质的稳定状态,另一方面,水质参数又一定程度上影响着精神活性物质及其代谢产物的稳定性[16 − 18]. 也就是说,污水中精神活性物质及其代谢产物的稳定性与污水水质参数存在着密切联系,因此,测定生活污水中的COD、NH3-N、TP、TN、pH等基本水质参数,并研究它们与THC、CBN、CBD和THC-COOH稳定性的关系,有助于对生活污水中上述目标物进行更准确的定量分析.
本研究选取青岛市某污水处理厂的生活污水样品为研究基质,为提高污水验毒工作的准确性,采用标准加入法,研究避光和光照条件下,18 h内生活污水加标样中THC、CBN和CBD的稳定性;探究加标后样品24 h内THC、CBN、CBD和THC-COOH的浓度变化,并同步监测前述基本污水水质参数的变化情况,通过多元线性回归及相关性分析研究目标物在生活污水中的稳定性与水质参数的关系,为准确定量目标物提供依据.
1. 材料与方法(Materials and methods)
1.1 实验仪器与试剂
本研究所用主要仪器设备包括:Qtrap
5500 plus型液相色谱-质谱联用仪(美国 AB SCIEX公司);SPE固相萃取仪(SUPELCO公司);12通道氮吹仪(杭州奥盛仪器有限公司);XW-80A涡旋混合器(上海精科实业有限公司);DR2800型分光光度计、DR200型消解仪(美国 HACH 公司);SHZ-D(Ш)循环水式多用真空泵(巩义市予华仪器有限责任公司);0.22 μm有机相针式滤器(上海安谱实验科技股份有限公司).主要耗材和试剂包括:Oasis MCX固相萃取小柱(美国Waters公司);氨氮试剂盒(0—50 mg·L−1)、COD试剂盒(20—
1500 mg·L−1)和TN试剂盒(0—150 mg·L−1)(美国HACH 公司);总磷试剂盒(江苏盛奥华环保科技有限公司);标准品储备液THC-COOH(1 mg·mL−1)、THC (100 μg·mL−1)、CBN (1 mg·mL−1)和CBD (1 mg·mL−1)以及氘代内标储备液THC-D3、CBN-D3、CBD-D3(均为1 mg·mL−1)(美国Cerilliant公司);甲酸铵(分析纯,国药集团化学试剂有限公司);甲醇、二氯甲烷、甲酸(液相色谱级,J&K百灵威公司). 所有大麻素类物质标准品及氘代内标均经山东省禁毒委员会备案,严格按照公安部门的要求管理使用.1.2 样品采集
不同滥用药物在不同污水环境中稳定性存在较大差异,通常可以通过添加杀菌剂抑制生物活性以降低被生物降解的可能性,如加入浓盐酸调节水样至pH = 2等,经滤膜过滤后根据目标物的理化性质选择合适的存储条件. 但对于大麻素类物质及其主要生物代谢产物而言,酸性条件下更容易吸附到悬浮颗粒物上[3, 19],在冷冻条件下可以稳定存储大约1个月[3]. 因此,生活污水自山东省青岛市某污水处理厂采集后,不酸化样品,直接冷冻避光保存. 水样中THC、CBN、CBD和THC-COOH的初始浓度均为未检出(低于检出限).
1.3 样品前处理方法
THC、CBN、CBD前处理方法:冷冻的样品取出经室温化冻后使用. 向50 mL水样中添加50 μL浓度为200.00 μg·L−1 THC-D3、CBN-D3、CBD-D3内标混合溶液,以1—2 mL·min−1的流速过Oasis MCX萃取柱(经6 mL甲醇和4 mL纯水活化平衡)富集,富集后真空抽干多余水分,萃取柱用6 mL甲醇进行洗脱,洗脱流速小于1 mL·min−1,收集洗脱液,在低于40 ℃的氮气流下吹至近干,用200 μL甲醇复溶样品,涡旋40 s,经0.22 μm有机相尼龙膜过滤后低温避光保存,待测. 对THC-COOH前处理时,除了不使用0.22 μm有机相尼龙膜过滤外,其他流程与上述一致.
1.4 仪器分析方法
本研究采用QTRAP Enabled Triple Quad
5500 plus + 型液相色谱-质谱联用仪检测目标物,色谱柱为Kinetex 2.6u BiphenyLC(100 mm × 2.1 mm).1.4.1 THC、CBN、CBD液相色谱-质谱联用仪分析条件
流动相分别为2 mmol·L−1甲酸铵 + 1‰甲酸超纯水溶液(A相),甲醇(B相),流速为0.3 mL·min−1, 进样2 μL. 流动相洗脱梯度见表1.
表 1 THC、CBN、CBD检测的LC-MS/MS流动相洗脱梯度Table 1. LC-MS/MS mobile phase elution gradient for the detection of THC, CBN and CBD时间/minTime A/% B/% 0.0 95.0 5.0 0.5 95.0 5.0 6.0 5.0 95.0 8.0 5.0 95.0 8.1 95.0 5.0 10.0 95.0 5.0 质谱扫描模式为MRM扫描,离子源为电喷雾离子源(ESI),气帘气(CUR)为30 psi,碰撞气(CAD)为9 psi,离子化电压(IS)为
5500 V,温度(TEM)为550 ℃,离子化模式为ESI(+),喷雾气1为(GS1)55 psi,喷雾气2为(GS2)60 psi,THC、CBN和CBD及其相应内标的母离子和定性、定量离子的质荷比(m/z)及相应质谱参数见表2.表 2 目标物离子对及相应质谱检测参数Table 2. Targeted ion pair and corresponding mass spectrum parameters for targets detection目标物质Target substances 母离子Parent ionm/z 定量离子Quantitative ion 定性离子Qualitative ion 保留时间/minRetention time m/z DP/V CE/eV m/z DP/V CE/eV THC 315.1 193.1 80.0 32.30 259.4 80.0 27.30 7.33 CBN 311.0 223.1 80.0 30.24 241.3 80.0 29.60 7.21 CBD 315.1 193.1 80.0 32.30 259.4 80.0 27.30 6.91 THC-D3 318.3 196.3 80.0 29.88 262.1 80.0 28.87 7.30 CBN-D3 314.1 223.3 100.0 31.00 296.3 100.0 25.79 7.20 CBD-D3 318.3 196.3 80.0 29.88 262.1 80.0 28.87 6.91 THC-COOH 357.2 313.2 100.0 −35.00 245.3 100.0 −45.00 注:DP——去簇电压,CE——碰撞能量. 1.4.2 THC-COOH液相色谱-质谱联用仪分析条件
流动相分别为5 mmol·L−1甲酸铵 + 0.75‰甲酸超纯水溶液(A相),1‰甲酸乙腈(B相),流速为0.3 mL·min−1,进样2 μL,流动相洗脱梯度见表3. 质谱扫描模式为MRM扫描,离子源为电喷雾离子源(ESI),气帘气(CUR)为35 psi,碰撞气(CAD)为9 psi,离子化电压(IS)为-
4500 V,温度(TEM)为500 ℃,喷雾气1为(GS1)50 psi,喷雾气2为(GS2)50 psi,THC-COOH的母离子和定性、定量离子的质荷比(m/z)及相应质谱参数见表2.表 3 THC-COOH检测的LC-MS/MS流动相洗脱梯度Table 3. LC-MS/MS mobile phase elution gradient for the detection of THC-COOH时间/minTime A/% B/% 1.5 95.0 5.0 3.4 5.0 95.0 5.0 5.0 95.0 5.1 95.0 5.0 8.0 95.0 5.0 1.5 目标物定量方法及质量控制与保障(QA/QC)
THC、CBN和CBD采用内标法定量. 移取适量THC、CBN和CBD及其氘代内标的标准溶液,甲醇稀释为300.00、250.00、200.00、150.00、100.00、50.00、25.00、12.50、6.25、3.13、1.56 ng·mL−1混合标准工作液. 将配制好的标准工作液按浓度从低到高的顺序,按照“1.4.1”中的仪器分析条件依次上机测试.
THC-COOH采用外标法定量. 移取适量THC-COOH标准工作溶液,甲醇稀释为浓度分别为250.00、200.00、100.00、50.00、25.00、10.00、5.00、2.50、1.00、0.50、0.10 ng·mL−1的标准工作液,按浓度从低到高的顺序,按照“1.4.2”的仪器分析条件上机测试. 线性回归方程见表4. 结果表明,THC、CBN和CBD在1.56 — 300.00 ng·mL−1范围内、THC-COOH在0.10 — 250.00 ng·mL−1范围内,R2均大于0.99,线性关系良好.
表 4 THC、CBN、CBD和THC-COOH标准品的线性回归方程(n = 11)Table 4. Linear regression equations of THC, CBN, CBD and THC-COOH standards (n = 11)目标物质Target substances 线性回归方程Linear regression equations 相关系数(R2)Related coefficient 检出限/(ng·mL−1) LOD THC Y = 1.26160 X +0.00413 0.9979 0.14 CBN Y = 0.79960 X +0.08911 0.9975 0.28 CBD Y = 0.96553 X −0.00675 0.9985 0.21 THC-COOH Y = 21815 X −43168 0.9967 1.62 为保证数据质量,本研究采取了严格的质量控制与保障(QA/QC)手段,主要包括:现场空白(以超纯水为空白)、全过程程序空白、空白加标和基质(污水样品)加标实验. 加标实验设置低(40.00 ng·L−1)、中(200.00 ng·L−1)、高(800.00 ng·L−1)的3个浓度梯度. 每10组样品各添加一组空白质控(仅加入氘代内标)和阳性质控(加入定量的混合标准溶液(200.00 ng·L−1)和对应内标).
所有现场空白、全过程程序空白、空白质控样均未检测到目标物(低于检出限),阳性质控样的目标物回收率在80.8% — 102.2%之间;4种目标物THC、CBN、CBD和THC-COOH的空白加标回收率分别为101.2% — 116.4%、93.7% — 116.5%、97.6% — 111.1%和102.3% — 109.9%,基质加标回收率依次分别为79.9% — 118.7%、98.8% — 118.7%、82.1% — 117.6%和112.5% — 118.6%. 这些结果表明,采样、样品前处理和分析检测过程以及所用试剂均不存在目标物污染,加标回收率满足痕量有机物质的分析要求(70% — 120%之间),且仪器在整个分析过程中处于持续良好的工作状态.
2. 结果与讨论(Results and discussion)
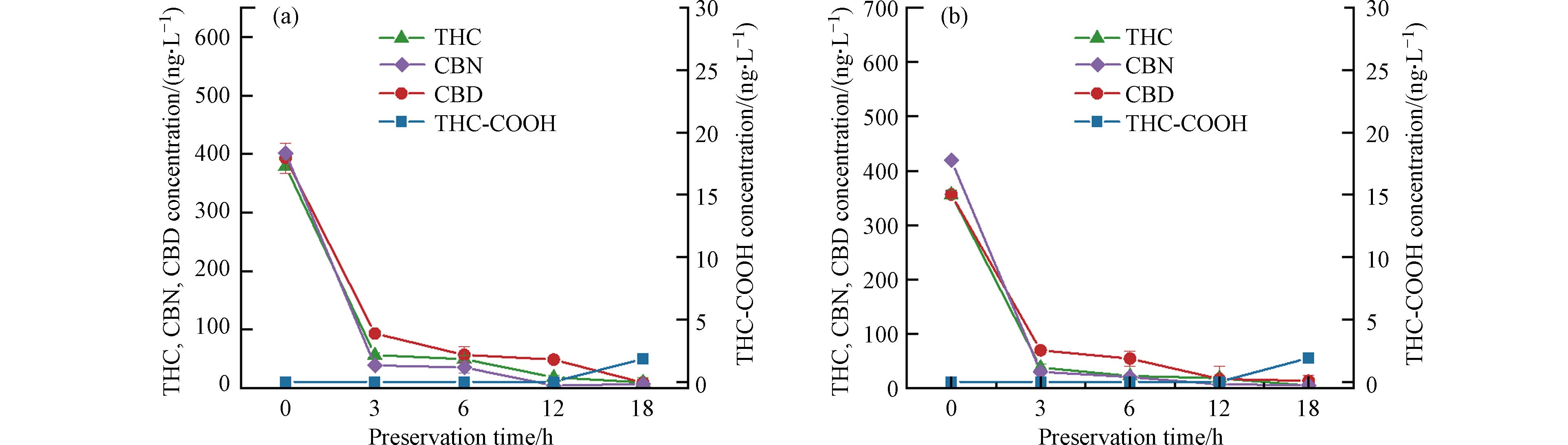
2.1 光照对生活污水中THC、CBN和CBD稳定性的影响
取50 mL生活污水样品,经检测水样中THC、CBN、CBD和THC-COOH的浓度均为未检出(低于检出限,记为0.00 ng·L−1). 向水样中添加THC、CBN和CBD混合标准物,目标物初始质量浓度为400.00 ng·L−1,常温避光和光照下保存18 h后进行分析,结果如图1所示. 可以看到,污水中添加THC、CBN和CBD后,随着存储时间的延长,无论避光或光照条件,均会生成一定量的THC-COOH(18 h时样品中的检测浓度分别为1.86 ng·L−1和1.92 ng·L−1),且随存储时间的增加,THC-COOH的浓度均呈增加趋势. Heuett等[20]认为,毒品在暴露于人体或自然环境中时,可通过水解、还原和氧化等Ⅰ期反应,引入—OH、—NH2、—SH、—COOH等官能团;How等[21]认为,THC在污水中可能会降解产生THC-COOH. 本实验水样中含量较低的THC-COOH有可能为THC在生活污水中通过引入羧基官能团生成.
为更直观地描述THC、CBN和CBD在生活污水中的降解,本研究利用去除率(按式1计算)来表征目标物的浓度变化. 去除率随保存时间的变化如表5所示.
表 5 避光、光照条件下18 h内生活污水中THC、CBN和CBD的去除率Table 5. Removal rates of THC, CBN and CBD in domestic sewage within 18 h in dark and under light irradiation保存条件Preservation conditions 保存时间/hPreservation time Ri/% THC CBN CBD 避光In dark 0 5.16 ± 6.03 −0.36 ± 1.29 1.69 ± 12.85 3 85.93 ± 1.99 90.32 ± 0.38 76.68 ± 0.67 6 87.63 ± 2.67 91.12 ± 4.81 85.75 ± 6.72 12 95.40 ± 1.90 98.94 ± 2.99 87.81 ± 1.59 18 97.50 ± 4.40 98.23 ± 1.16 97.77 ± 3.43 光照Under light irradiation 0 10.93 ± 4.10 −4.92 ± 1.06 10.90 ± 3.24 3 90.57 ± 3.58 92.53 ± 0.41 82.59 ± 2.15 6 94.43 ± 8.90 94.93 ± 1.58 86.45 ± 6.75 12 95.40 ± 0.73 98.30 ± 1.45 95.79 ± 11.87 18 98.96 ± 2.45 98.64 ± 0.43 96.63 ± 5.19 stringUtils.convertMath(!{formula.content}) (1) 式中,
Ri Cini Cfin 结果表明,光照条件下THC、CBN和CBD的去除率均高于避光条件下,说明光照一定程度上会加快THC、CBN和CBD在生活污水环境中的降解,这与孙维来[22]、杨雨[23]等的结果一致. 他们认为光照是影响大麻素类降解的重要因素. 因此样品测试前避光保存有助于更准确地定量THC、CBN和CBD.
Boix等的研究结果[24]表明,在自然环境中光照条件下,大麻素类物质除了生成THC-COOH外,还能通过羟基化反应和环己酸环上的去甲基化等反应生成C20H26O6、C21H28O6、C20H28O6、C9H13O4、C9H15O4等物质.
2.2 保存时间对生活污水中THC、CBN、CBD和THC-COOH稳定性的影响
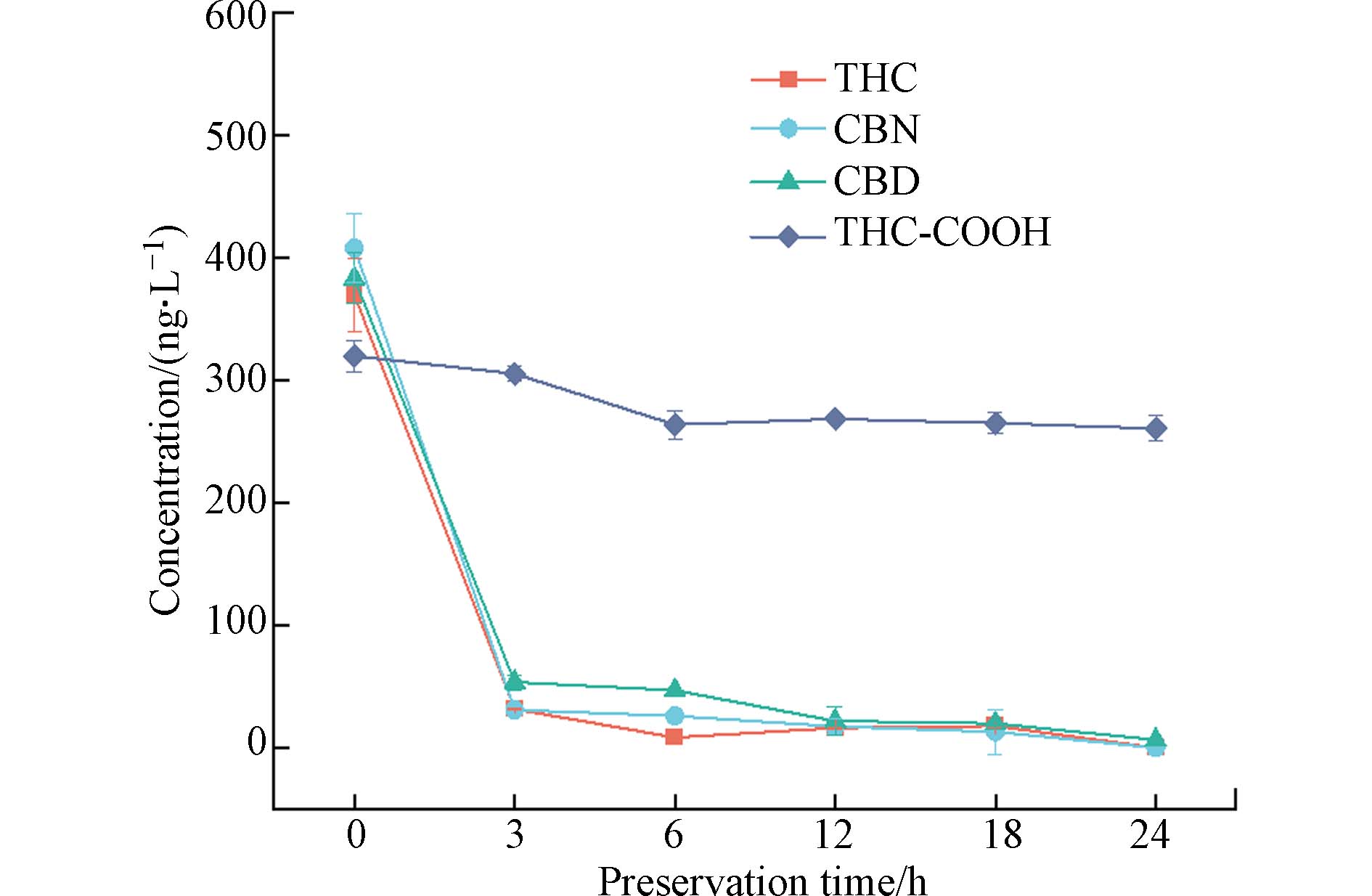
随着样品保存时间延长,无论避光或光照条件下生活污水加标样(加THC、CBN或CBD)中均有THC-COOH生成;为避免在稳定性研究中产生相互影响,将THC、CBN和CBD与THC-COOH作为两个独立体系进行研究. 分别向水样中加入THC、CBN和CBD混合标准工作溶液以及THC-COOH标准溶液,目标物初始质量浓度均为400.00 ng·L−1,常温避光保存0、3、6、12、18、24 h后进行分析. 24 h内目标物浓度变化如图2,去除率(按式1计算)结果见表6.
由图2和表6可知,避光条件下生活污水中THC、CBN、CBD和THC-COOH的检出浓度均随存储时间的延长而降低. THC、CBN和CBD的去除速度快,存储3 h后去除率分别达到了92.09%、92.27%和86.61%,24 h时THC和CBN已被完全去除,CBD去除率为98.39%. 即THC、CBN和CBD在生活污水中稳定性较差,一方面可能与污水中的微生物丰富,促进了目标物降解有关,另一方面由于大麻素具有低水溶性,易被吸附在颗粒物上而沉积到沉积物(污泥)中[21],这与Carmona等[25]在沉积物中检测到THC浓度为42.00 ng·g−1,而在同一地点的水样中未检测到THC的研究结果一致. THC-COOH在生活污水中的降解较慢,24 h内去除率维持在20.13% — 34.86%之间,稳定性高于THC、CBN和CBD. 因此,对生活污水进行大麻滥用评估时,以THC-COOH作为目标分析物,并在24 h内完成测试为佳.
表 6 生活污水加标后样品避光保存24 h内THC、CBN、CBD和THC-COOH的去除率Table 6. Removal rates of THC, CBN, CBD and THC-COOH in spiked domestic wastewaters within 24 hours in dark保存时间/hPreservation time Ri/% THC CBN CBD THC-COOH 0 7.69 ± 7.60 −1.90 ± 7.07 4.31 ± 5.15 20.13 ± 3.22 3 92.09 ± 0.10 92.27 ± 0.78 86.61 ± 1.52 23.72 ± 1.56 6 97.88 ± 0.09 93.49 ± 0.94 88.27 ± 0.28 34.09 ± 2.86 12 95.95 ± 0.21 95.62 ± 1.45 94.50 ± 2.88 32.95 ± 0.47 18 95.55 ± 0.40 96.72 ± 4.64 95.04 ± 0.32 33.79 ± 2.20 24 100.00 ± 0.00 100.00 ± 0.00 98.39 ± 0.26 34.86 ± 2.54 2.3 水质参数对生活污水中THC、CBN、CBD和THC-COOH稳定性的影响
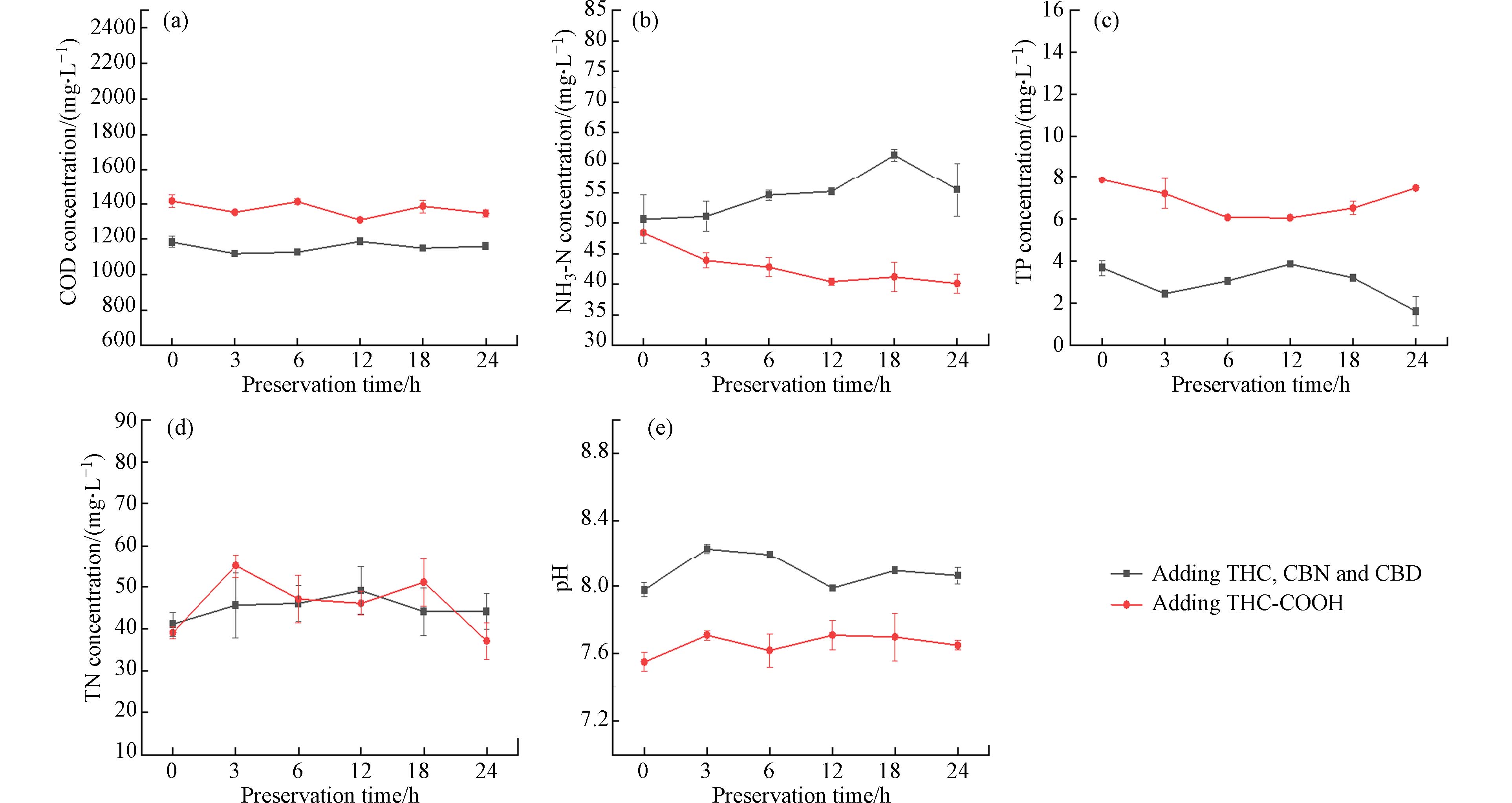
向生活污水中加入目标物质后,水样中COD、NH3-N、TP、TN浓度和pH值变化趋势如图3所示. 由图3可知,生活污水中加入THC、CBN和CBD后,24 h内COD、TP浓度随存储时间增加先降低后升高再降低,NH3-N浓度逐渐升高,TN浓度和pH值先升高后降低. 加入THC-COOH后,COD浓度随存储时间增加先降低后升高再降低,NH3-N浓度逐渐降低,TP浓度先降低后升高,TN浓度在37 — 55 mg·L−1范围内波动,pH值先升高后降低.
为确定生活污水中THC、CBN和CBD以及THC-COOH稳定性与存储时间(t)、水质参数之间的关系,本研究采用逐步分析法,对生活污水样品保存过程中自变量(t、COD、NH3-N、TP、TN浓度和pH)与因变量(THC、CBN、CBD和THC-COOH去除率)进行多元线性回归. 共线性诊断结果表明,自变量的VIF值均小于10,不存在多重共线性,可进行多元线性分析. 通过SPSS statistics软件计算确定回归方程(如式 (2) — 式 (5)),方差分析结果如表7所示. 所有回归模型的R2大于0.89,P值低于0.05,说明拟合的方程具有统计意义,且存储时间、COD浓度、NH3-N浓度等自变量可以较好地解释生活污水中THC、CBN、CBD和THC-COOH去除率的变化规律.
表 7 污水加标样中目标物去除率与样品保存时间t和典型水质参数间的回归方差分析Table 7. Variance analysis for the correlation between removal rates of THC, CBN, CBD, THC-COOH in spiked domestic wastewaters and sample preservation time t as well as common water quality parameters目标物质Target substances F P R2 THC 7.602 0.021 0.901 CBN 6.878 0.026 0.892 CBD 8.253 0.018 0.908 THC-COOH 14.550 0.005 0.946 生活污水加标样品中目标物去除率的多元线性回归方程分别为:
stringUtils.convertMath(!{formula.content}) (2) stringUtils.convertMath(!{formula.content}) (3) stringUtils.convertMath(!{formula.content}) (4) stringUtils.convertMath(!{formula.content}) (5) 其中,自变量X1、X2、X3、X4、X5和X6分别为存储时间/h、COD浓度/(mg·L−1)、NH3-N浓度/(mg·L−1)、TP浓度/(mg·L−1)、TN浓度/(mg·L−1)和pH值(无计量单位),μ为随机误差.
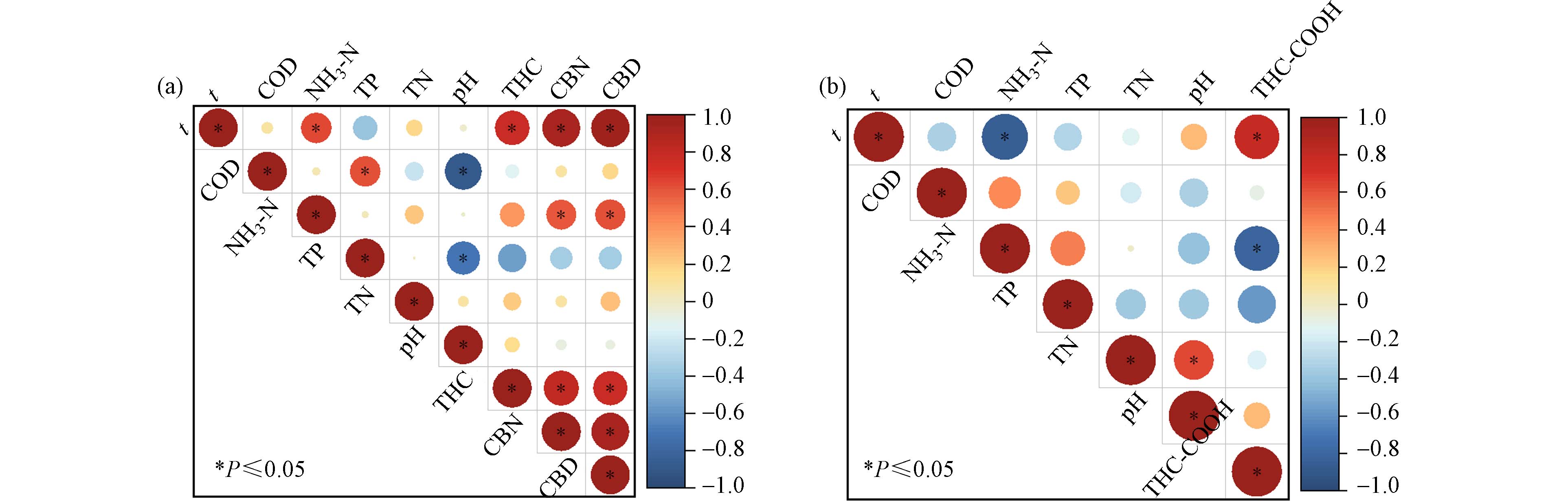
运用Origin使用Spearman相关绘制相关性热图,如图4所示. 在P ≤ 0.05的置信水平上,THC去除率与t(r = 0.78)具有正相关性,CBN、CBD去除率均与t(r分别为0.93、0.96)和NH3-N(r分别为0.59、0.61)存在正相关性,相关性强弱为t > NH3-N,THC-COOH去除率与t(r = 0.79)具有正相关性,与NH3-N(r = −0.80)存在负相关性,相关性强弱为NH3-N > t. 这表明t对上述四种目标物去除率均有较大的影响,NH3-N对CBN、CBD和THC-COOH去除率影响较大,说明硝化作用对生活污水中目标物稳定性具有重要作用[26].
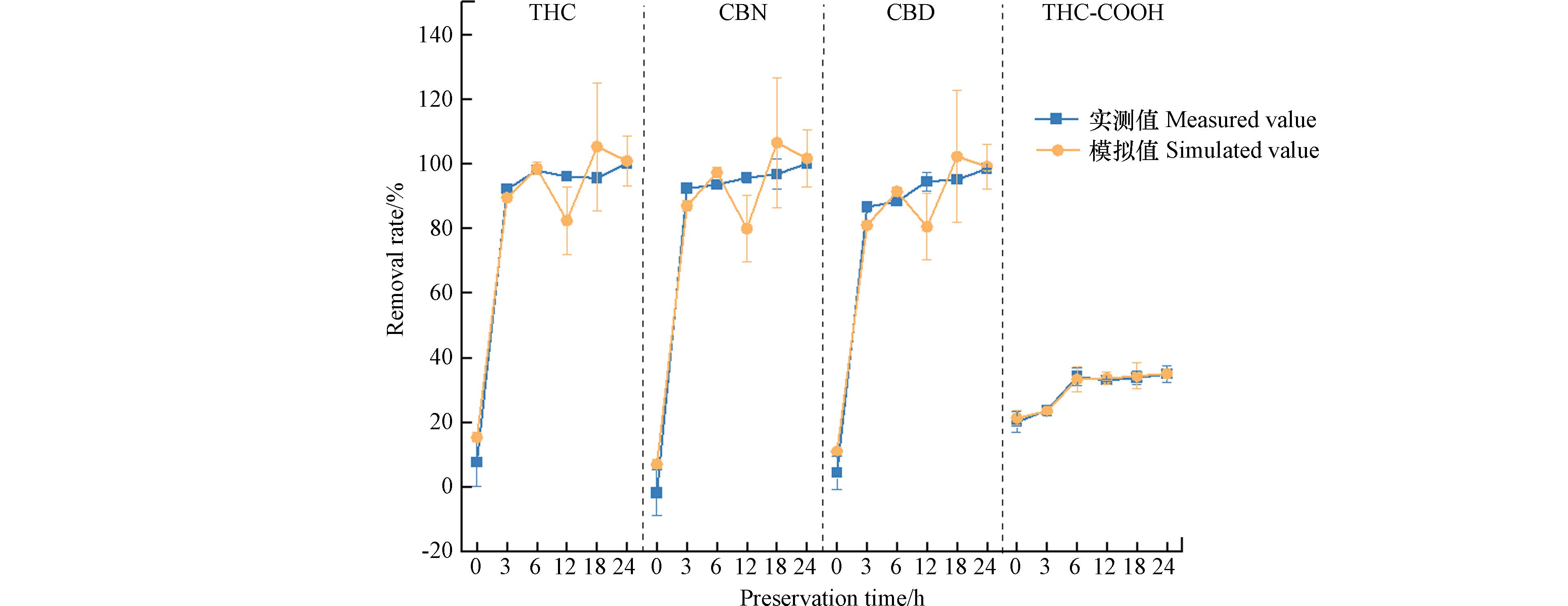
实测值与模型值的比较如图5所示. 运用自变量由模型得出的四种目标物去除率的模拟值与实测值接近,说明模型具有较好的预测准确性和可靠性.
3. 结论(Conclusion)
1)避光和光照条件下,THC、CBN和CBD在生活污水中均能降解产生较低浓度的THC-COOH,光照会加快THC、CBN和CBD的降解,样品测试前避光保存对于大麻素类物质的准确定量非常重要.
2)生活污水中THC-COOH稳定性高于THC、CBN和CBD. 因此,利用生活污水进行大麻滥用评估时,以THC-COOH作为目标分析物,且在24 h内完成分析测试为佳.
3)生活污水加标样中大麻素类物质去除率与样品保存时间和常规水质参数(COD、NH3-N、TP、TN浓度和pH值)有较好的相关性. 其中THC去除率与保存时间具有正相关性,CBN、CBD去除率均与保存时间和NH3-N存在正相关性,THC-COOH去除率与保存时间具有正相关性,与NH3-N存在负相关性. 表明存储时间对所有目标物的稳定性均有较大影响,取样后尽快完成测试对于准确定量目标物至关重要.
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 549
- HTML全文浏览数: 549
- PDF下载数: 20
- 施引文献: 0





 DownLoad:
DownLoad: