-
废弃矿业冶炼厂旧址污染场地是一种特殊土地类型,复垦利用对生态环境、国土空间和资源节约有重要作用[1]. 中国是世界上锑资源储量最多的国家,占全球总量的52.80%. 绝大部分产于西北地区和西南地区低温成矿域,因此,遗留了大面积锑(Sb)和砷(As)严重污染的废弃采矿区、尾矿库和冶炼区. Sb和As是化学元素周期表第五主族的类金属元素,具有相似的原子外电子结构[2]. 它们在地球化学上常常共存[3 − 5],因此在矿区中双污染现象十分普遍[6]. 这两种元素都是对动植物和人类有潜在危险的非必需有毒微量元素[7],包括它们的化合物已被美国EPA和欧盟列为优先控制污染物[8]. 因此,已引起广泛关注.
外源重金属进入土壤系统后会发生迁移[9 − 10]. 迁移能力越强,污染范围越大[11]. 而这种迁移性受到重金属总量与赋存形态分布的影响,它们又受到土壤pH值、有机质含量和阳离子交换量的影响[12],从而引起重金属迁移性的变化[13]. 前人研究表明,Sb和As在进入土壤后与有机质分子结构中的活性官能团发生络合作用,从而形成带负电或中性的络合物,并改变它们在环境中的行为[14 − 16],降低其迁移性和活性. 然而,Sb和As也可能与有机质竞争吸附点位,促进它们的迁移[17 − 19],进而增大污染风险. 此外,土壤有机质含量还随着土壤pH增大而下降,从而降低对Sb元素的固定能力[20 − 21]. 一般来说,阳离子交换量可以反映有机质含量,并且还会影响污染物在土壤中的迁移转化过程[22],随着土壤阳离子交换量含量的增加,重金属的生物有效性会降低[23].
目前关于西北地区和西南地区废弃锑厂污染场地剖面土壤中Sb和As迁移特性方面报道较少. 因此,在本研究中选择这两个地区具有代表性的废弃锑冶炼厂污染场地上的土壤作为研究对象,进行了多种重金属和养分含量分析,并采用多种方法进行了污染评估和生态风险评价. 同时,本文将以探讨土壤性质对Sb与As的赋存形态分布影响为切入点来讨论其对于这两种元素在土壤剖面中迁移行为制约作用. 以期为深入理解土壤pH值、有机质含量以及阳离子交换量等指标对于Sb与As的环境行为产生影响提供理论依据.
-
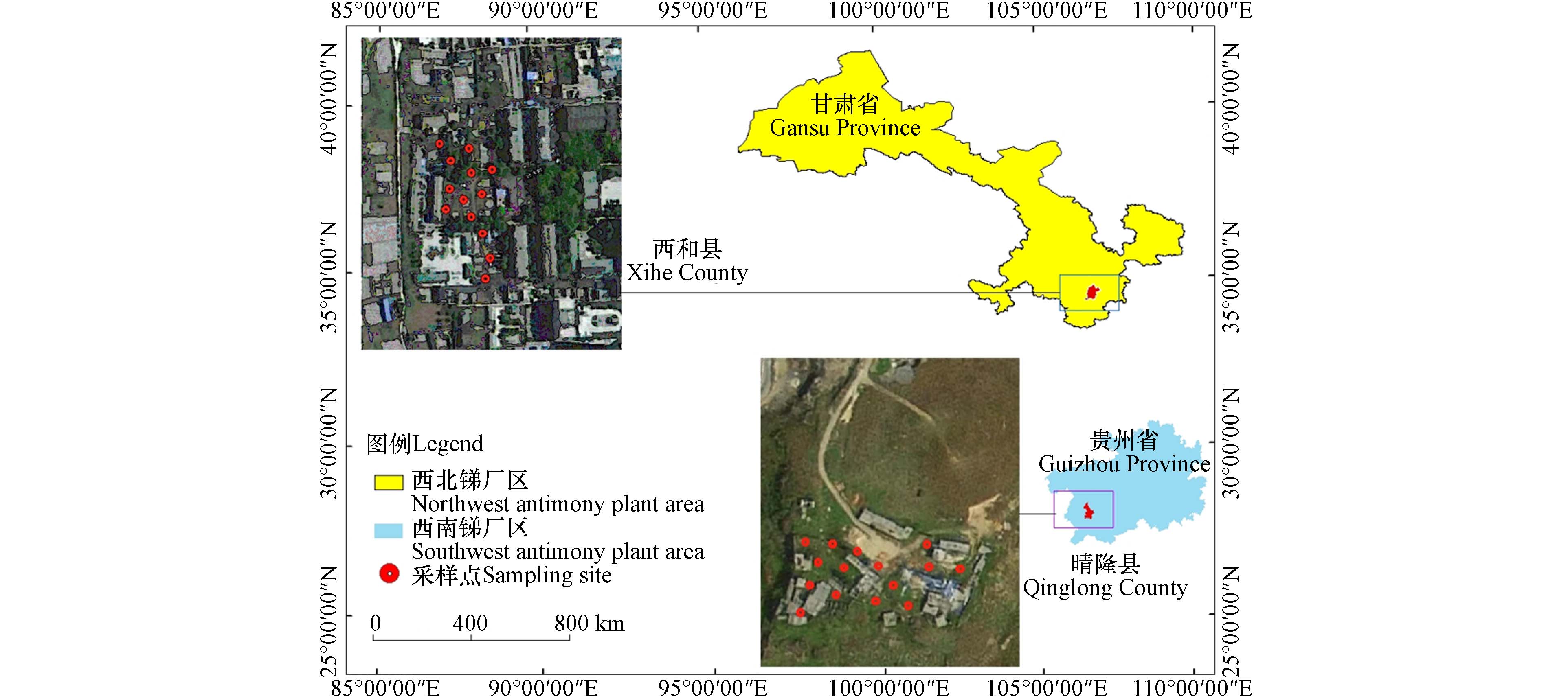
选取了两个具有代表性的废弃锑冶炼厂旧址污染场地土壤样品. 其中一种采集自(西北地区)甘肃省西和县(105°30′E,34°02′N(图1),位于西秦岭山区、高山峡谷、水系发育,潮湿温暖,无霜期长,年平均气温为8.4 ℃,海拔
1574.05 m. 该冶炼厂紧邻嘉陵江二级支流太石河,并被居民住宅区和农田环绕. 该地土壤主要为碱性壤质黏土. 另一种样品来自(西南地区)贵州省晴隆县(105°22′E,25°83′N)(图1),位于云贵高原中段、切割强烈的岩溶地貌区域. 该地属于温凉湿润的高原亚热带气候,降霜及凝冻时间相对较短,年平均气温为14.1 ℃,海拔1812.49 m,地下水系统丰富,并广泛分布着伏流、地下河床、溶洞、落水洞以及岩溶干沟等特征. 该冶炼厂区北面毗邻城区,南面则是林地和农田. 该处土壤主要为酸性和微酸性红黄土. -
于2021年6至9月期间,按照《土壤环境监测技术规范》(HJ/T 166—2004)[24]的要求,在卫星导航仪的指引下结合锑厂区污染场地地形和地物样点布设,避开放置矿渣的区域,并确定西北锑厂(XH)区和西南锑厂(QL)区各有12个和15个采样点位(详见图1). 为确保样品代表性,每个土层土样均由5个子样混合而成. 以GPS记录点为中心,先用挖掘机剖出长宽深1.5 m×1.5 m×1.5 m的土坑,再用木铲去除挖掘斗头接触的土壤后,使用木制直尺准确测量并分别采集0-30 cm、30-70 cm和70-100 cm共3个层次的土壤剖面样品. 采集过程中使用木铲进行取样,并保持每一位置5次采集量相同. 待混合后按四分法取约重为1.5 kg左右的标本装入聚乙烯袋内密封并标记信息后运回实验室. 参考《土地质量地球化学评价规范》(DZ/T 0295—2016)[25],对所得到的标本进行风干处理、碾压去杂质、粉碎等预处理工作,并通过10目筛和100目筛分别获得适于进行理化性质及重金属含量检测所需之试料. 所有实验所需试剂均选用优级纯品.
-
根据GB
15618 —2008《土壤环境质量标准》[26],选择了Cd、Cr、Ni、Cu、Hg、Pb以及As和Sb这8种重(类)金属作为关注的指标. 对于重金属的总量测定,采用了HCl-HNO3-HF-HClO4微波消解方法;而对于As和Sb的化学形态提取,则使用了Tessier法[27],该方法将重金属形态划分为可交换态(E1)、碳酸盐结合态(C2)、铁锰氧化态(F3)、强有机结合态(O4)和残渣态(R5). 所有8种元素的总量含量以及5种提取态含量均通过ICP-MS(电感耦合等离子体质谱仪,Agilent 7500c,USA)进行测定. 土壤pH值则是按照Zhao等[28]所使用的方法进行测定,水土比例为5:1. 有机质含量则采用K2Cr2O7氧化法进行测定[29]. 阳离子交换量则依据Rhoades[30]所提出的方法来确定. 土壤粒度组成则通过比重计法来测定[31]. 土壤总磷(P)含量采用分光光度法(GB9837 —1988)[32]进行定量分析,而土壤总氮(N)含量则利用自动定氮仪法(NY/T1121.24 -2012)[33]来检测. -
研究区未受到人为污染的背景土壤中N与P实测均值作为背景值,单项污染指数计算公式(1):
式中,
Si 为污染物的单项污染指数;Ci 为评价因子的实测值,mg·kg−1;Cn 为评价因子i的标准值或背景值,mg·kg−1. 综合污染指数计算公式(2):式中,FT综合污染指数;
Fimax 为最大单项污染指数;Fiave 为n项污染物污染指数平均值. 分级标准见表1.地累积指数法是综合考虑受人为污染和地球化学背景共同影响,判别污染土壤生态风险程度的一种评价方法,计算公式如下(3):
式中,
Igeo 为重金属的地累积指数;Ci 为重金属元素的实测值;B 为重金属元素在土壤中的地球化学背景值,本研究取甘肃省[34]和贵州省[35]土壤元素背景值;K 为背景值变动系数,此处取K =1.5,污染程度分级标准见表1.潜在生态危害指数法由瑞典科学家Hakanson(1980)[36]提出,是根据重金属的性质和环境行为等特征来评价土壤中重金属污染,计算公式如下(4)(5)(6):
式中,
Cf 为某单一重金属污染系数,Ci 为评价因子的实测值,Cn 为重金属元素i的参比值,本文取甘肃省[34]和贵州省[35]土壤元素背景值,Er 为某单一重金属潜在生态风险因子,Tr 为某金属生物毒性相应因子,RI为综合潜在生态风险指数,在潜在生态危害指数法中,Cd、Cr、Ni、Cu、Hg、Pb、As和Sb重金属的毒性系数分别取30、4、4、5、40、5、10和10[37]. 污染程度分级标准见表1.参考常见的风险评价编码法(RAC)和次生相与原生相分布比值法(RSP)两种方法对重金属Sb和As进行有效性评价. 其中E1和C2为生物可利用态,F3和O4合称为潜在生物可利用态,R5则称为生物不可利用态[38]. RAC主要关注E1和C2,其计算公式如下(7):
式中,
RAC 为T1(E1和C2之和)占总量的质量分数,%;T1 为E1和C2之和的含量,mg·kg−1;t 为Tessier 5种形态含量之和,mg·kg−1.RSP将土壤分为原生相和次生相,通过计算次生相与原生相的比值评价重金属对土壤环境的污染程度. 其计算公式如下(8):
式中,
RSP 为次生相与原生相的比值;Msec 代表次生相中重金属含量,本文以Tessier法提取的前四种态含量之和为次生相重金属含量,mg·kg−1;Mprim 则代表残渣态(原生相)含量,mg·kg−1. 评价标准见表1. -
土壤重金属的迁移性是评估其生态环境效应的关键指标. 由于重金属的E1和C2具有较高的生物有效性和迁移性,对环境造成较大危害. 因此,在本研究中,采用有效态含量(即E1和C2含量之和)与总量之比来表示迁移系数,以描述Sb和As元素的迁移转化能力[39 − 40].
-
西北锑厂(XH)区和西南锑厂(QL)区污染场地的表层(0-30 cm)土壤重金属含量数据统计见表2. XH区的Cd、Cr、Ni、Cu、Hg、Pb、As、Sb、N和P的总量均值分别为甘肃省土壤重金属背景值的12.33、1.01、1.21、1.23、173.06、5.69、2.96、
4611.73 、1.07、0.75倍,P以外其余元素均超过了背景值. 其中,Sb和As的总量分别为4150.56 mg·kg−1和37.28 mg·kg−1;而在QL区的Cd、Cr、Ni、Cu、Hg、Pb、As、Sb、N和P的总量均值分别是贵州省土壤重金属背景值的5.00、0.95、0.70、2.54、3.86、2.75、21.52、8819.77 、0.55、1.70倍;除了Cr、Ni、N之外其他都超过了背景值;其中,Sb和As的总量分别高达19756.28 mg·kg−1和236.90 mg·kg−1. 两个锑厂区的100%采样点位上表层土壤中Sb和As总量都出现了超标现象. 对比发现,Cd、Ni、Hg和Pb总量分布为XH区>QL区,Cr、Cu、As、Sb、N和P的总量分布为QL区>XH区. 变异系数(CV)显示,在两个锑厂区内,Cd、Pb、As、Sb、N和P 的CV都大于36%,说明它们具有较强变异性,并且可能与人类活动有关. 此外,Hg以及在QL区的Cu也具有较强变异性,而其他重金属元素基本处于中等变异范围(15%≤CV≤35%). 表明两个锑厂区的表层土壤普遍存在超过背景值和标准限值的重金属,且呈现明显的空间差异性,其中人类活动及外源输入可能是导致土壤重金属污染主要原因之一. -
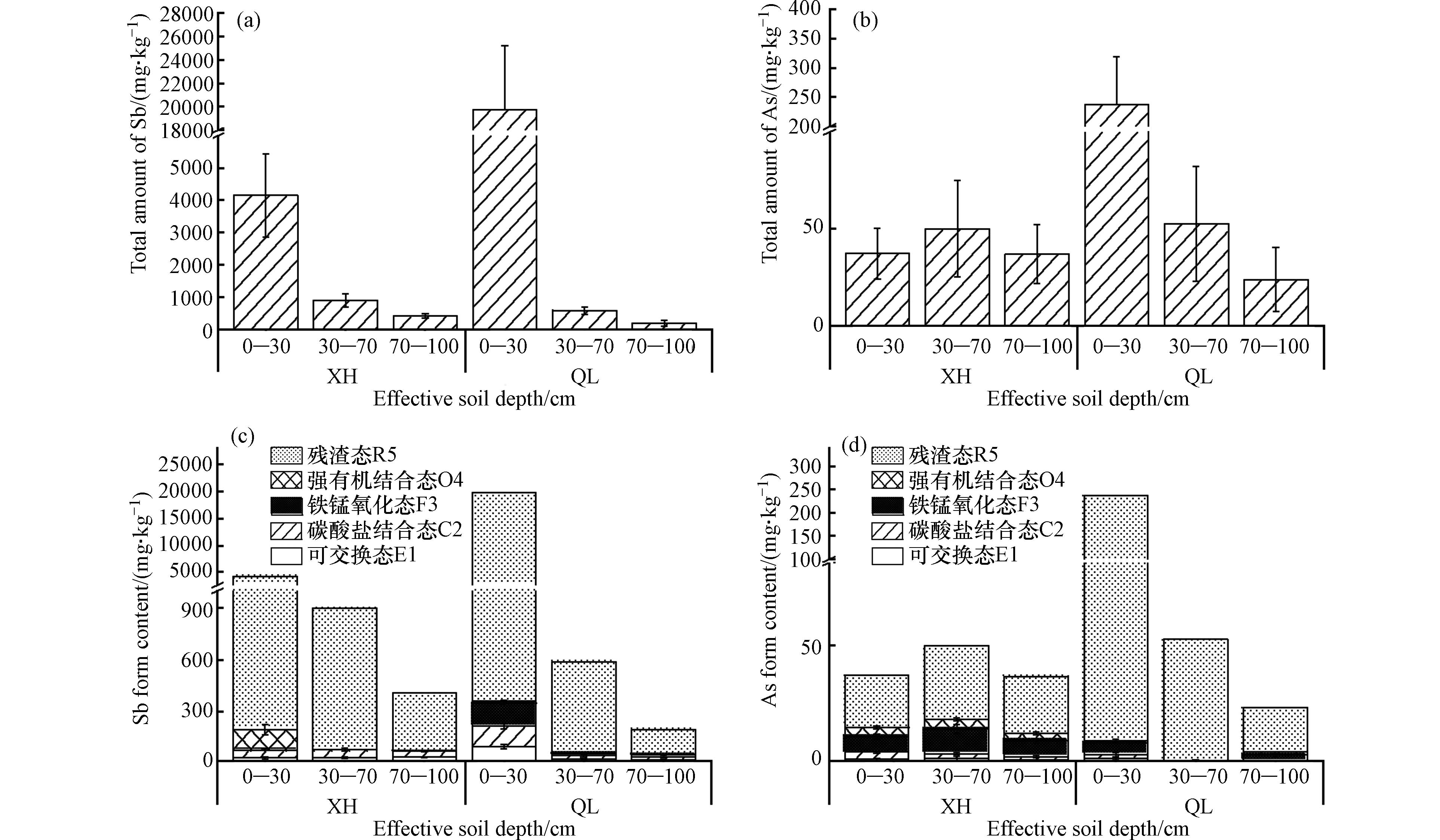
由于土壤中Sb和As的积累较为显著,因此进一步探讨了垂直剖面土壤中Sb和As及其赋存形态变化特征. 其结果如图2所示. 从图2可知,随着土层深度增加,Sb和As的总量含量呈现先迅速下降后缓慢下降的趋势,主要富集在表层土壤中. 具体而言,在XH区的底层(70-100 cm)土壤中,Sb和As的总量含量分别减少了90.10%和1.07%;而在QL区的底层土壤中,Sb和As的总量含量分别减少了99.00%和89.97%,表明QL区的Sb和As的降低率更为显著. 这可能是因为QL区的土壤pH值较低、有机质含量及阳离子交换量较高,导致Sb和As的降低率更显著[41 − 44]. 此外,两个锑厂区的Sb总量的垂直降低率较As显著. 由于Sb与As是同组元素且存在竞争吸附关系,在土壤中主要以不同形式存在:Sb主要以Sb(OH)6-、Sb(OH)3的形式存在[45],As主要以AsO43-、AsO2(OH)2-和AsO33-等形式存在[46]. 与Sb相比,As在其化学结构中含有少量羟基并存在砷氧双键,因此更为稳定,而Sb则具有多个易于发生螯合等反应的羟基官能团. 此外,Sb离子直径比As更大[47]. 因此,Sb在土壤胶体和铁锰氧化物等介质中较易被吸附形成络合物或发生共沉淀作用. 前人研究表明,在垂直迁移过程中,Sb相对较不活跃[48 − 50],主要积累在表层土壤中,在深层中浓度较低[51 − 53].
两个锑厂区污染场地采样点剖面土壤中,Sb和As主要以残渣态(R5)存在. 在XH区的不同土层中,Sb和As的残渣态含量分别约占总量的90.00%和65.00%左右,而在QL区的不同土层中,Sb和As的残渣态含量分别约占总量的70.00%和65.00%(图2). XH区的表层中,Sb的化学形态特征整体上呈现为R5>O4(强有机结合态)>C2(碳酸盐结合态)>E1(离子交换态)>F3(铁锰氧化态),在中层和底层则呈现为R5>C2>E1>O4>F3;而不同土层中As总体上表现为R5>F3>O4>C2>E1. QL区的表层中,Sb的化学形态特征整体上呈现为R5>F3>C2>E1>O4,在中层和底层则呈现为R5>C2>E1>F3>O4;而不同土层中As总体上表现为R5>F3>C2>O4>E1. 除了残渣态以外,XH区的Sb和As的E1和C2含量之和(有效态含量)随土层深度的增加变化不大;在QL区,表层中Sb和As的有效态含量明显高于底层和中层. 同时,通过对比发现,在表层,QL区的Sb有效态含量为166.96 mg·kg−1,明显高于XH区(74.92 mg·kg−1),而在中层与底层数值则呈现出XH区>QL区. 另一方面,在不同土壤深度上,As的有效态含量均显示出XH区>QL区,并且其数量远低于同一土壤深度上的Sb. 这说明两个不同地理位置的锑厂区存在着Sb和As的赋存形态差异. 这可能是因为XH区的3个土层都呈碱性,而QL区的表层土壤呈中性或弱碱性,而中层和底层数则呈弱酸性. 前人研究已证明,土壤pH是影响重金属生物有效性最显著的因素之一[54 − 55]. 由于阴离子交换机制主导了土壤中Sb和As的吸附过程,在体系pH升高时会促进其解吸释放[56],从而增加其生物有效性. 说明了除了总量外,土壤特征也对其中所含有的Sb和As元素的生物有效性产生影响.
-
土壤重金属的迁移能力不仅与总量相关,还与其存在形态密切相关[57,12]. 重金属的形态分布明显影响其迁移性、毒性和生物有效性等特征[58]. 然而,土壤重金属的存在形态变化主要受到土壤理化性质、气候条件和人类活动等综合因素的影响,其中土壤理化性质(如土壤pH值、有机质含量和阳离子交换量)具有最为显著的作用.
-
两个锑厂区的不同土层中Sb和As的迁移系数见表3,其与其总量以及5种形态存在密切关联(表4). 相关系数普遍超过0.80(P<0.01). 具体来说,在表层土壤中,Sb的迁移系数与其总含量以及5种形态呈现出明显负向关联;然而,在中层和底部土壤,则显示出明显正向关联,并且与E1和C2之间的相关系数最高可达1.00的相关性(P<0.01). 说明两个锑厂区中Sb和As的迁移能力随着它们的总量及生物有效性增加而增加,但在表层中,随着Sb总量及生物有效性的增加,其迁移能力反而下降.
-
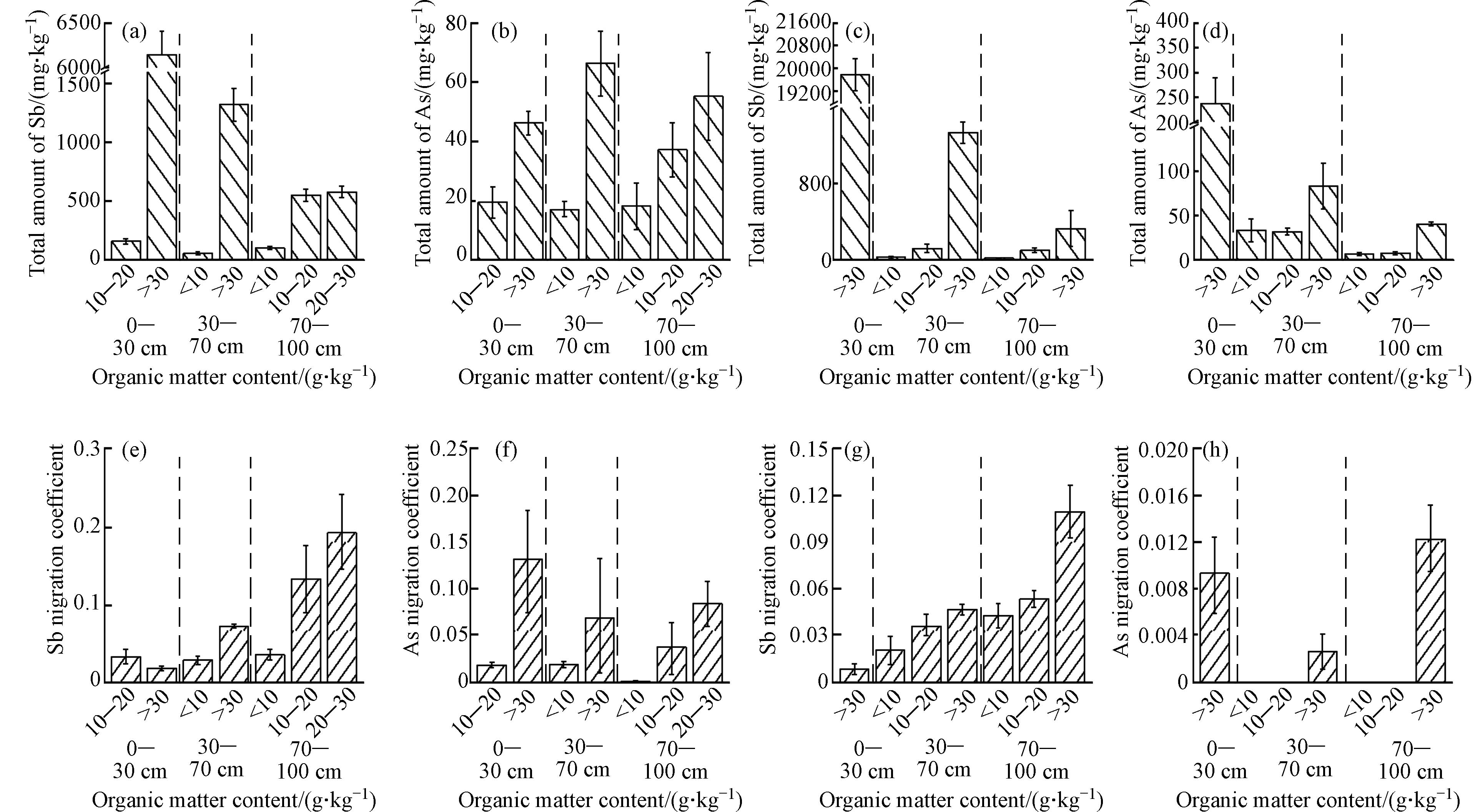
土壤pH值是影响重金属吸附解吸过程及迁移能力的重要因素之一. 不同的土壤pH会导致土壤的吸附性、配位、沉淀和电荷等要素发生变化,从而引起重金属不同形态含量的变化. 图3展示了土壤pH与土壤中Sb和As总量及其迁移系数之间的关系. 由于XH区的不同层次的土壤都呈碱性,因此无法直接进行评估(图3a、图3b、图3e和图3f). 对于QL区而言,在偏碱性条件下(pH 7.6-7.7),不同土层中Sb和As的总量和迁移系数均较高(图3c、图3d、图3g和图3h). 在相同土层中,与酸性相比,中性条件下Sb和As的总量和迁移系数均较高,并且具有更强的迁移能力. 这说明适当降低土壤pH值并保持酸性有利于减少Sb和As的迁移风险. 在不同土层中,底层中Sb和As总量相对较低,但迁移系数却较高,存在向表层或向下迁移潜在风险. 表明底层的Sb和As的迁移能力主要受到生物有效性影响.
-
土壤中的有机质可以与重金属发生络合和螯合反应,形成具有不同化学和生物学稳定性的物质,并促使不同形态之间相互转化,从而影响土壤中重金属的分布和积累[59]. 图4显示了土壤中有机质含量与Sb和As总量及其迁移系数之间的关系. 在两个锑厂区的不同土层中,随着土壤有机质含量增加,Sb和As的总量和迁移系数均呈现增加趋势. 在同一土层中,当有机质含量大于30 g·kg−1时,Sb和As的总量和迁移系数明显高于有机质含量小于10 g·kg−1或介于10-20 g·kg−1之间时,迁移能力较强. 在不同土层中,底层相对于表层和中层来说,Sb和As的总量较低,但迁移系数较高,存在潜在向表层或向下迁移风险. 这说明底层土壤中Sb和As的迁移能力主要受到生物有效性影响.
-
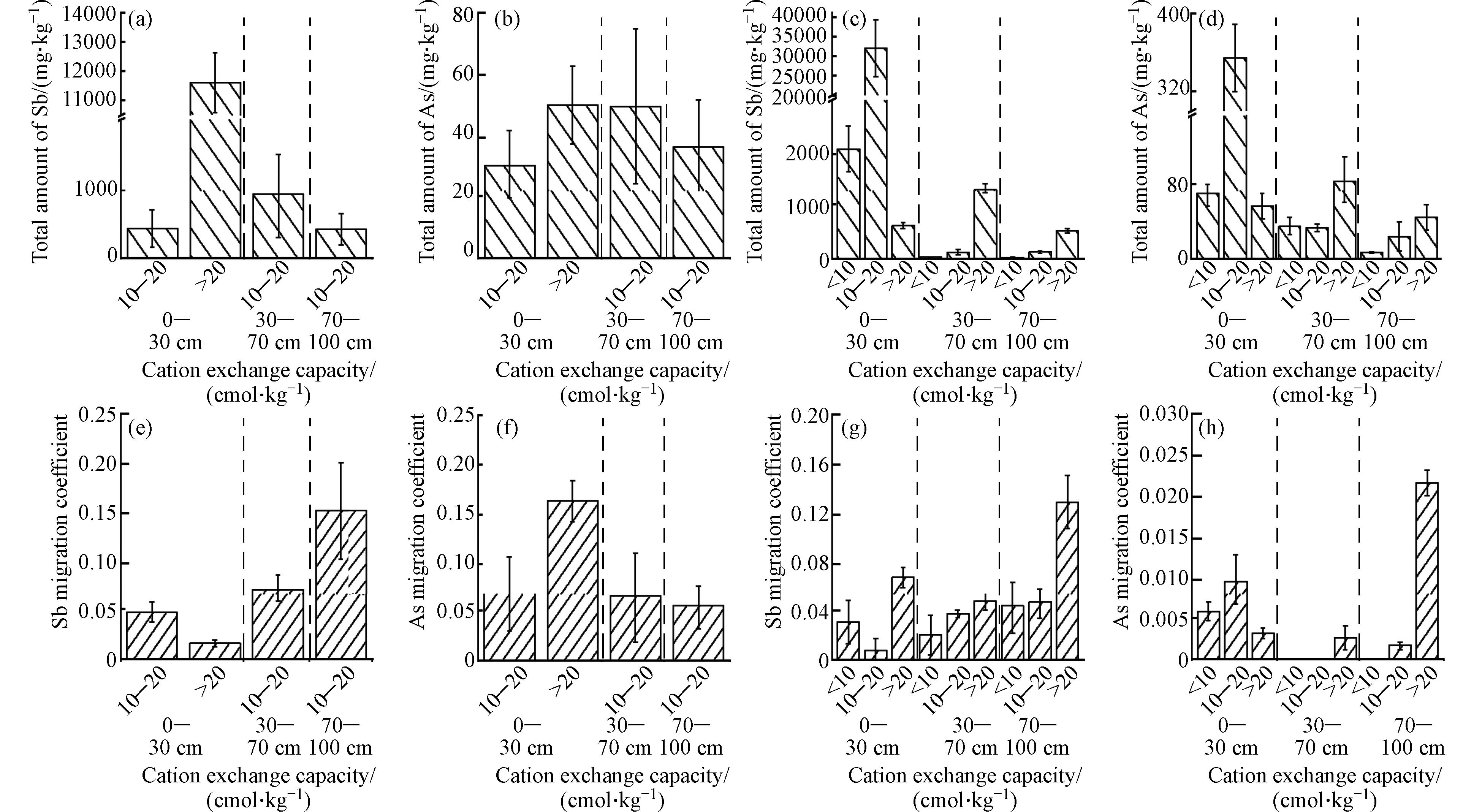
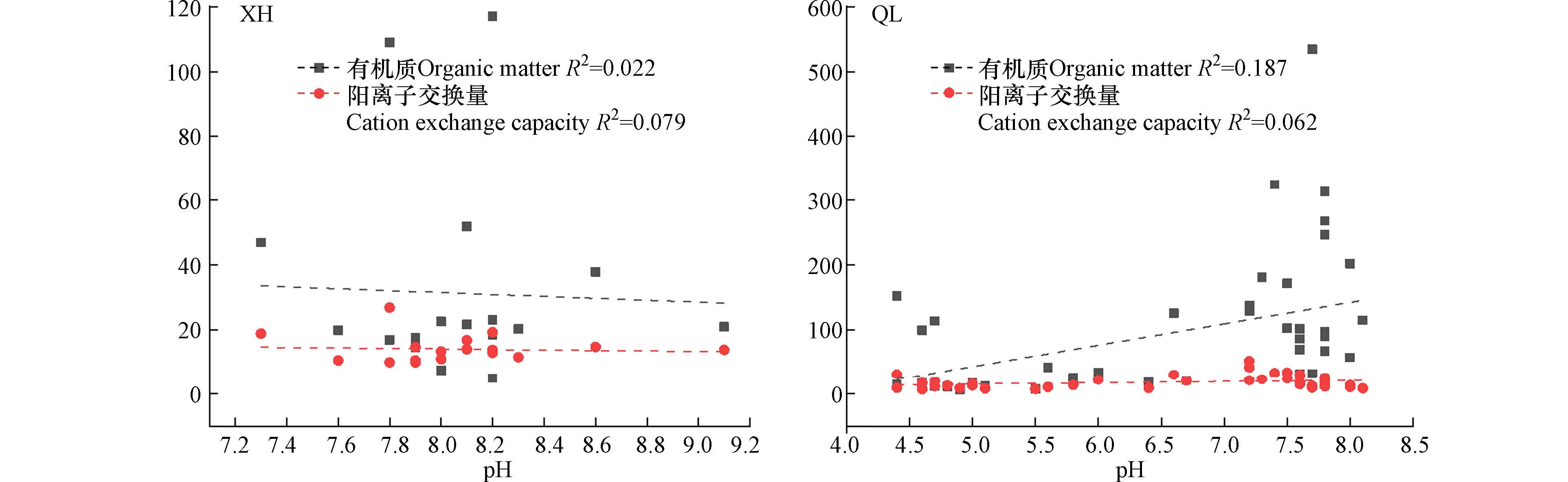
图5显示了土壤阳离子交换量与土壤中Sb和As的总量及其迁移系数之间的关系. 从图5中可知,在XH区的表层土壤中,随着阳离子交换量的增加,Sb和As的总量和迁移系数均呈上升趋势. 然而需要注意的是,Sb的迁移系数则呈现下降趋势(图5a、图5b、图5e和图5f). 在QL区的表层土壤中,当阳离子交换量大于10—20 cmol·kg−1时,Sb和As的总量明显较高,但迁移系数相对较低. 而在中层和底层土壤中,随着阳离子交换量增加,Sb和As的总量和迁移系数也逐渐增加,并且在阳离子交换量大于20 cmol·kg−1下达到最高水平(图5c、图5d、图5g和图5h). 同一土层中,除了XH区的表层中Sb以及QL区的表层中Sb和As的总量与它们的迁移系数不一致外,其余土层在高阳离子交换量下,显示出较高的Sb和As总量和迁移系数. 不同土层中,相对于表层和中层而言,底层的Sb和As总量较低,但迁移系数却较高,表明存在潜在的向表层和向下迁移的风险,底层土壤中Sb和As的迁移能力主要受到生物有效性影响.
综上所述,底层土壤中Sb和As存在潜在的向表层和向下迁移的风险. 这可能是由于氧化还原电位(Eh)在重金属元素行为中起到了关键作用[60]. 底层土壤的Eh较低,导致Sb(OH)6-逐渐还原为Sb(OH)3以及AsO43-逐渐还原为AsO33-,从而提高了它们的溶解度[47]. 此外,在不同土层中,高有机质含量和阳离子交换量条件下,Sb和As的总量及有效态含量均较高,表明有机质对Sb和As具有很强吸附能力. 通过进一步分析剖面土壤pH与有机质含量和阳离子交换量之间的关系发现(图6),随着土壤pH增大,两个锑厂区土壤阳离子交换量变化不显著,但在QL区,有机质含量随之增加,而在XH区,有机质含量却随之下降. 这些结果与前人研究[20 − 21]相符合. 同时,本研究还发现,在高土壤pH、有机质和阳离子交换量条件下,土壤中Sb和As则呈现出较高的生物有效性,其迁移能力较强,因此推测当前阶段主要以物理吸附形式存在,被吸附的Sb和As主要存在于有效态形式,并未转化为更稳定形态. 前期研究也表明两个锑厂区受人类活动影响大不同于自然母岩成土过程. 因此,基于本研究结果,建议当前阶段应通过适当调节相关理化性质指标,并投加吸附材料或生物碳基材料来促进老化过程、加快不稳定形态向更稳定状态转变;还可以通过生态修复植被(种植高富集Sb与As元素的植物)去除有效污染源,以减少甚至预防其迁移风险.
-
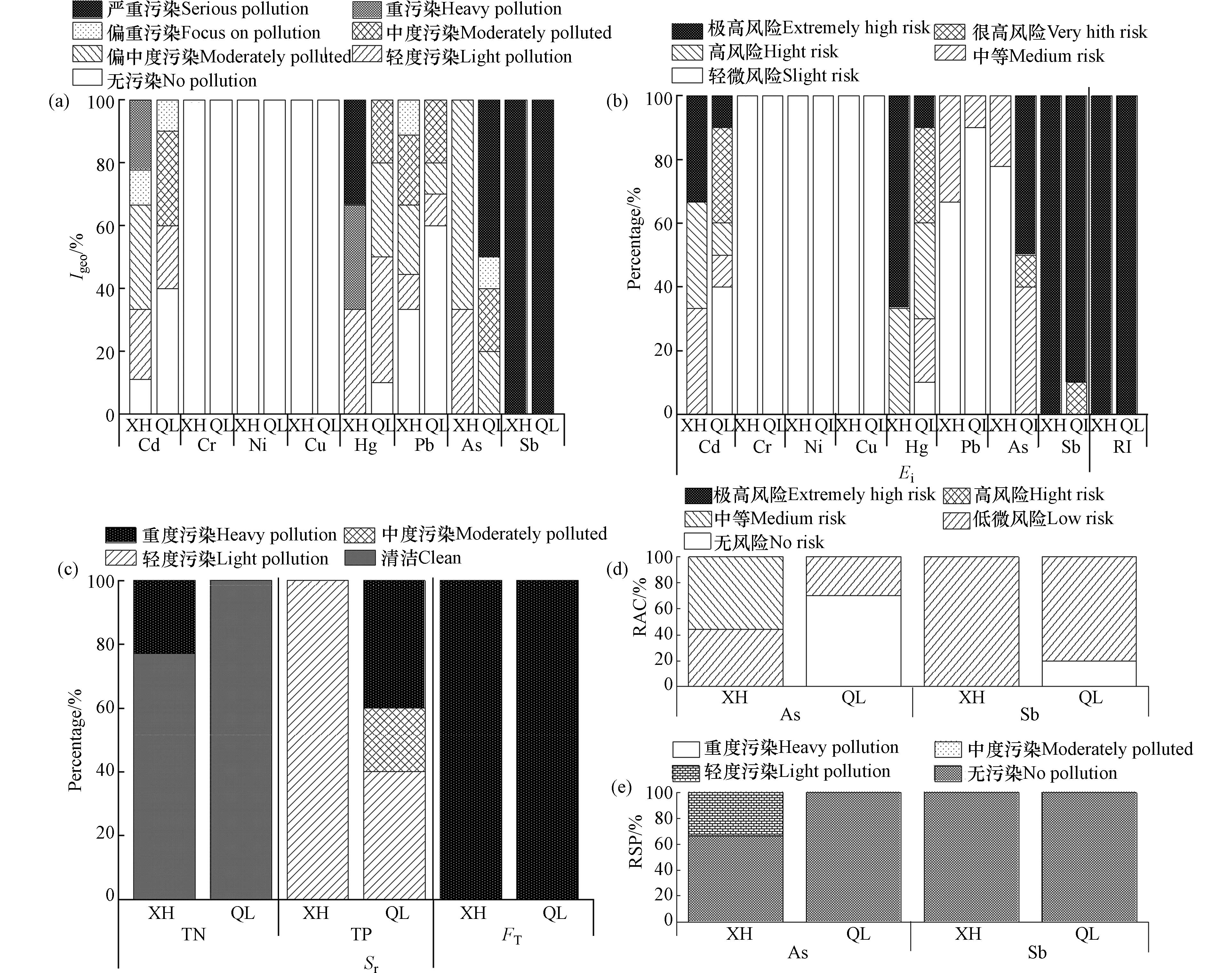
利用地累积指数法进行污染程度分析,根据图7a显示的结果,在XH区的8种重(类)金属的地累积指数顺序为Sb>Hg>Cd>As>Pb>Cr>Ni>Cu,而QL区则为Sb>As>Hg>Cd>Pb>Cr>Ni>Cu. 这表明在两个锑厂区中,Sb和As是污染程度较高的重金属元素.
采用单项重金属潜在生态危害指数(Er)评价法对8种重(类)金属的生态危害指数进行分析,结果见图7b. 从图中可以得知,两个锑厂区的Cu、Ni和Cr处于轻微风险以外,而其他重金属均存在中等以上的风险. XH区的8种重金属综合潜在生态危害指数(RI)范围为
1812.20 -137693.24 ,平均值为48657.80 ,处于极高风险,占比高达100.00%. 其中Sb是主要贡献因子之一,其Er范围为1618.47 -117281.82 ,均值为41854.19 ,在极高风险水平上. 在QL区的8种重金属的RI范围为1250.34 -377745.29 ,均值为76023.29 ,处于极高风险,占比也高达100.00%. Sb和As是主要贡献因子之一,在该地区Sb和As的Er分别范围1067.19 -376347.71 和49.01-3943.85 ,均值分别为74635.07 和1050.56 ,都属极高风险. 表明两个锑厂区均存在严重的外源富集现象,并且其生态风险程度较高,Sb和As是首要的潜在生态风险因子.图7c显示了两个锑厂区土壤中N和P的营养污染风险的比较. XH区的土壤中N和P的单项污染指数(Si)分别为0.33-0.25和0.65-0.89,综合污染指数(FT)为0.74-3.56;而QL区的土壤中N和P的Si分别为0.07-0.83和0.61-4.45,FT为0.70-4.73. 显然,QL区的污染指数相对较高. 在QL区,N的风险等级被评定为清洁,而P则被评定为重度、中度和轻度污染,其占比分别是40.00%、20.00%和40.00%. 在该地区FT方面,风险等级被评定为重度,其占比为100.00%. 而在XH区,N的风险等级被评定为重度与清洁,其占比分别是23.08 %和76.92%,而P则都属于轻度污染. 在该地区FT方面,风险等级被评定为重度,其占比也是100.00%. 表明两个锑厂区均存在着较大程度上的N与P营养物质污染,并且QL区所面临的问题要大于XH区.
土壤重金属赋存形态的分析为研究重金属来源和生物有效性提供了关键信息[61]. 考虑到研究区域Sb和As元素外源富集严重,选择这两种元素作为研究对象,并采用Tessier法提取它们的不同形态,以探索其潜在风险. 图7d和图7e展示了两个锑厂区的Sb和As形态的潜在风险结果. 通过比较风险评价编码法(RAC),发现对于Sb元素,在XH区的100.00%样点处于低风险范围,在QL区的80.00%样点处于低风险范围,其余为无风险;而对于As元素,在XH区的44.44%样点处于低风险范围,其余样点均为中等风险;在QL区的66.67%样点处于无风险,其余样点则均为低风险(图7d). 根据次生相与原生相的比值计算结果(RSP),除了XH区的33.33%样点存在轻度污染情况外,其他样点及所有QL区的样点中的Sb和As都未受到污染影响(图7e).
综上所述,对比地累积指数评价法与潜在生态危害指数评价法 ,结果表明,这两种方法存在差异. 地累积指数法主要反映外源重金属的富集程度,而潜在生态风险指数法则更加关注不同金属毒性对生物的影响. 同时,相较于地累积指数评价法和潜在生态危害指数评价法,风险评价编码法和次生相与原生相分布比值法对Sb和As的污染风险程度结果有很大差异. 地累积指数评价法和潜在生态危害指数评价法显示Sb和As的污染风险程度严重,但风险评价编码法和次生相与原生相分布比值法则显示轻微或无污染风险. 这与前人相关研究结果一致. Marrugo-Negrete等[62]发现,Ni的地积累指数表明严重污染,而RAC方法则认为是低风险. 杨新明等[63]对As进行了评估发现,潜在生态风险指数方法认为是轻微至中等水平的风险,而RAC方法认为是低风险. 胡青青等[57]对Cd进行了潜在风险评估,在RAC方法中结果显示为中等及以下级别的风险,而RSP方法主要表明严重污染情况存在. 丁竹红等[64]的研究表明,重金属的毒性不仅取决于其总量,还取决于其有效态. 显然,基于重金属总量的分析无法充分说明土壤重金属污染特性和危害性. 因此,在评估土壤污染水平和生态风险时,需要着重关注土壤中重金属存在形式及各形式相对含量,尤其是易被生物吸收利用的重金属形态[65]. 综合多种评价方法可以更准确地评估土壤污染水平和生态风险.
-
(1)两个锑厂区污染场地的表层土壤中,Sb总量超过当地背景值的
4158.48 倍和7463.51 倍. 其他重金属元素以及N和P的总量也超过了背景值. 综合评价结果显示,两个锑厂区存在严重的重金属和养分污染问题,生态风险高. 其中,Sb污染最严重,其次是As、Cd、Hg和Pb以及N和P的污染程度处于中等水平,而Cr、Ni和Cu则没有出现污染风险. 外源输入对Sb、As、Cd、Pb以及N和P含量产生了影响,因此需要采取措施改善这种情况.(2)随着土层深度增加,Sb和As的总量呈递减趋势. 尤其是在QL区中,Sb元素的降低率更为显著. Sb和As在化学形态方面也存在明显差异. 然而,它们主要以残渣态存在,并且占比较高(65.00%-90.00%). 就有效态而言,在表层中,QL区的有效态Sb含量大于XH区,在中层和底层则相反. 此外,不同土层上As的有效态含量显示出XH区大于QL区,并且数量远低于同一土层上的Sb.
(3)土壤pH、有机质含量和阳离子交换量是影响剖面土壤中Sb和As迁移性的关键因素. 当土壤呈碱性、有机质含量超过30 g·kg−1并且阳离子交换量大于20 cmol·kg−1时,在不同土层中总Sb和总As的积累达到最高水平. 然而,这也会导致它们的生物有效性明显增加,提高迁移风险. 其中,Sb主要以E1和C2增加,而As则倾向于F3和O4增加. 此外,底层土壤中Sb和As还存在潜在向表层和向下迁移的风险. 研究还发现,随着土壤pH值增大,两个锑厂区的阳离子交换量变化不明显,但在QL区有机质含量呈上升趋势,而在XH区则呈下降趋势. 因此,在XH区建议适度降低土壤pH值并提高有机质含量以增强对Sb和As的吸附能力. 根据本研究结果,在当前阶段可以考虑采用植物-稳定化技术联合修复治理两个研究区:一方面通过投加吸附材料或生物碳基材料来促进土壤老化过程,从而加速Sb和As的不稳定形态向更稳定形态的转变;另一方面采取植被种植等修复方法来降低它们的生物有效性,以减少迁移并缓解营养污染风险. 但具体修复方案需根据实地情况进行进一步研究评估以确定最佳措施.
西北和西南某废弃锑冶炼厂污染场地剖面土壤锑砷迁移性及其影响因素
Soil antimony and arsenic migration characteristics and influencing factors in the contaminated site profiles of an abandoned antimony smelting plant in northwest and southwest
-
摘要: 针对矿业废弃地高背景值-历史矿业源相叠加区下土壤重金属污染问题,选取了西北地区甘肃西和和西南地区贵州晴隆两个地区的废弃锑冶炼厂旧址污染场地土壤作为对象,全面分析了土壤样品中镉(Cd)、铬(Cr)、镍(Ni)、铜(Cu)、汞(Hg)、铅(Pb)、砷(As)、锑(Sb)、氮(N)和磷(P)等元素含量,运用综合污染指数法、地累积指数法、潜在生态风险指数法以及风险评估编码法等多种方法进行了污染评估与生态风险评价. 同时,初步探讨了元素总量,赋存形态以及土壤理化性质对Sb和As在土壤剖面中迁移行为的影响. 结果表明,两个地区的废弃锑冶炼厂旧址污染场地表层(0—30 cm)土壤存在严重的重金属和养分污染风险. 其中,Sb是最严重的污染物,其次是As、Cd、Hg、Pb、N和P,而Cr、Ni和Cu无污染风险. 此外,随着土层深度的增加,Sb和As的总量逐渐减少. 尤其在西南晴隆锑厂区,Sb含量下降更为显著. 土壤中Sb和As的赋存化学形态方面存在明显差异,但它们主要以残留态形式存在(占65.0%—90.0%). 土壤pH值、有机质含量和阳离子交换量是影响土壤中Sb和As迁移性的关键因素. 当土壤呈碱性、有机质含量超过30 g·kg−1以及阳离子交换量大于20 cmol·kg−1时,Sb和As在不同土层中的积累达到最高水平. 然而,这也会导致它们的生物有效性增加,提高迁移风险,尤其是在底层土壤中. 建议在当前阶段可以考虑采用植物-稳定化技术联合修复治理这两个研究区:一方面通过投加吸附材料或生物碳基材料来促进土壤老化过程,从而加速Sb和As的不稳定形态向更稳定形态的转变;另一方面采取植被种植等修复方法来降低Sb和As的迁移性和生物有效性,并缓解营养污染风险.Abstract: This study addresses the issue of heavy metal pollution in soil within the overlay area of high background values from mining waste land and historical mining sources. Soil samples were collected from an abandoned antimony smelting plant in Xihe, Gansu (northwest China), and Qinglong, Guizhou (southwest China). Comprehensive analyses were conducted on cadmium (Cd), chromium (Cr), nickel (Ni), copper (Cu), mercury (Hg), lead (Pb), arsenic (As), antimony (Sb), nitrogen (N), phosphorus (P), and other elements. Various assessment methods, including the comprehensive pollution index, geo-accumulation index, potential ecological risk index, and risk assessment coding, were employed to evaluate pollution and ecological risk. The study also explored the impact of total contents, chemical forms, and soil properties on the migration of Sb and As in the soil profiles. The findings indicated a significant risk of heavy metal and nutrient contamination in the surface soil (0–30 cm) of abandoned Sb smelting plant sites in both studied areas. Among these contaminants, the Sb emerged as the most serious pollutant, followed by As, Cd, Hg, Pb, N, and P. Conversely, Cr, Ni, and Cu posed no pollution risk. Furthermore, the total concentrations of Sb and As gradually decreased with increasing soil depth, with a more pronounced decrease observed in the Southwest Qinglong area. Distinct differences in geochemical fractionations of Sb and As were observed, and most of Sb and As existed in the form of residual fraction, accounting for 65.0%—90.0% of the total contents. Key factors influencing the mobility of Sb and As in the soil included soil pH, organic matter content, and cation exchange capacity. In alkaline soils, where the organic matter content exceeded 30 g·kg−1 and the cation exchange capacity surpassed 20 cmol·kg−1, the accumulation of Sb and As in different soil layers reached the highest levels. However, this circumstance also resulted in an elevated bioavailability of Sb and As, thereby increasing the risk of migration, particularly in subsoils. Notably, it is recommended to consider plant-stabilization technology for the joint restoration and treatment of these research areas. On the one hand, the addition of adsorbent materials or biocarbon-based materials can be used to promote the soil aging process, expediting the transformation of unstable forms of Sb and As into more stable forms. On the other hand, restoration methods such as vegetation planting can be employed to reduce the mobility and bioavailability of Sb and As, and alleviate nutrient pollution.
-
Key words:
- soil /
- heavy metals /
- risk assessment /
- migration ability.
-
矿山开发过程中会产生大量的固体废弃矿物,在自然环境中风化和微生物的氧化过程中伴随着有毒有害元素的释放,并逐渐形成了高硫酸根、高铁浓度的极端酸性矿山废水 (acid mine drainage,AMD) ,造成了矿区附近流域水体及土壤重金属的污染,严重威胁矿区生态系统安全及人群健康[1-4]。因此,AMD所引起的环境污染已成为国内外研究热点。
以广东省韶关市大宝山金属硫化物矿区为例,ZHUANG等[5]发现,受矿区酸性废水的长期影响,大宝山矿区附近土壤的pH多低于5,土壤中铜、铅、锌和镉的平均质量分数分别为502 mg·kg−1、278 mg·kg−1、498 mg·kg−1和3.92 mg·kg−1,远超过国家标准 (GB15618-2018) 限值。而AMD表层沉积物中的重 (类) 金属,如Pb、As和Cr的质量分数高达3 100、1 896和170 mg·kg−1[6-7]。据沉积物矿物学特征调查可知,AMD污染的流域中易形成大量特征性的含铁羟基硫酸盐次生矿物[8-10]。例如,当pH为2.8~4.5时,AMD环境中的三价铁和硫酸根离子共沉淀形成典型的施氏矿物 (schwertmannite) ;当体系中存在一价阳离子且pH为1.5~3时,易形成以黄铁矾类为主的矿物;当pH>5时,Fe3+水解产生的矿物主要为水铁矿[11-12]。由于类质同象作用,这些含铁羟基硫酸盐次生矿物容易吸持AMD中的重 (类) 金属离子,使其演变成为重 (类) 金属离子的沉淀库。同时,含铁硫酸盐次生矿物容易在环境因子 (pH、还原性物质、溶解性有机质 (dissolved organic matter,DOM) 和共存离子浓度等) 改变时,发生溶解重结晶,使其吸附和共沉淀的重 (类) 金属再次释放到相应的水体流域中,造成二次生态风险[13-16]。然而,目前关于大宝山矿区环境中重金属环境风险的研究主要针对矿区土壤中重金属的迁移。
在AMD环境中,可溶性S(-II)可由硫酸盐还原菌还原硫酸根产生,并通过还原、沉淀和络合等途径对矿区中重 (类) 金属的迁移转化起制约作用[17]。例如,在厌氧环境下,S(-II)可还原溶解铁 (氢) 氧化物等矿物且自身形态发生改变,亦引起了所吸持的重 (类) 金属再次释放[18-20]。然而,关于可溶性S(-II)与矿区沉积物中次生矿物的稳定性及重 (类) 金属的迁移转化动态关系的报道还甚少。
基于此,本研究围绕大宝山矿区拦泥库沉积物,采用流动柱进行模拟淋溶实验,模拟还原大宝山矿区拦泥库沉积物中的重 (类) 金属在还原性S(-II)介导下的垂直迁移特征,以探究S(-II)对拦泥库沉积物次生矿物的稳定性影响与重金属环境行为的关系,以期为金属硫化物矿区的环境修复与污染防治提供参考。
1. 材料与方法
1.1 实验主要试剂
主要试剂或药品:硫化钠 (Na2S,GR) 购自上海阿拉丁生化科技有限公司,硝酸 (HNO3,AR) 和氢氧化钠 (NaOH,AR) 购买于西陇科学股份有限公司;重 (类) 金属标准溶液购自于国家有色金属及电子材料分析测试中心,以5%的硝酸定容;实验用水为去离子水。
1.2 沉积物样品的采集与预处理
沉积物样品于2018年8月采集于大宝山矿区拦泥库 (经度:113°43′4.75″E,纬度:24°31′27.57″N) ,沉积物样品采集的深度为10 cm,沉积物样品呈现赭黄色。重金属质量分数分别为Pb 2 450 mg kg−1,Zn 1 009 mg kg−1,Mn 1 211 mg kg−1,Cu 680 mg kg−1,Cr 95 mg kg−1,Cd 16 mg kg−1,Mo 68 mg kg−1,以及As 760 mg kg−1。经采集的样品于干燥后压碎并混匀研磨过100目筛后进行密封保存,供沉积物流动柱实验和样品表征。
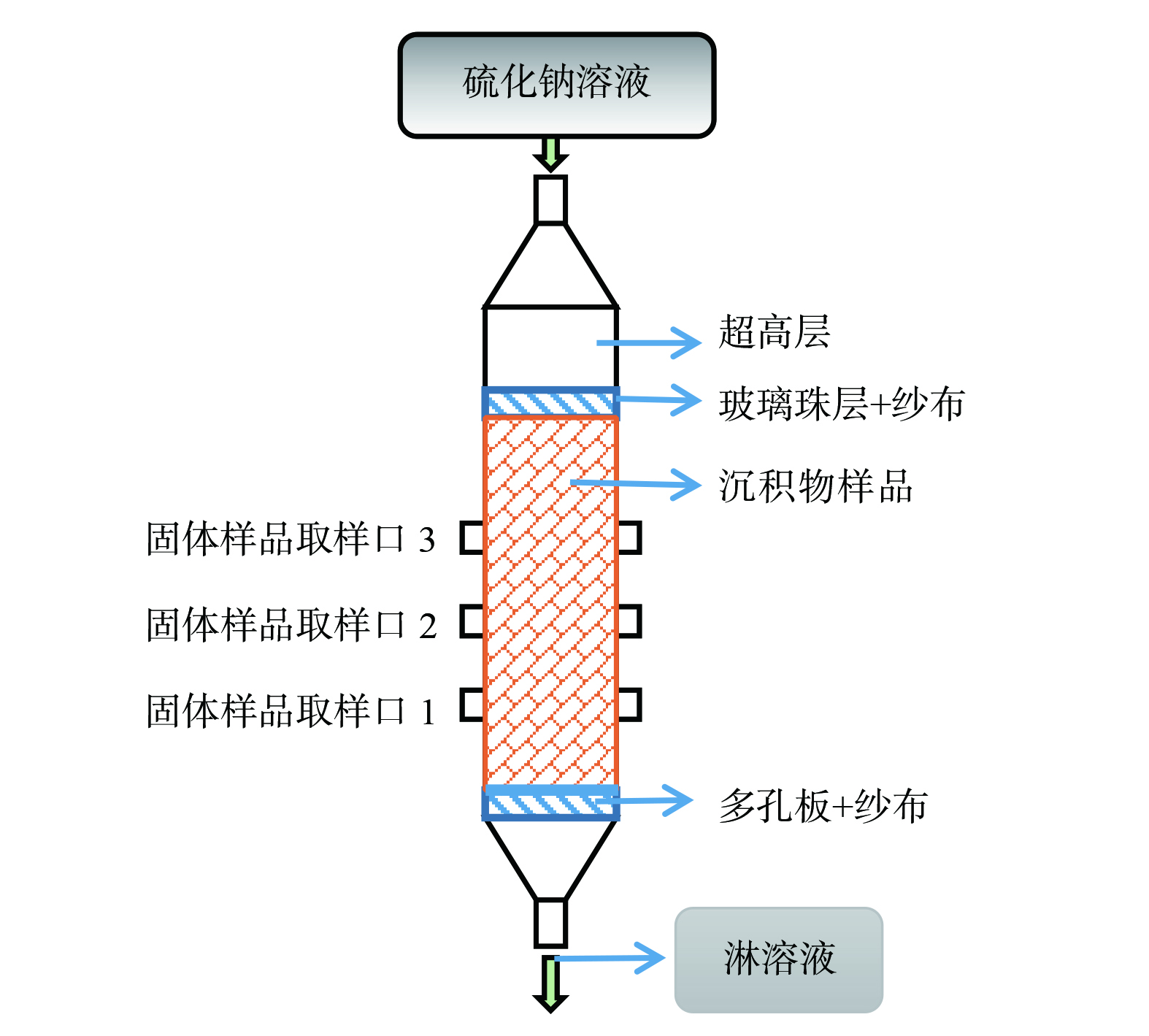
1.3 沉积物柱实验模拟研究实验及装置
实验装置如图1所示。淋滤柱体由有机玻璃制作而成,其内径为50 mm,高度为200 mm,在两侧各有3个直径10 mm的取样孔,其间距均为20 mm。在柱体底部放置一张滤网,然后平铺一层粒径为2 mm的石英砂。将粉末状样品填入柱体中,填充高度约为15 cm,轻微震荡后依靠重力使样品压实。在样品顶层放置一张滤网,并平铺一层粒径为2 mm的石英砂,避免水力作用对样品产生冲刷,模拟自然条件下的重力渗透过程。组装其他部件,将柱体固定在铁架上。所填沉积物样品的质量约为258.61 g。先向柱体通入初始pH为2.5的模拟AMD溶液以充分润湿沉积物并使孔隙饱和。其中,AMD溶液中各类重 (类) 金属的质量浓度分别约为SO42− 540.000 mg·L−1、Zn2+ 101.290 mg·L−1、Cu2+ 3.355 mg·L−1、AsO42− 0.024 mg·L−1、Cd2+ 0.170 mg·L−1、Pb2+ 0.349 mg·L−1、CrO42− 0.022 mg·L−1、MoO42− 0.011 mg·L−1及Mn2+ 80.620 mg·L−1。然后,每隔24 h分别添加30 mL质量浓度分别为10 mg·L−1和100 mg·L−1的Na2S溶液进行淋滤,空白对照组为去离子水。每日收集淋出液,约30 mL。实验周期为31 d。
1.4 样品收集及测定
液体样品用一次性取样针进行采集。经0.45 μm的水系滤膜过滤后,用pH计 (上海雷磁,PHS-3C) 测定样品pH,随后滴加1滴5%硝酸进行酸化,置于4 ℃下保存。使用电感耦合等离子体发射光谱仪 (ICP,日本岛津) 测定溶液中重金属离子浓度,并使用Origin 2018软件进行绘图。ICP测定过程中通过标准样品的回收率 (< 5%) 进行质量控制。
当淋溶实验结束后,在柱体3个取样口的沉积物分别混合均匀后各取约2 g沉积物样品。另取2 g未进行淋溶实验的沉积物样品作为对照,烘干后用聚乙烯离心管密封保存。使用X射线衍射仪 (XRD,德国布鲁克,D8 Advance) 分析样品的晶型结构。X射线为Cu靶Kα射线 (λ= 0.154 18 nm) ,管电压和管电流分别为40 V和40 mA,扫描区域为10°~80°,扫描速度为10°·min−1。利用场发射扫描电镜 (SEM,FEI Nova Nano SEM 450) 检测反应前后的固体颗粒样品的形貌。同时,采用0.2 mol·L−1草酸铵 (pH=3) 对固体样品进行避光萃取4 h,以验证重金属在还原态矿物相中的相对含量。
2. 结果与讨论
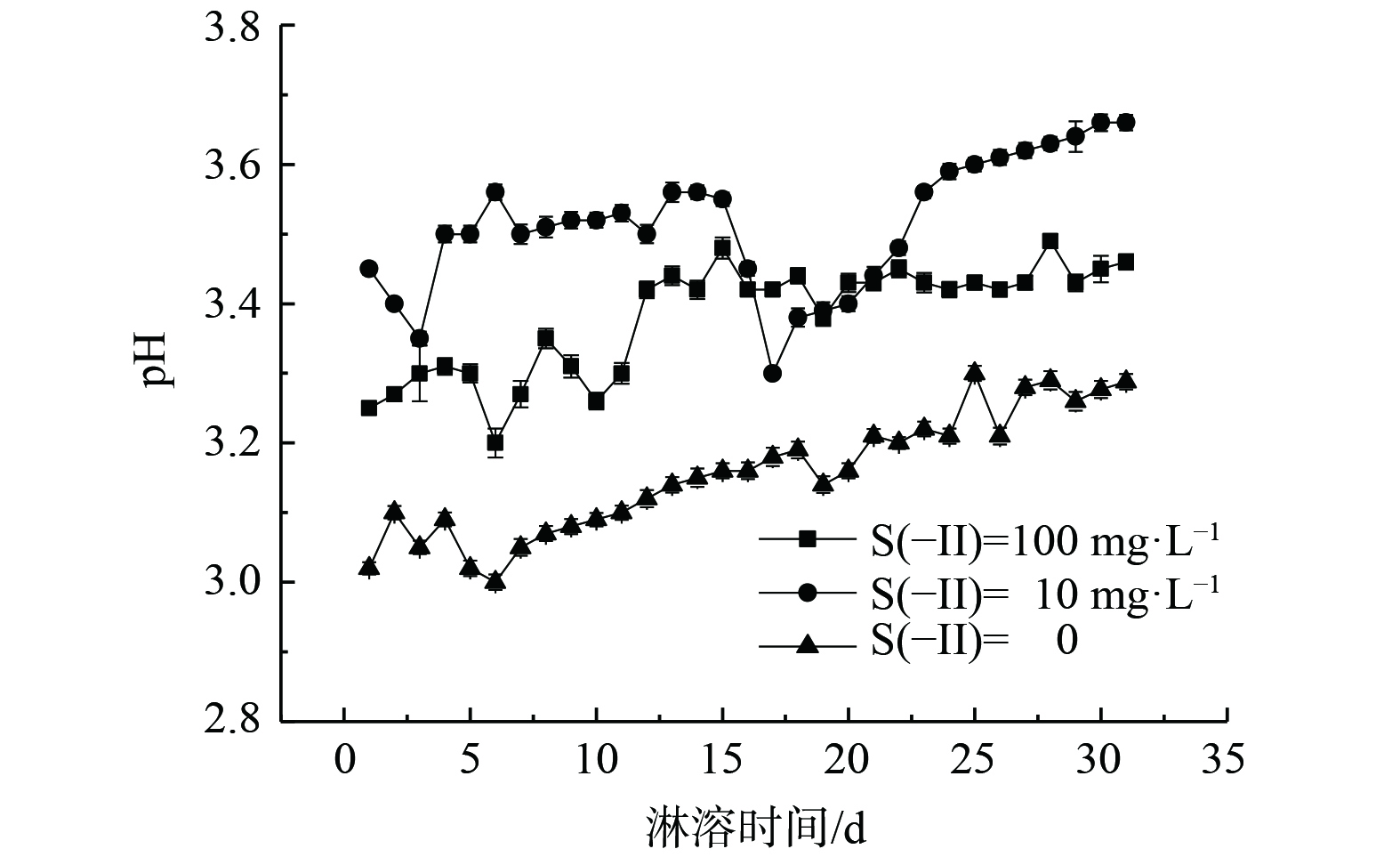
2.1 淋滤液pH的变化规律
如图2所示,在整个淋滤实验过程中,各组淋出液pH总体略呈上升趋势。其中,空白对照组的pH从最低3.00增至最高3.30,增幅最大,在7~18 d时,表现出稳步上升,前期和后期均出现一定波动。可见在没有S(-II)影响下,沉积物中的淋滤液pH呈现酸性且略为上升。质量浓度为10 mg·L−1的Na2S处理组pH从初始3.45增至最终的3.68,而质量浓度为100 mg·L−1 Na2S处理组的pH从最低3.20增至最高3.49。Na2S溶液呈碱性,沉积物本身为强酸性 (pH约为2.55) ,然而在通过沉积物淋溶后的淋溶液却呈现酸性,且质量浓度较高的S(-II)反而总体pH较低。原因可能是由于碱性溶液通过沉积物而使得沉积物中介稳定的矿物如施氏矿物溶解[6] (如式 (1) ) ,部分重金属和硫酸根的释放溶出,引起H+释放,从而使pH降低。然而,整个实验过程中3个实验组的pH变化较小,呈现酸性,其有利于重金属从结构态转变为游离态[21]并促进其迁移能力。
stringUtils.convertMath(!{formula.content}) (1) 2.2 淋滤液中重金属含量的变化
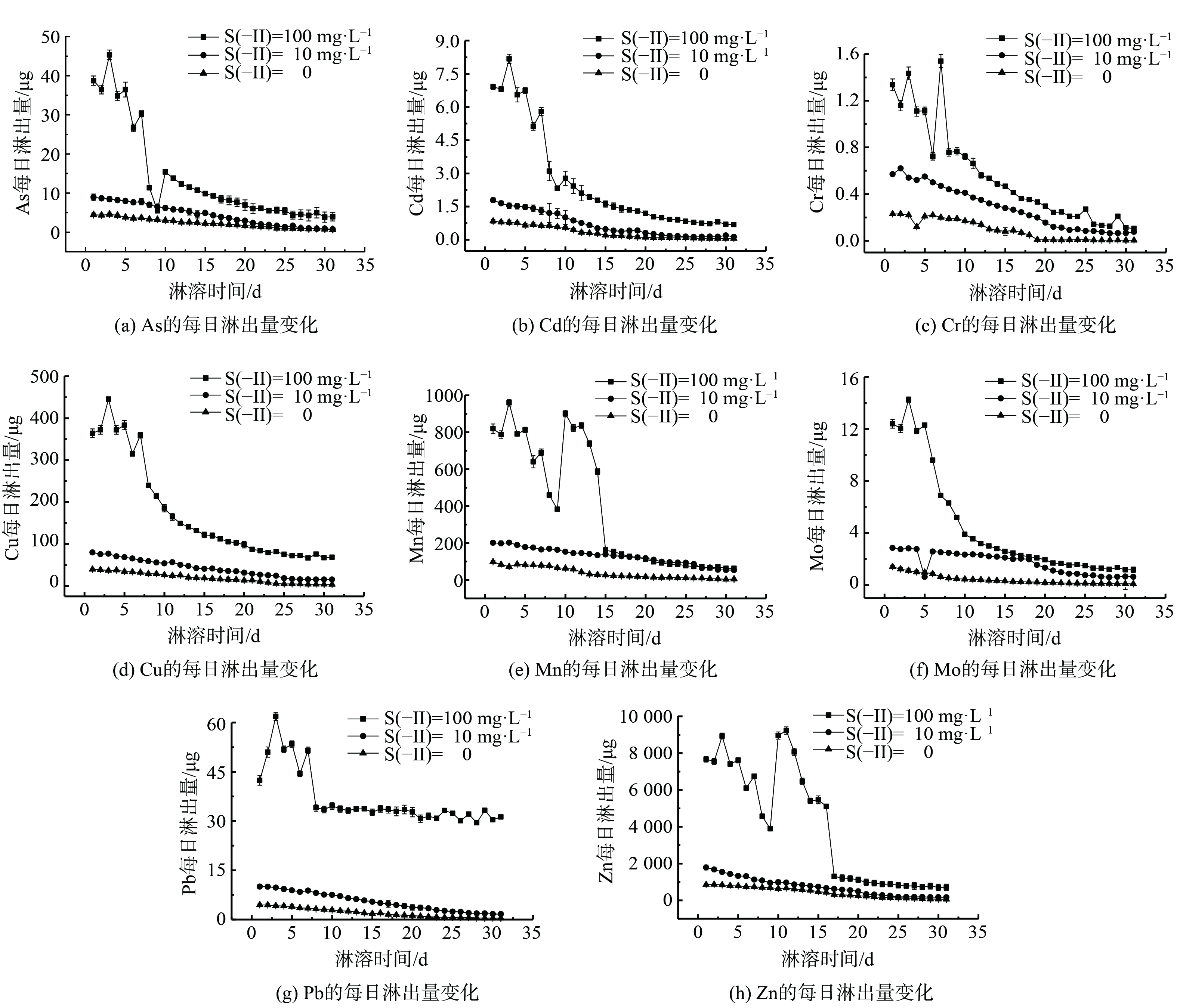
重金属每日淋出量随淋溶时间的变化趋势如图3所示。在本实验条件下,S(-II)的淋溶对于沉积物中重金属的释放有相对的促进作用。质量浓度为10 mg·L−1 Na2S处理组第1天的淋滤液中重 (类) 金属As、Cd、Cr、Cu、Mn、Mo、Pb和Zn的淋出量分别比空白高了约1.993、2.131、2.478、2.027、2.051、2.028、2.247、和2.095倍,且随着硫离子质量浓度的增加,重金属的释放量增加。
8种重金属元素的释放规律类似。1~3 d为重金属快速释放时期,各元素每日淋出量较高,且出现了一定的上升。但在此后5~10 d,各元素淋出量迅速下降。如Mo的每日淋出量从12.29 μg降至3.91 μg,降幅最大,为68.20 %。在10 d之后,各元素淋出量开始缓慢而稳定地下降,各元素的最终淋出量均小于2.09 μg·L−1。其中,Pb元素的变化趋势略有不同,每日淋出量虽在1~3 d时出现上升后下降,但其淋出量在8 d时便降至平稳阶段,其降幅相比As、Cu、Cr、Cd和Mo较小,此后一直稳定在约33.50 μg。从整体上看,Pb的每日淋出量从最高值61.88 μg降至最低值29.48 μg,变化幅度较小,但持续淋出量较高。这可能是由于拦泥库沉积物中Pb的质量分数最高 (2 450 mg·kg−1) ,这与文献[22]报道的结果一致。
Cu、Mn、Zn与Cd等其他元素在1~5 d时,同样呈现出先增长后回落的形势。Cu在7 d后稳步平滑下降。而Mn、Zn同时在第9天出现大幅异常增长后呈阶梯快速下降,最后分别于15 d和17 d转为平滑下降。从总体上看,Cu、Mn和Zn初始淋出量较高,分别为364.00、819.00 和7 670.00 μg,且Zn淋出量较Cu和Mn高出1个数量级。大宝山矿床主体为钼矿、褐铁矿、铜硫矿和铅锌矿等多金属共生或伴生矿体[23],矿区长期采矿和洗矿过程中产生的大量重金属污染,且研究区域的沉积物中重金属含量顺序为Zn>Mn>Cu>Cd。其中,Cd和As在9~11 d出现每日淋出量的大幅度快速增长。这表明各元素间可能具有一定的相互促进或抑制迁移作用。除了与沉积物中重金属的存在形态有关之外,也与淋滤液中硫离子的作用有关。研究表明,S2−离子的还原性会影响沉积物中矿物的稳定性,进而影响被沉积物固定的重金属,影响重金属的二次释放[24-26]。此外,S2−又会与重金属反应结合,生成较为稳定不易迁移的硫化物等沉淀[18, 27]。因此,S2−在整个淋滤过程中表现出前期促进而后期缓解抑制的作用。但Cu、Mn、Zn在淋滤过程中每日淋出量下降较快,或受到S2−的抑制作用。各重金属的淋溶特点均表明沉积物对环境造成的污染具有持续性特点,对于生态环境具有潜在影响[28]。
2.3 沉积物中重金属的释放动力学
沉积物中重金属的迁移过程受到水分、温度、氧化还原电位等多重因素的影响,是一个多因素相互作用的动态变化反应过程。为进一步研究这一过程,借助化学动力学和数学模型进行分析,通过拟合S(-II)介导下的实验结果以了解重金属迁移过程中的影响因素和各类重金属的迁移特点[29]。通过文献调研选取了一级动力学方程、双常数方程和Elovich方程 (式 (2)~(5) ) 。其中,Elovich方程是一个经验式,其主要描述一系列反应机制的过程,如溶质的本体、界面扩散、表面的活化与去活化作用等[30],其对重金属在土壤或沉积物界面上的迁移过程较为适用。而反应条件和反应过程较复杂的化学动力学过程则适合用双常数方程进行描述。其中,各类重金属累积释放量曲线如图4所示,拟合分析结果如表1所示。
表 1 各重金属元素拟合结果Table 1. Fitting results of each heavy metal elements重 (类) 金属元素种类 决定系数R2 一级动力学方程 双常数方程 Elovich方程 低浓度 高浓度 低浓度 高浓度 低浓度 高浓度 As 0.915 6 0.875 9 0.968 4 0.968 4 0.713 3 0.991 9 Cd 0.854 3 0.852 5 0.948 9 0.957 0 0.977 2 0.991 7 Cr 0.906 1 0.892 7 0.967 2 0.967 2 0.965 1 0.977 4 Cu 0.950 0 0.905 1 0.985 4 0.974 9 0.948 7 0.982 4 Mn 0.978 4 0.840 4 0.994 1 0.927 4 0.920 1 0.954 5 Mo 0.959 1 0.842 3 0.981 3 0.953 7 0.921 2 0.992 7 Pb 0.941 7 0.993 5 0.981 5 0.999 1 0.952 5 0.898 3 Zn 0.911 3 0.864 8 0.972 6 0.934 8 0.966 7 0.946 7 淋出液中重金属累积释放量的计算公式见式 (2) ,其一级动力学方程为式 (3) ,双常数方程为式 (4) ,Elovich方程为式 (5) 。
stringUtils.convertMath(!{formula.content}) (2) stringUtils.convertMath(!{formula.content}) (3) stringUtils.convertMath(!{formula.content}) (4) stringUtils.convertMath(!{formula.content}) (5) 式中:q为沉积物样品中重金属的累积释放量,μg·kg−1;t为淋溶时间,d;a, b为常数;
Ci为第i次采样的淋溶液中重金属浓度,μg·L−1;V为第i次采样的淋溶液体积,L;m为沉积物样品质量,kg。
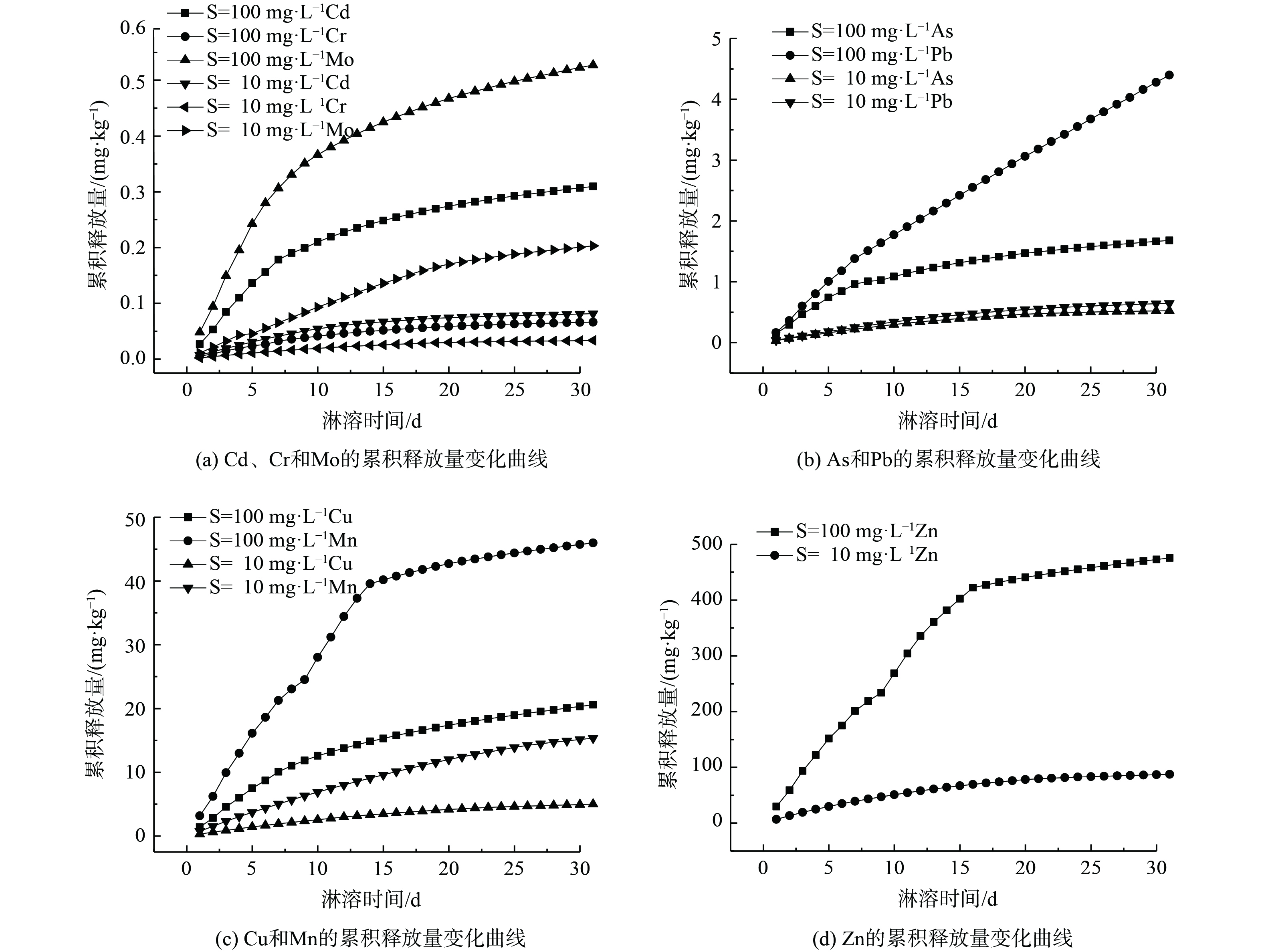
如图4所示,高浓度处理组中Cd、Mo、As和Cu的累积释放量在1~8 d增长较快,在9 d之后的增长趋于平缓;Pb的增长则呈现斜直线;Mn和Zn在1~14 d快速增长,在14 d后趋于平缓,Pb、Mn和Zn大致呈线性增长。而Cr的增长幅度不大,趋势不明显。而对于低浓度处理组,除Mn,Cd、Mo、Cr、Zn、Cu、As和Pb的累积释放量在20 d后趋于缓和,相比于高浓度处理组,累积释放量均在一定程度上下降了。
由表1拟合结果可知,对于一级动力学方程,在高浓度处理组中除Pb和Cu外,其他重金属的决定系数在0.85~0.90。这表明一级动力学对多数重金属元素拟合效果较为一般。一级动力学方程能体现出反应物浓度与反应速率之间的线性关系。这说明重金属在沉积物中吸附和分布并不是理想中的均匀状态,各吸附点位对于重金属的亲和力并不相等。但从个体来看,一级动力学方程对于Pb的拟合效果较好。而在低浓度处理组中,除了Cd,其他的决定系数都高于0.90。对于双常数方程而言,所有重金属决定系数均大于0.90。这表明双常数方程对于多数重金属拟合效果较好,且低浓度处理组的决定系数均高于0.94。其中,Pb的决定系数分别为0.98和0.99,这表明Pb的释放过程适合用双常数方程进行描述。对于Elovich方程而言,高浓度处理组中除Pb外,其余重金属决定系数均在0.95以上。这说明该方程具有较好的拟合效果。而在低浓度处理组中除As外,其余重金属决定系数均在0.92以上。这表明Elovich方程的拟合效果比双常数方程更好。
上述分析表明,低浓度处理组中所有重金属的双常数方程拟合度最优。而高浓度处理组中双常数方程能较好地描述Pb的迁移过程,这表明Pb在沉积物颗粒中的吸附和分布可能相对较为均匀,亦可能受到的影响因素较为单一。其他重金属As、Cd、Cr、Cu、Mn、Mo和Zn的Elovich方程拟合度最优。这表明多数重金属在沉积物中的吸附和解吸过程受到多种因素的制约和影响[31],如DOM、还原性物质、共存离子和pH等。
2.4 固体样品的分析
2.4.1 对重金属的萃取
通过对高浓度S(-II)处理组反应前后沉积物中水溶态、吸附和可交换态及易还原矿物相中重金属的萃取结果可知,被淋滤下来的重金属主要来源于沉积物中的水溶态、吸附和可交换态及易还原矿物相。其中,Zn和Mn的释放量为8种重金属中最高(见表2)。这可能是Zn和Mn在实验所测的8种重金属中含量较高,且其金属硫化物溶解度相对较高。此外,Zn所累积的释放量高于反应前水溶态、吸附和可交换态,以及易还原矿物相中Zn的含量。这说明淋滤的部分Zn来源较为稳定的矿物相。此外,Cd、Mo和Cr的累积释放量较低,源于其在沉积物中相对含量较低。而Pb和As在沉积物中的相对含量较高,但是被淋滤所累积的释放量却相反。这可能是由于Pb和As的硫化物溶解度较低,在一定程度上抑制了Pb和As的释放。因此,在AMD体系中,重金属的迁移转化受控于还原性物质等环境因子。
表 2 重金属萃取前后的对比Table 2. Comparison of heavy metals before and after extraction重金属种类 累积释放量/ (mg·kg−1) 重金属的质量分数/ (mg·kg−1) 反应前 反应后 Pb 4.40 544.55 540.20 Zn 475.53 268.43 23.49 Mn 45.97 215.12 206.15 Cu 20.60 174.40 153.70 Cr 0.07 45.32 45.26 Cd 0.31 3.93 3.64 Mo 0.53 44.01 43.52 As 1.68 540.11 538.58 注:反应前后重金属质量分数数据为水溶性、吸附和可交换态及易还原矿物相中重金属之和。 2.4.2 XRD表征
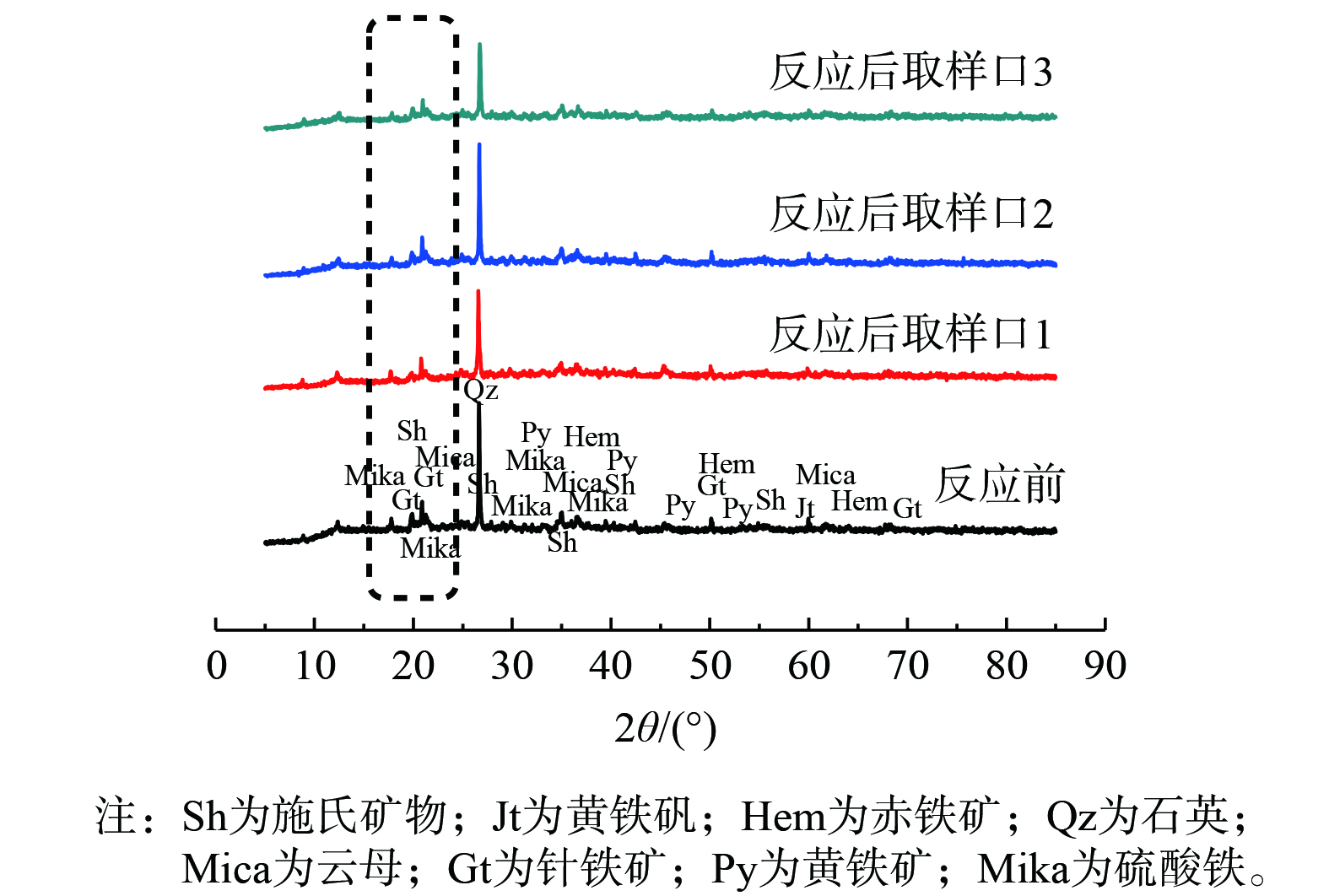
为进一步确定重金属的来源,采用了XRD对质量浓度为100 mg·L−1 Na2S处理组反应前后矿物组成进行分析,结果如图5所示。沉积物中主要矿物成分为:施氏矿物、黄铁矾、赤铁矿、石英、云母、针铁矿、黄铁矿、硫酸铁等含铁 (硫) 矿物及一些重金属与矿物形成的复合体。图5可观察到反应前后相对的区别,在峰位约20°可看到峰型的相对改变,即反应前峰型较宽,衍射强度更大,反应后衍射强度减弱,且在采样口3的位置处,无定型的矿物峰减弱最多。分析其原因,可能是S(-II)最先接触采样口3的沉积物,故采样口3的位置接触到的硫离子浓度最高。随着深度的增加,介稳定性矿物受淋溶液的影响较小,此时接触的硫离子质量浓度也低、厌氧程度加大,故出现了硫酸亚铁的峰位。因此,XRD结果表明沉积物中介稳定的矿物相对含量的变化,即淋溶液中重金属可能主要来源于沉积物中可还原态的矿物,如介稳定的施氏矿物和黄铁矾类矿物,淋溶后剩下了较为稳定的矿物相如针铁矿等。
2.4.3 SEM表征
采用SEM观察高浓度S(-II)处理组反应前后沉积物表观形貌,结果如图6所示。未淋溶前沉积物样品 (图6(a)) 表面相对较为光滑完整,且附着有页状形貌矿物。经过硫化钠溶液淋滤之后,柱体上层的沉积物 (图6(b)) 表面呈现附着有较多叠加的薄片状和少数杆状形貌的物质。柱体中层的沉积物 (图6(c)) ,颗粒表面较为粗糙,附着较小的片状、球状和少数米粒状的矿物。而柱体底层的沉积物 (图6(d)) 样品显示其表面附着的细小片状、针状矿物增多。这些片状、球状、针状的物质可能对应为施氏矿物、黄铁矾、赤铁矿、针铁矿等[32]。这表明在硫化钠溶液的淋溶作用下的沉积物中,从柱体上层至下层呈现不同的形貌变化,结合重金属萃取和XRD结果可知,沉积物中垂直迁移的重金属主要来源于沉积物相中可还原的矿物相,其迁移过程表现为“迁移—稳定”的模式[33]。
2.5 沉积物中重金属的可能释放机理
可溶性的二价硫离子具有还原、络合和沉淀重金属的作用,因此,在一定程度上制约着酸性矿山废水中重金属的迁移转化。本研究中的沉积物样品采集于大宝山拦泥库,含有的羟基含铁硫酸盐次生矿物质量分数约为24% [6],在环境因子pH改变和还原性物质存在时会导致矿物溶解重结晶的过程中吸附和共沉淀的重金属再次释放到环境中。在本研究的条件下,S(-II)可能会使环境中原有的铁矿物发生还原溶解,产生的内源二价铁对矿物具有催化作用,能加速含铁矿物的溶解重结晶。如ZHANG等[34]的研究结果,在S(-II)作用下,体系产生Fe(II)引发催化作用下,使得As(V)-施氏矿物会转化为Magnetite等次生矿物;但同时硫离子会与重金属离子形成硫化物沉淀;其次,硫化钠溶液本身呈现碱性,对矿物的溶解有促进作用。在复杂的反应过程中,矿物的溶解占据一定优势,故可观察到前期重金属的释放量相对较大。在反应的后期,由于S(-II)被氧化后或与沉积物中的重金属或Fe形成沉淀或新的矿物,使得被淋出的重金属再次被共沉淀和吸附,导致后期重金属淋出量减少。
2.6 对环境治理的意义
金属硫化物矿区AMD污染流域中的沉积物是矿区有毒有害金属元素的主要汇,且沉积物中存在大量的含铁硫酸盐次生矿物。这些次生矿物处于介稳定的状态,一旦环境条件改变 (还原性物质和共存离子等) 时,很容易发生溶解和相转变,从而引起沉积物中重金属的二次释放和再次分配,存在一定的环境风险。因此,基于以上的研究结果,在进行矿区AMD污染流域环境原位修复治理时,可对沉积物底泥进行清淤或者采用重金属吸附剂或钝化剂进行固定,但应避免选用还原性的吸附剂或钝化剂,并规避因流域pH变化引起固持的重金属存在二次释放的风险。
3. 结论
1) 在S(-II)介导,即在硫化钠溶液的淋滤作用下,大宝山拦泥库沉积物中重金属的垂直迁移特征,即沉积物中各重金属元素释放量的大小顺序为:Zn>Mn>Cu>Pb>As>Mo>Cd>Cr。
2) S(-II)在反应前期对重金属的释放具有较明显的促进作用,且释放的部分重金属主要来源于沉积物中的易还原矿物相,其释放过程可用双常数和Elovich模型进行描述拟合。
3) 在AMD环境下,沉积物中重金属的环境行为与介稳态矿物相的溶解-重结晶有关,存在着释放的潜在生态风险。因此,在AMD污染流域环境修复治理时应注意重金属的再次释放。
-
表 1 评价方法等级划分标准
Table 1. Evaluation method grade classification criteria
SN SP FT 污染程度Pollution level Er RI 风险程度Risk level SN<1.0 SP<0.5 FT<1.0 清洁 Er<40 RI<150 轻微风险 1.0<SN≤1.5 0.5<SP≤1.0 1.0<FT≤1.5 轻度污染 40≤Er<80 150≤RI<300 中等风险 1.5<SN≤2.0 1.0<SP≤1.5 1.5<FT≤2.0 中度污染 80≤Er<160 300≤RI<600 高风险 SN>2.0 SP>1.5 FT>2.0 重度污染 160≤Er<320 600≤RI< 1200 很高风险 Er≥320 RI≥ 1200 极高风险 RAC/% 风险程度Risk level RSP 污染程度Pollution level Igeo 污染程度Pollution level <1 无风险 <1 无污染 Igeo≤0 无污染 ≥1—10 低风险 ≥1—2 轻度污染 0<Igeo≤1 轻度污染 ≥10—30 中等风险 ≥2—3 中度污染 1<Igeo≤2 偏中度污染 ≥30—50 高风险 ≥3 重度污染 2<Igeo≤3 中度污染 ≥50 极高风 3<Igeo≤4 偏重污染 4<Igeo≤5 重污染 Igeo>5 严重污染 表 2 研究区监测点位表层土壤重金属及N和P含量数据统计
Table 2. Statistics of heavy metals and nitrogen and phosphorus content in surface soil at monitoring sites in the study area
污染场地Contaminated site 元素Element 范围/(mg·kg−1)Range 均值±标准偏差/(mg·kg−1)Mean ± standard deviation 变异系数/%Coefficient of variation 背景值/(mg·kg−1)Background value XH Cd 0.19—3.74 1.48±1.61 108.8 0.12 Cr 58.18—77.69 70.75±8.91 12.59 70.20 Ni 34.41—45.27 39.85±4.43 11.12 32.89 Cu 26.78—30.86 28.75±1.67 5.80 23.35 Hg 0.05—9.66 3.46±4.39 126.92 0.02 Pb 24.17—239.25 106.90±94.56 88.45 18.80 As 19.44—55.23 37.28±13.04 34.97 12.60 Sb 160.23— 11610.90 4150.56 ±5279.53 127.20 0.99 N 0.45—4.42 1.46±1.25 85.99 1.36 P 0.68—0.93 0.78±0.09 10.96 1.04 QL Cd 0.19—5.78 1.45±1.68 115.32 0.29 Cr 47.57—110.07 78.83±20.12 25.52 82.91 Ni 7.13—54.21 22.27±12.60 56.56 31.68 Cu 21.03—354.79 80.80±95.83 118.60 31.86 Hg 0.12—1.09 0.46±0.29 63.19 0.12 Pb 13.94—283.56 81.14±92.26 113.71 29.55 As 53.96—795.66 236.90±282.97 119.45 11.01 Sb 610.39— 84301.89 19756.28 ±32464.39 164.32 2.24 N 0.27—3.22 2.12±0.93 44.00 3.88 P 0.43—3.14 1.19±0.88 73.72 0.70 注:XH背景值为甘肃省土壤背景值,QL背景值为贵州省土壤背景值;N和P的背景值为锑厂区周围未污染土壤中的含量. Note: XH background value is the soil background value of Gansu Province, and QL background value is the soil background value of Guizhou province. The background values of N and P are the contents in uncontaminated soil around the antimony plant area. 表 3 两个场地不同深度的迁移系数
Table 3. Shows the migration coefficients of two sites at different depths
污染场地Contaminated site 有效土层深度/ cmEffective soil depth 锑迁移系数Sb migration coefficient 砷迁移系数As migration coefficient 平均值 Mean 标准偏差 Standard 平均值Mean 标准偏差 Standard XH 0—30 0.033 0.014 0.091 0.059 30—70 0.057 0.033 0.055 0.031 70—100 0.12 0.065 0.041 0.034 QL 0—30 0.033 0.023 0.008 0.003 30—70 0.035 0.02 0.001 0.001 70—100 0.067 0.036 0.006 0.009 表 4 不同土层Sb和As总量其及赋存形态分布与迁移系数的相关关系
Table 4. Correlation between the total amount of Sb and As in different soil layers, their occurrence form distribution and migration coefficient
锑冶炼厂污染场地Antimony smelting plant contaminated site 锑Sb 锑迁移系数Sb migration coefficient 砷As 砷迁移系数As migration coefficient 0-30 cm 30-70 cm 70-100 cm 0-30 cm 30-70 cm 70-100 cm XH 总量 -0.83** 0.75* 0.94** 总量 0.97** 0.58 1.00** E1 -0.68* 0.91** 0.96** E1 0.98** 0.82** 1.00** C2 -0.78* 1.00** 0.96** C2 0.99** 0.98** 0.98** F3 -0.88** 0.79* 0.79* F3 0.98** 0.64 1.00** O4 -0.76* 0.96** 0.96** O4 0.97** 0.76* 1.00** R5 -0.83** 0.70* 0.91** R5 0.82** 0.45 0.98** QL 总量 -0.65* 0.56 0.97** 总量 0.53 0.72* 0.72** E1 -0.63 0.82** 0.99** E1 0.48 — — C2 -0.72* 0.82** 0.99** C2 0.63 0.92** 1.00** F3 -0.68* 0.56 1.00** F3 0.83** 0.66* 0.99** O4 -0.83** 0.53 1.00** O4 0.92** 0.97** 0.99** R5 -0.65* 0.53 0.95** R5 0.52 0.72* 0.52 注:*. 在0.05水平(双侧)上显著相关;**. 在0.01水平(双侧)上显著相关. Note: *. Significant correlation at the 0.05 level (bilateral);**. Significant correlation at the 0.01 level (bilateral). -
[1] 周妍, 罗明, 周旭, 等. 工矿废弃地复垦土地跟踪监测方案制定方法与实证研究[J]. 农业工程学报, 2017, 33(12): 240-248. doi: 10.11975/j.issn.1002-6819.2017.12.031 ZHOU Y, LUO M, ZHOU X, et al. Making method of tracking monitoring scheme for abandoned industrial and mining land reclamation and its empirical research[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(12): 240-248 (in Chinese). doi: 10.11975/j.issn.1002-6819.2017.12.031
[2] NIES D H. Microbial heavy-metal resistance[J]. Applied Microbiology and Biotechnology, 1999, 51(6): 730-750. doi: 10.1007/s002530051457 [3] MITSUNOBU S, HARADA T, TAKAHASHI Y. Comparison of antimony behavior with that of arsenic under various soil redox conditions[J]. Environmental Science & Technology, 2006, 40(23): 7270-7276. [4] CASIOT C, UJEVIC M, MUNOZ M, et al. Antimony and arsenic mobility in a creek draining an antimony mine abandoned 85 years ago (upper Orb Basin, France)[J]. Applied Geochemistry, 2007, 22(4): 788-798. doi: 10.1016/j.apgeochem.2006.11.007 [5] HILLER E, LALINSKÁ B, CHOVAN M, et al. Arsenic and antimony contamination of waters, stream sediments and soils in the vicinity of abandoned antimony mines in the Western Carpathians, Slovakia[J]. Applied Geochemistry, 2012, 27(3): 598-614. doi: 10.1016/j.apgeochem.2011.12.005 [6] MAJZLAN J, LALINSKA B, CHOVAN M, et al. A mineralogical, geochemical, and microbiogical assessment of the antimony- and arsenic-rich neutral mine drainage tailings near Pezinok, Slovakia[J]. American Mineralogist, 2011, 96(1): 1-13. doi: 10.2138/am.2011.3556 [7] BAI Y, TANG X J, SUN L Y, et al. Application of iron-based materials for removal of antimony and arsenic from water: Sorption properties and mechanism insights[J]. Chemical Engineering Journal, 2022, 431: 134143. doi: 10.1016/j.cej.2021.134143 [8] WILLIS S S, HAQUE S E, JOHANNESSON K H. Arsenic and antimony in groundwater flow systems: A comparative study[J]. Aquatic Geochemistry, 2011, 17(6): 775-807. doi: 10.1007/s10498-011-9131-6 [9] 何梦媛, 董同喜, 茹淑华, 等. 畜禽粪便有机肥中重金属在土壤剖面中积累迁移特征及生物有效性差异[J]. 环境科学, 2017, 38(4): 1576-1586. HE M Y, DONG T X, RU S H, et al. Accumulation and migration characteristics in soil profiles and bioavailability of heavy metals from livestock manure[J]. Environmental Science, 2017, 38(4): 1576-1586 (in Chinese).
[10] STERCKEMAN T, DOUAY F, PROIX N, et al. Vertical distribution of Cd, Pb and Zn in soils near smelters in the North of France[J]. Environmental Pollution, 2000, 107(3): 377-389. doi: 10.1016/S0269-7491(99)00165-7 [11] 唐世琪, 刘秀金, 杨柯, 等. 典型碳酸盐岩区耕地土壤剖面重金属形态迁移转化特征及生态风险评价[J]. 环境科学, 2021, 42(8): 3913-3923. TANG S Q, LIU X J, YANG K, et al. Migration, transformation characteristics, and ecological risk evaluation of heavy metal fractions in cultivated soil profiles in a typical carbonate-covered area[J]. Environmental Science, 2021, 42(8): 3913-3923 (in Chinese).
[12] 陈江军, 刘波, 李智民, 等. 江汉平原典型场区土壤重金属赋存形态及其影响因素探讨[J]. 资源环境与工程, 2018, 32(4): 551-556. CHEN J J, LIU B, LI Z M, et al. Soil heavy metal occurrence and its influencing factors in typical areas in Jianghan plain[J]. Resources Environment & Engineering, 2018, 32(4): 551-556 (in Chinese).
[13] 郑顺安. 我国典型农田土壤中重金属的转化与迁移特征研究[D]. 杭州: 浙江大学, 2010. ZHENG S A. Studies on the transformation and transport of heavy metals in typical Chinese agricultural soils[D]. Hangzhou: Zhejiang University, 2010 (in Chinese).
[14] TELLA M, POKROVSKI G S. Antimony(Ⅲ) complexing with O-bearing organic ligands in aqueous solution: An X-ray absorption fine structure spectroscopy and solubility study[J]. Geochimica et Cosmochimica Acta, 2009, 73(2): 268-290. doi: 10.1016/j.gca.2008.10.014 [15] REDMAN A D, MACALADY D L, AHMANN D. Natural organic matter affects arsenic speciation and sorption onto hematite[J]. Environmental Science & Technology, 2002, 36(13): 2889-2896. [16] BAUER M, BLODAU C. Mobilization of arsenic by dissolved organic matter from iron oxides, soils and sediments[J]. Science of the Total Environment, 2006, 354(2/3): 179-190. [17] 霍丽娟, 王美玲, 赵慧超, 等. 不同组成有机质对土壤中砷迁移行为的影响[J]. 地球与环境, 2022, 50(2): 184-191. HUO L J, WANG M L, ZHAO H C, et al. Effects of natural organic matter with different composition on the mobility of arsenic in soil[J]. Earth and Environment, 2022, 50(2): 184-191 (in Chinese).
[18] CHEN Z R, CAI Y, LIU G L, et al. Role of soil-derived dissolved substances in arsenic transport and transformation in laboratory experiments[J]. The Science of the Total Environment, 2008, 406(1/2): 180-189. [19] 张磊, 宋柳霆, 郑晓笛, 等. 溶解有机质与铁氧化物相互作用过程对重金属再迁移的影响[J]. 生态学杂志, 2014, 33(8): 2193-2198. ZHANG L, SONG L T, ZHENG X D, et al. The remobilization of heavy metals influenced by interaction of DOM and iron oxides[J]. Chinese Journal of Ecology, 2014, 33(8): 2193-2198 (in Chinese).
[20] ZHOU L X, WONG J W. Effect of dissolved organic matter from sludge and sludge compost on soil copper sorption[J]. Journal of Environmental Quality, 2001, 30(3): 878-883. doi: 10.2134/jeq2001.303878x [21] TIGHE M, ASHLEY P, LOCKWOOD P, et al. Soil, water, and pasture enrichment of antimony and arsenic within a coastal floodplain system[J]. Science of the Total Environment, 2005, 347(1/2/3): 175-186. [22] AIHEMAITI A, JIANG J G, LI D A, et al. The interactions of metal concentrations and soil properties on toxic metal accumulation of native plants in vanadium mining area[J]. Journal of Environmental Management, 2018, 222: 216-226. [23] 王哲, 宓展盛, 郑春丽, 等. 生物炭对矿区土壤重金属有效性及形态的影响[J]. 化工进展, 2019, 38(6): 2977-2985. WANG Z, MI Z S, ZHENG C L, et al. Effect of biochar on the bioavailability and transformation of heavy metals in soil of mining area[J]. Chemical Industry and Engineering Progress, 2019, 38(6): 2977-2985 (in Chinese).
[24] 国家环境保护总局. 土壤环境监测技术规范: HJ/T 166—2004[S]. 北京: 以中国环境出版社, 2005. State Environmental Protection Administration. Technical specification for soil environmental monitoring: HJ/T 166—2004[S]. Beijing: China Environmental Science Press, 2005 (in Chinese).
[25] 中华人民共和国国土资源部. 土地质量地球化学评价规范: DZ/T 0295—2016[S]. 北京: 中国标准出版社, 2016. Ministry of Land and Resources of the People's Republic of China. Determination of land Quality Geochemical Evaluation: DZ/T 0295—2016[S]. Beijing: Standards Press of China, 2016 (in Chinese).
[26] 生态环境部, 国家市场监督管理总局. 土壤环境质量 农用地土壤污染风险管控标准: GB 15618—2018[S]. 北京: 中国标准出版社, 2019. Ministry of Ecology and Environment, State Administration for Market Regulation. Soil environmental quality Risk control standard for soil contamination of agricultural land: GB 15618—2018[S]. Beijing: Standards Press of China, 2019 (in Chinese).
[27] TESSIER A, CAMPBELL P G C, BISSON M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 1979, 51(7): 844-851. doi: 10.1021/ac50043a017 [28] ZHAO L, XU Y F, HOU H, et al. Source identification and health risk assessment of metals in urban soils around the Tanggu chemical industrial district, Tianjin, China[J]. Science of the Total Environment, 2014, 468/469: 654-662. doi: 10.1016/j.scitotenv.2013.08.094 [29] PAGE A L, MILLER R H, KEENEY D R. Total carbon, organic carbon, and organic matter[M]//Methods of soil analysis. Soil Science Society of America Inc. Wisconsin, 1982: 539-579. [30] RHOADES J D. Cation exchange capacity[M]//Methods of soil analysis. Part 2. Chemical and microbiological properties, American Society of Agronomy, Inc. Wisconson, 1982: 149-157. [31] BLACK C A. Methods of Soil Analysis: Part 1 Physical and Mineralogical Properties, Including Statistics of Measurement and Sampling[M]. Madison, WI, USA: American Society of Agronomy, Soil Science Society of America, 1965. [32] GB/T 9837—1988, 土壤全磷测定法[S]. GB/T 9837—1988, Determination of total phosphorus in soil[S] (in Chinese).
[33] 中华人民共和国农业部. 土壤检测 第24部分: 土壤全氮的测定自动定氮仪法: NY/T 1121.24—2012[S]. 北京: 中国标准出版社, 2012. Ministry of Agriculture of the People's Republic of China. Soil testing - Part 24: Determination of total nitrogen in soil by automatic nitrogen determination apparatus: NY/T 1121.24—2012[S]. Beijing: Standards Press of China, 2012 (in Chinese).
[34] 王生朴, 连兵. 甘肃省土壤环境背景值特征及其分布规律[J]. 甘肃环境研究与监测, 1993(3): 1-7. WANG S P, LIAN B. Characteristics and distribution of soil environmental background value in Gansu Province[J]. China Industrial Economics, 1993(3): 1-7 (in Chinese).
[35] 蔡大为, 李龙波, 蒋国才, 等. 贵州耕地主要元素地球化学背景值统计与分析[J]. 贵州地质, 2020, 37(3): 233-239. doi: 10.3969/j.issn.1000-5943.2020.03.003 CAI D W, LI L B, JIANG G C, et al. Statistics and analysis of geochemical backgrounds of main elements of cultivated land in Guizhou Province[J]. Guizhou Geology, 2020, 37(3): 233-239 (in Chinese). doi: 10.3969/j.issn.1000-5943.2020.03.003
[36] HAKANSON L. An ecological risk index for aquatic pollution control. a sedimentological approach[J]. Water Research, 1980, 14(8): 975-1001. doi: 10.1016/0043-1354(80)90143-8 [37] 陈惠芳, 李艳, 吴豪翔, 等. 富阳市不同类型农田土壤重金属变异特征及风险评价[J]. 生态与农村环境学报, 2013, 29(2): 164-169. doi: 10.3969/j.issn.1673-4831.2013.02.005 CHEN H F, LI Y, WU H X, et al. Characteristics and risk assessment of heavy metals pollution of farmland soils relative to type of land use[J]. Journal of Ecology and Rural Environment, 2013, 29(2): 164-169 (in Chinese). doi: 10.3969/j.issn.1673-4831.2013.02.005
[38] 秦延文, 张雷, 郑丙辉, 等. 太湖表层沉积物重金属赋存形态分析及污染特征[J]. 环境科学, 2012, 33(12): 4291-4299. QIN Y W, ZHANG L, ZHENG B H, et al. Speciation and pollution characteristics of heavy metals in the sediment of Taihu Lake[J]. Environmental Science, 2012, 33(12): 4291-4299 (in Chinese).
[39] MAIZ I, ARAMBARRI I, GARCIA R, et al. Evaluation of heavy metal availability in polluted soils by two sequential extraction procedures using factor analysis[J]. Environmental Pollution, 2000, 110(1): 3-9. doi: 10.1016/S0269-7491(99)00287-0 [40] PUEYO M, LÓPEZ-SÁNCHEZ J F, RAURET G. Assessment of CaCl2, NaNO3 and NH4NO3 extraction procedures for the study of Cd, Cu, Pb and Zn extractability in contaminated soils[J]. Analytica Chimica Acta, 2004, 504(2): 217-226. doi: 10.1016/j.aca.2003.10.047 [41] 奇奇格. 土壤砷生物有效性影响因素研究进展[J]. 安徽农业科学, 2018, 46(28): 15-17. doi: 10.3969/j.issn.0517-6611.2018.28.005 QI Q G. Research progress on influencing factors of soil arsenic bioavailability[J]. Journal of Anhui Agricultural Sciences, 2018, 46(28): 15-17 (in Chinese). doi: 10.3969/j.issn.0517-6611.2018.28.005
[42] 岳国辉. 土壤pH和有机质含量对重金属可利用性的影响[J]. 中国金属通报, 2021(5): 196-197. doi: 10.3969/j.issn.1672-1667.2021.05.097 YUE G H. Effects of soil pH and organic matter content on the availability of heavy metals[J]. China Metal Bulletin, 2021(5): 196-197 (in Chinese). doi: 10.3969/j.issn.1672-1667.2021.05.097
[43] SERAFIMOVSKA J M, ARPADJAN S, STAFILOV T, et al. Study of the antimony species distribution in industrially contaminated soils[J]. Journal of Soils and Sediments, 2013, 13(2): 294-303. doi: 10.1007/s11368-012-0623-9 [44] TSERENPIL S, LIU C Q. Study of antimony (III) binding to soil humic acid from an antimony smelting site[J]. Microchemical Journal, 2011, 98(1): 15-20. doi: 10.1016/j.microc.2010.10.003 [45] FILELLA M, BELZILE N, CHEN Y W. Antimony in the environment: A review focused on natural waters[J]. Earth-Science Reviews, 2002, 57(1/2): 125-176. [46] PEREIRA F J, LÓPEZ R, SUÁREZ D, et al. pH-dependent structural changes of arsenic oxoacids in solution and solid phase: Raman spectrometry and computational studies[J]. Microchemical Journal, 2022, 175: 107109. doi: 10.1016/j.microc.2021.107109 [47] 戴树桂. 环境化学[M]. 2版. 北京: 高等教育出版社, 2006. DAI S G. Environmental chemistry[M]. 2nd ed. Beijing: Higher Education Press, 2006 (in Chinese).
[48] ZHAO L, SHANGGUAN Y X, YAO N, et al. Soil migration of antimony and arsenic facilitated by colloids in lysimeter studies[J]. The Science of the Total Environment, 2020, 728: 138874. doi: 10.1016/j.scitotenv.2020.138874 [49] WILSON N J, CRAW D, HUNTER K. Antimony distribution and environmental mobility at an historic antimony smelter site, New Zealand[J]. Environmental Pollution, 2004, 129(2): 257-266. doi: 10.1016/j.envpol.2003.10.014 [50] HOU H, TAKAMATSU T, KOSHIKAWA M K, et al. Migration of silver, indium, tin, antimony, and bismuth and variations in their chemical fractions on addition to uncontaminated soils[J]. Soil Science, 2005, 170(8): 624-639. doi: 10.1097/01.ss.0000178205.35923.66 [51] AINSWORTH N, COOKE J A, JOHNSON M S. Distribution of antimony in contaminated grassland: 1—Vegetation and soils[J]. Environmental Pollution, 1990, 65(1): 65-77. doi: 10.1016/0269-7491(90)90165-9 [52] HAMMEL W, DEBUS R, STEUBING L. Mobility of antimony in soil and its availability to plants[J]. Chemosphere, 2000, 41(11): 1791-1798. doi: 10.1016/S0045-6535(00)00037-0 [53] 沈城, 叶文娟, 钱诗颖, 等. 典型城市土壤中重金属锑(Sb)的含量分布特征及风险评价[J]. 环境科学, 2022, 43(9): 4791-4799. SHEN C, YE W J, QIAN S Y, et al. Distribution characteristics and risk assessment of antimony in typical urban soil[J]. Environmental Science, 2022, 43(9): 4791-4799 (in Chinese).
[54] 张海琳, 张雨, 王顶, 等. 西南不同类型紫色土土壤pH变化、重金属累积与潜在生态风险评估[J]. 环境科学, 2024, 45(4): 2440-2449. ZHANG H L, ZHANG Y, WANG D, et al. Soil pH change, heavy metal accumulation and potential ecological risk assessment of different types of purple soil in Southwest China[J]. Environmental Science,2024, 45(4): 2440-2449 (in Chinese).
[55] ZHOU W X, HAN G L, LIU M, et al. Vertical distribution and controlling factors exploration of Sc, V, co, Ni, Mo and Ba in six soil profiles of the mun river basin, northeast Thailand[J]. International Journal of Environmental Research and Public Health, 2020, 17(5): 1745. doi: 10.3390/ijerph17051745 [56] KLITZKE S, LANG F. Mobilization of soluble and dispersible lead, arsenic, and antimony in a polluted, organic-rich soil - effects of pH increase and counterion valency[J]. Journal of Environmental Quality, 2009, 38(3): 933-939. doi: 10.2134/jeq2008.0239 [57] 胡青青, 沈强, 陈飞, 等. 重构土壤垂直剖面重金属Cd赋存形态及影响因素[J]. 环境科学, 2020, 41(6): 2878-2888. HU Q Q, SHEN Q, CHEN F, et al. Reconstructed soil vertical profile heavy metal Cd occurrence and its influencing factors[J]. Environmental Science, 2020, 41(6): 2878-2888 (in Chinese).
[58] 王蕊, 陈明, 陈楠, 等. 基于总量及形态的土壤重金属生态风险评价对比: 以龙岩市适中镇为例[J]. 环境科学, 2017, 38(10): 4348-4359. WANG R, CHEN M, CHEN N, et al. Comparison of ecological risk assessment based on the total amount and speciation distribution of heavy metals in soil: A case study for Longyan city, Fujian Province[J]. Environmental Science, 2017, 38(10): 4348-4359 (in Chinese).
[59] 曹勤英, 黄志宏. 污染土壤重金属形态分析及其影响因素研究进展[J]. 生态科学, 2017, 36(6): 222-232. CAO Q Y, HUANG Z H. Review on speciation analysis of heavy metals in polluted soils and its influencing factors[J]. Ecological Science, 2017, 36(6): 222-232 (in Chinese).
[60] HU J, LONG Y C, ZHOU W, et al. Influence of different land use types on hydrochemistry and heavy metals in surface water in the lakeshore zone of the Caohai wetland, China[J]. Environmental Pollution, 2020, 267: 115454. doi: 10.1016/j.envpol.2020.115454 [61] ADAMO P, IAVAZZO P, ALBANESE S, et al. Bioavailability and soil-to-plant transfer factors as indicators of potentially toxic element contamination in agricultural soils[J]. Science of the Total Environment, 2014, 500/501: 11-22. doi: 10.1016/j.scitotenv.2014.08.085 [62] MARRUGO-NEGRETE J, PINEDO-HERNÁNDEZ J, DÍEZ S. Assessment of heavy metal pollution, spatial distribution and origin in agricultural soils along the Sinú River Basin, Colombia[J]. Environmental Research, 2017, 154: 380-388. doi: 10.1016/j.envres.2017.01.021 [63] 杨新明, 庄涛, 韩磊, 等. 小清河污灌区农田土壤重金属形态分析及风险评价[J]. 环境化学, 2019, 38(3): 644-652. doi: 10.7524/j.issn.0254-6108.2018051001 YANG X M, ZHUANG T, HAN L, et al. Fraction distribution and ecological risk assessment of soil heavy metals in the farmland soil from the sewage irrigated area of Xiaoqing River[J]. Environmental Chemistry, 2019, 38(3): 644-652 (in Chinese). doi: 10.7524/j.issn.0254-6108.2018051001
[64] 丁竹红, 胡忻, 郭红岩. 用通用浸提剂Mehlich3研究城市污泥重金属生物有效性[J]. 环境污染与防治, 2006, 28(7): 485-487,525. doi: 10.3969/j.issn.1001-3865.2006.07.002 DING Z H, HU X, GUO H Y. Bioavailability of heavy metals in municipal sludges using Mehlich3 extractant[J]. Environmental Pollution & Control, 2006, 28(7): 485-487,525 (in Chinese). doi: 10.3969/j.issn.1001-3865.2006.07.002
[65] DELGADO J, BARBA-BRIOSO C, NIETO J M, et al. Speciation and ecological risk of toxic elements in estuarine sediments affected by multiple anthropogenic contributions (Guadiana saltmarshes, SW Iberian Peninsula): I. Surficial sediments[J]. Science of the Total Environment, 2011, 409(19): 3666-3679. doi: 10.1016/j.scitotenv.2011.06.013 -






 下载:
下载: