-
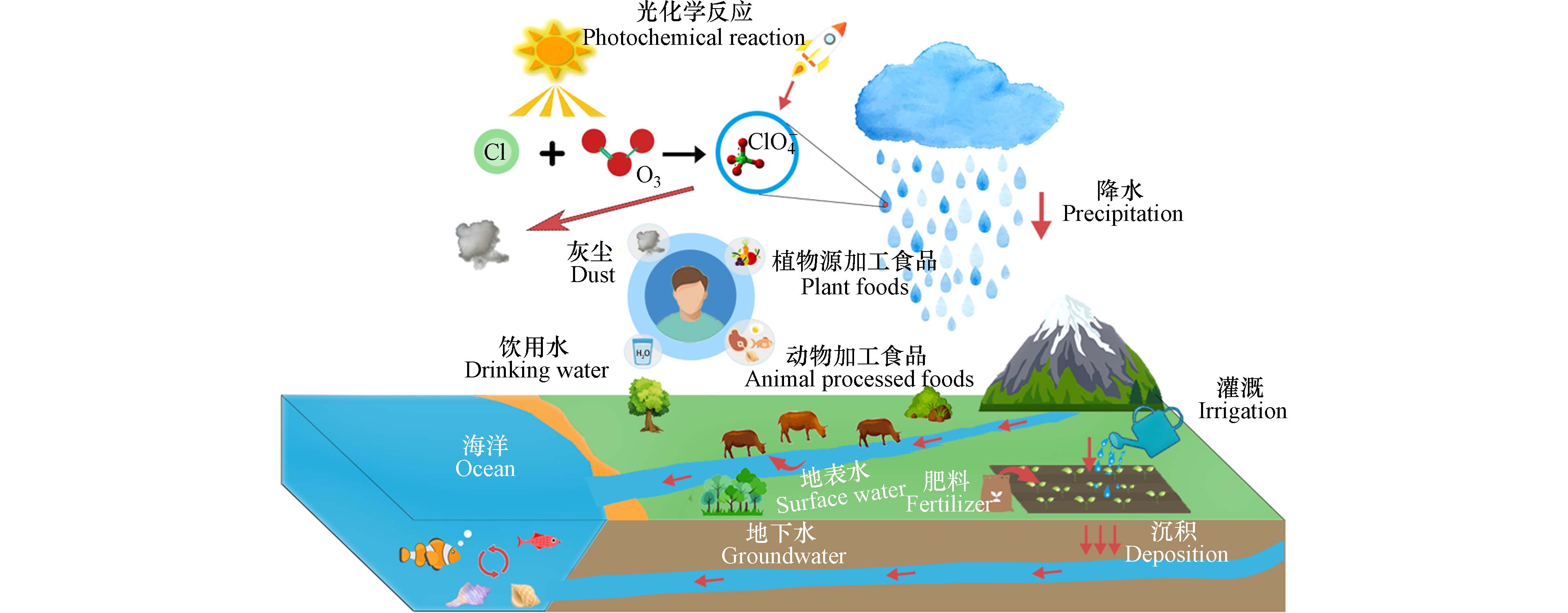
高氯酸盐(perchlorate, ClO4−)来源和分布广泛,在一定环境条件下,可通过氯化物与大气臭氧发生光化学氧化反应自然生成[1 − 2]. 由于ClO4−被广泛应用于火箭推进剂、烟火生产制造、爆破、安全气囊和食品包装领域[3 − 5],在人为因素下将随工业废弃物处理和排放等途径暴露于大气、土壤、水体等公共环境中,这可能会产生大量的ClO4−有毒污染物,相较于自然来源,更容易导致ClO4−环境浓度超标.
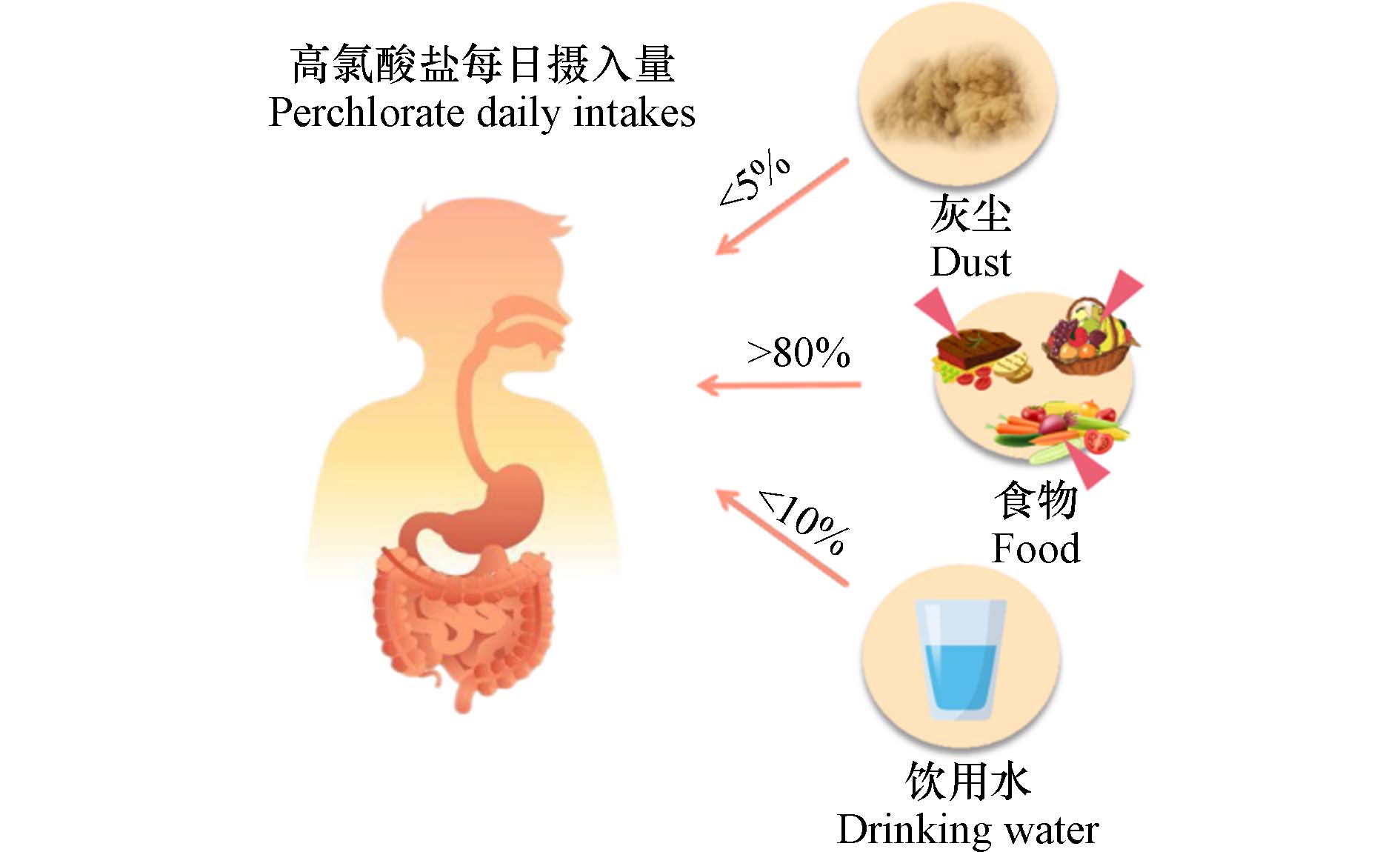
ClO4−中的Cl原子被4个氧原子呈正四面体结构包围,使其呈现化学惰性,具有极其稳定的物理化学性质. 此外,ClO4−易溶于水,在水中流动性强,扩散范围广,经水、土壤等途径被动植物吸收,并通过食物链的传递进入人体[6]. 总而言之,摄食和饮水是人类接触ClO4−的主要途径[7 − 8]. 此外,ClO4−还存在于室内外灰尘中[9],可能对人类健康构成直接威胁(图1).
ClO4−是一种具有持久性的有毒污染物质,通过与碘离子竞争性地进入哺乳动物和人体的甲状腺,阻碍甲状腺对碘离子的吸收,导致甲状腺激素失衡并扰乱甲状腺抗体水平[10]. 此外,它还能抑制三碘甲状腺原氨酸(T3)和甲状腺素(T4)的合成,影响人体的新陈代谢和生长发育[11],尤其是可能造成胎儿或婴儿的神经系统损伤和影响大脑组织的发育,引发智力缺陷、学习障碍等不良症状[12]. ClO4−污染及其造成的健康安全事件在世界各地相继发生,已成为一个与人类生活息息相关的全球性问题[13].
近年来,ClO4−领域的研究主要集中在ClO4−的检测、暴露风险评估以及其控制去除技术的研发与改进. 目前国际公认的ClO4−安全参考剂量(Reference Dose, RfD; RfD=0.7 µg·kg−1·d−1)由美国率先提出,后被美国环境保护署(Environment Protection Agency, EPA)采纳并作为官方推荐安全浓度限值[14]. 而其他大多数国家尚未确立ClO4−的限量标准,或是此类标准并未明确指出某些受ClO4−污染风险较高的检出源中的浓度限值. 鉴于此,本文对国际上较为典型的ClO4−的标准规定进行了直观地分类归纳,以期为各地相关法律法规的健全与完善提供一定参考. 针对世界各地出现的ClO4−污染情况,本文重点综述了ClO4−在饮用水、食品及室内外灰尘等主要暴露途径下的污染现状,进一步阐明其时空分布特征和迁移转化规律. 最后,对国内外饮用水中高氯酸盐的物理化学去除技术进行总结与分析,以推动ClO4−风险评估及污染防控工作的深入研究.
-
ClO4−浓度受饮食文化、工业化程度、环境治理水平等多种因素影响,在全球范围内ClO4−分布呈现出明显的地理性差异,因此,相关法律法规也因地制宜地对ClO4−浓度设定了不同的限值(表1).
EPA早在2005年就确定了食品中ClO4−的参考剂量RfD为0.7 µg·kg−1·d−1[14],折算到饮用水的当量水平为24.5 µg·L−1,2008年EPA将饮用水当量浓度更新至15 µg·L−1[15],这与法国食品、环境及劳动卫生署(French Agency for Food, Environmental and Occupational Health& Safety, ANSES)建议的饮用水中ClO4−的浓度限值一致[16]. 为了避免ClO4−区域分布差异对制订统一标准的影响,美国加州公共卫生部(California Department of Public Health, CDPH)[17]和马萨诸塞州环境保护部(Massachusetts Department of Environmental Protection, MDEP)[18]分别出台了相应的地方性环境法规.
2010年世界卫生组织(World Health Organization, WHO)将ClO4−的暂定每日最大耐受摄入量(provisional maximum tolerable daily intake, PMTDI)定为10 µg·kg−1·d−1体质量[19]. 欧洲食品安全局(European Food Safety Authority, EFSA)发布的每日可耐受摄入量(Tolerable Daily Intake, TDI)为0.3 µg·kg−1·d−1体质量[20]. 此外,EFSA还进一步提出了不同类别食品中ClO4−的临时参考水平(表2),主要包括水果、蔬菜、茶叶等.
多项研究表明,婴儿能通过摄食母乳、配方奶粉或其他婴儿食品等途径直接接触ClO4−[7,21 − 23],长期摄入可能导致甲状腺功能紊乱甚至影响婴儿生长发育. 因此,婴儿食品中ClO4−含量是否安全受到公众广泛关注. 但目前食品卫生安全领域的相关权威机构尚未明确规定婴儿食品中ClO4−浓度限值或对此制定法律法规.
-
居民生活饮用水主要有两大来源:市政自来水和瓶装/桶装水,其中自来水取自地表水或地下淡水,而瓶装/桶装水一般又分为纯净水、矿泉水和矿物质水(由纯净水经人工添加适量矿物质和灭菌处理加工而成). 目前已有多项研究报道了饮用水中ClO4−的存在(表3).
Erdemgil等[25]从土耳其5个城市采集的自来水中ClO4−的暴露水平虽均在安全限内,但值得注意的是开塞利市的ClO4−检测值明显高于其他4个城市,主要原因可能是自来水水源(地表水或地下水)的差异. 开塞利市当地气候干旱,选用地下水作为主要供水源,在高温环境中ClO4−的沉积速率远大于其在降水过程中的溶解速率[26],导致部分被土壤吸附或交换,最终ClO4−不断向地下水沉积富集. 有关智利地区的ClO4−暴露风险研究也显示出不同水源的ClO4−浓度差异,地下水ClO4−浓度(12.1 µg·L−1中值)超过地表水(中值1.8 µg·L−1)近10倍[27]. 由此可见,ClO4−在气候、地质和水文条件等因素影响下有逐渐向地下水沉积富集的趋势,使得各地区地下水ClO4−水平普遍高于地表水.
此外,水中ClO4−的含量受人类工业活动的影响较大. Alomirah等[28]发现,科威特艾哈迈迪省的自来水中ClO4−浓度最高为18.6 µg·L−1,超过中国成都市的暴露水平(最高浓度为1.61 µg·L−1)[29],这归因于该省是科威特的石油和天然气工业生产区;还有研究指出印度喀拉邦的地下水中ClO4−的平均浓度为773 µg·L−1,此检测值远超EPA建议的饮用水当量水平(15 µg·L−1)[30],原因在于取样点选取了当地高氯酸铵试验厂、航天中心等ClO4−生产及使用场所附近的水源. Kumarathilaka等[31]还分析了此类受污染程度较高的土壤或地下水中ClO4−与重金属/微量金属的影响关系,指出ClO4−可能会加速土壤矿物的溶解,以致土壤或地下水中重金属/微量金属浓度升高. Vigreux-Besret等[32]发现处理厂出水因含氯消毒剂的添加,其ClO4−浓度可能比集水区高0.15—0.5 µg·L−1. 因此,在选取饮用水水源时需充分考虑ClO4−的分布特征,同时保证可能被ClO4−影响的重金属含量等水质指标在标准限定范围内.
Lutter等[33]从经济成本的角度探讨了控制饮用水中ClO4−污染物的必要性. 由于公共饮用水系统中的ClO4−浓度处于相对安全水平,受ClO4−影响的高敏感人群占比较低,且通过降低饮用水中ClO4−水平以保障碘的正常吸收并非是最有效的途径,直接摄入微量碘补充剂足以满足人类健康需求[34]. 因此他认为降低饮用水中ClO4−浓度以控制ClO4−污染的水环境治理效益相对较低. 但“治标”还得“治本”,加强综合治理从水源中控制ClO4−污染至关重要.
近年来关于国内外饮用水中ClO4−暴露量的研究,绝大多数集中在自来水中污染物浓度检测层面,而对于矿物质水和纯净水中ClO4−的污染情况的认识仍处于空白,且不同水源的饮用水中其他离子与ClO4−之间的影响关系也有待进一步探索. 在饮用水ClO4−污染物治理方面,应优先加强环境中(特别是ClO4−生产和使用区)ClO4−污染监测与防治,严格管控相关企业的污染排放,以保障居民饮用水卫生安全.
-
植物不仅受天然水体、土壤等媒介中ClO4−环境浓度的影响,而且灌溉水和天然肥料中的ClO4−在一定程度上也能向外释放并在植物根系中积累[20,36 − 42]. 为评估ClO4−对植物源加工食品安全的潜在威胁,各国(地区)展开了一系列调查研究(表4).
Liao等[43]对京津冀地区植物源加工食品(包括谷物、豆制品、马铃薯制品、蔬菜产品、水果产品和食糖)中的ClO4−浓度进行测定,结果显示水果和蔬菜产品中的ClO4−检出水平最高,原因可能是其叶片面积较大,气孔数目多,在蒸腾作用下植物根部更易吸收水分,促进了ClO4−的运输. 就水果、蔬菜农产品而言,其对ClO4−的吸收速率可能受品种,气候条件以及竞争离子等因素影响而显现差异. Wang等[44]依据来自加拿大首都渥太华零售店的进口和国产食物样本,评估了加拿大人摄入水果和蔬菜可能接触到的ClO4−情况. 均由智利进口的两个不同品种的葡萄实验组的ClO4−含量存在差异,其中绿葡萄ClO4−的平均浓度为(45.5 ± 13.3)µg·kg−1,而无籽红提中ClO4−含量的平均值为(9.86 ± 15.1)µg·kg−1,产生这种差异的原因可能是受基因型以及生长和运输过程中环境因素的影响;值得注意的是,水果中哈密瓜的ClO4−暴露水平最高,其中产自危地马拉的哈密瓜的ClO4−平均含量高达(156 ± 99.5) µg·kg−1,已超过EFSA规定的临时参考水平(0.2 mg·kg−1). 另外,在中国武汉测定的蔬菜中ClO4−的结果显示,叶类蔬菜尤其是菠菜,相比于其他种类蔬菜(如黄瓜、胡萝卜等)更易吸收环境中的ClO4−[45],这一趋势与其他相关研究报道的结果一致[46 − 47]. Seyfferth等[38]还探究了两种气候条件下(“多云、潮湿、凉爽”:相对湿度=80%, 温度=18/15 ℃, 光量子通量密度=250 µmol·m−2·s−1;“晴朗、干燥、温暖”:相对湿度≤50%, 温度=28/18 ℃, 光量子通量密度=500 µmol·m−2·s−1)生菜在1.25 µg·L−1和10 µg·L−1ClO4−浓度体系中的污染物积累特征。研究表明,受气候影响,植物蒸腾速率相差2.0—2.7倍,导致生菜中ClO4−累积量呈现1.2—2.0倍的差异. 此外,NO3−已被证明能抑制大麦根对氯酸盐(ClO3−)的吸收,原因是这两种离子具有相同的转运机制[48],同理,ClO4−在植物中的跨膜运输效率可能也受NO3−等同类竞争离子的制约[49].
-
动物可在饮食过程中摄入ClO4−,食用动物加工食品时ClO4−可经食物链传递至人体内,对食品安全和人类健康构成直接威胁. 动物加工食品中肉类产品、蛋制品、水产品(包括海鲜)和乳制品中均存在可量化的ClO4−(表5).
Gan等[29]和Wang等[45]分别检测了中国成都市和武汉市动物食品样本中的ClO4−水平,发现鸡蛋中ClO4−的平均浓度(分别为15.3 µg·kg−1和15.86 µg·kg−1)远高于肉类,即使这两个地区肉类中ClO4−平均浓度相对不高,但却高出韩国肉类(0.60 µg·kg−1)[50]数倍. 值得注意的是,中国成都市的奶类中也检测出高浓度的ClO4−(均值:14.4 µg·kg−1)[29],这些高暴露水平的ClO4−可能来自喂养家畜的动物饲料和水源. 例如,Guruge等[51]比较了日本商业牛奶和现场直接采集的新鲜(生)牛奶中的ClO4−浓度,发现受畜牧业养殖过程中饲料差异的影响,商业牛奶中ClO4−的浓度明显更高. 此外,奶类中的ClO4−浓度或许还与家畜(牛/羊)的品种有关. Sungur等[52]测定了土耳其哈塔伊地区内牛奶、山羊奶、绵羊奶中ClO4−的平均含量,其中山羊奶(0.26 µg·kg−1)和牛奶(0.25 µg·kg−1)接近,绵羊奶检出水平最低(0.11 µg·kg−1). 同时,有关贝类的研究也表现了ClO4−的物种特异性积累. 位于中国南海海域内的深圳8种贝类(珠母贝、花蚬、近江牡蛎、华贵类栉孔扇贝、紫贻贝、方斑东风螺、杂色鲍和平蛤蜊)样本中,ClO4−平均浓度最高的是华贵类栉孔扇贝(14.0 µg·kg−1),其次是杂色鲍(11.6 µg·kg−1),方斑东风螺(2.33 µg·kg−1)最低[53],但对于物种差异导致ClO4−特异性积累的原因仍有待进一步研究.
-
人类除了通过摄食和饮用水途径接触ClO4−外,室内外灰尘也是ClO4−暴露的主要来源. 近年来,各国家及地区的灰尘样本中都检测出了一定浓度的ClO4−(表6).
Wan等[54]比较了中国、美国、印度等12个国家室内灰尘的ClO4−浓度,结果表明中国室内灰尘样本中的ClO4−浓度明显高于其他国家,其主要原因可能是中国人燃放烟花爆竹的节日习惯加剧了ClO4−污染. Gan等[55]在中国传统节日春节前后从中国北方地区采集了室外灰尘样本,部分采样点检出的ClO4−含量高达
5300 mg·kg−1,出现ClO4−浓度过高的原因可能是春节期间烟花爆竹的燃放产生的ClO4−残留物暴露于大气中,使得个别样品检测值偏高. Li等[9]发现在西藏某居住人口稀少的地区,灰尘中检出的ClO4−样本浓度值最低(0.01 mg·kg−1),而烟花生产区附近的ClO4−浓度高达815 mg·kg−1. 除上述烟火生产与燃放影响以外,人类生活习惯如开窗通风的频次也可能改变ClO4−水平[29]. Li等[9]还探究了季节差异对灰尘、土壤中ClO4−浓度的影响,结果表明中国人在冬季接触ClO4−的风险高于夏季,原因可能是夏季雨量充沛,灰尘中强水溶性的ClO4−被雨水溶解,转移到其他环境介质中. 室内外灰尘之间的ClO4−浓度在一定条件下存在相互影响关系[56]. Vella等[57]分析了马耳他国家同一地点收集的室内外灰尘之间ClO4−浓度的相关程度,结果表明两者具有强相关性,室外环境中负载ClO4−的大气颗粒可通过空气等媒介进入室内,影响室内ClO4−水平.综上可知,灰尘中ClO4−水平不仅受外部条件如人类活动、气候条件等因素的制约,室内外灰尘之间的ClO4−也会相互转移和累积,而室内外灰尘中ClO4−的来源及两者之间的转移机制有待进一步研究.
然而,据研究统计显示,室内灰尘对ClO4−日摄入的贡献不大(<5%)[29],摄食和饮水是中国人接触ClO4−的主要途径. 一般而言,大多数中国人的ClO4−日平均摄入量低于EPA的参考标准,但我国是世界上最大的烟花爆竹生产和消费国家,研究表明,烟花燃放后的水体和大气中存在高浓度ClO4−[58],故此标准未必能较好匹配或界定我国居民的ClO4−摄入量的安全限值. 即使该研究评估显示饮用水对ClO4−日摄入贡献率还不足10%,但由于ClO4−的水溶性极高(25 ℃时为200 g·L−1)[59],随地表水、地下水快速扩散,经食物链在动植物体内生物富集与积累,综上,究其原因在于饮用水水源为ClO4−污染途径的主要源头.
综上,ClO4−各暴露途径贡献率见图2.
-
如前所述,饮用水水源作为ClO4−污染途径的主要源头,如何有效控制其人群暴露风险是近年来研究工作的重点. 目前,处理饮用水中ClO4−污染物的方法包括物理法、化学法和生物法等,但由于生物法还原高氯酸盐对水质如pH值、温度和其他有机污染物非常敏感,电子供体的可获得性影响了ClO4−的生物降解的环境可持续性,且水体中各种病原生物的存在易造成处理工艺出水的二次污染,使得生物降解技术的应用受到限制[60],因此,本文重点综述了国内外饮用水中ClO4−的物理化学去除技术的研究进展,其中涉及的主要去除技术与原理如表7所示.
-
水处理过程中,常用颗粒活性炭(GAC)等吸附剂去除ClO4−. 一般来说,吸附效果受初始ClO4−浓度、溶液温度、pH值、接触时间和共存阴离子等多种因素的共同影响. 由于吸附剂的结构特征、表面性能直接制约着吸附材料的吸附能力,基于目前公认的离子交换、静电相互作用和表面络合的吸附机理,近年来大多数研究集中在新型吸附材料的探索以及吸附剂表面改性技术的研发与改进两大方面,以提高吸附法去除ClO4−的效果.
Krishnan等[61]采用纳米羟基磷灰石(nHA)及其磁性纳米复合材料(SPIONS@nHA)吸附实验室配水中的ClO4−,通过间歇吸附实验比较了不同吸附参数条件下两种材料对ClO4−的去除效果,nHA和SPIONS@nHA的最大吸附量分别为148.4 mg·g−1和305.8 mg·g−1,均高于目前使用广泛的GAC吸附剂. 此外,近中性pH值(pH=6—8)条件下ClO4−吸附同时发生PO43−的离子交换以及与正电荷吸附剂表面的静电相互作用,此时吸附效果最佳. 此外,季铵化改性磁性Mg/Al-层状双氢氧化合物(N8881Cl-LDH@Fe3O4)[62]、AIE效应超分子聚合物凝胶(PT-GEu)[63]和环氧氯丙烷交联壳聚糖水凝胶(ECH-CSBs)[64]等新型材料对水介质中的ClO4−均表现出良好的吸附性能,具有潜在的应用价值. 除吸附材料本身外,合成工艺对活性炭吸附剂的表面化学性质和多孔结构有显著影响,其中,表面改性可有效提高活性炭吸附容量. Rekha等[72]在Pluronic 123(P123)孔模板下利用KOH活化聚吡咯制备的氮掺杂活性炭对水中ClO4−的吸附容量高达587 mg·g−1,且材料可重复利用性能优良. Wang等[65]通过ZnO纳米颗粒调控生物炭的孔隙结构,用甜菜碱修饰生物炭的表面官能团,进而制备出了绿色季铵氮功能化介孔生物炭电极. 其增强机制为通过掺杂季胺氮基团引入额外的赝电容,改善电极的表面润湿性和电导率,从而加快双电层形成速率,提高了生物炭的电化学性能和电吸附能力.
需要注意的是,吸附过程只改变了ClO4−所在的位置,并没有将其还原降解成无毒的Cl−,因此,应充分考虑吸附剂解吸和避免产物可能引起的二次污染问题. 此外,新型吸附剂及其改性技术在市场上的竞争优势不仅取决于吸附材料的吸附性能,如吸附剂的吸附容量、化学稳定性、可重复使用性和可回收性等材料特性,材料成本的增加和高能耗的制备工艺等实际问题也不容忽视.
-
压力驱动膜过滤技术如纳滤(NF)、超滤(UF)、反渗透(RO)和电渗析(ED),被认为是去除ClO4−的有效工艺[73]. 针对水体中ClO4−污染防控的水净化膜技术,Li等[66]设计了一种聚偏氟乙烯-金属有机骨架复合超滤膜(PVA/Cu-iMOFs/PVDF-0.05),利用Cu-iMOFs的磺酸(R-SO3)配体与ClO4−之间的离子交换特性来捕获水中的ClO4−. 此外,反渗透膜主要用于地下水中ClO4−的去除,但由于污染物长期在膜表面或膜孔内的吸附、沉积,易造成膜孔堵塞,导致膜渗透流量下降,影响反渗透膜性能. 为减缓反渗透膜的污染,Yang等[67]在反渗透系统前增加了倒极电渗析工艺,ClO4−在电解过程中会生成盐酸,抑制氢氧化物的形成,从而减缓后期反渗透处理中污垢在膜上的积累. 此外,研究表明,倒极电渗析和反渗透一体化组合工艺(EDR + RO)中ClO4−的分离效果与工作电压呈正比,在40 V电压下,2.5 h内可去除高达95%的ClO4−. 经两级处理(EDR + RO)后,出水ClO4−浓度降至0.02 mg·L−1以下. 然而,由于RO工艺截留率易受初始ClO4−浓度影响,通常在处理低水平ClO4−污染的地下水时展现出良好的竞争力. 为了拓宽其适用范围,Russel等[74]在RO装置前串联了厌氧膜生物反应器(AFBR)和陶瓷微滤(MF)单元,以实现井水中ClO4−较高水平暴露条件下(15 mg·L−1)的水污染修复. 结果表明,约97%的ClO4−在AFBR单元被生物降解,RO膜只需负责吸附剩余部分(0.4 ± 0.35 mg·L−1),而MF的作用主要是控制AFBR出水中的菌落总数,对RO膜进水预处理,以减缓膜污染,保障AFBR-MF-RO生物-物理复合工艺能持续稳定发挥降解效能.
-
离子交换因其高效、操作方便和吸附容量高的特点已成为目前去除饮用水中ClO4−污染的主要途径. 近年来,多种阴离子交换树脂(不同基体或官能团)被研发用于水体中ClO4−的去除,其去除效率受树脂的交换能力、稳定性、选择性和再生能力等多种因素影响[31]. Zhu等[69]研究表明,在磁性离子交换树脂(MIEX)、Purolite A530E和Purolite A532E等 3种树脂中,由于不同树脂特定官能团和基体结构组成的差异,这两种Purolite树脂相较于MIEX树脂具有更优越的ClO4−选择性. 另外,ClO4−能自发地经历本体溶液迁移、边界层迁移、颗粒内迁移和本征吸附4个阶段被树脂化学吸附去除. 然而,天然水体中通常存在多种无机阴离子与ClO4−构成竞争关系,从而影响树脂吸附能力和ClO4−去除效果. Song等[70]探讨了共存离子(Cl−、SO42−、NO3−)对玉米秸秆改性磁性生物聚合物离子交换树脂(CS-MAB)去除水中ClO4−的影响,发现上述共存离子抑制CS-MAB去除ClO4−效果的影响程度排序为:SO42−>Cl−>NO3−. 此外,与MIEX树脂降解机理不同,CS-MAB降解ClO4−的整个过程中主要是以化学反应尤其是离子交换为主.
离子交换法去除ClO4−的技术限制主要是后期如何实现树脂中ClO4−的高效解吸,以保证树脂的可再生性和可持续利用. Faccini等[71]的研究表明,ClO4−在强碱性阴离子交换树脂中吸附和解吸的速率可能主要受化学吸附阶段限制. 此外,有研究指出,强碱性阴离子交换树脂似乎更适用于解决ClO4−浓度低于50 mg·L−1的水污染问题[75].
-
随着ClO4−在生产和使用过程中的排放,环境中的ClO4−含量逐渐上升,全球范围内饮用水、食品、室内外灰尘等介质中都能检测到ClO4−的存在. 对ClO4−的研究最早在美国引起了广泛关注,目前大多数国家对饮用水和食品中ClO4−的限量标准也通常基于美国及欧盟有关环保部门制订的法规或参考意见. 然而,由于ClO4−在不同地理区域的分布差异显著,此标准未必能适应当前形势下各国或地区对ClO4−安全限值摄入量的根本要求,亟待进一步完善. 在此基础上,应加强ClO4−在多介质环境中的监测并摸清其危害程度,以根据相应的人群暴露风险优先对特定污染源实行分类分级监管. 此外,为推动ClO4−环境化学行为的深入研究,针对ClO4−的分布、迁移与转化规律,提出如下建议:(1)加强ClO4−与多介质环境中共存阴离子的竞争机制研究;(2)明晰室内外灰尘中ClO4−的来源及两者之间的转移机制;(3)大气尘中的ClO4−是否可能成为土壤潜在污染源的问题有待进一步研究和解答.
饮用水水源是ClO4−污染途径的主要源头,为控制饮用水中ClO4−暴露风险,物理化学处理是去除饮用水中痕量ClO4−最常用的技术,包括吸附、膜过滤和离子交换. 在吸附法中,许多新型吸附剂及其表面改性复合材料均可经济高效地去除饮用水中的ClO4−,但吸附过程仅改变ClO4−所在的位置,并没有还原降解ClO4−并转化为Cl−,这可能导致ClO4−再次释放到环境中. 因此,应充分考虑吸附剂解吸和避免产物可能引起的二次污染问题. 与吸附法相似,离子交换也需实现树脂中ClO4−的高效解吸. 需要注意的是,选择性树脂是不可再生的,而非选择性树脂在可再生时会产生含高浓度ClO4−的废物流,今后研究可重点关注离子交换树脂与物化及生物降解技术的联合应用,解决其选择性和可再生性等应用难题. 此外,膜过滤技术易引起膜污染且成本较高,通常不适用于净化高浓度ClO4−的污染水体,但在膜过滤技术前增设预处理和膜污染防治单元或许是拓宽其应用前景的有效策略.
人群暴露高氯酸盐污染及其在饮用水中去除技术:综述
Population exposure to perchlorate contamination and its removal technologies in drinking water: A review
-
摘要: 高氯酸盐(perchlorate,ClO4−)是一种具有高水溶性、高度扩散性和持久性的有毒污染物质. 受自然和人为因素影响,ClO4−存在于大气、土壤、水体等公共环境中,并可通过食物链的传递进入人体. 此外,饮水和接触室内外灰尘也是人类暴露于ClO4−的主要途径. 因此,ClO4−的广泛存在会对人类健康构成直接或潜在威胁. 目前的研究主要集中在ClO4−的检测、暴露风险评估以及其控制去除技术的研发与改进. 大多数国家仍尚未确立ClO4−的限量标准,而是借鉴美国及欧盟有关环保部门制订的法规或参考意见. 鉴于此,本文对国际上有关ClO4−限量标准的规定进行了归纳分类,以期为形成更全面的环境健康和食品安全标准提供参考. 此外,还分别综述了ClO4−在不同暴露途径下(饮用水、食品及室内外灰尘等)的污染现状. 最后,讨论了物理化学方法去除水中ClO4−的内在机理与技术难点,由此展望相关技术的应用前景.Abstract: Perchlorate (ClO4−) is a toxic pollutant with high water solubility, high mobility and persistence. Perchlorate is present in atmosphere, soil, water, and other public environments due to natural and human factors, and can enter the human body through the food chain. In addition, drinking water and contacting with indoor and outdoor dust are also the main ways of human exposure to perchlorate. Hence, the presence of perchlorate poses a direct or potential threat to human health. The current researches mainly focus on the detection, assessment of exposure risks, as well as development and refinement of control technology of perchlorate. Most countries have not yet set up the guideline of perchlorate, but referred to the regulations or reference opinions present by the relevant environmental protection departments of the United States and the European Union. Given this, our review compiled and classified the international standard regulations on perchlorate, with a view to providing a reference for the establishment of more comprehensive environmental health and food safety standards. In addition, the pollution status of perchlorate under different exposure ways (i.e., drinking water, food, as well as indoor and outdoor dust, etc.) was summarized. Finally, the intrinsic mechanism and technical difficulties of physical-chemical treatment technologies for removing ClO4− from water were discussed, and the application prospects of related technologies were prospected.
-
Key words:
- perchlorate /
- standard regulations /
- pollution status /
- physical-chemical treatment /
- human exposure.
-
含镍废渣和废水的排放会污染地下水。受镍污染的地下水作为饮用水源时会危害人体健康[1],主要是对皮肤、神经和心脑血管系统等造成损害[2],1990年国际癌症研究所确定Ni(Ⅱ)及其化合物对人体具有致癌性[3]。因此,我国对水中Ni(Ⅱ)的标准也越来越严格,《地下水质量标准》(GB/T 14848-2017)中规定,I类水中Ni(Ⅱ)含量不能超过2 μg·L−1[4]。有研究者发现,Ni(Ⅱ)在长江水体中暴露的质量浓度均值为168.14 μg·L−1,其中采样点最高检出质量浓度为480 μg·L−1,在海河和珠江流域平均暴露质量浓度也超标,分别为11.11 μg·L−1和15.87 μg·L−1[5]。目前,去除水中Ni(Ⅱ)的方法包括化学沉淀法、电解法、离子交换法、膜分离法和吸附法等[6-10]。其中,吸附法操作简单、成本低且不易造成二次污染,是目前去除水中Ni(Ⅱ)的主要方法之一。
目前,用于去除水中Ni(Ⅱ)的吸附剂主要有活性炭[11]、多壁碳纳米管[12]、石墨烯[13]和沸石[14]等。其中,多壁碳纳米管(MWCNTs)是一种表面分布均匀,具有独特中空多层结构和高化学稳定性的新型碳纳米材料,被广泛应用于水中重金属的吸附研究[15]。但MWCNTs作为纳米材料在溶液中易团聚[16],从而导致其对水中Ni(Ⅱ)的吸附效能有限。因此,为了提高MWCNTs在水中的分散性和吸附效果,有必要对MWCNTs进行改性。有研究者发现,改性MWCNTs的最常用方法为表面氧化法[17]。LI等[12]用H2O2、HNO3和KMnO4氧化处理后的MWCNTs去吸附去除水中Cd2+,结果表明,氧化处理后MWCNTs的孔容和比表面增加,吸附能力增强,且经KMnO4氧化后的MWCNTs对水中Cd2+的吸附量最大,为11.0 mg·g−1。FARGHALI等[17]用H2O2和HNO3混合物制备氧化MWCNT,对Ni(Ⅱ)的去除率可达83%。这主要是由于H2O2和HNO3氧化作用可以破坏MWCNT的内管空间,甚至部分打开尖端并将MWCNT分解成较小的碎片,改善了MWCNT的分散性,并且氧化处理后MWCNT表面上的含氧官能团(例如—COOH,—OH和—C=O)的数量大大增加,可以提供更多化学吸附位点。不难看出,氧化改性MWCNTs主要是通过常用的氧化剂,使原本疏水的MWCNTs表面产生大量的亲水性含氧官能基团(羧基、羟基和酯类)[18]。亲水性含氧官能基团一方面能在溶液中发生解离从而降低MWCNTs表面的Zeta电位值,进而增强其对带正电金属离子(Cu2+、Cd2+、Zn2+和Ni2+等)的静电吸引力[19];另一方面可降低MWCNTs颗粒之间的范德华力,从而提高MWCNTs在水中的分散性[20]。同时,为了进一步提高氧化MWCNTs在水中的分散性,有研究人员采用超声的方法,主要通过在溶液中生成的微小气泡瞬间爆破,产生大的能量冲击波使通过范德华力粘结在一起的MWCNTs团族分离[21]。
鉴于上述原因,本研究旨在通过超声氧化的方法研制出一种水中Ni(Ⅱ)的高效吸附剂——超声氧化多壁碳纳米管(MWCNTs-Mn),该方法一方面可提高其在水中的分散性,另一方面可增强其对水中Ni(Ⅱ)的吸附效能。首先,通过单因素变量法优化MWCNTs-Mn的制备条件;然后采用动力学和等温吸附考察了MWCNTs-Mn对水中Ni(Ⅱ)的吸附效能;最后基于表面物化特性表征探究了MWCNTs-Mn对水中Ni(Ⅱ)的吸附机理,以期为水中Ni(Ⅱ)的有效去除方法提供参考。
1. 材料与方法
1.1 材料与试剂
本研究选用的MWCNTs购自深圳市纳米港有限公司,管径为50 nm,使用前需要在60 ℃干燥箱中干燥24 h待用。本研究所用化学试剂有高锰酸钾、硝酸、过氧化氢、六水合硫酸镍、柠檬酸铵、丁二酮肟、EDTA、氨水、碘和碘化钾,均购自北京蓝弋化工产品有限责任公司。
1.2 超声氧化MWCNTs的制备与优化
本研究分别采用H2O2、HNO3和KMnO4对MWCNTs进行氧化改性。首先,将1.5 g的MWCNTs加入到250 mL一定浓度的氧化剂中,将混合液封口后,在恒温水浴超声仪中超声分散,设置水浴温度为15~35 ℃、超声时间为1.5~2.5 h,然后将混合液抽滤,得到固相的超声氧化MWCNTs,用去离子水洗净后置于60 ℃恒温干燥箱中干燥24 h,固体样品研磨待用。
为了进一步提高超声氧化MWCNTs对水中Ni(Ⅱ)的吸附量,本研究优化了其制备条件,主要包括氧化剂种类(H2O2、HNO3和KMnO4)、氧化剂投加量(2.10、1.43、0.75 g)、超声氧化时间(0.5、1.5、2.5 h)和超声氧化温度(15、25、35 ℃)。
1.3 Ni(Ⅱ)的吸附
本研究中动力学和等温吸附实验均参照HOU等[22]研究中使用的方法。其中,动力学吸附实验中Ni(Ⅱ)的初始质量浓度为150 mg·L−1,等温吸附实验中Ni(Ⅱ)的初始质量浓度依次为1、5、10、20、50、100和150 mg·L−1,吸附温度为25 ℃。本研究水中Ni(Ⅱ)的检测方法采用丁二酮肟分光光度法(GB 11910-1989)。每次实验都设置平行样,且实验误差控制在1%~3%。
1.4 MWCNTs的表征
本研究分别采用Autosorb-iQ仪器(美国Quanta-chrome公司)、场发射扫描电子显微镜(SEM)、vario MACRO cube元素分析仪和傅里叶变换红外光谱仪(Nicolet IS10美国尼高力公司)对超声氧化前后的MWCNTs进行表观形貌分析、BET比表面积和孔容孔径测定、元素分析以及表面含氧官能团分析。
2. 结果与讨论
2.1 超声氧化MWCNTs的制备条件优化
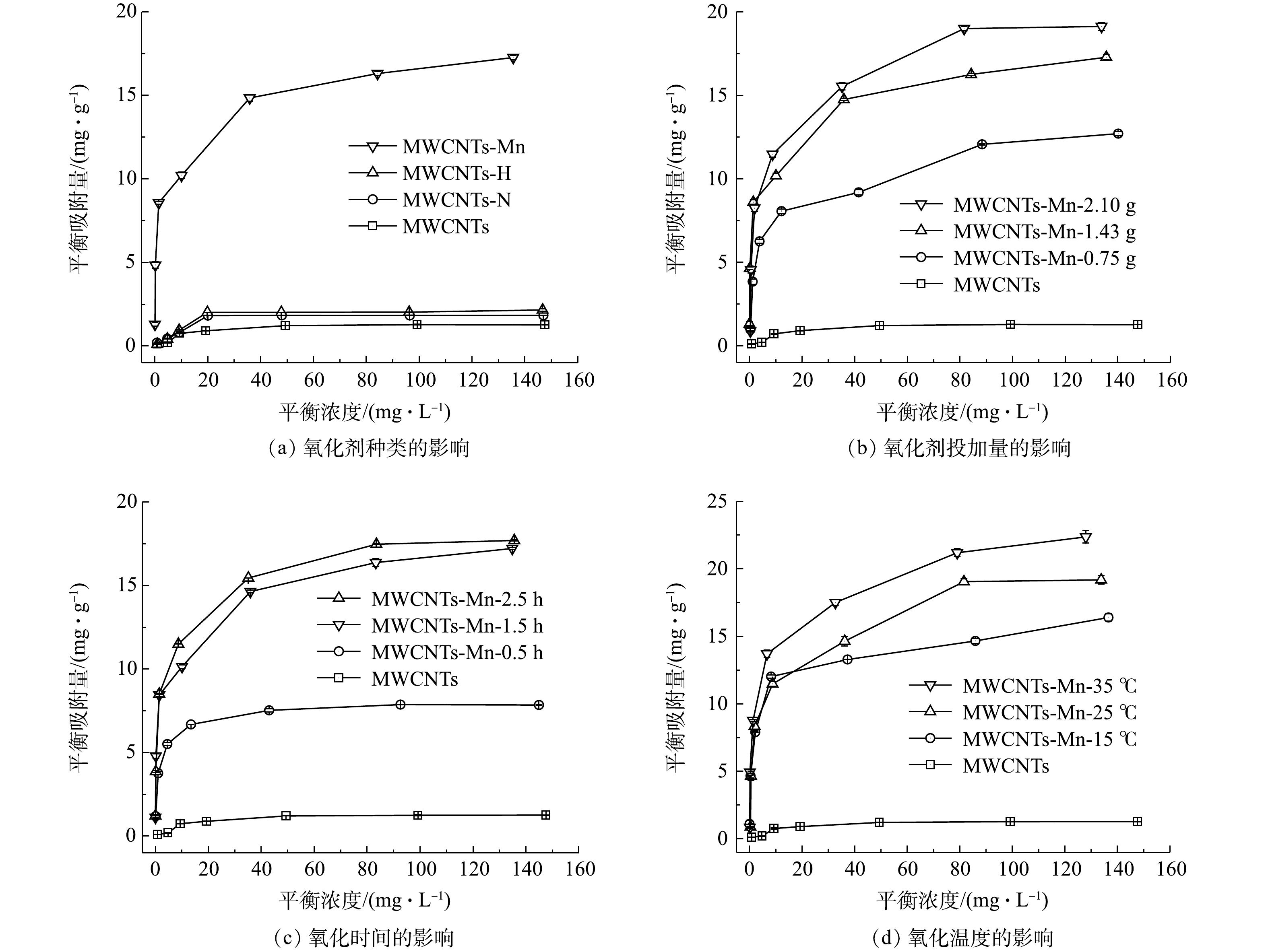
分别考察了不同氧化剂种类、氧化剂投加量、超声氧化时间和超声氧化温度对超声氧化MWCNTs吸附水中Ni(Ⅱ)的效能影响。由图1(a)可知,当氧化剂投加量为1.43 g、超声氧化时间为1.5 h和超声氧化温度为25 ℃时,在3种氧化剂中,经KMnO4氧化后的MWCNTs-Mn对Ni(Ⅱ)的吸附量最大(17.27 mg·g−1),是H2O2氧化后MWCNTs-H的8.15倍,是HNO3氧化后MWCNTs-N的9.39倍,是MWCNTs的13.59倍。这可能是由于:一方面,与H2O2和HNO3相比,经KMnO4氧化后MWCNTs表面的含氧官能基团含量更多,可提高其对Ni(Ⅱ)的吸附强度;另一方面,KMnO4氧化过程中产生了少量的MnO2,而MnO2本身就具有较大的比表面积和良好的吸附性能,可进一步增强MWCNTs-Mn对Ni(Ⅱ)的吸附作用。这与LI等[12]的研究结果是一致的,即当采用H2O2、HNO3和KMnO4分别氧化处理MWCNTs时,经KMnO4氧化后的MWCNTs对Cd2+的吸附量最大,为11 mg·g−1,而Ni2+与Cd2+具有相似的吸附特性。
由图1(b)可知,当氧化剂为KMnO4、超声氧化时间为1.5 h和超声氧化温度为25 ℃时,在氧化剂投加量从0 g增大到2.10 g的过程中,MWCNTs-Mn对Ni(Ⅱ)的吸附量逐渐增加;且当氧化剂投加量为2.10 g 时,MWCNTs-Mn对Ni(Ⅱ)的吸附量达到最大值(19.14 mg·g−1),明显高于氧化剂投加量为1.43 g和0.75 g时的吸附量(17.30 mg·g−1和12.71 mg·g−1)。这说明,当KMnO4的投加量增加时,MWCNTs的氧化程度提高,使其表面产生的含氧官能基团含量增加,从而可增加其对水中Ni(Ⅱ)的吸附量。
由图1(c)可知,当氧化剂为KMnO4、氧化剂投加量为2.10 g和超声氧化温度为25 ℃时,在超声氧化时间为2.5 h时,MWCNTs-Mn对Ni(Ⅱ)的吸附量最大(17.71 mg·g−1),当超声氧化时间分别减少到1.5 h和0.5 h时,MWCNTs-Mn对Ni(Ⅱ)的吸附量逐渐减小,分别为17.23和7.85 mg·g−1。以上结果说明,MWCNTs-Mn对Ni(Ⅱ)的吸附量随着氧化时间的增加而增加。这与叶智新等[23]的研究结果是一致的,即在使用酰胺化/氧化碳纳米管去除三价砷时,当氧化时间从2 h 增加到4 h时,吸附量从4 mg·g−1提高到了13 mg·g−1。
由图1(d)可以看出,当氧化剂为KMnO4、氧化剂投加量为2.10 g和超声氧化时间为2.5 h时,在超声氧化温度由 15 ℃升高到 35 ℃的过程中,MWCNTs-Mn对Ni(Ⅱ)的吸附量逐渐增加,且吸附速率逐渐升高,说明MWCNTs-Mn吸附去除水中Ni(Ⅱ)的反应属于吸热反应。当超声氧化温度为 35 ℃时,MWCNTs-Mn对Ni(Ⅱ)的吸附量达到最大,为22.37 mg·g−1。这主要是由于温度升高可以提高分子的活化能,分子扩散速率升高,从而促进反应进行。
综合以上结果可知,MWCNTs-Mn的最佳制备条件为:氧化剂KMnO4投加量为2.1 g,氧化时间为2.5 h,氧化温度为35 ℃,此时,MWCNTs-Mn对Ni(Ⅱ)的吸附量最大为22.37 mg·g−1(C0=150 mg·L−1),比氧化前提高了16.61倍。对比4种不同的制备条件可以看出,氧化剂种类对氧化效果影响最大,其次是氧化时间。这主要是由于MWCNTs-Mn的氧化程度越高,其表面的亲水性官能基团越多,分散性能越好,对水中Ni(Ⅱ)的吸附效果越好[20];此外,超声也可提高MWCNTs-Mn在水中的分散性,有利于MWCNTs-Mn对水中Ni(Ⅱ)的吸附。
2.2 MWCNTs-Mn对Ni(Ⅱ)的吸附效能
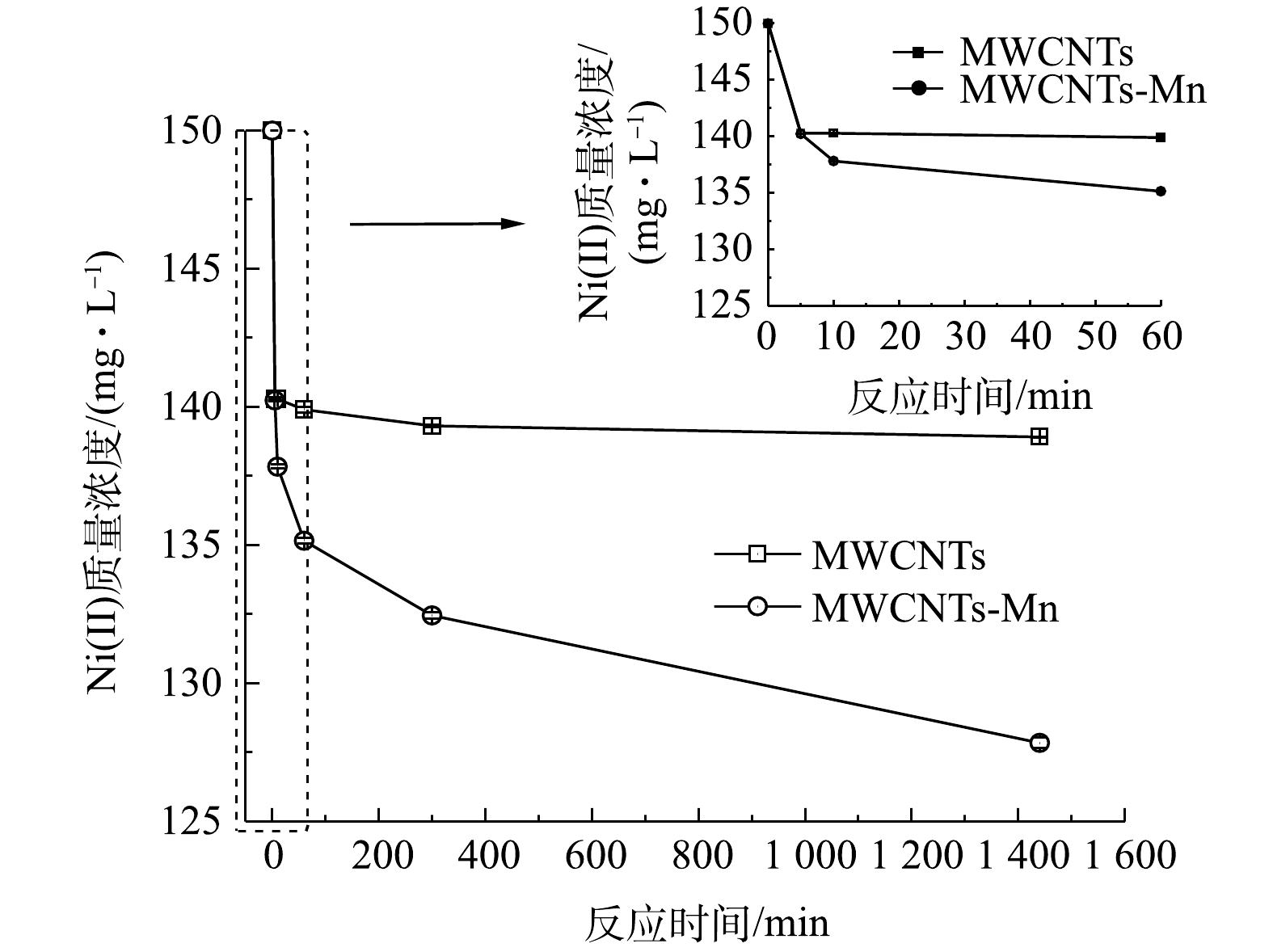
1)动力学吸附效能。为了进一步考察MWCNTs-Mn在超声氧化前后对水中Ni(Ⅱ)的吸附效能,本研究分析了MWCNTs-Mn对水中Ni(Ⅱ)的动力学吸附变化规律,如图2所示。由图2可以看出,当水中Ni(Ⅱ)的初始质量浓度为150 mg·L−1时,MWCNTs-Mn对水中Ni(Ⅱ)的吸附速率均高于MWCNTs;且随着吸附时间的增加,MWCNTs-Mn在超声氧化前后对水中Ni(Ⅱ)的吸附速率均逐渐降低。尤其需要关注的是,当吸附时间小于等于5 min时,超声氧化前后的MWCNTs对Ni(Ⅱ)的吸附速率最快;而当吸附时间大于5 min时,超声氧化前后的MWCNTs对Ni(Ⅱ)的吸附速率逐渐减慢。同时,MWCNTs-Mn对Ni(Ⅱ)的去除率明显提高,吸附平衡时去除率从超声氧化前的7.39%提高到14.77%。
为了进一步研究MWCNTs超声氧化前后的动力学吸附过程,通过准一阶动力学和准二阶动力学方程进行拟合[24],拟合结果如表1所示。由表1可以看出,准二阶动力学吸附模型可以更好地描述MWCNTs-Mn对Ni(Ⅱ)的吸附过程(R2=0.997 1),说明 MWCNTs-Mn对水中的Ni(Ⅱ)主要以化学吸附为主。此外,超声氧化后的MWCNTs-Mn对Ni(Ⅱ)的吸附速率常数k2(0.533 9)比超声氧化前(0.046 7)大幅提高,说明MWCNTs-Mn对Ni(Ⅱ)的吸附速率明显增加。这可能是由于化学吸附过程会涉及离子交换过程,或者MWCNTs-Mn上的含氧官能基团与Ni(Ⅱ)形成了化学键,这均有利于MWCNTs-Mn对水中Ni(Ⅱ)的吸附[25]。
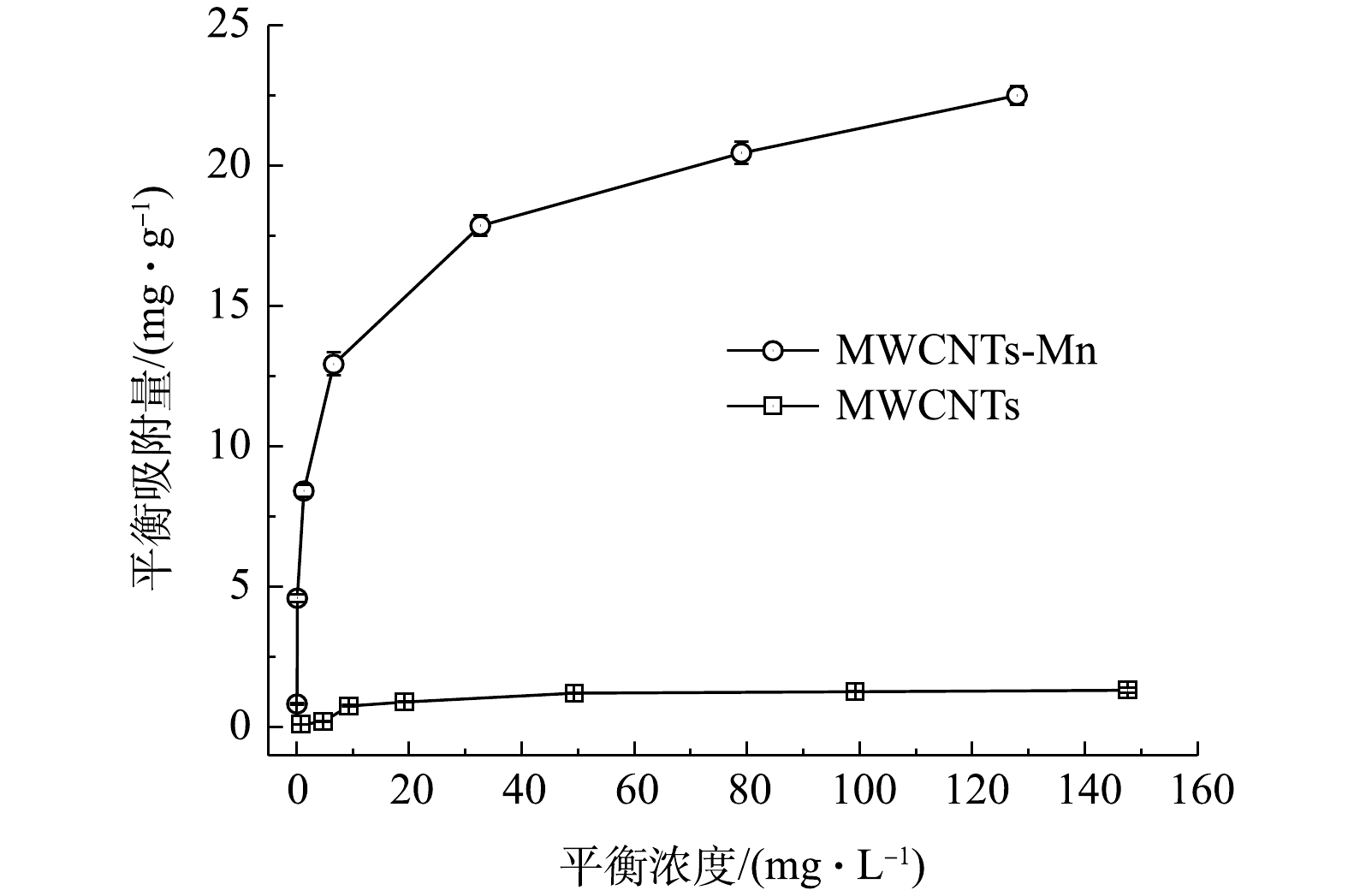
表 1 超声氧化前后MWCNTs的动力学吸附模型拟合参数Table 1. Fitting parameters of kinetic adsorption model of MWCNTs before and after ultrasonic oxidation材料类型 qe/(mg·g−1) 准一阶动力学参数 准二阶动力学参数 k1/min−1 R2 k2/min−1 R2 MWCNTs 1.270 0 0.001 8 0.982 4 0.046 7 0.653 2 MWCNTs-Mn 22.370 0 0.004 8 0.979 8 0.533 9 0.997 1 2)等温吸附效能。图3为超声氧化前后的MWCNTs对水中Ni(Ⅱ)的等温吸附曲线。由图3可以看出,MWCNTs-Mn对Ni(Ⅱ)的吸附量随着Ni(Ⅱ)的平衡浓度的增加而增加。当水中Ni(Ⅱ)平衡浓度低于15 mg·L−1时,吸附量呈直线上升趋势,吸附速率较快;当平衡浓度高于15 mg·L−1时,吸附量随平衡浓度的增加而增加缓慢;当吸附达到平衡时,MWCNTs-Mn的吸附量(22.37 mg·g−1)明显高于MWCNTs的吸附量(1.32 mg·g−1)。
为考察超声氧化前后MWCNTs吸附水中Ni(Ⅱ)的热力学机理,本研究分别采用Langmuir和Freundlich等温吸附模型对等温吸附过程进行拟合[24],结果见表2。由表2可以看出,Langmuir等温吸附模型能较好地描述MWCNTs-Mn对水中Ni(Ⅱ)的吸附过程(R2为0.996 2),说明MWCNTs-Mn表面均一,各处吸附性能相同,对Ni(Ⅱ)的吸附属于单分子层吸附。同时,拟合参数n>1,说明MWCNTs-Mn对水中Ni(Ⅱ)的吸附属于易吸附过程[26]。此外,Langmuir模型也可以较好地描述MWCNTs对Ni(Ⅱ)的吸附过程(R2为0.982 3),说明其对Ni(Ⅱ)的吸附也属于单分子层吸附。
表 2 超声氧化前后MWCNTs的等温吸附模型拟合参数Table 2. Fitting parameters of isotherm adsorption model for MWCNTs before and after ultrasonic oxidation类型 Langmuir模型参数 Freundlich模型参数 qe/(mg·g−1) KL/(L·mg−1) R2 n KF R2 MWCNTs 1.270 0 0.080 5 0.982 3 1.934 2 0.135 3 0.868 7 MWCNTs-Mn 22.370 0 0.264 1 0.996 2 2.798 0 5.004 3 0.775 3 以上结果表明,超声氧化MWCNTs-Mn能有效提高其对水中Ni(Ⅱ)的吸附效能,其最大吸附量可达到22.37 mg·g−1(表2),比超声氧化前增加了21.10 mg·g−1,亦高于其他研究中改性MWCNTs对水中Ni(Ⅱ)的吸附量[27-29]。CHEN等[27]制备的MWCNT/Fe2O3复合材料对水中Ni(Ⅱ)的吸附量为9.18 mg·g−1;AHMADI等[28]使用H2O2氧化改性MWCNT,其对水中Ni(Ⅱ)的吸附量为14.20 mg·g−1;SHIN等[29]制备的氮掺杂磁性MWCNT对水中Ni(Ⅱ)的吸附量为8.06 mg·g−1。
2.3 超声氧化MWCNTs对Ni(Ⅱ)的吸附机理
1) SEM分析。为了进一步研究MWCNTs在超声氧化前后的表面形态分布情况,本研究对比分析了超声氧化前后的MWCNTs的扫描电镜图像,如图4所示。如图4可知,超声氧化处理后的MWCNTs-Mn表面较为分散,呈层状分布,每层的厚度在0.5~1 μm(图4(b),图4 (d));而超声氧化前的MWCNTs则相互聚集且缠绕在一起,呈团状分布,团体的直径为4~6 μm,明显大于超声氧化后。这一结果说明超声氧化增强了MWCNTs-Mn的分散性,这可能是由于超声产生的微小气泡瞬间爆破,该能量冲击波对周围的碳纳米管簇起作用,从而使得通过范德华力粘结在一起的团族分散[30-31]。
2) BET比表面积及孔容孔径分布。表3为超声氧化前后MWCNTs的比表面积及孔容孔径分布情况。由表3可以看出,MWCNTs-Mn的总孔容量比超声氧化前减少了1.969 cm3·g−1,其中中孔孔容减少最多,为1.965 cm3·g−1。这可能是由于含氧官能基团占据了空位,或者氧化过程中生成的MnO2负载到MWCNTs表面,从而造成其部分孔道在反应过程中被堵塞。这与DAIFULLAH等[32]和LI等[12]研究结果是一致的。DAIFULLAH等[32]发现,经过KMnO4改性后的活性炭会有一些MnO2附着在其表面。LI等[12]使用H2O2、HNO3和KMnO4氧化处理的碳纳米管(CNT)去吸附去除水中Cd2+,对Cd2+的吸附量分别为2.6、5.1和11.0 mg·g−1,其中KMnO4氧化的CNT的吸附容量突然增加,这可能是由于负载在CNT上的残留MnO2颗粒的吸附作用所致,由此可以推测,本实验中MWCNT-Mn表面有MnO2沉积。
表 3 超声氧化前后 MWCNTs的比表面积及孔容孔径分布Table 3. Specific surface area and pore volume distribution of MWCNTs before and after ultrasonic oxidation类型 微孔/(cm3·g−1) 中孔/(cm3·g−1) 总孔/(cm3·g−1) 比表面积/(m2·g−1) 平均孔径/nm MWCNTs 0.021 2.690 2.711 161.190 67.260 MWCNTs-Mn 0.017 0.725 0.742 181.280 33.097 3)元素分析。表4为超声氧化前后MWCNTs的元素分析情况。由表4可以看出,在超声氧化后,MWCNTs-Mn表面的O含量明显增加,由超声氧化前的1.40 %增加到14.08 %,这说明超声氧化后MWCNTs-Mn表面的含氧官能基团增加,这与图5的结果一致。
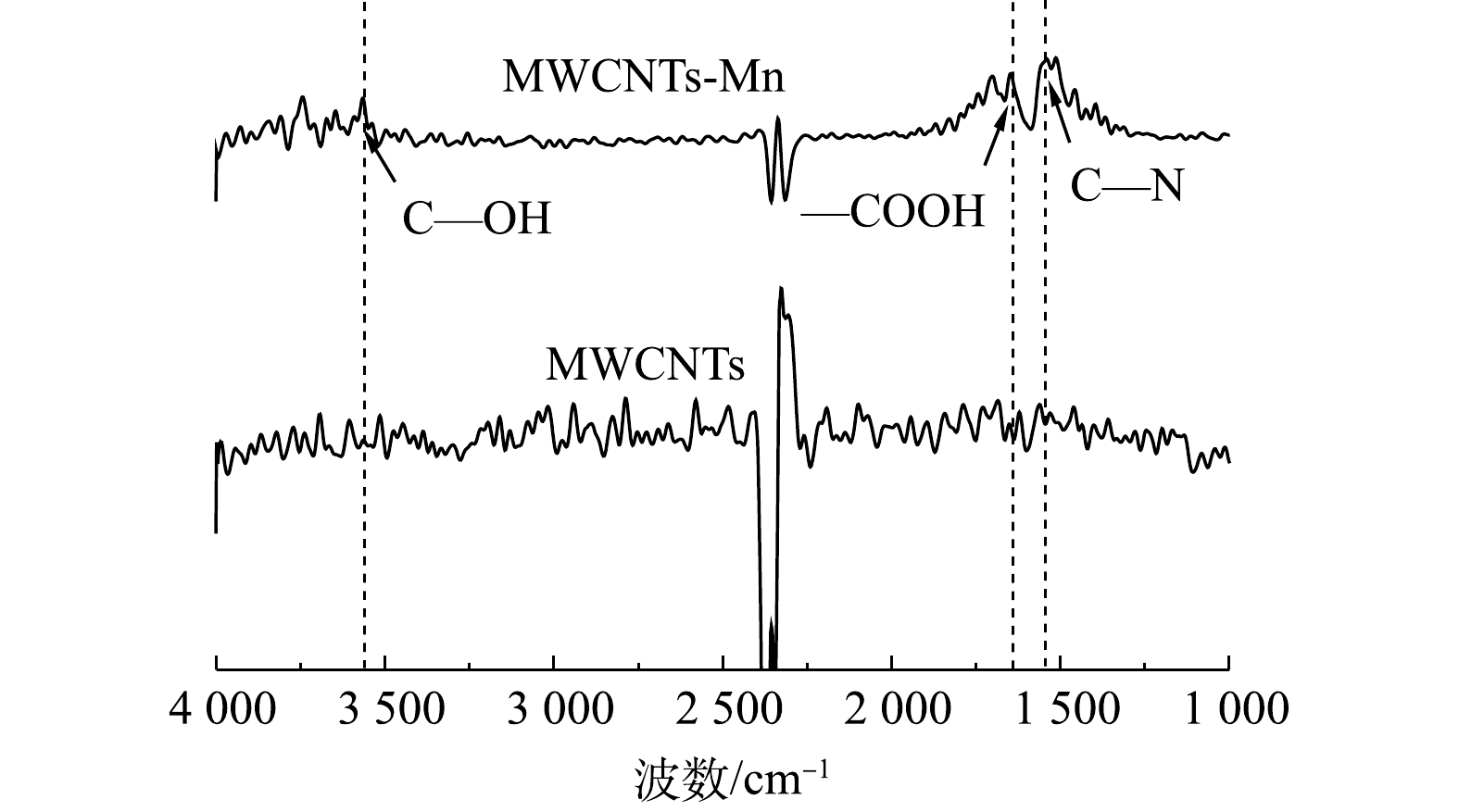
表 4 超声氧化前后MWCNTs的元素分析Table 4. Elemental analysis of MWCNTs before and after ultrasonic oxidation类型 元素含量/% N C S H O MWCNTs 0.474 93.960 0.118 0.049 1.399 MWCNTs-Mn 0.334 84.060 0.163 0.364 14.079 4)傅里叶变换红外光谱分析。图5为超声氧化前后MWCNTs的红外吸收光谱图。其中,波数3 200~3 600 cm−1为C—OH(羟基)的伸缩振动锋,波数1 650~1 750 cm−1为—COOH(羧基)的伸缩振动锋,波数1 690~1 590 cm−1为C—N(氰基)的伸缩振动锋。由图5可以看出,经过超声氧化处理,MWCNTs-Mn表面引入了大量的亲水性官能基团(羟基、羧基)。这一方面可提高MWCNTs-Mn在水中的分散性;另一方面,可提高MWCNTs-Mn对水中Ni(Ⅱ)的吸附效能。这与CHEN等[33]的研究结果一致,即通过X 射线吸收光谱证实了Cu2+和Pb2+ 与MWCNTs表面的羧基或者羟基能够形成内层配合物,且MWCNTs对金属离子的吸附能力随其表面含氧官能团(羧基、羟基和内酯基等)数量的增加而增强。
综上所述,通过对MWCNTs-Mn的扫描电镜分析、比表面积、孔容孔径分布、元素分析和红外光谱分析发现,MWCNTs-Mn的总孔容量减少了72.64%,O元素含量提高了12.68%,说明亲水性官能基团填充在MWCNTs-Mn表面孔隙内。亲水性含氧官能基团一方面能在溶液中发生解离从而降低MWCNTs表面的Zeta电位值,进而增强其对Ni(Ⅱ)的静电吸引力;另一方面可降低MWCNTs颗粒之间的范德华力,从而提高MWCNTs在水中的分散性[19]。同时,本研究采用超声的方法,通过在溶液中生成的微小气泡瞬间爆破,产生大的能量冲击波使通过范德华力粘结在一起的MWCNTs团族分离[20],从而可提高MWCNTs-Mn在水中的分散性,这些均有利于提高MWCNTs-Mn对水中Ni(Ⅱ)的吸附能力。
3. 结论
1)本实验获得了MWCNTs- Mn的最佳制备条件,即KMnO4为氧化剂、氧化剂投加量为2.1 g、超声氧化时间为2.5 h、超声氧化温度为35 ℃;此时MWCNTs-Mn对水中Ni(Ⅱ)的吸附量最大,为 22.37 mg·g−1,比超声氧化前提高了16.61倍,且优于其他常见的吸附剂。
2) MWCNTs-Mn对水中Ni(Ⅱ)的吸附过程符合准二阶动力学模型(R2=0.997 1)和Langmuir模型(R2=0.996 2),说明超声氧化后MWCNTs-Mn表面均一,对Ni(Ⅱ)的吸附属于单分子层吸附和化学吸附。
3)超声氧化后MWCNTs-Mn的总孔容量降低了72.64 %,O元素含量提高了12.68 %,亲水性含氧官能基团(羟基和羧基)含量增加,推测可能是这些含氧官能团和超声的综合作用提高了MWCNTs-Mn对Ni(Ⅱ)的吸附效能。
-
表 1 饮用水中ClO4−含量的限值
Table 1. Upper limits of perchlorate content in drinking water
表 2 食物中ClO4−含量的参考水平
Table 2. Reference level of perchlorate content in food
表 3 各国(地区)饮用水中ClO4−检出情况
Table 3. Perchlorate pollution in indoor and outdoor dust in various countries (regions)
国家(地区)Countries(regions) 检测对象Detection objects 检出浓度/(µg·L−1)Detection concentration 参考文献References 中国 成都 自来水 0.57—1.61(均值=0.86,中值=0.83, DN=51) [29] 矿泉水 0.15—2.84(均值=1.03,中值=0.75, DN=12) 智利 地下水 中值=12.1, DN=6 [27] 地表水 中值=1.8, DN=6 土耳其 伊斯坦布尔 自来水 0.04—0.09(中值=0.08, DN=60) [25] 安卡拉 0.07—0.21(中值=0.07, DN=35) 萨卡利亚 中值=0.04, DN=20 伊斯帕尔塔 0.02—0.07(中值=0.03, DN=15) 开塞利 0.23—0.31(中值=0.25, DN=15) 科威特 艾哈迈迪 自来水 0.01—18.6(均值=1.24) [28,35] 印度 喀拉拉邦 地下水 均值=773, DN=160 [30] 地表水 均值=79.41, DN=10 注:DN, 样本数. data number. 表 4 各国(地区)植物源加工食品中ClO4−检出情况
Table 4. Perchlorate contamination in plant-source processed foods in various countries (regions)
国家(地区)Countries(regions) 检测对象Detection objects 检出浓度/(µg·kg−1)Detection concentration 参考文献References 中国 北京, 天津, 河北 谷物 均值=6.2, DN=60 [43] 豆制品 均值=7.7, DN=60 马铃薯制品 均值=7.6, DN=60 蔬菜产品 均值=11.2, DN=60 水果产品 均值=10.4, DN=60 食糖 均值=2.0, DN=60 中国 武汉 菠菜 均值=140.2 ± 102.4, DN=15 [45] 生菜 均值=29.28 ± 66.37, DN=15 黄瓜 均值=7.77 ± 4.55, DN=15 胡萝卜 均值=8.73 ± 4.75, DN=15 加拿大 商品 原产国 [44] 菠菜 美国 均值=133 ± 24.9, DN=6 哈密瓜 哥斯达黎加 均值=0.61 ± 1.13, DN=6 哈密瓜 危地马拉 均值=156 ± 99.5, DN=6 绿葡萄 智利 均值=45.5 ± 13.3, DN=6 无籽红提 智利 均值=9.86 ± 15.1, DN=6 注:DN, 样本数. data number. 表 5 各国(地区)动物加工食品中ClO4−污染情况
Table 5. Perchlorate contamination in animal processed foods in various countries (regions)
国家(地区)Countries(regions) 检测对象Detection objects 检出浓度/(µg·kg−1)Detection concentration 参考文献References 中国 北京, 天津, 河北 肉类 均值=3.8, DN=60 [43] 蛋制品 均值=3.1, DN=60 水产品 均值=8.0, DN=60 乳制品 均值=3.7, DN=60 中国 成都 肉类 猪肉 ND—13.8(均值=4.60, DN=20) [29] 牛肉 ND—28.8(均值=5.61, DN=20) 淡水鱼 鲫鱼 ND—15.7(均值=4.45, DN=20) 鲤鱼 ND—16.0(均值=4.48, DN=20) 草鱼 1.40—11.7(均值=4.43, DN=20) 海鲜 带鱼 3.17—8.80(均值=5.94, DN=5) 螳螂虾 6.89—15.8(均值=12.1, DN=5) 扇贝 4.40—8.25(均值=6.34, DN=5) 蛋制品 蛋 LOQ—22.5(均值=15.3, DN=20) 乳制品 奶 9.38—25.2(均值=14.4, DN=20) 中国 武汉 肉类 猪肉 ND—14.48(均值=2.99, DN=15) [45] 牛肉 0.89—10.68(均值=3.72, DN=15) 蛋制品 蛋 ND—59.31(均值=15.86, DN=15) 韩国 肉类 猪肉 均值=0.32, DN=20 [50] 牛肉 均值=0.62, DN=20 鱼类和贝类 均值=0.95, DN=100 土耳其 哈塔伊 奶 牛奶 均值=0.25, DN=3 [52] 山羊奶 均值=0.26, DN=3 绵羊奶 均值=0.11, DN=3 中国 深圳 贝类 珠母贝 均值=5.99, DN=16 [53] 花蚬 均值=5.64, DN=15 近江牡蛎 均值=7.40, DN=42 华贵类栉孔扇贝 均值=14.0, DN=31 紫贻贝 均值=4.45, DN=13 方斑东风螺 均值=2.33, DN=11 杂色鲍 均值=11.6, DN=27 平蛤蜊 均值=4.22, DN=23 注:DN, 样本数. data number; ND, 未检出. not detected; LOQ, 定量极限. limit of quantification. 表 6 各国(地区)室内外灰尘中ClO4−污染情况
Table 6. Perchlorate pollution in indoor and outdoor dust in various countries (regions)
国家(地区)Countries(regions) 检测对象Detection objects 检出浓度/(mg·kg−1)Detection concentration 季节Season 参考文献References 中国 华北地区 室外灰尘 0.22—215(中值=5.01) 夏季 [9] 华南地区 0.01—921(中值=13.0) 全国范围 中值=8.1 北方地区 室内灰尘 中值=15.2 南方地区 中值=9.79 全国范围 中值=11.4 全国范围 土壤 均值=0.33, 中值=0.05 中国 北方地区 室外灰尘 0.132— 5300 (中值=37.4)春季2—3月(春节期间) [55] 南方地区 0.270— 3700 (中值=48.7)中国 天津 室内灰尘 0.72—119(均值=30.1, DN=54) 夏季 [29] 成都 0.11—38.8(均值=7.91, DN=51) 夏季 希腊 室内灰尘 0.08—4.67(中值=0.37, DN=30) — [54] 罗马尼亚 0.03—1.83(中值=0.16, DN=23) 美国 0.03—1.18(中值=0.41, DN=30) 印度 室内灰尘 0.04—19.1(中值=0.14, DN=30) — [54] 中国 0.88—60.7(中值=4.25, DN=30) 马耳他 室内灰尘 0.790—53(中值=7.8, DN=37) 秋季 [57] 注:DN, 样本数. data number; 灰尘中检测的ClO4−浓度指摄入、吸入和皮肤接触的暴露量. 表 7 饮用水中ClO4−的主要物理化学去除技术与原理
Table 7. Main physicochemical removal technologies and mechanism of perchlorate in drinking water
去除技术Removal technologies 材料/工艺Materials/Processes 实现途径Pathways 机理Mechanism 参考文献References 吸附 磁性纳米复合材料(SPIONS@nHA) ClO4−与吸附剂表面(FeOH2+-ClO4−,≡Ca-OH2+-ClO4−)的静电引力;PO43−与ClO4−交换 离子交换静电相互作用 [61] 季铵化改性磁性Mg/Al-层状双氢氧化合物(N8881Cl-LDH@Fe3O4) ClO4−与[N+(CH8CH17)3Cl−]中的Cl−发生离子交换 离子交换 [62] AIE效应超分子聚合物凝胶(PT-GEu) Eu3+与PT-G中的酰胺键配位并发生电子转移,随后ClO4−与Eu3+竞争配位 竞争配位 [63] 环氧氯丙烷交联壳聚糖水凝胶(ECH-CSBs) ECH-CSB上的质子化-NH3+位点在酸性条件下通过静电相互作用吸附ClO4− 静电相互作用 [64] 甜菜碱功能化介孔生物炭电极(BK-Z15%N) 电场引发的瞬时表面吸附在吸附过程中起主导作用,掺杂季胺氮基团引入额外的赝电容 电吸附 [65] 膜过滤 聚偏氟乙烯-金属骨架超滤膜(PVA/Cu-iMOFs/PVDF) Cu-iMOFs的磺酸(R-SO3)配体与ClO4−的可逆离子交换 离子交换 [66] 电渗析反渗透复合工艺(EDR+RO) 在EDR试验中,ClO4−电解产生HCl和Cl−,采用NZVI和纳米Fe0/Al0还原高浓度ClO4− 电解Fe还原 [67] 聚烯丙基胺盐酸盐(PAH)和聚丙烯酸(PAA)改性纳滤(NF)膜 NF膜的表面电荷随双层数变化不显著,改性NF膜的离子排斥机制中尺寸排除占主导地位 尺寸排除机制 [68] 离子交换 磁性离子交换树脂(MIEX)、Purolite A530E和Purolite A532E 3种树脂 吸附过程可分为4个连续的步骤:本体溶液迁移、边界层迁移、颗粒内迁移和本征吸附 化学吸附 [69] 玉米秸秆改性磁性生物聚合物树脂(CS-MAB) 物理吸附;ClO4−与CS-MAB的含Cl基团发生离子交换反应 物理吸附离子交换 [70] 强碱性阴离子交换树脂(SBA) 吸附解吸速率限制阶段可能是化学吸附 化学吸附 [71] -
[1] CHANG W H, CHEN P H, HERIANTO S, et al. Aggregating exposures and toxicity equivalence approach into an integrated probabilistic dietary risk assessment for perchlorate, nitrate, and thiocyanate: Results from the National food monitoring study and National Food Consumption Database[J]. Environmental Research, 2022, 211: 112989. doi: 10.1016/j.envres.2022.112989 [2] TRUMPOLT C W, CRAIN M, CULLISON G D, et al. Perchlorate: Sources, uses, and occurrences in the environment[J]. Remediation Journal, 2005, 16(1): 65-89. doi: 10.1002/rem.20071 [3] COUNCIL N R. Health implications of perchlorate ingestion[M]. Washington D C : National Academies Press, 2005. [4] MAFFINI M V, TRASANDE L, NELTNER T G. Perchlorate and diet: Human exposures, risks, and mitigation strategies[J]. Current Environmental Health Reports, 2016, 3(2): 107-117. doi: 10.1007/s40572-016-0090-3 [5] TRASANDE L, SHAFFER R M, SATHYANARAYANA S, et al. Food additives and child health[J]. Pediatrics, 2018, 142(2): e20181408. doi: 10.1542/peds.2018-1408 [6] 许建红, 高乃云, 刘祖文, 等. 去除饮用水中高氯酸盐的研究新进展[J]. 水处理技术, 2011, 37(9): 28-32. XU J H, GAO N Y, LIU Z W, et al. The new development of perchlorate removal in the drinking water[J]. Technology of Water Treatment, 2011, 37(9): 28-32 (in Chinese).
[7] LI M H, XIAO M H, XIAO Q R, et al. Perchlorate and chlorate in breast milk, infant formulas, baby supplementary food and the implications for infant exposure[J]. Environment International, 2022, 158: 106939. doi: 10.1016/j.envint.2021.106939 [8] ZHANG L, FANG C R, LIU L P, et al. A case-control study of urinary levels of iodine, perchlorate and thiocyanate and risk of papillary thyroid cancer[J]. Environment International, 2018, 120: 388-393. doi: 10.1016/j.envint.2018.08.024 [9] LI Y W, LIAO R Y, GAN Z W, et al. Seasonal variation and exposure risks of perchlorate in soil, indoor dust, and outdoor dust in China[J]. Archives of Environmental Contamination and Toxicology, 2018, 75(3): 367-376. doi: 10.1007/s00244-018-0526-x [10] WANG H R, JIANG Y S, SONG J Y, et al. The risk of perchlorate and iodine on the incidence of thyroid tumors and nodular goiter: A case-control study in southeastern China[J]. Environmental Health, 2022, 21(1): 4. doi: 10.1186/s12940-021-00818-8 [11] 吴春笃, 李顺, 许小红, 等. 高氯酸盐的环境毒理学效应及其机制的研究进展[J]. 环境与健康杂志, 2013, 30(1): 85-89. WU C D, LI S, XU X H, et al. Environmental toxicological effect and mechanism of perchlorate[J]. Journal of Environment and Health, 2013, 30(1): 85-89 (in Chinese).
[12] BELLANGER M, DEMENEIX B, GRANDJEAN P, et al. Response to the letter by middlebeek and veuger[J]. The Journal of Clinical Endocrinology & Metabolism, 2015, 100(6): L54-L55. [13] CALDERÓN R, GODOY F, ESCUDEY M, et al. A review of perchlorate (ClO4−) occurrence in fruits and vegetables[J]. Environmental Monitoring and Assessment, 2017, 189(2): 82. doi: 10.1007/s10661-017-5793-x [14] U. S. Environmental Protection Agency (USEPA). Perchlorate (ClO4−) and perchlorate salts[EB/OL].2005, [2021-2-12]. [15] BRANDHUBER P, CLARK S, MORLEY K. A review of perchlorate occurrence in public drinking water systems[J]. Journal AWWA, 2009, 101(11): 63-73. doi: 10.1002/j.1551-8833.2009.tb09991.x [16] French Agency for Food, Environmental and Occupational Health& Safety (ANSES). Opinion on the presence of perchlorate in infant formula and in drinking water in France[EB/OL]. [2014-4-8]. [17] California Department of Public Health (CDPH). Comparison of MCLs and PHGs for regulated contaminants in drinking water[EB/OL].2007, [2014-7-5]. [18] U. S. Environmental Protection Agency (USEPA). EPA sets feference dose for perchlorate[EB/OL].2005, [2014-7-15]. [19] FAO J, NG J. Joint FAO/WHO expert committee on food additives seventy-second meeting: Summary and conclusions[R]. World Health Organization Technical Report Series, 2010. [20] BENFORD D, CECCATELLI S, COTTRILL B, et al. Scientific Opinion on the risks to public health related to the presence of perchlorate in food, in particular fruits and vegetables[J]. EFSA Journal, 2014, 12(10): 3869. doi: 10.2903/j.efsa.2014.3869 [21] PANSERI S, NOBILE M, ARIOLI F, et al. Occurrence of perchlorate, chlorate and polar herbicides in different baby food commodities[J]. Food Chemistry, 2020, 330: 127205. doi: 10.1016/j.foodchem.2020.127205 [22] CALDERÓN R, JARA C, ALBORNOZ F, et al. Accumulation and distribution of perchlorate in spinach and chard growing under greenhouse: Implications for food safety in baby foods commodities[J]. Food Chemistry, 2022, 370: 131101. doi: 10.1016/j.foodchem.2021.131101 [23] HAKME E, HERRMANN S S, POULSEN M E. Chlorate and perchlorate residues in food products on the Danish market[J]. Food Additives & Contaminants. Part A, 2022, 39(3): 551-559. [24] European Commission(EC). Commission regulation(EU) 2020/685 of 20 May 2020 amending Regulation (EC)No 1881/2006 as regards maximum levels of perchlorate incertain foods[EB/OL].2020, [2021-2-12]. [25] ERDEMGIL Y, GÖZET T, CAN Ö, et al. Perchlorate levels found in tap water collected from several cities in Turkey[J]. Environmental Monitoring and Assessment, 2016, 188(3): 158. doi: 10.1007/s10661-016-5161-2 [26] URBANSKY E T, COLLETTE T W. Survey of fertilizers and related materials for perchlorate (ClO4−)[M]. National Risk Management Research Laboratory, Office of Research and Development, US Environmental Protection Agency, 2001. [27] CALDERÓN R, PALMA P, ARANCIBIA-MIRANDA N, et al. Occurrence, distribution and dynamics of perchlorate in soil, water, fertilizers, vegetables and fruits and associated human exposure in Chile[J]. Environmental Geochemistry and Health, 2022, 44(2): 527-535. doi: 10.1007/s10653-020-00680-6 [28] ALOMIRAH H F, AL-ZENKI S F, ALASWAD M C, et al. Widespread occurrence of perchlorate in water, foodstuffs and human urine collected from Kuwait and its contribution to human exposure[J]. Food Additives & Contaminants. Part A, 2016, 33(6): 1016-1025. [29] GAN Z W, PI L, LI Y W, et al. Occurrence and exposure evaluation of perchlorate in indoor dust and diverse food from Chengdu, China[J]. Science of the Total Environment, 2015, 536: 288-294. doi: 10.1016/j.scitotenv.2015.07.057 [30] NADARAJA A V, PUTHIYAVEETTIL P G, BHASKARAN K. Surveillance of perchlorate in ground water, surface water and bottled water in Kerala, India[J]. Journal of Environmental Health Science and Engineering, 2015, 13(1): 56. doi: 10.1186/s40201-015-0213-z [31] KUMARATHILAKA P, OZE C, INDRARATNE S P, et al. Perchlorate as an emerging contaminant in soil, water and food[J]. Chemosphere, 2016, 150: 667-677. doi: 10.1016/j.chemosphere.2016.01.109 [32] VIGREUX-BESRET C, MAHÉ A, LEDOUX G, et al. Perchlorate: Water and infant formulae contamination in France and risk assessment in infants[J]. Food Additives & Contaminants. Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2015, 32(7): 1148-1155. [33] LUTTER R. An upper-bound assessment of the benefits of reducing perchlorate in drinking water[J]. Risk Analysis, 2014, 34(10): 1944-1956. doi: 10.1111/risa.12261 [34] LEWANDOWSKI T A, PETERSON M K, CHARNLEY G. Iodine supplementation and drinking-water perchlorate mitigation[J]. Food and Chemical Toxicology, 2015, 80: 261-270. doi: 10.1016/j.fct.2015.03.014 [35] ALOMIRAH H F, AL-ZENKI S F, ALASWAD M C, et al. Widespread occurrence of perchlorate in water, foodstuffs and human urine collected from Kuwait and its contribution to human exposure[J]. Food Additives & Contaminants. Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2016, 33(6): 1016-1025. [36] PARKER D R. Perchlorate in the environment: The emerging emphasis on natural occurrence[J]. Environmental Chemistry, 2009, 6(1): 10. doi: 10.1071/EN09001 [37] SEYFFERTH A L, PARKER D R. Determination of low levels of perchlorate in lettuce and spinach using ion chromatography-electrospray ionization mass spectrometry (IC-ESI-MS)[J]. Journal of Agricultural and Food Chemistry, 2006, 54(6): 2012-2017. doi: 10.1021/jf052897v [38] SEYFFERTH A L, PARKER D R. Effects of genotype and transpiration rate on the uptake and accumulation of perchlorate (ClO4−) in lettuce[J]. Environmental Science & Technology, 2007, 41(9): 3361-3367. [39] SEYFFERTH A L, PARKER D R. Uptake and fate of perchlorate in higher plants[J]. Advances in Agronomy, 2008, 99: 101-123. [40] SANCHEZ C A, CRUMP K S, KRIEGER R I, et al. Perchlorate and nitrate in leafy vegetables of North America[J]. Environmental Science & Technology, 2005, 39(24): 9391-9397. [41] SANCHEZ C A, KRIEGER R I, KHANDAKER N, et al. Accumulation and perchlorate exposure potential of lettuce produced in the Lower Colorado River region[J]. Journal of Agricultural and Food Chemistry, 2005, 53(13): 5479-5486. doi: 10.1021/jf050380d [42] SANCHEZ C A, KRIEGER R I, KHANDAKER N R, et al. Potential perchlorate exposure from Citrus sp. irrigated with contaminated water[J]. Analytica Chimica Acta, 2006, 567(1): 33-38. doi: 10.1016/j.aca.2006.02.013 [43] LIAO Z Y, CAO D L, GAO Z B, et al. Occurrence of perchlorate in processed foods manufactured in China[J]. Food Control, 2020, 107: 106813. doi: 10.1016/j.foodcont.2019.106813 [44] WANG Z W, FORSYTH D, LAU B P Y, et al. Estimated dietary exposure of Canadians to perchlorate through the consumption of fruits and vegetables available in Ottawa markets[J]. Journal of Agricultural and Food Chemistry, 2009, 57(19): 9250-9255. doi: 10.1021/jf901910x [45] WANG Y J, DONG J J, CHEN M Y, et al. Dietary exposure and risk assessment of perchlorate in diverse food from Wuhan, China[J]. Food Chemistry, 2021, 358: 129881. doi: 10.1016/j.foodchem.2021.129881 [46] VEJDOVSZKY K, GROSSGUT R, UNTERLUGGAUER H, et al. Risk assessment of dietary exposure to perchlorate for the Austrian population[J]. Food Additives & Contaminants. Part A, 2018, 35(4): 623-631. [47] CHANG W H, CHEN H L, LEE C C. Dietary exposure assessment to perchlorate in the Taiwanese population: A risk assessment based on the probabilistic approach[J]. Environmental Pollution, 2020, 267: 115486. doi: 10.1016/j.envpol.2020.115486 [48] TAN K, ANDERSON T A, JACKSON W A. Uptake and exudation behavior of perchlorate in smartweed[J]. International Journal of Phytoremediation, 2006, 8(1): 13-24. doi: 10.1080/15226510500506922 [49] LIANG Y B, ZHOU L, ZHANG X Z, et al. Uptake, accumulation, translocation, and subcellular distribution of perchlorate in tea (Camellia sinensis L. ) plants[J]. Journal of Agricultural and Food Chemistry, 2021, 69(16): 4655-4662. doi: 10.1021/acs.jafc.1c01270 [50] LEE J W, OH S H, OH J E. Monitoring of perchlorate in diverse foods and its estimated dietary exposure for Korea populations[J]. Journal of Hazardous Materials, 2012, 243: 52-58. doi: 10.1016/j.jhazmat.2012.09.037 [51] GURUGE K S, WU Q, KANNAN K. Occurrence and exposure assessment of perchlorate, iodide and nitrate ions from dairy milk and water in Japan and Sri Lanka[J]. Journal of Environmental Monitoring, 2011, 13(8): 2312-2320. doi: 10.1039/c1em10327j [52] SUNGUR Ş, ATAN M M. Determination of nitrate, nitrite and perchlorate anions in meat, milk and their products consumed in Hatay region in Turkey[J]. Food Additives & Contaminants. Part B, 2013, 6(1): 6-10. [53] CHEN Y N, ZHU Z, ZHAO Y, et al. Perchlorate in shellfish from South China Sea and implications for human exposure[J]. Marine Pollution Bulletin, 2021, 170: 112672. doi: 10.1016/j.marpolbul.2021.112672 [54] WAN Y J, WU Q, ABUALNAJA K O, et al. Occurrence of perchlorate in indoor dust from the United States and eleven other countries: Implications for human exposure[J]. Environment International, 2015, 75: 166-171. doi: 10.1016/j.envint.2014.11.005 [55] GAN Z W, SUN H W, WANG R N, et al. Occurrence and exposure evaluation of perchlorate in outdoor dust and soil in mainland China[J]. Science of the Total Environment, 2014, 470/471: 99-106. doi: 10.1016/j.scitotenv.2013.09.067 [56] ZHANG T, CHEN X J, WANG D, et al. Perchlorate in indoor dust and human urine in China: Contribution of indoor dust to total daily intake[J]. Environmental Science & Technology, 2015, 49(4): 2443-2450. [57] VELLA A J, CHIRCOP C, MICALLEF T, et al. Perchlorate in dust fall and indoor dust in Malta: An effect of fireworks[J]. Science of the Total Environment, 2015, 521/522: 46-51. doi: 10.1016/j.scitotenv.2015.03.071 [58] SHI Y L, ZHANG N, GAO J M, et al. Effect of fireworks display on perchlorate in air aerosols during the Spring Festival[J]. Atmospheric Environment, 2011, 45(6): 1323-1327. doi: 10.1016/j.atmosenv.2010.11.056 [59] 闻自强, 郑雯静, 沈昊宇, 等. 高氯酸盐的危害、水污染现状与去除技术研究进展[J]. 环境化学, 2019, 38(1): 209-216. doi: 10.7524/j.issn.0254-6108.2018022702 WEN Z Q, ZHENG W J, SHEN H Y, et al. Research progress on the hazards, water pollution status and removal technique of perchlorate[J]. Environmental Chemistry, 2019, 38(1): 209-216 (in Chinese). doi: 10.7524/j.issn.0254-6108.2018022702
[60] MA H Z, BONNIE N A, YU M A, et al. Biological treatment of ammonium perchlorate-contaminated wastewater: A review[J]. Journal of Water Reuse and Desalination, 2016, 6(1): 82-107. doi: 10.2166/wrd.2015.016 [61] KRISHNAN G R, PRABHAKARAN K, GEORGE B K. Biogenic magnetic nano hydroxyapatite: Sustainable adsorbent for the removal of perchlorate from water at near-neutral pH[J]. Journal of Environmental Chemical Engineering, 2021, 9(6): 106316. doi: 10.1016/j.jece.2021.106316 [62] MENG Z L, FAN J X, CUI X Y, et al. Removal of perchlorate from aqueous solution using quaternary ammonium modified magnetic Mg/Al-layered double hydroxide[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2022, 647: 129111. doi: 10.1016/j.colsurfa.2022.129111 [63] ZHANG Q, ZHANG Y M, YAO H, et al. Supramolecular AIE polymer-based rare earth metallogels for the selective detection and high efficiency removal of cyanide and perchlorate[J]. Polymer Chemistry, 2021, 12(13): 2001-2008. doi: 10.1039/D0PY01630F [64] YU X L, ZHANG J, ZHENG Y. Perchlorate adsorption onto epichlorohydrin crosslinked chitosan hydrogel beads[J]. Science of the Total Environment, 2021, 761: 143236. doi: 10.1016/j.scitotenv.2020.143236 [65] WANG B, ZHAI Y B, HU T J, et al. Green quaternary ammonium nitrogen functionalized mesoporous biochar for sustainable electro-adsorption of perchlorate[J]. Chemical Engineering Journal, 2021, 419: 129585. doi: 10.1016/j.cej.2021.129585 [66] LI T, REN Y, ZHAI S, et al. Integrating cationic metal-organic frameworks with ultrafiltration membrane for selective removal of perchlorate from Water[J]. Journal of Hazardous Materials, 2020, 381: 120961. doi: 10.1016/j.jhazmat.2019.120961 [67] YANG B M, LI J M, YOU Z Y, et al. Using integrated electrodialysis and RO hybrid system to remediate and reclaim perchlorate-contaminated groundwater[J]. Desalination, 2020, 480: 114377. doi: 10.1016/j.desal.2020.114377 [68] SANYAL O, SOMMERFELD A N, LEE I. Design of ultrathin nanostructured polyelectrolyte-based membranes with high perchlorate rejection and high permeability[J]. Separation and Purification Technology, 2015, 145: 113-119. doi: 10.1016/j.seppur.2015.03.011 [69] ZHU Y P, GAO N Y, WANG Q F, et al. Adsorption of perchlorate from aqueous solutions by anion exchange resins: Effects of resin properties and solution chemistry[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2015, 468: 114-121. [70] SONG W, GAO B Y, GUO Y, et al. Effective adsorption/desorption of perchlorate from water using corn stalk based modified magnetic biopolymer ion exchange resin[J]. Microporous and Mesoporous Materials, 2017, 252: 59-68. doi: 10.1016/j.micromeso.2017.06.019 [71] FACCINI J, EBRAHIMI S, ROBERTS D J. Regeneration of a perchlorate-exhausted highly selective ion exchange resin: Kinetics study of adsorption and desorption processes[J]. Separation and Purification Technology, 2016, 158: 266-274. doi: 10.1016/j.seppur.2015.12.019 [72] REKHA KRISHNAN G, PRABHAKARAN K, GEORGE B K. N-doped activated carbon with hierarchical pores for the efficient removal of perchlorate from water[J]. Microporous and Mesoporous Materials, 2021, 315: 110892. doi: 10.1016/j.micromeso.2021.110892 [73] YOON J, AMY G, CHUNG J, et al. Removal of toxic ions (chromate, arsenate, and perchlorate) using reverse osmosis, nanofiltration, and ultrafiltration membranes[J]. Chemosphere, 2009, 77(2): 228-235. doi: 10.1016/j.chemosphere.2009.07.028 [74] RUSSEL J G, THULASIRAMAN V, NAIR R R, et al. A novel bio-physical approach for perchlorate contaminated well water treatment[J]. Environmental Advances, 2021, 4: 100058. doi: 10.1016/j.envadv.2021.100058 [75] DARRACQ G, BARON J, JOYEUX M. Kinetic and isotherm studies on perchlorate sorption by ion-exchange resins in drinking water treatment[J]. Journal of Water Process Engineering, 2014, 3: 123-131. doi: 10.1016/j.jwpe.2014.06.002 -





 下载:
下载: