-
空气污染物中的挥发性有机化合物 (volatile organic chemicals,VOCs) 是形成对流层臭氧、PM2.5和光化学烟雾等二次污染物的主要前驱物。针对室内净化及工业生产中面临的诸多问题,建立并发展了“存储-氧化”循环净化VOCs新方法[1]。“存储-氧化”循环净化法为VOCs的脱除提供了一种新颖、有效的途径,即在室温下将VOCs存储,然后进行原位催化氧化再生[1-3]。适用于“存储-原位氧化”循环再生净化的催化剂应具有双功能性,一是“存储”VOCs分子,二是将富集的VOCs完全氧化为CO2和H2O。即在再生过程中无VOCs脱附逃逸,保证催化氧化速率要快于解吸速率[1, 4];同时催化剂需要具有良好的稳定性,实现重复循环利用[3, 5-7]。因此,增强目标VOCs分子与催化剂之间的键合,同时加快氧化再生速率成为该领域研究的关键。
甲苯 (C7H8) 是一种有机化合物,由一个苯环和一个甲基构成,动力学直径约为0.59 nm。β分子筛的孔径大小为0.75 nm×0.57 nm和0.65 nm×0.56 nm,与甲苯的分子动力学直径 (0.59 nm) 相近,有利于对甲苯的择形吸附[8-10]。基于此,本研究以β-25分子筛为载体,制备一系列不同Ag含量的Agx/β-25分子筛催化剂,用于“存储-原位氧化”循环净化甲苯,并采用UV-vis、H2-TPR和TEM表征Ag在β-25分子筛中的落位和存在状态,结合C7H8-TPD研究甲苯在不同Ag物种上的吸附强度,以探索其催化反应的控制工艺条件,为实现“存储-原位氧化”循环再生提供参考。
-
硝酸银 (AgNO3,分析纯) 采购于国药集团化学试剂有限公司。β分子筛采购于山东和发环保科技有限公司。实验中所用气体N2 (99.999%) 和O2 (99.999%) 均购于大连科纳科学技术开发有限责任公司,C7H8标准气(0.044 6 mmol·L−1 C7H8/N2)购于大连光明特种气体有限公司。
-
使用等体积浸渍的方法负载银,将质量 (a) 为15.7 g、78.5 g、157 g的硝酸银分别溶解于0.78 mL水中。称取1 g的β-25(m (SiO2) /m (Al2O3) =25)分子筛,用滴管将配置好的硝酸银溶液逐滴加入分子筛中,边滴加边搅拌,使之呈牙膏状;静置12 h后在真空干燥箱中以65 ℃干燥2 h;最后于马弗炉中以5 ℃·min−1的速率升温至450 ℃,并保持4 h,以期制备Agx/β-25(x=1/5/10)催化剂。
-
催化氧化脱除甲苯或“存储-原位氧化”循环脱除甲苯均在常压微型固定床石英微反应器中进行。将65 mg催化剂 (20~40目) 置于直径6 mm的固定床石英微反应器中。在活性测试前,催化剂在400 ℃的N2中预处理1 h。反应气组成:浓度为8.92×10−4 mmol·L−1的C7H8;体积分数21%的O2;相对湿度(relative humidity,RH) 为50% (25 ℃下)的N2,总流量为100 mL·min−1,空速(space velocity,SV)为36 000 h−1。在室温下,将气态H2O通过N2鼓泡法携带入反应气中,以RH表示其体积分数。甲苯通过入口处后经VOCs催化燃烧炉 (CuMn/γ-Al2O3,450 ℃) 时被完全氧化为CO2和H2O,并由气体分析仪 (S710) 监测CO2浓度而计算得出。甲苯存储容量(NC7H8,mmol·gcat−1)、C7H8氧化为CO2的转化率(X C7H8→CO2)和碳平衡(Bc)分别定义如式 (1) 和 (2) 所示。
式中:CC7H8in为原料气中C7H8的浓度,mmol·L−1;F1为总流量,mL·min−1;t1为穿透时间,min;Wcat是催化剂的质量,g。穿透时间定义为出口C7H8浓度达到入口甲苯浓度10%时的时间。
-
X射线衍射:采用日本Rigaku,型号为D/Max 2400的X射线衍射仪对催化剂晶型结构进行表征,扫描范围 (2 theta) 10 o~50 o,扫描速度10 o·min−1。紫外-可见光谱:使用UV-550光谱仪检测在190~800 nm的紫外-可见光谱。程序升温脱附:程序升温脱附实验在内径为4 mm的石英管反应器中装入65 mg催化剂,经氮气在400 ℃下预处理1 h,待冷却到室温后,于特定气氛中进行定量吸附。在吸附完成后切换回N2气氛,经短时间吹扫后,从室温以10 ℃·min−1的升温速率至500 ℃,使用质谱分析仪对脱附物种进行在线监测。
-
对负载了不同含量Ag的Agx/β-25催化剂的晶相结构进行XRD表征,结果如图1所示。当Ag的负载量 (质量分数) 由1%增至5%,仅观察到归属于β分子筛自身的衍射峰,未观察到归属于银物种的特征衍射峰。这可能是由于Ag在催化剂表面高度分散,或者Ag的负载量较低未被检测到所致[11]。当Ag负载量增至10%时,出现了属于金属Ag的特征衍射峰 (2θ=38.115 °) ,但峰强很弱。该结果说明催化剂表面的Ag发生聚集而出现金属银。
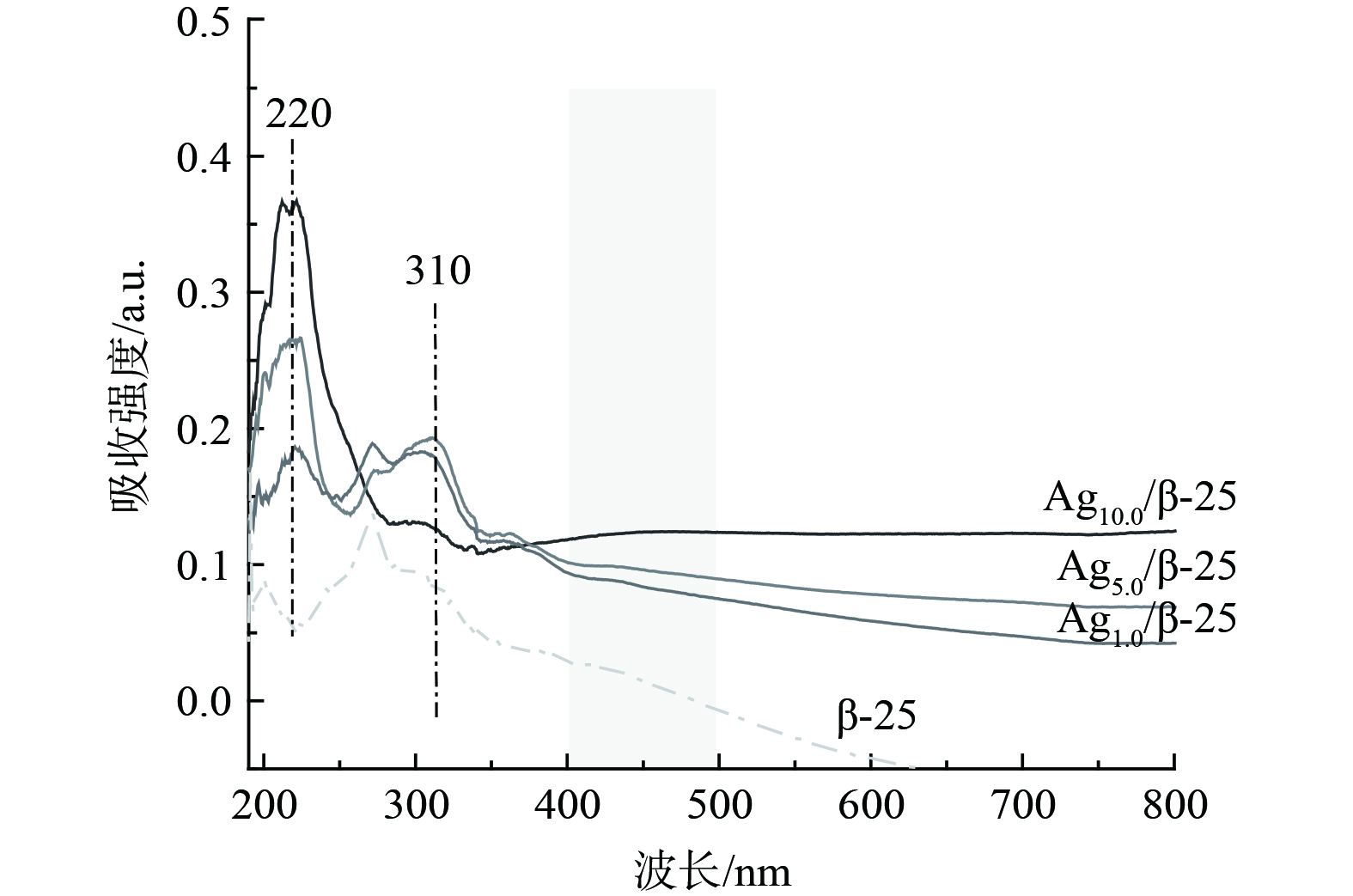
为探讨银在分子筛上的存在状态,对不同质量分数Ag的Agx/β-25催化剂进行了UV-vis表征。图2表明,对于Ag1.0/β-25催化剂,其谱图主要出现2个吸收峰,分别位于220 nm、310 nm处。220 nm处的吸收峰可归属为分子筛离子交换位上的Ag+,310 nm处的吸收峰可归属为带有一定电荷的Agnδ+团簇[12-13]。该结果表明在Ag1.0/β-25催化剂中,Ag主要以Ag+状态存在,同时含有少量Agnδ+团簇。随着银负载量由1%增至5%,归属于Ag+的吸收峰强度显著增强,这说明有更多的银被交换到分子筛的离子交换位上。继续增加Ag负载量至10%,310 nm归属于Agnδ+团簇的吸附峰峰强减弱[12-13],并且在400~500 nm处出现了归属为金属银颗粒的吸收峰[14]。该结果说明Ag开始聚集长大,这与XRD结果相一致。
XRD和UV-vis表征分析结果表明,Agx/β-25催化剂表面Ag物种的主要存在状态为Ag+和Agnδ+团簇。当Ag的负载量低于5%时,催化剂表面的银物种分散较好,均以Ag+和Agnδ+的形式存在;当Ag的负载量为10%时,催化剂表面的Agnδ+减少,最后伴随银纳米粒子的出现。
-
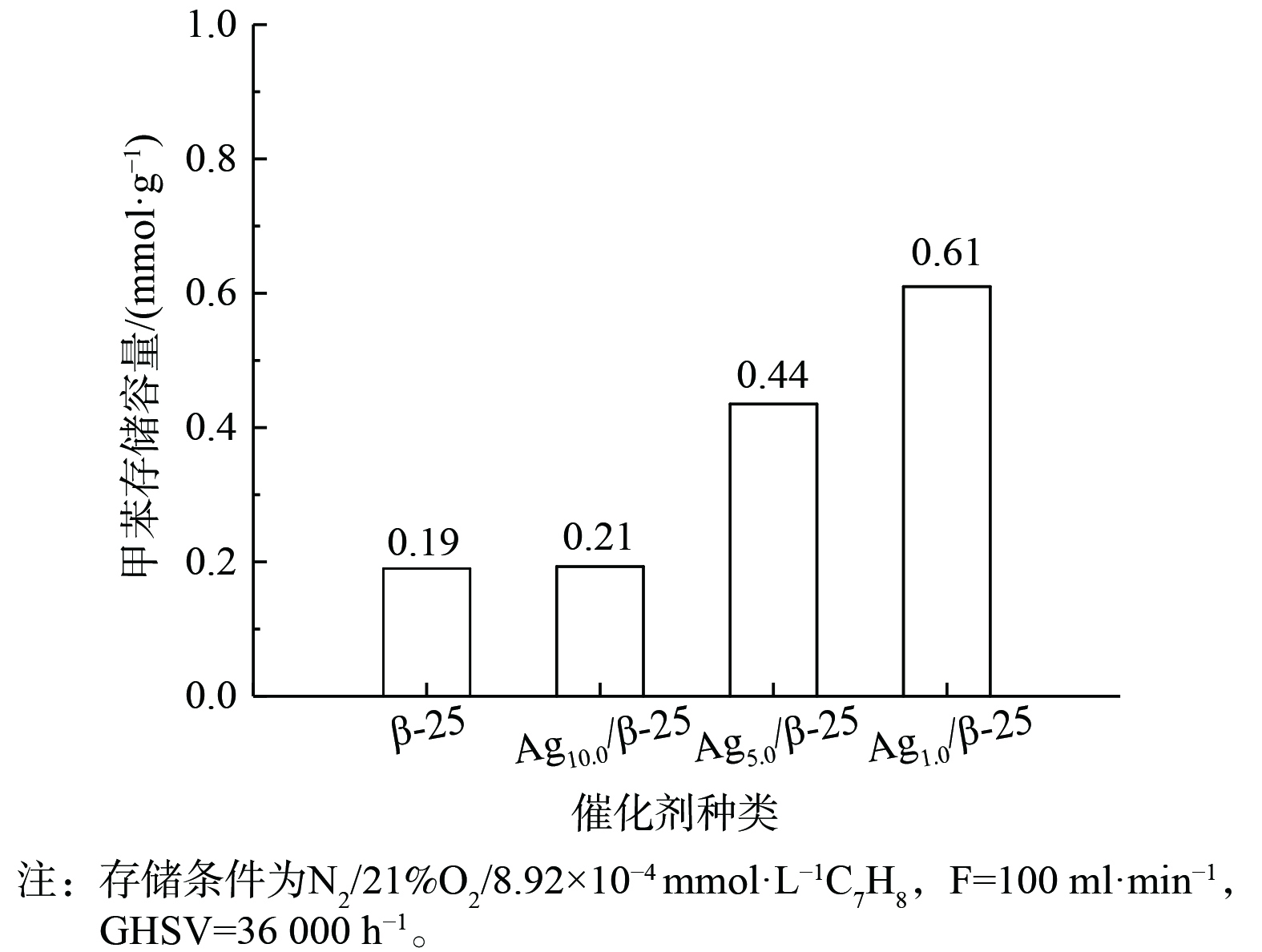
图3表现了不同质量分数Ag的Agx/β-25分子筛及β-25分子筛本身对甲苯的存储能力。β-25分子筛本身对甲苯的存储量为0.19 mmol·g−1。当负载1%的Ag后,催化剂对甲苯的存储提升较小;当负载量增至5%时,甲苯的存储量是Ag1.0/β-25的2倍,继续增加银负载量至10%,甲苯的存储量可达0.61 mmol·g−1。因此,当催化剂中Ag质量分数增大,甲苯存储量有显著提升,推测Ag引入后会与甲苯产生键合作用,从而提供新的甲苯存储位点,使存储量较分子筛本身有所增加。
-
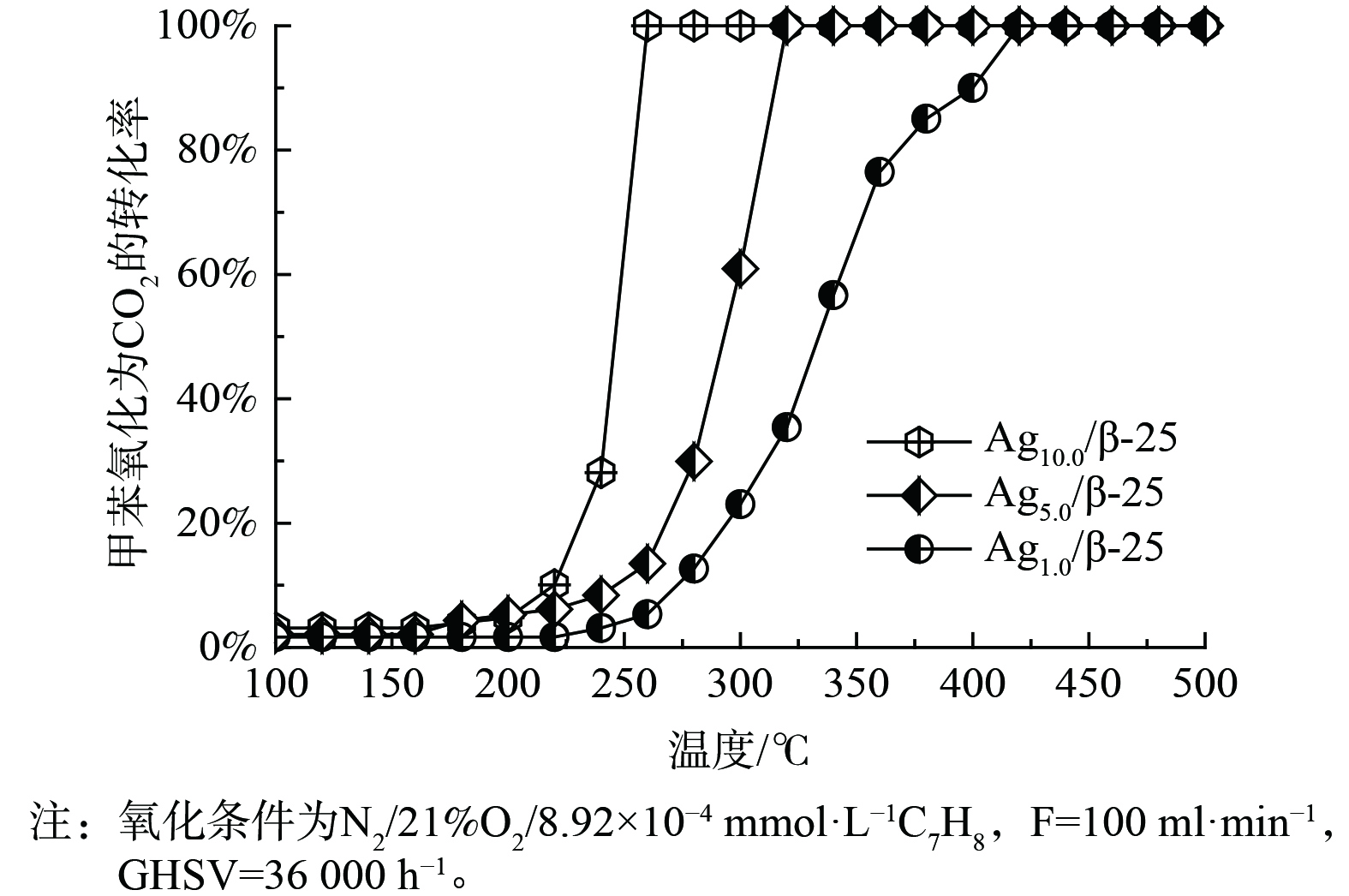
催化剂的氧化能力是“存储-原位氧化”循环过程中的另一重要因素,因此,对Ag改性的β-25催化剂的甲苯氧化能力进行考察,结果如图4所示。Ag1.0/β-25催化剂的甲苯氧化能力最差,甲苯完全氧化为CO2的温度是420 ℃,其次是Ag5.0/β-25催化剂 (320 ℃) ,而Ag10.0/β-25催化剂的甲苯氧化能力最优。此时,甲苯完全氧化为CO2的温度低至260 ℃,这说明银的引入使催化剂的氧化能力显著提升。
-
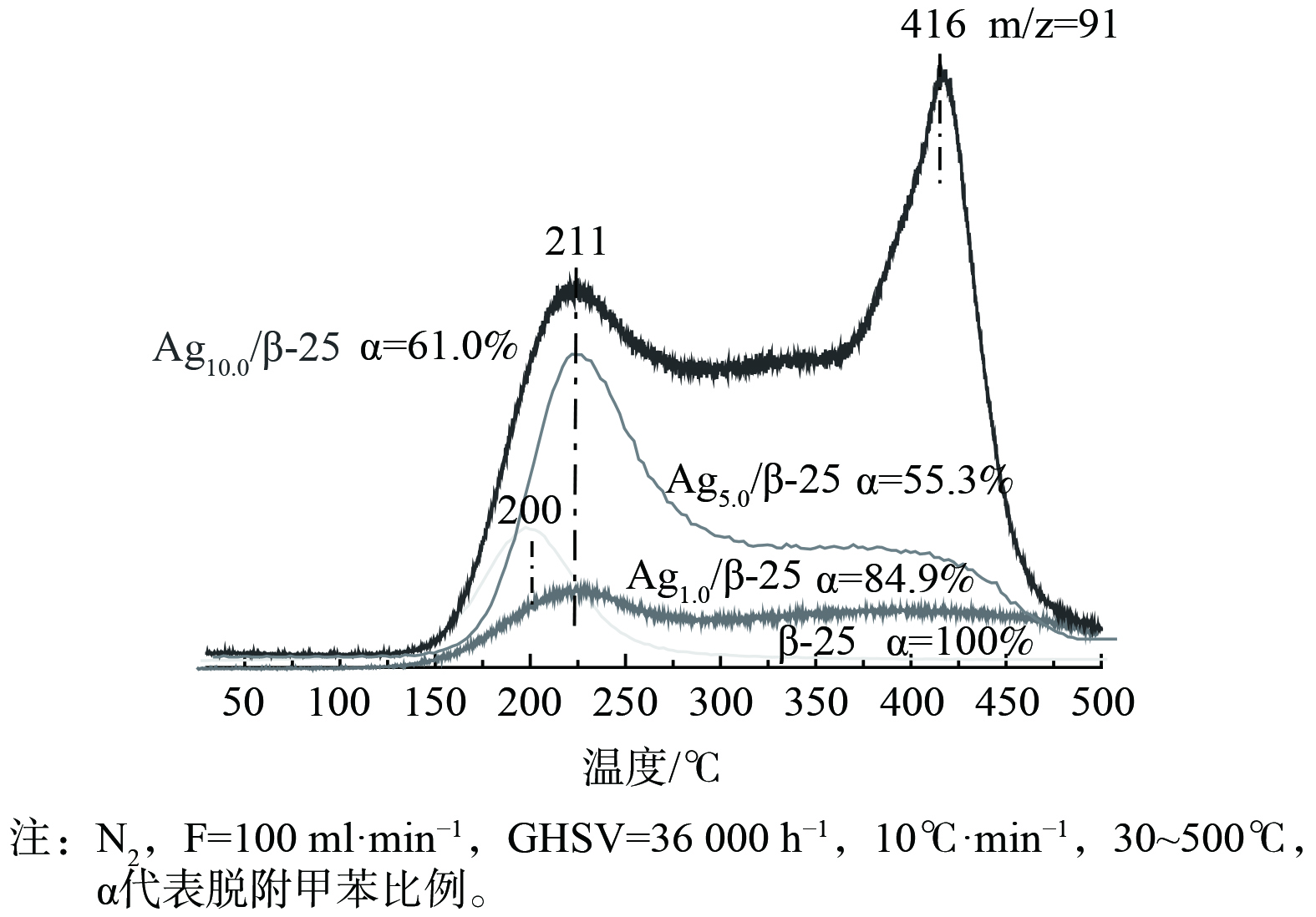
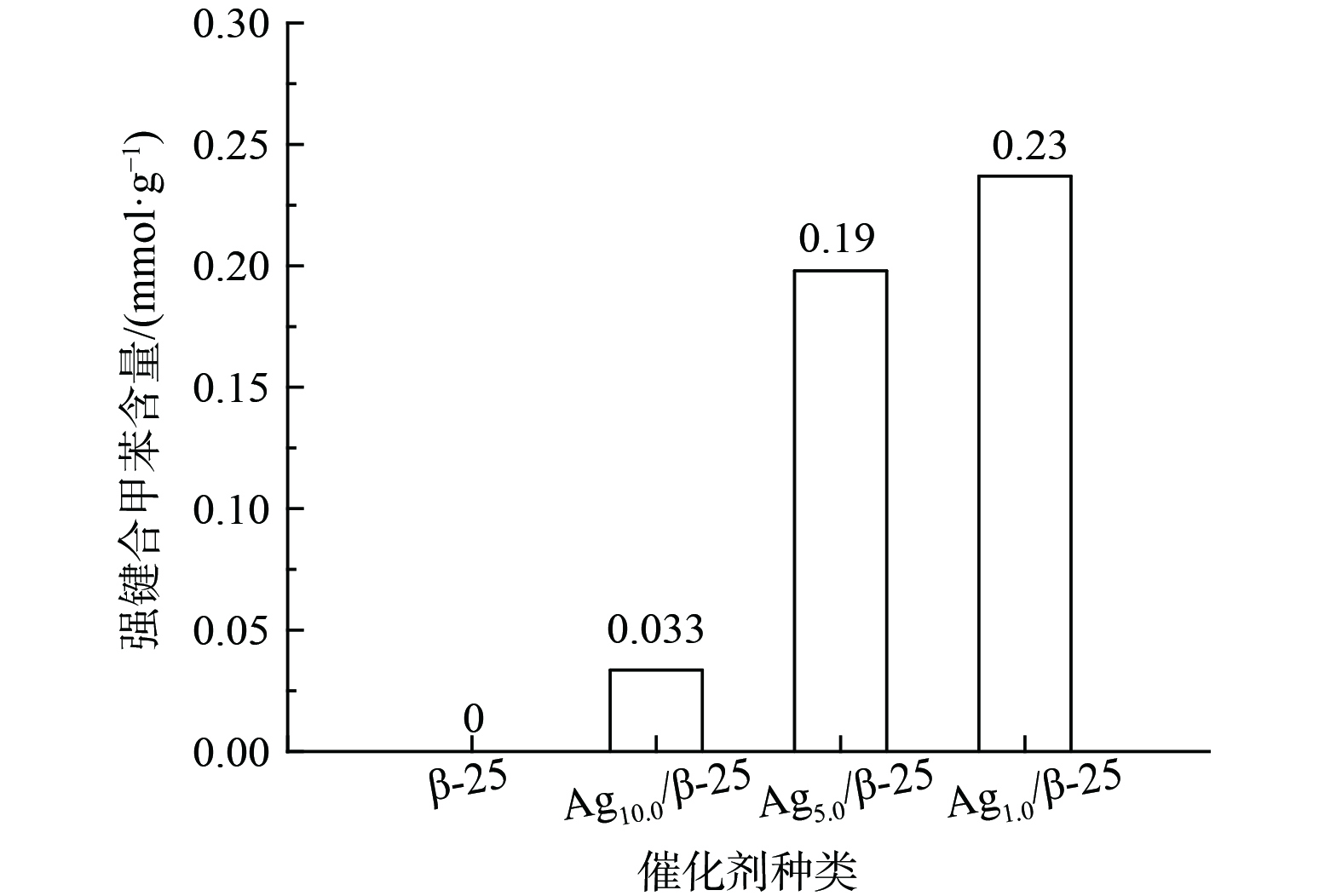
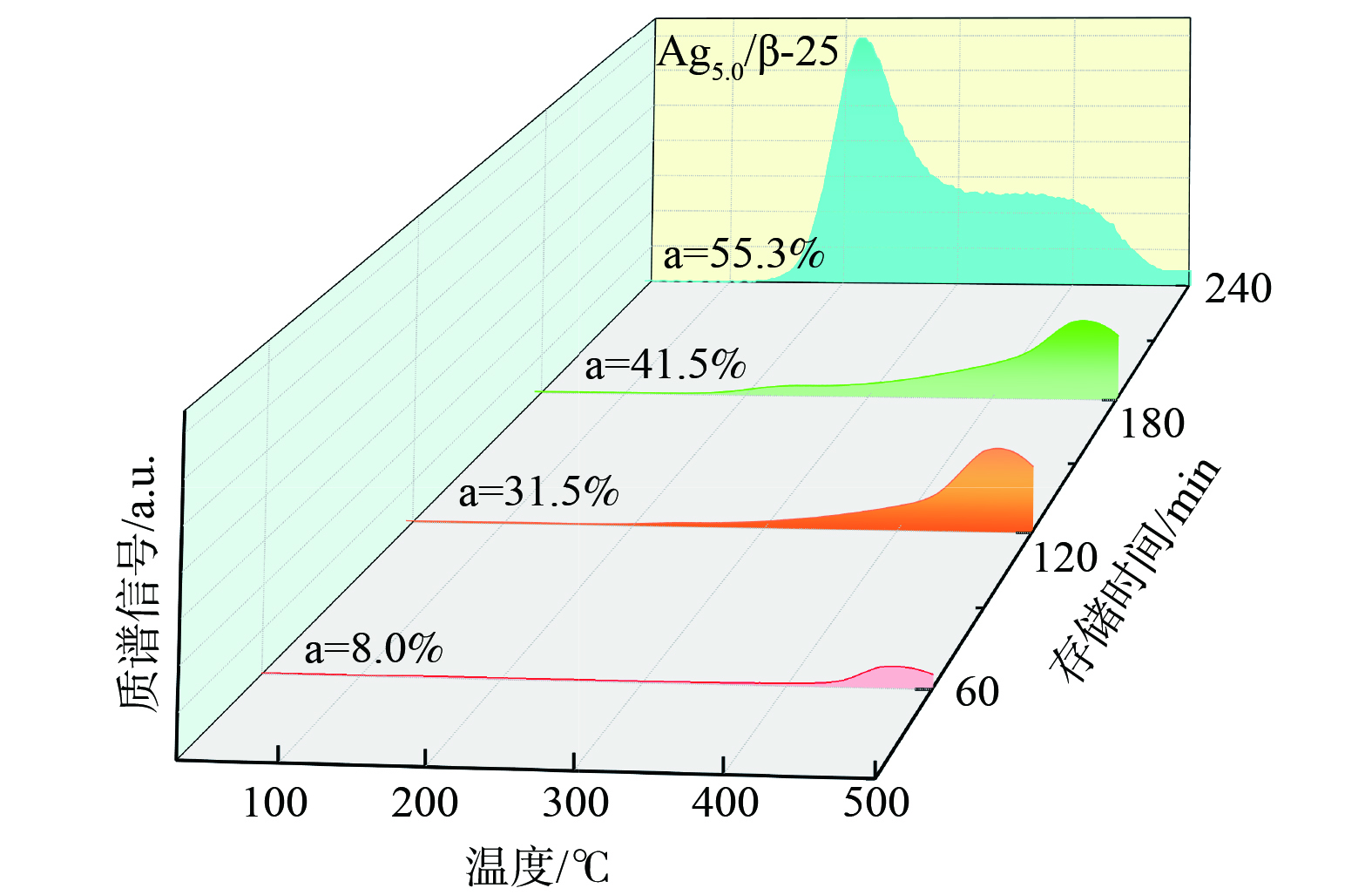
实现“存储-原位氧化”循环脱除甲苯的关键在于保证再生过程中VOCs不会发生脱附逃逸而产生二次污染物。这就要求VOCs的催化氧化速率要大于脱附速率,基于此研究了程序升温过程中存储于催化剂的甲苯的脱附规律 (图5) 。甲苯的脱附曲线分为3个温区:低温区 (< 250 ℃) ,中温区 (250~500 ℃) 和高温区 (> 500 ℃) 。β-25催化剂上存储的甲苯脱附峰温为200 ℃,这属于吸附在分子筛Bronsted位点上的脱附[15]。在负载Ag后,不仅在低温区 (211 ℃) 存在脱附峰,在250~500 ℃之间还存在一个宽泛的脱附峰。随着Ag负载量的增加,210 ℃的甲苯脱附峰逐渐升高,这属于Ag纳米粒子上吸附甲苯的脱附。Ag纳米粒子与甲苯间依靠范德华力形成物理键合,故在低温下会发生脱附[16-17]。当Ag负载量 (质量分数) 由1%提升至5%,250~500 ℃的宽泛脱附峰峰强逐渐增强。根据UV-vis结果分析发现,当温度为250~500 ℃时,重叠解吸主要为吸附在Agnδ+团簇上而产生的甲苯脱附,因为大多数Agnδ+团簇的成核数是不固定的 (一般为2~8组成),这与温度为250~500 ℃时的宽泛脱附峰相一致。由于Ag独特的 (n-1) d10ns0电子构型,Agnδ+容易接受电子,从而与甲苯间形成反馈π键这种较强的键合,导致了甲苯的脱附温度升高(250~500 ℃)[16, 18-20]。当Ag负载量 (质量分数) 达到10%时,这个宽泛的脱附峰开始变得尖锐并向低温区移动,这说明过量引入的Ag使小粒径Agnδ+团簇团聚长大,故吸附强度逐渐减弱。在脱附过程中,还观察到一个有意义的现象,即当温度升至500 ℃,在Ag改性的β-25分子筛催化剂上,仍存在一定量甲苯未脱附。将未脱附的甲苯浓度与Ag负载量进行关联分析 (图6) 发现,在500 ℃时仍未脱附的甲苯浓度随Ag负载量增加而逐渐增大,与图2 中属于Ag+吸收峰峰强逐渐增大的规律相吻合。由此推断,当温度大于500 ℃时,仍未脱附的甲苯是与离子交换位上的Ag+强键合那部分甲苯。Ag+能吸引甲基电子发生部分氧化反应,从而形成强化学键合,在500 ℃时仍未脱附[11, 21-24]。通过以上甲苯升温脱附研究,得出Ag改性β分子筛催化剂表面存在3种不同强度甲苯吸附位点。根据甲苯的脱附温度高低,可将其分为强吸附位点、中强吸附位点和弱吸附位点。强吸附位点上的甲苯在500 ℃时仍未脱附;中强吸附位点上的甲苯在250~500 ℃发生脱附;弱吸附位点上的甲苯在低于250 ℃时即发生脱附。
将甲苯吸附位点与Ag存在状态进行关联分析后发现,强吸附位点对应于离子交换位上的Ag+,中强吸附位点对应于Agnδ+团簇,弱吸附位点对应于金属银颗粒和分子筛的B酸位。上述结果表明,引入Ag可有效增强甲苯与催化剂之间的键合,最优Ag负载量为5%。此时,Ag在催化剂表面高度分散,并主要以键合甲苯能力强的Ag+和小尺寸Agnδ+的形式存在。
-
对比各催化剂上的甲苯完全氧化温度与脱附温度后发现,即使在Ag10.0/β-25催化剂上,甲苯完全氧化的温度 (260 ℃) 仍高于甲苯的脱附温度 (吸附在Ag纳米粒子上的甲苯脱附峰温为211 ℃)。该结果表明,存储的甲苯在被完全氧化前即发生了脱附逃逸。因此,应通过控制甲苯的存储位点,使其有选择性地优先存储在强存储位上,从而实现甲苯脱附前的完全氧化再生。通过控制存储时间来调控甲苯在催化剂上的吸附位点的实验结果如图7所示。对于Ag5.0/β-25来说,当存储时间为60 min时,仅出现强吸附在Agnδ+处的甲苯脱附峰 (475 ℃) ,这说明甲苯是优先选择吸附在Ag+位点和Agnδ+上。随着存储时间从60 min延长至120 min、180 min,强吸附在Agnδ+的脱附峰峰强增大,且未观察到甲苯的低温脱附峰,这说明控制存储时间在180 min内时,甲苯仅选择性地吸附在Ag+和Agnδ+上,且键合能力较强。继续延长存储时间至240 min,才会逐渐出现吸附在分子筛B酸位和Ag纳米粒子上的低温脱附峰。这说明甲苯在Agx/β-25催化剂上的存储吸附顺序为Ag+→Agnδ+→Ag纳米粒子+B酸位。
-
基于图6数据,在“存储-原位氧化”循环净化甲苯实验中,将存储时间控制为180 min,此时甲苯全部存储在Ag+和Agnδ+位点上,其存储量可达0.32 mmol·gcat−1;在原位氧化再生阶段,存储的甲苯全部被氧化成为COx。图7表明,在3次循环测试中,碳平衡均大于98%,没有甲苯的提前脱附,这说明Ag5.0/β-25催化剂在“存储-原位氧化”循环再生净化甲苯过程中稳定性很好,也充分说明了通过调控存储位点实现“存储-原位氧化”循环再生净化甲苯这一思路的可行性。
-
1) 通过制备不同Ag负载量的β分子筛催化剂,研究了催化剂中Ag的状态。通过将甲苯的脱附温度与甲苯在不同存储位点上的键合强度相关联,将催化剂表面存储位点分为3个级别。强存储位点即离子交换位上为Ag+,对于甲苯有最强的键合能力,程序升温至500 ℃时仍未脱附。中强存储位点即离子交换位为Agnδ+团簇,其与甲苯之间可形成较稳定的π键合,在温度为250~500 ℃时出现脱附。弱存储位点即金属Ag纳米粒子和分子筛的酸性位,与甲苯间键合最弱 (范德华力) ,在210 ℃左右出现脱附。2) 依据甲苯在Agx/β-25分子筛上的存储强度,通过控制存储时间来调控甲苯在催化剂上的优先吸附顺序,使甲苯优先吸附在Ag+和Agnδ+强存储位点上,使脱附温度高于氧化温度,即可实现原位氧化再生。3) 通过优化Ag的最佳负载量为5%,Ag在催化剂表面高度分散,并主要以Ag+和小尺寸的Agnδ+的形式存在。此时吸附在Ag+和Agnδ+上的甲苯可达0.32 mmol·gcat−1,且存储的甲苯可全部被原位热氧化为COx。4) 在3次循环测试中,碳平衡均大于98%,再生过程中未发生甲苯的提前脱附,这说明Ag5.0/β-25催化剂在“存储-原位氧化”循环再生净化甲苯过程中有很好的稳定性及重现性,证实了这种再生思路的可行性。
基于调控存储位点实现甲苯的“存储-原位氧化”循环净化
Toluene removal through “storage - in situ oxidation” cycling via modulating the storage sites
-
摘要: “存储-原位氧化”循环净化气态污染物 (VOCs) 的方法是利用存储材料对VOCs的选择吸附,在室温先将VOCs富集并存储在催化剂上。当存储饱和后,通过升温使催化剂催化氧化活性提高,短时间内将存储的VOCs完全氧化为CO2和H2O,使得催化剂得以原位氧化再生。选择分子筛材料用于“存储-原位氧化”循环净化甲苯的关键问题是:大部分的甲苯以物理吸附的形式存储于分子筛催化剂的孔道中,脱附温度低,导致原位催化氧化过程中甲苯未被氧化前就脱附逃逸,造成二次污染。以不同银负载量的Agx/β-25催化剂作为研究对象,利用XRD和UV-vis对分子筛催化剂表面Ag物种的存在状态进行识别。将Ag物种状态与甲苯程序升温脱附结果定性关联,明确了甲苯在不同状态的Ag物种上的存储强弱。位于离子交换位上的Ag+与甲苯键合最强,其次为Agnδ+团簇,键合最弱的为金属银粒子。通过控制存储时间,可调控甲苯在Agx/β-25催化剂上的存储位点,使甲苯优先选择吸附在位于离子交换位上的Ag+或Agnδ+团簇上,当脱附温度高于氧化温度,即可实现低浓度甲苯的“存储-原位氧化”循环再生净化。通过该研究,可初步得出调控分子筛表面存储位点强弱的方法,并构建适宜的催化剂,为指导设计低浓度甲苯脱除的双功能催化材料提供参考。
-
关键词:
- 甲苯 /
- 银物种存在状态 /
- 存储位点调控 /
- “存储-原位氧化”循环
Abstract: “Storage-in situ oxidation” cycling process includes storing low concentration of volatile organic chemicals (VOCs) on the catalyst at room temperature and complete oxidation the stored species into CO2 and H2O at elevated temperature in a short time, and the catalyst can be oxidized and regenerated in situ. The key issue for application of this approach over zeolite materials is in situ regeneration of the zeolite materials without any release of the toluene or generation of secondary pollutants. Therefore, in this study, a series of Agx/β-25 catalysts were prepared and the status of surface Ag species were characterized through XRD and UV-vis. By qualitative analysis, the C7H8-temperature-programmed desorption results with the status of Ag species, the different storage sites and bond strength for C7H8 storage were clarified. Ag+ at the ion exchange site had the strongest bond to toluene, followed by Agnδ+ clusters, and the weakest bond was silver. The storage site could be modulated by controlling the storage time, so that toluene could be preferentially adsorbed on strong adsorption sites (Ag+ and Agnδ+), which could enable the in situ thermal oxidation regeneration of toluene when the desorption temperature was higher than oxidation temperature. The method of regulating the strength of storage sites on the surface of molecular sieve was preliminarily mastered, and a suitable catalyst was constructed in this study, which can provide a promising strategy to synthesis and design bifunctional catalyst for toluene removal through “storage - in situ oxidation” cycling. -
氮氧化物指的是只由氮、氧两种元素组成的化合物。常见的氮氧化物(NOx)包括一氧化氮(NO)、二氧化氮(NO2)、一氧化二氮(N2O)和五氧化二氮(N2O5)等。作为空气污染物的NOx常指NO和NO2[1]。全球每年因人类活动向大气排放的NOx约5 300万t。NOx对自然环境的破坏力非常大,它是形成酸雨、光化学烟雾的重要物质,同时也是消耗臭氧的一个重要因子[2]。火力发电厂作为NOx的一个重要排放源,每年向大气中排放大量的NOx,随着我国环保政策的日益严格,NOx排放得到了严格控制。目前,国家大力推行火电厂超低改造,依据超低排放的要求,NOx排放标准为50 mg/m3[3]。根据生态环境部2018年数据显示,全国实现超低排放的煤电机组约8.1×109 kW,占全国煤电总装机容量的80%[4]。目前,火电厂对于NOx的脱除措施主要包括2种:选择性非催化还原法(Selective Non-Catalytic Reduction,SNCR)和选择性催化还原法(Selective Catalytic Reduction,SCR),由于SNCR脱硝技术脱硝效率较低,很多时候难以满足NOx的排放要求,大多数火电厂选择了脱硝效率更高的SCR脱硝技术来进行NOx的控制。
近年来,我国大力推行清洁能源发展,清洁能源发电量所占比例逐年升高,但是由于自然条件的限制,其存在发电量不稳定,变化较大的问题。社会用电量在一段时间内也存在着很大的变化。这些变化因素都需要火电机组进行负荷的调整。机组负荷的变化会引起烟气温度、氧含量和污染物含量等的变化,进而影响SCR脱硝系统的正常工作。本文以SCR脱硝系统为研究对象,研究机组不同负荷条件下SCR的脱硝效果。
1. 方法及设备
1.1 试验方法
试验选取5台燃煤机组,将5台机组按照#1机组、#2机组、#3机组、#4机组和#5机组的方式进行分类编号。5台机组燃烧的煤种主要以东胜和乌海烟煤为主,脱硝方式为SCR,脱硝还原剂均为液氨,催化剂均为(2+1)层模式,备用层均未投运。为保证测试结果仅与负荷调整有关,试验采取控制变量的方式,将各负荷段的测试试验集中在一定时间内完成,保证机组燃烧煤种和催化剂等条件不发生明显变化,保证机组负荷稳定。同时,各负荷段试验期间不进行燃烧调整和风量调整。试验主要测定5台机组A、B侧在不同负荷条件下SCR反应器进出口NOx、进出口温度、进出口氧含量、NH3/NOx摩尔比、氨逃逸浓度、脱硝效率以及SO2/SO3转化率。
采样点布置采用烟道断面网格法,进出口NOx、进出口温度、进出口氧含量,入口SO2以及氨逃逸浓度等采用便携式的仪器设备进行测定,每组测定10个平行样,每次测定3 min;SO3按照标准《石灰石-石膏湿法烟气脱硫装置性能验收试验规范:DL/T998—2016》[5]中的方法拼装仪器进行测定,每组测定3个平行样,每次测定30 min。用Excel 2003将NOx、SO2以及SO3浓度折算到标准状态、干基、6%O2时的浓度,同时对所有数据进行平均值计算。
1.2 试验设备仪器
试验分析的设备仪器包括便携式大流量低浓度烟尘自动测试仪(3012HD)、芬兰GASMT公司的便携式红外多阻气体分析仪(GASMET DX-4000)、德国testo公司的烟气分析仪(testo 350)、德国testo公司的单点烟气温度测量仪(testo 925)、德国M&C公司的顺磁氧量分析仪(PMA10)、加拿大Unisearch公司的便携式氨逃逸浓度分析仪以及《石灰石-石膏湿法烟气脱硫装置性能验收试验规范:DL/T998—2016》中的SO3采样设备等。
2. 结果与分析
2.1 氧含量与机组负荷的关系
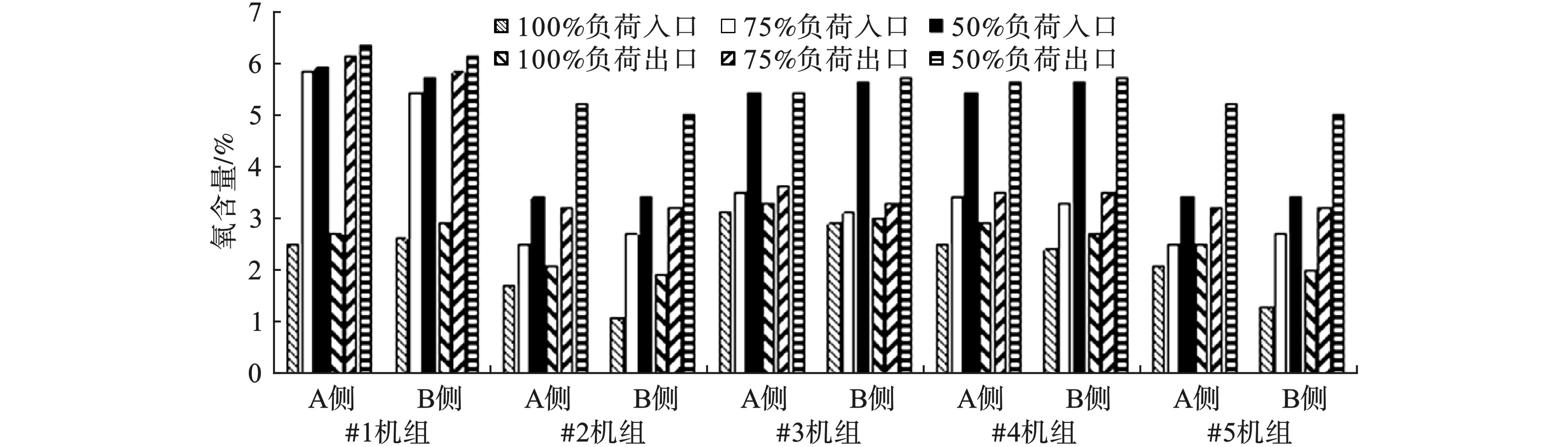
不同负荷条件下的氧含量变化见图1。5台机组SCR入口、出口氧含量均随负荷的降低而增加。
对于入口氧含量,负荷为50%时,最大值和最小值分别为5.9%和3.4%;负荷为75%时最大值和最小值分别为5.8%和2.5%;负荷为100%时最大值和最小值分别为3.1%和1.1%。50%负荷的入口氧含量平均是75%负荷的1.4倍,是100%负荷的2.1倍。
对于出口氧含量,负荷为50%时,最大值和最小值分别为6.3%和5.0%;负荷为75%时最大值和最小值分别为6.1%和3.2%;负荷为100%时最大值和最小值分别为3.3%和1.9%。50%负荷的出口氧含量平均是75%负荷的1.4倍,是100%负荷的2.1倍。
氧含量随着负荷的降低而升高。当负荷较高时,炉膛温度较高,炉膛内着火条件、煤粉与空气混合条件较好,燃烧稳定,最佳过量空气系数较低。而当锅炉低负荷运行时,锅炉燃烧所需的燃料减少,炉膛内火球较小,锅炉燃烧范围减少,锅炉炉膛温度降低,燃烧效率降低,这时需要加入更多的空气来维持燃烧中心的稳定,最佳过量空气系数较高。因此,高负荷时的最佳氧含量要低于低负荷时的最佳氧含量[6-7]。
2.2 温度与机组负荷的关系
不同负荷条件下温度的变化见图2a、2b。5台机组SCR入口,出口烟气温度均随负荷的降低而降低。
对于入口温度,负荷为50%时,最大值和最小值分别为340和278 ℃;负荷为75%时,最大值和最小值分别为356和287 ℃;负荷为100%,时最大值和最小值分别为370和313 ℃。100%负荷的入口温度平均比75%负荷高6.0%,比50%负荷平均高10.7%。
对于出口温度,负荷为50%时,最大值和最小值分别为337和275 ℃;负荷为75%时最大值和最小值分别为354和283 ℃;负荷为100%时,最大值和最小值分别为367和309 ℃。100%负荷的出口温度平均比75%负荷高6.1%,比50%负荷平均高10.9%。
烟气温度随负荷的降低而降低。当锅炉进行负荷调整时,燃料消耗量发生变化,锅炉内的温度场也会随之发生改变,炉内温度场的变化也必将会导致炉内辐射换热量的改变。但是,燃料消耗量引起的热量变化要大于炉内辐射换热量的变化,所以烟气温度变化主要由燃料消耗量来决定。当负荷降低时,燃料消耗量减少,烟气温度降低[8]。
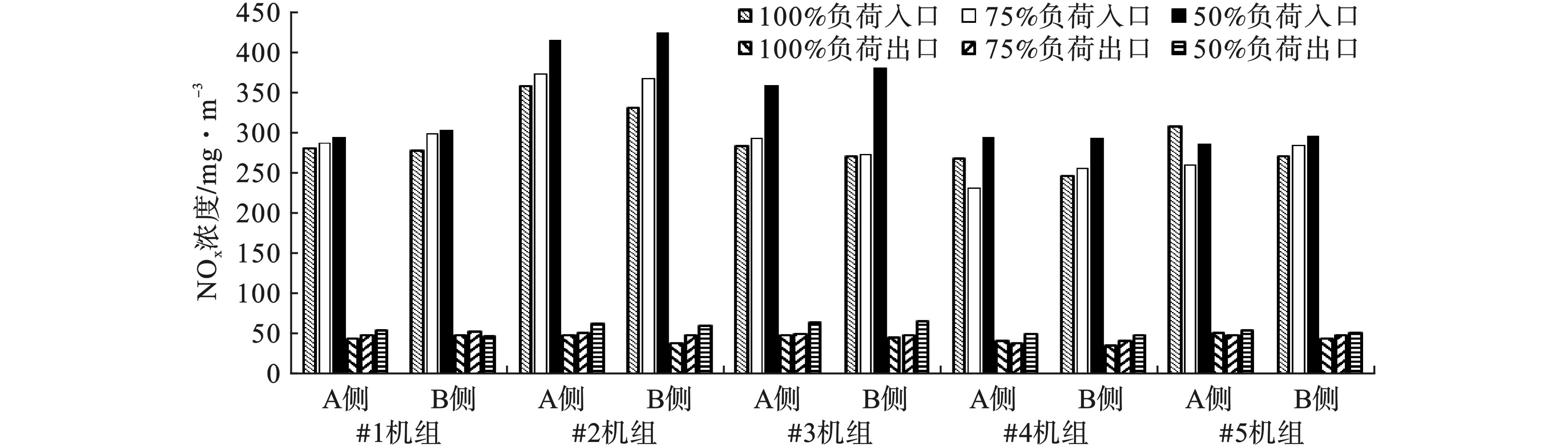
2.3 NOx质量浓度与机组负荷的关系
不同负荷条件下NOx质量浓度变化见图3。5台机组SCR入口、出口的NOx质量浓度随负荷的降低整体呈现出升高的趋势。
对于入口NOx质量浓度,负荷为50%时,入口NOx质量浓度最大值和最小值分别为423和285 mg/m3;负荷为75%时,入口NOx质量浓度最大值和最小值分别为372和231 mg/m3;负荷为100%时,入口NOx质量浓度最大值和最小值分别为358和246 mg/m3。50%负荷的入口NOx质量浓度平均比75%负荷的高14.4%,比100%负荷高15.5%。
对于出口NOx质量浓度,负荷为50%时,出口NOx质量浓度最大值和最小值分别为67和48 mg/m3;负荷为75%时,出口NOx质量浓度最大值和最小值分别为54和40 mg/m3;负荷为100%时,出口NOx质量浓度最大值和最小值分别为53和37 mg/m3。50%负荷的出口NOx质量浓度平均比75%负荷高17.1%,比100%负荷高24.2%。
负荷降低时,锅炉尾部烟道之后SCR反应器前的NOx质量浓度整体呈现了升高的趋势。根据NOx生成机理,燃料型NOx占总生成NOx的70~80%左右,热力型NOx占总生成NOx的15~25%[9]。炉膛氧含量和温度对燃料型与热力型NOx的生成都有影响,其中氧含量对燃料型NOx生成有更加显著的影响,而温度对热力型NOx生成有更明显的作用[10]。随着负荷的降低,氧含量升高,空气过剩系数增大,锅炉内燃烧区域出现氧过量的情况,会促进燃料型和热力型NOx的生成;负荷降低,温度也会降低,而温度降低主要对热力型NOx的生成有一定的抑制作用,但是热力型NOx所占比例较少,所以在负荷降低时总体表现为NOx质量浓度升高[11-13]。
2.4 NH3/NOx摩尔比、氨逃逸浓度以及脱硝效率与机组负荷的关系
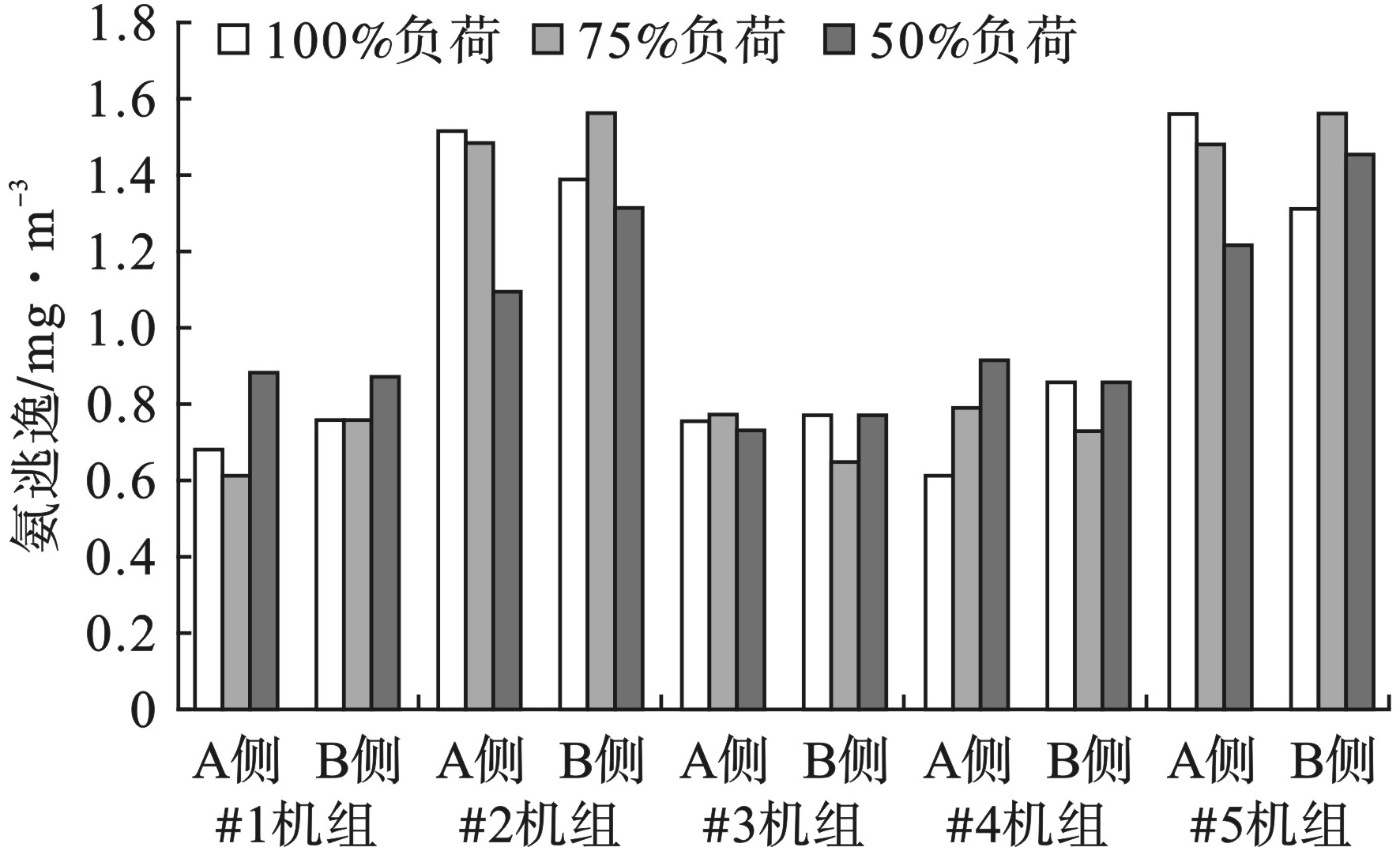
不同负荷条件下NH3/NOx摩尔比、氨逃逸浓度以及脱硝效率变化见图4~6。5台机组脱硝效率和NH3/NOx摩尔比整体呈现出随着负荷的降低而降低的趋势;氨逃逸浓度均在2.28 mg/m3以下,达到了设计要求。
对于NH3/NOx摩尔比,负荷为50%时,最大值和最小值分别为0.864和0.818;负荷为75%时最大值和最小值分别为0.878和0.826;负荷为100%时最大值和最小值分别为0.893和0.831。100%负荷的NH3/NOx摩尔比平均比75%负荷高1.0%,比50%负荷高1.6%。
对于氨逃逸浓度,负荷为50%时,最大值和最小值分别为1.45和0.73 mg/m3;负荷为75%时,最大值和最小值分别为1.56和0.61 mg/m3;负荷为100%时,最大值和最小值分别为1.56和0.61 mg/m3。100%负荷的氨逃逸浓度平均比75%负荷低2.0%,比50%负荷高1.1%。
对于脱硝效率,负荷为50%时,最大值和最小值分别为85.6%和80.7%;负荷为75%时,最大值和最小值分别为86.6%和81.2%;负荷为100%时,最大值和最小值分别为88.2%和82.4%。100%负荷的脱硝效率平均比75%负荷高1.1%,比50%负荷高1.5%。
SCR反应器一般布置在省煤器与空预器之间,SCR反应器中最重要的部分是催化剂,催化剂主要包括载体、活性成分以及助催化剂。影响脱硝效率的因素主要包括温度、烟气流速与停留时间、NH3/NOx摩尔比及氨逃逸浓度等。温度对脱硝效率的影响主要表现在当温度低于催化剂最适宜的温度,脱硝还原剂会发生很多副反应,减少对NOx还原作用,温度太高催化剂活性成分会形成多聚态晶体,多聚态晶体比表面积较小,减少了与NOx的接触面积,催化能力降低[14];对于烟气流速与停留时间,烟气流速低停留时间长,NOx与还原剂反应更充分,脱硝效率越高,反之则脱硝效率降低[15];NH3/NOx摩尔比和氨逃逸浓度对脱硝效率的作用体现在未达到最大脱硝效率之前,NH3/NOx摩尔比越大脱硝效率越高,氨逃逸浓度较低,当达到最大脱硝效率之后,NH3/NOx摩尔比增加,脱硝效率变化不大,而氨逃逸浓度会显著性增加,因此需要根据氨逃逸浓度确定最佳NH3/NOx摩尔比[16]。试验结果表明在保证NH3/NOx摩尔比和氨逃逸浓度较佳的情况下,负荷由100%降到50%,温度降低,脱硝效率降低,出口NOx质量浓度增加。烟气流速的降低,停留时间的增加,并没有使脱硝效率升高,表明在负荷调整过程中,温度对脱硝效率影响较大。
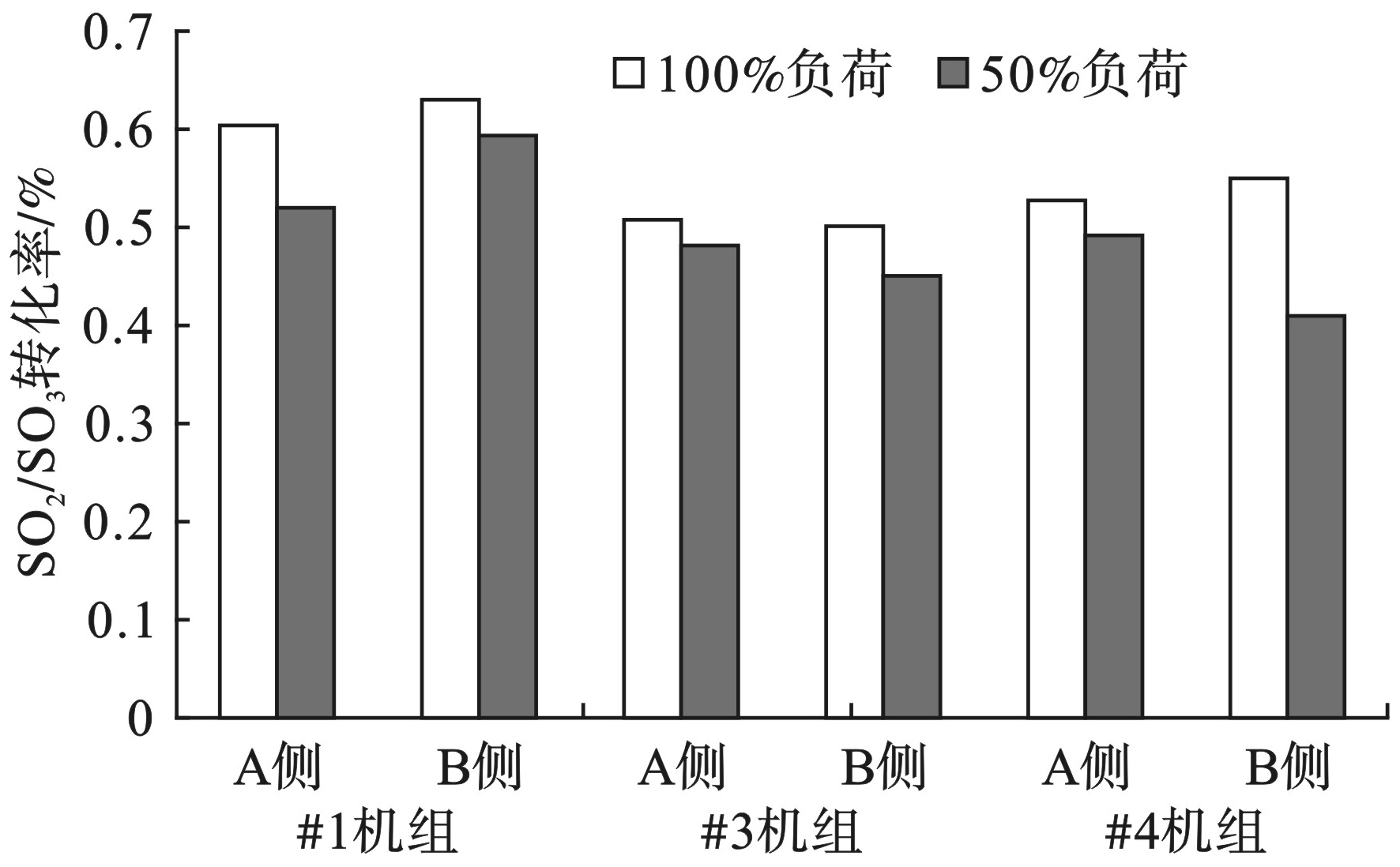
2.5 SO2/SO3转化率与机组负荷的关系
不同负荷条件下SO2/SO3转化率见图7。
此次试验进行了50%和100%两个负荷段3台机组SO2/SO3转化率的测定。测试结果显示,100%负荷的SO2/SO3转化率均大于50%负荷。负荷为50%时,最大值和最小值分别为0.59%和0.41%;负荷为100%时,最大值和最小值分别为0.63%和0.50%;100%负荷比50%负荷SO2/SO3转化率平均高出12.9%。
SO3与烟气中NH3反应生成的NH4HSO4和(NH4)2SO4会对下游的设备造成腐蚀、堵塞以及磨损,影响了机组的安全稳定运行。同时,硫酸雾气溶胶还是有色烟羽的主要成因,因此合理有效控制SO2/SO3转化率非常重要。影响SO2/SO3转化率的因素主要包括烟气温度以及催化剂中V2O5的含量。温度越高,SO2/SO3转化率越大,温度越低,SO2/SO3转化率越小;SO2/SO3转化率与催化剂V2O5含量呈线性关系,V2O5含量越大SO2/SO3转化率越高[17-19]。试验结果表明,在负荷降低时,温度降低,V2O5含量不变,SO2/SO3转化率降低。
3. 结论
1)机组进行负荷调整时,氧含量以及NOx质量浓度变化与负荷变化负相关,温度、脱硝效率以及SO2/SO3转化率则与负荷变化正相关。当负荷的降低,氧含量以及NOx质量浓度升高,温度、脱硝效率以及SO2/SO3转化率降低。
2)机组进行负荷调整时,氧含量和温度的变化都会对NOx的生成产生影响,同温度相比,氧含量变化对NOx生成量的影响更大。
3)影响催化剂活性的主要因素是温度,同时催化剂又是控制SCR技术脱硝效率以及SO2/SO3转化率的重要因素。进行负荷调整时,温度的变化影响催化剂的活性,催化剂影响脱硝效率以及SO2/SO3转化率。因此,温度对于脱硝效率以及SO2/SO3转化率有较为显著的影响。
-
-
[1] CHEN B B, WU L, WU B, et al. Catalytic materials for low concentration VOCs removal through “storage-regeneration” cycling[J]. ChemCatChem, 2019, 11(16): 3646-3661. doi: 10.1002/cctc.201900581 [2] POSCHL U, SHIRAIWA M. Multiphase chemistry at the atmosphere-biosphere interface influencing climate and public health in the anthropocene[J]. Chemical Reviews, 2015, 115(10): 4440-4475. doi: 10.1021/cr500487s [3] HE C, CHENG J, ZHANG X, et al. Recent advances in the catalytic oxidation of volatile organic compounds: a review based on pollutant sorts and sources[J]. Chemical Reviews, 2019, 119(7): 4471-4568. doi: 10.1021/acs.chemrev.8b00408 [4] WANG Y D, CHEN B B, WU B, et al. “Storage-oxidation” cycling process for indoor benzene removal at room temperature[J]. Catalysis Today, 2017, 297: 193-200. doi: 10.1016/j.cattod.2017.04.054 [5] ZHANG J, XU X P, ZHAO S Z, et al. Recent advances of zeolites in catalytic oxidations of volatile organic compounds[J]. Catalysis Today, 2023, 410: 56-67. doi: 10.1016/j.cattod.2022.03.031 [6] MURINDABABISHA D, YUSUF A, SUN Y, et al. Current progress on catalytic oxidation of toluene: a review[J]. Environmental Science and Pollution Research International, 2021, 28(44): 62030-62060. doi: 10.1007/s11356-021-16492-9 [7] LIOTTA L F. Catalytic oxidation of volatile organic compounds on supported noble metals[J]. Applied Catalysis B: Environmental, 2010, 100(3/4): 403-412. [8] ROKICIŃSKA A, DROZDEK M, DUDEK B, et al. Cobalt-containing BEA zeolite for catalytic combustion of toluene[J]. Applied Catalysis B: Environmental, 2017, 212: 59-67. doi: 10.1016/j.apcatb.2017.04.067 [9] LI Y, LI L, YU J H. Applications of zeolites in sustainable chemistry[J]. Chem, 2017, 3(6): 928-949. doi: 10.1016/j.chempr.2017.10.009 [10] ILIĆ B, WETTSTEIN S G. A review of adsorbate and temperature-induced zeolite framework flexibility[J]. Microporous and Mesoporous Materials, 2017, 239: 221-234. doi: 10.1016/j.micromeso.2016.10.005 [11] MIKHEEVA N N, ZAIKOVSKII V I, LARICHEV Y V, et al. Toluene abatement on Ag-CeO2/SBA-15 catalysts: Synergistic effect of silver and ceria[J]. Materials Today Chemistry, 2021, 21: 100530. doi: 10.1016/j.mtchem.2021.100530 [12] DZWIGAJ S, MILLOT Y, KRAFFT J-M, et al. Incorporation of silver atoms into the vacant T-atom sites of the framework of SiBEA zeolite as mononuclear Ag (I) evidenced by XRD, FTIR, NMR, DR UV–vis, XPS, and TPR[J]. The Journal of Physical Chemistry C, 2013, 117(24): 12552-12559. doi: 10.1021/jp401849e [13] SHI C, CHENG M J, QU Z P, et al. On the correlation between microstructural changes of Ag-H-ZSM-5 catalysts and their catalytic performances in the selective catalytic reduction of NOx by methane[J]. Journal of Molecular Catalysis A: Chemical, 2005, 235(1/2): 35-43. [14] KUNDAKOVIC L, FLYTZANI-STEPHANOPOULOS M. Deep oxidation of methane over zirconia supported Ag catalysts[J]. Applied Catalysis A: General, 1999, 183: 35-51. doi: 10.1016/S0926-860X(99)00043-5 [15] PALČIĆ A, VALTCHEV V. Analysis and control of acid sites in zeolites[J]. Applied Catalysis A: General, 2020, 606: 117795. doi: 10.1016/j.apcata.2020.117795 [16] BHARGAVI K, RAY D, CHAWDHURY P, et al. Oxidation of toluene by ozone over surface-modified γ-Al2O3: effect of Ag addition[J]. Catalysts, 2022, 12(4): 421. doi: 10.3390/catal12040421 [17] KRATZER J M M P. The role of the van der waals interactions in the adsorption of anthracene and pentacene on the Ag (111) surface[J]. The journal of chemical physics, 2017, 146(3): 4702. [18] XU X X, WANG P T, XU W C, et al. Plasma-catalysis of metal loaded SBA-15 for toluene removal: comparison of continuously introduced and adsorption-discharge plasma system[J]. Chemical Engineering Journal, 2016, 283: 276-284. doi: 10.1016/j.cej.2015.07.050 [19] AKIRA TAKAHASHI F H Y, AND RALPH T. YANG. Aromatics/Aliphatics separation by adsorption: new sorbents for selective aromatics adsorption by π-complexation[J]. Industrial & Engineering Chemistry Research, 2000, 39, (10): 3856-3867. [20] ELDRIDGE R B. Olefin/Paraffin separation technology: a review[J]. Industrial & Engineering Chemistry Research, 1993, 32(10): 2208-2212. [21] HOU X J, LI H, HE P, et al. Molecular-level investigation of the adsorption mechanisms of toluene and aniline on natural and organically modified montmorillonite[J]. The Journal of Chemical Physics, 2015, 119(45): 11199-11207. doi: 10.1021/acs.jpca.5b09475 [22] NETTO M S, OLIVEIRA J S, SALAU N P G, et al. Analysis of adsorption isotherms of Ag+, Co+2, and Cu+2 onto zeolites using computational intelligence models[J]. Journal of Environmental Chemical Engineering, 2021, 9(1): 104960. doi: 10.1016/j.jece.2020.104960 [23] HESSOU E P, BEDE L A, JABRAOUI H, et al. Adsorption of toluene and water over cationic-exchanged Y zeolites: a DFT exploration [J]. Molecules, 2021, 26 (18) . [24] ASPROMONTE S G, MIR E E, BOIX A V. FTIR studies of butane, toluene and nitric oxide adsorption on Ag exchanged NaMordenite[J]. Adsorption, 2011, 18(1): 1-12. -





 下载:
下载: