-
抗生素是一类由微生物(包括细菌、真菌、放线菌属)分泌或化学合成等途径产生的复杂分子,可以抑制微生物活性,提高人和动物的抵抗力,因而在医疗和养殖行业被广泛应用[1]. 滥用现象导致的抗生素耐药性问题,已经使其成为备受关注的一类新型污染物. 抗生素在环境中极为隐蔽、检出难度大、扩散性强且极易被生物积累,对生态系统稳定性和人体健康造成潜在威胁[2].
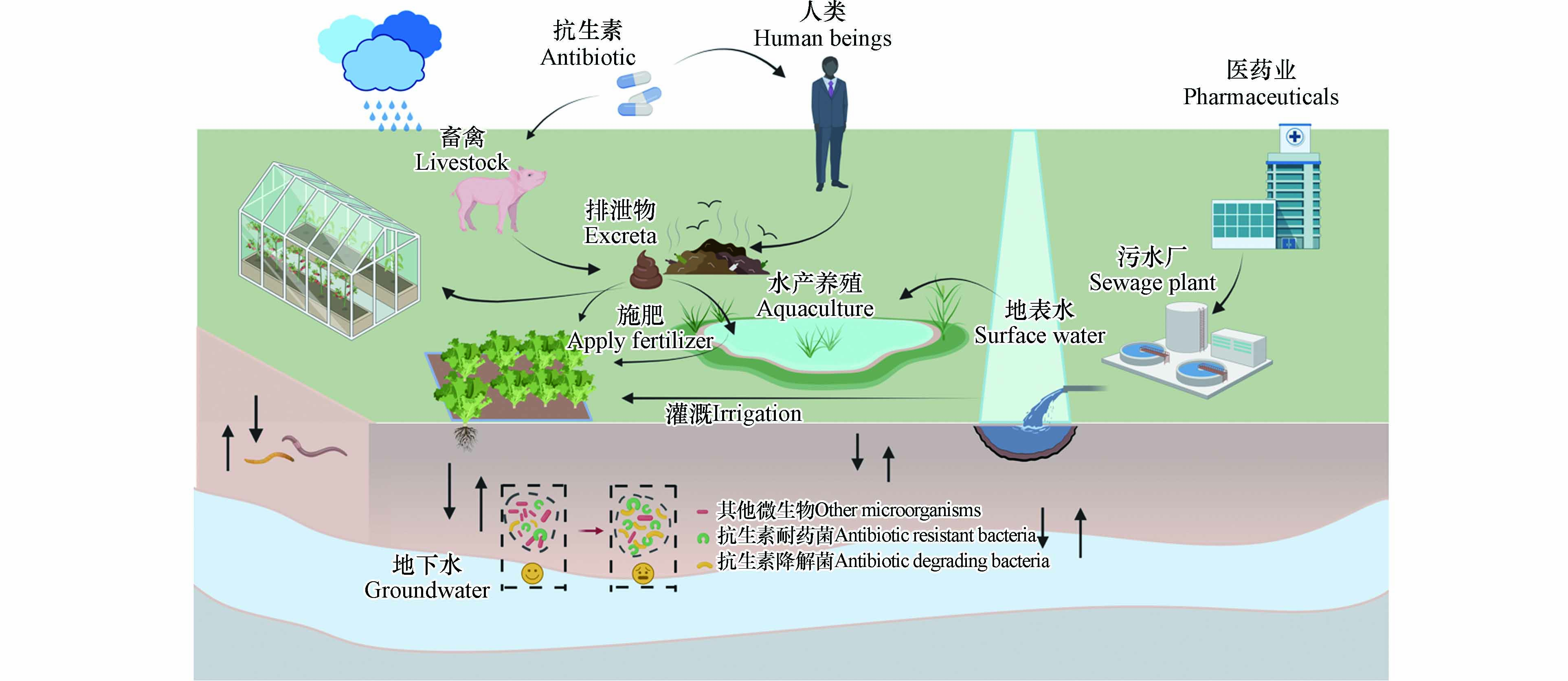
与人类医疗行业使用的抗生素类型不同,四环素类、磺胺类和喹诺酮类药物在畜禽养殖中被广泛使用[3]. 多数兽用抗生素在畜禽体内生物利用率较低,未完全代谢的抗生素极易随动物排泄物进入环境[4]. 因此,畜禽粪便被认为是环境抗生素的主要污染源之一. 进入土壤中的抗生素,一部分在生物因素(如土壤微生物)和非生物因素(如土壤组分)的作用下发生吸附或降解反应,另一部分则会持续对土壤微生物施加选择压力,改变土壤微生物的活性和群落组成,甚至会促进环境中耐药菌的传播和抗生素抗性基因的污染. 此外,抗生素不仅会通过多种途径迁移到动植物体内,还会伴随地表径流以及淋溶作用迁移到地表水和地下水中,扩大污染范围(图1)[5 − 6]. 因此,土壤环境中抗生素的污染现状及其生态风险逐渐成为研究热点.
近年来,作为化肥的替代品,以畜禽粪便为重要来源的有机肥成为了农业生产必不可少的营养来源. 与其他类型的农用地相比,菜地往往因作物生长周期短且经济效益高而轮作频繁,对有机肥的消耗量也远高于其他类型作物[7],因此菜地较粮食作物地更可能受到畜禽粪便污染,也更易出现抗生素残留. 调查显示,相对于常规菜地,施用有机肥的菜地土壤中抗生素残留量更高,部分地区抗生素残留量达到mg·kg−1级别[6, 8]. 尽管学者对抗生素污染的来源、现状和归趋已经有了深入研究成果,但是各类抗生素在菜地系统中的污染现状调查仍然存在技术壁垒等客观限制. 抗生素在环境中具有一定的内在生物活性,能够对生物和人类健康产生毒性作用. 目前关于抗生素的潜在生态危害的相关研究较少,其产生生态毒性效应机制尚不明确. 文章综述了菜地系统中抗生素的污染情况、影响因素和可能造成的生态效应,重点分析了抗生素对土壤生物的毒性作用机制,以期为减轻环境抗生素污染提供理论支撑和实践指导.
-
我国菜地土壤受到不同程度抗生素污染,具体污染状况与区域位置密切相关,总体呈现“北高南低,东高西低”的特征(表1). 截至2021年底,我国菜地土壤抗生素的残留量范围在4.59—2101.4 μg·kg−1之间,平均残留量为186.98 μg·kg−1. 其中,西北和华中部分区域的抗生素污染相对严重,平均含量分别高达243.20 μg·kg−1和724.13 μg·kg−1,而东部沿海典型污染带主要分布在黄淮海和长江三角洲地区,该地区抗生素平均总含量达166.32 μg·kg−1. 我国菜地土壤抗生素含量的空间差异可能与当地抗生素的使用情况有关. Zhang等[9]对我国抗生素使用情况调研显示,华东(38800 t)>华北(27900 t)>华中(21100 t)>西南(18300 t)>华南(9030 t)>东北(6070 t)>西北(2360 t). 然而,西北地区抗生素的使用量和土壤抗生素残留量呈现负相关关系,这极可能与区域农户的施肥习惯有关[10]. 此外,研究区域中四环素类抗生素的检出量最高,其次是喹诺酮类和磺胺类抗生素(表1). 可能原因如下:(1)四环素类在畜禽养殖中使用量最大[11]且具有高Koc值[12];(2)喹诺酮类抗生素在土壤中的吸附能力较低,即使畜禽养殖对其消耗量较大,其在土壤中的残留水平仍低于四环素类抗生素[13];(3)磺胺类抗生素较低的pKa值会导致去质子化物种的比例增加进而降低对土壤的吸附[12]. 然而,由于缺少合适的测定方法,复杂基质中的低浓度水平抗生素难以被检出,因此难以全面评估土壤抗生素污染情况. 此外,我国对菜地土壤抗生素污染的研究多集中在人口稠密、经济发达地区,如京津冀、长三角和珠三角地区,对西北地区的关注有限,有关部门理应给予警惕.
-
如上所述,我国菜地土壤普遍存在抗生素污染且污染水平在地理空间上差异较大. 土壤作为抗生素富集的一种典型环境载体,其中的抗生素残留量还与很多因素有关,主要包括以下4种.
-
农业生产中灌溉和施肥是大部分土壤中抗生素的主要来源. 污水和粪肥中抗生素含量与土壤抗生素总含量表现显著正相关关系. 厉文辉等[14]对凉水河两岸污灌区和井水灌溉区农田土壤样品进行采集检测,发现污灌区土壤抗生素残留量高于井水灌溉区,这意味着抗生素会从灌溉水转移到农田土壤中. 考虑到不同来源灌溉水污染水平的差异,Pan等[12]比较了用鱼塘水和生活污水灌溉后土壤中抗生素污染情况,发现鱼塘水灌溉的土壤中抗生素污染水平较高,这警示相关部门需要加强对水产养殖业的药品管控. 此外,距灌溉水源越近,土壤中抗生素检出率和残留量越高,反之越低[15]. 在Zhao等[16]的研究中,施用鸡、猪、牛等3类粪肥后土壤抗生素残留水平高低与这3类粪肥中抗生素含量高低一致,说明粪肥施用可显著增加土壤抗生素含量,且土壤抗生素残留水平与输入抗生素量息息相关. 重复性施肥可增加抗生素在土壤中的累积,不过也有学者研究发现,在施用粪肥的前期,土壤中抗生素的浓度会有所降低. 例如徐秋桐等[17]发现,在粪肥施加前期(第8天)施用1%有机肥处理组比未添加有机肥处理组4种抗生素降解率分别高出了12.5%、13.5%、24.8%和12.0%,这与Zhang等[18]的研究结论基本一致. 原因可能是有机肥提高了土壤中某些微生物的活性,从而加速了抗生素的生物降解.
-
种植条件对菜地土壤中抗生素残留水平也存在一定影响. 一般来说,温室菜地中抗生素浓度要高于露天菜地,可能是在温室种植模式下,蔬菜的轮作更加频繁,粪肥的施用频率和总量更高,导致土壤中更多抗生素残留. 但彭秋等[19]和罗凯等[20]的调查发现,大棚菜地土壤抗生素浓度也可能会低于露天菜地. 这可能是该露天菜地靠近污染源,接触了由大气颗粒物携带的抗生素类污染物[21],也可能是露天菜地常以附近地表水作为灌溉水源,而灌溉水源受到了抗生素污染[20]. 其次,相较于露天环境,大棚的高温高湿条件有利于土壤微生物对抗生素的降解[22]. 种植年限与土壤抗生素残留水平存在密切关系. 在Zhang等[23]研究中,四环素类和氟喹诺酮类残留量随种植年限呈(中期)6年至10年<(长期)10年以上<(短期)5年以下的变化趋势,但土壤抗生素残留量的增长率却随种植年限延长而降低,这是由于进入土壤后抗生素的消散速率最初被抑制而后恢复,导致高含量的四环素类和喹诺酮类抗生素出现在短期种植的土壤中. 该现象提醒了今后研究还需关注抗生素代谢产物在土壤中的污染机制. 值得注意的是,磺胺类抗生素呈现出相反的情况. 在长期种植年限的土壤中往往能检测出更高含量的磺胺类[23],Fang等[24]研究也得到类似的结论. 从抗生素本身性质来说,一方面磺胺类抗生素的水溶性较四环素类和氟喹诺酮类更高,因而不易被土壤颗粒吸附. 另一方面,磺胺类抗生素对土壤有机质表现出高亲和力,这减缓了它在土壤中的迁移. 上述结论进一步证实了抗生素在土壤中的动态持久性.
-
理化性质和颗粒组成等土壤条件制约了抗生素在土壤中的移动. 土壤pH通过改变抗生素的电荷状态间接干扰抗生素的吸附. 多数抗生素(如四环素类和喹诺酮类等)的吸附能力随pH上升呈下降趋势,而磺胺类的吸附能力与pH有强烈的正相关性[25 − 26]. 抗生素进入土壤就会与土壤固相紧密结合,不难推断土壤抗生素含量与土壤有机质呈显著正相关关系[27]. 而有机质多分布在土壤黏粒上,意味着土壤黏粒比重越高土壤抗生素含量越高. 但也出现了不一样的研究结论,即在粘土比例较低的土壤中四环素类抗生素含量反而最高[28],这可能是在多因素的作用下土壤有机质含量下降了[29 − 30]. 因此可以认为土壤性质与抗生素的环境行为密切相关.
-
关于气候条件对土壤中抗生素分布特征的研究较少. Hu等[6]报道,与夏季相比,冬季菜地土壤抗生素的残留更多,不难推测在一定条件下南方土壤抗生素残留水平要低于北方. 究其原因,适宜的水热条件极大帮助了土壤微生物对抗生素的降解[31],而低温低湿环境不利于抗生素在土壤中的降解和迁移. 此外,蔬菜种类的差异也是影响土壤抗生素含量的重要因素,比如磺胺类抗生素在土壤中表现为根茎类蔬菜土壤(289 μg·kg−1)>瓜果类蔬菜土壤(143 μg·kg−1)>叶菜类蔬菜土壤(98.1 μg·kg−1)[22];四环素类抗生素表现为叶菜类蔬菜土壤(77.4 μg·kg−1)>瓜果类蔬菜土壤(67.8 μg·kg−1)>茄果类蔬菜土壤(54.1 μg·kg−1)>豆类蔬菜土壤(47.7 μg·kg−1)[19],喹诺酮类抗生素总含量表现为果类蔬菜(44.8 μg·kg−1)>根茎类蔬菜(37.0 μg·kg−1)>叶菜类蔬菜(32.1 μg·kg−1)[8].
综上所述,菜地抗生素赋存差异性是多因素共同作用的结果. 其中,输入水平直接决定了土壤中抗生素的污染水平,而抗生素性质、种植条件、土壤条件和气候条件等在一定程度上影响着抗生素在土壤中含量的变化. 如吸附能力强的抗生素更易在土壤中累积,重复的施肥可以增加土壤中抗生素含量,而高温高湿环境有利于抗生素的降解.
-
暴露在受抗生素污染的土壤中时,蔬菜可能会吸收抗生素并在体内不断累积. 某些抗生素甚至能够在较低浓度下被蔬菜吸收并累积,出现蔬菜体内抗生素浓度高于土壤中的现象. 如Hu等[6]发现林可霉素在土壤中的检出量低于在蔬菜中的检出量,Migliore等[53]发现,恩诺沙星在4种果蔬中的含量远高于培养基中的水平. 以上事实均表明,蔬菜对抗生素具有极强的生物累积性,而且实际环境下蔬菜对抗生素的累积系数远低于实验室模拟值,因此可以推断在更严重的污染条件下,该累积系数会增大.
蔬菜对抗生素的吸收按照吸收方式分为主动吸收和被动吸收. 主动吸收主要受蒸腾作用影响,需要消耗能量,而被动运输不需要其他辅助. 有研究比较了田间试验和盆栽试验发现,前者四环素类抗生素含量显著高于后者[54]. 这是由于田间开放条件下的蔬菜蒸腾作用更高,更有利于蔬菜对抗生素的主动吸收. 有研究发现磺胺多辛、土霉素和林可霉素在蔬菜中含量均很高,意味着这些抗生素的理化性质(如水溶性和半衰期)几乎不影响蔬菜对其的吸收,说明了蔬菜对这些抗生素的吸收是被动吸收[6]. 目前认为,蔬菜对有机污染物的吸收以被动吸收为主,并伴有一定程度的主动吸收.
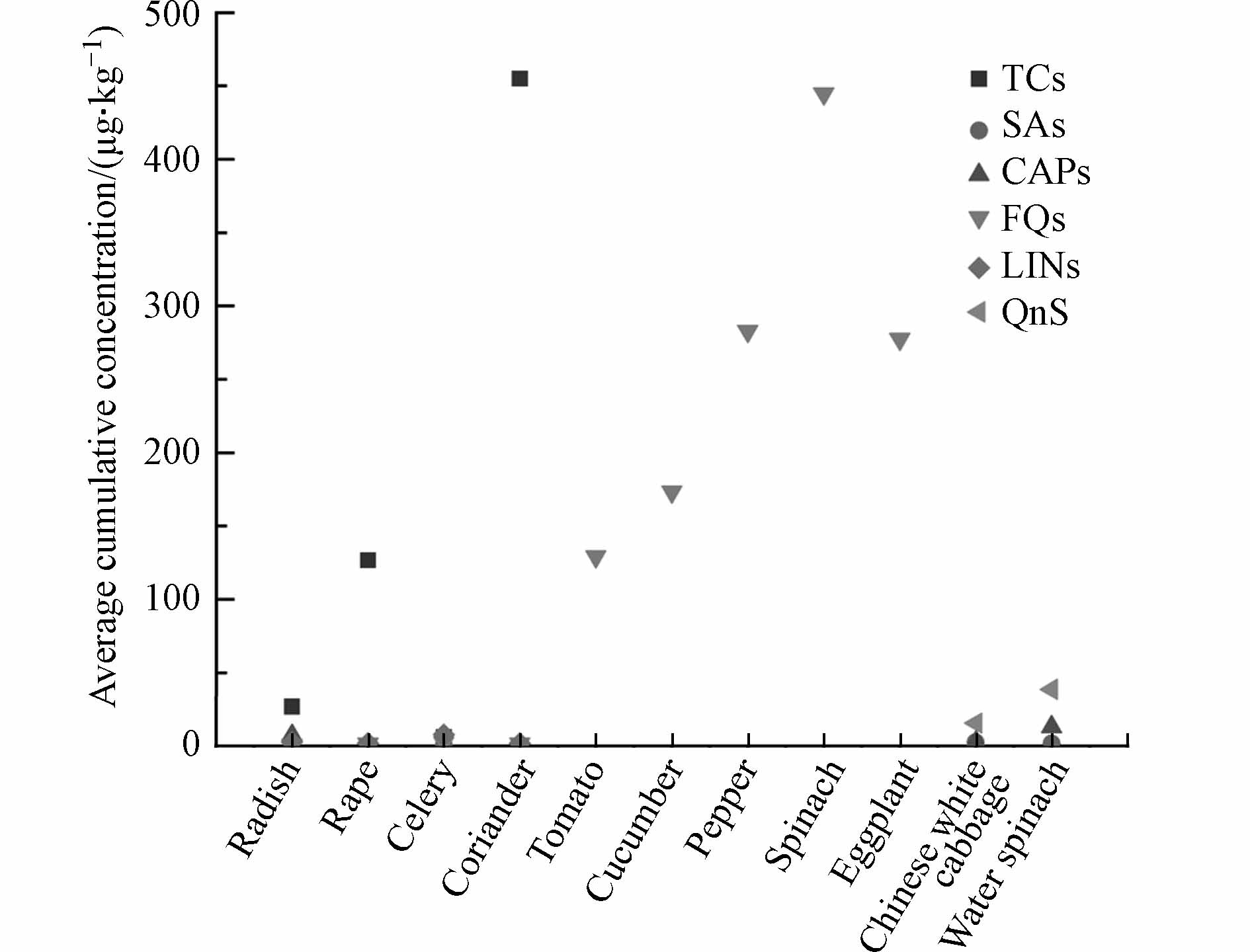
蔬菜对抗生素的吸收和累积受多种因素影响,主要包括蔬菜种类、抗生素性质以及其他环境因子. 不同种类蔬菜中抗生素的残留水平差异很大,一般为叶菜类>果蔬类>块茎类[55],但是Li等[56]调查了蔬菜可食用部分氟喹诺酮的累积情况,发现茄果类>叶菜类. 这可能是不同类型蔬菜对抗生素的吸收能力不同,当然也不能忽略其他影响因素的作用,如土壤性质可以通过控制抗生素的生物可利用度来影响蔬菜对抗生素的吸收[56 − 58]. 抗生素性质似乎是影响抗生素吸收过程的主要因素. 一般认为,强土壤吸附性、高疏水性的四环素类抗生素的生物可利用度较低,而较弱土壤吸附性、较高水溶性的磺胺类和喹诺酮类抗生素生物可利用度较高[59]. 因此可以推测,磺胺类和喹诺酮类更容易被蔬菜吸收并累积. 然而,在某些实际环境中,蔬菜对这3类抗生素的吸收情况不符合上述结论. 如图2所示,前4种蔬菜中四环素类含量显著高于磺胺类和喹诺酮类,这与土壤中不同种类抗生素含量的变化一致[6],说明土壤中抗生素污染水平也是一个重要的影响因素. 此外,抗生素降解、土壤结合和浸出也限制了蔬菜吸收抗生素[2].
表2中抗生素在叶中含量要大于茎和根,但是Migliore等[60]发现,根中抗生素含量高于叶. 这是由于抗生素在蔬菜体内的转运受蒸腾作用驱动,而蒸腾水量的差异最终会影响抗生素在根和叶中含量的差异[61]. 此外,抗生素种类也是影响其在蔬菜组织中分布水平差异的重要因素. 抗生素从植物根部向地上部分的转运能力常用易位因子测定. 大多数四环素类抗生素、喹诺酮类抗生素和林可霉素易位因子>1,但磺胺类抗生素和大环内酯类抗生素易位因子<1[62]. 这就造成了前者在植物体内均能被检出,而后者很难在植物地上部分被检出. 值得注意的是,大环内酯类药物尺寸较大,多数情况下很难在植物中被检测到[63]. 抗生素在蔬菜内的分布随不同生长阶段变化. 如采集收获前15 d蔬菜样品,发现抗生素在叶菜类根部含量高于叶片,而对成熟期采集的蔬菜样品检测得到相反的结论[6].
抗生素的理化性质以及蔬菜种类、生长阶段和蒸腾速率是导致其在蔬菜中含量不同的影响因素. 目前已有学者开展了一些蔬菜可食用部分的人体暴露影响的研究,但是仍然缺乏蔬菜摄食途径下抗生素的人体健康风险的全面评估. 因此,需要进一步研究来评估这些抗生素在食物链中的积累,以确定人类使用的安全浓度.
-
抗生素具有易被生物积累的特性. 大量研究证实,长期的农业生产不仅会促使抗生素在植物间迁移[57, 64 − 65],还会诱导微生物产生抗生素抗性,严重破坏了土壤微生态系统的稳定性[66 − 67],同时,长期暴露在抗生素污染环境中的动物也会表现出诸多不良反应.
-
抗生素对植物生长的影响具有两面性,一方面,抗生素可以帮助植物抵抗病害、提高植物体内Ca、Mg、K、N等营养元素的含量[68 − 69],另一方面,某些条件下,抗生素的存在反而会诱发植物毒性,并持续作用于植物生长发育的不同阶段. 抗生素对蔬菜生长的影响表现为低浓度促进高浓度抑制[68]. 金彩霞等[70]研究发现,低浓度磺胺嘧啶钠(1 mg·kg−1)对大白菜的芽伸长有一定促进作用. 在0、50、100、5000 μg·kg−1恩诺沙星处理的土壤中,黄瓜、菜豆、萝卜和莴苣生长发生变化,低浓度(0—50 μg·kg−1)条件下,根长、下胚轴长、子叶和叶片长度及数量均受到刺激作用,随着恩诺沙星浓度提高,抑制作用逐渐明显[53]. 在种子萌发时期,抗生素的毒性作用影响不大[71],这可能是抗生素难以穿过种皮,因而对胚根生长的抑制作用不大[72]. 从这点来看,为缓解抗生素对种子的毒性作用,未来可以利用现代生物技术培育适宜质地的种皮,以达到减少抗生素渗透的目的[73]. 抗生素对植物的潜在毒性作用常通过干扰蚯蚓和微生物介导的土壤速效养分间接抑制植物生产力[74]. 在抗生素的直接或间接作用下,农业系统可持续性将受到严重威胁.
与其他污染物类似的是,抗生素干预了蔬菜光合作用等许多重要的生理过程. 如四环素类、氟喹诺酮类和大环内酯类等抗生素会影响蔬菜的叶绿体和线粒体蛋白质合成[75 − 76],环丙沙星和头孢菌素会降低气孔导度[77]. 这意味着与光合作用有关的叶绿素和类胡萝卜素的减少和叶片气孔导度的降低,会导致蔬菜光合作用速率降低,从而影响蔬菜的生长[78]. 从根本来看,抗生素的毒性作用机理是破坏遗传物质或限制酶作用途径. 喹诺酮类抗生素能够抑制核酸合成或代谢过程,主要通过改变DNA拓扑异构酶Ⅱ活性、抑制酶的切割和链接,进而对真核DNA复制造成不同程度的影响并抑制了叶绿素的转录,最终影响植物生长[53, 75]. 磺胺类抗生素作用机制是改变能量代谢过程,其具有类似氨基苯甲酸结构,能竞争性作用于叶酸合成途径中的相关酶,阻止叶酸合成,最终干扰根系伸长、木质素和光呼吸作用[79 − 80]. 四环素类和大环内酯类抗生素对植物生长的抑制作用表现在能够显著抑制蛋白质生物合成或诱导染色体变异,而β-内酰胺会影响低等植物的质体分裂[75]. 目前很多有关植物毒性的研究都在实验室环境中进行,其设计的抗生素浓度并不一定会在土壤中出现,因此在实际土壤环境中这些抗生素是否仍会表现出毒性作用有待商榷. 如红扁豆在含较低浓度抗生素营养液中根伸长减缓、植物干重降低,而在相应浓度土壤基质的红扁豆则没有出现植物毒性效应[69].
-
抗生素对土壤动物的毒性作用的相关研究并不多,且各方观点不一. Baguer等[81]发现蚯蚓、线虫和弹尾虫在3000—5000 mg·kg−1土霉素和泰乐菌素胁迫下,其生长并未受到严重影响,说明这两种抗生素不太可能对土壤动物构成直接风险. 然而,一些研究认为,抗生素对动物的毒性具有明显的剂量-效应关系. 如在1.0—2.0 mg·kg−1浓度抗生素胁迫下,蚯蚓的生长和呼吸作用受抑制、繁殖率下降、回避反应增强,且随浓度提高,蚯蚓的反应越明显[82]. 除了蚯蚓,抗生素也在破坏着跳虫和白符䖴的健康机能[83 − 84]. 暴露于10 mg·kg−1诺氟沙星和土霉素中,跳虫出现明显的体重下降[83]. 与对照组相比,当白符䖴暴露在浓度为1000 mg·kg−1的诺氟沙星环境下,其繁殖数和成虫体长分别减少34.4%和9%[84].
抗生素对土壤动物的毒性作用首先表现在对DNA的破坏性. 抗生素代谢产物的自由基和碱基位点等会直接导致土壤动物细胞DNA断裂,造成细胞DNA损伤[85]. DNA损伤程度与抗生素剂量呈显著正相关关系,即使是最低暴露剂量(0.3 mg·kg−1)仍然会造成严重DNA损伤[85]. 其次,抗生素还会引起土壤动物酶活性的变化. 在抗生素的暴露下,动物会出现氧化应激反应,导致其脂质过氧化,最终促进脂质过氧化产物丙二醛的形成并诱导过氧化氢酶、过氧化物酶和超氧化物歧化酶的表达[84]. 如Eisenia foetida蚯蚓在环丙沙星(0—51.2 mg·kg−1)污染土壤中发生了蛋白质羟基化造成的氧化损伤[86]. 为了抵消抗生素产生的负面影响,动物肠道菌群物种组成发生改变,身体机能迅速反应形成一道强硬的防御系统. 动物体内产生的抗氧化酶、抗氧化剂和蛋白水解系统等可以极大缓解细胞的氧化损伤,在一定程度上保护了机体[87]. 此外,动物肠道会将已经发生改变的肠道菌群输送到土壤中,进而引起周边土壤菌群发生改变,形成微生物菌群对抗生素的共代谢模式,最终促成对土壤抗生素的削减. 但是目前关于肠道内生菌对抗生素的降解机制依旧未知.
-
土壤微生物是土壤生态系统的关键组成成分,它们在促进土壤有机物分解、提高土壤肥力和增进作物产量的过程中扮演者重要角色[88]. 而外源输入的抗生素会对土壤生态系统产生一系列的影响[89 − 90],造成土壤微生物群落特征的改变[91],干扰微生物对碳源利用[92],且不利于微生物硝化和反硝化等过程[93].
-
多数抗生素为抑菌药物,将其添加到土壤中会显著降低土壤细菌数量、改变群落结构并促使群落演替. Hammesfahr等[94]发现,4 d后暴露在磺胺嘧啶中的细菌/真菌比值从70%减少到57%. 磺胺嘧啶还对土壤氨氧化微生物群落分布和活性有显著影响[95 − 96]. 在磺胺嘧啶处理的土壤中,氨氧化细菌丰度会显著下降,而氨氧化古细菌基本稳定[97],Radl等[98]也得到类似的结论. 但另一项研究得到了不同的结论,在施加粪肥土壤中,具有生物有效性的磺胺嘧啶对全程硝化菌活性的抑制作用最强,其次是氨氧化古细菌,对氨氧化细菌的影响可以忽略不记[99]. 部分抗生素还会对革兰氏阳性菌和革兰氏阴性菌起到选择作用. 如当添加高浓度四环素8 d后,革兰氏阳性菌和革兰氏阴性菌的比例会下降,这可能是环境中耐四环素细菌多为革兰氏阴性菌,而磺胺类抗生素则不受此影响[94,100]. 在添加抗生素的处理中,相较于有益菌群,潜在致病菌群的丰度更高[101],即使是将生物质堆肥处理后仍可能增加土壤中病原菌丰度[102]. 但抗生素对真菌的影响仍然不清楚.
-
进一步研究表明,抗生素会限制微生物对碳源的正常利用,进而干扰其生长繁殖过程. 有研究检测了施加100 mg·kg−1磺胺甲恶唑水稻土经21 d培育后水稻土中微生物对碳源的利用情况,结果显示,微生物对碳源的利用受到抑制且其Shannon指数降低[103]. 但抗生素也可以作为微生物可利用的碳源,改变其呼吸强度. 有研究显示,最初添加磺胺嘧啶和金霉素处理组的土壤呼吸活性均受到抑制,随抗生素添加频率的增加,土壤呼吸活性逐渐提高[24]. 抗生素对土壤微生物的呼吸作用的影响较复杂,如低浓度的抗生素有促进作用,环境浓度抗生素却无显著作用[104 − 105]. 这些影响一般比较短暂,可能是由于抗生素生物可利用性会随时间推移而降低,最终导致了抗生素对微生物呼吸作用受限[106]. 同样,抗生素的种类和暴露时间也影响了呼吸作用[107]. 在抗生素的胁迫下,土壤微生物的活性出现明显的差异,其活性可能增强也可能受抑制[108 − 109]. 如较低浓度四环素对土壤脱氢酶和磷酸酶活性有明显的抑制效果[110],而微生物在较高浓度土霉素中表现出较低的生物活性[111]. 一个可能的原因是,土壤中的酶一般是由真菌分泌产生,而某些抗生素能够促进真菌繁殖造成土壤酶活性的增加[101]. 反之,酶活性受抑制可能是土壤微生物不能够抵抗抗生素的选择压力,出现了生长停缓或死亡等情况.
-
此外,抗生素对微生物的影响还表现在干扰土壤的硝化、反硝化和产甲烷化等过程,最终阻碍了土壤养分循环. 抗生素能够刺激土壤微观世界中氮循环,主要体现在对土壤微生物的硝化和反硝化作用所造成的影响[112]. Ma等[113]观察到高浓度的土霉素(30 mg·kg−1)和磺胺嘧啶(100 mg·kg−1)抑制了土壤微生物的硝化作用. 然而,部分研究发现仅最低浓度的环丙沙星和诺氟沙星(1 mg·kg−1)会刺激土壤微生物的硝化作用[114 − 115]. 低浓度的磺胺甲恶唑、磺胺嘧啶、庆大霉素、甲基盐霉素(500 μg·kg−1)还会抑制反硝化过程,但是更低浓度(<1 μg·kg−1)会促进该过程[116]. 抗生素还被证实可以干扰土壤中铁的转化率和产甲烷化过程. 如超过10 mg·kg−1磺胺甲恶唑和土霉素暴露会强烈抑制三价铁的还原[117],而500 μg·kg−1磺胺甲恶唑可以显著刺激土壤微生物产甲烷化过程[118]. 以上事实证明了抗生素在一定程度上不利于地球化学循环.
-
综上所述,我国菜地系统存在不同程度的抗生素污染,且与输入水平、土壤性质、抗生素种类以及气候条件等息息相关. 抗生素从畜牧业向农业的流动过程不仅对土壤生物产生直接毒性作用,还能干扰土壤速效养分造成植物减产,提高致病菌丰度,并对动、植物生长构成严重威胁. 为维护农业的可持续性,相关领域目前已经开展一系列研究,但仍存在一定局限性,未来研究可以关注以下方向:
(1)抗生素在全国尺度上的长期追踪调查目前还未实现,这不利于全面评估我国土壤抗生素污染现状. 因此,未来可以进一步增加对不同区域的调查研究,尤其是人口密度和经济发展水平较低的西北地区,以期为制定相关政策法规提供科学依据.
(2)学者们已认识到抗生素的分子结构是决定抗生素作用机制的关键因素,抗生素的转化和降解速率很大程度上取决于抗生素的结构. 因此,未来研究可以关注如何利用分子手段等高新技术改造相应的官能团,以保障抗生素本身功效的同时安全高效的实现抗生素降解为研究目标.
(3)为全方面控制农田系统中抗生素污染现状,准确定量土壤中抗生素及其降解产物是极为必要的. 对于复杂环境基质中痕量分析,建议尝试更先进的样品前处理方法以及更高性能的数据采集和分析平台. 吸附、转化和降解是土壤中抗生素主要的环境行为,除抗生素自身性质外,这些过程还受到很多环境因素影响. 因此,未来研究可侧重于土壤性质、水热条件等对抗生素的作用机制. 对于参与土壤中抗生素降解的微生物,其降解能力的遗传效率同样值得研究. 掌握调控微生物降解抗生素的关键功能基因技术,尝试将该基因技术运用到培育具备高降解特性的功能性降解菌,这对未来土壤抗生素污染的修复具有重要意义.
(4)目前对于评估抗生素生态风险的方法并不统一,用于毒性试验的物种仍然局限,抗生素对生态环境造成的风险可能被低估了. SSD和风险熵值法是常见的环境风险评估方法,但易受太多不同因素影响而不可靠. 因此,应进一步扩充多营养级多物种的毒性数据,构建更科学的抗生素生态风险评估体系.
菜地系统中抗生素污染特征及生态效应研究进展
Research on the characteristics of antibiotic pollution and ecological effects in vegetable field systems
-
摘要: 抗生素直接或间接释放到菜地系统中已逐渐产生了许多环境问题. 然而,现有研究局限在地块尺度上对土壤界面过程中抗生素的污染现状的描述,缺乏基于农业生态系统整体维度的综合性研究. 文章在解析我国菜地系统中抗生素污染特征的基础上,概述了促成抗生素在菜地系统残留差异性的相关影响因素,如输入水平、种植条件、抗生素类型和土壤性质等,从机理角度重点分析了抗生素可能对蔬菜及土壤动物产生的毒性作用,以及对土壤微生物群落结构和生态功能的影响. 在此基础上,对后续研究提出了建议和展望,以期为农田系统抗生素污染控制提供理论支撑.Abstract: Many environmental problems have been gradually caused by the direct or indirect release of antibiotics into the vegetable field system. The existing studies, however, are limited to describing the status quo of soil antibiotic pollution on specific plots, and lack comprehensive studies based on the whole agro-ecosystem. On the basis of analyzing the characteristics of antibiotic pollution in the vegetable land system in China, this paper summarizes the relevant influencing factors such as input level, planting conditions, antibiotic types and soil properties that contribute to the difference of antibiotic residues in the vegetable field system. From the perspective of mechanism, the article focuses on analyzing the possible toxic effects of antibiotics on vegetables and soil animals, as well as their impact on the structure and ecological function of soil microbial communities. On this basis, suggestions and prospects are proposed for future researches, in order to provide theoretical support for antibiotic pollution control in agricultural system.
-
Key words:
- antibiotics /
- vegetable field system /
- distribution characteristics /
- ecological effect.
-
消毒是城市给水厂运行中的重要环节。氯消毒仍为我国大多数饮用水处理厂的主导消毒技术[1],但氯的使用可能会导致氯化消毒副产物的生成[2],进而影响水质安全。对水中出现的隐孢子虫和贾第鞭毛虫,常规化学消毒工艺难以去除[3]。紫外消毒工艺因其对微生物具有良好的灭活效果而受到重视,但其消毒能力缺乏持续性,难以保障管网水质持久安全[4]。因此,紫外消毒和氯消毒技术的组合使用(即紫外-氯消毒工艺,后简称紫外-氯工艺)受到广泛关注。紫外-氯工艺具有多重保障水质的特点,在保证微生物控制效果的同时,可有效降低消毒副产物生成,利于保证管网水质稳定。
目前,紫外-氯工艺在给水厂的应用还相对较少,存在运行标准化技术文件缺失和给水厂应用管理水平不足的问题,已有给水厂应用案例亦存在运行成本较高的问题。因此,研究并建立紫外-氯工艺运行效能评价模型,明确一定条件下紫外-氯工艺的最佳运行参数具有实际应用价值。本文对已应用紫外-氯工艺给水厂的技术条件进行了梳理,并基于灰色聚类关联分析模型和技术成本效益模型,对不同条件下的紫外-氯工艺运行效能进行综合评价,以期为该组合技术在给水厂中的应用提供参考。
1. 紫外-氯工艺运行技术效能评价
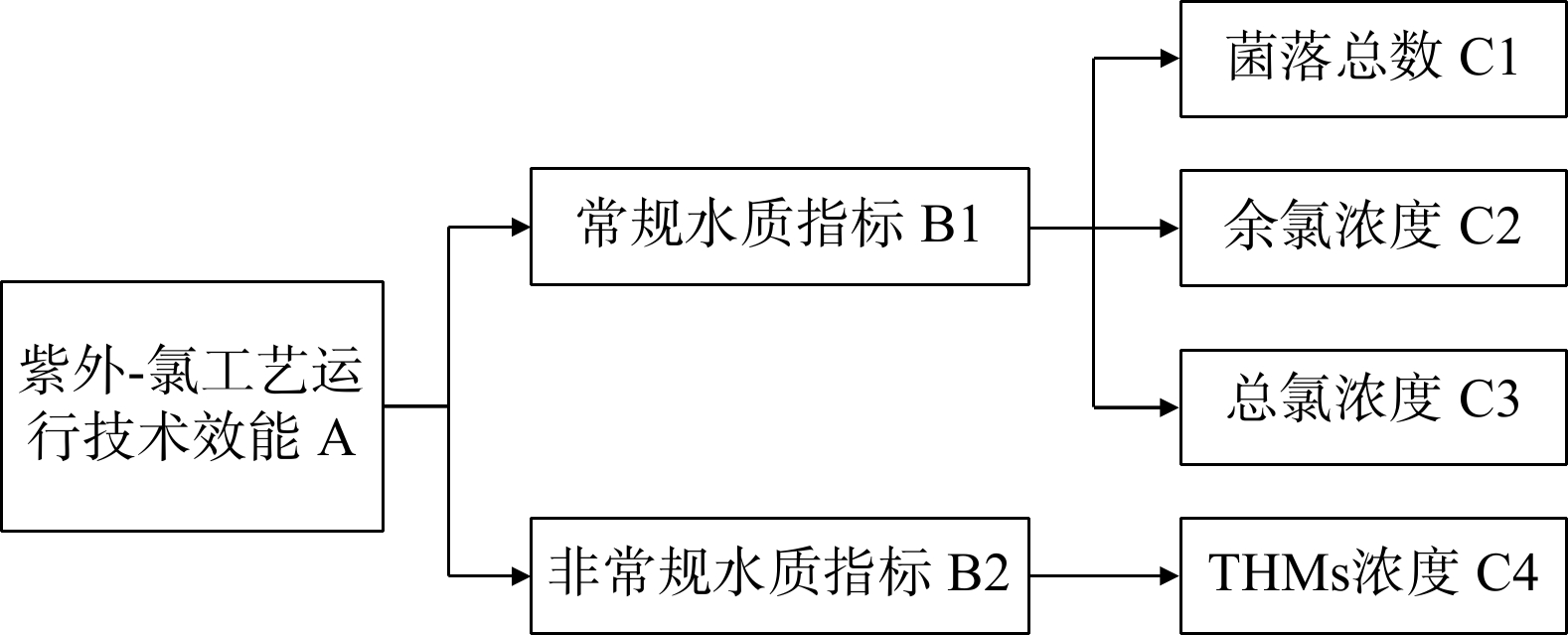
1.1 指标体系构建
以紫外-氯工艺出水水质为依据进行技术效能评价。按照科学性、典型性、可靠性及动态和静态相结合[5-6]的原则,通过文献分析确定可表征紫外-氯工艺效能的具体水质指标。共查阅相关文献85篇(其中32篇来自web of science,其余来自中国知网),对文献的统计分析结果表明:紫外-氯工艺主要用于微生物灭活(78篇)、消毒副产物控制(66篇)和出厂水余氯保证(19篇)等研究。根据文献量,选用能反映微生物灭活、消毒副产物控制效果的水质指标作为评价指标,因三卤甲烷类(46%)是氯化消毒饮用水中的主要氯化副产物[7],所以分别选取菌落总数和三卤甲烷浓度作为评价指标。余氯和总氯2个指标和管网水质安全密切相关,故将余氯和总氯的浓度一并作为评价指标。综合以上几点,构建紫外-氯工艺运行技术效能评价指标体系(见图1)。
1.2 基于灰色聚类关联分析法的紫外-氯工艺技术效能评价体系建立
1.2.1 评价指标分级标准的建立
合理的指标分级标准是开展技术评价的基础。以《生活饮用水卫生标准》(GB 5749-2006)为依据,参照我国地表水环境质量标准的分类方法,结合调研梳理得到的11座典型给水厂紫外-氯工艺运行情况,建立各要素层的指标分级标准。
1)菌落总数指标分级。进行了典型给水厂出水的菌落总数分析,结果表明,各给水厂出水的菌落总数多为“未检出”,即便偶有检出,也多分布在个位数,远小于《生活饮用水卫生标准》(GB 5749-2006)规定的100 cfu·mL−1,故需细分菌落总数指标分级标准,其具体分级标准见表1。
表 1 菌落总数指标分级标准Table 1. Classification standard of total colony indexcfu·mL−1 Ⅰ类 Ⅱ类 Ⅲ类 Ⅳ类 Ⅴ类 ≤1 ≤4 ≤10 ≤50 ≤100 2)余氯指标分级。当消毒剂为氯气或者游离氯制剂时,《生活饮用水卫生标准》(GB 5749-2006)中规定的出厂水余氯质量浓度应为0.3~4 mg·L−1。根据典型给水厂出水余氯浓度分析结果,可知该值多为1~2 mg·L−1。因此,在1~2 mg·L−1进行指标细分,并确定Ⅰ类阈值为1.0 mg·L−1,其余阈值按照梯度依次为0.30、0.50、0.70和1.10 mg·L−1,将余氯指标分为5级,分级结果见表2。
表 2 余氯指标分级标准Table 2. Classification standard of residual chlorine indexmg·L−1 Ⅰ类 Ⅱ类 Ⅲ类 Ⅳ类 Ⅴ类 ≥1.00 ≥1.30 ≥1.80 ≥2.50 ≥3.60 3)总氯指标分级。当给水厂采用氯胺作为消毒剂时,宜选用总氯浓度来表征剩余氯含量,《生活饮用水卫生标准》(GB 5749-2006)中规定出厂水总氯质量浓度应为0.5~3 mg·L−1。结合典型给水厂出水总氯质量浓度分析,可知该值一般在2~3 mg·L−1。据此建立总氯指标分级标准,见表3。
表 3 总氯指标分级标准Table 3. Classification standard of total chlorine indexmg·L−1 Ⅰ类 Ⅱ类 Ⅲ类 Ⅳ类 Ⅴ类 ≥1.50 ≥2.00 ≥2.30 ≥2.80 ≥3.00 4)三卤甲烷(THMs)指标分级。我国《生活饮用水卫生标准》(GB 5749-2006)和美国国家环境保护局标准(US EPA)都对三卤甲烷指标限值做了相关规定,分别规定该值不得大于1 mg·L−1和80 μg·L−1。根据典型给水厂紫外-氯工艺出水水质分析结果可知,各给水厂三卤甲烷类指标浓度皆小于80 μg·L−1,因此以80 μg·L−1为上限,建立三卤甲烷指标的分级标准,见表4。
表 4 三卤甲烷指标分级标准Table 4. Classification standard of trihalomethane indexμg·L−1 Ⅰ类 Ⅱ类 Ⅲ类 Ⅳ类 Ⅴ类 ≤10 ≤20 ≤30 ≤50 ≤80 1.2.2 白化函数建立
白化函数是用来计算某一指标对于某一灰度隶属程度的函数[8],本文采用指数型[9]白化函数,以达到“加权宽域”的目的。以余氯指标为例,根据表2所列的余氯指标分级标准,构建余氯指标在每个灰类下的白化函数f(见图2)。其余指标白化函数建立可参照余氯指标白化函数建立方法。
1.2.3 聚类权重计算
聚类权重被用来表征指标对于不同灰类的隶属程度[10],在各方案数据类型不同的情况下,计算得到的聚类权重也不相同。
在进行聚类权重计算时,首先需对各指标值进行无量纲化处理,以消除各指标值间的量纲差异。指标无量化的计算公式见式(1)~(2)。
stringUtils.convertMath(!{formula.content}) (1) stringUtils.convertMath(!{formula.content}) (2) 式中:
xij yjk x0ij y0jk μjk(i) stringUtils.convertMath(!{formula.content}) (3) 1.2.4 计算灰色关联度
i方案中指标j对k灰类的隶属度记为
zik(j) zik(j) (zik(1) zik(2) zik(n)) zik(0) zik(j) rik(j) stringUtils.convertMath(!{formula.content}) (4) stringUtils.convertMath(!{formula.content}) (5) 1.3 给水厂紫外-氯工艺技术效能评价
综合考虑各给水厂的位置和所处流域,从11座典型给水厂中最终选择A、B、C、D 4座给水厂进行工艺运行效能评价。这4座给水厂的基本情况见表5。
表 5 紫外-氯工艺评价指标样本数据汇总Table 5. Summary of sample data of UV / chlorine process evaluation indicators给水厂编号 进水来源 运行参数 评价指标样本数据 实际紫外剂量/(mJ·cm−2) 有效氯的质量浓度/(mg·L−1) 菌落总数/(cfu·mL−1) 余氯/(mg·L−1) 总氯/(mg·L−1) THMs的质量浓度/(mg·L−1) A 炭滤出水 40.0 1.8 NAD 1.41 — 0.041 6 B 砂滤出水 41.9 1.6 NAD 1.28 — 0.009 6 C 炭滤出水 42.8 1.8 1.8 1.34 — 0.013 9 D 炭滤出水 48.0 1.0 NAD — 2.30 0.020 2 注:“—”表示给水厂未测定该指标浓度;“NAD”表示未检出菌落。 同时,对这4座给水厂紫外-氯工艺进水水质指标进行分析,主要关注与三卤甲烷生成浓度呈正相关的高锰酸盐指数,与紫外设备运行状况密切相关的进水浊度和硬度,以及进水菌落总数等指标,分析结果见表6。另外,由于这4座给水厂皆没有前加氯装置,故工艺进水没有氯检出。
表 6 调研给水厂紫外-氯工艺进水水质Table 6. Influent quality of UV/chlorine process in water plant给水厂编号 浊度/(mg·L−1) CODMn/(mg·L−1) 硬度/(mg·L−1) 菌落总数/(cfu·mL−1) A 0.87 1.92 163 1 200 B 0.75 1.68 184 1 000 C 0.68 1.97 235 870 D 0.46 1.43 122 1 000 根据表6可知,各给水厂紫外-氯工艺进水水质相差不大,仅菌落总数指标数值略有差异,因此,为简化分析条件,后续评价时忽略各给水厂进水水质对紫外-氯工艺运行的影响。
根据1.2节所建立的技术评价体系,开展4座给水厂紫外-氯工艺运行技术效能评价。在各评价指标样本数据和标准数据量纲一化的基础上,按照公式(3)~(5)开展计算,并根据计算结果判定各给水厂出水水质级别,计算结果见表7。
表 7 给水厂紫外-氯工艺出水水质关联度计算结果Table 7. Correlative degree calculation results of water quality of effluent from UV/chlorine process in water plant给水厂编号 Ⅰ类 Ⅱ类 Ⅲ类 Ⅳ类 Ⅴ类 水质级别 A 0.380 0.605 0.822 0.721 0.478 Ⅲ类(0.6) B 0.815 1.000 0.719 0.431 0.333 Ⅱ类(0.8) C 0.446 0.955 0.736 0.452 0.333 Ⅱ类(0.8) D 0.362 0.803 1.000 0.754 0.458 Ⅲ类(0.6) 1.4 评价可靠性分析
将各给水厂工艺技术效能评价结果与实际情况进行对比分析,以验证评价结果可靠与否。各给水厂的评价结果与实际情况对比结果见表8。根据表8可知,4座给水厂紫外-氯工艺实际出水水质类别与评价结果相同,表明上述评价结果具有一定可靠性。
表 8 评价成果与实际情况的对比结果Table 8. Comparison of the evaluation results with the actual situation of the water plant给水厂编号 水质评价级别 水质实际情况 备注 A Ⅲ类(0.6) Ⅲ类(符合饮用水标准) 运行时间较短 B Ⅱ类(0.8) Ⅱ类(符合饮用水标准) 已进行多次调整 C Ⅱ类(0.8) Ⅱ类(符合饮用水标准) 已进行多次调整 D Ⅲ类(0.6) Ⅲ类(符合饮用水标准) 未做大量调试 2. 紫外-氯工艺运行成本效益评价
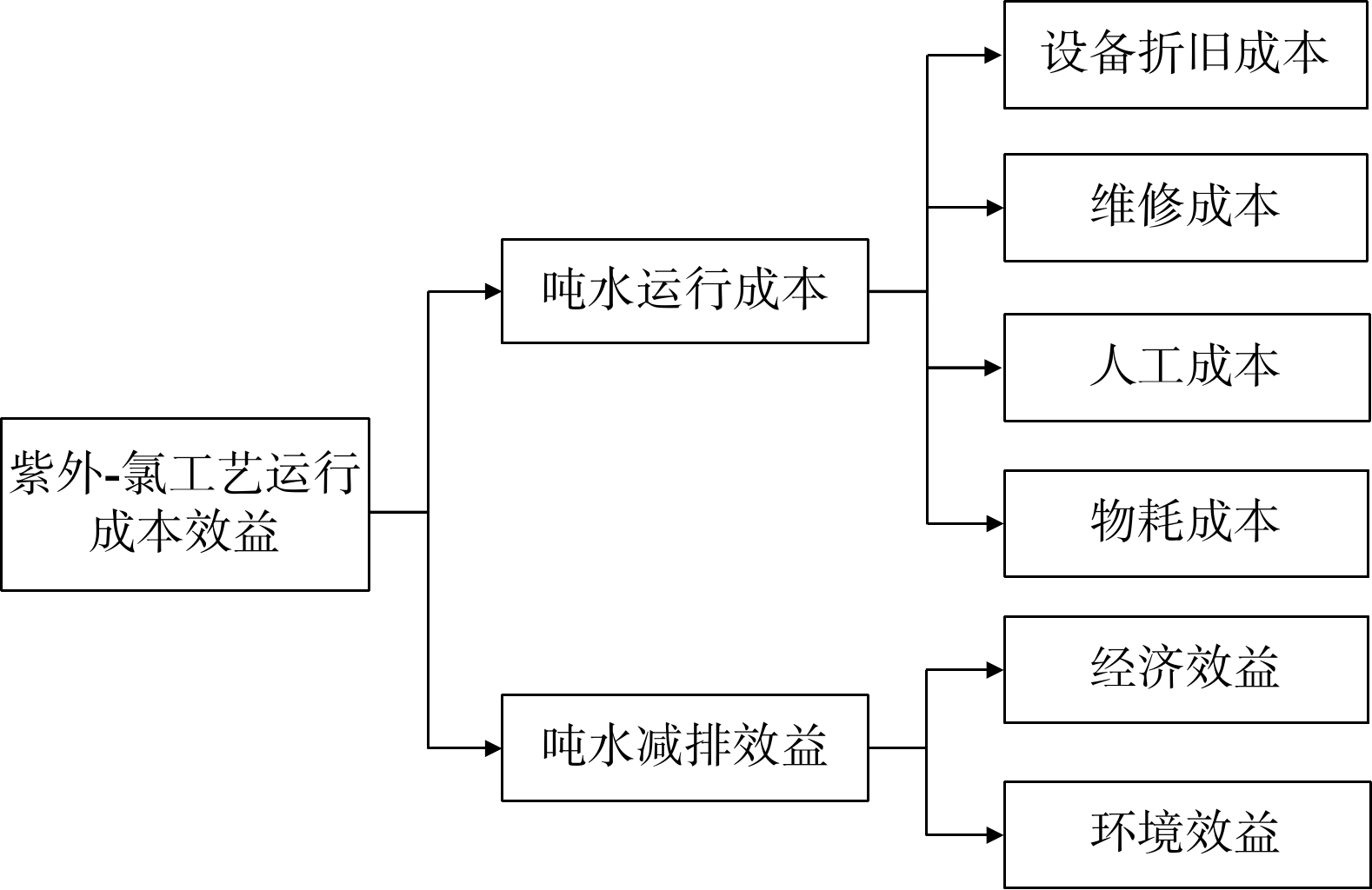
2.1 评价指标体系构建
对紫外-氯工艺运行综合效能的评价,应综合考虑工艺运行的技术效能和经济收益[11]。其中,采用技术成本效益分析法进行工艺经济收益评价,通过分析工艺总成本和总收益间的关系,以确定技术经济收益。紫外-氯工艺运行成本效益评价应综合考虑紫外-氯工艺的日常运行成本和技术采用后所带来的经济收益,通过前期调研,确定层次指标体系,如图3所示。
2.2 紫外-氯工艺费用效益分析模型的建立
1)建立运行成本效益模型。采用运行成本效益模型分析计算工艺运行成本,综合分析工艺运行产生的成本,得到工艺吨水运行成本。方案i的吨水运行成本ICi的计算公式见式(6)。
stringUtils.convertMath(!{formula.content}) (6) 式中:Di为方案i的设备折旧成本,万元,计算公式见式(7)[12];Mi为方案i的设备维修成本,万元,计算公式见式(8)[12];Li为方案i的运行人工成本,万元,计算公式见式(9)[12];Cri为方案i的吨水能耗成本,元·m−3,等于单位吨水电耗和单位吨水药耗之和,其计算皆按照“单价×数量”的计算模式进行;t为工艺总运行时间,d。其中,紫外设备的单位吨水耗电量E计算见式(10)。
stringUtils.convertMath(!{formula.content}) (7) 式中:C0为紫外氯消毒工艺的初始投资(包括工程建设费和设备购置费用),万元;n为紫外线设备折旧年限,a;R为紫外线设备的固定资产形成率,本文取95%。
stringUtils.convertMath(!{formula.content}) (8) 式中:
ϵM stringUtils.convertMath(!{formula.content}) (9) 式中:m为紫外氯消毒工艺运行维护工人数目,人;W是一个工人的年薪,万元。
stringUtils.convertMath(!{formula.content}) (10) 式中:P为紫外设备功率,kW;q为过水流量,m3·h−1。
2)减排效益模型建立。减排效益模型是根据技术采用后所带来的收益大小进行评价。与单独氯消毒工艺相比,在保证水处理效果的情况下,紫外-氯工艺所需的投氯量更少,而消毒副产物的生成浓度与投氯量之间呈线性或对数型正相关,相应的消毒副产物生成浓度也有所下降。据此综合考虑消毒副产物浓度降低带来的环境效益和投氯量减少带来的经济收益,以计算紫外-氯工艺的吨水减排效益,其具体计算公式见式(11)。
stringUtils.convertMath(!{formula.content}) (11) 式中:
IMi μ Ci 3)技术收益率计算。紫外-氯工艺的运行收益率
γ stringUtils.convertMath(!{formula.content}) (12) 2.3 成本效益评价模型的应用
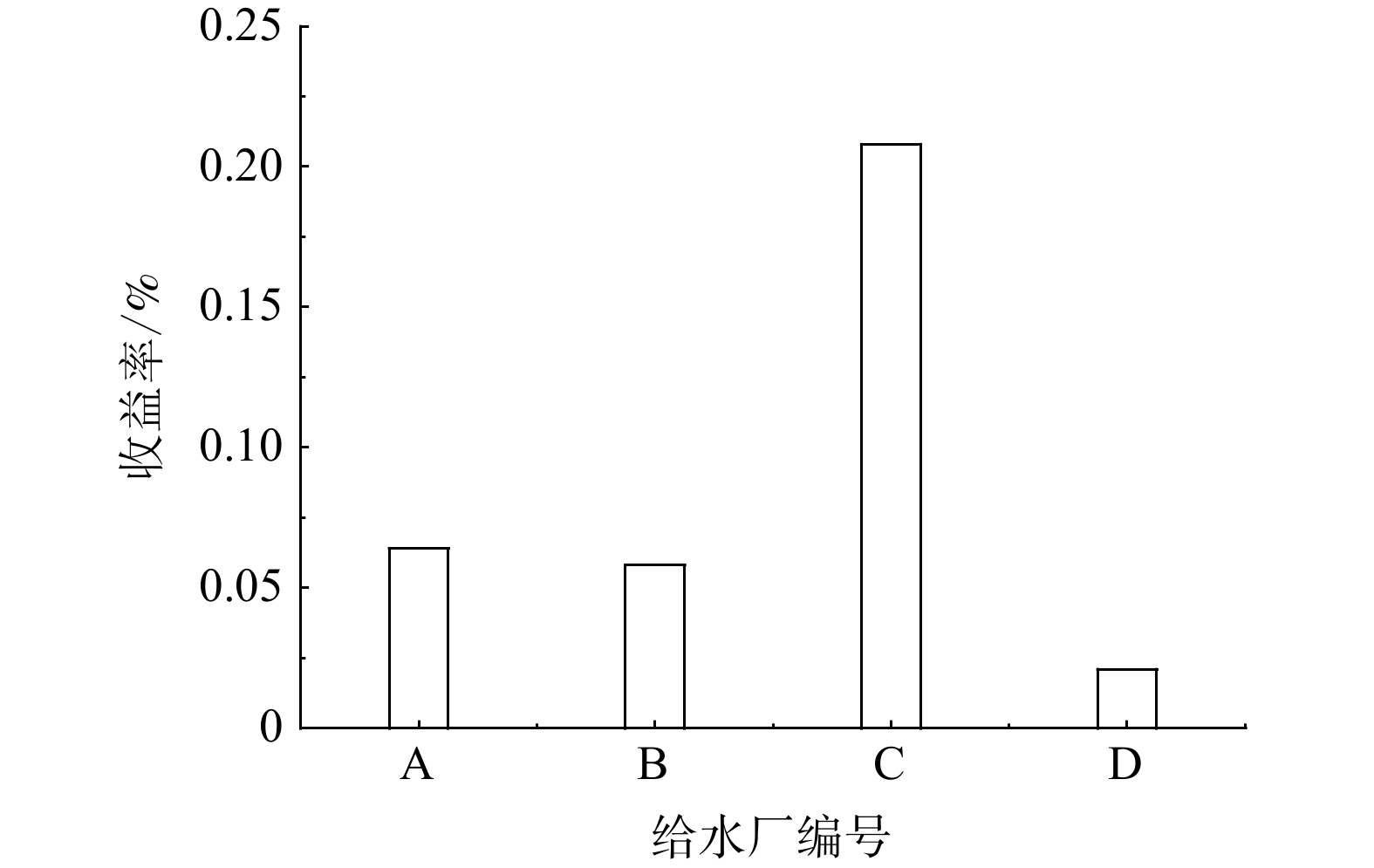
依旧选用1.3节所述的4座给水厂开展紫外-氯工艺运行成本效益分析,4座给水厂的相关经济指标数据见表9,根据公式(6)~(12)计算得到各给水厂收益率如图4所示。
表 9 紫外-氯工艺经济指标数据汇总Table 9. Summary of economic index data of UV/chlorine process给水厂编号 单台设备初始投资/万元 单台设备流量/(m3·h−1) 折旧年限/a 固定资产形成率/% 维修费用比例/% 运行维护工人数量/人 薪酬/(万元·月−1) A 450 2 600 10 95 30 12 0.45 B 550 2 400 15 95 30 6 0.43 C 550 2 800 15 95 30 8 0.35 D 300 5 000 12 95 12 9 0.45 给水厂编号 功率/kW 电费/(元·(kWh)−1) 氯消毒剂种类 药剂单价/(元·t−1) 投药量/(g·m−3) 连续运行时间/d THMs的减少排放量/(mg·L−1) A 21.0 0.695 10%次氯酸钠 1 185 18 365 0.7114 B 25.2 0.703 10%次氯酸钠 1 185 16 365 0.6794 C 30.2 0.647 液氯 2 925 1.8 365 0.7331 D 22.0 0.707 氯胺(4∶1) 3 260 5 365 0.1388 由图4可知,C厂技术收益率最佳,为0.208%,这或许是由于C厂THMs的减少排放量和氯使用减少量最大导致的。
2.4 评价可靠性分析
将评价得到的各给水厂技术收益率与实际情况进行对比分析,对比结果见表10。由表10可知,各给水厂收益率评价结果与给水厂实际情况相符,表明上述评价模型具备一定的合理性以及评价结果存在一定的可靠性。
表 10 评价结果与实际效益的对比分析Table 10. Comparative analysis of evaluation results and actual benefits of water plants给水厂编号 评价结果收益率/% 实际收益情况 A 0.064 良 B 0.058 良 C 0.208 优 D 0.021 中 3. 紫外-氯工艺运行效能综合评价
紫外-氯工艺运行效能综合评价是基于技术效能评价和技术成本效益评价的评价结果展开的,本文综合考虑工艺运行技术效能和技术经济收益,对技术运行情况进行了全面评价。
采用加权平均的方式将技术效能评价结果和技术成本效益评价结果进行综合,分别对其赋以对应权重。根据专家意见,技术效能是给水厂运行的首要关注点,经济收益在给水厂日常运行也应给予关注。因此,确定二者权重值之比为6∶4较为合理,则4座给水厂的综合评价结果如表11所示。
表 11 评价给水厂综合评价结果Table 11. Comprehensive assessment results of water plants给水厂编号 技术效能评价 收益率/% 综合评分 A Ⅲ类(0.6) 0.064 0.385 6 B Ⅱ类(0.8) 0.058 0.503 2 C Ⅱ类(0.8) 0.208 0.563 2 D Ⅲ类(0.6) 0.021 0.368 4 表11中的数据表明,C厂紫外-氯工艺综合运行效能最佳,表明该厂紫外-氯工艺运行参数设置较为合理。这主要是由于C厂工艺运行时间较长,积累了较丰富的运行经验,可以在保障出水水质的条件下实现经济收益较优。因此,该厂工艺运行参数(有效紫外消毒剂量为42.8 mJ·cm−2,有效氯投加量为1.8 mg·L−1)可为紫外-氯工艺在其他厂的运行提供参考。
4. 结论
1)基于灰色聚类关联模型建立了紫外-氯工艺运行技术效能评价模型,并将所建模型用于A、B、C、D 4座给水厂技术效能评价,在排除进水水质对工艺运行效果和紫外设备运行的影响下,最终得到B、C厂工艺出水水质较佳,水质类别为Ⅱ类。然后,将评价结果与实际水质情况进行对比分析,初步验证了技术效能评价模型的合理性。
2)基于技术成本效益模型建立了紫外-氯工艺运行技术经济收益评价模型,同时将所建模型用于A、B、C、D 4座给水厂经济收益评价,得到C厂经济收益率最佳,为0.208%。将评价结果与工艺实际收益情况进行了对比分析,结果表明,技术经济收益模型具有一定可靠性。
3)综合考虑紫外-氯工艺运行技术效能和经济收益,对前述评价结果进行了综合分析。结果表明:在不考虑进水水质影响的情况下,C厂紫外-氯工艺运行综合效能最佳,可以在满足工艺效能最佳时保证经济收益较优,因此,其他厂在工艺进水水质相近的情况下,可参考C厂工艺的运行参数(有效紫外消毒剂量为42.8 mJ·cm−2,有效氯投加量为1.8 mg·L−1)进行调试运行。
-
表 1 我国菜地表层土壤抗生素检出浓度
Table 1. Antibiotic concentrations in the surface soil of vegetable fields in China
地理区域Geographic area 省份Provinces 调查地点Investigation sites 抗生素含量/(μg·kg−1)Antibiotic content 参考文献References ∑TCs ∑SAs ∑QNs SUM 华南地区South China 广东省Guangdong Province 珠三角The Pearl River Delta Area 242.6 321.4 1537.4 2101.4 [3] 84.8 9 — 93.8 [32] 佛山市Foshan 4.24 — 17.83 22.07 中山市Zhongshan 14 — — 14 东莞市Dongguan 15.4 0.96 50.23 66.59 广州市Guangzhou 27.48 1.53 55.81 84.82 [33] 37.1 96.2 — 133.3 [34] — — 48.85 48.85 [35] 西南地区Southwest China 云南省Yunnan Province 昆明市Kunming 19.9 0.2 15.2 35.3 [23] 重庆市Chongqing 重庆Chongqing 79.81 — — 79.81 [19] 9.36 2.564 29.83 41.754 [27] 贵州省Guizhou Province 贵阳市Guiyang 5.07 0.62 5.28 10.97 [36] 1.52 0.62 5.28 7.42 [15] 三峡库区the Three Gorges Reservoir 53.3 99.2 75.9 228.4 [37] 华东地区East China 安徽省Anhui Province 安庆市Anqing 31.9 — — 31.9 [38] 合肥市Hefei — 4.59 — 4.59 [39] 上海市Shanghai 上海Shanghai 17.1 7.6 62.5 87.2 [23] 江苏省Jiangsu Province 徐州市Xuzhou 460.8 6.6 54.1 521.5 南京市Nanjing 64.5 10.2 38.5 113.2 黄淮海平原Huang-Huai-Hai Plain 24.01 0.03 16.32 40.36 [40] 浙江省Zhejiang Province 宁波市Ningbo 41.43 0.07 8.97 50.47 [41] 长三角Yangtze River Delta 27.03 3.25 42.67 72.95 [42] 山东省Shandong Province 135.664 32.866 — 168.53 [43] 274 3.91 73.05 350.96 [44] 华中地区Central China 河南省Henan Province 723.42 0.61 0.1 724.13 [45] 华北地区North China 北京Beijing 北京Beijing 103.58 13.41 7.35 124.34 [46] 102 1.1 86 189.1 [47] 河北省Hebei Province 石家庄市Shijiazhuang — — 170.775 170.775 [48] 西北地区Northwest China 宁夏省Ningxia Province 银川市Yinchuan 462.24 — — 462.24 [10] 陕西省Shaanxi Province 杨凌市Yangling 12.77 1.14 51.76 65.67 [49] 甘肃省Gansu Province — 201.676 — 201.676 [50] 东北地区Northeast China 黑龙江省Heilongjiang Province 哈尔滨市Harbin 181.74 — — 181.74 [51] 河北、河南、四川和江苏省Hebei, Henan, Sichuan and Jiangsu Province 82.75 2.61 12.78 98.14 [52] — ,未检测;TCs,四环素类;SAs,磺胺类;QNs,喹诺酮类. — , non-detection; TCs, tetracyclines; SAs, sulfonamides; QNs, quinolones. 蔬菜Types of vegetables 抗生素Types of antibiotics 抗生素含量/(μg·kg−1)Antibiotic content 根Root 茎Stem 叶Leaves 萝卜Radish TCs 8.3 22.1 24.4—76.4 SAs 0.1—0.4 0.2—0.5 0.2—0.6 CAPs ND. 1.4—3.4 8—30 QNs ND. 0.5 0.8—1.6 LINs 0.9—3.1 1.5—3.9 1.4—5.4 油菜Rape TCs ND. — 61.1—192.1 SAs 0.1—0.5 — 0.5—1.4 CAPs ND. — 0.7 FQs ND. — 0.7—2.1 LINs 0.5—3.5 — 0.7—3.2 芹菜Celery TCs — 1.0—2.4 15.7 SAs — 0.1—0.3 0.3—0.7 FQs — 0.5—1.9 2.8—4.7 LINs — 1.2—5.1 5—20 香菜Coriander TCs 128.2—690.1 — 133.9—867.6 SAs 0.1—0.5 — 0.5—1.3 FQs ND. — 0.7—3.5 LINs 0.4—2.4 — 0.8—3.8 小白菜Chinese white cabbage TCs ND. — 5.5 QNs 5.9 — 9.6 CAPs ND. — 2.6 SAs 0.8 — ND. 空心菜Water spinach TCs 4.8 — 6.3 QNs 16.9 — 21.8 CAPs 3 — 10.1 SAs 1.7 — ND. —,未检测;ND.,未检测出;TCs,四环素类;SAs,磺胺类;CAPs,氯霉素类;QNs,喹诺酮类;LINs,林可酰胺类;FQs,氟喹诺酮类. —, non-detection; ND., not detected; TCs, tetracyclines; SAs, sulfonamides; CAPs, chloramphenicols; QNs, quinolones; Lins, lincolamide; FQs, fluoroquinolones. -
[1] SARMAH A K, MEYER M T, BOXALL A B A. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment[J]. Chemosphere, 2006, 65(5): 725-759. doi: 10.1016/j.chemosphere.2006.03.026 [2] THIELE-BRUHN S. Pharmaceutical antibiotic compounds in soils–a review[J]. Journal of Plant Nutrition and Soil Science, 2003, 166(2): 145-167. doi: 10.1002/jpln.200390023 [3] LI Y W, WU X L, MO C H, et al. Investigation of sulfonamide, tetracycline, and quinolone antibiotics in vegetable farmland soil in the Pearl River Delta area, Southern China[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 7268-7276. doi: 10.1021/jf1047578 [4] MIGLIORE L, CIVITAREALE C, BRAMBILLA G, et al. Effects of sulphadimethoxine on cosmopolitan weeds (Amaranthus retroflexus L. , Plantago major L. and Rumex acetosella L. ) [J]. Agriculture, Ecosystems & Environment, 1997, 65(2): 163-168. [5] 吴小莲, 向垒, 莫测辉, 等. 长期施用粪肥蔬菜基地蔬菜中典型抗生素的污染特征[J]. 环境科学, 2013, 34(6): 2442-2447. WU X L, XIANG L, MO C H, et al. Concentrations of antibiotics in vegetables from manure-mended farm[J]. Environmental Science, 2013, 34(6): 2442-2447 (in Chinese).
[6] HU X G, ZHOU Q X, LUO Y. Occurrence and source analysis of typical veterinary antibiotics in manure, soil, vegetables and groundwater from organic vegetable bases, Northern China[J]. Environmental Pollution, 2010, 158(9): 2992-2998. doi: 10.1016/j.envpol.2010.05.023 [7] 张世昌, 吴凌云. 福建省规模种植户4种主要农作物施肥现状调查与分析[J]. 福建农业科技, 2018(10): 36-39. ZHANG S C, WU L Y. Investigation and analysis on fertilization status of four main crops of large-scale planters in Fujian Province[J]. Fujian Agricultural Science and Technology, 2018(10): 36-39 (in Chinese).
[8] WU X L, XIANG L, YAN Q Y, et al. Distribution and risk assessment of quinolone antibiotics in the soils from organic vegetable farms of a subtropical city, Southern China[J]. Science of the Total Environment, 2014, 487: 399-406. doi: 10.1016/j.scitotenv.2014.04.015 [9] ZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. [10] 张小红, 陶红, 王亚娟, 等. 银川市农田土壤中四环素类抗生素的污染特征及生态风险评估[J]. 环境科学, 2021, 42(10): 4933-4941. ZHANG X H, TAO H, WANG Y J, et al. Pollution characteristics and risk assessment of tetracycline antibiotics in farmland soil in Yinchuan[J]. Environmental Science, 2021, 42(10): 4933-4941 (in Chinese).
[11] LI Y X, ZHANG X L, LI W, et al. The residues and environmental risks of multiple veterinary antibiotics in animal faeces[J]. Environmental Monitoring and Assessment, 2013, 185(3): 2211-2220. doi: 10.1007/s10661-012-2702-1 [12] PAN M, WONG C K C, CHU L M. Distribution of antibiotics in wastewater-irrigated soils and their accumulation in vegetable crops in the Pearl River Delta, Southern China[J]. Journal of Agricultural and Food Chemistry, 2014, 62(46): 11062-11069. doi: 10.1021/jf503850v [13] BOXALL A B A. The environmental side effects of medication: how are human and veterinary medicines in soils and water bodies affecting human and environmental health?[J]. EMBO Journal, 2004, 5(12): 1110-1116. doi: 10.1038/sj.embor.7400307 [14] 厉文辉, 史亚利, 高立红, 等. 污灌区土壤中抗生素污染水平及分布特征研究 [C]//中国化学会第29届学术年会摘要集——第20分会: 环境与健康. 北京, 2014: 74. LI W H, SHI Y L, GAO L H, et al. Occurrence and distribution of antibiotics in soils from wastewater irrigated farmlands [C] // The 29th annual meeting of the Chinese chemical society. Abstracts of the 29th annual meeting of the Chinese Chemical Society. Beijing: the 29th annual meeting of the Chinese Chemical Society, 2014: 74 (in Chinese).
[15] 刘艳萍, 刘鸿雁, 吴龙华, 等. 贵阳市某蔬菜地养殖废水污灌土壤重金属、抗生素复合污染研究[J]. 环境科学学报, 2017, 37(3): 1074-1082. LIU Y P, LIU H Y, WU L H, et al. Co-contamination of heavy metals and antibiotics in soils under husbandry wastewater irrigation in Guiyang City[J]. Acta Scientiae Circumstantiae, 2017, 37(3): 1074-1082 (in Chinese).
[16] ZHAO L, DONG Y H, WANG H. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J]. Science of the Total Environment, 2010, 408(5): 1069-1075. doi: 10.1016/j.scitotenv.2009.11.014 [17] 徐秋桐, 顾国平, 章明奎. 有机肥对土壤中抗生素降解的促进作用[J]. 浙江农业学报, 2015, 27(3): 417-422. XU Q T, GU G P, ZHANG M K. Promoting antibiotics degradation via application of organic fertilizers[J]. Acta Agriculturae Zhejiangensis, 2015, 27(3): 417-422 (in Chinese).
[18] ZHANG Y, HU S Q, ZHANG H C, et al. Degradation kinetics and mechanism of sulfadiazine and sulfamethoxazole in an agricultural soil system with manure application[J]. Science of the Total Environment, 2017, 607/608: 1348-1356. doi: 10.1016/j.scitotenv.2017.07.083 [19] 彭秋, 王卫中, 徐卫红. 重庆市畜禽粪便及菜田土壤中四环素类抗生素生态风险评价[J]. 环境科学, 2020, 41(10): 4757-4766. PENG Q, WANG W Z, XU W H. Ecological risk assessment of tetracycline antibiotics in livestock manure and vegetable soil of Chongqing[J]. Environmental Science, 2020, 41(10): 4757-4766 (in Chinese).
[20] 罗凯, 李文红, 章海波, 等. 南京典型设施菜地有机肥和土壤中四环素类抗生素的污染特征调查[J]. 土壤, 2014, 46(2): 330-338. LUO K, LI W H, ZHANG H B, et al. Pollution characteristics of tetracycline antibiotics in typical protected vegetable organic fertilizer of Nanjing city[J]. Soils, 2014, 46(2): 330-338 (in Chinese).
[21] MCEACHRAN A D, BLACKWELL B R, HANSON J D, et al. Antibiotics, bacteria, and antibiotic resistance genes: aerial transport from cattle feed yards via particulate matter[J]. Environmental Health Perspectives, 2015, 123(4): 337-343. doi: 10.1289/ehp.1408555 [22] 成玉婷, 吴小莲, 向垒, 等. 广州市典型有机蔬菜基地土壤中磺胺类抗生素污染特征及风险评价[J]. 中国环境科学, 2017, 37(3): 1154-1161. CHENG Y T, WU X L, XIANG L, et al. Distribution and risk assessment of sulfonamide antibiotics in soil from organic vegetable farms in Guangzhou[J]. China Environmental Science, 2017, 37(3): 1154-1161 (in Chinese).
[23] ZHANG H B, ZHOU Y, HUANG Y J, et al. Residues and risks of veterinary antibiotics in protected vegetable soils following application of different manures[J]. Chemosphere, 2016, 152: 229-237. doi: 10.1016/j.chemosphere.2016.02.111 [24] FANG H, HAN Y L, YIN Y M, et al. Variations in dissipation rate, microbial function and antibiotic resistance due to repeated introductions of manure containing sulfadiazine and chlortetracycline to soil[J]. Chemosphere, 2014, 96: 51-56. doi: 10.1016/j.chemosphere.2013.07.016 [25] PAN M, CHU L M. Leaching behavior of veterinary antibiotics in animal manure-applied soils[J]. Science of the Total Environment, 2017, 579: 466-473. doi: 10.1016/j.scitotenv.2016.11.072 [26] 提清清, 高增文, 季慧慧, 等. 抗生素在土壤中的吸附行为研究进展[J]. 土壤, 2017, 49(3): 437-445. TI Q Q, GAO Z W, JI H H, et al. Adsorption of antibiotics in soils: A review[J]. Soils, 2017, 49(3): 437-445 (in Chinese).
[27] 方林发, 叶苹苹, 方标, 等. 重庆开州区菜地土壤抗生素污染特征及潜在生态环境风险评估[J]. 环境科学, 2022, 43(11): 5244-5252. FANG L F, YE P P, FANG B, et al. Pollution characteristics and ecological risk assessment of antibiotics in vegetable field in Kaizhou, Chongqing[J]. Environmental Science, 2022, 43(11): 5244-5252 (in Chinese).
[28] TANG X, LOU C, WANG S, et al. Effects of long-term manure applications on the occurrence of antibiotics and antibiotic resistance genes (ARGs) in paddy soils: Evidence from four field experiments in south of China [J]. Soil Biology and Biochemistry, 2015, 90: 179-187. doi: 10.1016/j.soilbio.2015.07.027 [29] TASHO R P, CHO J Y. Veterinary antibiotics in animal waste, its distribution in soil and uptake by plants: A review[J]. Science of the Total Environment, 2016, 563/564: 366-376. doi: 10.1016/j.scitotenv.2016.04.140 [30] TOLLS J. Sorption of veterinary pharmaceuticals in soils: A review[J]. Environmental Science & Technology, 2001, 35(17): 3397-3406. [31] WANG Q Q, BRADFORD S A, ZHENG W, et al. Sulfadimethoxine degradation kinetics in manure as affected by initial concentration, moisture, and temperature[J]. Journal of Environmental Quality, 2006, 35(6): 2162-2169. doi: 10.2134/jeq2006.0178 [32] 李彦文, 莫测辉, 赵娜, 等. 菜地土壤中磺胺类和四环素类抗生素污染特征研究[J]. 环境科学, 2009, 30(6): 1762-1766. doi: 10.3321/j.issn:0250-3301.2009.06.035 LI Y W, MO C H, ZHAO N, et al. Investigation of sulfonamides and tetracyclines antibiotics in soils from various vegetable fields[J]. Environmental Science, 2009, 30(6): 1762-1766 (in Chinese). doi: 10.3321/j.issn:0250-3301.2009.06.035
[33] 刘彩媚, 林泳欣, 谢晓仪, 等. 广州市城-郊梯度上典型蔬菜地土壤抗生素污染研究[J]. 广东农业科学, 2019, 46(6): 59-67. doi: 10.16768/j.issn.1004-874X.2019.06.009 LIU C M, LIN Y X, XIE X Y, et al. Study on antibiotic pollution in soils of typical vegetable fields along an urban-suburban gradient in Guangzhou[J]. Guangdong Agricultural Sciences, 2019, 46(6): 59-67 (in Chinese). doi: 10.16768/j.issn.1004-874X.2019.06.009
[34] 赵娜. 珠三角地区典型菜地土壤抗生素污染特征研究 [D]. 广州: 暨南大学, 2007. ZHAO N. The study of antibiotics in the soil of typical vegetable fields in pearl river delta [D]. Guangzhou: Jinan University, 2007 (in Chinese).
[35] 邰义萍. 珠三角地区蔬菜基地土壤中典型抗生素的污染特征研究 [D]. 广州: 暨南大学, 2010. TAI Y P. The study on pollution characteristics of typical antibiotics in soil from vegetable fields of pearl river delta area [D]. Guangzhou: Jinan University, 2010 (in Chinese).
[36] 刘艳萍. 养殖废水污染土壤抗生素、重金属复合污染及植物修复 [D]. 贵阳: 贵州大学, 2016. LIU Y P. Co-contamination of heavy metals and antibiotics in soils under husbandry wastewater irrigation and phytoremediation [D]. Guiyang: Guizhou University, 2016 (in Chinese).
[37] 徐晨. 三峡库区水体、土壤和沉积物中抗生素与抗生素抗性基因的污染特征 [D]. 武汉: 中国科学院武汉植物园, 2017. XU C. Contamination of antibiotic and antibiotic resistance genes in water, soil and sediment of the three gorges reservoir [D]. Wuhan: Wuhan Botanical Garden, Chinese Academy of Sciences, 2017 (in Chinese).
[38] CHEN H Y, ZHENG W F, SHEN X M, et al. Occurrence, distribution, and ecological risk assessment of antibiotics in different environmental media in Anqing, Anhui Province, China[J]. International Journal of Environmental Research and Public Health, 2021, 18(15): 8112. doi: 10.3390/ijerph18158112 [39] 陈海燕, 花日茂, 李学德, 等. 不同类型菜地土壤中3种磺胺类抗生素污染特征研究[J]. 安徽农业科学, 2011, 39(23): 14224-14226, 14229. CHEN H Y, HUA R M, LI X D, et al. Study on pollution characteristic of three sulfonamides antibiotics in different soils of vegetable plot[J]. Journal of Anhui Agricultural Sciences, 2011, 39(23): 14224-14226, 14229 (in Chinese).
[40] PAN Z, YANG S D, ZHAO L X, et al. Temporal and spatial variability of antibiotics in agricultural soils from Huang-Huai-Hai Plain, Northern China[J]. Chemosphere, 2021, 272: 129803. doi: 10.1016/j.chemosphere.2021.129803 [41] 赵方凯, 陈利顶, 杨磊, 等. 长三角典型城郊不同土地利用土壤抗生素组成及分布特征[J]. 环境科学, 2017, 38(12): 5237-5246. ZHAO F K, CHEN L D, YANG L, et al. Composition and distribution of antibiotics in soils with different land use types in a typical peri-urban area of the Yangtze River Delta[J]. Environmental Science, 2017, 38(12): 5237-5246 (in Chinese).
[42] 李文. 长三角农田土壤中crAssphage与抗生素抗性基因共存关系研究 [D]. 杭州: 浙江大学, 2021. LI W. Co-occurrence of crAssphage and antibiotic resistance genes in agricultural soils of the Yangtze River delta [D]. Hangzhou: Zhejiang University, 2021 (in Chinese).
[43] 赵祥. 施用粪肥的设施菜地土壤中抗生素及抗性基因多样性及丰度的研究 [D]. 泰安: 山东农业大学, 2017. ZHAO X. Diversity and abundance of antibiotics and ARGs in vegetable soil with manure application [D]. Taian: Shandong Agricultural University, 2017 (in Chinese).
[44] 尹春艳, 骆永明, 滕应, 等. 典型设施菜地土壤抗生素污染特征与积累规律研究[J]. 环境科学, 2012, 33(8): 2810-2816. YIN C Y, LUO Y M, TENG Y, et al. Pollution characteristics and accumulation of antibiotics in typical protected vegetable soils[J]. Environmental Science, 2012, 33(8): 2810-2816 (in Chinese).
[45] 张凤丽. 某冶炼厂周围农田土壤中抗生素抗性基因分布及其影响因素 [D]. 郑州: 郑州大学, 2018. ZHANG F L. The distribution of antibiotic resistance genes and its influencing factors in agricultural soil nearby a smelting plant [D]. Zhengzhou: Zhengzhou University, 2018 (in Chinese).
[46] 王佳佳. 北京地区蔬菜土壤抗生素抗性基因分布特征的研究 [D]. 吉林: 东北电力大学, 2016. WANG J J. Research on distribution of antibiotic resistance genes in vegetable soils in Beijing [D]. Jilin: Northeast Dianli University, 2016 (in Chinese).
[47] LI C, CHEN J Y, WANG J H, et al. Occurrence of antibiotics in soils and manures from greenhouse vegetable production bases of Beijing, China and an associated risk assessment[J]. Science of the Total Environment, 2015, 521/522: 101-107. doi: 10.1016/j.scitotenv.2015.03.070 [48] 赵鑫宇, 剧泽佳, 陈慧, 等. 石家庄市土壤中喹诺酮类抗生素空间分布特征及其与微生物群落相关性[J]. 环境科学, 2022, 43(9): 4684-4696. ZHAO X Y, JU Z J, CHEN H, et al. Spatial distribution of quinolone antibiotics and its correlation relationship with microbial community in soil of Shijiazhuang city[J]. Environmental Science, 2022, 43(9): 4684-4696 (in Chinese).
[49] 李国秀, 崔利辉, 刘颖沙. 陕西省杨凌区蔬菜基地土壤中抗生素污染评价[J]. 农业工程, 2021, 11(7): 41-46. LI G X, CUI L H, LIU Y S. Evaluation of antibiotic pollution in soil of vegetable base in Yangling district, Shaanxi Province[J]. Agricultural Engineering, 2021, 11(7): 41-46 (in Chinese).
[50] 谢超然. 干旱区设施菜地土壤磺胺类抗生素污染特征及吸附行为初步研究 [D]. 兰州: 兰州大学, 2017. XIE C R. Preliminary study on sulfonamides pollution characteristics and adsorption behavior in arid oasis soil [D]. Lanzhou: Lanzhou University, 2017 (in Chinese).
[51] 郎朗, 狄静波, 王戈, 等. 哈尔滨市蔬菜基地四环素类抗生素的污染现状[J]. 环境科学与技术, 2018, 41(8): 153-159. LANG L, DI J B, WANG G, et al. Study on the tetracycline antibiotics pollution in soil of vegetable bases in Harbin[J]. Environmental Science & Technology, 2018, 41(8): 153-159 (in Chinese).
[52] WEI R C, HE T, ZHANG S X, et al. Occurrence of seventeen veterinary antibiotics and resistant bacterias in manure-fertilized vegetable farm soil in four provinces of China[J]. Chemosphere, 2019, 215: 234-240. doi: 10.1016/j.chemosphere.2018.09.152 [53] MIGLIORE L, COZZOLINO S, FIORI M. Phytotoxicity to and uptake of enrofloxacin in crop plants[J]. Chemosphere, 2003, 52(7): 1233-1244. doi: 10.1016/S0045-6535(03)00272-8 [54] 丁丹, 黄晓依, 顾静仪, 等. 畜禽粪肥还田四环素类抗生素(TCs)在土壤-蔬菜系统的分布特征及风险评估 [J]. 环境科学,2023, 44(8): 4440-4447. DING D, HUANG X Y, GU J Y, et al. Distribution Characteristics and Risk Assessment of Tetracycline Antibiotics (TCs) in Soil-Vegetable System with Soil Fertilized with Animal Manure [J]. Environmental Science, 2023, 44(8): 4440-4447(in Chinese) .
[55] KANG D H, GUPTA S, ROSEN C, et al. Antibiotic uptake by vegetable crops from manure-applied soils[J]. Journal of Agricultural and Food Chemistry, 2013, 61(42): 9992-10001. doi: 10.1021/jf404045m [56] LI X W, XIE Y F, LI C L, et al. Investigation of residual fluoroquinolones in a soil–vegetable system in an intensive vegetable cultivation area in Northern China[J]. Science of the Total Environment, 2014, 468/469: 258-264. doi: 10.1016/j.scitotenv.2013.08.057 [57] BOXALL A B A, JOHNSON P, SMITH E J, et al. Uptake of veterinary medicines from soils into plants[J]. Journal of Agricultural and Food Chemistry, 2006, 54(6): 2288-2297. doi: 10.1021/jf053041t [58] EGGEN T, ASP T N, GRAVE K, et al. Uptake and translocation of metformin, ciprofloxacin and narasin in forage- and crop plants[J]. Chemosphere, 2011, 85(1): 26-33. doi: 10.1016/j.chemosphere.2011.06.041 [59] TANOUE R, SATO Y, MOTOYAMA M, et al. Plant uptake of pharmaceutical chemicals detected in recycled organic manure and reclaimed wastewater[J]. Journal of Agricultural and Food Chemistry, 2012, 60(41): 10203-10211. doi: 10.1021/jf303142t [60] MIGLIORE L, CIVITAREALE C, COZZOLINO S, et al. Laboratory models to evaluate phytotoxicity of sulphadimethoxine on terrestrial plants[J]. Chemosphere, 1998, 37(14/15): 2957-2961. [61] SIMONICH S L, HITES R A. Organic pollutant accumulation in vegetation[J]. Environmental Science & Technology, 1995, 29(12): 2905-2914. [62] PAN M, CHU L M. Fate of antibiotics in soil and their uptake by edible crops[J]. Science of the Total Environment, 2017, 599/600: 500-512. doi: 10.1016/j.scitotenv.2017.04.214 [63] MILLER E L, NASON S L, KARTHIKEYAN K G, et al. Root uptake of pharmaceuticals and personal care product ingredients[J]. Environmental Science & Technology, 2016, 50(2): 525-541. [64] MIGLIORE L, BRAMBILLA G, COZZOLINO S, et al. Effect on plants of sulphadimethoxine used in intensive farming (Panicum miliaceum, Pisum sativum and Zea mays) [J]. Agriculture, Ecosystems & Environment, 1995, 52(2/3): 103-110. [65] LILLENBERG M, LITVIN S V, NEI L, et al. Enrofloxacin and ciprofloxacin uptake by plants from soil[J]. Agronomy Research, 2010, 8(1): 807-814. [66] 汪勇, 林先贵, 王一明, 等. 长期施用粪肥对农田土壤中细菌四环素抗性水平的影响[J]. 安徽农业科学, 2008, 36(14): 5944-5945, 5947. doi: 10.3969/j.issn.0517-6611.2008.14.108 WANG Y, LIN X G, WANG Y M, et al. Effects of long-term application of manure on bacteria resistance level to tetracycline in farmland soil[J]. Journal of Anhui Agricultural Sciences, 2008, 36(14): 5944-5945, 5947 (in Chinese). doi: 10.3969/j.issn.0517-6611.2008.14.108
[67] HEUER H, SOLEHATI Q, ZIMMERLING U, et al. Accumulation of sulfonamide resistance genes in arable soils due to repeated application of manure containing sulfadiazine[J]. Applied and Environmental Microbiology, 2011, 77(7): 2527-2530. doi: 10.1128/AEM.02577-10 [68] BATCHELDER A R. Chlortetracycline and oxytetracycline effects on plant growth and development in soil systems[J]. Journal of Environmental Quality, 1982, 11(4): 675-678. [69] McMANUS P S, STOCKWELL V O, SUNDIN G W, et al. Antibiotic use in plant agriculture[J]. Annual Review of Phytopathology, 2002, 40: 443-465. doi: 10.1146/annurev.phyto.40.120301.093927 [70] 金彩霞, 陈秋颖, 刘军军, 等. 两种常用兽药对作物发芽的生态毒性效应[J]. 环境科学学报, 2009, 29(3): 619-625. JIN C X, CHEN Q Y, LIU J J, et al. The Eco-toxicological effect of two common veterinary drugs on crop germination[J]. Acta Scientiae Circumstantiae, 2009, 29(3): 619-625 (in Chinese).
[71] BELLINO A, LOFRANO G, CAROTENUTO M, et al. Antibiotic effects on seed germination and root development of tomato (Solanum lycopersicum L. )[J]. Ecotoxicology and Environmental Safety, 2018, 148: 135-141. doi: 10.1016/j.ecoenv.2017.10.006 [72] AN J, ZHOU Q X, SUN F H, et al. Ecotoxicological effects of paracetamol on seed germination and seedling development of wheat (Triticum aestivum L. )[J]. Journal of Hazardous Materials, 2009, 169(1/2/3): 751-757. [73] PAN M, CHU L M. Phytotoxicity of veterinary antibiotics to seed germination and root elongation of crops[J]. Ecotoxicology and Environmental Safety, 2016, 126: 228-237. doi: 10.1016/j.ecoenv.2015.12.027 [74] ZHAO F K, YANG L, LI G, et al. Veterinary antibiotics can reduce crop yields by modifying soil bacterial community and earthworm population in agro-ecosystems[J]. Science of the Total Environment, 2022, 808: 152056. doi: 10.1016/j.scitotenv.2021.152056 [75] BRAIN R A, HANSON M L, SOLOMON K R, et al. Aquatic plants exposed to pharmaceuticals: Effects and risks[J]. Reviews of Environmental Contamination and Toxicology, 2008, 192: 67-115. [76] KÜMMERER K. Antibiotics in the aquatic environment–A review–Part I[J]. Chemosphere, 2009, 75(4): 417-434. doi: 10.1016/j.chemosphere.2008.11.086 [77] OPRIŞ O, SORAN M L, COMAN V, et al. Determination of some frequently used antibiotics in waste waters using solid phase extraction followed by high performance liquid chromatography with diode array and mass spectrometry detection[J]. Central European Journal of Chemistry, 2013, 11(8): 1343-1351. [78] ARISTILDE L, MELIS A, SPOSITO G. Inhibition of photosynthesis by a fluoroquinolone antibiotic[J]. Environmental Science &Technology, 2010, 44(4): 1444-1450. [79] BASSET G J C, QUINLIVAN E P, GREGORY J F, et al. Folate synthesis and metabolism in plants and prospects for biofortification[J]. Crop Science, 2005, 45(2): 449-453. doi: 10.2135/cropsci2005.0449 [80] BOXALL A B A, BLACKWELL P, CAVALLO R, et al. The sorption and transport of a sulphonamide antibiotic in soil systems[J]. Toxicology Letters, 2002, 131(1/2): 19-28. [81] BAGUER A J, JENSEN J, KROGH P H. Effects of the antibiotics oxytetracycline and tylosin on soil fauna[J]. Chemosphere, 2000, 40(7): 751-757. doi: 10.1016/S0045-6535(99)00449-X [82] LI Y S, HU Y X, AI X J, et al. Acute and sub-acute effects of enrofloxacin on the earthworm species Eisenia fetida in an artificial soil substrate[J]. European Journal of Soil Biology, 2015, 66: 19-23. doi: 10.1016/j.ejsobi.2014.11.004 [83] ZHU D, AN X L, CHEN Q L, et al. Antibiotics disturb the microbiome and increase the incidence of resistance genes in the gut of a common soil collembolan[J]. Environmental Science & Technology, 2018, 52(5): 3081-3090. [84] 李进. 跳虫(弹尾纲)不同生物水平特征对农田重金属和抗生素类污染响应的毒理学研究 [D]. 上海: 华东师范大学, 2019. LI J. Toxicological study on response of different biological level characteristics of collembolan(Collembola) to heavy metals in farmland and antibiotics pollution [D]. Shanghai: East China Normal University, 2019 (in Chinese).
[85] DONG L X, GAO J, XIE X J, et al. DNA damage and biochemical toxicity of antibiotics in soil on the earthworm Eisenia fetida[J]. Chemosphere, 2012, 89(1): 44-51. doi: 10.1016/j.chemosphere.2012.04.010 [86] WANG C R, RONG H, LIU H T, et al. Detoxification mechanisms, defense responses, and toxicity threshold in the earthworm Eisenia foetida exposed to ciprofloxacin-polluted soils[J]. Science of the Total Environment, 2018, 612: 442-449. doi: 10.1016/j.scitotenv.2017.08.120 [87] MITTLER R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410. doi: 10.1016/S1360-1385(02)02312-9 [88] FIERER N. Embracing the unknown: Disentangling the complexities of the soil microbiome[J]. Nature Reviews Microbiology, 2017, 15(10): 579-590. doi: 10.1038/nrmicro.2017.87 [89] HALLING-SØRENSEN B, NORS NIELSEN S, LANZKY P F, et al. Occurrence, fate and effects of pharmaceutical substances in the environment- A review[J]. Chemosphere, 1998, 36(2): 357-393. doi: 10.1016/S0045-6535(97)00354-8 [90] JJEMBA P K. The potential impact of veterinary and human therapeutic agents in manure and biosolids on plants grown on arable land: A review [J]. Agriculture, Ecosystems & Environment, 2002, 93(1/2/3): 267-278. [91] GIRARDI C, GREVE J, LAMSHÖFT M, et al. Biodegradation of ciprofloxacin in water and soil and its effects on the microbial communities[J]. Journal of Hazardous Materials, 2011, 198: 22-30. doi: 10.1016/j.jhazmat.2011.10.004 [92] VACLAVIK E, HALLING-SØRENSEN B, INGERSLEV F. Evaluation of manometric respiration tests to assess the effects of veterinary antibiotics in soil[J]. Chemosphere, 2004, 56(7): 667-676. doi: 10.1016/j.chemosphere.2004.02.018 [93] CYCOŃ M, MROZIK A, PIOTROWSKA-SEGET Z. Antibiotics in the soil environment-degradation and their impact on microbial activity and diversity[J]. Frontiers in Microbiology, 2019, 10: 338. doi: 10.3389/fmicb.2019.00338 [94] HAMMESFAHR U, HEUER H, MANZKE B, et al. Impact of the antibiotic sulfadiazine and pig manure on the microbial community structure in agricultural soils[J]. Soil Biology and Biochemistry, 2008, 40(7): 1583-1591. doi: 10.1016/j.soilbio.2008.01.010 [95] FRANCIS C A, ROBERTS K J, BEMAN J M, et al. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(41): 14683-14688. [96] LEININGER S, URICH T, SCHLOTER M, et al. Archaea predominate among ammonia-oxidizing prokaryotes in soils[J]. Nature, 2006, 442(7104): 806-809. doi: 10.1038/nature04983 [97] SCHAUSS K, FOCKS A, LEININGER S, et al. Dynamics and functional relevance of ammonia-oxidizing archaea in two agricultural soils[J]. Environmental Microbiology, 2009, 11(2): 446-456. doi: 10.1111/j.1462-2920.2008.01783.x [98] RADL V, KINDLER R, WELZL G, et al. Drying and rewetting events change the response pattern of nitrifiers but not of denitrifiers to the application of manure containing antibiotic in soil[J]. Applied Soil Ecology, 2015, 95: 99-106. doi: 10.1016/j.apsoil.2015.06.016 [99] LI J J, YANG H Z, QIN K N, et al. Effect of pig manure-derived sulfadiazine on species distribution and bioactivities of soil ammonia-oxidizing microorganisms after fertilization[J]. Journal of Hazardous Materials, 2022, 423: 126994. doi: 10.1016/j.jhazmat.2021.126994 [100] HUND-RINKE K, SIMON M, LUKOW T. Effects of tetracycline on the soil microflora: Function, diversity, resistance[J]. Journal of Soils and Sediments, 2004, 4(1): 11-16. doi: 10.1007/BF02990823 [101] DING G C, RADL V, SCHLOTER-HAI B, et al. Dynamics of soil bacterial communities in response to repeated application of manure containing sulfadiazine[J]. PLoS One, 2014, 9(3): e92958. doi: 10.1371/journal.pone.0092958 [102] ZHANG Y, CHEN M L, BAO C X, et al. Application of pig manure compost with different biochar modifies the antibiotic resistome and bacterial community in agriculture soil [J]. Water, Air, & Soil Pollution, 2022, 233(4): 108. [103] LIU F, WU J S, YING G G, et al. Changes in functional diversity of soil microbial community with addition of antibiotics sulfamethoxazole and chlortetracycline[J]. Applied Microbiology and Biotechnology, 2012, 95(6): 1615-1623. doi: 10.1007/s00253-011-3831-0 [104] LIU A J, CAO H S, YANG Y, et al. Combinational effects of sulfomethoxazole and copper on soil microbial community and function[J]. Environmental Science and Pollution Research, 2016, 23(5): 4235-4241. doi: 10.1007/s11356-015-4892-x [105] 刘伟, 王慧, 陈小军, 等. 抗生素在环境中降解的研究进展[J]. 动物医学进展, 2009, 30(3): 89-94. doi: 10.3969/j.issn.1007-5038.2009.03.022 LIU W, WANG H, CHEN X J, et al. Progress on degradation of antibiotics in environment[J]. Progress in Veterinary Medicine, 2009, 30(3): 89-94 (in Chinese). doi: 10.3969/j.issn.1007-5038.2009.03.022
[106] LIU F, YING G G, TAO R, et al. Effects of six selected antibiotics on plant growth and soil microbial and enzymatic activities[J]. Environmental Pollution, 2009, 157(5): 1636-1642. doi: 10.1016/j.envpol.2008.12.021 [107] WEPKING C, AVERA B, BADGLEY B, et al. Exposure to dairy manure leads to greater antibiotic resistance and increased mass-specific respiration in soil microbial communities[J]. Proceedings of the Royal Society B: Biological Sciences, 2017, 284(1851): 20162233. doi: 10.1098/rspb.2016.2233 [108] MARX M C, KANDELER E, WOOD M, et al. Exploring the enzymatic landscape: Distribution and kinetics of hydrolytic enzymes in soil particle-size fractions[J]. Soil Biology and Biochemistry, 2005, 37(1): 35-48. doi: 10.1016/j.soilbio.2004.05.024 [109] DANTAS G, SOMMER M O A, OLUWASEGUN R D, et al. Bacteria subsisting on antibiotics[J]. Science, 2008, 320(5872): 100-103. doi: 10.1126/science.1155157 [110] BOLEAS S, ALONSO C, PRO J, et al. Toxicity of the antimicrobial oxytetracycline to soil organisms in a multi-species-soil system (MS·3) and influence of manure co-addition[J]. Journal of Hazardous Materials, 2005, 122(3): 233-241. doi: 10.1016/j.jhazmat.2005.03.003 [111] KONG W D, ZHU Y G, LIANG Y C, et al. Uptake of oxytetracycline and its phytotoxicity to alfalfa (Medicago sativa L. )[J]. Environmental Pollution, 2007, 147(1): 187-193. doi: 10.1016/j.envpol.2006.08.016 [112] DEVRIES S L, ZHANG P F. Antibiotics and the terrestrial nitrogen cycle: A review[J]. Current Pollution Reports, 2016, 2(1): 51-67. doi: 10.1007/s40726-016-0027-3 [113] MA T T, PAN X, CHEN L K, et al. Effects of different concentrations and application frequencies of oxytetracycline on soil enzyme activities and microbial community diversity[J]. European Journal of Soil Biology, 2016, 76: 53-60. doi: 10.1016/j.ejsobi.2016.07.004 [114] CUI H, WANG S P, FU J, et al. Influence of ciprofloxacin on microbial community structure and function in soils[J]. Biology and Fertility of Soils, 2014, 50(6): 939-947. doi: 10.1007/s00374-014-0914-y [115] YANG J F, YING G G, LIU S, et al. Biological degradation and microbial function effect of norfloxacin in a soil under different conditions[J]. Journal of Environmental Science and Health Part B Pesticides Food Contaminants and Agricultural Wastes, 2012, 47(4): 288-295. [116] DEVRIES S L, LOVING M, LI X Q, et al. The effect of ultralow-dose antibiotics exposure on soil nitrate and N2O flux[J]. Scientific Reports, 2015, 5(1): 16818. doi: 10.1038/srep16818 [117] MOLAEI A, LAKZIAN A, HAGHNIA G, et al. Assessment of some cultural experimental methods to study the effects of antibiotics on microbial activities in a soil: An incubation study[J]. PLoS One, 2017, 12(7): e0180663. doi: 10.1371/journal.pone.0180663 [118] CONKLE J L, WHITE J R. An initial screening of antibiotic effects on microbial respiration in wetland soils[J]. Journal of Environmental Science and Health, Part A, 2012, 47(10): 1381-1390. doi: 10.1080/10934529.2012.672315 -




 下载:
下载: