-
磷(P)是所有动植物生长过程中必需的营养元素,在自然界中主要以结合态和游离态的形式存在[1]。当水生生态系统中存在过量的正磷酸盐时,就会引起水体富营养化而导致水环境质量恶化[2]。迄今为止,几乎所有用于农业生产的磷都来自于磷矿的开采。美国地质调查局(USGS)报告,以目前磷矿的开采速度计算,地球上的磷酸盐储量将在2051至2092年间耗尽[3],磷资源已成为人类发展的限制性因素之一。因而,对散失到水环境中的磷资源进行有效回收,控制磷污染的同时缓解磷资源危机,引起研究者的广泛关注。
目前去除水体中磷的方法主要有化学沉淀、生物处理、吸附技术、膜技术、离子交换、人工湿地和结晶法等[4-5]。这些处理过程中,沉淀法和生物处理(活性污泥法)会产生大量的污泥,从而对环境造成二次污染;此外,膜工艺经济成本较高[6]。近年来,利用结晶法回收水体中的磷引起研究人员的广泛兴趣,如磷酸钙结晶法、鸟粪石结晶法、蓝铁矿结晶法等[7]。其中磷酸钙具有多种存在形态,例如磷酸三钙(TCP)、羟基磷灰石(HAP)、磷酸氢钙(DCPA)等。HAP不仅是一种优质的肥料资源,而且是人体和动物骨骼的主要无机成分[8],可用作生物材料,具有良好的应用前景。DCPD(CaHPO4·2H2O)在一定条件下可以转化成HAP[9]。并且磷酸钙具有磷矿的有效成分,可在产磷工业体系中加工利用。因此,通过磷酸钙结晶回收散失到水体中的磷资源被广泛的研究[10]。然而,一般来说将含磷产物从水体中直接回收较为困难,通常需要通过离心、过滤等方式,一定程度上增加了磷回收的成本。如何实现水体中磷的高效回收已成为一项挑战。磁分离是一种通过借助外部磁场实现物质有效分离的技术,具有操作简单、反应条件温和、成本低廉等优势,被广泛应用于污水处理、酶反应工程以及生物医药等领域[11]。磁性复合材料的应用有助于实现废水中磷资源的结晶回收。
本研究采用微波冷却回流法首先制备多级花球状方解石和纳米四氧化三铁,进一步通过超声法将纳米磁铁矿与多级结构方解石结合,形成Ca-Fe基磁性纳米复合材料。通过调控初始pH、反应时间、磷的初始浓度、固液比、共存离子等单因素系统研究了Ca-Fe纳米复合材料对水体中磷的去除效率及影响因素,阐释Ca-Fe纳米复合材料对水体中磷的去除机制。
-
实验所使用的乙酸钙(Ca(CH3COO)2·H2O)、尿素(CO(NH2)2)、乙二醇((CH2OH2))、氯化铁(FeCl3·6H2O)、氯化亚铁(FeCl2·4H2O)、氢氧化钠(NaOH)、磷酸二氢钠(NaH2PO4)、乙醇(C2H5OH)均为分析纯,购置于国药集团化学试剂有限公司,实验用水为去离子水。
-
多级结构方解石的制备。采用前驱体煅烧法制备多级结构方解石[12-13]:将0.53 g (3 mmol) Ca(CH3COO)2·H2O和0.18 g (3 mmol) CO(NH2)2分别超声溶解于25 mL和5 mL乙二醇中,然后将上述溶液加入到100 mL圆底烧瓶中。溶液混合均匀后将圆底烧瓶置于微波化学反应器(额定输出功率为800 W)中,在50%的额定输出功率下反应10 min,反应结束后冷却至室温,将产物用乙醇洗涤3次,然后在40 ℃下进行真空干燥,即获得方解石前驱体。将干燥后的前驱体置于马弗炉中,在500 ℃空气气氛中煅烧2 h(升温速率为5 ℃·min−1),获得多级结构方解石。
纳米四氧化三铁的制备。采用微波辅助法制备纳米磁铁矿[14]:将0.54 g (2 mmol) FeCl3·6H2O和0.20 g (1 mmol) FeCl2·4H2O超声溶解于20 mL乙二醇,将0.32 g (8 mmol)氢氧化钠溶解于2 mL去离子水中。然后将上述溶液在100 mL圆底烧瓶中充分混匀,置于微波化学反应器中,在80%的额定输出功率下反应20 min。反应结束后,冷却至室温,用乙醇洗涤后将所得固体在60 ℃真空条件下干燥,获得纳米四氧化三铁。
Ca-Fe基磁性纳米复合材料的制备。采用超声法制备磁性复合材料[15]:称取0.12 g四氧化三铁和0.25 g方解石分别放入2个烧杯中,分别加入10 mL乙醇进行超声分散。然后将上述2种悬浊液混合、密封,并在室温下超声30 min。反应结束后通过离心分离,在60 ℃条件下进行真空干燥,获得Ca-Fe纳米磁性复合材料。
通过改变方解石的加入量,制备具有不同磁铁矿负载率的Ca-Fe基复合材料,将复合材料充分溶解于稀酸溶液后,利用电感耦合等离子体-原子发射光谱仪(ICP-AES)测定Fe和Ca的含量,通过计算获得复合材料中Fe3O4的实际负载率,具体结果见表1。在后续实验过程中,除特别说明外,所使用的材料均为C-2。
-
将磷酸二氢钠(NaH2PO4)溶解于去离子水配置模拟含磷废水贮备液,实验过程中所需的含磷废水均通过稀释该贮备液获得。在典型的实验过程中,取50 mL 1 mmol·L−1的含磷废水于烧杯中,使用1 mol·L−1的HCl和NaOH溶液调节含磷废水的初始pH后加入50 mg吸附剂,在室温下将烧杯置于恒温摇床中,以150 r·min−1振荡反应24 h,反应结束后取样,使用0.22 μm滤头过滤,并测定磷的残留浓度。同时对固体样品进行回收、干燥,以备分析。有关pH、接触时间、材料用量、不同磷的初始浓度、共存离子(K+、Mg2+、CO32-、SO42-)对复合材料去除磷的影响均采用相似步骤研究。通过钼酸盐分光光度法测定溶液中的磷含量,所有实验均进行3次,取其平均值。
-
本研究采用X射线衍射仪(XRD,D/MAX 2600)测定材料去除磷前后物质的组成;通过傅里叶红外光谱仪(FTIR,INVENIO)对材料表面官能团进行分析;采用光电子能谱仪(XPS,ESCALAB 250Xi)分析材料的元素及价态;利用场发射扫描电子显微镜(SEM,Zeiss Gemini 300)观察样品的形貌特征;通过比表面积测试仪(BET,ASAP2460)测定材料的比表面积和孔径分布;采用紫外分光光度仪(T2602S)测定磷的质量浓度。
-
图1(a)为碳酸钙负载Fe3O4前后的XRD谱图。可见,29.41°、39.40°、43.14°等位置出现的衍射峰为方解石(JCPDS 05-0586)的特征峰,峰型尖锐且强烈,表明实验所合成的CaCO3(方解石)具有良好的结晶性。经超声负载处理之后,除了方解石原有特征峰外,在37.07°(222)处出现了新的特征峰,为Fe3O4(JCPDS 85-1436)的特征衍射峰。此外,通过FTIR对产物进一步分析。如图1(b)所示,在713、876和1 429 cm−1处的吸收峰归因于方解石中碳酸盐的伸缩振动峰[16],1 795、2 513、2 870、2 978 cm−1处的吸收峰为碳酸盐的泛音或组合带[17]。红外光谱分析结果进一步证实了方解石的存在。负载Fe3O4之后的复合材料与方解石特征峰相比,主要区别在590 cm−1附近出现了1个较宽的吸收峰,该吸收峰是由于Fe3O4的四面体位和八面体位的Fe-O键的拉伸振动和扭转振动产生[18];634 cm−1附近出现的吸收峰归因于—OH 振动峰[19],在3 430 cm−1和1 080 cm−1等吸收峰为水分子[20]和—OH官能团的伸缩振动特征峰[21]。FTIR表征结果表明,通过超声处理后方解石与磁铁矿形成了Fe3O4- CaCO3复合材料。
进一步利用SEM对所制备的方解石和复合材料进行形貌和结构分析。由图1(c)可见,所制备的方解石CaCO3呈现出3~5 μm的均匀的花球状结构,并且微米结构花球由多孔纳米片相互交叉的纳米片形成。由图1(d)可见,在超声引入Fe3O4后,方解石的花球状结构未发生明显改变,然而在表面发现纳米颗粒的存在,SEM结果进一步表明通过超声法成功制备出Fe3O4-CaCO3复合材料。图1(e)中复合材料的Mapping表征结果表明,Ca、Fe、O、C等元素分布于材料表面,这进一步说明Fe3O4-CaCO3复合材料的生成。
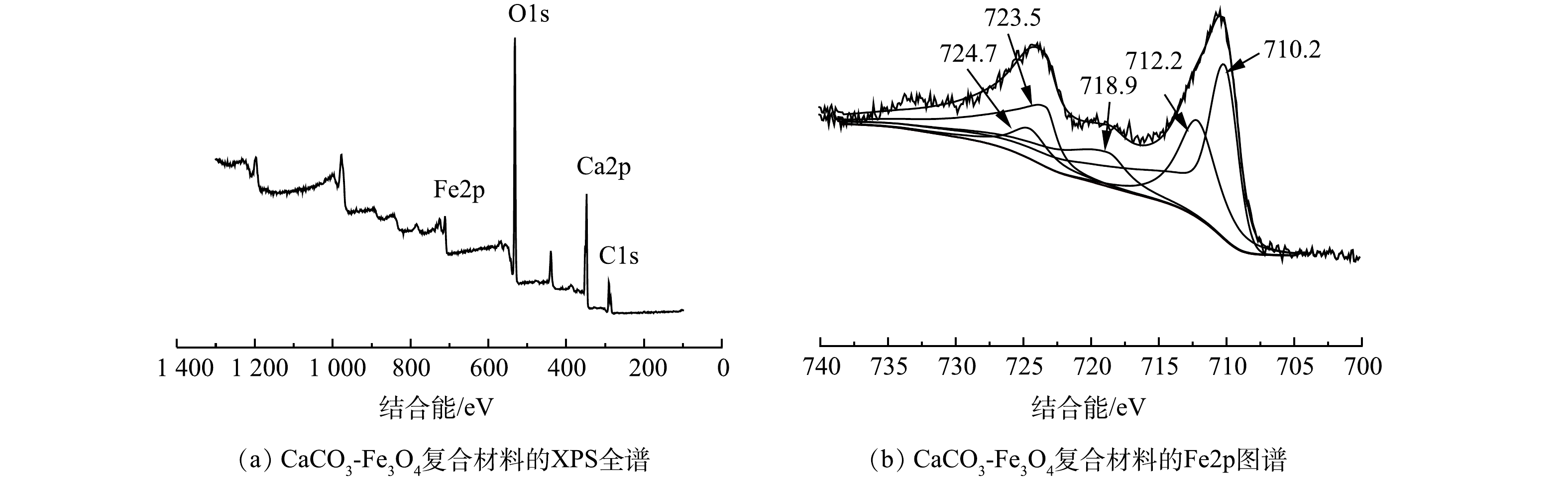
利用XPS分析复合材料元素组成和价态结构。图2(a)为Ca-Fe基复合材料的XPS全谱。由图2(a)可见,复合材料含有Ca、Fe、O、C元素。图3(b)中Fe2p的XPS分峰图谱表明,在710.2、712.2、723.5和724.7 eV处出现的峰分别与Fe2+的Fe2p3/2、Fe3+的Fe2p3/2、Fe2+的Fe2p1/2和 Fe3+的Fe2p1/2的峰值相对应[22],证明铁的氧化物以Fe2+和Fe3+混合组成[23]。Fe2p3/2的肩峰对Fe3O4的氧化态非常敏感[24-25],被用来定性地验证铁的存在形态。一般来说,Fe2p3/2卫星峰的位置比主峰数值高6 eV,则 Fe为+2价;差值为8 eV,则Fe为+3价[26-27]。所制备的复合材料中Fe2p3/2的卫星峰值(718.9 eV)与主峰值(712.2 eV)之间的差值为6.7 eV,表明同时存在Fe3+和Fe2+。因此,XPS分析结果进一步表明Fe3O4成功的负载于方解石,形成Ca-Fe基纳米复合材料,并且Fe3O4的形态在超声负载过程中未发显著变化。
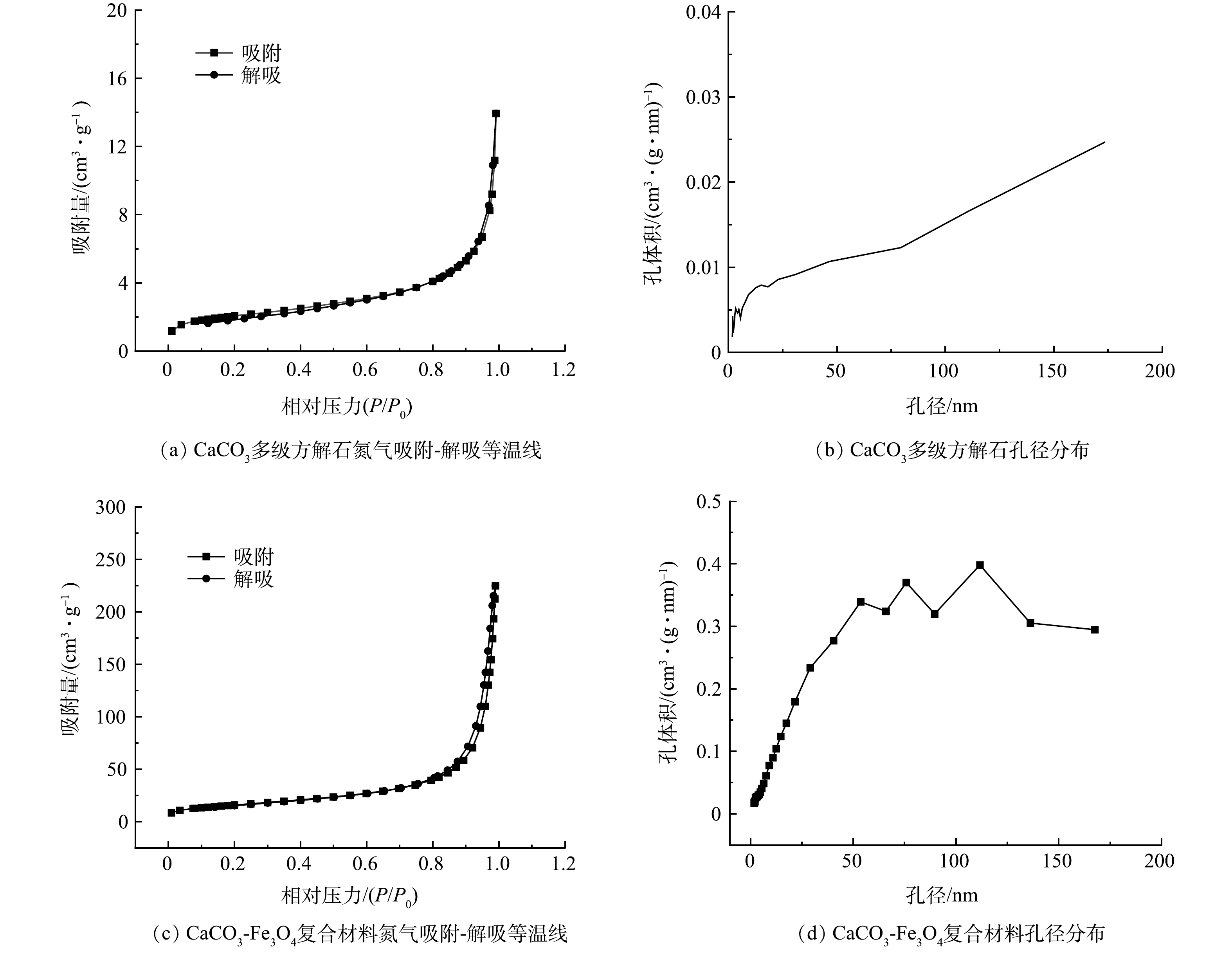
通过比表面积测定仪对材料的比表面积和孔体积进行分析。如图3所示,多级方解石和CaCO3-Fe3O4复合材料的N2吸附-解吸等温线呈现IV型结构,复合材料的等温线中能够观测到较为明显的滞后回环,表明复合材料存在内部孔隙[16]。方解石花球和CaCO3-Fe3O4复合材料的比表面积和孔体积分别为7.17 m2·g−1、0.02 cm3·g−1和57.79 m2·g−1、0.35 cm3·g−1。由于纳米磁铁矿的负载,复合材料的比表面积和孔体积增加,可提供更多的活性位点,有利于污染物的去除。
由图4(a)可见,Ca-Fe基复合材料的磁化强度为18.50 emu·g−1,复合材料具有良好的顺磁性,能够满足材料使用后进行磁分离的需要。图4(b)直观的反映了材料的磁效应,经外加磁铁装置后,材料能够较好地被磁铁吸引。以上结果表明,所制备的Ca-Fe基磁性纳米复合材料具备良好的磁分离性能。
-
在反应体系中,不同pH下PO43-具有不同的存在形态,同时吸附材料的表面电荷也有所不同。因此,首先探究pH对材料去除磷的影响(磷溶液初始浓度为1 mmol·L−1,反应时间24 h)。如图5(a)所示,当pH为3~6时,复合材料对磷具有较高的去除率,并且随着初始pH的升高磷的去除率呈现缓慢降低的趋势;在初始pH为6~8时,磷的去除率从77.21%迅速下降至31.39%;当pH大于8时,下降趋势变缓。就反应后pH而言,在反应达到平衡后溶液的pH较初始pH有不同程度的增加,均为碱性。有研究[28]表明,方解石在不同的pH下具有不同的溶解度。在酸性条件下,方解石具有较大的溶解度,当pH小于6.5时,超过50%的方解石会发生溶解,同时溶液中的磷主要以H2PO4−为主,Ca2+与H2PO4−生成沉淀,从而实现对水体中磷的有效去除。当pH为6.5~7.5时,仅有10%~20%的方解石发生溶解,方解石主要通过吸附作用实现对对磷的去除。在碱性条件下方解石几乎不发生溶解,同时OH−还会与PO43-产生竞争,从而导致磷的去除率降低。综上所述,在磷去除过程中,方解石在溶解过程中释放出Ca2+,通过与磷酸根形成钙的磷酸盐矿物,进促进磷的去除;随着pH的增大,Ca2+的释放量减少,导致对体系中磷去除率的降低。
图5(b)为花球状方解石和Ca-Fe基复合材料对磷的去除率随反应时间的变化(磷溶液浓度为1 mmol·L−1,反应初始pH为5.0)。花球状方解石对磷的去除率随着时间的延长而升高,反应时间为1 h,磷的去除率为26.7%;在1~4 h内,去除率几乎保持不变,呈现出停滞状态;在4~24 h,方解石对磷的除率不断升高,反应12 h后去除容率达到80.7%。以上结果表明,方解石对磷的吸附主要发生在反应前1 h内,而后随着反应时间增加,方解石发生溶解释放的Ca2+与磷酸根发生反应,导致磷的去除率进一步升高。Ca-Fe基纳米复合材料对磷的去除趋势与花球状方解石规律几乎一致。然而,在反应进行到1 h,复合材料对水体中磷的去除效率明显高于方解石,12 h后去除率上升到86.7%。复合材料对磷的去除率高于方解石花球,是由于在Ca-Fe复合材料形成过程中,Fe的引入导致复合材料表面形成大量的氧的空位,从而提高了Ca-Fe复合材料表面的电子转移速率,减低吸附过程中的结合能障碍,加速了Ca-Fe复合材料与磷酸盐的配体交换反应动力学[29-30]。
吸附剂用量对水体中磷的去除的规律(磷溶液浓度为1 mmol·L−1,反应初始pH=5.0,反应时间24 h)见图5(c)。随着吸附剂用量的不断增大,复合材料对磷的去除率明显增大。当吸附剂由0.2 g·L−1增至0.6 g·L−1时,磷的去除率由67.4%增加90.7%。随着吸附剂浓度的持续增大,去除率逐渐达到平衡。这是由于随着吸附剂浓度增加,更多的方解石发生水解,提供了更多的活性位点,同时溶液的pH呈现出上升的趋势。为保证获得良好的去除率同时兼顾经济性,材料的使用剂量在接下来的实验中设定为1.0 g·L−1。
进一步在最佳初始pH为5.0条件下,探究了磷的初始浓度对复合材料去除磷的影响。图5(d)显示,在室温条件下,当初始浓度从0.1 mmol·L−1增大至25.0 mmol·L−1时,复合材料对磷的去除容量从2.01 mg·g−1迅速增大至189.21 mg·g−1。Ca-Fe基复合材料对磷的去除容量远高于天然方解石的去除容量(0.10 mg·g−1)[28],也高于文献所报道的Ca/Fe复合材料(161.40 mg·g−1)[29]、氧化镁负载硅藻土(160.94 mg·g−1)[31]、镁改性硅酸钙(71.05 mg·g−1)[32]、氧化镁改性磁性生物炭(149.25 mg·g−1)[33]、La-Fe氢氧化物(123.46 mg·g−1)[34] (表2)。
图5(e)为Ca-Fe基复合材料中Fe3O4负载率对磷去除容量的影响(磷溶液浓度为20 mmol·L−1,反应初始pH 5.0,反应时间24 h)。可以看出,未负载的花球状纳米方解石对磷表现出了良好的去除性能,其对磷的去除容量为218.43 mg·g−1。随着复合材料中Fe3O4负载率的不断增大,复合材料对水体中磷的去除容量呈现递减的趋势。这是由于随着Fe3O4负载率的增加,相同质量复合材料中的方解石的含量减少,导致复合材料对磷的去除容量降低。以上结果进一步说明方解石组分在复合材料中对磷的去除起到主导作用。
在实际应用中,水体中通常含有多种共存离子,因此探究了K+、Mg2+、CO32-和SO42-对复合材料去除磷的影响。由图5(f)可见,在相同反应条件下,共存离子种类和浓度的不同均会对复合材料除磷的性能产生一定的影响。当磷的初始浓度为20 mmol·L−1时,K+对磷的去除影响较为轻微,然而 Mg2+对磷的去除产生明显的抑制作用,Mg2+在2 mmol·L−1和10 mmol·L−1时,复合材料对磷的去除容量分别下降至154.31 mg·g−1和116.47 mg·g−1。这可能是由于,体系pH随着反应的进行不断升高,Mg2+发生水解产生氢氧化物吸附于复合材料表面,产生桥联作用[35],从而降低方解石的分散和水解能力,导致复合材料对磷的去除率降低[36]。同时发现CO32-和SO42-对体系中磷的去除也存在抑制作用,并且随着SO42-浓度的增大,对磷去除的抑制作用不断增强。Ca2+容易与CO32-和SO42-发生沉淀反应,CO32-和SO42-与HnPO4(3-n)-形成竞争关系,抑制了复合材料对HnPO4(3-n)-的有效去除。
-
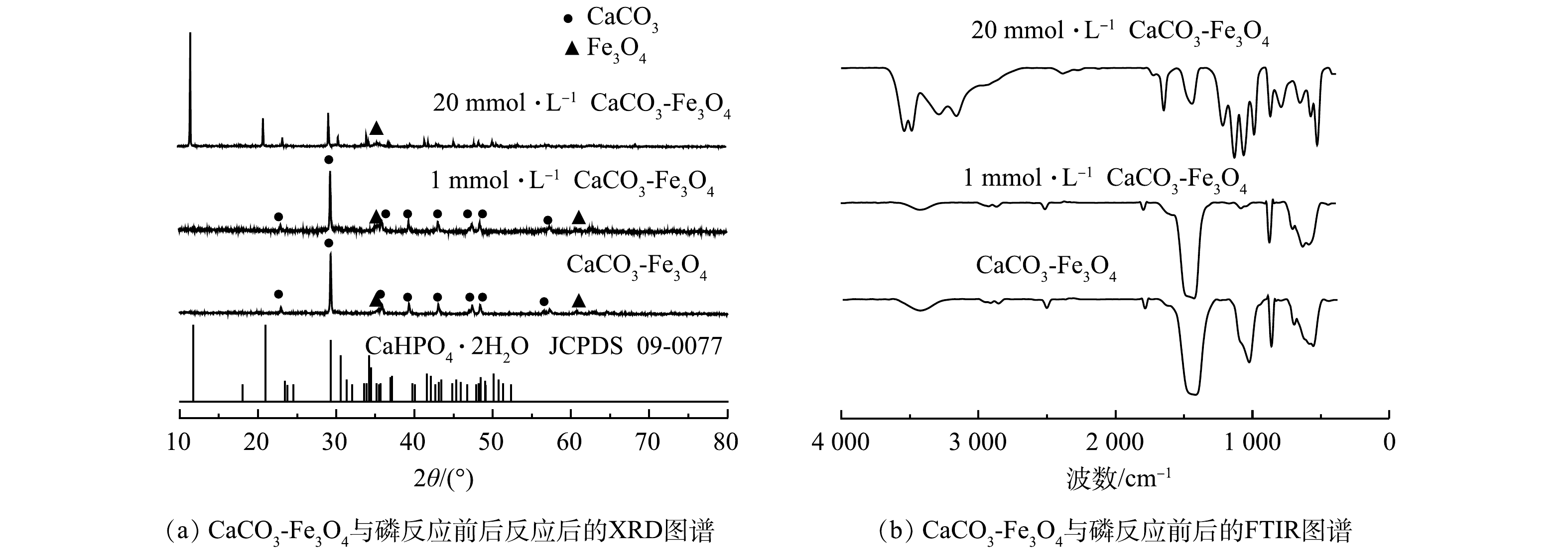
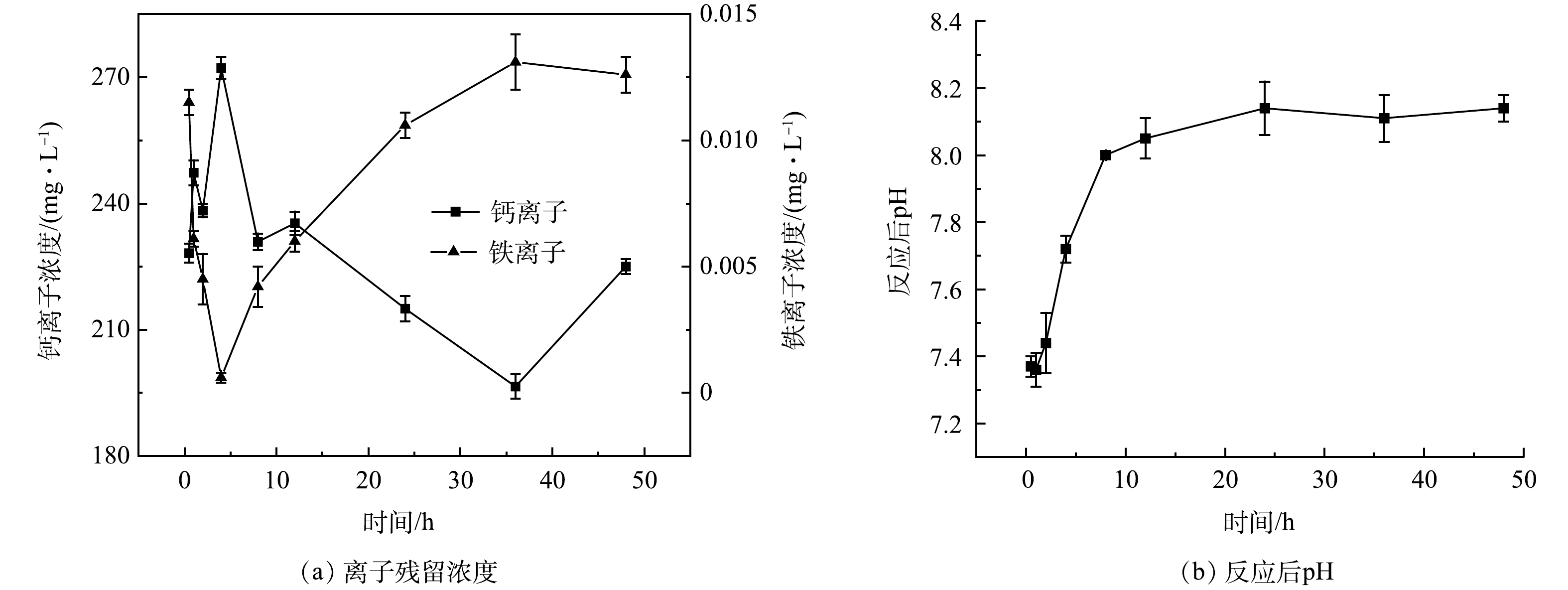
为了进一步阐明Ca-Fe基磁性纳米复合材料对磷的去除机制,通过XRD、FTIR、SEM、XPS对复合材料除磷后的产物进行表征。如图6(a)所示,XRD结果表明在磷初始浓度为1 mmol·L−1时所获得的产物的物相与原材料相比未发生明显变化。这可能是由于复合材料对低浓度的磷主要以吸附的方式去除。此外,在反应过程中生成的钙的磷酸盐产物可能以非晶的形式存在,导致XRD无法精确检测。当磷的初始浓度为20 mmol·L−1时,产物在11.68°、17.97°、23.39°、29.25°等位置均出现了CaHPO4·2H2O(JCPDS 09-0077)的特征峰,表明在反应过程中体系中的HnPO4 (3-n)-与Ca2+发生化学反应生成CaHPO4·2H2O。此外,XRD图谱中依然可以观测到Fe3O4的特征峰存在,说明复合材料中的Fe3O4在磷的去除过程中未发生明显变化,并且反应后依然具有磁性,可通过磁分离技术对产物进行有效回收。结合图5中影响因素实验结果推测,Ca-Fe基复合材料在反应的初始阶段首先通过吸附作用对磷去除。随着反应的进行,由于复合材料中方解石的特殊花球纳米结构,Ca-Fe基复合材料中的方解石快速水解释放出大量的Ca2+,由图7(a)可见,反应体系中Ca2+的质量浓度在反应30 min后即可到达228.2 mg·L−1;与此同时,方解石的水解消耗了一定量的H+,导致反应体系pH逐步升高,图7(b)显示,反应体系pH从初始阶段的5.0左右逐步升高到8.2左右;在反应进行4 h后体系pH大于7.8,此时HnPO4(3-n)-主要以HPO42-的形式存在[5]。因此,反应体系中方解石所释放的Ca2+与HPO42-反应生成CaHPO4·2H2O (20 ℃时CaHPO4·2H2O的溶度积常数为4.3×10−3),复合材料通过结晶-吸附机制实现对磷的有效回收。图5(a)显示复合材料对磷的去除在反应1~4 h阶段出现停滞,该现象产生的原因可能是由于在反应4 h内体系的pH在7.3~7.5(图7(b)),此时溶液中的HnPO4(3-n)-主要以H2PO4−的形式存在[5],由于Ca(H2PO4)2溶解度较大(20 ℃时Ca(H2PO4)2的溶度积常数为1.8),不易产生结晶,导致反应停滞。值得注意的是,反应体系中虽然Ca2+释放量较高,然而Fe3+浓度低于0.01 5 mg·L−1(图8(b)),表明在反应过程中Fe3O4保持稳定,有利于反应后物质的回收。
在不同磷初始浓度下所得产物的FTIR图谱如图6(b)所示。在磷初始浓度为1 mmol·L−1时,所得产物在571 cm−1和1 037 cm−1附近出现了新的吸收峰,为PO43-的ν4和ν3反对称伸缩振动峰[37-38]。在磷初始浓度为20 mmol·L−1时,所得产物在876、1 425 cm−1处CO32-的吸收峰减弱,说明方解石在反应过程中发生溶解,CO32-含量降低。此外,FTIR谱图还显示出标准CaHPO4·2H2O的特征吸收峰[39-40]。在3 700~3 000 cm−1内出现了2个不同的双峰,分别位于3 543、3 489 cm−1和3 288、3 163 cm−1处,该吸收峰为2种结晶水分子的O—H 伸缩振动[41];同时在1 645 cm−1处的吸收峰也是由于水分子的 O—H 弯曲振动所产生[42]。PO43-的特征吸收峰位于1 150、900附近及650~520 cm−1[43]。此外,在1 134 cm−1和1 066 cm−1处出现了P=O的伸缩振动峰;在1 218、871和792 cm−1处的特征峰分别是由HPO42−的P—O—H和P—OH的振动引起的[44-45];576 cm−1和573 cm−1处为(H—O—)P=O的振动峰[46]。以上FTIR分析结果进一步说明CaHPO4·2H2O的生成。
产物的SEM和EDS表征结果如图8所示。可见,反应后方解石原有的形貌与初始形貌完全不同。在磷初始浓度为1 mmol·L−1条件下,方解石发生水解,原有的花球形貌发生变化,仍保留部分原有骨架。同时,由Mapping表征结果可见磷均匀分布于产物表面,CaPFeCO并且钙与磷元素的比值明显小于1(产物中钙的含量为10.05%,磷的含量为5.05%),说明在该条件下复合材料通过吸附对磷去除。当磷的初始浓度为20 mmol·L−1时,方解石的原有形貌被完全破坏,出现了由纳米颗粒状构成的块状物质;钙与磷元素的比值接近于1(产物中钙的含量为14.03%,磷的含量为15.49%),表明CaHPO4·2H2O矿物的生成,该结果与XRD分析结果一致。
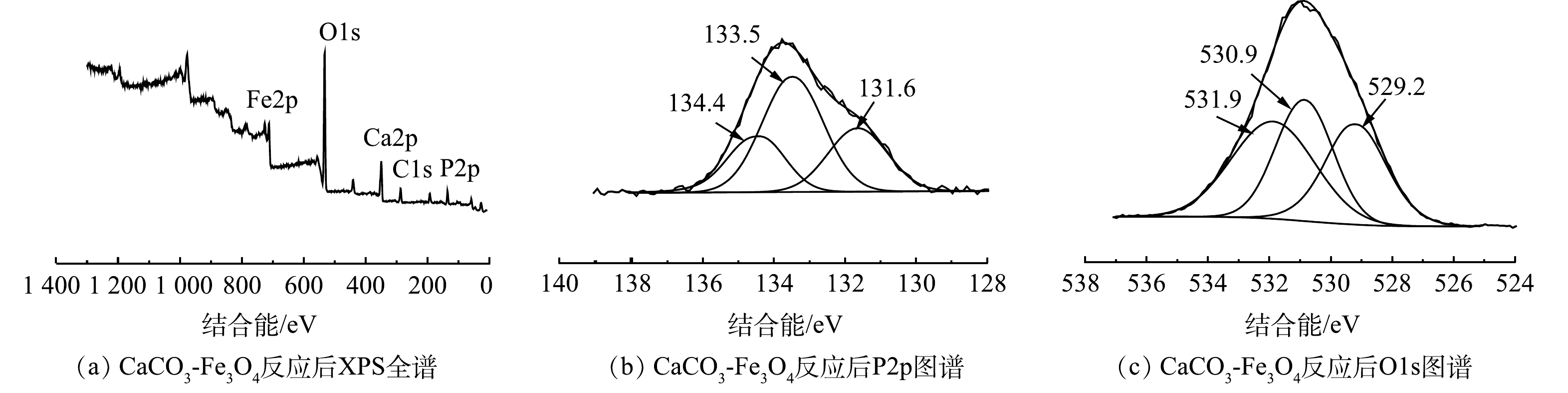
利用X射线光电子能谱仪对产物的化学成分以及所涉及元素的化学形貌进行表征分析。由图9(a)可见,XPS全谱中出现了明显的P2p和O1s的特征峰,证明产物中磷发生反应。由图9(b)可见,131.6、133.5和134.4 eV位置出现的3个特征峰分别对应于PO43-、HPO42-、H2PO4−[47-48]。其中,133.5 eV处的特征峰最强,表明在生成物中磷主要以HPO42-的形式存在。由图9(c)可见,在530.9 eV处出现的特征峰为P=O,531.9 eV处的特征峰为P-OH[49][和CaCO3中的C—O[50],529.2 eV处的吸收峰为表面羟基和结合水的O—H[51]。以上结果进一步表明生成物为CaHPO4·2H2O,与XRD和FTIR的分析结果一致。
所制备的Ca-Fe基磁性复合材料对磷的回收机制主要为吸附-结晶耦合。在结晶反应过程中,Ca-Fe基复合材料中方解石通过水解提供Ca2+,与磷酸根离子发生结晶反应生成CaHPO4·2H2O,从而实现磷资源的回收。所回收的磷矿物可作为肥料或生物材料被进一步利用。由于所制备的复合材料富有磁性,便于磁性回收,降低在实际应用中的回收成本,同时能够避免二次污染的产生。此外,Ca-Fe基磁性复合材料合成过程中所使用钙源和铁源易于获取,具有较好的经济性。
-
1)利用微波-冷却-回流和超声的方法制备Ca-Fe 基磁性纳米复合材料,系统研究了复合材料对水体中磷的回收性能,复合材料在pH=3.0~6.0内对水体中的磷表现出良好的回收效果,在最佳实验条件下复合材料对磷的最大去除容量为189.21 mg·g−1。
2)复合材料中的方解石组分在对磷的去除中起到主导作用。复合材料对低浓度的磷主要通过吸附作用实现有效去除;对于高浓度的磷,复合材料通过吸附-结晶耦合的机制实现对水体中磷的有效回收,产物中磷以CaHPO4·2H2O的形式存在。
3)由于复合材料具有良好的磁性,在处理含磷废水之后,可以通过磁分离技术将产物高效回收,避免产生二次污染,所制备的复合材料在磷回收领域具有潜在的应用价值。
Ca-Fe基磁性纳米复合材料对水体中磷的结晶回收
Crystallization recovery of phosphorus from water by Ca-Fe based magnetic nanocomposites
-
摘要: 人类活动导致大量的不可再生的磷资源流失到水环境中造成水体富营养化,磷的结晶回收对废水治理、地表水管理和可持续发展具有重要意义。采用微波-冷却-回流和超声的方法制备Ca-Fe 基磁性纳米复合材料(CaCO3-Fe3O4),通过批量吸附实验法系统探究了体系pH、接触时间、磷的初始浓度、共存离子等因素对复合材料去除水体中磷的影响规律。结果表明,CaCO3-Fe3O4纳米磁性复合材料在pH=3.0~6.0内对磷表现出良好的去除效果,对磷的最大去除容量为189.21 mg·g−1。复合材料对水体中的磷主要通过吸附-结晶耦合机制去除,在高浓度含磷废水中,磷以CaHPO4·2H2O的形式被回收。综合考虑磁分离的简易性、磷的去除容量和环境友好性,所制备的Ca-Fe基磁性复合材料在磷资源回收领域具有潜在的应用价值。Abstract: Human activities induced the loss of non-renewable phosphorus resources into aquatic environment, leading to eutrophication of waterbody. Crystallization recovery of phosphorus is crucial for wastewater treatment, surface water management and sustainable development. In this study, Ca-Fe based magnetic nanocomposites (CaCO3-Fe3O4) were synthesized by microwave-assisted reflux and ultrasound method. The effects of solution pH, contact time, initial phosphorus concentration, coexisting ions on phosphorus removal by magnetic nanocomposite were systematically examined by the batch adsorption method. The results demonstrated that the phosphate could be effectively recovered from water by CaCO3-Fe3O4 nanocomposites in the pH range of 3.0~6.0, and the maximum removal capacity of 189.21 mg·g−1(P). The phosphate was removed via sorption-crystallization coupling mechanism, and in high phosphate concentration effluent, P was harvested in a CaHPO4·2H2O form. Considering the easy magnetic separation, high phosphorus removal capacity and environmental friendliness, the prepared Ca-Fe based magnetic composites have potential applications in phosphorus resource recovery.
-
Key words:
- calcite /
- magnetic nanocomposites /
- phosphorus /
- sorption /
- crystallization recovery
-
汞具有较高的挥发性,其毒性具有持久性和生物累积性,可通过食物链传递,已经被世界卫生组织列为优先控制污染物[1-3]。煤炭燃烧是重要的大气汞排放污染源之一[4-5],我国最新修订的《火电厂大气污染物排放标准》,对燃煤电厂烟气中的汞及其化合物的排放进行了严格的限定,限值为30 μg·m−3。2017年8月6日,中国参与的全球首个汞限排国际公约《关于汞的水俣公约》正式生效[6]。燃煤汞污染问题的高效治理,已成为煤炭清洁利用的重要方面之一。
燃煤烟气中的汞主要以3种形态存在:气态单质汞(Hg0g)、气态二价汞(Hg2+g)和吸附态汞(Hgp)。Hg2+和Hgp可以通过电厂的空气污染控制装置(APCD)脱除[7-8]。由于Hg0易挥发且难溶于水的特性,电厂现有的APCD难以将烟气中的Hg0g有效地脱除。因此,燃煤烟气中Hg0g的高效脱除成为了烟气汞污染净化的重点和难点。
目前,燃煤电厂研究较多而且开始应用的汞排放控制方法是在烟道中喷射活性炭来吸附烟气中的汞[9-10]。然而,燃煤电厂现场的应用结果表明,活性炭用量较大,其对汞的脱除效果受烟气温度和组分影响很大,活性炭脱汞成本较高,使活性炭喷射技术在燃煤电厂脱汞的应用受到很大限制。近年来,经济高效的非碳基吸附剂特别是天然矿物吸附剂受到研究者的广泛重视[11-12]。
凹凸棒石(PG)是一种天然硅酸盐类黏土矿物,经处理后孔隙发达,比表面积大,具有良好的吸附性和热稳定性,而且成本低廉,来源广泛,是良好的催化剂载体。锰氧化物具有良好的低温催化氧化活性,可将Hg0氧化为容易脱除的Hg2+,负载MnOx的催化剂已被研究用于脱除燃煤烟气中的Hg0[13-18]。
本课题组前期研究结果表明,PG负载V2O5、CuO、MnOx等所形成的催化剂在排烟温度范围内对Hg0具有较高的氧化和吸附能力,其中凹凸棒石负载MnOx催化剂在低温展现了较高的脱除Hg0的能力[19-20]。为进一步研究MnOx/PG催化剂脱除烟气中Hg0的性能,本文研究了MnOx/PG催化剂制备条件、工况条件(反应温度、汞浓度、空速)等对MnOx/PG催化剂脱除Hg0的影响,并研究了脱除Hg0后MnOx/PG催化剂的再生及不同条件下再生后MnOx/PG催化剂的脱除Hg0活性。
1. 实验部分(Experimental section)
1.1 催化剂制备
将凹凸棒石黏土与蒸馏水按照一定比例混合后搅拌均匀、挤压,然后在烘箱中于110 ℃下干燥24 h,将充分干燥后的凹凸棒石样品研磨并筛选出30—60目的颗粒,在N2气氛中300 ℃下热处理2 h,即得凹凸棒石载体。采用等体积浸渍法制备MnOx/PG催化剂,根据所需制备催化剂的MnOx的负载量,将PG等体积浸渍于Mn(NO3)2溶液中,然后在室温静置2 h,50 ℃干燥5 h,110 ℃干燥5 h,最后依次在N2、N2+O2气氛中煅烧2 h,即可制得MnOx/PG催化剂[20]。
1.2 Hg0的脱除实验
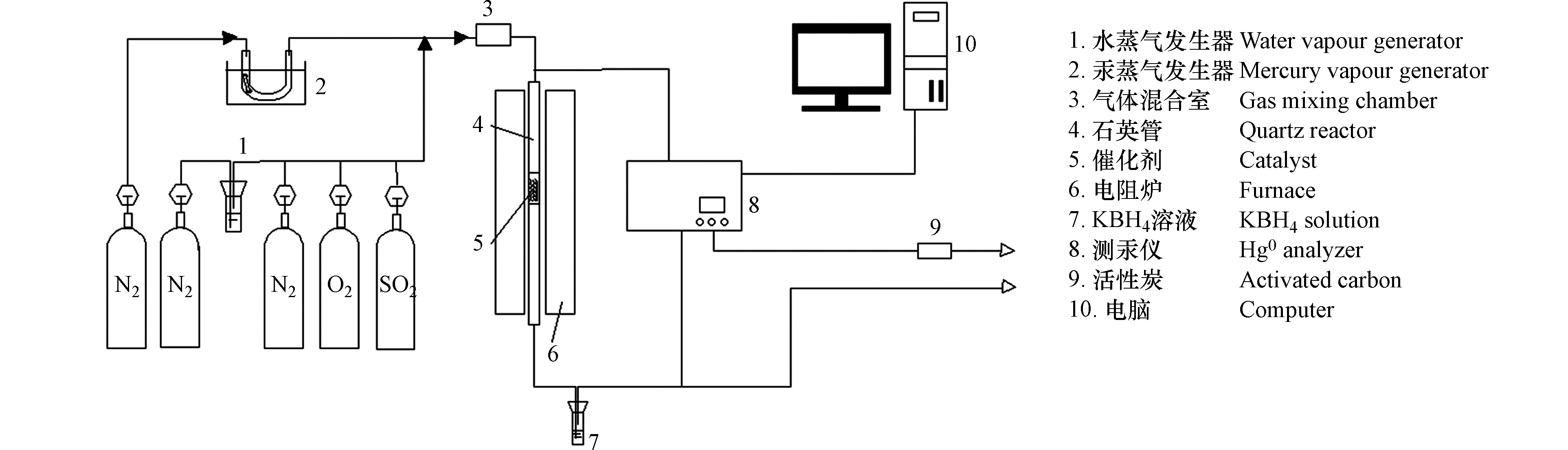
MnOx/PG催化剂对Hg0的脱除实验装置如图1所示。
实验气氛为含有N2(平衡气)、O2、SO2和H2O的模拟烟气,Hg0蒸气由汞渗透管产生,Hg0 浓度为240 μg·m−3。催化剂装填量为0.5 g,反应温度为120—240 ℃,反应时间为400 min。利用测汞仪(俄罗斯Lumex公司,RA—915M型)在线连续检测催化剂前后气体中的Hg0浓度。实验管路采用加热带保温防止气态Hg0的冷凝,尾端利用装有疏松多孔活性炭的吸收塔处理尾气。MnOx/PG催化剂脱除Hg0的能力用脱除效率表示,本文中的实验数据均为3次测量的平均值[20]。
1.3 催化剂的再生实验
脱除Hg0后的MnOx/PG催化剂进行热再生和水洗再生,再生后的催化剂再次进行脱除Hg0的实验。热再生在图1所示的固定床反应装置上进行。再生条件为:气体流量为100 mL·min−1的 N2气氛下,程序升温至再生温度(300—500 ℃)并保持恒温再生2 h,升温速率为10 ℃·min−1。
水洗再生的过程是将脱除Hg0后的MnOx/PG催化剂在100 mL锥形瓶中与去离子水混合,将锥形瓶放入超声设备中振荡10 min后过滤,在真空干燥箱中110 ℃下干燥6 h,即得到再生后的MnOx/PG催化剂。
1.4 催化剂的表征
采用扫描电镜(SEM,JSM-6490LV,日本电子公司)表征载体PG和MnOx/PG催化剂的表面形貌。
2. 结果与讨论(Results and discussion)
2.1 MnOx/PG催化剂的扫描电镜
图2为MnOx负载量为8%的MnOx/PG催化剂的SEM图。可以看出,PG载体具有大量的孔道结构,使得MnOx/PG催化剂具有较高的比表面积,不仅有利于活性组分MnOx在PG载体上的分散负载,而且有利于含Hg0气体的扩散和Hg0在MnOx/PG催化剂上的吸附、氧化。
2.2 MnOx/PG催化剂脱除Hg0的活性
图3为不同MnOx负载量(0%、2%、4%、6%、8%、10%)的MnOx/PG催化剂在模拟烟气中400 min时对Hg0的脱除效率。可以看出,负载量0%的PG载体对Hg0的脱除效率较低,只有35%左右。随着MnOx负载量从2%增加到8%,Hg0的脱除效率明显升高,这表明MnOx的负载对Hg0的脱除起到了关键作用。MnOx负载量为8%的MnOx/PG脱除Hg0的效率最高,达到95.9%。随着MnOx负载量的继续增加,Hg0的脱除效率出现了下降。这是由于MnOx负载量较低时,MnOx能够较好的分散在载体PG表面,有利于Hg0的吸附、氧化,因此具有较高的Hg0的脱除效率。但MnOx负载量过高时,MnOx会发生团聚、阻塞载体的孔道,使得催化剂的比表面积下降,降低了对Hg0的吸附、氧化,从而导致催化剂脱除Hg0的能力有所降低[21-22]。
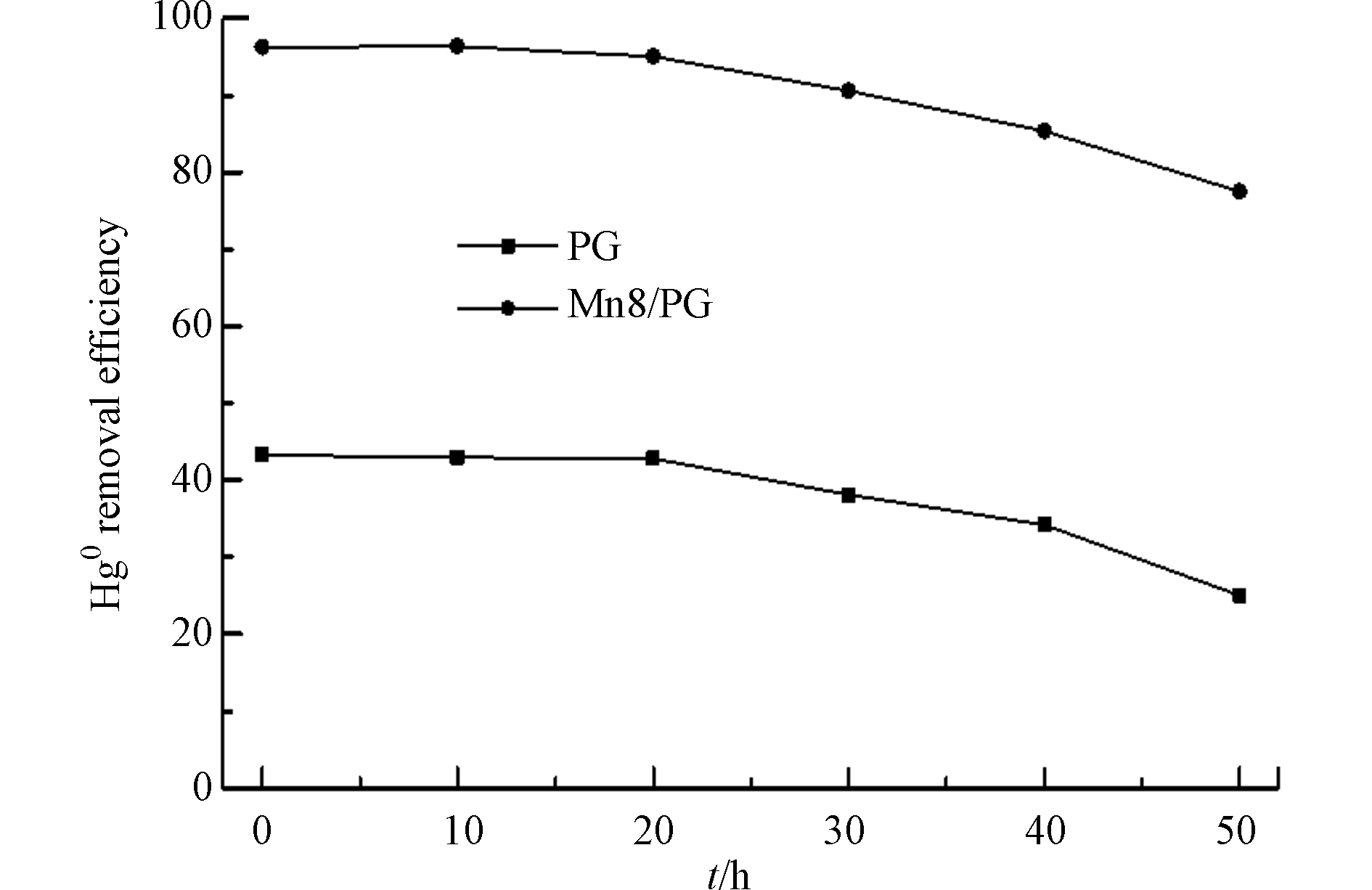
为考察MnOx/PG催化剂长时间使用的脱除Hg0的活性,在空速6000 h−1、温度210 ℃时,选用负载量8%的MnOx/PG催化剂进行了脱除Hg0 50 h的活性评价实验,结果如图4所示。可以看出,随着反应时间的延长,PG载体逐渐失活,50 h时的Hg0脱除效率已经降到了25%以下。而MnOx/PG催化剂一直保持了较高的脱除Hg0的活性,50 h时的Hg0脱除效率仍在80%左右,这表明MnOx/PG催化剂不仅具有优良的脱除Hg0的活性而且具有较长的使用寿命。
2.3 Hg0浓度对MnOx/PG脱除Hg0的影响
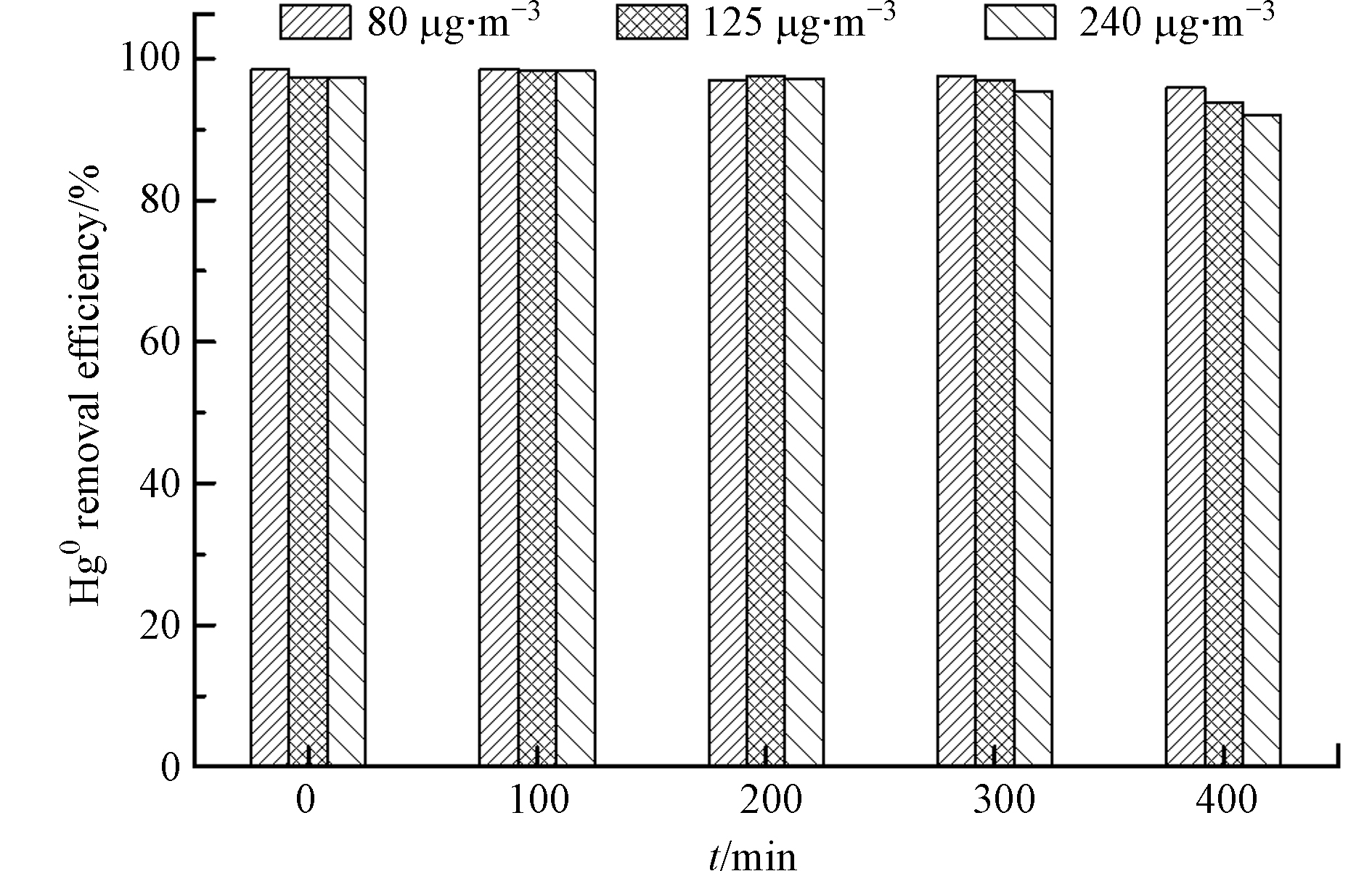
图5为MnOx/PG催化剂在80—240 μg·m−3的Hg0浓度范围内对Hg0脱除400 min的结果。可以看出,尽管Hg0的浓度变化较大,但对MnOx/PG催化剂脱除Hg0的能力影响很小。随着Hg0的浓度从80 μg·m−3升高到125 μg·m−3和240 μg·m−3,Hg0的脱除效率变化很小,均在95%以上。图5中的实验结果再次表明,MnOx/PG催化剂具有较高且稳定的脱除Hg0的能力,可用于在含有较高Hg0浓度的烟气中脱除Hg0。
2.4 空速对MnOx/PG脱除Hg0的影响
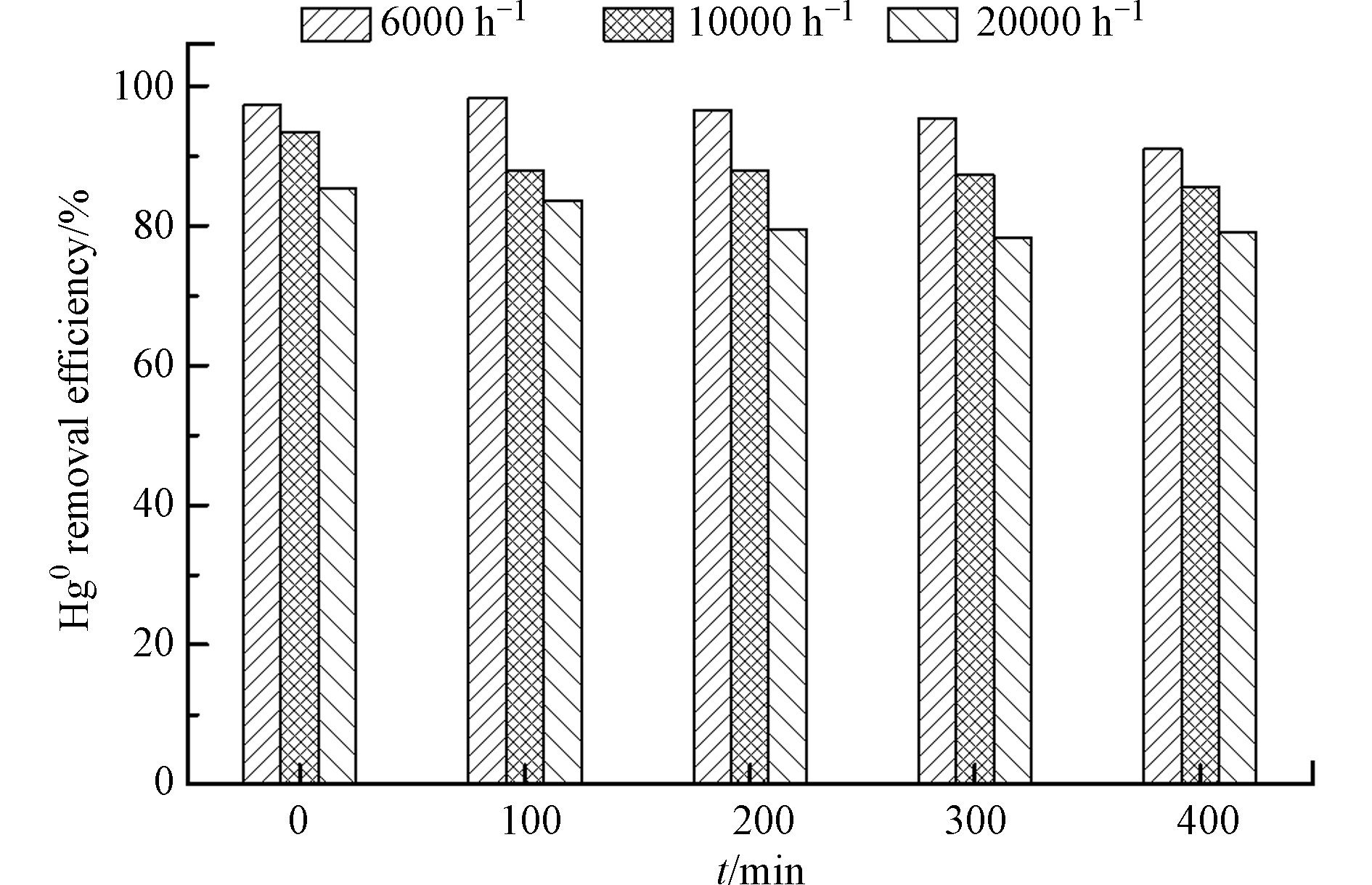
图6为MnOx/PG在6000—20000 h−1的空速范围内对Hg0 脱除400 min的结果。可以看出,在实验所用的空速范围内,空速由6000 h−1增大至20000 h−1,Hg0的脱除效率出现明显降低,400 min 时降低至80%。这主要是由于低空速下气体流速较慢,烟气与MnOx/PG催化剂的接触时间较长,有利于Hg0在MnOx/PG催化剂上吸附、氧化,从而提高了Hg0的脱除效率。而空速过大时,气体流速相应增大,烟气与MnOx/PG催化剂的接触时间变短,不利于Hg0在MnOx/PG催化剂上吸附、氧化,进而导致Hg0的脱除效率降低。
2.5 脱除Hg0后MnOx/PG催化剂的再生
为考察MnOx/PG催化剂的再生及循环使用性能,对上述脱除Hg0 50 h后的MnOx/PG催化剂进行了热再生和水洗再生。图7(a)为在300 ℃、400 ℃和500 ℃的N2中热再生2 h的MnOx/PG催化剂再次脱除Hg0的效果。可以看出,热再生后的MnOx/PG催化剂仍保持了较高的脱除Hg0的能力,且400 ℃下的再生效果最好,400 min时Hg0的脱除效率仍保持在85%以上。而500 ℃下的再生效果不好,MnOx/PG脱除Hg0的能力明显下降,400 min时Hg0的脱除效率快速下降至25%左右。这主要是由于载体PG在500 ℃下的热稳定性较低,多孔结构发生坍塌堵塞部分孔道,导致MnOx/PG催化剂比表面积变小(新鲜MnOx/PG催化剂和500 ℃再生后的MnOx/PG催化剂的比表面积和孔结构数据见表1),影响了脱除Hg0的能力。
表 1 500 ℃热再生前后MnOx/PG的比表面积和孔结构Table 1. Properties of MnOx/PG and MnOx/PG after 500 ℃ regeneration样品Samples 比表面积/(m2·g−1)ABET 孔体积/(cm3·g−1)Vt 平均孔径/nmDave MnOx/PG 133.21 0.499 17.10 MnOx/PG-500 71.24 0.538 16.93 图7(b)为在水浴温度100 ℃下再生后的MnOx/PG催化剂再次脱除Hg0的性能。可以看出,水洗再生后的MnOx/PG催化剂对Hg0的脱除能力较低,400 min时均降低至50%左右,这表明水洗再生的方法不能使脱除Hg0后的MnOx/PG催化剂的活性有效恢复,这可能主要是由于水洗过程中会使得MnOx/PG催化剂的部分活性组分损失,导致MnOx/PG对Hg0的脱除能力下降。因此,选用热再生的方法对脱除Hg0后的MnOx/PG催化剂进行再生。
2.6 预氧化对再生后MnOx/PG脱除Hg0的影响
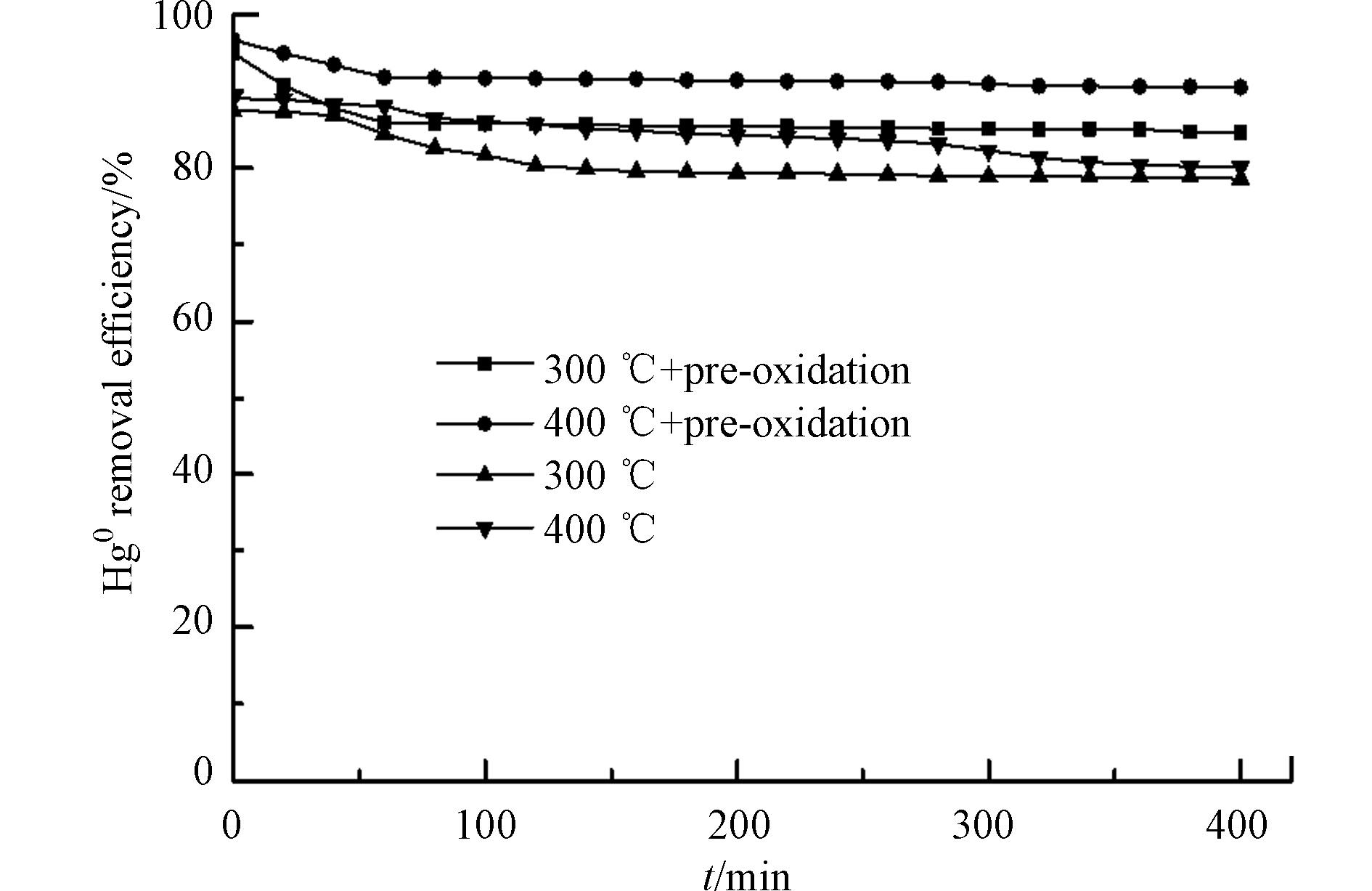
为进一步优化脱除Hg0后MnOx/PG催化剂的再生条件,对300 ℃和400 ℃再生后的MnOx/PG催化剂在空气气氛中250 ℃下预氧化处理2 h,并将其用于再次脱除Hg0,结果如图8所示。可以看出,在300 ℃和400 ℃两种温度下热再生后的催化剂经过预氧化处理有利于提高其脱除Hg0的能力,预氧化处理使得热再生后的催化剂对Hg0的脱除效率提高了10%左右。这表明,预氧化处理有利于提高再生后MnOx/PG催化剂脱除Hg0的能力,主要是由于预氧化过程中O2可将MnOx中低价态的Mn氧化成高价态,提高了MnOx对Hg0的氧化活性,使得MnOx/PG催化剂脱除Hg0的能力提高[23-25]。
2.7 再生次数对MnOx/PG催化剂脱除Hg0的影响
图9为在400 ℃的再生温度下经过3次热再生-预氧化处理的MnOx/PG催化剂对Hg0的脱除性能。可以看出,3次热再生-预氧化处理的MnOx/PG催化剂仍具有较高的脱除Hg0的能力。与新鲜的MnOx/PG催化剂相比,3次热再生-预氧化处理的MnOx/PG催化剂对Hg0的脱除能力有所下降,但降低的幅度较小,第3次热再生-预氧化的MnOx/PG催化剂对Hg0的脱除效率在400 min时仍高于75%,远高于PG载体对Hg0的脱除效率。这表明,MnOx/PG催化剂不仅具有较高的脱除Hg0的活性,而且具有良好的再生循环使用性能。
3. 结论(Conclusions)
(1)MnOx/PG催化剂具有良好的脱除Hg0的活性和稳定性,载体PG的多孔结构有利于活性组分MnOx的分散和Hg0的吸附、氧化。
(2)低Hg0浓度和低空速条件下有利于MnOx/PG催化剂对Hg0的脱除。
(3)热再生对脱除Hg0后的MnOx/PG催化剂的再生效果好于水洗再生,最佳再生温度为400 ℃。热再生后的MnOx/PG催化剂仍具有良好的脱除Hg0的能力。
(4)脱除Hg0后的MnOx/PG催化剂经400 ℃热再生和预氧化处理,可有效恢复其对Hg0的再次脱除能力。MnOx/PG催化剂不仅具有较高的脱除Hg0的活性,而且具有良好的再生循环使用性能。
-
表 1 不同材料负载率
Table 1. Different loading rates of synthesized materials
样品编号 方解石/g Fe3O4/g 负载率(Fe3O4)/% C-1 0.125 0.12 41.7 C-2 0.250 0.12 22.4 C-3 0.500 0.12 11.9 表 2 不同吸附剂对磷去除性能的比较
Table 2. The phosphorus removal performance of different Mg-based sorbents
材料 初始pH 去除容量/(mg·g−1) 参考文献 天然方解石 6.5 0.10 29 Ca/Fe复合材料 5.4 161.40 30 氧化镁负载硅藻土 7.0 160.94 32 镁改性硅酸钙 7.0 71.05 33 氧化镁改性磁性生物炭 3.0 149.25 34 La-Fe氢氧化物 7.0 123.46 35 CaCO3-Fe3O4 5.0 189.21 本研究 -
[1] MAYER B K, BAKER L A, BOYER T H, et al. Total value of phosphorus recovery[J]. Environmental Science and Technology, 2016, 50(13): 6606-6620. doi: 10.1021/acs.est.6b01239 [2] MITROGIANNIS D, PSYCHOYOU M, BAZIOTIS I, et al. Removal of phosphate from aqueous solutions by adsorption onto Ca(OH)2 treated natural clinoptilolite[J]. Chemical Engineering Journal, 2017, 320: 510-522. doi: 10.1016/j.cej.2017.03.063 [3] FORREST A L, FATTAH K P, MAVINIC D S, et al. Optimizing struvite production for phosphate recovery in WWTP[J]. Journal of Environmental Engineering, 2008, 134(5): 395-402. doi: 10.1061/(ASCE)0733-9372(2008)134:5(395) [4] WANG S, WU Y, AN J, et al. Geobacter autogenically secretes fulvic acid to facilitate the dissimilated iron reduction and vivianite recovery[J]. Environmental Science & Technology, 2020, 54(17): 10850-10858. [5] TAO W, FATTAH K P, HUCHZERMEIER M P. Struvite recovery from anaerobically digested dairy manure: A review of application potential and hindrances[J]. Journal of Environmental Management, 2016, 169: 46-57. [6] FURUYA K, HAFUKA A, KUROIWA M, et al. Development of novel polysulfone membranes with embedded zirconium sulfate-surfactant micelle mesostructure for phosphate recovery from water through membrane filtration[J]. Water Research, 2017, 124: 521-526. doi: 10.1016/j.watres.2017.08.005 [7] HUANG H, ZHANG D D, LI J, et al. Phosphate recovery from swine wastewater using plant ash in chemical crystallization[J]. Journal of Cleaner Production, 2017, 168: 338-345. doi: 10.1016/j.jclepro.2017.09.042 [8] OBADA D O, OSSENI S A, SINA H, et al. Fabrication of novel kaolin-reinforced hydroxyapatite scaffolds with robust compressive strengths for bone regeneration[J]. Applied Clay Science, 2021, 215: 106298. doi: 10.1016/j.clay.2021.106298 [9] SHIH W J, CHEN Y F, WANG M C, et al. Crystal growth and morphology of the nano-sized hydroxyapatite powders synthesized from CaHPO4·2H2O and CaCO3 by hydrolysis method[J]. Journal of Crystal Growth, 2004, 270(1-2): 211-218. doi: 10.1016/j.jcrysgro.2004.06.023 [10] HERMASSI M, VALDERRAMA C, DOSTA J, et al. Evaluation of hydroxyapatite crystallization in a batch reactor for the valorization of alkaline phosphate concentrates from wastewater treatment plants using calcium chloride[J]. Chemical Engineering Journal, 2015, 267: 142-152. doi: 10.1016/j.cej.2014.12.079 [11] 彭诗珍, 黄启同, 甘滔等. 四氧化三铁基复合材料在生物磁分离中的应用[J]. 赣南医学院学报, 2022, 42(04): 389-395. doi: 10.3969/j.issn.1001-5779.2022.04.012 [12] YU S H, LI H, YAO Q Z, et al. Preparation of mesoporous calcite with hierarchical architectures[J]. Materials Letters, 2015, 160: 167-170. doi: 10.1016/j.matlet.2015.07.116 [13] YIN W, LIU M, ZhAO T L, et al. Removal and recovery of silver nanoparticles by hierarchical mesoporous calcite: Performance, mechanism, and sustainable application[J]. Environmental Research, 2020, 187: 109699. doi: 10.1016/j.envres.2020.109699 [14] YU S H, LI H, YAO Q Z, et al. Microwave-assisted preparation of sepiolite-supported magnetite nanoparticles and their ability to remove low concentrations of Cr(VI)[J]. RSC Advances, 2015, 5: 84471. doi: 10.1039/C5RA14130C [15] 天津大学. 一种负载四氧化三铁的SiC泡沫陶瓷及其制备方法和应用: CN201810852660.0[P]. 2021-11-19. [16] ZHOU G T, GUAN Y B, YAO Q Z, et al. Biomimetic mineralization of prismatic calcite mesocrystals: Relevance to biomineralization[J]. Chemical Geology, 2010, 279(3/4): 63-72. doi: 10.1016/j.chemgeo.2010.08.020 [17] DLAPA P, BODI M B, MATAIX-SOLERA J, et al. FT-IR spectroscopy reveals that ash water repellency is highly dependent on ash chemical composition[J]. Catena, 2013, 108(108): 38-46. [18] NAMDURI H, NASRAZADANI S. Quantitative analysis of iron oxides using Fourier transform infrared spectrophotometry[J]. Corrosion Science, 2008, 50(9): 2493-2497. doi: 10.1016/j.corsci.2008.06.034 [19] MA M G, ZHU Y J, CHANG J. Monetite formed in mixed solvents of water and ethylene glycol and its transformation to hydroxyapatite[J]. Journal of Physical Chemistry B, 2006, 110(29): 14226-14230. doi: 10.1021/jp061738r [20] NEAGLE W, ROCHESTER C H. Infrared study of the adsorption of water and ammonia on calcium carbonate[J]. Journal of the Chemical Society Faraday Transactions, 1990, 86: 181-183. doi: 10.1039/ft9908600181 [21] 刘帅朋. 改进型共沉淀法制备四氧化三铁磁粉的工艺优化与表征[D]. 天津: 天津大学, 2018. [22] ZHAO K, XU T, CAO J, et al. Fabrication and adsorption properties of multiwall carbon nanotubes-coated/filled by various Fe3O4 nanoparticles[J]. Journal of Materials Science:Materials in Electronics, 2019, 30(20): 18802-18810. doi: 10.1007/s10854-019-02234-8 [23] ASUHA S, WAN H L, ZHAO S, et al. Water-soluble, mesoporous Fe3O4: Synthesis, characterization, and properties[J]. Ceramics International, 2012, 38(8): 6579-6584. doi: 10.1016/j.ceramint.2012.05.042 [24] LI B, CAO H, SHAO J, et al. Superparamagnetic Fe3O4 nanocrystals@graphene composites for energy storage devices[J]. Journal of Materials Chemistry, 2011, 21(13): 5069-5075. doi: 10.1039/c0jm03717f [25] CHASTAIN J, KING Jr R C. Handbook of X-ray photoelectron spectroscopy[J]. Perkin-Elmer Corporation, 1992, 40: 221. [26] MORDINA B, KUMAR R, TIWARI R K, et al. Fe3O4 nanoparticles embedded hollow mesoporous carbon nanofibers and polydimethylsiloxane-based nanocomposites as efficient microwave absorber[J]. The Journal of Physical Chemistry C, 2017, 121(14): 7810-7820. doi: 10.1021/acs.jpcc.6b12941 [27] MORDINA B, TIWARI R K, SETUA D K, et al. Impact of graphene oxide on the magnetorheological behaviour of BaFe12O19 nanoparticles filled polyacrylamide hydrogel[J]. Polymer, 2016, 97: 258-272. doi: 10.1016/j.polymer.2016.05.026 [28] 张小梅. 天然菱铁矿和方解石矿物及其改性产物除磷性能研究[D]. 南京: 南京大学, 2022. [29] WU D, TIAN S, LONG J, et al. Remarkable phosphate recovery from wastewater by a novel Ca/Fe composite: Synergistic effects of crystal structure and abundant oxygen-vacancies[J]. Chemosphere, 2021, 266: 129102. doi: 10.1016/j.chemosphere.2020.129102 [30] XIANG C, JI Q, ZHANG G, et al. In situ creation of oxygen vacancies in porous bimetallic La/Zr sorbent for aqueous phosphate: Hierarchical pores control mass transport and vacancy sites determine interaction[J]. Environmental Science & Technology, 2019, 54(1): 437-445. [31] XIA P, WANG X, WANG X, et al. Struvite crystallization combined adsorption of phosphate and ammonium from aqueous solutions by mesoporous MgO–loaded diatomite[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2016, 506: 220-227. doi: 10.1016/j.colsurfa.2016.05.101 [32] SI Q, ZHU Q, XING Z. Simultaneous removal of nitrogen and phosphorus by magnesium-modified calcium silicate core-shell material in water[J]. Ecotoxicology and Environmental Safety, 2018, 163: 656-664. doi: 10.1016/j.ecoenv.2018.07.120 [33] LIU J, JIANG J, AIHEMAITI A, et al. Removal of phosphate from aqueous solution using MgO-modified magnetic biochar derived from anaerobic digestion residue[J]. Journal of Environmental Management, 2019, 250: 109438. doi: 10.1016/j.jenvman.2019.109438 [34] YU J, XIANG C, ZHANG G, et al. Activation of lattice oxygen in LaFe (oxy) hydroxides for efficient phosphorus removal[J]. Environmental Science & Technology, 2019, 53(15): 9073-9080. [35] 方启学. 钙镁对微细矿粒分散稳定性的影响及其机理研究[J]. 国外金属矿选矿, 1998(6): 42-45. [36] 刘忠义. 金属离子对菱锌矿和方解石分散行为的影响研究[D]. 北京: 中国矿业大学, 2019. [37] LI J, CAO X, PAN A, et al. Nanoflake-assembled three-dimensional Na3V2 (PO4)3/C cathode for high performance sodium ion batteries[J]. Chemical Engineering Journal, 2018, 335: 301-308. doi: 10.1016/j.cej.2017.10.164 [38] SHARIF F, TABASSUM S, MUSTAFA W, et al. Bioresorbable antibacterial PCL-PLA-nHA composite membranes for oral and maxillofacial defects[J]. Polymer Composites, 2019, 40(4): 1564-1575. doi: 10.1002/pc.24899 [39] HIRSCH A, AZURI I, ADDADI L, et al. Infrared absorption spectrum of brushite from first principles[J]. Chemistry of Materials, 2014, 26(9): 2934-2942. doi: 10.1021/cm500650t [40] TORTET L, GAVARRI J R, NIHOUL G, et al. Study of protonic mobility in CaHPO4· 2H2O (brushite) and CaHPO4 (monetite) by infrared spectroscopy and neutron scattering[J]. Journal of Solid State Chemistry, 1997, 132(1): 6-16. doi: 10.1006/jssc.1997.7383 [41] PETROV I, ŠOPTRAJANOV B, FUSON N, et al. Infra-red investigation of dicalcium phosphates[J]. Spectrochimica Acta Part A Molecular Spectroscopy, 1967, 23(10): 2637-2646. doi: 10.1016/0584-8539(67)80155-7 [42] JAYASREE R, KUMAR T S S, VENKATESWARI R, et al. Eggshell derived brushite bone cement with minimal inflammatory response and higher osteoconductive potential[J]. Journal of Materials Science:Materials in Medicine, 2019, 30(10): 1-14. [43] BERRY E E, BADDIEL C B. The infra-red spectrum of dicalcium phosphate dihydrate (brushite)[J]. Spectrochimica Acta Part A Molecular Spectroscopy, 1967, 23(7): 2089-2097. doi: 10.1016/0584-8539(67)80097-7 [44] CASCIANI F, CONDRATE SR R A. The vibrational spectra of brushite, CaHPO4·2H2O[J]. Spectroscopy Letters, 1979, 12(10): 699-713. doi: 10.1080/00387017908069196 [45] HAZZAT M E, HAMIDI A E, HALIM M, et al. Complex evolution of phase during the thermal investigation of Brushite-type calcium phosphate CaHPO4·2H2O[J]. Materialia, 2021, 16(4): 101055. [46] RAJENDRAN K, DALE K C. Growth and characterization of calcium hydrogen phosphate dihydrate crystals from single diffusion gel technique[J]. Crystal Research and Technology, 2010, 45(9): 939-945. doi: 10.1002/crat.200900700 [47] SONG Y W, SHAN D Y, CHEN R S, et al. A novel phosphate conversion film on Mg-8.8Li alloy[J]. Surface & Coatings Technology, 2009, 203(9): 1107-1113. [48] LI S, ZENG W, XU H, et al. Performance investigation of struvite high-efficiency precipitation from wastewater using silicon-doped magnesium oxide[J]. Environmental Science and Pollution Research, 2020, 27(13): 15463-15474. doi: 10.1007/s11356-019-07589-3 [49] WEI L, HONG T, LI X, et al. New insights into the adsorption behavior and mechanism of alginic acid onto struvite crystals[J]. Chemical Engineering Journal, 2019, 358: 1074-1082. doi: 10.1016/j.cej.2018.10.110 [50] LIU X, ZHONG H, YANG Y, et al. Phosphorus removal from wastewater by waste concrete: influence of P concentration and temperature on the product[J]. Environmental Science and Pollution Research, 2020, 27(10): 10766-10777. doi: 10.1007/s11356-019-07577-7 [51] ZHANG Y, SHI J, CHENG C, et al. Hydrothermal growth of Co3(OH)2(HPO4)2 nano-needles on LaTiO2N for enhanced water oxidation under visible-light irradiation[J]. Applied Catalysis B:Environmental, 2018, 232: 268-274. doi: 10.1016/j.apcatb.2018.03.067 -




 下载:
下载: