-
碘代消毒副产物(I-DBPs)在水中的检出含量虽然较低,但比常规氯代和溴代表现出更强的细胞毒性和遗传毒性[1]. 有研究表明, 三碘甲烷,碘乙酸和碘乙腈的毒性分别是其同类的氯代物质146[2]、500、74倍[3-4]. Mahmut的研究表明,当水中的碘离子的浓度为40 μg·L−1升高至400 μg·L−1,碘代三卤甲烷(I-THMs)生成量由30 nmol·L−1升高至250 nmol·L−1以上[5]. 此外,碘代的显影剂如碘帕醇,泛影酸盐等也是I-DBPs的重要碘源和前驱体. 在北美地区一些水厂的调查中,即使水中的碘离子的浓度很低,但仍在出水中监测到了一定量的I-DBPs [6].
含氮有机物是广泛存在于自然水体中的一类重要的天然有机物,主要来自于人类生产生活用水排放,动植物腐败以及土壤溶出等,包括氨基酸、多肽、蛋白质、嘌呤和硝基腐殖酸等物质[7]. 含氮有机物是水体消毒过程中亚硝胺、卤代硝基甲烷以及卤乙腈等消毒副产物最重要的前驱物,因而受到了广泛的研究和关注[8]. 但是,关于水中含氮有机物在氯化过程中I-DBPs的生成规律研究则较少. Li等研究了色氨酸在氯化后I-THMs的生成量为27.21 μg·L−1,是常规三卤甲烷的1.3倍[9]. 查晓松等用鱼油模拟天然水体中生物源有机物对氯胺消毒过程中碘乙腈(IAN)等含氮消毒副产物的生成趋势,在实验条件下,IAN的最大生成量为 106.95 μg·L−1, IAN 的生成量则随I-和总有机碳浓度的增加而增加[10]. 有别于在复杂水质条件下的消毒研究,对典型含氮有机物,如氨基酸、多肽、蛋白质等的消毒副产物生成势研究,有助于针对性的制定前体物的去除工艺以及消毒策略,控制I-DBPs对人类饮用水的健康风险.
本文选取了6种典型的含氮有机物,包括3种氨基酸,多肽,硝基腐殖酸,蛋白质等,对其氯化消毒后的I-THMs的生成潜能进行了系统的研究,为I-DBPs的生成控制提供的一定参考依据.
-
一溴二氯甲烷(BDCM)、二溴一氯甲烷(DBCM)、二氯一碘甲烷、溴氯碘甲烷(CBIM)、二溴一碘甲烷 (DBIM)、一氯二碘甲烷、一溴二碘甲烷 (BDIM),碘仿(TIM)标准样品购自 CanSyn公司(多伦多,加拿大),苯丙氨酸(Phe)、色氨酸(Trp)、甘氨酸(Gly)、牛血清蛋白(BSA)、谷胱甘肽(Glu)、硝基腐殖酸(NHA)购自Sigma-Aldrich公司(密苏里州,美国). 其余均购自国药集团化学试剂有限公司(上海,中国).
-
在棕色的试剂瓶中加满超纯水后,移除一定量的溶液,随后加入磷酸盐缓冲液. 再依次加入反应物,,溴化钾,碘化钾溶液,充分混匀后,并加入一定量的NaClO溶液,最后用超纯水灌满瓶口,不留空隙. 取样时,先加入硫代硫酸钠对体系中的活性氯进行淬灭取样. 取样后依次加入3 g无水硫酸钠和2 mLMtBE,充分震荡均匀,静置10 min后,取上层约1 mL萃取液进行GC-MS分析.
-
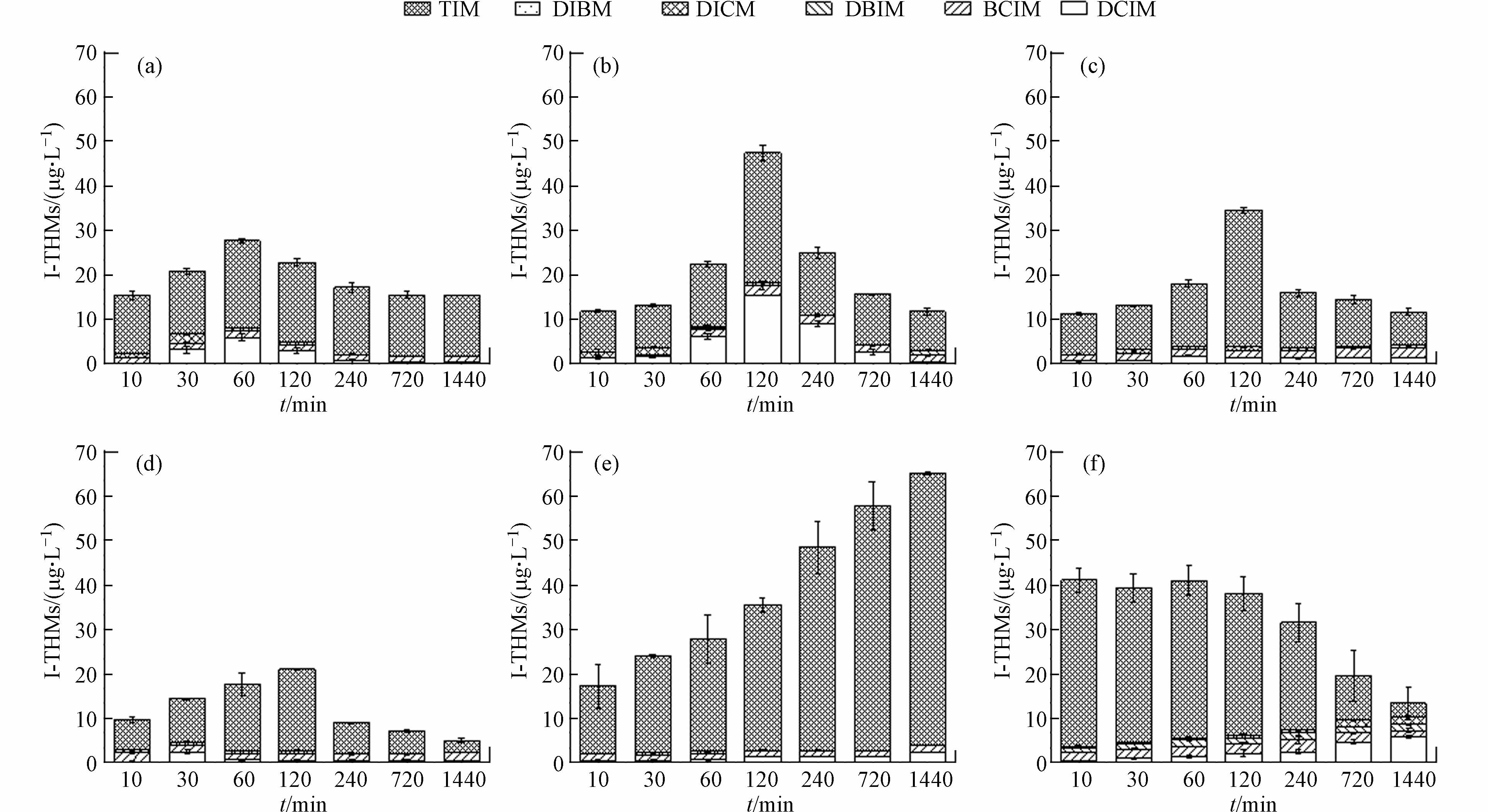
从图1可以看出,当体系中含有一定的I-时,典型含氮有机物氯化消毒后可以生成一定量的I-THMs. 其中DCIM和TIM是最主要的成份. Gly由于结构较为简单,反应较为迅速,在60 min时I-THMs的生成量就达到27.65 μg·L−1,之后在24 h时内逐步减少至15.47 μg·L−1. Phe、Trp以及Glu在氯化消毒后120 min时,I-THMs的生成量最大,分别为47.40、37.64、20.99 μg·L−1,之后开始逐渐下降. 这可能是随着氯化反应的进行,I-DBPs被转换成其他物质. BSA生成I-THMs的总量由在第10分钟的35.53 μg·L−1增加至结束时的65.04 μg·L−1,其中CHI3从32.73 μg·L−1增加至61.23 μg·L−1. NHA的氯化消毒后I-THMs的总量在前120分钟变化较少,之后逐渐下降. 但是除CHI3以外的其他I-THMs有所增加,主要表现在DCIM从第10分钟的0.34 μg·L−1增至1440 min的5.83 μg·L−1;DICM从最开始的0.18 μg·L−1增加至1.80 μg·L−1. 这有可能是NHA相比于其他含氮有机物结构较为稳定,随着反应的进行,生成的I-DBPs的稳定性较差,从而容易在HClO或者其他中间产的作用下进行分解转化.
-
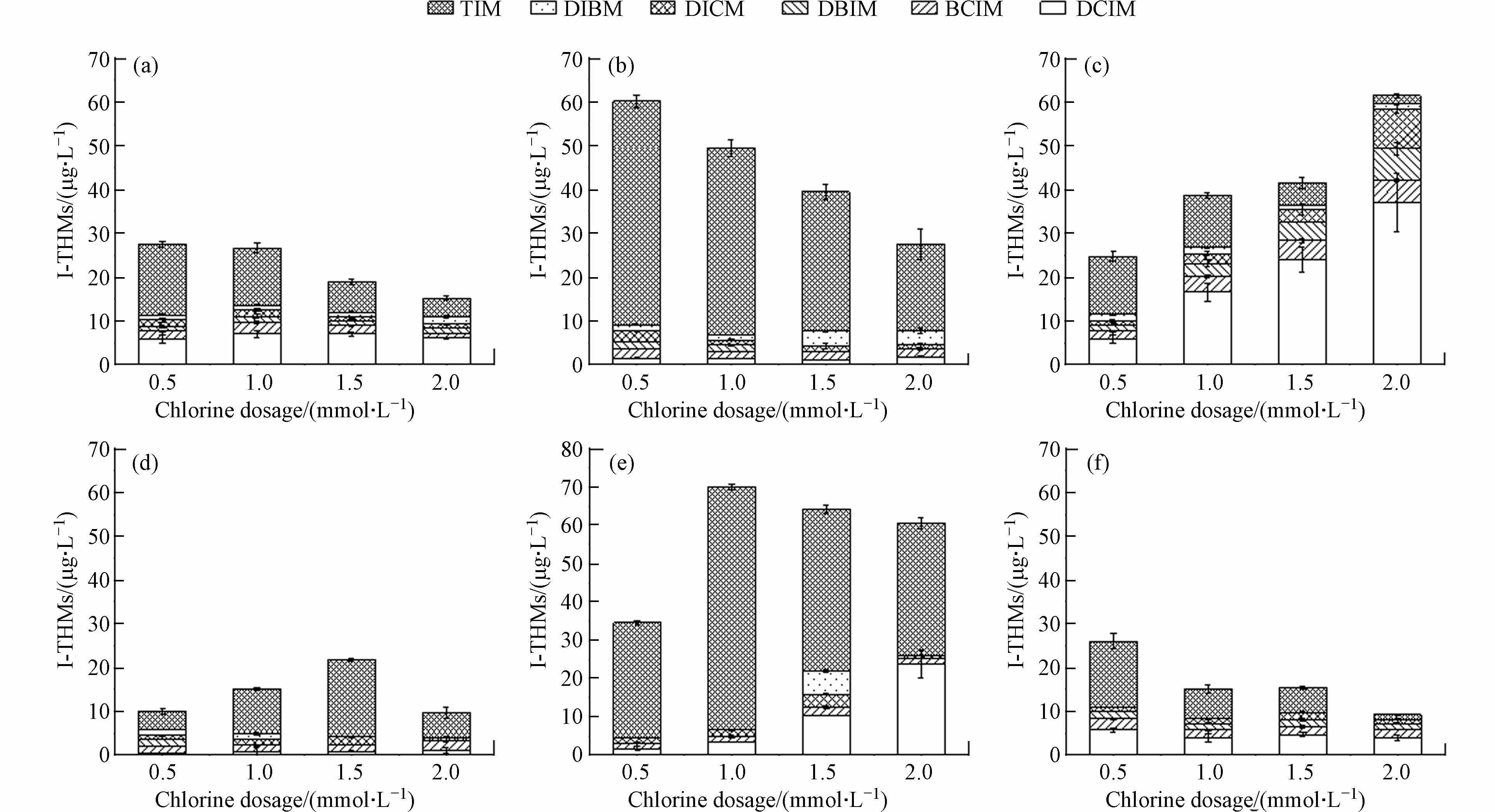
如图2(a)所示,对于低分子量的Gly而言,随着氯投加量的增加,I-THMs生成总量减少,尤其是碘仿的降低更为明显,DCIM随之增加. 如图2(c)所示,Trp经氯化消毒后,I-THMs的种类和数量有所增加. DCIM和BCIM的生成量分别从0.5 mmol·L−1时的5.73 μg·L−1、1.92 μg·L−1增加到2 mmol·L−1时的5.04 μg·L−1、34.04 μg·L−1,碘仿的的生成量由13.25 μg·L−1减少至1.72 μg·L−1. BSA氯化消毒后,TIM含量在氯投加量1 mmol·L−1的时候达到最大;增至为2 mmol·L−1时, DCIM的含量增加了22.03 μg·L−1. 氯投加量对I-DBPs的生成主要有几方面的作用,在低氯浓度下,浓度增加,促进了苯环开环,共价键断裂等,容易生成更多的氯代消毒副产物. 在本研究中Trp的氯化过程中,随着氯的增加,对色氨酸吲哚基团的破坏增强,导致I-THMs生成量和种类增加. 但对于结构更为复杂的NHA和BSA,有效氯投加量从0.5 mmol·L−1增加到1 mmol·L−1,I-THM分别由26.00 、34.53 μg·L−1增加到28.84、71.34 μg·L−1. 当有效氯投加量由1 mmo·L−1增加至2 mmo·L−1时,I-THMs的生成量反而分别减少至9.20 、60.24 μg·L−1. 这可能是由于氧化剂增加会促进更多的I-被直接氧化成IO- 3,导致HOI的减少,进而使得I-THMs的生成量减少.
-
如图3所示,在pH小于8时,Gly,BSA和HA氯化后I-THMs的生成量和种类随着pH值的增加而增加. 例如,在pH=5时,Gly氯化后的产物主要为TIM,浓度为6.08 μg·L−1,I-THMs的总量为7.23 μg·L−1. pH=8时,TIM、DCIM、DBIM、DIBM都有出现,浓度分别为24.27、6.44、2.77、3.99 μg·L−1,I-THMs的总量也增加到了39.39 μg·L−1. 在Phe、Glu、BSA和NHA条件下和pH=8时,I-THMs的总量也分别增加到了70.29、43.03、130.74、59.16 μg·L−1. 研究表明,HOI是形成碘代消毒副产物的重要先决条件,HOI的生成速率和生成量直接影响碘代消毒副产物的生成速率和生成量[11]. HOI的分布主要与溶液中HClO、NH2Cl、HBrO等氧化剂的氧化活性以及溶液的pH值密切相关[12]. 在酸性条件下,HClO的氧化性较强,生成的HOI会被快速氧化成IO- 3,不利于I-THMs的生成. 在氯化体系中,当体系pH值为8时,HOI的生成量最大[1, 13-14]. 此外,碘代消毒副产物的生成路径主要包括烯醇化,碘化和水解[12]. 在低pH的条件下,虽然HClO的活性会加强,有利于氯代消毒副产物的生成,但是不利于前体物质的烯醇化和碘化,从而在一定程度上抑制了I-THMs的生成. 在较高的pH条件下,HClO的氧化能力减弱,更有利于HOI的形成,但同时水解反应会受到抑制,会有利于I-THMs的生成,这是二者综合作用的结果.
由此说明,HOI的产生是影响I-THMs生成最主要的因素. 从某些方面来看,低pH值会抑制碘代消毒副产物的生成. 但其他研究表明,在低pH条件下,三卤甲烷、卤乙腈、卤乙酸等其他消毒副产物的生成势能会增加. 因此,水厂在消毒的过程中应严格控制反应体系的pH值,尤其是在含碘较为丰富的水体中,从而避免生成毒性更强风险更大的I-THMs.
-
1)在含有I-的条件下,氯化消毒后的含氮有机物容易生成I-THMs,其中Phe,Trp和BSA的生成量最大. TIM是氯化后最主要的碘代消毒副产物.
2)低浓度条件下,增加氯投加量促进I-THMs的生成,而在较高的氯投加量则会抑制I-THMs的产生.
3)pH值通过影响水中HClO的活性以及HOI/I/IO3-的分布对消毒副产物的种类和浓度产生作用. 除NHA以外,大部分的含氮有机物经过氯化消毒后在pH=8时I-THMs达到最大. 实际消毒过程中应根据水体特性合理选择消毒策略,控制消毒副产物生成的综合风险.
典型含氮有机物氯化消毒过程中碘代三卤甲烷生成特征
Formation of iodo-trihalomethanes during the chlorination of typical nitrogenous organics
-
摘要: 碘代消毒副产物因其较强的细胞和遗传毒性给人们的饮用水安全造成了安全风险. 本研究选取了水中常见的典型含氮有机物,包括氨基酸、多肽、蛋白质以及腐殖酸,对其氯化后碘代三卤甲烷(I-THMs)的生成规律予以研究. 探讨了反应时间、氯投加量和pH对I-THMs生成的影响. 结果表明,碘仿是最主要的I-THMs,I-THMs的生成速率,种类和数量与前体物的结构相关. 色氨酸、赖氨酸和蛋白质氯化后I-THMs产量分别达到47.40、37.64、65.04 μg·L−1. pH主要影响水中HOI的分布从而影响I-THMs的生成. 高氯投加量和Br-会抑制I-THMs的生成,但也增加其他消毒副产物的生成风险.Abstract: Iodinated disinfection byproducts pose threats to drinking water safety because of the cytotoxicity and genotoxicity. In this research, the formation of iodo-trihalomethanes(I-THMs) after chlorination of typical nitrogenous organics, including amino acids, peptides, proteins and humic acids, were studied. The effects of reaction time, active chlorine dosage, pH and bromide on I-THMs production were investigated. The results showed that iodoform is the most important I-THMs after chlorination, and the rate, type and quantity of I-THMs were related to the structure of the precursors. The total I-THMs of Tryptophan, lysine and protein was 47.40, 37.64, 65.04 μg·L−1, respectively after chlorination. The distribution of HOI was strongly associated with solution pH, thus influence the formation of I-THMs. Generally, high chlorine dosages and bromine ions could restrain the formation of I-THMs, but also increased the risks of other disinfection byproducts.
-
Key words:
- nitrogen-organics /
- iodo-trihalomethanes /
- chlorination /
- iodide
-
[1] YE T, XU B, LIN Y L, et al. Formation of iodinated disinfection by-products during oxidation of iodide-containing waters with chlorine dioxide [J]. Water Research, 2013, 47(9): 3006-3014. doi: 10.1016/j.watres.2013.03.003 [2] 李宏伟, 丁顺克, 肖融, 等. Fe3+对氯胺消毒体系中碘代消毒副产物生成影响研究 [J]. 给水排水, 2021, 57(2): 27-34. [3] POSTIGO C, RICHARDSON S D, BARCELÓ D. Formation of iodo-trihalomethanes, iodo-haloacetic acids, and haloacetaldehydes during chlorination and chloramination of iodine containing waters in laboratory controlled reactions [J]. Journal of Environmental Sciences, 2017, 58: 127-134. doi: 10.1016/j.jes.2017.04.009 [4] POSTIGO C, ZONJA B. Iodinated disinfection byproducts: Formation and concerns [J]. Current Opinion in Environmental Science & Health, 2019, 7: 19-25. [5] ERSAN M S, LIU C, AMY G, et al. Chloramination of iodide-containing waters: Formation of iodinated disinfection byproducts and toxicity correlation with total organic halides of treated waters [J]. Science of the Total Environment, 2019, 697: 134142. doi: 10.1016/j.scitotenv.2019.134142 [6] TUGULEA A M, ARANDA-RODRIGUEZ R, BÉRUBÉ D, et al. The influence of precursors and treatment process on the formation of Iodo-THMs in Canadian drinking water [J]. Water Research, 2018, 130: 215-223. doi: 10.1016/j.watres.2017.11.055 [7] CHANG H H, WANG G S. Correlations between surrogate nitrogenous organic precursors and C-, N-DBP formation [J]. Water Science and Technology, 2011, 64(12): 2395-2403. doi: 10.2166/wst.2011.823 [8] BOND T, HUANG J, TEMPLETON M R, et al. Occurrence and control of nitrogenous disinfection by-products in drinking water - A review [J]. Water Research, 2011, 45(15): 4341-4354. doi: 10.1016/j.watres.2011.05.034 [9] LI C, LIN Q F, DONG F L, et al. Formation of iodinated trihalomethanes during chlorination of amino acid in waters [J]. Chemosphere, 2019, 217: 355-363. doi: 10.1016/j.chemosphere.2018.10.190 [10] 查晓松, 于颖奇. 鱼油氯胺消毒过程中溴代和碘代含氮消毒副产物的生成 [J]. 环境化学, 2023, 42(5): 1414-1423. doi: 10.7524/j.issn.0254-6108.2022101705 [11] HU S Y, GONG T T, XIAN Q M, et al. Formation of iodinated trihalomethanes and haloacetic acids from aromatic iodinated disinfection byproducts during chloramination [J]. Water Research, 2018, 147: 254-263. doi: 10.1016/j.watres.2018.09.058 [12] GUO W H, SHAN Y C, YANG X. Factors affecting the formation of iodo-trihalomethanes during oxidation with chlorine dioxide [J]. Journal of Hazardous Materials, 2014, 264: 91-97. doi: 10.1016/j.jhazmat.2013.10.064 [13] YE T, ZHANG T Y, TIAN F X, et al. The fate and transformation of iodine species in UV irradiation and UV-based advanced oxidation processes [J]. Water Research, 2021, 206: 117755. doi: 10.1016/j.watres.2021.117755 [14] ALLARD S, NOTTLE C E, CHAN A, et al. Ozonation of iodide-containing waters: Selective oxidation of iodide to iodate with simultaneous minimization of bromate and I-THMs [J]. Water Research, 2013, 47(6): 1953-1960. doi: 10.1016/j.watres.2012.12.002 -




 下载:
下载: